-
Medical journals
- Career
Postižení periferního nervového systému a míra motorického postižení u Parkinsonovy nemoci: korelační studie
: Z. Chovancová 1; P. Kaňovský 1; I. Nestrašil 1; J. Dufek 2; M. Nevrlý 1; P. Otruba 1
: Neurologická klinika LF UP a FN – Centrum pro diagnostiku a léčbu neurodegenerativních onemocnění, Olomouc 1; Privátní poliklinika Dr. Kropáče, neurofyziologická laboratoř, Brno 2
: Čas. Lék. čes. 2008; 147: 211-214
: Original Article
Východisko.
Práce se zabývá korelací mezi mírou motorického postižení u Parkinsonovy nemoci a postižením periferního nervového systému.Metody a výsledky.
Ve studii bylo vyšetřeno celkem 23 pacientů trpících Parkinsonovou nemocí, která byla striktně diagnostikována na základě rigorózních kritérií United Kingdom Parkinson’s Disease Brain Bank (UK-PDBB). Soubor zahrnoval 14 mužů (průměrný věk 57 let, průměrný věk při vzniku onemocnění 51 let, průměrná doba trvání onemocnění 7 let, průměrná doba léčby za použití dopaminergní medikace 4 roky) a 9 žen (průměrný věk 67 let, průměrný věk při vzniku onemocnění 63 let, průměrná doba trvání onemocnění 4 roky, průměrná doba léčby za použití dopaminergní medikace 1 rok). Ve studii byla polyneuropatie prokázána u 10 pacientů z celkového počtu 23, což odpovídá 43,5 % (5 mužů a 5 žen).Závěry.
Na základě výsledků můžeme zvažovat neurodegenerativní proces (v širším slova smyslu) za velmi pravděpodobnou příčinu postižení nejen centrální, ale i periferní nervové soustavy u pacientů trpících Parkinsonovou nemocí.Klíčová slova:
Parkinsonova nemoc, polyneuropatie, elektromyografie, korelace.Parkinsonova nemoc (PN) je chronické neurodegenerativní onemocnění, kde hlavní poruchou je deficit dopaminu v oblasti bazálních ganglií. Deficit je způsoben sníženým transportem dopaminu do oblasti striata cestou nigrostriatálních projekcí a jeho prvotní příčinou je apoptotický zánik melaninových buněk v oblasti substantia nigra v mezencefalu.
Kromě výše popsané poruchy jsou ale u Parkinsonovy nemoci popisovány další morfologické a neurochemické změny, které reflektují postupnou progresi nemoci. Recentní, tzv. Braakův koncept (1) uvádí 6 stupňů prokázaného morfologického postižení centrální nervové soustavy v průběhu progrese Parkinsonovy nemoci, přičemž těchto 6 stupňů uvádí do korelace s klinickým stavem, reflektovaným hodnotami Unified Parkinson’s Disease Rating Scale (UPDRS) a Hoehn-Yahrovy stupnice. Tato klinicko-patologická korelace je uváděna již v seminární Braakově práci (1) a spolehlivě slouží jako východisko ke srovnání stupně postižení CNS in vivo a klinických manifestací Parkinsonovy nemoci. Minimálně u 3 stupňů (3., 4. a 5.) udává Braakův koncept postižení i jiných než nigrostriatálních, nebo obecněji kmenových struktur (tab. 1). Podle Braaka a jeho dalších spoluautorů jsou v průběhu Parkinsonovy nemoci neurodegenerativním procesem postihovány i jiné struktury CNS, než které jsou součástí kortikostriatálního, nigrostriatálního či olivonigrálního systému (1–4).
1. Srovnání stupňů postižení podle stupnice Braakovy a Hoehn-Yahrovy 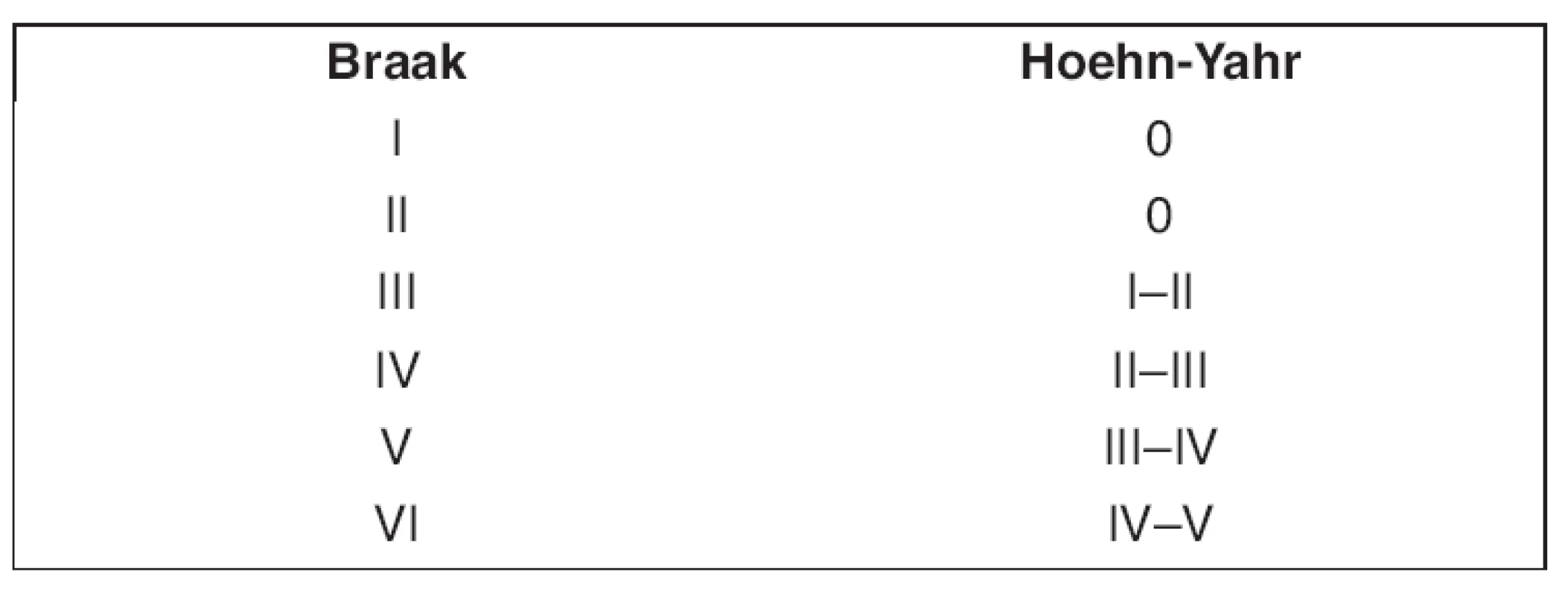
Z dalších pramenů je již několik let známo, že u poměrně vysokého procenta pacientů trpících neurodegenerativním onemocněním je přítomno i postižení jak kortexu, tak i periferního nervového systému (1, 6, 7). Nejfrekventovanější evidence tohoto postižení existuje právě u Parkinsonovy nemoci (2, 4, 6, 8–11). V dosud publikovaných studiích bylo uvažováno o neurodegenerativním procesu obecně jako o společné příčině postižení centrální i periferní části nervové soustavy. Bylo by tedy logické předpokládat, že míra postižení, vyjádřena ve stupni odpovídajícím Braakovu konceptu, je reflektována i přítomností postižení periferních nervů, resp. tíží tohoto postižení. A navíc, že i míra postižení, vyjádřena v hodnotě skóre UPDRS bude taktéž podléhat této, vlastně dvojité korelaci, tj. korelaci se stupněm postižení podle Braakova konceptu a zároveň korelaci s přítomností eventuálních tíží postižení periferní nervové soustavy. K ověření této hypotézy byla zpracována předkládaná korelační studie.
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
V rámci studie bylo vyšetřeno 23 pacientů trpících Parkinsonovou nemocí. Diagnóza PN byla stanovena na základě kritérií United Kingdom Parkinson’s Disease Brain Bank (UKPD BB) (13). V souboru bylo celkem 14 mužů a 9 žen. U mužů byl průměrný věk 57 let, průměrný věk při vzniku onemocnění 51 let, průměrná doba trvání onemocnění 7 let, průměrná doba léčby za použití dopaminergní medikace 4 roky. U žen byl průměrný věk 67 let, průměrný věk při vzniku onemocnění 63 let, průměrná doba trvání onemocnění 4 roky, průměrná doba léčby za použití dopaminergní medikace 1 rok.
U všech pacientů bylo před zahájením neurofyziologického vyšetřování provedeno komplexní vyšetření neurologické včetně zobrazovacího vyšetření pomocí magnetické rezonance mozku, vyšetření autonomních funkcí, vyšetření biochemických, hematologických a likvorologických.
U všech pacientů byla potom provedena elektromyografie (EMG), při které byla prováděna kondukční studie, vyšetření H reflexu a jehlová EMG. Všechna vyšetření byla prováděna za použití přístroje Keypoint IV® (Medtronic, Tonstakken, Dánsko).
Při provádění kondukční studie bylo vyšetřeno motorické vedení n. tibialis a n. peroneus profundus a senzitivní vedení n. peroneus superficialis a n. suralis. Při vyšetření motorického vedení n. tibialis a n. peroneus profundus byla stimulace prováděna povrchovými elektrodami tak, ževzdálenost mezi snímací elektrodou a stimulační katodou byla 10 cm u n. tibialis a 7,5 cm u n. peroneus profundus. K registraci byly použity AgCl3 povrchové elektrody, aktivní snímací elektroda byla umístěna nad svalové bříško (v místě tzv. motorického bodu) a referenční snímací elektroda byla umístěna nad úponem svalu. Měřeny byly latence a amplituda bifázického sumačního svalového akčního potenciálu (CMAP) s iniciální negativní deflexí. Latence CMAP (v milisekundách) byla měřena k počátku negativní deflexe, amplituda (v milivoltech) byla měřena od bazální linie k prvnímu negativnímu vrcholu. Při vyšetření senzitivního vedení n. suralis a n. peroneus superficialis byla stimulace prováděna antidromní technikou povrchovými elektrodami umístěnými co nejblíže senzitivním vláknům nervů (správná lokalizace stimulační elektrody byla určována podle subjektivního vjemu vyšetřovaného). Registrován byl bifázický senzitivní nervový akční potenciál (SNAP), s iniciální negativní deflexí. Měřeny byly latence, amplituda a rychlost vedení. Latence SNAP (v milisekundách) byla měřena k počátku negativního vrcholu, amplituda (v mikrovoltech) byla měřena mezi negativním a následným pozitivním vrcholem, rychlost vedení byla měřena v terminálním úseku senzitivního nervu. U každého pacienta byl vyšetřen H-reflex z m. soleus. Snímací elektroda byla umístěna 2 cm distálně od úponu m. gastrocnemius na Achillovu šlachu, referenční 3,5 cm distálněji. Stimulace byla prováděna ve fossa poplitea. Měřeny byly latence a amplituda trifázického H-reflexu, latence (v milisekundách) byla měřena k počátku pozitivní deflexe a amplituda (v milivoltech) byla měřena mezi prvním pozitivním a následným negativním vrcholem. Jehlová EMG byla prováděna za použití bipolárních koncentrických jehlových elektrod (Medtronic, Tongstakken, Dánsko). Jehla byla zaváděna kolmo na povrch končetiny do svalového bříška m. tibialis anterior. Při vyšetření jehlové EMG byla hodnocena klidová aktivita, nábor a interferenční křivka při kontrakci s maximálním úsilím. Výsledky EMG vyšetření byly zanášeny do elektronické databáze. Statistické zpracování bylo provedeno za použití programu StatSoft®.
2. Hodnoty latencí a amplitud CMAP, SNAP a H-reflexu 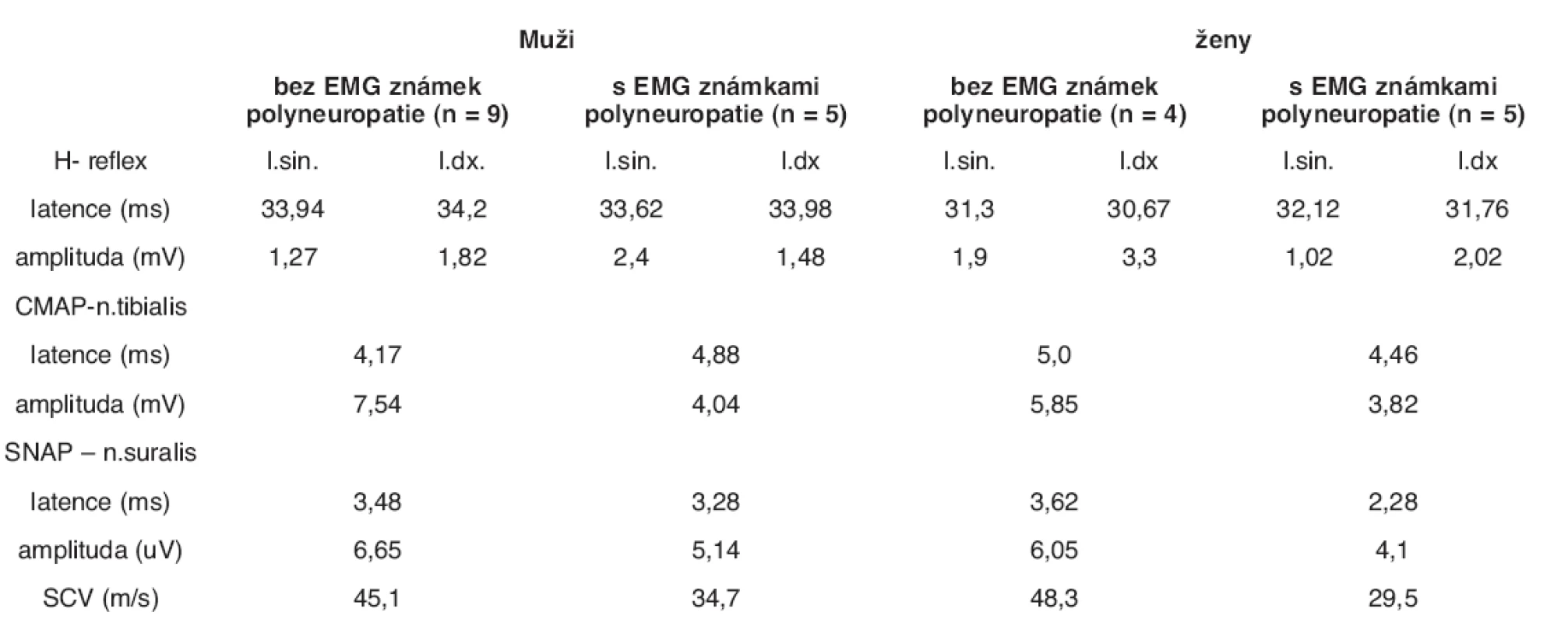
l.sin. – vlevo, l.dx. – vpravo, CMAP – sumačního svalového akčního potenciálu, SNAP – senzitivní nervový akční potenciál, SCV – rychlost vedení senzitivními vlákny Výsledky
Výsledky jsou uvedeny v tabulkách 2 až 4.
3. Demografické a anamnestické údaje vyšetřených pacientů s Parkinsonovou nemocí 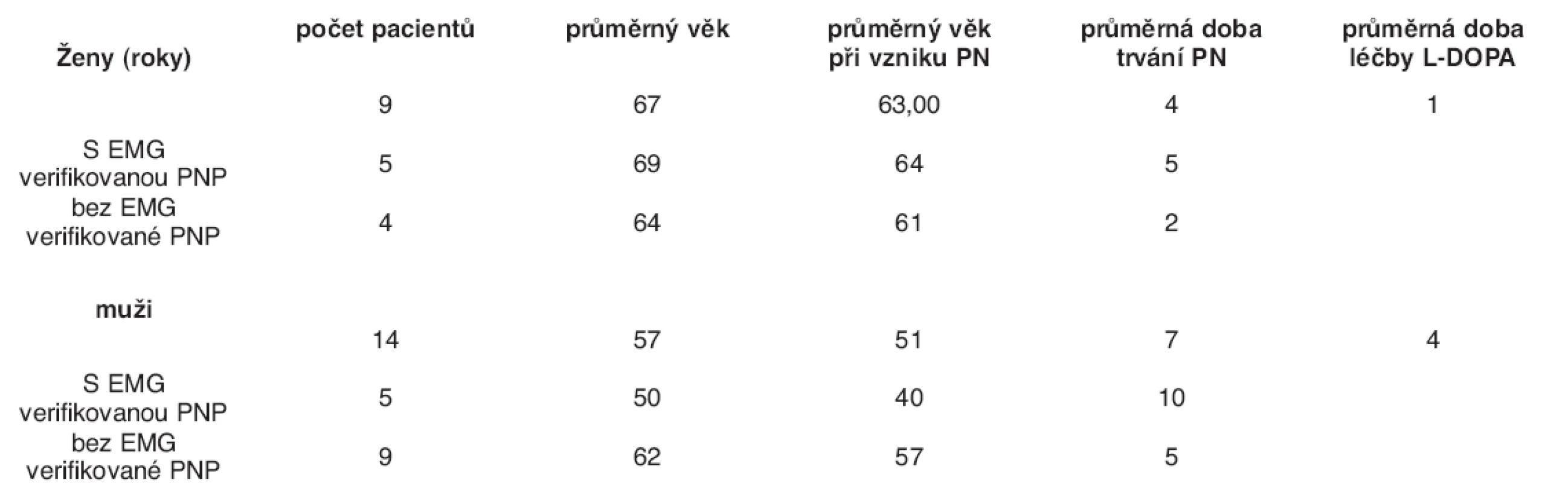
EMG – elektromyografie, PN – Parkinsonova nemoc, PNP – polyneuropatie 4. Přítomnosti polyneuropatie u pacientů řazených podle stupňů postižení Hoehn-Yahrovy stupnice 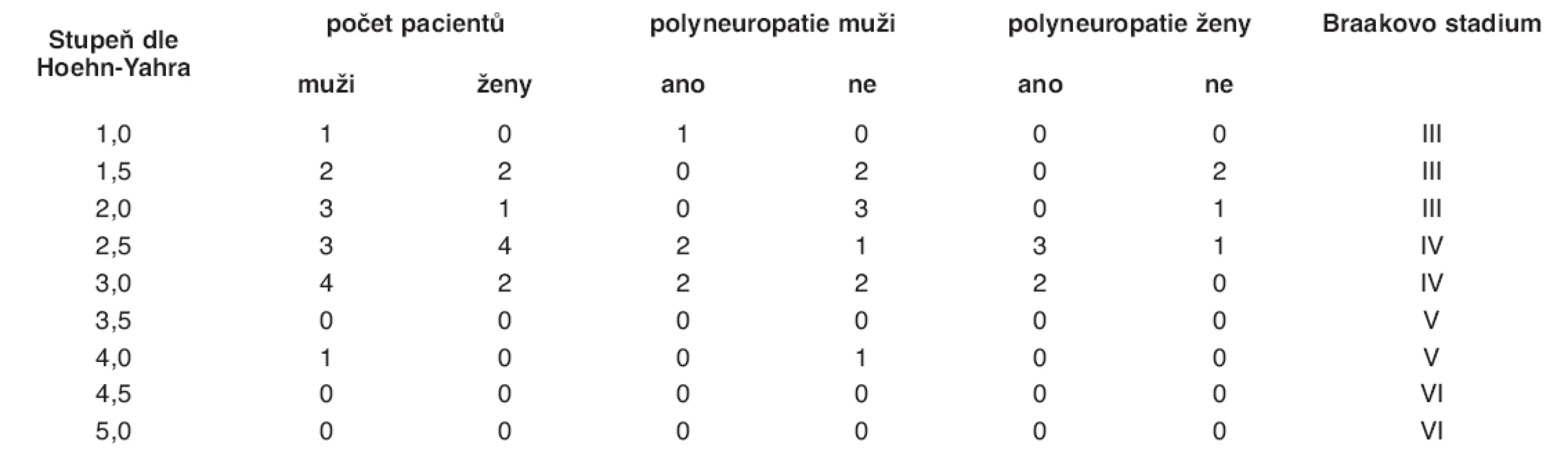
Z všech 23 pacientů, vyšetřených v rámci studie, byly klinické známky polyneuropatie (snížené šlachové a okosticové reflexy na dolních končetinách v jakékoliv distribuci, svalová hypotrofie, svalová hypodynamie, hypestezie či pallhypestezie na dolních končetinách v jakékoliv distribuci, subj. udávané dysestezie či parestezie na dolních končetinách v jakékoliv distribuci) přítomny u 10 pacientů. Jednalo se o 5 žen (55,5 %) a 5 mužů (35,7 %), celkově byly klinické známky polyneuropatie přítomny u 43,5 % všech pacientů v souboru.
Z celkem 23 pacientů byly EMG známky přítomnosti polyneuropatie prokázány v 10 případech (43,5 %). Z 9 žen, které byly vyšetřeny, byla přítomnost polyneuropatie prokázána v 5 případech (55,5 %), ze 14 mužů byla polyneuropatie prokázána v 5 případech (35,7 %). Ve všech případech se jednalo o pacienty, u kterých byl při předchozím klinickém vyšetření přítomen alespoň jeden z výše uváděných symptomů polyneuropatie. U mužů s prokázanou polyneuropatií byly při vyšetření CMAP průměrná latence 4,88 ms a průměrná amplituda 4,04 mV. Při vyšetření SNAP byla průměrná latence 3,28 ms a průměrná amplituda 5,14 uV. Při vyšetření H reflexu byla průměrná latence 33,8 ms a průměrná amplituda 1,94 mV. U žen s prokázanou polyneuropatií byly při vyšetření CMAP průměrná latence 4,46 ms a průměrná amplituda 3,82 mV, při vyšetření SNAP byla průměrná latence 2,28 ms a průměrná amplituda 4,1 uV, při vyšetření H reflexu byla průměrná latence 31,94 ms a průměrná amplituda 1,52 mV.
Na základě srovnání stupně postižení podle Hoehn-Yahrovy stupnice a příslušného stupně tzv. Braakovy stupnice stagingu postižení (1) bylo do stadia III dle Braaka zařazeno 9 pacientů (6 mužů, 3 ženy), z nichž pouze u 1 (muž) byla prokázána přítomnost polyneuropatie. Do stadia IV bylo zařazeno 13 pacientů (7 mužů, 6 žen), z nichž u 9 (4 mužů, 5 žen) byla prokázána polyneuropatie. Do stadia V byl zařazen 1 pacient (muž), u něhož nebyla polyneuropatie prokázána, a do stadia VI nebyl zařazen žádný pacient.
Diskuze
Přítomnost polyneuropatie u neurodegenerativních onemocnění je poměrně novým klinickým faktem. U většiny neurodegenerativních onemocnění zatím nebyla polyneuropatie dávána do souvislosti se základním procesem. Pouze u multisystémové atrofie (MSA) byla přítomnost symetrické polyneuropatie DKK považována za symptom podporující diagnózu MSA, a to zejména (multisystémová atrofie parkinsonského typu) MSA-P typu.
Ve studii byla polyneuropatie prokázána u 10 pacientů z celkového počtu 23 pacientů (43,5 %) trpících Parkinsonovou nemocí, která byla striktně diagnostikována na základě rigorózních kritérií UK-PDBB. Toto procento bylo překvapivě vyšší než procento ve studii Pramstallerově, kde byli zkoumáni právě pacienti s diagnózou MSA. Znamená to patrně, že podobně jako autoři předchozích prací zvažovali základní patofyziologický proces u MSA za příčinu i polyneuropatie, můžeme zvažovat neurodegenerativní proces (v širším slova smyslu) za příčinu polyneuropatie v naší skupině pacientů trpících PN. Mechanismus periferní neurodegenerace zatím nebyl jednoznačně popsán, což je pochopitelné vzhledem k tomu, že neurodegenerace v CNS má k úplnému objasnění také daleko.
Dalším cílem studie byla korelace postižení periferních nervů se stupněm tzv. Braakova stagingu. I když má Braakův koncept vertikální progrese neurodegenerace řadu odpůrců, většinou neuropatologů je považován za plauzibilní vysvětlení postupné progrese klinické symptomatologie PN. Stejně tak vzájemný vztah Hoehn-Yahrova stupně klinického postižení a stupně Braakova stagingu je nepochybně konstrukcí, jejíž ověřování postupně probíhá od roku 2003, kdy byla Braakova seminární práce publikována. Nicméně, z heuristického pohledu jde o velmi významný posun v chápání vzájemných vztahů morfologických změn tkáně CNS a klinické symptomatologie v dané časové doméně rozvoje chorobného procesu. Z tohoto hlediska zaslouží fakt, že polyneuropatie byla prokázána u 9 z 13 (tj. téměř u 70 %) pacientů, jejichž klinické postižení odpovídá Braakovu stupni postižení IV, mimořádnou pozornost. Znamenalo by to, že proces neurodegenerace v oblasti periferního nervového systému začíná u daného individua až tehdy, kdy stejný proces v oblasti CNS dosáhne určitého stupně progrese. Jinými slovy, rozsah apoptózy a s ní existujícího neurodegenerativního procesu se natolik zvětšuje, že postihuje kromě centrálních struktur i struktury periferní. Tuto pilotní hypotézu by jistě podpořil nález významnější poruchy periferních nervů u pacientů s těžším stupněm parkinsonského postižení. K tomu je nezbytný další výzkum a další a delší sledování ještě většího souboru pacientů, do kterého bude zahrnuto více jedinců s předpokládanými stupni postižení V a VI – jinými slovy řečeno, více pacientů s nejzávažnější pokročilou formou Parkinsonovy nemoci, u kterých se stupeň klinického postižení podle Hoehn-Yahra udává mezi IV–V.
Zkratky
CMAP – sumační svalový akční potenciál
DKK – dolní končetiny
EMG – elektromyografie
MSA – multisystémová atrofie
MSA-P – multisystémová atrofie parkinsonského typu
PN – Parkinsonova nemoc
SNAP – senzitivní nervový akční potenciál
UKPD BB – United Kingdom Parkinsonęs Disease Brain Bank
UPDRS – Unified Parkinsonęs Disease Rating Scale
MUDr. Zuzana Chovancová
Neurologická klinika LF UP a FN
I. P. Pavlova 6, 772 00 Olomouc
fax: +420 585 428 201, e-mail: zuzana.chovancova@fnol.cz
Sources
1. Braak, H., Del Tredici, K., Rub, U. et al.: Staging of brain pathology related to sporadic Parkinsons disease: Neurobiology of aging, 2003, 24, s. 197–211.
2. Abbruzzesse, G., Pigullo, S., Schenone, A. et al.: Does parkin play a role in a peripheral nervous system? A family report. Mov. Disord., 2004, 18, s. 978–981.
3. Rodolico, C., Toscano, A., De Luca, G. et al.: Peripheral neuropathy as the presenting features of multiple system atrophy. Clin. Autonom. Res., 2001, 11, s. 63.
4. Taly, A. B., Mutane, U. B.: Involvement of peripheral nervous system in juvenile Parkinsonęs disease. Acta Neurol. Scand., 1992, 85, s. 272–275.
5. Abele, M., Schulz, J. B., Burk, K. et al.: Nerve conduction studies in multiple system atrophy. Eur. Neurol., 2000, 43, s. 221–223.
6. Becker, G., Muller, A., Braune, S. et al.: Early diagnosis of Parkinsonęs disease. J. Neurol., 2002, 249 (Suppl. 3), s. 40–48.
7. Bareš, M., Kaňovský, P., Rektor, I.: Disturbed intracortical excitability in early Parkinsonęs disease is L-DOPA related: a prospective 12-month paired TMS study. Parkinsonism Relat. Disord., 2007, 13, 520–526
8. Hoehn, M. M., Mahr, M. D.: Parkinsonism, s. onset, progression and mortality Neurology, 1967, 17, s. 427–442.
9. Tolosa, E., Wenning, G., Poewe, W.: The diagnosis of Parkinson’s disease. Lancet Neurol., 2006, 5, s. 75–86.
10. Chovancová, Z., Kaňovský, P., Nestrašil, I., Dufek, J.: Peripheral nerves injury in the central nervous system degeneration: pilot study (abstract). Movement Disorders, 2006, 21 (Suppl. 15), s. S362–S363.
11. Nevrlý, M., Vranová, H., Ressner, P. et al.: Effect of levodopa and entacapone treatment on plasma homocystein level in Parkinson Disease: pilot study (abstract) Movement Disorders, 2006, 21 (Suppl. 15), s. S545.
12. Hallett, M. et al.: Handbook of clinical Neurophysiology, Vol 1, Movement disorders, 1st Edition, Philadelphia, Elsevier 2003, s. 7–19.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Venous Ulcer – Present View on Aetiology, Diagnostics and Therapy
- Therapy of Chronic Myeloid Leukemia. Uncommon View of the Modern Approaches
- Peripheral Nerve Injury and the Degree of Motor Involvement in Parkinson’s Disease: A Correlation Study
- Trends in Respiratory Morbidity of Children in Relation to Their Passive Smoking Exposure
- Parenteral Nutrition Before Surgery in Patients with Upper Gastrointestinal Tract Resection
- Risk Factors of Atelectasis Following Pulmonary Lobectomy
- Somatostatin Analogues in the Treatment of Carcinoid
- Sacral Nerve Stimulation in the Treatment of Anal Incontinence
- Alfred Kohn, Professor of Histology at German University in Prague
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Risk Factors of Atelectasis Following Pulmonary Lobectomy
- Somatostatin Analogues in the Treatment of Carcinoid
- Sacral Nerve Stimulation in the Treatment of Anal Incontinence
- Peripheral Nerve Injury and the Degree of Motor Involvement in Parkinson’s Disease: A Correlation Study
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

