-
Medical journals
- Career
Interferující ribonukleové kyseliny a molekulární patofyziologie vybraných onemocnění
Authors: J. Lochmanová; M. Bartoš
Authors‘ workplace: Ústav přírodních léčiv, Farmaceutická fakulta, Veterinární a farmaceutická univerzita, Brno
Published in: Čas. Lék. čes. 2008; 147: 607-615
Category: Review Article
Overview
V současné době existuje po celém světě velké množství pacientů s diagnostikovanými genetickými chorobami. Proto jsou moderní terapeutické metody zaměřené na hledání nových farmaceutických produktů, které budou schopny působit na genové úrovni, respektive na úrovni nukleotidů samotných.
RNA interference je evolučně konzervovaný proces založený na existenci dvouřetězcových RNA – interferujících RNA. Mezi nejdůležitější doposud objevené interferující RNA patří mikro RNA (miRNA) a malé interferující RNA (siRNA).
Krátké (19–25bp) nekódující dvouřetězcové RNA kontrolují správný průběh buněčného vývoje, vznik heterochromatinu a stabilitu genomu u eukaryot. Na základě komplementarity bází jsou interferující RNA schopné umlčovat jim příbuzné geny, díky čemuž je možné objasnit funkce některých genů a metabolických drah. Kromě toho jsou tyto molekuly považovány za nové diagnostické a terapeutické cíle zejména při léčbě genetických chorob, které mohou být způsobeny nukleotidovými inzercemi, delecemi a translokacemi.Klíčová slova:
RNAi, miRNA, siRNA, genetické choroby.Příčinou geneticky podmíněných chorob jsou záměny, inzerce a delece nukleotidů nebo translokace nukleotidových sekvencí. Tyto změny pozorovatelné na úrovni DNA se na úrovni proteinů projevují zvýšenou nebo sníženou aktivitou enzymů nebo změnou koncentrace proteinů v buňce. Některá onemocnění jsou důsledkem částečné nebo úplné ztráty funkce proteinu.
Průběh geneticky podmíněných chorob ovlivňují vnější i vnitřní faktory, např. oxidativní stres nebo působení volných radikálů apod. Užíváním vitaminů a antioxidantů je možné alespoň částečně zpomalit nástup nebo progresi geneticky podmíněné choroby, ale nemoc samotnou těmito přípravky vyléčit nelze. Moderní terapeutické postupy jsou proto zaměřeny na vyhledávání nových léčiv a přípravků, které působí přímo na úrovni genů (sekvencí nukleotidů) a jsou selektivní především ke konkrétním sekvencím dané mRNA, jejíž transkripci a následně translaci chceme ovlivnit. Z tohoto důvodu se do popředí zájmu farmaceutických firem stále více dostávají v roce 1993 objevené tzv. interferující RNAi (1).
Vymezení pojmů
Interferující RNA (RNAi) představují endogenní mechanismus regulace genové exprese. Účastní se ho krátké molekuly RNA, které jsou produkty regulačních genů a samy nekódují žádný protein. RNAi kontrolují genovou expresi několika způsoby – především inhibicí nebo velmi vzácně zesílením exprese na úrovni transkripce nebo translace anebo ovlivňováním epigenetických změn v lokální struktuře chromatinu (2).
Existují dva základní typy těchto malých RNA, tzv. mikroRNA (miRNA) a malé interferující RNA (siRNA). Jsou přítomny ve všech typech eukaryotických buněk, zejména v buňkách rostlinných a živočišných, byly ale popsány i u hub (3).
Oba typy interferujících RNAi využívají v průběhu svého působení mezistadia dvouřetězcové molekuly. Dvouřetězcová RNA v normálním procesu exprese genetické informace nevzniká, ale často bývá meziproduktem při replikaci virů. Všechny eukaryotické buňky tudíž na přítomnost dvouřetězcové RNA reagují obrannými mechanismy. Předpokládá se, že primární funkcí RNA interference u rostlin a bezobratlých je obrana proti aktivitě virů, ale také transposonů (4).
V rostlinách byl účinek dvoušroubovicové RNA, nazývané „antisense mRNA“ (antimediátorová RNA), na redukci genové exprese známý již mnoho let (5). Teprve popsání fenoménu RNAi u hlístice Caenorhabditis elegans roku 1998 ovšem znamenalo skutečnou revoluci v molekulární biologii (6). V roce 2006 získali Andrew Z. Fire a Craig C. Mello za tento objev Nobelovu cenu za fyziologii a lékařství.
I přesto, že je mechanismus RNAi velmi konzervovaný, probíhá u různých druhů organismů různě. Společným jevem ale zůstává štěpení dlouhé dvouřetězcové RNA na krátké úseky o délce 21–26bp komplementární k mRNA, jejíž exprese je následně utlumena. Malé interferující siRNA indukují degradaci mRNA poté, co se spojí s komplementární sekvencí na mRNA. Naproti tomu miRNA inhibují proces translace.
Nomenklatura interferujících RNA
Denně jsou popisovány nové a nové RNAi. Z tohoto důvodu bylo nutné zvolit jednotný a jedinečný nomenklaturní systém a také vytvořit databázi existujících interferujících RNAi. Příkladem takové, mezinárodně uznávané, databáze je http://microrna.sanger.ac.uk/sequences/ (7).
V databázích jsou zralé interferující RNA označovány „miR“. Pro prekurzory těchto molekul se používá zkratka „mir“. Interferující RNAi, které jsou charakteristické pro určitý druh organismu, jsou označeny 3–4 písmennými prefixy. Označení „hsa-miR-101“ a „mmu-miR-101“ pak znamenají totožnou mikroRNA lišící se pouze svým druhovým původem – „hsa“ u Homo sapiens a „mmu“ je molekula původem z Mus musculus (7).
Nově identifikovaným miRNA jsou na základě podobnosti s již existujícími sekvencemi přiřazována pořadová čísla. To znamená, že pokud je v současné době poslední identifikovanou miRNA v Drosophilla melanogaster miR-318, tak další ponese po svém objevu označení miR-319 (8).
Jelikož jedna miRNA může být kódována více geny, bylo nutné pomocí dalších numerických sufixů odlišit sekvenčně identické miRNA, které pochází z různých oblastí genomu. Označení mir-6-1 a mir-6-2 u Drosophilla melanogaster tudíž znamená identické miRNA, které pochází z různých lokusů (8).
Pomocí sufixů „3p“ a „5p“ lze rozeznat, zda maturovaná miRNA pochází z 3‘ konce nebo 5‘ konce prekurzorové molekuly (prekurzoru) (9).
Písmennými sufixy jsou označovány miRNA, které se v sekvencích liší pouze 1 nebo 2 nukleotidy, např. miR-181a, miR-181b (10).
Mechanismus vzniku RNAi
Molekuly siRNA a miRNA jsou si velmi podobné, co se týká délky (21–26bp), přítomnosti fosfátu na 5’ - konci a hydroxylu na 3’ - konci, nezbytností ribonukleázy Dicer pro jejich syntézu a principu inhibice mRNA na základě komplementarity bází. Oba typy molekul se liší především mechanismem svého vzniku (obr. 1) (11).
Image 1. Mechanismus vzniku RNAi 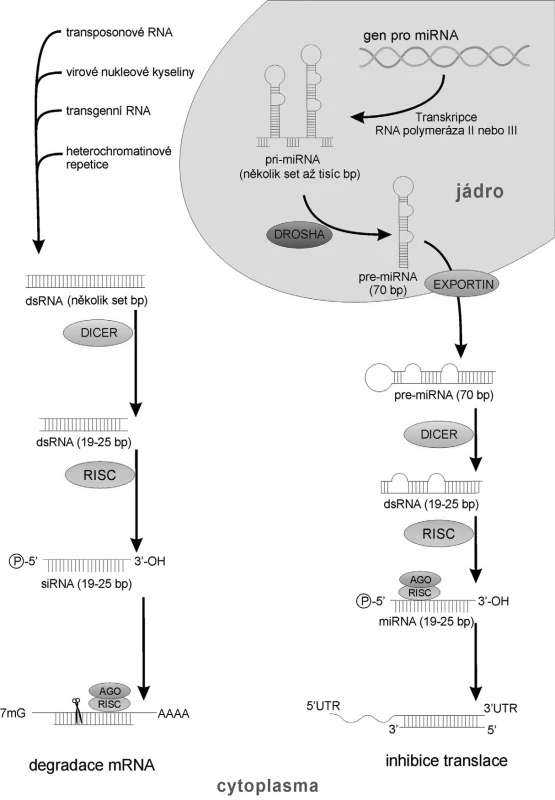
Malé regulační dvouřetězcové siRNA vznikají štěpením prekurzoru dsRNA o původní délce až několik tisíc bp RNAázou III nazvanou Dicer (12). siRNA mohou mít původ v endogenních i exogenních dvouřetězcových prekurzorech (transposonové dsRNA, transgenní dsRNA, heterochromatinové repetice, cizorodé virové nukleové kyseliny) o délce několika set bp (13). Prekurzory pro miRNA jsou jednořetězcové endogenní RNA tvořící vlásenku se smyčkou (11).
Funkční molekuly siRNA i miRNA následně v cytoplazmě interagují s velkým multiproteinovým komplexem s helikázovou aktivitou zvaným „RNA-induced silencing complex” (RISC) (14). V tomto komplexu dochází k rozpletení dvouřetězcových struktur a s RISC zůstává asociováno pouze jedno z vláken. Toto vlákno poté směřuje celý komplex k cílové struktuře, ke své komplementární mRNA. Interferující RNA (vázaná v komplexu RISC) se svým 5’ koncem (tzv. „seed region“) na základě komplementarity bází váže na 3’UTR oblast cílové mRNA. Součástí RISC komplexu jsou proteiny z rodiny Argonaute (AGO), které následně svou nukleázovou aktivitou cílovou mRNA rozštěpí, a zahájí tak její degradaci buněčnými RNázami (15).
miRNA vznikající z jednoho genu jsou schopné regulovat expresi několika set odlišných mRNA, jelikož k úspěšnému průběhu interference je dostačujících 7–8 nukleotidů „seed regionu“ na miRNA. Naopak pro siRNA platí, že inhibují expresi genů, ze kterých samy pochází (11).
Původní molekula RNAi v průběhu degradace cílové mRNA spotřebována není. Ve fázi vazby vlákna RNAi na mRNA může naopak dojít k její amplifikaci buněčnými RNA dependentními RNA polymerázami, které použijí vlákno interferující RNAi jako primer a pokračují v syntéze dsRNA. Ta je poté štěpena již zmíněnou nukleázou Dicer na další sekundární siRNA. Tyto sekundární RNAi se potom účastní dalšího kola regulace. Tímto lze vysvětlit vysokou a relativně dlouhodobou účinnost RNA interference (16).
I savčí buňky mají ribonukleázu Dicer a uměle vnesené siRNA v nich vyvolají RNA interferenci. Jelikož ale savčí buňky neobsahují RNA-dependentní RNA polymerázy, nedochází v nich k následné amplifikaci interference (11).
Využití malých molekul RNAi
Díky svým schopnostem a funkcím jsou RNAi již několik let nezbytnými nástroji a pomocníky v laboratořích nejen molekulární biologie a biochemie při zkoumání funkce genů, signalizačních a metabolických drah, při vytváření tzv. „knock-down“ modelů, ale také v aplikovaném výzkumu, např. při testování efektu léčiv (15, 17).
Molekuly siRNA byly doposud využívány zejména při vyhledávání nových nástrojů pro léčbu virových infekcí, chorob imunitního systému, kancerogeneze, neurodegenerativních a metabolických onemocnění. (15).
Molekuly miRNA jsou pro své vlastnosti (kontrola buněčného růstu, diferenciace, proliferace, apoptózy a onkogeneze v lidských buňkách) z terapeutického hlediska důležitější (18). Zatím jsou u člověka známa 2–3 % genů kódujících miRNA (19) a předpokládá se, že tyto malé RNA regulují více než 1/3 lidského genomu (20). Také se předpokládá, že 35–70 % lidských genů je přepisováno do transkriptů hnRNA, které podléhají alternativnímu sestřihu. Defekty v procesu alternativního sestřihu vedou k řadě onemocnění. Právě RNAi by mohly být použity k zablokování defektně sestřižených struktur a v důsledku toho k inhibici exprese defektního genu.
Pro správný průběh RNA interference je nezbytná přítomnost nejen miRNA a RISC komplexu, ale také několika enzymů (Dicer, Argonaute, Drosha). Doposud bylo objeveno několik chorob, na jejichž vzniku se podílí buď miRNA samotná, anebo některý z uvedených proteinů podílejících se na maturaci miRNA molekul. Choroba může být způsobena nadbytečným množstvím miRNA nebo daného proteinu, ale také naopak jejich nesprávnou nebo nedostatečnou expresí (15).
Příklady aplikací siRNA
siRNA v terapii virových onemocnění
Jako antivirové látky blokují siRNA replikaci virového genomu nebo expresi virových genů. Nejčastěji uvažovaným cílem je virus HIV, virus hepatitidy B (21), HPV (22), HCV (23), adenovirus (24, 25) a SARS asociovaný koronavirus (26). Kromě toho jsou siRNA schopné inhibovat funkce povrchových receptorů a ko-receptorů CD4 (27), CCR5 (28) nebo blokovat vstup viru do hostitelských buněk.
siRNA terapie onemocnění imunitního systému
siRNA lze terapeuticky využít i pro zlepšení funkcí imunitního systému. Bylo prokázáno, že exprese ligandů pro Notch receptory v T-lymfocytech CD4+ a dendritických buňkách pomocí malých RNA způsobuje změny v intracelulárních signálních drahách, čímž je dále ovlivněna i produkce jednotlivých cytokinů (29).
Kancerogeneze a siRNA
V případě kancerogeneze byly siRNA konstruovány s cílem inhibovat jednak známé onkogeny, fúzní (30, 31) a virové onkogeny (22) a onkogeny mutantní (např. Ras) (32), které se vyskytují pouze v určitých typech nádorových buněk. Dalšími cíli jsou inhibitory apoptózy Bcl-2 (33) a regulátory buněčného cyklu (např. polo-like kinasy) (34).
Malé siRNA byly úspěšně využity k omezení počtu i proliferace metastáz u karcinomu prostaty (35) a hepatocelulárního karcinomu (36). Účinek siRNA v tomto případě spočívá v inhibici plazminogenového aktivátoru urokinázového typu (u-PA), což je jedna z proteáz umožňující invazivní růst a tvorbu metastáz. Podobně tomu bylo v případě invazí rakoviny prsu, kdy byly siRNA využity k inhibici integrinů (37).
Vaskulární endoteliální růstový faktor (VEGF) je dalším potenciálním cílem při léčbě karcinomů, jelikož zvýšená exprese je asociována s celou řadou nádorových onemocnění (karcinom prsu, kolorektální karcinom) i metastáz (38). Prvním antagonistou VEGF byla monoklonální protilátka bevacizumab. Současná terapie je ale směřována k metodám RNA interference. V 1. fázi klinického testování jsou nyní molekuly siRNA se sekvencí komplementární k VEGF jako léčiva proti věkem podmíněné makulární degeneraci (AMD – age related macular degeneration) (39).
Malými siRNA je také možné zlepšit efektivitu chemoterapie, a to inhibicí genu MDR1, jehož produktem je membránový P-glykoprotein exportující z buňky toxické látky, a to včetně cytostatik (vinca alkaloidy, anthracykliny, paclitaxel a etoposid) (40).
siRNA terapie neurodegenerativních onemocnění
Malými RNA bylo na modelu Caenorhabditis elegans prokázáno, že jsou schopné oddálit nástup některých neurodegenerativních chorob (Parkinsonova, Alzheimerova choroba a amyotrofní laterální skleróza), které jsou vyvolané nesprávnou proteostázou a nadměrným množstvím toxicky působícího proteinu (41, 42). Malé RNA ovlivňují progresi těchto chorob působením na „heat shock response proteiny“ (HSR), které kontrolou exprese heat shock proteinů zajišťují správný průběh proteostázy a degradaci toxického proteinu. Dalšími cílovými proteiny pro siRNA jsou „unfolded protein response“ proteiny (UPR) (43).
Dále bylo prokázáno, že malé RNA jsou schopné inhibovat expresi dominantní toxické alely (44) i alely se SNP (45), jež jsou zodpovědné za vznik Huntingtonovy chorey a Kennedyho choroby, které jsou způsobené expanzí CAG repetic (46).
siRNA a terapie diabetes mellitus
RNAi mohou být zacíleny proti genům, které jsou spojeny s metabolickými poruchami (například v léčbě diabetes mellitus (DM) I. i II. typu).
DM I. typu může být způsoben autoimunitní destrukcí ß buněk pankreatu, která je iniciována translokací intracelulárních ligandů Fas/FasL po stimulaci cytokiny. Bukhardt et al. malými RNA inhibovali expresi genů pro intracelulární ligandy Fas, čímž byly ß–buňky chráněny před působením cytokinů (47).
Podstatou DM II. typu je zejména inzulínová rezistence, kde centrální roli v rezistenci periferních tkání k inzulínu hrají poruchy signalizace v důsledku změn v expresi genů a dále snížená schopnost inzulínu blokovat výdej glukózy z jater (48).
Valadés et al. malými RNA inhibovali v myších i lidských buňkách expresi fosfoenolpyruvát-karboxykinázy (PEPCK), což je jeden z klíčových enzymů glukoneogeneze (GNG). Jaterní GNG je velmi důležitý proces, který upravuje hladinu krevní glukózy. Výsledkem inhibice PEPCK bylo snížení plazmatické hladiny glukózy a zlepšení glukózové tolerance. Současně došlo ke snížení hladin sérových triacylglycerolů a volných mastných kyselin (49).
Koo et al. malými RNA inhibovali expresi jaderného transkripčního koaktivátoru PPAR-γ (PGC-1), jehož množství je zvýšené u diabetických pacientů a přispívá k rozvoji inzulínové rezistence. Inhibicí PGC-1 došlo ke snížení množství krevní glukózy i enzymů GNG (PEPCK, glukóza-6-fosfatáza) a ß-oxidace (50).
Dalšími klíčovými místy ovlivňující působení inzulínu jsou inzulínové receptory (IR) a jejich substráty (IRS). Ke vzniku DM II. typu dochází, pokud jsou IR nebo IRS poškozené, a není tudíž umožněn vstup glukózy do buněk (51).
Taniguchi et al. inhibovali malými RNA jaterní expresi obou izoforem – IRS-1 a IRS-2. V obou případech došlo k hyperinzulinémii, systémové inzulínové rezistenci, glukózové intoleranci a jaterní steatóze. Svými pokusy potvrdili, že snížená exprese IRS může vést ke vzniku inzulínové rezistence. A dále, že IRS-1 více souvisí s homeostázou glukózy a IRS-2 s lipidovým metabolismem (51).
IR i IRS jsou za fyziologických podmínek deaktivovány tyrosinovými fosfatázami (PTP1B, TCPTP), které jsou negativními regulátory inzulínového signálu. Inhibicí exprese jednotlivých fosfatáz malými RNA došlo ke zlepšení inzulínové signalizace. Xu et al. tímto vyvrátili dřívější teorie o synergistickém účinku fosfatáz na přenos inzulínového signálu (52).
siRNA molekuly lze považovat za nové terapeutické možnosti v léčbě diabetické nefropatie, která je způsobená nadměrnou akumulací proteinů extracelulární matrix (ECM). Malými siRNA byla v tomto případě inhibována exprese transformujícího růstového faktoru (TGF-ß1), který je schopen stimulovat syntézu proteinů ECM (53). Důsledkem této inhibice byla inhibice exprese proteinů ECM. Za další potenciální cíl při léčbě diabetické nefropatie je možno považovat miR-192, jejíž hladina se přítomností TGF-ß1 zvyšuje (54).
Příklady aplikací miRNA
miRNA a neurodegenerativní onemocnění
První souvislost mezi lidskými chorobami a malými RNA byla objevena u Drosophily, jejíž protein dFMR1 je homologní k lidskému fragile X mental retardation proteinu (FMRP) (55). Tento protein je zodpovědný za vznik syndromu fragilního X-chromozómu spočívajícího v expanzi repetitivní sekvence CGG, která se nachází v 5‘ UTR oblasti genu FMRP/FMR1. Pokud se tato repetice opakuje více než 200×, dochází následně k metylaci přilehlého ostrůvku CpG i repetic samotných, čímž je znemožněna transkripce genu FMRP/FMR1 (56).
Prozatím bylo několika autory prokázáno, že protein FMRP/FMR1 je jedním z mnoha vázajících se na podjednotku RISC komplexu a řídící translaci ostatních proteinů (55, 56). Jakékoliv narušení FMRP jako podjednotky RISC může tedy vést ke vzniku této choroby. Zatím není známo, které miRNA řídí expresi mRNA právě pomocí FMRP/FMR1 proteinu (55).
V mozkových buňkách se vyskytuje velké množství miRNA (např. miR-124a, miR-134, miR-133b). Pro správný vývoj nejen dopaminergních neuronů jsou důležité Dicer i miRNA, a proto se předpokládá, že ztráta určitých miRNA může zapříčinit vznik i progresi Parkinsonovy choroby (PCH) (57).
V souvislosti se vznikem neurodegenerativních chorob existuje určitá pravděpodobnost výskytu genových polymorfismů v oblastech kódujících specifické miRNA nebo enzymy účastnící se zrání RNAi, přičemž nejdůležitějšími se zdají být 3’ UTR genů pro alfa-synuklein a amyloidový prekurzorový protein. Je také známo, že nedostatek některých miRNA může úzce souviset se stářím, což jen potvrzuje výskyt PCH a Alzheimerovy choroby (ACH) po 50. roce života (57).
miRNA jsou součástí některých ribonukleoproteinových (RNP) komplexů (58), které štěpí mRNA na základě jejich komplementarity s miRNA (59). Pro vznik i funkci RNP jsou důležité proteiny motorických neuronů, tzv. „SMN“ proteiny, jejichž mutací dochází ke vzniku spinální muskulární atrofie (SMA). Dalšími proteiny nezbytnými pro RNP jsou Gemin 2, 3, 4, 5 a 6. Za fyziologických podmínek v různých tkáních, včetně motorických neuronů, interaguje protein Gemin 3 s miRNA a předpokládá se, že zajišťuje rozvinutí dsRNA nebo usnadňuje rozpoznání cílové mRNA, a tím kontrolu translace (58). U pacientů postižených spinální muskulární atrofií (SMA) k této interakci nedochází (58). Zatím není objasněno, jaký vliv má Gemin 3 na vznik RNP komplexů v průběhu SMA (60).
miRNA a metabolická onemocnění
Některé miRNA jsou exprimovány pouze v určitých tkáních a nebo pouze v jejich určitém vývojovém stadiu. Je tomu tak i v případě ß-buněk pankreatu, ve kterých bylo identifikováno několik miRNA podílejících se na regulaci hladiny krevní glukózy a sekreci inzulínu (miR-375, miR 376, miR-9, miR-124-a2). Nejvíce zastoupena je miR 375 (61, 62).
miR-375, pokud je exprimována v nadměrném množství, inhibuje glukózou stimulovanou sekreci inzulínu. A naopak, pokud je inhibována sama miR-375, je sekrece inzulínu zvýšena. Mechanismus, kterým je sekrece inzulínu modifikována, není závislý na změnách metabolismu glukózy nebo intracelulárních hladinách Ca2+, ale má přímý efekt na exocytózu inzulínu (61). Poy et al. na základě zjištění, že inhibice exprese myotrofinu má stejný vliv na sekreci inzulínu jako miR-375, prokázali, že miR-375 inhibuje v ß-buňkách pankreatu expresi myotrofinu, a ovlivňuje tak poslední stadia exocytózy (62).
Nádorová onemocnění spojená s miRNA
Mezi další choroby související s miRNA patří nádorová onemocnění. Bylo objeveno mnoho potenciálních terapeutických cílů regulujících apoptózu, proliferaci a buněčnou signalizaci. Molekuly schopné inhibovat expresi těchto genů jsou v dnešní době hlavními nástroji ve výzkumu kancerogeneze.
V buňkách není kontrolována exprese pouze strukturních genů, ale i transkripce a úpravy miRNA samotných (63, 64). Aktivita genů pro miRNA může být ovlivněna třemi způsoby:
- přemístěním genů vyskytujících se v blízkosti promotorů pro miRNA,
- translokací v regulačních oblastech,
- změnou v oblasti 3’ UTR na mRNA (64).
Ke vzniku nádorového onemocnění může dojít i mutací genů podílejících se na vzniku miRNA. Například u pacientů s Wilmsovým tumorem nejsou exprimovány AGO proteiny (65) a u primitivních neuroektodermálních nádorů je změněna struktura AGO proteinů (13).
Na post-transkripční úrovni mohou být dysregulovány i onkogeny, které jsou pod kontrolou určité miRNA. Ztráta represe řízené molekulami miRNA je u některých onkogenů jedním ze způsobů, jakým jsou tyto geny aktivovány (63, 64). Může docházet i k mutacím v sekvenci molekul miRNA kontrolujících expresi tumor-supresorového genu; to vede ke zvýhodnění nádorových buněk (obr. 2.) (66).
Image 2. Obecné schéma kontroly nádorového bujení molekulami miRNA 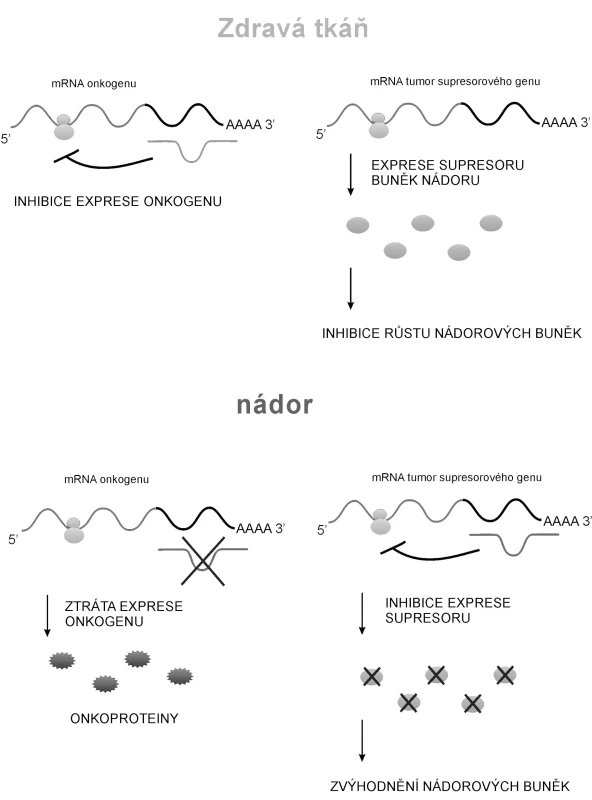
Z terapeutického hlediska je nejdůležitější, že molekulami miRNA lze inhibovat expresi mutovaných genů (67).
Molekuly miRNA se mohou v průběhu kancerogeneze chovat jednak jako onkogeny, jako je tomu v případě miR-155, jejíž hladina je několikanásobně zvýšená u pacientů s Burkittovým lymfomem (68). Naopak pacienti s chronickou lymfocytární leukémií (CLL) postrádají geny pro miR-15 a miR-16, které se v tomto případě chovají jako klasické tumor supresorové geny (69).
Exprese některých proteinů (RAF1 kináza, G-protein γ 7 a tumor-suppresing subfragment candidate 1) účastnících se transdukce signálu, genové exprese a onkogeneze je řízená miR-143 a miR-145 (70). Hladiny těchto miRNA jsou snížené u nádorů prostaty, prsu, děložního čípku a kolorektálního karcinomu (63, 70).
Pod kontrolou tumor supresorového genu let-7 miRNA jsou také proteiny nehistonové povahy „High Mobility Group A2“ (HMGA2), které svou translokací a strukturními změnami chromatinu ovlivňují transkripci některých genů. Jsou exprimovány nejen v embryonálních nediferencovaných proliferativních buňkách, ale také v buňkách maligních. Ke vzniku nádorového bujení může dojít při poškození v oblasti 3’ UTR v důsledku translokace chromozomů a zkrácení ORF pro HMGA2. Hlavním mechanismem translokací onkogenního HMGA2, který je asociovaný s některými lidskými tumory, je tedy ztráta represe pomocí let-7 miRNA (66).
Hong et al. poprvé použili RNAi v lidských buňkách s Burkittovým lymfomem a prokázali tak, že metodou RNA interference je možné objasnit patogenezi chorob způsobených viry Epstein-Barrové (EBV) a miRNA použít v terapii karcinomů vyvolaných EBV (71).
miRNA-155 je v nadměrném množství exprimována v solidních tumorech a B-lymfomech (72), což znamená, že gen pro miR-155 může do jisté míry souviset s kancerogenezí. Mimo jiné se miR-155 exprimuje v nadměrném množství v buňkách imunitního systému, a to v aktivovaných B a T lymfocytech (73, 74), makrofázích a dendritických buňkách (75, 76). Inhibicí exprese miR-155 bylo prokázáno, že je nezbytná pro udržení homeostázy imunitního systému, jelikož řídí expresi několika genů (cytokiny, chemokiny a transkripční faktory). Dále je naprosto nezbytná pro správnou funkci B - a T-lymfocytů a následnou produkci cytokinů.
Byla prokázána komplementarita mezi sekvencemi miR 155 a oblastmi na chromozómu, které souvisejí s výskytem asthma bronchiale, atopické dermatitidy a pylové alergie. Předpokládá se, že miR-155 určitým způsobem souvisí s uvedenými chorobami (77–79).
Ostatní poruchy spojené s RNAi
Geny kódující miRNA nejsou na chromozómech umístěny náhodně, ale velká část z nich je lokalizována v tzv. fragilních oblastech (63), což jsou místa, kde preferenčně dochází k translokacím, výměně sesterských chromatid, delecím, amplifikacím nebo k integraci plasmidové DNA. Dále se mohou miRNA vyskytovat v blízkosti míst pro začlenění lidského papilloma viru (HPV). Integrací HPV do lidského genomu může dojít k deleci i amplifikaci miRNA vyskytujících se právě v dané integrační oblasti, což dále může vést k určitým vývojovým změnám a chorobám.
Je známo, že 52,5 % genů pro miRNA se vyskytuje v oblastech asociovaných s nádorovým bujením, což potvrzuje účast miRNA při vzniku těchto onemocnění (63).
Výskyt miRNA byl prokázán i v clusterech HOX genů a v jejich blízkosti. Exprese HOX genů asociovaných s miRNA (HOXB4, HOXB5, HOXC9, HOXC10, HOXD4 a HOXD8) je v řadě solidních a hematopoietických nádorů deregulována (63).
Závěr
S postupem času a neustálým objevováním nových interferujících RNA jsou starší metody (anti-sense DNA, cílená mutageneze, ribozymy) postupně z praxe vytlačovány. Dalšími důvody, proč se upouští od jejich používání, je vysoká cena, nepříliš efektivní reasociace s cílovými sekvencemi a zejména neschopnost přenosu inhibičního signálu do dalších linií (80).
RNAi technologie má několik velmi významných vlastností z hlediska terapie – je to zejména vysoká specifičnost působení a efektivnost účinku, schopnost inhibovat expresi genů na post-transkripční úrovni i na úrovni translace a v neposlední řadě i to, že jsou malé interferující RNAi metabolizovány jako přirozené nukleotidy (81).
Teoreticky by RNAi technologie mohla být použita při léčbě jakékoliv choroby způsobené nadměrnou expresí určitého proteinu nebo jeho mutantní formy, pokud by po jeho inhibici malými RNA nebyla naopak toxická jeho nízká hladina (82).
Využití interferujících RNAi je perspektivní cestou k léčbě širokého spektra onemocnění, o čemž svědčí zájem řady farmaceutických firem o vývoj léčiv na bázi RNAi. Mezi nejvýznamnější farmaceutické společnosti v tomto směru patří Acuity Pharmaceuticals, AGY Therapeutics, Alnylam Pharmaceuticals Inc., Atugen AG, Benitec Australia Limited, Calando Pharmaceuticals, Cytrx Corporation, Devgen, Genesis R&D, Genta Incorporated, International Therapeutics, Intradigm Corporation, Nucleonics, Inc. a Sirna Therapeutics, Inc.(83). Ve fázi pre-klinického vývoje jsou nyní siRNAs proti syncitial respiratory viru, hepatitidě C, HIV, Huntingtonově choree a některým neurodegenerativním chorobám (83).
Zkratky
AGO – Argonaute proteiny
ACH – Alzheimerova choroba
AMD – věkem podmíněná makulární degenerace (age related macular degeneration)
bp – páry bází (base pair)
CLL – chronická lymfocytární leukémie
EBV – virus Epstein-Barrové
ECM – extracelulární matrix
FMRP – fragile X mental retardation protein
GNG – glukoneogeneze
HCV – hepatitis C virus
HIV – human immunodeficiency virus
HMG – high mobility group protein
HOX – Homeobox geny
HPV – lidský papilloma virus (human papilloma virus)
HSR – heat shock response proteiny
hnRNA – heterogenní jaderná RNA (heterogenous nuclear RNA)
IR – inzulínové receptory
IRS – substráty inzulínových receptorů
mRNA – mediátorová RNA
miRNA – microRNA
ORF – otevřený čtecí rámec (open reading frame)
PEPCK – fosfoenolpyruvát karboxykináza (phosphoenolpyruvate carboxykinase)
PCH – Parkinsonova choroba
PPAR-γ – receptory aktivované proliferátory peroxizomů (peroxisome proliferators-activated receptors)
RISC – RNA induced silencing complex
RNA – ribonukleová kyselina (ribonucleic acid)
RNAi – interferující RNA
RNP – ribonukleoproteiny
siRNA – malé interferující RNA (small interfering RNA)
SMA – spinální muskulární atrofie
SNP – jednonukleotidový polymorfismus (single nucleotide polymorphism)
TGF – transformující růstový faktor (transforming growth factor)
UPR – unfolded protein response
UTR – nepřekládaná oblast genu (untranslated region)
VEGF – vaskulární endotelový růstový faktor (vascular endothelial growth factor)
Mgr. Jana Lochmanová
Ústav přírodních léčiv FaF VFU
Palackého 1–3, 612 42 Brno
e-mail: jana.lochmanova@gmail.com
Sources
1. Lee, R. C., Feinbaum, R. L., Ambros, V.: The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell, 1993, 75, s. 843–854.
2. Amaral, P. P., Dinger, M. E., Mercer, T. R., Mattick, J. S.: The Eukaryotic Genome as an RNA Machine. Science, 2008, 319, s. 1787–1789.
3. Cogoni, C., Macino, G.: Post-transcriptional gene silencing across kingdoms. Curr. Opi. Genet. Dev., 2000, 10, s. 638–643.
4. Štruncová, S., Borská, R., Kusenda, B. et al.: RNA interference – účinný nástroj regulace genové exprese. Biologické listy, 2005, 70, s. 231–247.
5. Napoli, C. L., Jorgensen, R.: Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans. Plant Cell, 1990, 2, s. 279–289.
6. Fire, A., Xu, S. Q., Montgomery, M. K. et al.: Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature, 1998, 391, s. 806–811.
7. Jones, S. G., Grocock, R. J., van Dongen, S. et al.: miRBase: microRNA sequences, targets and gene nomenclature. Nucleic Acids Research, 2006, 34, s. 140–144.
8. Lagos-Quintana, M., Rauhut, R., Lendeckel, W., Tuschl, T.: Identification of Novel Genes Coding for Small Expressed RNAs. Science, 2001, 294, s. 853–858.
9. Jones, S. G.: The microRNA Registry. Nucleic Acids Research, 2004, 32, s. 109–111.
10. Lim, L. P., Glasner, M. E., Yekta, S. et al.: Vertebrate MicroRNA Genes. Science, 2003, 299, s. 1540.
11. Novina, C. D., Sharp, P. A.: The RNAi revolution. Nature, 2004, 430, s. 161–164.
12. Bernstein E., Caudy A., Hammond S., Hannon G.: Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature, 2001, 409, s. 363–366.
13. Nelson, P., Kiriakidou, M., Sharma, A. et al.: The microRNA world: Small is mighty. Trends Biochem. Sci., 2003, 28, s. 534–540.
14. Hammond, S. M., Bernstein, E., Beach, D., Hannon, G. J.: An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature, 2000, 404, s. 293–296.
15. Huan Gong, Chang-Mei Liu, De-Pei Liu, Chih-Chuan Liang: The role of small RNAs in human diseases: Potential troublemaker and therapeutic tools. Medicinal research reviews, 2005, 25, s. 361–381.
16. Hannon, G. J.: RNA interference. Nature, 2002, 418, s. 244–251.
17. Agrawal, N., Dasaradhi, P. V. N., Mohmmed, A. et al.: RNA Interference: Biology, Mechanism, and Applications. Microbiol Mol Biol Rev, 2003, 67, s. 657–685.
18. Ambros, V.: The functions of animal microRNAs. Nature, 2004, 431, s. 350–355.
19. Sontheimer, E. J., Carthew, R. W.: Silence from within: Endogenous siRNAs and miRNAs. Cell, 2005, 122, s. 9–12.
20. Lewis, B. P., Burge, C. B., Bartel, D. P.: Conserved Seed Pairing, Often Flanked by Adenosines, Indicates that Thousands of Human Genes are MicroRNA Targets. Cell, 2005, 120, s. 15–20.
21. Sholmai, A., Shaul, Y.: Inhibition of hepatitis B virus expression and replication by RNA interference. Hepatology, 2003, 37, s. 764–770.
22. Jiang, M., Milner, J.: Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treatment with siRNA: A primer of RNA interference. Oncogene, 2002, 21, s. 6041–6048.
23. Randall, G., Grakoui, A., Rice, C. M.: Clearance of replicating hepatitis C virus replicon RNAs in cell culture by small interfering RNAs. Proc. Natl. Acad. Sci. USA, 2003, 100, s. 235–240.
24. Ge, Q., McManus, M. T., Nguyen, T. et al.: RNA interference of influenza virus production by directly targeting mRNA for degradation and indirectly inhibiting all viral RNA transcription. Proc. Natl. Acad. Sci. USA, 2003, 100, s. 2718–2723.
25. Tompkins, S. M., Lo, Ch. Y., Tumpey, T. M., Epstein, S. L.: Protection against lethal influenza virus challenge by RNA interference in vivo. Proc. Natl. Acad. Sci. USA, 2004, 101, s. 8682–8686.
26. Wang, Z., Ren, L., Zhao, X. et al.: Inhibition of Severe Acute Respiratory Syndrome Virus Replication by Small Interfering RNAs in Mammalian Cells. Journal of Virology, 2004, 78, s. 7523–7527.
27. Novina, C, D., Murray, M. F., Dykxhoorn, D. M. et al.: siRNA-directed inhibition of HIV-1 infection. Nature Medicine, 2002, 8, s. 681–686.
28. Qin, X. F., An, D. S., Chen, I. S. Y., Baltimore, D.: Inhibiting HIV-1 infection in human T cells by lentiviral-mediated delivery of small interfering RNA against CCR5. Proc. Natl. Acad. Sci. USA, 2003, 100, s. 183–188.
29. Stallwood, Y., Briend, E., Ray, K. M. et al.: Small Interfering RNA-Mediated Knockdown of Notch Ligands in Primary CD4+ T Cells and Dendritic Cells Enhances Cytokine Production. The Journal of Immunology, 2006, 177, s. 885–895.
30. Wilda, M., Fuchs, U., Wössmann, W., Borkhardt, A.: Killing of leukemic cells with a BCR/ABL fusion gene by RNA interference (RNAi). Oncogene, 2002, 21, s. 5716–5724.
31. Scherr, M., Battmer, K., Winkler, T. et al.: Specific inhibition of bcr-abl gene expression by small interfering RNA. Blood, 2003, 101, s. 1566–1569.
32. Brummelkamp, T. R., Bernards, R., Agami, R.: Stable suppression of tumorgenicity by virus-mediated RNA interference. Cancer Cell, 2002, 2, s. 243–247.
33. Cioca, D. P., Aoki, Y., Kiyosawa, K: RNA interference is a functional pathway with therapeutic potential in human myeloid leukemia cell lines. The Cancer Gene, 2003, 10, s. 125–133.
34. Spänkuch, B., Matthess, Y., Knecht, R. et al.: Cancer Inhibition in Nude Mice After Systemic Application of U6 Promoter-Driven Short Hairpin RNAs Against PLK1. Journal of the National Cancer Institute, 2004, 96, s. 862–872.
35. Pulukuri, S. M. K., Gondi, Ch. S., Lakka, S. S. et al.: RNA Interference-directed Knockdown of Urokinase Plasminogen Activator and Urokinase Plasminogen Activator Receptor Inhibits Prostate Cancer Cell Invasion, Survival, and Tumorigenicity in Vivo. J. Biol. Chem., 2005, 280, s. 36529–36540.
36. Salvi, A., Arici, B., Alghisi, A. et al.: Small interfering RNA urokinase silencing inhibits invasion and migration of human hepatocellular carcinoma cells. Mol. Cancer Ther., 2004, 3, s. 671–678.
37. Lipscomb, E. A., Dugan, A. S., Rabinovitz, I., Mercurio, A. M.: Use of RNA interference to inhibit integrin (α6ß4)-mediated invasion and migration of breast carcinoma cells. Clinical and Experimental Metastasis, 2003, 20, s. 569–576.
38. Holash, J., Davis, S., Papadopoulos, N. et al.: VEGF-Trap: A VEGF blocker with potent antitumor effects. Proc. Natl. Acad. Sci. USA, 2002, 99, s. 11393–11398.
39. Perkel, J. M.: Therapeutic RNAi: Delivering the Future? Life Science Technologies, 2007, s. 829–832.
40. Nieth, C., Priebsch, A., Stege, A., Lage, H.: Modulation of the classical multidrug resistance (MDR) phenotype by RNA interference (RNAi). FEBS Letters, 2003, 545, s. 144–150.
41. Cohen, F. E., Bieschke, J., Perciavalle, R. M. et al.: Opposing Activities Protect Against Age-Onset Proteotoxicity. Science, 2006, 313, s. 1604–1610.
42. Cohen, F. E., Kelly, J. W.: Review article Therapeutic approaches to protein-misfolding diseases. Nature, 2003, 426, s. 905–909.
43. Balch, W. E., Morimoto, R. I., Dillin, A., Kelly, J. W.: Adapting Proteostasis for Disease Intervention. Science, 2008, 319, s. 916–919.
44. Xia, H., Mao, Q., Eliason, S. L. et al.: RNAi suppresses polyglutamine-induced neurodegeneration in a model of spinocerebellar ataxia. Nature Medicine, 2004, 10, s. 816–820.
45. Miller, V. M., Xia, H., Marrs, G. L. et al.: Allele-specific silencing of dominant disease genes. Proc. Natl. Acad. Sci. USA, 2003, 10, s. 2718–2723.
46. Caplen, N. J., Taylor, J. P., Statham, V. S. et al.: Rescue of polyglutamine-mediated cytotoxicity by double-stranded RNA-mediated RNA interference. Hum. Mol. Gen., 2002, 11, s. 175–184.
47. Burkhardt, B. R., Lyle, R., Keping, Q. et al.: Efficient delivery of siRNA into cytokine-stimulated insulinoma cells silences Fas expression and inhibits Fas-mediated apoptosis. FEBS Letters, 2006, 580, s. 553–560.
48. Poy, M. N., Spranger, M., Stoffel, M.: microRNAs and the regulation of glucose and lipid metabolism. Diabetes, Obesity and Metabolism, 2007, 9, s. 67–73.
49. Gómez-Valadés, A. G., Vidal-Alabró, A., Molas, M. et al.: Overcoming Diabetes-Induced Hyperglycemia through Inhibition of Hepatic Phosphoenolpyruvate Carboxykinase (GTP) with RNAi. Molecular Therapy, 2006, 13, s. 401–410.
50. Koo, S.-H., Satoh, H., Herzig, S. et al.: PGC-1 promotes insulin resistance in liver through PPAR dependent induction of TRB-3. Nature Medicine, 2004, 10, s. 530–534.
51. Taniguchi, C. M., Ueki, K., Kahn, C. R.: Complementary roles of IRS-1 and IRS-2 in the hepatic regulation of metabolism. The Journal of Clinical Investigation, 2005, 115, s. 718–727.
52. Xu, J., Li, L., Hong, J., Huang, W.: Effects of small interference RNA against PTP1B and TCPTP on insulin signaling pathway in mouse liver: Evidence for non-synergetic cooperation. Cell Biology International, 2007, 31, s. 88–91.
53. Noh, H. J., Kim, H. C., Lee, S. S. et al.: The inhibitory effect of siRNAs on the high glucose-induced overexpression of TGF-beta1 in mesangial cells. J. Korean Med. Sci., 2006, 21, s. 430–435.
54. Kato, M., Zhang, J., Wang, M. et al.: MicroRNA-192 in diabetic kidney glomeruli and its function in TGF – induced collagen expression via inhibition of E-box repressors. Proc. Natl. Acad. Sci. USA, 2007, 104, s. 3432–3437.
55. Caudy, A. A., Myers, M. P., Hannon, G. J., Hammond, S. M.: Fragile X-Related protein and VIG associate with the RNA interference machinery. Genes & Dev., 2002, 16, s. 2491–2496.
56. Ishizuka, A., Siomi, M. C., Siomi, H.: A Drosophila fragile X protein interacts with components of RNAi and ribosomal proteins. Genes & Dev., 2002, 16, s. 2497–2508.
57. Kim, J., Inoue, K., Ishii, J. et al.: A MicroRNA Feedback Circuit in Midbrain Dopamine Neurons. Science, 2007, 317, s. 1220–1224.
58. Mourelatos, Z., Dostie, J., Paushkin, S. et al.: miRNPs: a novel class of ribonucleoproteins containing numerous microRNAs. Genes & Dev., 2002, 16, s. 720–728.
59. Hutvágner, G., Zamore, P.D.: A microRNA in a multiple turnover RNAi enzyme complex. Science, 2002, 297, s. 2056–2060.
60. Dostie, J., Mourelatos, Z., Yang, M., Sharma, A., Dreyfuss, G.: Numerous microRNPs in neuronal cells containing novel microRNAs. RNA, 2003, 9, s. 180–186.
61. Poy, M. N., Spranger, M., Stoffel, M.: microRNAs and the regulation of glucose and lipid metabolism. Diabetes, Obesity and Metabolism, 2007, 9, s. 67–73.
62. Poy, M. N., Eliasson, L., Krutzfeld, J. et al.: A pancreatic islet-specific microRNA regulates insulin secretion. Nature, 2004, 432, s. 226–230.
63. Calin, G. A., Sevignani, C., Dumitru, C. D. et al.: Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers. Proc. Natl. Acad. Sci. USA, 2004, 101, s. 2999–3004.
64. McManus, M. T.: MicroRNAs and Cancer, Seminars in Cancer Biology, 2003, 13, s. 253–258.
65. Carmell, M A., Xuan, Z., Zhang, M. Q., Hannon, G. J.: The Argonaute family: Tentacles that reach into RNAi, developmental control, stem cell maintenance, and tumorigenesis. Genes & Dev., 2002, 16, s. 2733–2742.
66. Mayr, Ch., Hemann, M. T., Bartel, D. P.: Disrupting the Pairing Between let-7 and Hmga2 Enhances Oncogenic Transformation. Science, 2007, 315, s. 1576–1579.
67. Wei Lv, Chao Zhang, Jia Hao: RNAi technology: A Revolutionary tool for the Colorectal cancer therapeutics. World J. Gastroenterol., 2006, 12, s. 4636–4639.
68. Metzler, M., Wilda, M., Busch, K. et al.: High expression of precursor microRNA-155/BIC RNA in children with Burkitt lymphoma. Genes, Chromosomes and Cancer, 2003, 39, 167–169.
69. Calin, G. A., Dumitru, C. D., Shimizu, M. et al.: Frequent deletions and down-regulation of micro - RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc. Natl. Acad. Sci. USA, 2002, 99, s. 15524–15529.
70. Michael, M. Z., O‘Connor, S. M., Pellekaan, N. G. H. et al.: Reduced Accumulation of Specific MicroRNAs in Colorectal Neoplasia. Molecular Cancer Research, 2003, 1, s. 882–889.
71. Hong, M., Murai, Y., Kutsuna, T. et al.: Suppression of Epstein-Barr nuclear antigen 1 (EBNA1) by RNA interference inhibits proliferation of EBV-positive Burkitt‘s lymphoma cells. J Cancer Res Clin Oncol, 2006, 132, s. 1–8.
72. Krivtsov, A. V., Twomey, D., Feng, Z. et al.: Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature, 2006, 442, s. 818–822.
73. Pui, C. H., Behm, F. G., Downing, J. R. et al.: 11q23/MLL rearrangement confers a poor prognosis in infants with acute lymphoblastic leukemia. Journal of Clinical Oncology, 1994, 12, s. 909–915.
74. So, Ch. W., Karsunky, H., Passegué, E. et al.: MLL-GAS7 transforms multipotent hematopoietic progenitors and induces mixed lineage leukemias in mice. Cancer Cell, 2003, 3, s. 161–171.
75. Zeisig, B. B., García-Cuéllar, M. P., Winkler, T. H., Slany, R. K.: The Oncoprotein MLL-ENL disturbs hematopoietic lineage determination and transforms a biphenotypic lymphoid/myeloid cell. Oncogene, 2003, 22, s. 1629–1637.
76. Cozzio, A., Passegué, E., Ayton, P. M. et al.: Similar MLL-associated leukemias arising from self-renewing stem cells and short-lived myeloid progenitors. Genes & Dev., 2003, 17, s. 3029–3035.
77. Ober, C., Cox, N. J., Abney, M. et al.: Genome-wide search for asthma susceptibility loci in a founder population. Human Molecular Genetics, 1998, 7, s. 1393–1398.
78. Blumenthal, M. N., Langefeld, C. D., Barnes, K. C. et al.: A genome-wide search for quantitative trait loci contributing to variation in seasonal pollen reactivity. The Journal of Allergy and Clinical Immunology, 2006, 117, s. 79–85.
79. Bu, L. M., Bradley, M., Soderhall, C. et al.: Susceptibility loci for atopic dermatitis on chromosome 21 in a Swedish population. Allergy, 2006, 61, s. 617–621.
80. Brantl, S.: Antisense-RNA regulation and RNA interference. Biochim. Biophys. Acta, 2002, 1575, s. 15–25.
81. Kawakami, S., Hashida, M.: Targeted Delivery Systems of Small Interfering RNA by Systemic Administration. Drug Metabolism and Pharmacokinetics, 2007, 22, s. 142–151.
82. Lieberman, J., Song, E., Lee, S. K., Shankar, P.: Interfering with disease: opportunities and roadblocks to harnessing RNA interference. Trends Mol. Med., 2003, 9, s. 397–403.
83. Uprichard, S. L.: The therapeutic potential of RNA interference. FEBS Letters, 2005, 579, s. 5996–6007.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Diferenciální diagnostika refrakterní refluxní choroby jícnu
- Interferující ribonukleové kyseliny a molekulární patofyziologie vybraných onemocnění
- Pendredův syndrom u pacientů s hypotyreózou: genetická diagnostika, fenotypová variabilita a výskyt fenokopií
- Lenalidomid (Revlimid) v léčbě mnohočetného myelomu – první zkušenosti v České republice
- Zkušenosti s omezováním kouření tabáku ve světě
- Hostilita jako rizikový faktor řady onemocnění a možnosti jejího ovlivnění
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika refrakterní refluxní choroby jícnu
- Hostilita jako rizikový faktor řady onemocnění a možnosti jejího ovlivnění
- Lenalidomid (Revlimid) v léčbě mnohočetného myelomu – první zkušenosti v České republice
- Pendredův syndrom u pacientů s hypotyreózou: genetická diagnostika, fenotypová variabilita a výskyt fenokopií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

