-
Medical journals
- Career
Zapojení mikroRNA do patogeneze nádorových onemocnění a možnosti jejich využití v diagnostické a prediktivní onkologii
Authors: O. Slabý 1,3; D. Krekáč 1,3; R. Hrstka 1; M. Svoboda 2,3; R. Vyzula 2,3
Authors‘ workplace: Oddělení klinické a experimentální patologie, Masarykův onkologický ústav, Brno 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 2; LF MU, Brno 3
Published in: Čas. Lék. čes. 2008; 147: 25-31
Category: Review Article
Overview
MikroRNA (miRNA) tvoří velkou skupinu krátkých nekódujících RNA post-transkripčně regulujících genovou expresi. Schopnost miRNA inhibovat translaci onkogenů a nádorových supresorů dává předpoklad jejich zapojení do procesů kancerogeneze. Důkazů o funkcích miRNA v regulaci apoptózy, buněčné proliferace a diferenciace neustále přibývá. Zajímavá je rovněž skutečnost, že přibližně 50 % miRNA genů se nachází na fragilních částech chromozómů, jejichž ztráta nebo amplifikace je často detekována u nádorových onemocnění. Z tohoto pohledu jsou i nekódující miRNA nositelkami důležité genetické informace, jejíž regulace je narušena, nebo dochází k její ztrátě v průběhu nádorové transformace. Analýza expresních profilů miRNA je proto stále častěji využívána pro účely molekulární diagnostiky nádorových onemocnění, analogicky, jako je tomu u studií založených na DNA čipech a profilování kódujících transkriptů. Tato přehledová práce přináší základní poznatky o biogenezi a biologických funkcích miRNA a přehledně shrnuje dosavadní znalosti o významu miRNA nejen v oblasti nádorové biologie, ale také diagnostické a prediktivní onkologie.
Klíčová slova:
nádor, apoptóza, mikroRNA, profily genové exprese, predikce, prognóza.MikroRNA (miRNA) jsou nekódující jednořetězcové RNA o délce 18–25 nukleotidů tvořící nedávno objevenou skupinu regulátorů genové exprese vyskytující se jak v rostlinných, tak v živočišných buňkách.
V závislosti na míře komplementarity s cílovou kódující mRNA využívají miRNA dva rozdílné mechanizmy post-transkripční regulace genové exprese, které vedou buď k degradaci cílové mRNA, nebo k represi její translace a následně poklesu hladin jejího proteinového produktu. Možnou souvislost s onkogenním procesem naznačil již objev prvních miRNA. Funkční studie s lin-4 a let-7 u Caenorhabditis elegans a později s bantam miRNA u Drosophila melanogaster ukázaly zásadní roli miRNA v regulaci buněčné diferenciace a přechodů mezi jednotlivými vývojovými stadii těchto živočichů. Inaktivace lin-4 u C. elegans znemožnila přechod do dalšího vývojového stadia (1), zvýšená exprese bantam miRNA u D. melanogaster byla zase spojena se zvýšenou mírou buněčné proliferace a antiapoptotickým účinkem, které vedly k nadměrnému růstu křídel a oční tkáně (1). Funkční studie na modelových organizmech prokázaly zapojení nebo narušení funkce miRNA v souvislosti se základními vlastnostmi definujícími nádorovou buňku, jako jsou ztráta kontroly buněčné proliferace nebo alterace buněčné diferenciace.
Podle odhadu bioinformatiků jsou miRNA schopny regulovat až jednu třetinu lidských genů. Dnes již víme, že některé z těchto genů jsou také významné onkogeny či nádorové supresory (1, 2). Geny regulované pomocí miRNA jsou nejen součástí procesu onkogeneze, podílejí se také na nádorové invazivitě, diseminaci nebo lékové rezistenci (3). Bylo zavedeno množství metodik umožňujících detekovat jednotlivé miRNA či profily jejich exprese. Doposud byl nejpoužívanější metodou kvantifikace miRNA Northern blotting, čím dál tím častěji se ovšem setkáváme s postupy založenými na principu miRNA arrays (4, 5) a modifikované kvantitativní PCR v reálném čase (6, 7), vzácněji s postupy založenými na použití prostupujících fluorescenčních sond v nefrakcionovaných lyzátech (8) nebo průtokové cytometrie (9). miRNA již byly zkoumány v souvislosti s širokým spektrem nádorových onemocnění: kolorektálním karcinomem (10–13), mamárním karcinomem (14), plicním karcinomem (15, 16), karcinomem pankreatu (17), papilárním karcinomem štítné žlázy (PTC) (18), hepatocelulárním karcinomem (19), glioblastomem (20), neuroblastomem (21), testikulárním germinálním nádorem (22), chronickou lymfatickou leukémií (23, 24), Burkittovým lymfomem (25), Hodgkinovým lymfomem (26) a difuzním velkobuněčným B lymfomem (26, 27). Cílem této práce je popsat základní poznatky, jichž bylo dosaženo ve výzkumu funkce a mechanizmu účinku miRNA a přehledně shrnout výsledky získané studiem miRNA v základním a klinickém onkologickém výzkumu.
Biogeneze a biologická funkce miRNA
Biogeneze miRNA z prekurzorových molekul je dvoustupňový proces. Primární transkripty, pri-miRNA, jsou často dlouhé i několik kilobází a jsou dále v jádře zpracovávány RNázou III zvanou Drosha a dvouřetězcovou RNA vázajícím proteinem Pasha (Mikroprocesorový komplex) na přibližně 70 nukleotidů dlouhé pre-miRNA vytvářející nedokonalé vlásenkové struktury, které jsou exportovány do cytoplazmy transportérem nazývaným Exportin 5. Pre-miRNA jsou dále štěpeny RNázou III označovanou Dicer na finální miRNA duplexy dlouhé přibližně 22 bazí. Jedno z vláken miRNA duplexu se asociuje k multiproteinovému komplexu RISC (RNA – induced silencing complex) s centrální částí tvořenou proteiny rodiny Argonaute (AGO1, AGO2 aj.) a druhé vlákno je ihned degradováno. Komplex miRNA-RISC je pak schopen inhibovat translaci, případně degradovat cílové mRNA (1, 28).
Post-transkripční regulace miRNA je uskutečňována jedním ze dvou mechanizmů v závislosti na míře komplementarity miRNA s cílovou sekvencí. Při úplné nebo téměř úplné komplementaritě miRNA s cílovou sekvencí dochází k jevu označovanému jako RNA interference. Kódující mRNA jsou štěpeny ribonukleázami v multiproteinovém komplexu asociovaném s miRNA (RISC), dokud nejsou zcela degradovány. Živočišné miRNA obvykle využívají rozdílného mechanizmu, který není spojený s degradací cílové mRNA. Regulační účinek uskutečňují vazbou na nedokonale komplementární sekvence v rámci 3’ netranslatovaných oblastí (UTR) cílových mRNA, a expresi genů regulují post-transkripčně tím, že znemožňují jejich translaci. Druhý mechanizmus je proto doprovázen poklesem hladiny kódovaného proteinu, zatímco hladina cílové mRNA není ovlivněna (1). Biogeneze a biologické funkce miRNA jsou znázorněny na obrázku 1.
Image 1. Biogeneze a možné biologické funkce miRNA Primární transkripty miRNA genů, pri-miRNA, dlouhé i několik kilobází, jsou v jádře zpracovávány RNázou III zvanou Drosha a dvouřetězcovou RNA vázajícím proteinem Pasha na přibližně 70 nukleotidů dlouhé pre-miRNA. Pre-miRNA vytvářejí nedokonalé vlásenkové struktury, které jsou exportovány do cytoplazmy transportním proteinem nazývaným Exportin 5 a jsou dále štěpeny RNázou III označovanou Dicer na finální miRNA duplexy dlouhé přibližně 22 bazí. Zatímco jedno z vláken miRNA duplexu je zapojeno do inhibice translace případně degradace cílové mRNA, druhé vlákno je ihned odbouráno. Obrázek schématicky znázorňuje regulační funkci miRNA za fyziologických podmínek a při nádorové transformaci buňky, kdy může působit jako onkogen nebo nádorový supresor. 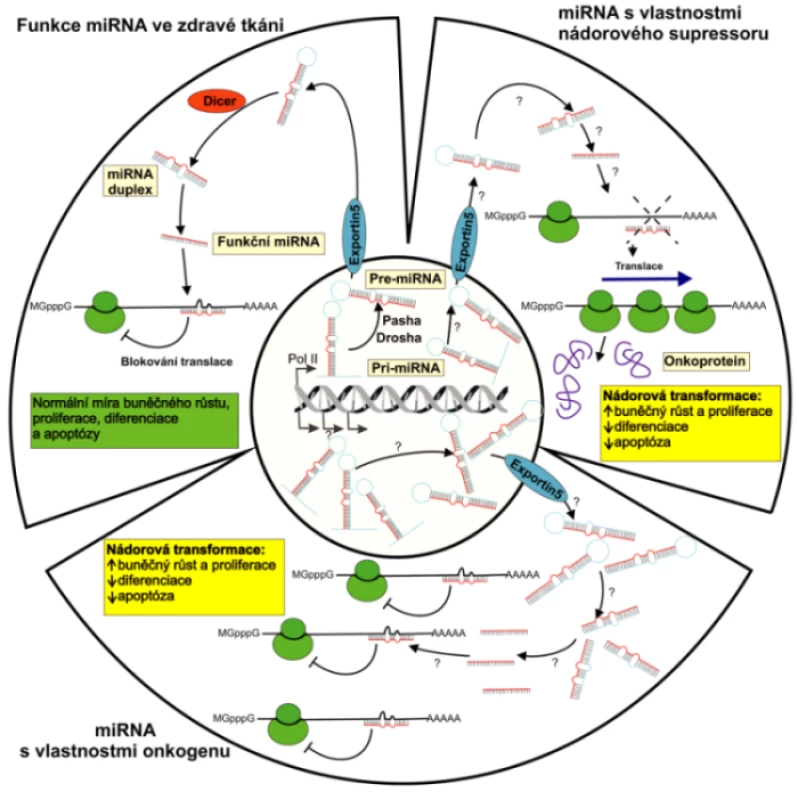
Schopnost miRNA vázat se k cílovým sekvencím i v případě nedokonalé komplementarity je důvodem velkého množství cílových mRNA pro každou jednotlivou miRNA. Na základě bioinformatických analýz tvoří geny kódující miRNA asi 3 % lidských genů a mají potenciál regulovat přibližně 30 % lidských genů (1). Do již existujících miRNA databází byly implementovány algoritmy schopné predikovat cílové mRNA pro danou miRNA a na základě termodynamických vlastností vznikajících duplexů a sekvenční konzervativnosti vazebné oblasti dané mRNA vyjádřit míru pravděpodobnosti jejich vzájemného regulačního vztahu (29, 30). K dnešnímu dni byla represe translace vybranými miRNA potvrzena funkčními studiemi pouze pro malou skupinu proteinů. Část těchto proteinů souvisí s procesem kancerogeneze a bude níže diskutována.
Zapojení miRNA do mechanizmů nádorové transformace
Úspěšné studie na buněčných kulturách a modelových organizmech potvrzující zapojení vybraných miRNA do procesů, jako jsou buněčná proliferace, diferenciace, buněčné přežívání a apoptóza (pro přehled 1, 3, 31), následovaly rovněž práce prováděné na klinickém materiálu (pro přehled 32). Výzkum miRNA v onkologickém výzkumu je v současné době velice progresivní oblastí a stále více důkazů nasvědčuje tomu, že nekódující miRNA jsou další úrovní vyjádření genetické informace, jejíž regulace je narušena, nebo došlo k její ztrátě v průběhu mnohastupňového kancerogenního procesu.
Přibližně 50 % miRNA genů se nachází na fragilních částech chromozómů, jejichž ztráta nebo amplifikace je často detekována u nádorových onemocnění (33). Typickým příkladem je delece oblasti 13q14 vyskytující se přibližně u poloviny případů chronických lymfatických leukémií (CLL), která nese mimo jiné geny kódující miR-15a a miR 16-1, jejichž snížené hladiny byly s CLL asociovány (23). Současně byl prokázán přímý regulační účinek těchto miRNA na hladinu antiapoptotického proteinu Bcl-2 (34), jehož význam v patogenezi CLL je znám. miR-15a a miR 16-1 jako negativní regulátory onkogenu BCL2 mají tedy vlastnosti nádorového supresoru. Tato skutečnost dokládá, že miRNA mohou mít funkci nejen onkogenu, ale i nádorového supresoru v závislosti na charakteru kódujících mRNA, které regulují (2). Dalším významným představitelem miRNA s funkcí nádorového supresoru je rodina miRNA označovaná jako let-7 negativně regulující onkogen RAS. Snížená exprese let-7 v nádorech vede ke zvýšeným hladinám onkogenu RAS a související ztrátě kontroly proliferace (35). Nádorově supresorové vlastnosti byly opakovaně pozorovány u miR-143 a miR-145, jejichž hladiny v nádorových buňkách jsou sníženy (10–13) a jejichž transfekce do vybraných buněčných linií odvozených od kolorektálního karcinomu signifikantně inhibovala jejich proliferaci. Tento antiproliferační efekt je realizován represí translace mitogenně aktivované protein kinázy ERK5, jejíž down-streamovou molekulou je mimo jiné také onkogen MYC (13).
Oproti tomu typickou miRNA s onkogenními vlastnostmi je miR-21. Antiapoptotické vlastností miR-21 byly poprvé popsány u glioblastomů a její mnohonásobně zvýšené hladiny byly následně pozorovány u celé skupiny nádorových onemocnění (11–13, 20). Transfekce anti-miR-21 do nádorových buněk MCF-7 má prokazatelný antiproliferační efekt a zvyšuje senzitivitu nádorových buněk k inhibitoru topoizomerázy I, topotecanu. Nádorové buňky MCF-7 ovlivněné anti-miR-21 vykazovaly významné snížení exprese proliferačního antigenu Ki-67 a po jejich vnesení do myší mamární žlázy průkazně docházelo k 50% snížení nádorového růstu oproti buňkám kontrolním (36).
Onkogenní vlastnosti jsou přičítány rovněž skupině miR 17-92, která je transkripčně přímo aktivována onkogenem MYC (37). Skupina miR-17-92 je tvořena šesti miRNA (miR-17-5p, miR-18a, miR-19a, miR-20a, miR-19b-1 miR 92-1), mezi jejichž cílové kódující mRNA patří nádorové supresory jako PTEN a TGFBR2, ale také transkripční faktor E2F1, který je rovněž aktivován onkogenem MYC a vytváří s ním pozitivní zpětnou vazbu. Předpokládá se, že bez modulace zpětnovazebné MYC-E2F1 smyčky skupinou miR-17-92 by mohlo dojít k její hyperaktivaci schopné indukovat apoptózu, a snižovat tak její onkogenní potenciál (37).
U onkogenní miR-155 se někdy můžeme setkat s označením BIC (B-cell integration cluster), případně BIC/miR-155. BIC byl původně identifikován u kuřat jako transkript odvozený od inzerčního místa retroviru u buněk lymfomů indukovaných virem ptačí leukózy, kde byl cestou přes onkogen MYC schopen akcelerovat tvorbu lymfomů (26). Teprve v nedávné době bylo zjištěno, že BIC je ve skutečnosti pri miR-155. Až stonásobně zvýšené hladiny miR-155 doprovází velkou skupinu lymfoidních malignit (Burkittova, Hodgkinova a difuzního velkobuněčného B-lymfocytárního lymfomu) a je v souvislosti s nimi také intenzivně zkoumána (25–27). Výše jmenované miRNA, ale i další příklady, jejich funkce a význam v nádorových onemocněních shrnuje tabulka 1. Možné zapojení diskutovaných miRNA do programované buněčné smrti je naznačeno na obrázku 2. V jedné z posledních prací zaměřených na výzkum miRNA publikované v časopise Nature, identifikoval He et al. (38) rodinu miRNA schopnou reflektovat status p53. Jsou to miR 34a až c, které jsou pod přímou transkripční kontrolou proteinu p53 a jejichž ektopická exprese je schopná indukovat zastavení buněčného cyklu v primárních i nádorových buněčných liniích. Zdá se tedy, že miR-34a až c jsou zapojeny do apoptotické dráhy spojené s proteinem p53 (38).
Table 1. Přehled nejstudovanějších miRNA s onkogenní nebo nádorově supresorovou funkcí 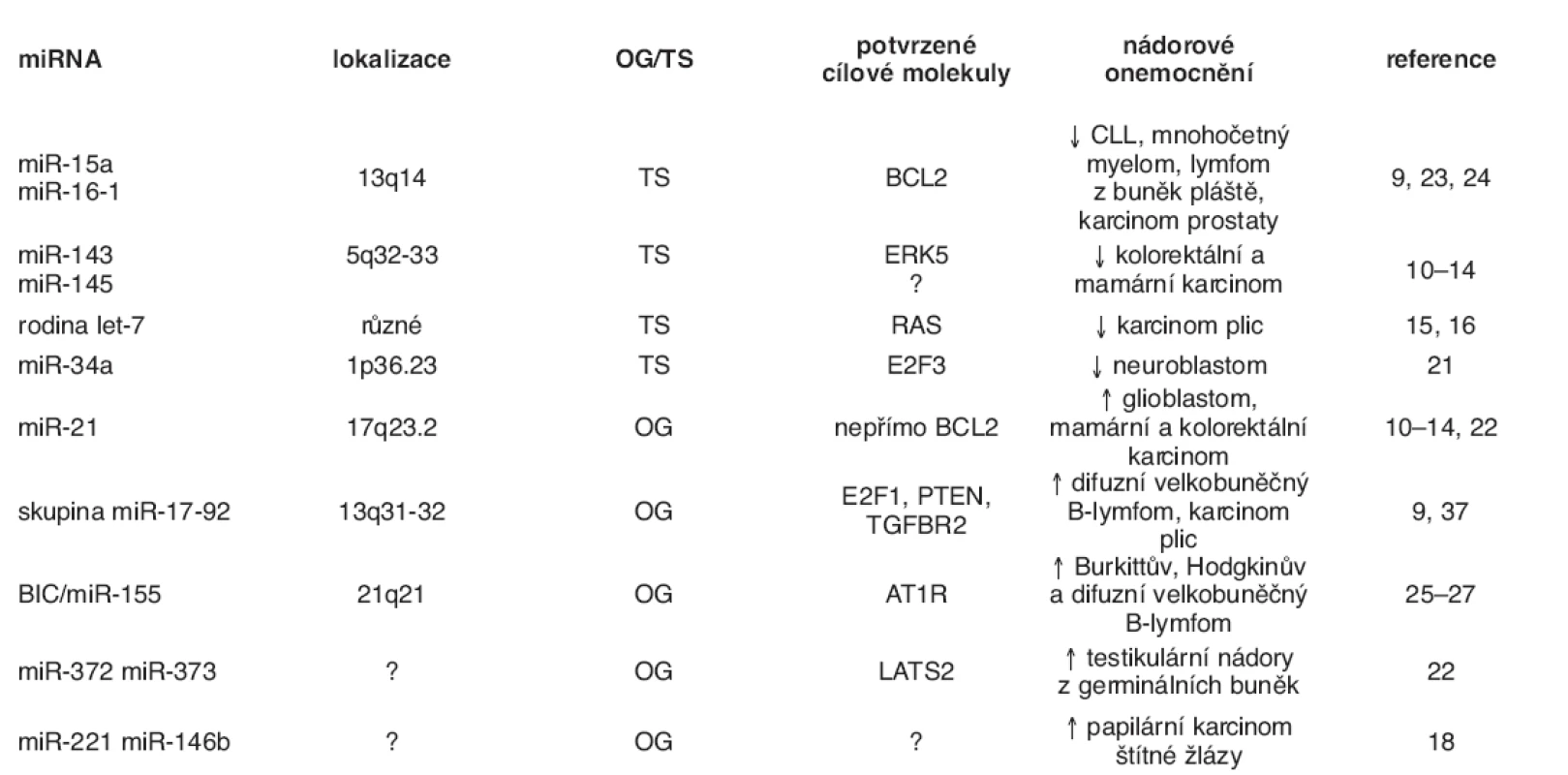
↑↓ – zvýšená resp. snížená hladina dané miRNA v nádorové tkáni oproti příslušné nenádorové tkáni či buňkám, OG – onkogen, TS – tumor supresorový gen, CLL – chronická lymfocytární leukémie, ERK5 – extracelulárním signálem regulovaná kináza 5, PTEN – fosfatázový a tenzinový homolog, TGBFR2 – receptor typ 2 pro transformující růstový faktor, AT1R – receptor typ 1 pro angiotenzin II, LATS2 – large tumor supressor homolog 2 (inhibitor cyklin-dependentní kinázy 2) Image 2. Zapojení vybraných miRNA do typických signálních apoptotických drah Apoptóza může být aktivována dvěmi hlavními cestami: 1) přes receptory smrti, neboli apoptóza vyvolaná tzv. vnějšími signály, kdy je nejdříve aktivována kaspáza-8 a následuje postupná aktivace dalších kaspáz, které provedou proteolýzu buněčných struktur. V těchto drahách hraje důležitou roli jako negativní regulátor miR-21; 2) apoptóza vyvolaná vnitřními signály, neboli mitochondiální cesta, kdy v buňce vznikají pomocí mitochondiálních faktorů, cytochromu-c, kaspáz a ATP tzv. apoptozómy, které se agregují v cytosolu a jsou postupně proteolyticky rozloženy kaspázami. Zde se uplatňují především miR-15, miR-16 a rodina miR-34a až c. 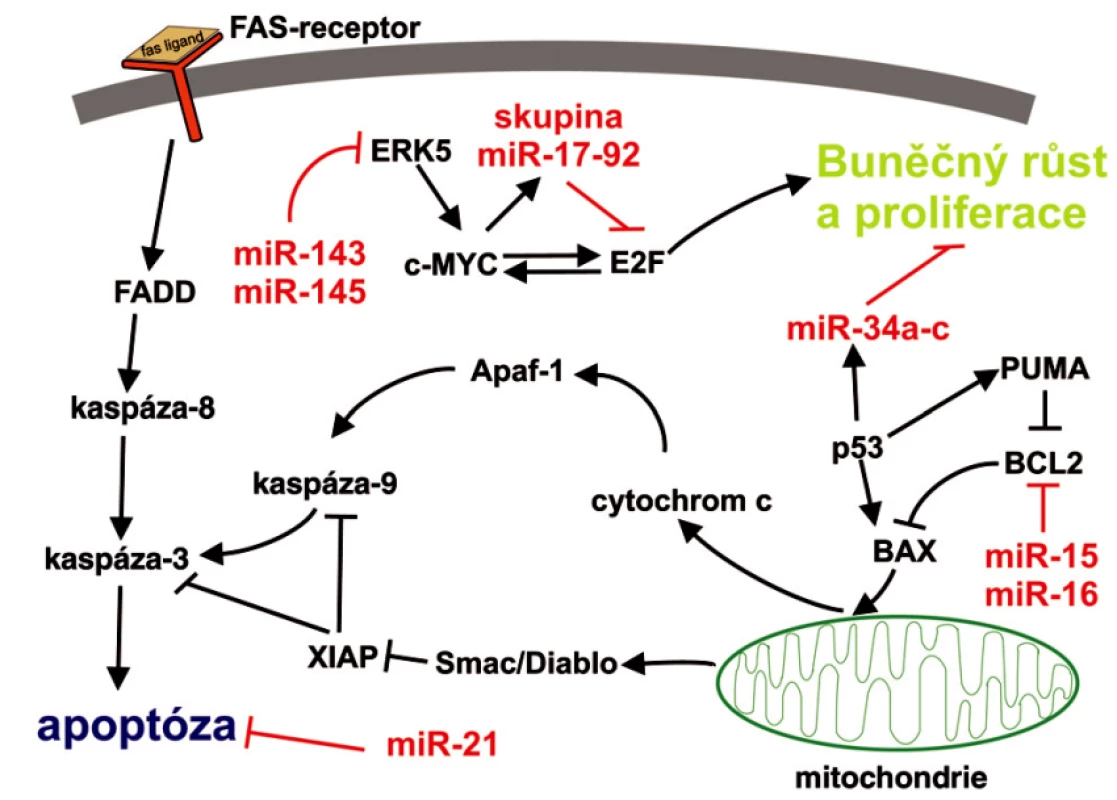
Dalším z možných mechanizmů zapojení miRNA do onkogeneze může být uskutečňován cestou onkogenních virů. Poprvé byly virové miRNA identifikovány u viru Epstein-Barrové, následoval virus Kaposiho sarkomu, Simian virus SV40 a další. Virové miRNA mohou fungovat jak v režimu cis, kdy regulují expresi vlastního genomu, nebo režimu trans, kdy regulují translaci hostitelových transkriptů (39). Systém miRNA tedy představuje možný mechanizmus transformačního účinku onkogenních virů v savčích buňkách.
Pro plný rozvoj nádorového onemocnění jsou kromě narušené regulace buněčné proliferace a apoptózy nutné i alterace v dalších biologických procesech, jako jsou novotvorba cév, invazivita a schopnost metastazování. Podle bioinformatických analýz jsou miRNA schopné post-transkripčně regulovat mRNA kódující vybrané adhezivní molekuly, složky extracelulární matrix, některé metalloproteinázy, molekuly indukované hypoxií, a jiné angiogenní faktory a molekuly související s nádorovou invazivitou a diseminací, některé z nich již byly i experimentálně ověřeny (pro přehled 3).
Expresní profily miRNA specifické pro nádorová onemocnění
Speciálně vyvinuté vysoceúčinné technologie umožnily z množství klinického materiálu získat charakteristické expresní profily miRNA pro různé typy nádorových onemocnění. Například v oblasti výzkumu kolorektálního karcinomu (CRC) byly provedeny čtyři nezávislé studie sledující rozdílné expresní profily v nádorové tkáni případně nádorových buněčných liniích a přiléhající nenádorové sliznici (10–13).
Přestože všechny tři práce byly založeny na rozdílných technologických platformách, dospěli jejich autoři k dobře srovnatelným výsledkům. V první studii z roku 2003 byly u šestnácti pacientů srovnávány hladiny 283 miRNA v nádorové tkáni CRC a její korespondující zdravé sliznici. Prokazatelně docházelo ke globálnímu snížení exprese miRNA v nádorové tkáni, signifikantní redukci exprese v karcinomech vykazovaly především miR-143 a miR-145 (10). Cummins et al. (11) použila varianty metodiky sériové analýzy genové exprese (SAGE) pro miRNA (miRAGE) a identifikovala 50 rozdílně exprimovaných miRNA v kolorektální nádorové tkáni. Z těchto miRNA mělo 32 sníženou expresi, součástí této skupiny byly rovněž miR-143 a miR-145. Studie provedená Bandresem et al. (12) založená na detekci 156 miRNA přesnou metodou Real-Time PCR potvrdila předchozí pozorování popisující statisticky významné snížení exprese miR-143 a miR-145, ale identifikovala rovněž zvýšení exprese miR-21 v CRC nádorové tkáni (12).
Ačkoliv není pochyb o tom, že u nádorových buněk dochází k signifikantním změnám v expresních profilech miRNA, není v současnosti zřejmé, zda jsou tyto změny příčinnou nebo následkem nádorové transformace. I přes všechny ne zcela objasněné biologické souvislosti mohou expresní profily miRNA účinně sloužit k diagnostickým a prognostickým účelům. Například u akutní lymfoblastické leukémie (ALL) lze pomocí profilů miRNA rozlišit podskupiny pacientů s rozdílnými molekulárně-patologickými znaky (BCR/ABL-pozitivní vzorky, T-ALL, vzorky s chromozomální translokací postihující mixed-lineage leukemia (MLL) gen a další) (9). Tato práce ukazuje potenciál miRNA profilů dále členit nádorové onemocnění podle rozdílných mechanizmů kancerogeneze, jako je tomu u molekulárně taxonomických přístupů založených na DNA čipech a profilech genové exprese.
Za účelem diagnostiky nádorů neznámého původu byl vyvinut rovněž klasifikační systém vycházející z exprese 217 miRNA a byl testován na souboru 17 málo diferencovaných nádorových vzorků bez jednoznačného histologického nálezu (9). Tento klasifikační systém umožnil správnou diagnózu s daleko větší přesností (12 ze 17 správně) než klasifikace založená na expresi vybrané skupiny genů (1 ze 12 správně), kterou vytvořil Ramaswamy et al. na základě výsledků DNA čipových analýz (40). Vysoká informativní hodnota miRNA klasifikačního systému je o to překvapivější, že je založena pouze na malém počtu miRNA (~200), ve srovnání s počtem transkriptů, se kterými se pracuje u DNA čipových studií (~20 000). Pravděpodobně je to dáno centrální úlohou miRNA ve vývoji a schopnosti každé miRNA regulovat desítky cílových genů. Byla proto naznačena hypotéza, že výrazně nižší informativní potenciál exprese mRNA je dán skutečnosti, že pouze relativně malé množství kódujících transkriptů jsou regulační molekuly.
Význam miRNA v diagnostické a prediktivní onkologii
Z mnoha poznatků, kterých bylo během posledních několika let v oblasti výzkumu miRNA dosaženo, je zřejmé, že miRNA hrají zásadní úlohu v procesu nádorové transformace a mohly by proto být použitelné rovněž k účelům diagnostické a prediktivní onkologie. Množství prací potvrzujících využitelnost vybraných miRNA či jejich profilů ke stanovení přesné diagnózy a prognózy nádorových onemocnění také rychle narůstá (32). Za zmínku stojí jistě skutečnost, že z hlediska klinických studií mají miRNA značnou výhodu oproti mRNA, vzhledem k tomu že zůstávají intaktní i ve formalinem fixovaném materiálu uloženém v parafinových blocích, čímž zpřístupňují obsáhlé archivy na ústavech patologie, a umožňují tak rozsáhlé retrospektivní studie.
Doposud nejblíže se k pacientovu lůžku přiblížil kolektiv Calina a Croce, který se zabývá výzkumem CLL. Na souboru 94 pacientů s CLL, u kterých byly stanoveny známé prognostické markery, jako je hladina proteinu ZAP-70 (mj. jedná se o jeden z největších přínosů technologie DNA čipů v oblasti prediktivní onkologie leukémii) nebo mutační status variabilní části těžkého řetězce imunoglobulinů (IgVH) a současně časový interval od diagnózy do zahájení léčby, identifikovali skupinu 13 miRNA (ze 190 analyzovaných), která umožnila pacienty rozdělit do skupin z hlediska prognózy. Zatímco pacienti s nízkou hladinou proteinu ZAP-70 a mutovaným IgVH mají obvykle příznivější průběh onemocnění, vysoké hladiny ZAP-70 a wild-type IgVH jsou spojeny s agresivní formou CLL. Tyto dvě skupiny pacientů byla sada 13 miRNA schopná jednoznačně rozlišit a navíc umožňovala rozlišit pacienty s dlouhým a krátkým intervalem od diagnózy do zahájení léčby (24). Zda je tato sada miRNA nezávislým prediktivním faktorem bude teprve ověřeno.
U difuzního velkobuněčného B-lymfomu (DLBCL) byly nezávislými studiemi potvrzeny až stonásobně zvýšené hladiny BIC/mir-155 u pacientů se špatnou prognózou (DLBCL s fenotypem aktivovaných B-lymfocytů) oproti pacientům s příznivější prognózou (DLBCL s fenotypem buněk germinálního centra) (26, 27).
Takamizawa et al. (15) stanovil na souboru 143 pacientů s karcinomem plic hladiny pěti členů let-7 rodiny miRNA, které umožňovaly ve shlukovací analýze rozdělit pacienty do dvou skupin. Část pacientů, která vykazovala sníženou expresí rodiny let-7, měla po kurativním chirurgickém zákroku kratší dobu přežití než pacienti s vyššími hladinami let-7 (p = 0,0003). Hladiny let-7 byly schopné predikovat délku přežití s vyšší statistickou významností než věk, histologický nález a kuřácká minulost (15). Tyto výsledky byly potvrzeny nezávislou studii Yanaihary et al. (16), který navíc jako další prognostický marker plicního karcinomu identifikoval BIC/miR-155.
Potenciálně přínosné pro diagnostiku nádorových onemocnění mohou být i výsledky studií provedených na vzorcích papilárního karcinomu štítné žlázy (PTC) (18), mammárního (14) a kolorektálního karcinomu. Na souboru 20 vzorku PTC a 6 vzorcích ze zdravé štítné žlázy byla identifikována sada 5 miRNA, která byla schopná odlišit nádorovou od zdravé tkáně. Jako miRNA s nejvíce až dvacetinásobně zvýšenými hladinami v nádorové tkáni byly identifikovány miR-221, miR-222 a miR-146b. Zvýšené hladiny miR-221 byly pozorovány rovněž v nenádorové, k nádoru přilehající tkáni, což naznačuje její funkci v počátečních událostech kancerogeneze (18). U mammárního karcinomu byly identifikovány specifické miRNA profily schopné nejen rozlišit nádorovou tkáň od zdravého epitelu, ale také rozličné klinicko-patologické charakteristiky, jako je status progesteronových a estrogenových receptorů (rodina miR-30), stadium nádorového onemocnění (miR-213 a miR-203), angioinvazivita a proliferační index (14). V naší laboratoři se zabýváme výzkumem zapojení vybraných miRNA do patogeneze CRC. Dle našich předběžných výsledků miR-21 silně pozitivně koreluje s klinickým stádiem onemocnění, oproti tomu hladiny miR-143 a miR-145 jsou v nádorové tkání snížené a negativně korelují s velikostí nádorů. V současné době provádíme funkční studie na tkáňových kulturách CRC a ověřujeme předpokládané regulační účinky miR-21, miR-143 a miR-145 na vybrané mRNA na proteinové úrovni a jejich vliv na proliferaci nádorových buněk a jejich senzitizaci k panelu vybraných cytostatik.
Závěr
Výzkum miRNA je v současnosti jednou z nejrychleji se rozvíjejících oblastí molekulární onkologie. Je známo několik úrovní a mechanizmů, kterými se miRNA podílí na regulaci biologických procesů jako buněčná proliferace, diferenciace, přežívání a apoptóza. Neustále také přibývá potvrzených cílových molekul (RAS, BCL2, ERK5, E2F1) regulovaných pomocí miRNA. Studium expresních profilů miRNA, ačkoliv je z hlediska klinického výzkumu stále ve svých počátcích, dnes umožňuje další stupeň molekulární klasifikace celé řady nádorových onemocnění, u některých dokonce zdokonalit stanovení jejich prognózy, případně včasnou detekci. I když jsou miRNA již samozřejmou součástí nádorové biologie, k úplnému pochopení jejich zapojení do procesu nádorové transformace zbývá zodpovědět ještě řadu otázek. Kde a kdy přesně jsou jaké miRNA exprimovány a jaké mají cíle? Jak se mění sady jejich cílových mRNA za rozdílných podmínek? Jaké transkripční faktory regulují expresi miRNA? Dokud nebudeme znát odpovědi na tyto otázky, budou pro nás miRNA zahaleny závojem tajemství, který, doufejme, bude dostatečnou motivací, aby vývoj v této opravdu zajímavé oblasti molekulární biologie pokračoval stejným tempem jako doposud.
Zkratky
ALL – akutní lymfoblastická leukémie
CLL – chronická lymfatická leukémie
CRC – kolorektální karcinom
DLBCL – difuzní velkobuněčný B-lymfom
mRNA – informační (messenger) RNA
miRNA – mikro RNA
MLL – mixed-lineage leukemia
PTC – papilární karcinom štítné žlázy
RISC – multiproteinový komplex asociovaný s miRNA
RNA – induced silencing complex
SAGE – sériová analýza genové exprese
UTR – netranslatovaná oblast
Práce byla podpořena granty IGA MZ ČR NR/9076-4 a MZ0MOU2005.
Sources
1. Esquela-Kerscher, A., Slack, F. J.: Oncomirs – microRNAs with a role in cancer. Nat. Rev. Cancer, 2006, 6, s. 259–269.
2. Kent, O. A., Mendell, J. T.: A small piece in the cancer puzzle: microRNAs as tumor suppressors and oncogenes. Oncogene, 2006, 25, s. 6188–6196.
3. Dalmay, T., Edwards, D. R.: MicroRNAs and the hallmarks of cancer. Oncogene, 2006, 25, s. 6170–6175.
4. Liu, C. G., Calin, G. A., Meloon, B. et al.: An oligonucleotide microchip for genome-wide microRNA profiling in human and mouse tissues. Proc. Natl. Acad. Sci. USA, 2004, 101, s. 9740–9744.
5. Lim, L. P., Lau, N. C., Garrett-Engele, P. et al.: Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs. Nature, 2005, 433, s. 769–773.
6. Chen, C., Ridzon, D. A., Broomer, A. J. et al.: Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res., 2005, 33, s. e179.
7. Lao, K., Xu, N. L., Yeung, V. et al.: Multiplexing RT-PCR for the detection of multiple miRNA species in small samples. Biochem. Biophys. Res. Commun., 2006, 343, s. 85–89.
8. Allawi, H. T., Dahlberg, J. E., Olson, S. et al.: Quantitation of microRNAs using a modified Invader assay. Rna, 2004, 10, s. 1153–1161.
9. Lu, J., Getz, G., Miska, E. A. et al.: MicroRNA expression profiles classify human cancers. Nature, 2005, 435, s. 834–838.
10. Michael, M. Z., Sm, O. C., van Holst Pellekaan, N. G. et al.: Reduced accumulation of specific microRNAs in colorectal neoplasia. Mol. Cancer. Res., 2003, 1, s. 882–891.
11. Cummins, J. M., He, Y., Leary, R. J. et al.: The colorectal microRNAome. Proc. Natl. Acad. Sci. USA, 2005, 103, s. 3687–3692.
12. Bandres, E., Cubedo, E., Agirre, X. et al.: Identification by Real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues. Mol. Cancer, 2006, 5, s. 29.
13. Akao, Y., Nakagawa, Y., Naoe, T.: MicroRNAs 143 and 145 are possible common onco-microRNAs in human cancers. Oncol. Rep., 2006, 16, s. 845–850.
14. Iorio, M. V., Ferracin, M., Liu, C. G. et al.: MicroRNA gene expression deregulation in human breast cancer. Cancer Res., 2005, 65, s. 7065–7070.
15. Takamizawa, J., Konishi, H., Yanagisawa, K. et al.: Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival. Cancer Res., 2004, 64, s. 3753–3756.
16. Yanaihara, N., Caplen, N., Bowman, E. et al.: Unique microRNA molecular profiles in lung cancer diagnosis and prognosis. Cancer Cell, 2006, 9, s. 189–198.
17. Lee, E. J., Gusev, Y., Jiang, J. et al.: Expression profiling identifies microRNA signature in pancreatic cancer. Int. J. Cancer, 2007, 120, s. 1046–1054.
18. He, H., Jazdzewski, K., Li, W. et al.: The role of microRNA genes in papillary thyroid carcinoma. Proc. Natl. Acad. Sci. USA, 2005, 102, s. 19075–19080.
19. Murakami, Y., Yasuda, T., Saigo, K. et al.: Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues. Oncogene, 2006, 25, s. 2537–2545.
20. Chan, J. A., Krichevsky, A. M., Kosik, K. S.: MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells. Cancer Res., 2005, 65, s. 6029–6033.
21. Welch C., Chen Y., Stallings R. L. MicroRNA–34a functions as a potential tumor suppressor by inducing apoptosis in neuroblastoma cells. Oncogene, 2007, 26, s. 5017–5022.
22. Voorhoeve P. M., le Sage C., Schrier M.et al.: A genetic screen implicates miRNA-372 and miRNA-373 as oncogenes in testicular germ cell tumors. Cell, 2006, 124, s. 1169–1181.
23. Calin, G. A., Dumitru, C. D., Shimizu, M. et al.: Frequent deletions and down–regulation of micro - RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc. Natl. Acad. Sci. USA, 2002, 99, s. 15524–15529.
24. Calin, G. A., Ferracin, M., Cimmino, A. et al.: A MicroRNA signature associated with prognosis and progression in chronic lymphocytic leukemia. N. Engl. J. Med., 2005, 353, s. 1793–1801.
25. Kluiver, J., Haralambieva, E., de Jong, D. et al.: Lack of BIC and microRNA miR-155 expression in primary cases of Burkitt lymphoma. Genes Chromosomes Cancer, 2006, 45, s. 147–153.
26. Kluiver, J., Poppema, S., de Jong, D. et al.: BIC and miR-155 are highly expressed in Hodgkin, primary mediastinal and diffuse large B cell lymphomas. J. Pathol., 2005, 207, s. 243–249.
27. Eis, P. S., Tam, W., Sun, L. et al.: Accumulation of miR-155 and BIC RNA in human B cell lymphomas. Proc. Natl. Acad. Sci. USA, 2005, 102, s. 3627–3632.
28. Gregory, R. I., Shiekhattar, R.: MicroRNA biogenesis and cancer. Cancer Res., 2005, 65, s. 3509–3512.
29. Lewis, B. P., Shih, I. H., Jones-Rhoades, M. W. et al.: Prediction of mammalian microRNA targets. Cell, 2003, 115, s. 787–798.
30. Griffiths-Jones, S.: miRBase: the microRNA sequence database. Methods Mol. Biol., 2006, 342, s. 129–138.
31. Jovanovic, M., Hengartner, M. O.: miRNAs and apoptosis: RNAs to die for. Oncogene, 2006, 25, s. 6176–6187.
32. Cummins, J. M., Velculescu, V. E.: Implications of micro-RNA profiling for cancer diagnosis. Oncogene, 2006, 25, s. 6220–6227.
33. Calin, G. A., Sevignani, C., Dumitru, C. D. et al.: Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers. Proc. Natl. Acad. Sci. USA, 2004, 101, s. 2999–3004.
34. Cimmino, A., Calin, G. A., Fabbri, M. et al.: miR-15 and miR-16 induce apoptosis by targeting BCL2. Proc. Natl. Acad. Sci. USA, 2005, 102, s. 13944–13949.
35. Johnson, S. M., Grosshans, H., Shingara, J. et al.: RAS is regulated by the let-7 microRNA family. Cell, 2005, 120, s. 635–647.
36. Si, M. L., Zhu, S., Wu, H. et al.: miR-21-mediated tumor growth. Oncogene, 2007, 26, s. 2799–2803.
37. Dews, M., Homayouni, A., Yu, D. et al.: Augmentation of tumor angiogenesis by a Myc–activated microRNA cluster. Nat. Genet., 2006, 38, s. 1060–1065.
38. He, L., He, X., Lim, L. P. et al.: A microRNA component of the p53 tumour suppressor network. Nature, 2007, 447, s. 1130–1134.
39. Pfeffer, S., Voinnet, O.: Viruses, microRNAs and cancer. Oncogene, 2006, 25, s. 6211–6219.
40. Ramaswamy, S., Tamayo, P., Rifkin, R. et al.: Multiclass cancer diagnosis using tumor gene expression signatures. Proc. Natl. Acad. Sci. USA, 2001, 98, s. 15149–15154.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Předoperační příprava a vyšetření pacienta před plánovaným kardiochirurgickým výkonem
- Výpověď biochemických markerů remodelace kosti při nádorovém postižení skeletu
- Esenciálna hypertenzia ako syndróm alebo kompenzačný mechanizmus?
- Zapojení mikroRNA do patogeneze nádorových onemocnění a možnosti jejich využití v diagnostické a prediktivní onkologii
- Vliv nízkokalorické diety na sérové koncentrace a expresi cytoadhezivních molekul v tukové tkáni u obézních žen
- Cyklosporín A verzus cyklofosfamid v liečbe detí s nefrotickým syndrómom
- Psychomotorické tempo a rychlost vyhledávání v sémantické paměti
- Migrační tendence u českých lékařů
- Politická korektnost a myšlení lékařů
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Esenciálna hypertenzia ako syndróm alebo kompenzačný mechanizmus?
- Předoperační příprava a vyšetření pacienta před plánovaným kardiochirurgickým výkonem
- Psychomotorické tempo a rychlost vyhledávání v sémantické paměti
- Výpověď biochemických markerů remodelace kosti při nádorovém postižení skeletu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

