-
Medical journals
- Career
Specifika diagnostiky a léčby multimorbidních pacientů
Authors: Zdeněk Monhart 1,2
Authors‘ workplace: Interní oddělení a urgentní příjem, Nemocnice Znojmo 1; Lékařská fakulta Masarykovy Univerzity, Brno 2
Published in: Vnitř Lék 2023; 69(3): 173-180
Category: Main Topic
doi: https://doi.org/10.36290/vnl.2023.030Overview
To, v čem jsme jako internisté jedineční, je schopnost postarat se komplexně o pacienty, kteří nestonají pouze s jednou nemocí, ale mají onemocnění více, zpravidla celou řadu. Tato kompetence je podstatou našeho oboru bez ohledu na to, zda pracujeme v nemocnicích nebo v ambulancích. Definice internisty je podle české Wikipedie následující: „Internisté jsou kvalifikováni k tomu, aby řešili obtížné diagnostické problémy a léčili závažná chronická onemocnění včetně situací, kdy se projeví několik různých chorob najednou“. Mezi základní dovednosti internisty musí patřit schopnost identifikovat multimorbidního nemocného a následně používat vhodné diagnostické, a především léčebné postupy. Ty musí zohledňovat komplexnost zdravotních problémů pacienta, tedy kromě přítomnosti dalších diagnóz a stavu pacienta především složení a rozsah užívané medikace. Multimorbidita je kromě snížené kvality života a vyšší mortality charakteristická také větším počtem aplikovaných léčebných postupů – v podmínkách interní medicíny především polyfarmakoterapií. Z toho plyne vyšší riziko lékových interakcí jak při chronické léčbě, tak v akutních situacích. Kromě možných lékových interakcí je potřeba znát zásady bezpečné farmakoterapie, vědět, které léky bychom měli preferovat, a kterým se vyhnout. Při rozhodování nám mohou pomoci ověřené nástroje pro výběr vhodné medikace, jako je například START/STOPP systém. Průběžně je také nutné posuzovat, zda všechny dosud předepisované léky jsou stále nezbytně nutné, a v oprávněných případech zvažovat redukci podávané medikace.
Klíčová slova:
deprescribing – multimorbidita – polypragmazie
Specifika diagnostiky u multimorbidních pacientů
Diagnostika jednotlivých onemocnění u pacientů s multimorbiditou může být ovlivněna více faktory. V principu samozřejmě vychází ze standardních diagnostických postupů a diagnostických kritérií jednotlivých onemocnění. U multimorbidních nemocných nemusí být ale vše tak jednoduché, protože současná přítomnost jednoho onemocnění může ovlivňovat charakter příznaků onemocnění jiného – například bezbolestná ischemie myokardu u diabetiků. Navíc je řada z nich v kategorii geriatrických pacientů, kteří zvláště často stonají s nevýraznými či atypickými příznaky ve srovnání s mladší populací (1). Tento aspekt neplatí samozřejmě pouze pro kardiovaskulární onemocnění. A nejen u akutních stavů vídáme u polymorbidních pacientů vyššího věku atypické průběhy nebo nevýrazné symptomatologie. Komě nespecificky vyjádřených příznaků např. u náhlých příhod břišních nebo u infekčních onemocnění se jedná také o chroničtější stavy, jako je anémie, hypotyreóza apod. Při diagnostickém procesu dále musíme mít na paměti pravděpodobnost výskytu určitých diagnóz v konkrétních věkových skupinách a aktivně po nich pátrat, i když pacient nemá žádné symptomy daného onemocnění. V rámci kardiovaskulárních onemocnění je takovým případem fibrilace síní, kde je doporučen aktivní screening u osob starších 65 let (2). Další zásadou diagnostiky u multimorbidních pacientů je skutečnost, že se jednotlivé choroby mohou navzájem kauzálně podmiňovat. Po chorobách logicky souvisejících bychom tedy měli cíleně pátrat a přítomnost již známých diagnóz nás tedy vede k suspekci na související a společně se vyskytující onemocnění. U pacienta s diabetem, hypertenzí a dyslipidemií budeme samozřejmě uvažovat o onemocnění koronárních tepen, i když byl dosud bez příznaků. U pacienta se známým chronickým koronárním syndromem budeme myslet také na možné projevy aterosklerózy v jiných lokalitách, které mohou být dosud klinicky němé. Případný nález stenóz magistrálních mozkových tepen či starších ischemických ložisek na CT či MR mozku bude představovat nejen další diagnózu, ale může mít také další diagnosticke, a především terapeutické konsekvence, které mohou pozitivně ovlivnit prognózu pacienta. V takovém případě budeme pátrat po přítomnosti rizikových faktorů aterosklerózy a vylučovat paroxyzmální fibrilací síní. A v rámci rozvahy nad vzájemnými interakcemi jednotlivých onemocnění musíme také myslet na možnost ovlivnění některých parametrů (krevní tlak, glykemie) léčbou jiných onemocnění (například kortikosteroidy). Dalším specifickým aspektem v diagnostice multimorbidity je skutečnost, že bychom se neměli soustředit pouze na somatické příznaky a onemocnění. Především u pacientů ve vyšším věku (ale nejen u nich) se setkáváme s mentálními problémy, jako jsou demence, deprese, deliria apod. (3, 4). Na multimorbiditě se podle současného chápání rozhodně podílejí také komplexní problémy, jako je stařecká křehkost, přítomnost chronické bolesti různé etiologie, smyslové omezení (problémy se zrakem a sluchem) a dále také užívání alkoholu nebo jiných návykových látek.
Diagnostika multimorbidity a hodnocení její závažnosti
Multimorbiditu diagnostikujeme u naprosté většiny nemocných, kteří jsou v dispenzární péči internistů, pokud použijeme definici přítomnosti 2 nebo více chronických souběžně přítomných onemocnění u jednoho jedince buď bez příčinné souvislosti, nebo chorob navzájem se kauzálně podmiňujících (5). Současně by měla platit podmínka, že žádnou z koexistujících nemocí nelze definovat jako ústřední vůči ostatním. Pro stanovení multimorbidity jako takové u daného pacienta můžeme samozřejmě použít prostý výčet onemocnění, která u něj diagnostikujeme, nebo která zjistíme z jeho dokumentace. K jednoznačné diagnostice, resp. zhodnocení závažnosti a prognostického dopadu multimorbidity pak lze použít řadu mezinárodně uznávaných skórovacích systémů (6). Tyto škály jsou založeny buď na počtu (a závažnosti) přítomných diagnóz u daného pacienta, nebo na počtu užívaných léků. Pro použití těchto skórovacích systémů mají zdravotníci zpravidla k dispozici záznamy pacienta, ze kterých je možno čerpat výčet vyskytujících se diagnóz a jejich intenzitu, nutnost farmakoterapie apod. Dosud využívané indexy mohou být také využity k odhadu vlivu multimorbidity na osud pacienta a také na odhad potřeb využití zdravotní péče v budoucnu (7). Jako příklad jsou následně uvedeny některé z nich.
Kaplan-Feinstein index (KFI) byl poprvé publikován jako systém hodnotící prognostický vliv současně přítomných komorbidit na mortalitu pacientů s diabetem mellitem. Tento systém byl primárně navržen jako prospektivně využitelná metoda na odhad rizika mortality způsobené komorbiditami využitelná v longitudinálních studiích (8) (Obr. 1).
Image 1. Kaplan-Feinstein Index 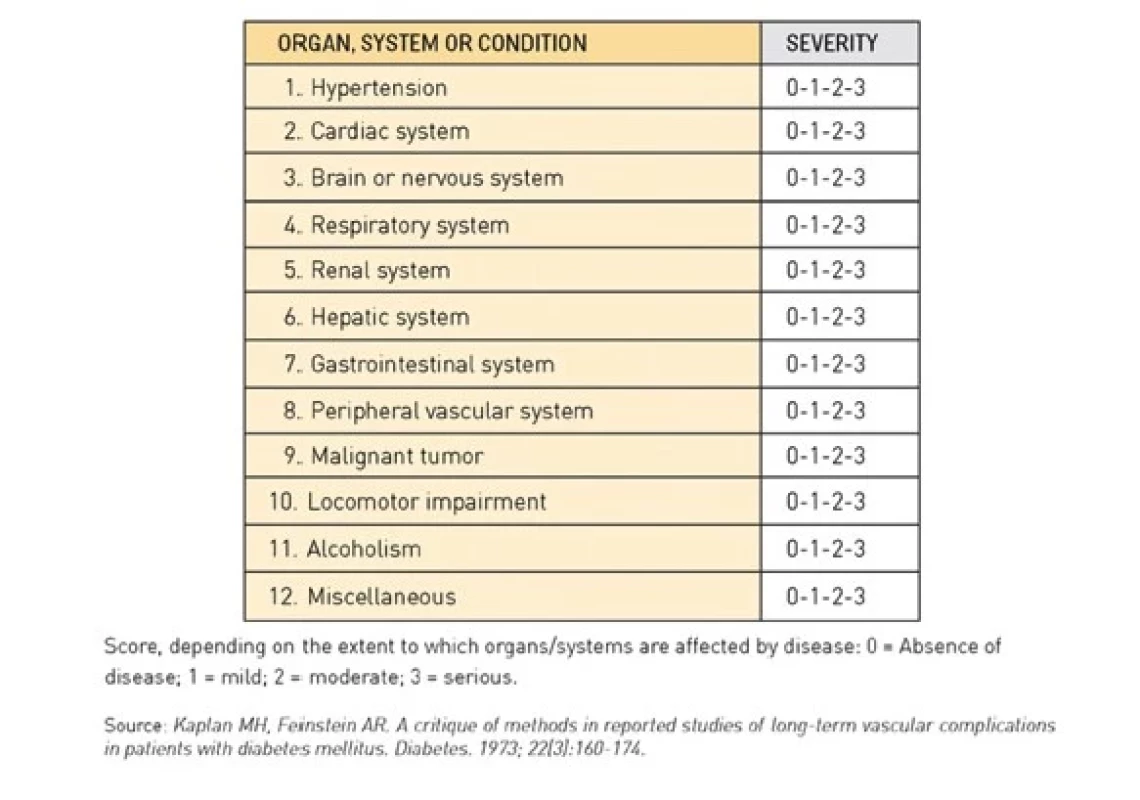
Charlson comorbidity index (CCI) zahrnuje 19 různých komorbidit a sleduje stupně jejich závažnosti. Také tento skórovací systém je validován jako prediktor mortality v závislosti na počtu a tíži přítomných komorbidit (9).
Cumulative Index Illness Rating Scale (CIRS) hodnotí přítomnost onemocnění 14 orgánových systémů a jejich intenzitu. Stejně jako předchozí byl validován jako prediktor mortality v závislosti na počtu a tíži přítomných komorbidit (10).
Jistou výhradou k především nejstarším výše uvedeným skórovacím systémům může být, že jejich škály zpravidla neobsahují „měkké diagnózy“ – tedy především stařeckou křehkost, a také nezahrnují sociální problematiku pacienta (míru sociální deprivace).
Predicting Emergency Admissions Over the Next Year (PEONY) je prognostický nástroj, který hodnotí riziko neplánované hospitalizace pacientů s multimorbiditou. Podle tohoto skóre patří mezi prediktory neplánované hospitalizace vyšší věk a mužské pohlaví, počet a délka předchozích hospitalizací. Dalšími faktory, které zvyšují riziko hospitalizace polymorbidních pacientů, jsou chronicky užívané léky (analgetika, nitráty, diuretika apod.) a také z našeho pohledu spíše „nezdravotnická“ charakteristika – vyšší stupeň sociální deprivace (11).
QAdmissions je pomůcka pro stanovení rizika nutnosti neplánované hospitalizace. Ze zdravotních dat jsou zahrnuty somatické i mentální komorbidity a dále užívané léky (nesteroidní antiflogistika, antikoagulancia, kortikosteroidy a psychofarmaka). Z dalších faktorů prognózu pacienta ovlivňuje abúzus (alkohol, cigarety) a jeho věk a socioekonomický status (12) (Obr. 2).
Chronic Disease Score (CDS) je příkladem skórovacího systému polymorbidních nemocných, který je založen na analýze předepsané medikace v průběhu posledního roku (případně posledních 6 měsíců). Po zohlednění dalších faktorů (např. věk, pohlaví) může přispět k predikci nutnosti hospitalizace nebo úmrtí v průběhu následujícího roku (13).
Specifika léčby multimorbidních pacientů
Zásadou léčby pacientů s multimorbiditou je komplexní a uvážlivý terapeutický přístup. Komplexní v tom smyslu, že musí zohledňovat jak celkový zdravotní stav, tak preference pacienta, uvážlivý v tom smyslu, aby naše terapeutické snahy byly přiměřené stavu a prognóze pacienta. Současně je důležitá také komplexní znalost všech onemocnění pacienta, jejich stadia a dynamiky. Fragmentace péče mezi „orgánové“ specialisty může být pro komplikované pacienty s multimorbiditou škodlivá, protože je zatížena rizikem izolovaného pohledu na jednotlivá přítomná onemocnění, bez znalosti dalších zdravotních problémů pacienta, a především bez zohlednění současně užívané komedikace. Z tohoto pohledu je stále důležitá úloha ambulantního internisty jako specialisty poskytujícího komplexnější pohled na multimorbidního pacienta než logicky zúžený přístup diabetologa, gastroenterologa, či kardiologa. Také v případě akutní hospitalizace by se měl pacient s multimorbiditou setkat s „generalistou“, tedy v podmínkách našeho systému postgraduálního vzdělávání opět s všeobecným nemocničním internistou (14). Faktorů, které budou ovlivňovat rozhodování lékaře o formě léčby, volbě medikace, jejím dávkování a terapeutických cílech, je celá řada. Zohledňujeme věk, tělesnou hmotnost a stavbu, schopnost biotransformace a eliminace léčiv (tedy především přítomnost orgánových dysfunkcí, v první řadě možnou renální insuficienci). Přítomnost souběžných onemocnění bude důležitá pro výskyt možných nežádoucích účinků, a zcela zásadní je další užívaná medikace s potenciálem lékových interakcí různých typů. U multimorbidních pacientů navíc představuje farmakoterapie somatických onemocnění jen jednu ze složek léčebného přístupu. V rámci komplexní péče musíme zohledňovat jíž zmíněnou skutečnost, že u chronicky nemocných pacientů je častý souběh mezi problémy somatickými a mentálními (15). V rámci celkového managementu pacienta s multimorbiditou proto musíme vždy myslet také na možnou přítomnost deprese a anxiety. Tyto faktory často souvisí s chronickými somatickými obtížemi, které jsou u pacienta přítomny, mohu jimi být vyvolány a současně negativně ovlivňují spolupráci pacienta při léčbě, adherenci k terapii apod. Proto bychom jejich možný výskyt měli vždy zvažovat (16). Další diagnózou, která by neměla uniknout naší pozornosti, je chronická bolest. Ta může být často hlavním subjektivním problémem multimorbidního pacienta, a stejně jako dříve zmíněná deprese či anxieta i chronická bolest může negativně ovlivňovat komplexní zdravotní stav (17). Lepší management chronické bolesti může pozitivně ovlivnit nejen funkční kapacitu a kvalitu života pacienta, ale také různými mechanismy dokáže zlepšit kontrolu některých dalších komorbidit. Nepřítomnost nebo alespoň dobrá kontrola chronické bolesti umožní pacientovi větší rozsah fyzické aktivity. Tu pacientům doporučujeme v rámci komplexní léčby jiných onemocnění, ať už kardiovaskulárních, či metabolických (obezita, diabetes mellitus, osteoporóza). Rovněž relativně malé a „banální“ intervence (např. použití pomůcek zlepšení zraku či sluchu) pozitivně ovlivní kvalitu života pacienta. Součástí péče o pacienta s multimorbiditou je i spolupráce s rodinou, vyhodnocení jeho zázemí. Dlouhodobé stonání je vždy i problémem bio‑psycho‑sociálním. Součástí péče o závažně multimorbidního pacienta je proto také případná indikace návštěvní, denní, nebo pobytové ošetřovatelské péče.
Většina pacientů, kteří trpí některým chronickým onemocněním, nemívají toto onemocnění izolovaně, a naplní tedy definici multimorbidity. Většina existujících doporučených postupů je však vytvářena specialisty z jednotlivých medicínských oborů (za interní odbornosti např. kardiology, nefrology, revmatology, diabetology atd.). Proto některá z doporučení nemusejí zohledňovat častou multimorbiditu pacientů a také polypragmazii, která ji logicky doprovází. Další komplikací pro adaptaci doporučených postupů u multimorbidních pacientů je skutečnost, že guidelines pro léčbu jednotlivých diagnóz samozřejmě vycházejí především z výsledků klinických hodnocení. Populace zahrnutá do většiny klinických hodnocení, jejichž výsledky představují podklady pro „evidence‑based“ medicínu, je však bohužel populací selektovanou. Důvodem jsou jak zařazovací a vyřazovací kritéria studií, tak přístup studijních lékařů k pacientům s multimorbiditou. Některé komorbidity neumožňují pacienta do studií zařadit (často je to závažnější stupeň renální insuficience). Závažnější multimorbidita pacientů je bohužel také faktorem diskriminujícím z pohledu investigátorů – tito pacienti mají častěji akutní zhoršení zdravotního stavu, včetně neplánovaných hospitalizací, a jsou z hlediska studijního lékaře obecně „náročnější“. Při volbě terapeutických postupů u pacientů s multimorbiditou tedy nelze slepě následovat doporučené postupy, ale musíme zohlednit další přítomná onemocnění a léčbu individualizovat. Rizikem je především nadměrná zátěž pacienta, vysoký počet současně užívané medikace, a také možné nežádoucí účinky léčby, které mohou ve svém důsledku pacienta spíše poškodit (18, 19). Přesná doporučení pro léčebné postupy pro všechny možné kombinace chronických onemocnění budou těžko někdy k dispozici, ale je pozitivní, že řada recentně publikovaných guidelines již na multimorbidní pacienty a seniory myslí, a specifika léčby v těchto situacích zohledňuje (20).
S multimorbiditou úzce souvisí také problematika polypragmazie (21) (Obr. 3). Nejčastější definice polypragmazie je současné užívání 5 léčiv a excesivní polypragmazie (polypharmacy) je definována jako současné užívání 10 léčiv ve stejné době (22). Předepisování (a užívání) velkého počtu různých léků se však u multimorbidních pacientů zpravidla nevyhneme. Musíme mít ale na paměti, že byla opakovaně prokázána závislost mezi počtem současně podávaných léků a výskytem nežádoucích účinků, výskytem závažných lékových interakcí, vyšším výskytem křehkosti, ale především nutností hospitalizace pacientů nebo úmrtí (23) (Obr. 4). Vztah mezi polypragmazií a horší prognózou pacientů nelze zjednodušeně interpretovat tak, že polypragmazie sama o sobě je primární příčinou špatného osudu pacientů, kteří užívají větší počet léků současně. Je spíše markerem horší prognózy multimorbidních pacientů, jejichž stav vyžaduje léčbu mnoha léky najednou. Tuto skutečnost potvrzuje fakt, že množství souběžně užívaných léčiv vstupuje do již dříve zmíněných prognostických nástrojů pro odhad rizika hospitalizace a mortality (CDS, MDBI, PEONY, QAdmission). Tuto skutečnost ale nelze zjednodušeně interpretovat tak, že souběžná medikace větším počtem léků je vždy chybná a znamená tedy špatnou péči (24). Musíme však rozlišovat, zda je seznam užívaných léků přiměřený, nebo nepřiměřený celkovému stavu pacienta, a také zda je adekvátní s ohledem na terapeutické cíle, které chceme dosáhnout. Často to není vůbec jednoduchá úvaha a vyžaduje pečlivé zhodnocení řady faktorů – posouzení jasné indikace léku pro daného pacienta v konkrétní situaci, stanovení vhodné dávky, zvážení možných nežádoucích účinků, efektu léčby až po úvahu o možnostech alternativní léčby farmakologické a nefarmakologické, včetně jiných cest podání léku.
Image 3. Multimorbidita a polypragmazie (21) 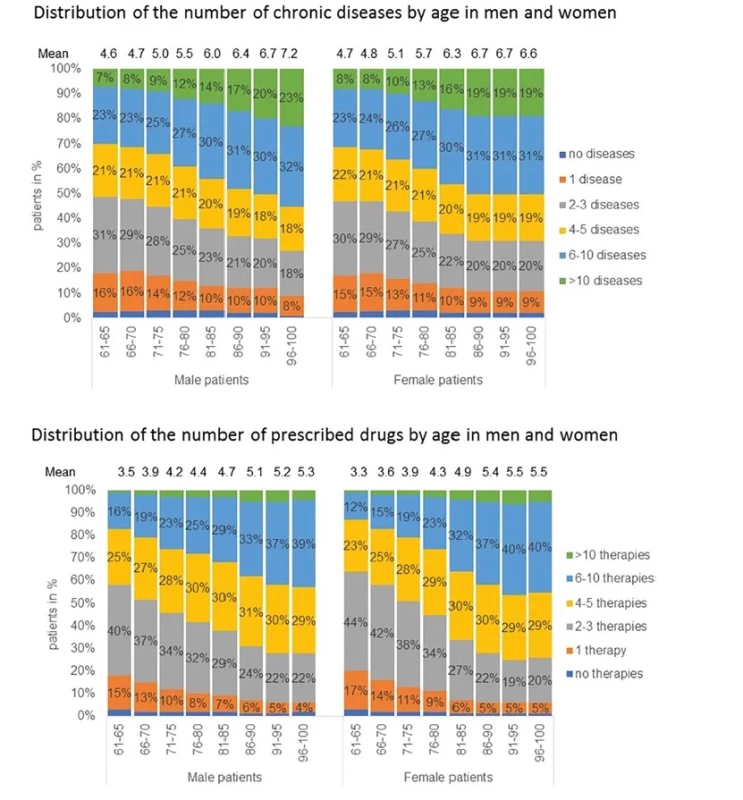
Image 4. Vztah mezi počtem denně užívaných léků a rizikem úmrtí podle věku (A) a pohlaví (B) (23) 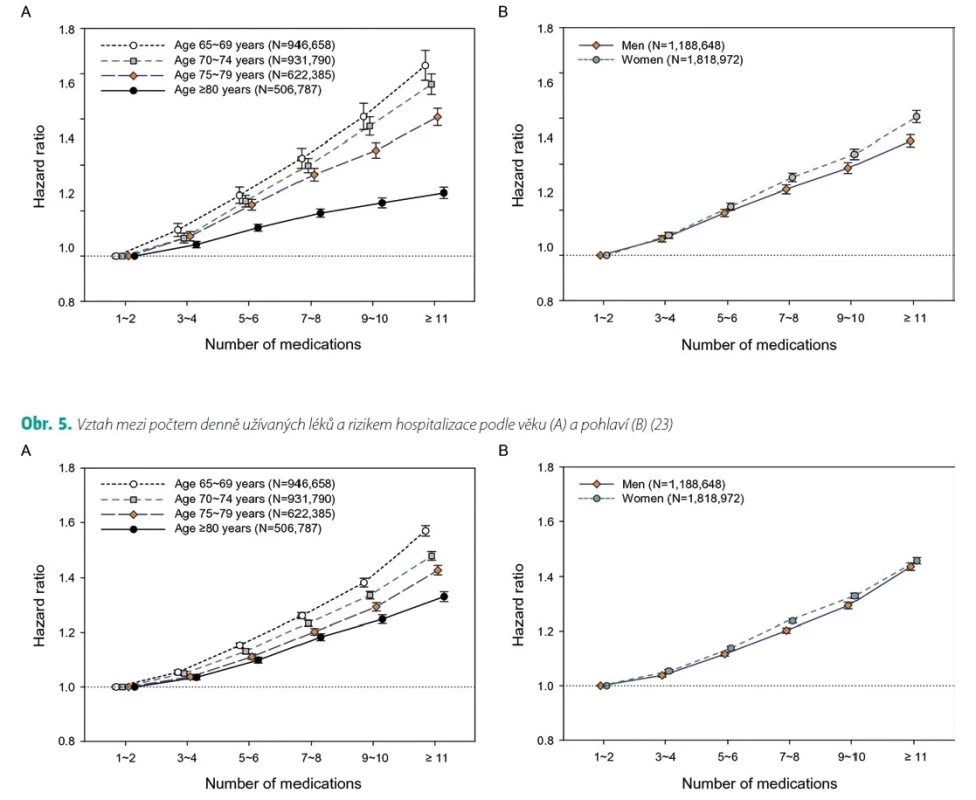
Jak bezpečně léčit pacienty s multimorbiditou
Pro vedení farmakoterapie u multimorbidních pacientů můžeme kromě naší klinické úvahy (a zohlednění kontraindikací a potenciálních interakcí) též využívat některé stratifikační systémy rozdělující léky podle jejich bezpečnosti pro rizikové populace pacientů. Tyto nástroje byly sice primárně vyvinuty pro posouzení vhodnosti daných léků v populaci pacientů vyššího věku (Beersova kritéria pro pacienty nad 65 let věku), a pro tuto populaci byly také validovány. Nicméně většina multimorbidních pacientů, se kterými se setkáváme, do této věkové skupiny již patří.
Beersova kritéria se snaží identifikovat léky nebo lékové skupiny, které by neměly být předepisovány pacientům ve vyšším věku. Tato kritéria byla poprvé publikována v roce 1991 a každé 3 roky probíhá jejích aktualizace v gesci Americké geriatrické společnosti. Tento seznam zahrnuje velký počet léků, které jsou potencionálně nevhodné u pacientů nad 65 let věku, případně by měly být v této skupině pacientů používány s maximální opatrností (25).
Improved Prescribing in the Elderly Tool (IPET) je dalším nástrojem využitelným pro bezpečnou farmakoterapii u seniorů. Zahrnuje 14 kombinací léků, které není vhodné používat s ohledem na věk či další onemocnění pacienta (26).
Screening Tool to Alert doctors to the Right Treatment (START) je nástroj, který je koncipován jinak než předchozí – indikuje vhodnost zahájit potenciálně prospěšnou léčbu. Na rozdíl od předchozích nástrojů není postaven na konceptu rizikových léků. Nepodání léku s jednoznačným profitem pro pacienta je totiž chybou stejně jako podávání nevhodné medikace. Kritéria START zahrnují léky a klinické situace, kdy by měla být medikace nasazena – opět validováno pro pacienty nad 65 let věku (27).
Screening Tool of Older Persons’ potentially inappropriate Prescriptions (STOPP) jsou kritéria, která jsou opět určena pro posouzení nevhodné preskripce u starších osob. Identifikují nevhodná léčiva v různých klinických situacích nebo kombinacích s jinou medikací – opět pro populaci nad 65 let věku. Optimální je současné použití s předchozím screeningovým nástrojem – tedy současné použití START/STOPP systému (28).
Fit fOR The Aged (FORTA) je systém klasifikace léčiv zavedený v roce 2008, aby pomohl lékařům optimalizovat a upřednostňovat používání vhodných léků u pacientů nad 65 let věku. Tento systém kombinuje pozitivní a negativní hodnocení farmak pro danou skupinu pacientů. Léky získávají hodnocení na základě jejich přínosu, rizika a vhodnosti pro každodenní použití u starších pacientů. Hodnocení léků A znamená velmi prospěšné (testováno ve velkých klinických studiích u starší populace s jasně pozitivním poměrem přínosu a rizika), B – prospěšné (důkazy o užitečnosti u starší populace, ale nevýhody ohledně účinnosti nebo vedlejších účinků), C – sporné (léky s neutrálním nebo negativním poměrem přínosu a rizika u starší populace) a D – nedoporučené. Také tato klasifikace vhodných a nevhodných léků je pravidelně aktualizována (29).
V řadě klinických situací u pacientů s multimorbiditou řešíme otázku smysluplnosti rozsáhlé farmakoterapie, kterou v průběhu času a diagnosticko‑terapeutického procesu „nasbírali“. Redukce užívaných léků (deprescribing) je logická součást individualizované, racionální a bezpečné farmakoterapie. Jedná se o aktivní a kontinuální proces, který zahrnuje zvažování nezbytnosti indikace všech současně užívaných léků, hodnocení jejich možných nežádoucích účinků v kontextu dalších přítomných onemocnění a další souběžně užívané medikace. Součástí tohoto procesu je opakované hodnocení terapeutických cílů a celkové prognózy pacienta s multimorbiditou a jednoznačně vždy také zohlednění preferencí pacienta. Bez nadsázky lze napsat, že stejně jako bychom měli na každé návštěvě pacienta zvažovat, zda je jeho účelná medikace kompletní a optimálně dávkovaná (START), měli bychom také medikaci průběžně revidovat z pohledu vhodnosti a nevhodnosti v aktuální klinické situaci (STOPP). Při optimalizaci medikace se můžeme řídit výše uvedenými doporučeními pro volbu bezpečné medikace pro pacienty ve vyšším věku. Pro vlastní proces deprescribingu je navržena řada postupů, příkladem může být algoritmus CEASE (30).
Confirm current medicines – ověření aktuálně užívané medikace a důvodu jejich podávání,
Estimate risk – posouzení rizika nežádoucího účinku všech užívaných léků,
Assess each medicine – posouzení přínosu a rizika každého z aktuálně užívaných léků z pohledu indikace, efektu a terapeutických cílů,
Sort – stanovení pořadí užívaných léků podle jejich důležitosti pro pacienta a možnosti vysazení,
Eliminate – vysazení zvolené medikace s následným sledováním pacienta (zlepšení stavu, možný rebound fenomén).
V rámci posouzení smysluplné a bezpečné farmakoterapie u pacientů s multimorbiditou, a tedy logicky přítomnou polypragmazií, je velmi důležitá úloha klinického farmaceuta. Jeho dostupnost by měla být standardem pro pracoviště akutní i následné lůžkové péče, která pečují o multimorbidní pacienty užívající větší počet léků současně – skutečnost je však jiná. Takto možnost spolupráce v primární péči je však zatím v našich podmínkách bohužel omezená.
Závěr
Vnitřní lékařství je oborem, který systematicky pečuje o pacienty s přítomností více chronických nemocí najednou. Značnou částí náplně naší práce je tedy diagnostika a často mnohaletá léčba těchto multimorbidních nemocných, která musí být skutečně komplexní. Pokud chceme být v našem terapeutickém snažení úspěšní, musíme se věnovat nejen našim klasickým „internistickým“ diagnózám, ale také pracovat s dalšími zdravotními problémy – například s depresí či anxietou, a rovněž s často přítomnou chronickou bolestí u těchto nemocných. Logickým důsledkem mnoha diagnóz u jednoho pacienta je polyfarmakoterapie. Ta by však měla zohledňovat stav pacienta včetně přítomnosti možných orgánových dysfunkcí, a především případné interakce užívané medikace. Také terapeutické cíle musí být individualizované, a mohou se v průběhu času měnit, i s ohledem na preference samotného pacienta. Při volbě bezpečné farmakoterapie u multimorbidních pacientů můžeme využít některé nástroje pro výběr vhodné medikace, jako je například START/STOPP systém. Deprescribing jako racionální redukce užívaných léků je logická součást individualizované, racionální a bezpečné farmakoterapie. Léčba našich pacientů je zpravidla dlouhodobá, jsme jejich průvodci různými stadii chronických onemocnění. Proto musí být vedení farmakoterapie multimorbidních pacientů aktivním a kontinuálním procesem, který obsahuje průběžné zvažování nutnosti užívání všech současně předepisovaných léků a také hodnocení jejich možných nežádoucích účinků v kontextu celkového stavu pacienta.
Článek přijat redakcí: 6. 3. 2023
Článek přijat po recenzích: 11. 4. 2023
MUDr. Zdeněk Monhart, Ph.D.
Interní oddělení a urgentní příjem, Nemocnice Znojmo
Sources
1. Ho IS, Azcoaga‑Lorenzo A, Akbari A, et al. Variation in the estimated prevalence of multimorbidity: systematic review and meta‑analysis of 193 international studies. BMJ Open 2022;12:e057017.
2. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio‑Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC, Eur Heart J. 2021 Feb 1;42(5):373-498.
3. Farmer C, et al. Clinical assessment and management of multimorbidity: summary of NICE guidance. BMJ. 2016 Sep 21;354:i4843.
4. Barnett K, Mercer SW, Norbury M, et al. Epidemiology of multimorbidity and implications for health care, research, and medical education: A cross‑sectional study. Lancet,380,37-43.
5. Valderas JM, Starfield B, Sibbald B et al. Defining comorbidity: implications for understanding health and health services. Ann Fam Med. 2009;7(4):357-363.
6. de Groot V, Beckerman H, Lankhorst GJ, et al. How to measure comorbidity. a critical review of available methods. J Clin Epidemiol. 2003;56(3):221-229.
7. Huntley AL, Johnson R, Purdy S, et al. Measures of multimorbidity and morbidity burden for use in primary care and community settings: a systematic review and guide. Ann Fam Med. Mar‑Apr 2012;10(2):134-41.
8. Newschaffer CJ, Bush TL, Penberthy LT. Comorbidity measurement in elderly female breast cancer patients with administrative and medical records data, J Clin Epidemiol. 1997,50 : 725-733.
9. Charlson ME, Charlson RE, Peterson JC, et al. The Charlson comorbidity index is adapted to predict costs of chronic disease in primary care patients. J Clin Epidemiol. 2008;61(12):1234-1240.
10. Salvi F, Miller MD, Grilli A, et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly patients.J Am Geriatr Soc. 2008 Oct;56(10):1926-31.
11. Donnan PT, Dorward DW, Mutch B, et al. Development and validation of a model for predicting emergency admissions over the next year (PEONY): a UK historical cohort study. Archives of Internal Medicine. 2008; 168(13):1416-1422.
12. Hippisley‑Cox J, Coupland C. Predicting risk of emergency admission to hospital using primary care data: Derivation and validation of QAdmissions score. BMJ Open. 2013 Aug 19;3(8):e003482.
13. Von Korff M, Wagner EH, Saunders K. A chronic disease score from automated pharmacy data. J Clin Epidemiol. 1992;45(2):197-203.
14. Bernabeu‑Wittel M, Para O, Voicehovska J, et al; EFIM Multimorbidity Working Group. Competences of internal medicine specialists for the management of patients with multimorbidity. EFIM multimorbidity working group position paper. Eur J Intern Med. 2023 Mar;109 : 97-106.
15. Lyness JM, Niculescu A, Tu X, et al. The relationship of medical comorbidity and depression in older, primary care patients.Psychosomatics. 2006;47(5):435-9.
16. European guide for management of frailty at individual level including recommendations and roadmap. https://www.advantageja.eu/images/D6.2_EuropeanGuide_Management. pdf
17. Butchart A, Kerr EA, Heisler M, et al. Experience and management of chronic pain among patients with other complex chronic conditions. Clin J Pain. 2009 May;25(4):293-8.
18. Boyd CM, Darer J, Boult C, et al. Clinical practice guidelines and quality of care for older patients with multiple comorbid diseases. JAMA. 2005;294 : 716-24.
19. Guthrie B, Payne K, Alderson P, et al. Adapting clinical guidelines to take account of multimorbidity. BMJ. 2012;345:e6341.
20. Leśniak W, Morbidoni L, Dicker D, et al. EFIM Clinical practice guidelines adaptation for internists – an EFIM methodology.Eur J Intern Med. 2020;77 : 1-5.
21. Kostev K, Jacob L. Multimorbidity and polypharmacy among elderly people followed in general practices in Germany. Eur J Intern Med. 2018 Sep;55 : 66-68.
22. Masnoon N, Shakib S, Kalisch‑Ellett L, et al. What is polypharmacy? A systematic review of definitions. BMC Geriatr. 2017 Oct 10;17(1):230.
23. Chang TI, Park H, Kim DW, et al. Polypharmacy, hospitalization, and mortality risk: a nationwide cohort study. Sci Rep. 2020 Nov 3;10(1):18964.
24. Burt J, Elmore N, Campbell SM, et al. Developing a measure of polypharmacy appropriateness in primary care: systematic review and expert consensus study. BMC Med. 2018 Jun 13;16(1):91.
25. The 2019 American Geriatrics Society (AGS) Beers Criteria® Update Expert Panel (2019). American Geriatrics Society 2019 Updated AGS Beers Criteria® for Potentially Inappropriate Medication Use in Older Adults. J Am Geriatr Soc. 2019 Apr;67(4):674-694.
26. Naugler CT, Brymer C, Stolee P, et al. Development and validation of an improving prescribing in the elderly tool. Can J Clin Pharmacol. 2000 Summer;7(2):103-7.
27. Barry PJ, Gallagher P, Ryan C, et al. START (screening tool to alert doctors to the right treatment) –an evidence‑based screening tool to detect prescribing omissions in elderly patients. Age and Ageing. 36(6):632-638.
28. O’Mahony D. STOPP/START criteria for potentially inappropriate medications/potential prescribing omissions in older people: origin and progress. Expert Rev Clin Pharmacol. 2020 Jan;13(1):15-22.
29. Pazan F, Weiss C, Wehling M. FORTA. The FORTA (Fit fOR The Aged) List 2021: Fourth Version of a Validated Clinical Aid for Improved Pharmacotherapy in Older Adults. Drugs Aging. 2022 Mar;39(3):245-247.
30. Scott IA, Le Couteur DG. Physicians need to take the lead in deprescribing. Intern Med J. 2015 Mar;45(3):352-6.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2023 Issue 3-
All articles in this issue
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Perioperační péče o pacienta s multimorbiditou
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
- Specifika diagnostiky a léčby multimorbidních pacientů
- JAK inhibice v léčbě zánětlivých revmatických onemocnění
- Efekt inhibitoru sodíko‑glukózového ko‑transporteru 2 empagliflozinu na vývoj onemocnění u pacienta se srdečním selháním a zachovalou ejekční frakcí
- Diferenciální diagnostika intersticiálních plicních procesů
- Novinky v gastroenterologii, hepatologii a digestivní endoskopii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika intersticiálních plicních procesů
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


