-
Medical journals
- Career
Multimorbidita při nefrotickém syndromu
Authors: Vladimír Teplan 1,2
Authors‘ workplace: Interní a kardiologická klinika Fakultní nemocnice Ostrava a Lékařská fakulta Ostravské univerzity, Ostrava 1; Subkatedra nefrologie, Institut postgraduálního vzdělávání ve zdravotnictví, Praha 2
Published in: Vnitř Lék 2023; 69(3): 156-165
Category: Main Topic
doi: https://doi.org/10.36290/vnl.2023.028Overview
Nefrotický syndrom (NS) je charakterizován velkou proteinurií (nad 3,5 g/24 h), hypalbuminemií, generalizovanými otoky, hyperlipidemií a poruchami koagulace. Vedle primárních glomerulonefritid se vyskytuje u sekundárních glomerulopatií při diabetu, amyloidóze, systémových zánětlivých chorobách, onkologických onemocněních, u poškození léky a drogami, při alergiích, závažných infekcích a u dětí jsou i formy vrozené. Nejčastější příčinou NS v dospělosti je diabetes mellitus (DM). V současnosti je DM příčinou 40 % selhání ledvin u nemocných na dialýze. Z hlediska prevence je proto věnována velká pozornost gliflozinům (SGLT2 inhibitory), které mají prokazatelně nefroprotektivní účinky. Glifloziny vedou k navození glykosurie, doprovázené současně natriurézou a osmotickou diurézou. Účinnost gliflozinů na snížení glykemie je proporcionální k úrovni glomerulární filtrace, zatímco efekty vázané na natriurézu jsou zachovány ve všech stadiích renální insuficience.
Klíčová slova:
diabetes – nefrotický syndrom – glifloziny – primární a sekundární glomerulopatie
Úvod
Nefrotický syndrom (NS) je charakterizován komplexem metabolických a dalších nasedajících poruch následujících po závažném a prolongovaném zvýšení propustnosti glomerulární membrány, jakož i porušené tubulární resorpci pro bílkovinu. Hlavními rysy jsou: proteinurie (větší než 2 g/m2/den, tj. nad 3,5 g/den), následná hypoalbuminemie (pod 30 g/l), generalizované otoky, hyperlipidemie a poruchy koagulace spojené s rizikem trombóz velkých žil. Etiologicky je spojen s řadou onemocnění a vede často k dalším orgánovým poškozením. Jedná se o syndrom, proto je třeba vždy pátrat po základním patologickém procesu, který renální poškození vyvolá. Může se jednat jak o primární renální patologii, tak o postižení sekundární při metabolických či hematoonkologických onemocněních. Může být též spojen s toxoalergickou reakcí organismu či poškozením polékovým (1).
NS se může objevit v každém věku. V mladém věku je častěji spojen s primárním renálním onemocněním typu glomerulonefritidy (GN), u vyšších věkových kategorií s diabetickou nefropatií nebo hematoonkologickým onemocněním. U dětí je nejčastější ve věku 1,5–4 roky. V mladším věku je predilekce v postižení chlapců, která však s postupujícím věkem mizí (2, 3).
Léčebný postup závisí na základní příčině (léčba GN imunosupresivy a kortikoidy, kompenzace diabetu, chemoterapie u onkologického onemocnění, léčba infekčních onemocnění, změna léčby, ukončení užívání drog ap.). Vždy však musíme současně ovlivňovat přidružené poruchy, jako jsou klinicky otoky (diuretika, dietní opatření, úprava hladiny albuminu ap.), hyperlipidemie (statiny i fibráty) a hyperkoagulace (antikoagulancia a antiagregancia). Pravidelnou součástí je i léčba přítomné hypertenze s její plnou kompenzací k hodnotám 125/80 mm Hg (4).
Etiologie a klasifikace nefrotického syndromu
Jak je uvedeno v tabulce 1, NS může vzniknout primárně v rámci glomerulárního onemocnění (GN minimálních změn – MCD, imunokomplexové GN, fokálně segmentální GN, membranózní či membranoproliferativní GN, mezangioproliferativní GN vč. IgA nefropatie Berger i výjimečně rychle proliferující GN), či sekundárně ve spojení s řadou chorob, jako jsou např. diabetes mellitus, nádorová onemocnění, kolagenózy a vaskulitidy, lupus erythematodes, amyloidóza, infekce (malárie, hepatitida, HIV) i užíváním některých léků a drog (5). Může být spojen i s hereditárním onemocněním, jako je Alportův syndrom (porucha syntézy alfa‑řetezců kolegenu IV bazální membrány glomerulů) či Fabryho nemoc (mutace genu pro alfa‑galaktozidázu A).
Table 1. Onemocnění spojená s nefrotickým syndromem 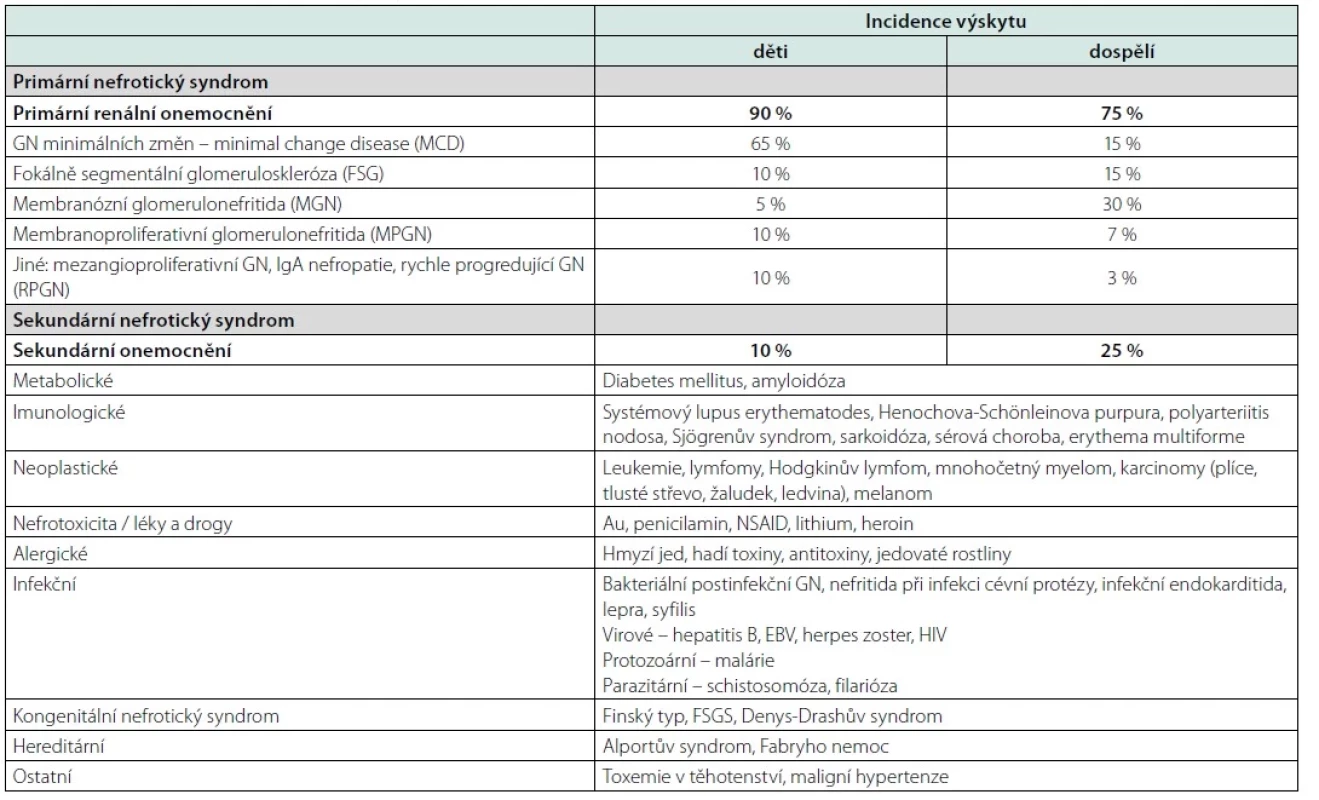
Familiární nefrotické syndromy se vyskytují jako kongenitální NS (finský typ mutace nefrinu, FSGS:-AR typu, mutace podocinu či AD typu, mutace alfa aktininu či difuzní mezangiální skleróza, Denys Drash syndrom‑mutace WT genu). Tyto syndromy jsou rychle progredující a obvykle vyžadující dialýzu v časném údobí věku (6).
Patologie
Proteinurie vzniká při funkčním poškození dvou bariér bazální membrány – porušenou selektivní propustností pro velké molekuly a poruchou elektrostatického náboje se zvyšuje propustnost pro proteiny nižší molekulové hmotnosti. Je porušena i resorpce proteinů v proximálním tubulu (7).
Příznaky a objektivní nález
Při vyšetření je proteinurie obvykle větší než 2 g/m2/den (3,5 g/24 h). Další příznaky zahrnují anorexii, malátnost, oteklá oční víčka, abdominální bolesti, úbytek svalové hmoty a otoky. Může být přítomna též anasarka s pleurálními výpotky (8, 9).
Lokální retence tekutin může být důvodem pro ztížené dýchání (pleurální výpotky, edém laryngu), bolesti za sternem (perikardiální výpotek), otok skrota, kolen, ascites a někdy (u dětí) abdominální bolesti z otoku mezenteria. Často se otoky stěhují – ráno otoky víček, večer kolem kotníků. Tekutina se hromadí primárně dle Starlingových zákonů (v závislosti na poměru mezi hydraulickým a onkotickým tlakem v kapilárách a v intersticiu a celkových mechanismech, které zvyšují frakční resorpci Na – renin‑angiotenzin‑aldosteron). U dětí se může vyvinout ortostatická hypotenze či dokonce šokový stav. Dospělí mohou být hypo-, normo - či hypertenzní v závislosti na stupni stimulace jejich produkce angiotenzinu II. Je třeba dát pozor na úbytek svalové hmoty, který může být maskován otoky. Oligurie, či dokonce akutní selhání ledvin se může vyvinout při hypovolemii a snížené renální perfuzi – výjimečně se může objevit až oligoanurická forma akutního selhání ledvin.
Metabolické poruchy a komplikace
Nefrotický syndrom je charakterizován proteinurií, hypoproteinemií (hypalbuminemií), hyperlipoproteinemií a tvorbou otoků. Ačkoliv nemusí být v jednotlivých případech všechny tyto známky jasně vyjádřeny, je zřejmé, že proteinurie představuje klíčovou poruchu. Proteinurie musí být alespoň 3 g/24 h/m2 (tzv. velká proteinurie).
Většinou se však pohybuje nad 5 g/den. Nefrotický syndrom je spojen s řadou často na sebe navazujících metabolických poruch, které lze obtížně ovlivnit, aniž bychom odstranili poruchu základní spojenou s velkou proteinurií (10).
Po stránce patofyziologické se v souvislosti s hypoproteinemií a hypalbuminemií mění (lehce zvyšuje) průtok krve ledvinami a glomerulární filtrace a mění se permeabilitní vlastnosti glomerulární membrány.
Při zvýšeném příjmu proteinů (či albuminu) se aktivuje celá kaskáda hormonů a vazoaktivních substancí, především dopamin, IGF-1 (insulin‑like growth factor), angiotenzin II a NO. (Oxid dusnatý vzniká při metabolismu aminokyseliny ureového cyklu argininu. Je produkován cévními endoteliemi a hraje velmi významnou roli v regulaci cévního tonu, a tím průtoku krve ledvinou.)
Při významnější proteinurii jsou v závislosti na velikosti molekuly, ale i jejím elektrickém náboji (fyziologicky záporný elektrický náboj bazální glomerulární membrány při závažnějším poškození mizí) ztráceny především tyto bílkoviny (m.hm. 40–150 kD): albumin, transferin, vazebný protein pro vitamin D, ceruloplazmin, fibrinogen, protrombin, antitrombin III. Při závažné neselektivní proteinurii jsou ztráceny i velké molekuly, např. imunoglobuliny G, A, M ap.
1. Metabolismus albuminu
Albumin je klíčovým proteinem plazmy. Vzhledem ke své relativně malé molekulové hmotnosti a vysoké koncentraci v plazmě významně ovlivňuje onkotický tlak. Koncentrace albuminu nižší než 25 g/l bývá spojena s tvorbou otoků. Hypalbuminemie se sníženým onkotickým tlakem vede ke zvýšené transudaci tekutiny do intersticia spojené s volumovou kontrakcí plazmy a sekundární aktivací systému renin‑angiotensin‑aldosteron a s retencí sodíku. Při pokračující proteinurii a hypalbuminurii však nemůže být stabilizován objem cirkulující plazmy. Pozitivní feedback vede k další aktivaci RAA a další retenci sodíku. Retinovaný sodík a voda vstupují do intersticiálního prostoru. Tvorba otoků je tak přímo závislá na stupni hypalbuminemie. Retence sodíku a vody je pak důsledkem opakovaných kontrakcí plazmatického volumu. Snížená schopnost nefrotické ledviny vylučovat sodík je vedle zmenšení plazmatického volumu vyvolána i v porušené odpovědi na atriální natriuretický faktor (ANF).
2. Vliv proteinů a aminokyselin na renální hemodynamiku u nefrotického syndromu
Za 2–4 hodiny po podání proteinové suplementace (nad 1 g/kg) dochází ke zvýšení průtoku krve ledvinami a splanchnickou oblastí a zvyšuje se velikost glomerulární filtrace se současným zvýšením glomerulární permeability pro protein. Tento poznatek je znám z klinické praxe, kdy po podání zvýšeného příjmu bílkovin stoupá i proteinurie. Příjem proteinů tedy vyvolá tři nezávislé procesy, které významně ovlivňují hladinu albuminu u nemocných s nefrotickým syndromem:
a) zvýšení syntézy proteinů při dodání potřebného množství nezbytných aminokyselin,
b) zvýšení katabolismu albuminu vedoucí k jeho snížení a tvorbě dusíkatých katabolitů,
c) zvýšení močových ztrát, akcentace proteinurie.
Lze tedy souhrnně říci, že samotné zvýšení příjmu proteinů v dietě nezaručuje zvýšení hladiny albuminu, či dokonce u některých pacientů může vést k jejímu dalšímu snížení. (Navíc si musíme být vědomi dlouhodobě nepříznivého účinku zvýšeného příjmu proteinů na renální hemodynamiku spojeného s intraglomerulární vazodilatací a hypertenzí a aktivací růstových faktorů podporujících spolu s angiotenzinem II fibrotizační procesy.)
Podobné efekty lze zaznamenat po podání infuze aminokyselin, i když zde významně závisí na složení jednotlivých aminoroztoků. Např. infuze obsahující aminokyseliny s rozvětveným řetězcem nevedou ke zvýšení glomerulární filtrace a průtoku krve ledvinou, zatímco infuze obsahující arginin způsobují výrazné změny v renální hemodynamice. Proto také výsledný hemodynamický efekt podané bílkoviny více závisí na jejím složení, než na příjmu solutu či dusíku.
Zvýšený příjem proteinů a jejich výsledný efekt je také spojen se změnami hormonálních aktivit. Zvyšuje se sekrece glukagonu, růstového hormonu, kortikosteroidů, dopaminu a ovlivňuje i renin‑angiotenzin‑aldosteronový systém, který zpětně stimuluje sekreci prostaglandinů. Zvýšená sekrece glukagonu se zdá nezbytnou pro zvýšení GFR a průtok krve ledvinou, které následuje zvýšení příjmu proteinů.
Angiotenzin II podaný exogenně stejně jako jeho endogenní účinek vede ke zvýšení glomerulární permeability pro makromolekuly. Nálezy studií prokazující snížení proteinurie po podání inhibitorů angiotenzin‑konvertujícího enzymu (ACE), resp. AT1 receptorů podporují závěry, že angiotenzin II je významný hormonální mediátor ovlivňující glomerulární permeabilitu ve vztahu ke zvýšenému příjmu proteinů.
ACE inhibitory jsou ovšem relativně nespecifické, protože neblokují pouze tvorbu angiotenzinu II, ale také blokují enzymy nezbytné pro degradaci kininů. Jejich farmakologický účinek může být zřejmě vyvolán jak snížením tvorby angiotenzinu II, tak zvýšením kininů.
3. Nefrotický syndrom a tkáňové proteiny
V experimentálních studiích bylo ukázáno, že přísně nízkobílkovinná dieta (8,5 % kaseinu v denním příjmu) vedla u krys s nefrotickým syndromem s úbytku svalové hmoty a zpomalení růstu ve srovnání s příjmem vysokým (40 % kaseinu v denním příjmu). U nemocných s nefrotickým syndromem není často jednoduché odhalit úbytek svalové hmoty vzhledem k přítomným otokům. Navíc, jak již bylo zmíněno, zvýšený příjem proteinů je spojen s akcentací proteinurie, zvýšením tvorby proteinových katabolitů a dlouhodobě akcelerací progrese renální insuficience. Za situace výrazných ztrát viscerálních proteinů však stoupá jejich tvorba v játrech s cílem především udržet koloidně osmotický tlak plazmy. Vedle zvýšené syntézy albuminu však stoupá i tvorba dalších jaterních proteinů, především apolipoproteinů a prokoagulačních faktorů, což ve svých důsledcích vede k rozvoji hyperlipoproteinemie a zvýšené tvorbě trombóz.
4. Bilance příjmu bílkovin u nemocných s nefrotickým syndromem
U nemocných s nefrotickým syndromem doporučujeme k zajištění optimálního příjmu proteinu sledovat několik dní příjem a výdej bílkovin s cílem zajistit vyrovnanou dusíkovou bilanci.
Tzv. čistý příjem proteinů u nefrologických nemocných by se měl pohybovat kolem hodnoty 0,8 g proteinu / kg tělesné hmotnosti / den s přídavkem proteinu ve velikosti proteinurie.
Např. u nemocného vážícího 70 kg s proteinurií (průměr tří denních hodnot) 7 g by měl denní příjem proteinu činit: 70 × 0,8 = 56 + 7 = 63 g (1).
Dusíková bilance (NB) měřená pomocí odpadů močoviny do moči by představovala u tohoto nemocného vylučování močoviny (průměr tří denních hodnot) 250 mmol/den.
(Z 1 g proteinu vzniká 5,5 mmol močoviny, 80 % urey se vylučuje močí a fekální vylučování dusíku se pohybuje v průměru mezi 1,5–2 g). Hodnotu močoviny v mmol/den je nutné násobit faktorem 0,25. K výpočtu hodnot dusíku dělíme zjištěné hodnoty bílkovin faktorem 6,25.
NB(1): 250 × 0,25/6,25 = 62,5/6,25 = 10 (g) (2)
V uvedeném případě je tedy metabolizováno 62,5 g proteinu, což odpovídá 10 g dusíku.
NB = příjem/metabolická degradace proteinů – vylučování dusíku močí / stolicí
Vyrovnaná NB: příjem – výdej = 0.
Negativní NB: odpady dusíku jsou větší, než by odpovídalo přijatému proteinu, nemocný katabolizuje.
Pozitivní NB: odpady dusíku jsou menší, než by odpovídalo příjmu, nemocný anabolizuje.
Ve výše uvedeném příkladě NB: (1) – (2) : 10,1 – 10 = + 0,1 (g).
Hodnota PCR (protein catabolic rate) má činit u těchto nemocných ve vyrovnaném metabolickém stavu 0,8 g/kg + 24h proteinurie/tělesnou hmotností (TH).
U uvedeného nemocného: 0,8 + (7 : 70) tj. 0,1 = 0,9 (g)/kgTH.
K dlouhodobému udržení vyrovnané dusíkové bilance musí nemocný přijímat:
0,9 × 70 = 63 g bílkoviny.
Nejméně 50 % tohoto proteinu musí být biologicky plnohodnotná (živočišná) bílkovina.
5. Poruchy metabolismu lipidů u nefrotického syndromu
Hyperlipoproteinemie u nemocných s nefrotickým syndromem vzniká v důsledku jak zvýšení produkce lipoproteinových partikulí, tak jejich porušeným odbouráváním (lipoproteinové lipázy). Podíl jednotlivých dílčích poruch a jejich vzájemná interference mohou být v různých případech rozdílné. Vedle tvorby a degradace lipoproteinů hraje významnou roli základní onemocnění vedoucí k proteinurii, její velikost a selektivita, stupeň hypalbuminemie, snížený onkotický tlak apod. Nepochybně se uplatňuje i genetická predispozice. Charakteristickým rysem této poruchy je výrazné zvýšení LDL, VLDL a IDL. Naproti tomu hodnoty HDL jsou většinou snížené či normální. Zjišťujeme tedy výrazné zvýšení celkového cholesterolu, LDL‑cholesterolu, částečně i triacylglycerolů. HDL‑cholesterol může být snížený či normální. Je zvýšený poměr LDL/HDL cholesterol. Chylomikrony jsou katabolizovány cévním endotelem na aterogenní remnantní částice bohaté cholesterolem, které jsou vychytávány a metabolizovány v játrech. Byla prokázána negativní korelace mezi sérovou koncentrací albuminu a hladinami cholesterolu, respi triacylglycerolů. Současně existuje i pozitivní korelace mezi velikostí proteinurie a hladinou cholesterolu.
Hyperlipoproteinemie při delším trvání nefrotického syndromu ohrožuje nemocné nejenom rozvojem ateroklerózy a kardiovaskulárními komplikacemi, ale nepochybně může přispět i k progresi renálního onemocnění. Lipoproteinové partikule podobně jako imunokomplexy jsou vychytávany specifickými receptory a vedou k závažným fibroticko‑sklerotickým změnám především v oblasti glomerulárního melasangia. Toto poškození je nezávislé na dalších faktorech chronického poškození, jako je hyperfiltrace a hypertrofie glomerulárních buněk. Především v experimentálních studiích byla zjištěna lipoproteinová depozita, proliferace mesangiálních buněk a pěnovité buňky. Velmi významnou roli v mechanismu poškození hrají i oxidované LDL‑partikule. V důsledku zvýšené nabídky stoupá nekontrolovaně i aktivita specifických LDL receptorů spojená se zvýšenou intracelulární depozicí cholesterolu.
6. Změny v metabolismu stopových prvků a vitaminů při nefrotickém syndromu
Vzhledem ke ztrátám transportních vazebných proteinů zjišťujeme u některých nemocných s nefrotickým syndromem v důsledku ztrát transferinu hyposideremii s následnou mikocytární hypochromní anémií.
Při ztrátách celuloplazminu klesá serová koncentrace mědi (většinou bez klinické manifestace).
Nejvýznamnějším proteinem transportujícím zinek je albumin. Vzhledem k významné hypalbuminemii je pravidelně přítomen i významný defekt metabolismu zinku, který dosud nebyl klinicky doceněn.
Dobře známou metabolickou poruchou je hypokalcemie. Týká se jak ionizovaného, tak celkového kalcia. Hypokalcemie může být i relativní při snížení albuminemie, proto doporučujeme vždy vyšetření ionizovaného Ca. Významně klesá hladina vitaminu D v důsledku ztrát vazebného proteinu pro vitamin D. Ztrácí se i samotný vitamin D. Hypovitaminóza D není důsledkem snížené renální funkce, neboť je nalézána u nemocných s nefrotickým syndromem při normální funkci. Hypokalcemický syndrom může vést k pokročilým změnám na kostře nemocných a často je přítomna i porušená resorpce kalcia ve střevě. Porucha může být výrazně zlepšena podáním vitaminu D.
Laboratorní nálezy
Iniciální močové vyšetření prokazuje významnou proteinurii přesahující obvykle 3,5 g/den. Močový sediment obvykle obsahuje hyalinní, granulární, eventuálně i tukové, voskové a epiteliální válce. Mikroskopická hematurie a erytrocytární válce mohou být též přítomny v závislosti na etiologii glomerulárního onemocnění. Leukocyturie může převažovat při zánětlivých procesech a SLE. Amyloidní fibrily mohou být zjištěny v elektronovém mikroskopu.
Hladina sérového albuminu je často nižší než 25 g/l, u dětí dokonce nižší než 10 g/l. Jsou ztráceny i četné transportní bílkoviny – obvykle nízké jsou hodnoty IgG a ostatních imunoglobulinů, ceruloplazminu a transferinu. Nízké mohou být i hladiny kortikosteroidních a tyreoidálních hormonů, ASLO a složek komplementu. Existují výjimky související se základní chorobou. Např. při SLE jsou hladiny IgG obvykle zvýšené a při MGN je hladina C3 složky normální. Hladiny sérové urey a kreatininu odrážejí stupeň snížení renálních funkcí.
Močová koncentrace Na může být výrazně snížena v retenční fázi tvorby nefrotických otoků. Močové koncentrace K jsou obvykle vyšší, poměr Na : K obrácený, menší než 1. Sekrece aldosteronu je v této fázi zvýšena – může být však i normální v dalším průběhu onemocnění, a to i při trvajících otocích. Vylučování Na u nemocných s NS je sníženo, což ukazuje na defekt v renálním transportu Na.
Hyperlipidemie může být patrná již z chylózního zabarvení séra. Tito pacienti mívají sníženou aktivitu lipoproteinové lipázy a jaterní lipázovou aktivitu. Při laboratorním vyšetření je zjišťována zvýšená hladina celkového cholesterolu (volného i cholesterolových esterů), LDL cholesterolu, někdy i triacylglycerolů a fosfolipidů. Neesterifikované mastné kyseliny mohou být v závislosti na hladině albuminu snížené či normální. Těžká hyperlipoproteinemie provází závažnou hypoalbuminemii (vedle snížené aktivity lipáz i zvýšená tvorba apolipoproteinů).
Mikrocytární anémie může být přítomna při závažných ztrátách transferinu močí.
Koagulační poruchy jsou časté. Zatímco koncentrace faktorů vnitřního koagulačního systému mohou být v důsledku ztrát močí snížené (především faktory IX, XII), stejně jako faktory trombolytické aktivity (urokináza, antitrombin III), ostatní prokoagulační faktory jsou často zvýšené (faktory VIII, VII, V, fibrinogen a destičky).
Poruchy v koagulaci spolu se sníženou fibrinolytickou aktivitou (snížený antitrombin III) a epizodickou hypovolemií jsou příčinou zvýšeného rizika trombóz (včetně závažné trombózy renální žíly). Může se projevit symptomatologie peritonitidy, časté jsou oportunní infekce. Vysoká incidence infekcí je vyvolána nízkou hladinou imunoglobulinů (IgG). Hypertenze spolu s kardiálními a cerebrovaskulárními komplikacemi jsou mnohem častější u diabetiků a pacientů, kteří trpí systémovou kolagenózou (11).
Hypoproteinemie a hypoalbuminemie mohou vést též ke zvýšení volné frakce některých léků s rizikem zvýšeného účinku (fibráty, warfarin). Naopak u jiných se účinek v důsledku zvýšení distribučního objemu snižuje (furosemid).
Diagnóza
Diagnóza NS je založena na klinických a laboratorních nálezech s tím, že definitivní diagnózu poskytuje většinou až renální biopsie.
U nemocných s primárním NS představuje těžká proteinurie s průvodními biochemickými nálezy hlavní klinický problém. Při dlouhodobém průběhu se u primárního NS může objevit i renální insuficience. Objevení se významné proteinurie u nemocných s chorobami ledvin ukazuje závažnost onemocnění, a je proto špatnou prognostickou známkou. V terminálním stadiu renální insuficience často klesá proteinurie (s poklesem glomerulární filtrace) a mohou vymizet i průvodní otoky.
Více než 25 % případů NS u dospělých vzniká sekundárně.
Elektroforéza a imunoelektroforéza močových a sérových bílkovin pomůže odlišit glomerulární a tubulární proteinurii a odhalit paraprotein (lehké řetězce, Bence‑Jonesova bílkovina, monoklonální gamapatie apod.). Musí být provedeno současně podrobné vyšetření zaměřené na základní systémové onemocnění (především na diabetes mellitus, amyloidózu, mnohočetný myelom a SLE). Jestliže histologický nález potvrzuje MGN, a zvláště pak je‑li nemocný starší a ubývá na váze, je třeba vždy pátrat po malignitě. HBsAg je zjišťován u 22 % primárních glomerulopatií spojených s MGN, MPGN a IgA nefropatií.
Prognóza
Prognóza závisí na základní etiologii onemocnění. Ke kompletní remisi může dojít, jestliže vznikne NS sekundárně a základní vyvolávající onemocnění je úspěšně vyléčeno (např. infekce, malignita, polékové stavy). Kompletní remise je obecně častější u dětí (kolem 50 %) než v dospělosti. Prognóza je též příznivější u kortikosenzitivních glomerulopatií a u nemocných, u nichž vede imunosupresivní léčba k relapsu onemocnění. Někdy se můžeme setkat se spontánní remisí, např. u MGN, a to až po pěti letech (12).
MCD má nejlepší prognózu, u více než 90 % dětí a většiny dospělých dojde k příznivé odpovědi na léčbu. Časté jsou však relapsy, i když progrese renální insuficience je vzácná. Po více než jednoleté remisi onemocnění je rekurence málo pravděpodobná, a to i při těhotenství.
MGN je onemocnění, které je spojeno s více chorobami především u dospělých. Jeho průběh může být proto velmi rozdílný – u přibližně u 50 % nemocných dojde během 15 let k renálnímu selhání, u zbylých 50 % k remisi či mají perzistující proteinurii, někdy s rozvinutým NS. Většina onemocnění u dětí má spontánní remisi proteinurie do 5 let od vzniku onemocnění.
FSG a MPGN většinou odpovídají špatně na léčbu a jejich prognóza je nejistá. Více než 50 % nemocných s FSG se dostane během 10 let do renálního selhání. U 20 % je však průběh mnohem horší a progrese do renálního selhání nastane během 2 roků. Onemocnění má opět závažnější prognózu u dospělých než u dětí.
Podobně u přibližně 50 % nemocných s MPGN může dojít během 10 let k renálnímu selhání. Remise jsou zde vzácné (pod 5 %). Nemocní s MPGN až na výjimky neodpovídají příznivě na léčbu kortikoidy.
U SLE, amyloidózy a diabetické nefropatie je indikována kombinovaná léčba. Dosud žádný léčebný postup jednoznačně a definitivně nezastavil progresi onemocnění. Při diabetické nefropatii s NS se nemocní mohou dostat do renálního selhání i během 3–5 let.
Ve všech případech NS může být prognóza výrazně zhoršena při interkurentní či dlouhodobé infekci, hypertenzi, signifikantní hyperazotemii, hematuri, či trombózách mozkových, pulmonálních, periferních a renálních žil.
Je známa také rekurence NS v transplantované ledvině u nemocných, kteří mají jako základní onemocnění FSG, SLE, IgA nefropatii a zvláště typ II MPGN (méně již typ I). Rekurence je také někdy zjišťována u MGN a mezangioproliferativní GN.
Léčba
Léčba je závislá na patologickém procesu zjištěném při renální biopsii (13).
V léčbě základního onemocnění postupujeme dle doporučených léčebných postupů uvedených pro jednotlivé typy onemocnění (14).
V současné době narůstají pozitivní zkušenosti s podávání monoklonální protilátky proti antigenu CD20 na povrchu B lymfocytů, která navozuje kompletní deplexi B lymfocytů (rituximab). U nemocných s NS byly nadějné výsledky získány především u pacientů s diagnózou lupusové nefritidy (SLE), membranózní nefropatie (MGN), minimálních změn glomerulu (MCD) a fokálně segmentální glomerulosklerózy (FSG) (15).
Při sekundárních příčinách NS (např. Hodgkinově lymfomu či jiných nádorových onemocněních) se remise může objevit při specifické léčbě základního onemocnění. Také léčba infekčních antigenů může příznivě ovlivnit NS (endokarditida vyvolaná stafylokoky či Streptococcus viridans, infekce cévní protézy, malárie, syfilis a schistosomóza). NS vyvolaný heroinem může mít kompletní remisi, pokud je podávání heroinu zastaveno v časné fázi onemocnění. Progrese do dokončeného stadia renálního selhání je velice častá u FSG spojené s HIV. Pečlivá desenzibilizace může zvrátit průběh NS při toxoalergickém postižení, stejně jako odstranění potenciálně nefrotoxických léků (zlato, penicilamin, nesteroidní antiflogistika) může navodit remisi.
Podpůrná léčba vyžaduje nutriční režim s příjmem bílkovin kolem 0,8 g/kg/den + proteinurie, respektive při Skr > 250 μmol/l kolem 0,7–0–8 g/kg/den + proteinurie + ketoanaloga es. aminokyselin 0,1 – 0,2 g/kg/den, snížený příjem tuků se saturovanými mastnými kyselinami a soli (Na pod 100 mmol/den, tj. kolem 5 g NaCl). Zvýšený příjem bílkovin zhoršuje proteinurii. Inhibitory angiotenzin konvertujícího enzymu (ACE) a sartany mohou významně snížit proteinurii, eventuálně i hyperlipidemii.
(Pozor: ACE inhibitory mohou u nemocných se středním a těžším stupněm renální insuficience navodit hyperkalemii.)
Je‑li přítomna hyponatremie, má být upraven i příjem tekutin. Po nástupu vydatné diurézy a vymizení otoků musí být příjem Na uvolněn.
K ovlivnění symptomatických otoků doporučujeme opatrné podávání thiazidových či kličkových diuretik (Pozor: diuretika redukcí objemu plazmy mohou vést ke snížení renální funkce a predispozici k trombózám). Je‑li hypovolemie těžká a život ohrožující, je nutné neodkladně podat infuzi plazmy či albuminu. K ovlivnění rezistentních otoků lze použít kombinaci kličkového diuretika a thiazidů. K navození akutní diurézy při již snížené renální funkci lze úspěšně podat vyšší dávku furosemidu (např. 250 mg) přímo v roztoku albuminu (např. ve 100 ml 20% albuminu) (16–17).
U pacientů nereagujících na diuretickou léčbu (např. při současném srdečním selhání) může významně pomoci přístrojová ultrafiltrace.
Také hypertenze musí být léčena. Většinou vystačíme s diuretiky, někdy jsou však nezbytné i další léky. Infekce (především bakteriurie, endokarditida a peritonitida) jsou život ohrožující, proto musí být okamžitě účinně léčeny. Trombóza je častou komplikací a je třeba na ni myslet (především na hluboké žilní trombózy a plicní embolizace). V těchto případech je indikováno podávání antikoagulancií (18).
Při albuminemii pod 25 g/l vždy doporučíme podávání antiagregancií. Důležitá je i léčba průvodné sekundární hyperlipidemie, která souvisí s poruchou lipázové aktivity a ke které nyní užíváme statiny i fibráty.
V souvislosti s poruchami sérových proteinů je také porušena vazba a transport řady léků, a tím změněna jejich léčebná účinnost.
Dieta u nefrotického syndromu
Dietní opatření u nemocných v chronické renální insuficienci s rozvinutým nefrotickým syndromem musí přihlížet nejen ke stupni snížení renálních funkcí, ale i ztrátám bílkovin močí a přítomným dalším metabolickým poruchám. Redukovaný příjem bílkovin u těchto nemocných může ovlivnit progresi renální insuficience včetně imunologické aktivity onemocnění a snížit proteinurii (19).
Nemocným s hodnotou sérového kreatininu 150–200 μmol/l podáváme dietu obsahující 0,8–1,0 g bílkovin/kg/den a při sérovém kreatininu 250–400 μmol/l 0,7–0,8 g bílkovin/kg/den, kterou vždy doplňujeme množstvím proteinu odpovídajícímu proteinurii. Energetická hodnota diety činí minimálně 130–140 kJ/kg/den. Často doplňujeme dietu podáváním enterální výživy ve formě sippingu či u indikovaných nemocných ve stadiu snížení funkce ledvin CKD 3 b-4 ketoanalogy esenciálních aminokyselin.
V počátečních stadiích léčby, především při velkých otocích, se často neubráníme současnému podávání albuminu a diuretik. Příjem sodíku upravujeme dle aktuálního stavu (otoky, TK, účinek diuretik). Vzhledem k závažné poruše lipidového metabolismu má podávaná dieta upraveno složení sacharidů a lipidů. Při pokročilé renální insuficienci klesá s úbytkem renálních funkcí i proteinurie. Je‑li vyrovnaný metabolický stav, lze pak individuálně u těchto nemocných podávat i modifikovanou nízkobílkovinnou dietu s ketoanalogy es. aminokyselin. Porucha metabolismu lipidů však i přes léčbu většinou zůstává často zachována a tito nemocní jsou ohroženi aterogenními komplikacemi.
Nedílnou součástí péče o nemocné s chronickým selháním ledvin je správná léčba ostatních poruch, významně ovlivňujících další osud nemocných (hypertenze, močová infekce, městnání v dutém systému apod.)
Při déletrvajícím NS může vzniknout řada klinických syndromů: nutriční deficience zahrnující proteinovou malnutrici podobající se kwashiorkoru, zvýšená lámavost nehtů a vlasů, alopecie, retardovaný růst, demineralizace kostí, glykosurie, různé typy aminoacidurií, syndromy spojené s deplecí kalia, myopatie, snížená hladina kalcia, tetanie a hypometabolismus.
Nefrotický syndrom při diabetu
Onemocnění ledvin je u nemocných s diabetem časté a nefrotický syndrom při diabetu je nejčastější příčinou nefrotického syndromu u dospělých (20).
Diabetes je komplexní metabolické onemocnění postihující více orgánových systémů, především srdce, cévy, ledviny, nervový systém a oči. Pro postižení ledvin je typická forma diabetické nefropatie (DN). DN je mikroangiopatická komplikace diabetu charakterizovaná postižením glomerulů, tubulů a mezangia spojeného se zbytněním bazální membrány, expanzí mezangia a hyalinizací interkapilárního pojiva glomerulů. Glomeruloskleróza se může vyskytovat ve formě nodulární, nebo difuzní. Její vznik souvisí s dlouhodobou hyperglykemií.
Z hlediska závažnosti stojí na prvním místě diabetická nefropatie. Velmi časté jsou i komplikace způsobené cévními změnami souvisejícími s hypertenzí a častou aterosklerózou (makroangiopatie). Významné jsou i infekce ledvin a močových cest. Závažnost chronického selhání ledvin u diabetiků je zřejmá i z toho, že podíl diabetiků z celkového počtu dialyzovaných nemocných činí v ČR již více než 40 % a toto procento dále stoupá se zvyšujícím se věkem nemocných.
Prevalence a etiologie
K rozvoji diabetické nefropatie dochází až u 30 % nemocných s diabetem (DM) 1. typu, častěji u mužů, u nichž se diabetes objevil před 15. rokem věku. U jedinců s diabetem 2. typu činí prevalence onemocnění také mezi 20–30 %. Tito nemocní mají často i další orgánové komplikace (především ICHS).
V etiopatogenezi diabetické mikroangiopatie se uplatňuje řada faktorů. V současné době se přisuzuje velký význam skutečnosti, že dlouhodobá hyperglykemie vede k vzestupu množství glykoproteinů v bazální membráně glomerulů, ale i tubulů a mezangiální matrix (neenzymatická glykace). Tím dochází postupně ke ztluštění bazální membrány a expanzi mezangia. Zřejmě se uplatňují i další mechanismy metabolické (enzymatická redukce glukózy za vzniku vysoké intracelulární koncentrace sorbitolu a jeho nepříznivý účinek na buňky, přímý toxický účinek vysokých koncentrací glukózy na buňky či změny v biosyntéze extracelulární matrix). Velký význam mají i změny hemodynamické (zvýšený intraglomerulární tlak a nepochybně přispívají i faktory genetické) (21).
Klinický průběh a prognóza
Včasná diagnostika latentní preklinické fáze onemocnění má zásadní význam pro další osud nemocných. Účinná a dlouhodobá úprava hyperglykemie, dietní režim s edukací nemocných a včasné ovlivnění intraglomerulární hypertenze zpomalují či přechodně zastavují rozvoj diabetické nefropatie.
Na základě klinických a laboratorních nálezů můžeme vznik a rozvoj diabetické nefropatie rozdělit do několika stadií.
I. stadium latentní (hyperfiltračně‑hypertrofické)
Toto stadium – potencionálně reverzibilní – je charakterizováno zvýšením glomerulární filtrace o 10–40 % ve srovnání s hodnotami zdravých osob stejné věkové kategorie. Současně je zvýšen i průtok plazmy ledvinami a sonograficky prokazatelné zvětšení ledvin. Histologicky nalézáme zvětšené glomeruly s dilatací kapilárních kliček. Objevuje se transientní (přechodná) mikroalbuminurie 20–70 μg/min, respektive 30–100 mg/den. Ke konci tohoto stadia trvajícího v průměru 5–8 let u některých nemocných klesá glomerulární filtrace k normálním hodnotám. Může být i nízká mikroalbuminurie (20–40 μg/min). Objevují se však již první morfologické změny charakterizované nevelkým ztluštěním bazální membrány.
II. stadium (incipientní diabetická nefropatie)
Stadium je charakterizováno perzistentní (trvalou) mikroalbuminurií v rozmezí 20–200 μg/min, což odpovídá hodnotě vyloučeného albuminu 30–300 mg/den. Glomerulární filtrace klesá k normálním hodnotám a posléze i sníženým. Významně často se objevuje hypertenze (především diastolická). Morfologicky progreduje ztluštění bazální membrány glomerulů (i tubulů) s expanzí mezangia a následnou okluzí glomerulárních kliček.
Stadium trvá v průměru kolem 10 roků a přechází plynule do stadia manifestní nefropatie.
III. stadium (manifestní diabetická nefropatie)
Pro třetí stadium diabetické nefropatie je charakteristický již rozvoj proteinurie větší než 0,5 g/den vedoucí až k rozvoji nefrotického syndromu. Dochází k postupné progresi renálního postižení a míra kompenzace diabetu v této fázi již zřejmě není pro rychlost poklesu glomerulární filtrace rozhodující. Výsledky řady studií na druhé straně prokazují, že důsledná léčba hypertenze a nízkoproteinová dieta mohou i zde významně zmírnit progresi renální insuficience. Průměrná doba poklesu glomerulární filtrace od prvního průkazu proteinurie (nad 0,5 g/den) do terminálního stadia trvá v průměru 3–7 let. Pro manifestní formu diabetické nefropatie je charakteristické též většinou trvalé závažné zvýšení systémového krevního tlaku. Morfologicky dále progredují změny v ledvinách vedoucí ke konečné sklerotizaci většiny glomerulů.
IV. stadium (chronická renální insuficience a selhání)
Terminální fáze tohoto stadia s možným rozvojem uremické symptomatologie se objevuje u diabetiků dříve než u nemocných s ostatními nefrologickými chorobami. Proto musí být včas konzultován nefrolog dialyzačního střediska (při sérovém kreatininu nad 200 μmol/l), aby mohl být nemocnému včas založen arteriovenózní zkrat či peritoneální katétr a pravidelné dialyzační léčení zahájeno dle klinického stavu již při sérovém kreatininu 400–500 μmol/l (22).
Léčebná opatření
Je třeba dbát o co nejlepší metabolickou kompenzaci diabetu a zaručit účinnou kontrolu hyperglykemie, v případě potřeby i formou intenzifikovaných inzulinových režimů především u DM 1. typu (glykovaný hemoglobin HbA1c). U diabetu 2. typu volíme perorální antidiabetika či také inzulin, případně v kombinaci. Je třeba upravit dietní režim s ohledem na úroveň snížení renální funkce, kompenzaci diabetu i častou nadváhu. Příjem bílkovin by neměl překročit 0,8 g/kg/den (s přídavkem odpovídajícím velikosti proteinurie). Při dalších metabolických poruchách (především časté hyperlipidemii) je třeba volit individuální dietní postup. Při závažné hyperlipidemii podáváme hypolipidemika, většinou v redukované dávce (statiny či fibráty, eventuálně ezetimib). Nediagnostikovaná a špatně léčená hypertenze je jedním z nejzávažnějších faktorů ovlivňujících progresi mikroangiopatie, kam patři závažná diabetická neuropatie. Mezi nálezem diabetické retinopatie a nefropatie je často korelace a nález na očním pozadí predikuje poškození renální. Je třeba účinně léčit i nemocné s hraničními hodnotami krevního tlaku. V terapii hypertenze patří mezi nejčastěji užívané léky ACE inhibitory, které snižují vedle systémové hypertenze významně i hypertenzi glomerulární (dilatací vas efferens). Současně se snižuje i albumin - či proteinurie. Malé dávky ACE inhibitorů podáváme s cílem ovlivnit intraglomerulární tlak a albuminurii/proteinurii i u normotoniků. Z dalších hypotenziv jsou často podávány i jako léky první volby sartany (blokátory AT1 receptoru pro angiotenzin II), které nemají některé nežádoucí účinky (především kašel). Dále jsou užívána diuretika a blokátory kalciového kanálu, ß‑blokátory nejlépe kardioselektivní, aby se předešlo případné hypoglykemii), centrální/periferní sympatolytika a přímá vazodilatancia.
Je nutné pečlivě léčit každou interkurentní infekci. Dávkování léčiv je třeba upravit s ohledem na úroveň renální funkce. Při renálním selhání je nutné včas zahájit dialyzační léčbu (hemodialýza či PD). Indikovaní nemocní by měli být co nejdříve transplantováni (transplantace segmentu pankreatu a ledviny u DM 1 či samotné ledviny u DM 2) (23).
Nové léčebné postupy v prevenci rozvoje NS při diabetu
Do metabolismu glukózy zasahují ledviny třemi způsoby, které jsou tyto:
1. filtrace a reabsorpce glukózy v nefronu,
2. glukoneogeneze,
3. utilizace glukózy ledvinami.
Mechanismus renálního účinku gliflozinů
Základním mechanismem účinku gliflozinů je inhibice transportu glukózy z primární moče do buněk proximálního tubulu, který se děje prostřednictvím transportéru SGLT2, lokalizovaném v S1 segmentu proximálního tubulu ledvin. Působením SGLT2 inhibitorů dochází k inhibici reabsorpce glukózy v proximálním tubulu s navozením glykosurie, doprovázené současně natriurézou a osmotickou diurézou. Efekt je nezávislý na účinku inzulinu a není spojen se zvýšeným rizikem hypoglykemie. Účinnost gliflozinů na snížení glykemie je proporcionální k úrovni glomerulární filtrace, s klesajícím farmakodynamickým účinkem u pacientů se středním stupněm renální dysfunkce (eGFR 0,5–1,0 ml/s/1,73 m2) a se ztrátou antidiabetického účinku při eGFR < 0,5 ml/s/1,73 m2 (24).
Naproti tomu efekty gliflozinů vázané na natriurézu jsou zachovány ve všech stadiích renální insuficience. Zahrnují účinky na tradiční rizikové faktory KV onemocnění – tj. na pokles krevního tlaku, tělesné hmotnosti a urikemie. U diabetiků 2. typu je jejich podávání spojováno s poklesem systolického krevního tlaku o 3–5 mm Hg a diastolického tlaku o 1–2 mm Hg, bez ovlivnění již užívanou, přidruženou antihypertenzní medikací. Účinek na redukci tělesné hmotnosti začíná po 3 dnech od zahájení léčby pravděpodobně v důsledku zvýšení diurézy a mírné redukce plazmatického objemu (25).
Nefroprotektivní účinky gliflozinů
Hlavní renoprotektivní účinek gliflozinů je založen na obnovení tubuloglomerulárního feedbacku – autoregulační zpětné vazby, při které je za fyziologických podmínek GFR navzdory malým výkyvům v krevním tlaku a plazmatického objemu udržována v relativně konstantní úrovni. Působením SGLT2 inhibitorů dochází ke zvýšení dostupnosti sodíku v distálním tubulu, oblast macula densa vnímá pak tuto zvýšenou nabídku a obnovuje tubuloglomerulární zpětnou vazbu navozením vazokonstrikce aferentní arterioly. Tímto mechanismem dochází k žádanému poklesu intraglomerulárního tlaku a glomerulární hypertenze (26, 27).
Významnou studií k potvrzení renoprotektivních účinků gliflozinů u diabetiků přestavuje studie CREDENCE (The Canagliflozin and Renal Endpoints in Diabetes with Established Nephropathy Clinical Evaluation), publikovaná v r. 2019, jež měla za primární renální cílové parametry definováno zdvojnásobení hladiny kreatininu, riziko terminálního selhání ledvin, úmrtí z renálních nebo kardiovaskulárních příčin a do které byli zařazeni pacienti s DM 2. typu s vysokým renálním rizikem (téměř 60 % účastníků studie mělo eGFR < 1,0 ml/s/1,73 m2, UACR – poměr albumin/kreatinin v moči > 300 mg/g). U léčených pacientů se prokázalo snížení rizika kombinovaného renálního ukazatele o 30 % (28).
První průlomové výsledky ve smyslu renoprotektivního efektu i u nediabetických nefropatií přinesla studie DAPA‑CKD, jejíž výsledky byly publikovány v r. 2020. Šlo o multicentrickou, randomizovanou, dvojitě zaslepenou studiu, která zařadila 4 304 pacientů a ve které dapagliflozin (10 mg) v porovnání s placebem snížil u pacientů s CKD stadia 2–4 nezávisle na přítomnosti DM 2. typu léčených ACEi nebo ARB riziko zhoršení renálních funkcí a úmrtí z kardiovaskulárních nebo renálních příčin o 39 %. Studie také prokázala snížení celkové mortality o 31 % (29).
Glifloziny mají také velmi významný kardioprotektivní efekt (30), který souběžně zlepšuje prognózu s kardiorenálním sydromem typu 5 u diabetu.
Při intoleranci SGLT2 inhibitorů lze s úspěchem užít GLP-1 RA.
Závěr
Nefrotický syndrom (NS) je charakterizován velkou proteinurií (nad 3,5 g/24 h), hypalbuminemií, generalizovanými otoky, hyperlipidemií a poruchami koagulace. Vedle příčin primárně nefrologických (glomerulonefritidy) je spojen s glomerulopatiemi při diabetu, amyloidóze, systémových chorobách, leukemiích, poškozením léky a drogami, poškozeními při alergiích, infekcích a příčinami hereditárními. Častou komplikací je malnutrice a vysoké riziko trombóz velkých žil často s anémií. Léčba je závislá na základním onemocnění často zjištěném až při renální biopsii.Pro poruchu vazebné kapacity a transportu může být porušena účinnost léků. Diabetes mellitus (DM) je nejčastější příčinou NS u dospělých.Jde o komplexní chronické metabolické onemocnění spojené s postižením makro - a mikrovaskulárním. Závažnost chronického selhání ledvin u diabetiků je taková, že podíl diabetiků v celkovém počtu dialyzovaných v ČR činí více než 40 %. V poslední době je velká pozornost věnována gliflozinům (SGLT2 inhibitory), které mají prokazatelně nefroprotektivní účinky. Glifloziny vedou k navozením glykosurie, doprovázené současně natriurézou a osmotickou diurézou. Účinnost gliflozinů na snížení glykemie je proporcionální k úrovni glomerulární filtrace, zatímco efekty vázané na natriurézu jsou zachovány ve všech stadiích renální insuficience.
Článek přijat redakcí: 14. 3. 2023
Článek přijat po recenzích: 17. 4. 2023
prof. MUDr. Vladimír Teplan, DrSc.
Interní a kardiologická klinika, Fakultní nemocnice Ostrava a LF Ostravské univerzity
Sources
1. Teplan V, et al. Praktická nefrologie, Grada Publishing, Praha. 2006.
2. Wang CS,Greenbaum LA. Nephrotic syndrome.Pediatr Clin North Am. 2019;66(1):73-85.
3. Downie ML, Gallibois C,Parekh RS, Noone DG.Nephrotic syndrome in intants and childre: pathyophysiology and management.Paediatr Int Child Health. 2017;37(4):248-258.
4. Václavík J. Dyslipidemia and hypertension – what to worry about more? Vnitř Lék. Spring 2018;(4):395-401.
5. Politano SA,Colbert GB,Hamiduzzaman N. Nephrotic syndrome. Prim Care. 2020;47(4):597-613.
6. Noone DG, Iijima K, Parekh R. Idiopathic nephrotic syndrome in children. Lancet. 2018;392(10):61-74.
7. Saleem MA. Molecular stratification of idiopathic nephrotic syndrome. Nat Rev Nephrol. 2019;15(12):750-765.
8. Kodnesr C. Diagnosis and management of nephrotic syndrome in adults. AmFamPhysician. 2016;93(6):479-485.
9. Siddall EC, Radhakrishan J. The pathophysiology of edema formation in the nephrotic syndrome. Kidney Int. 2012;82(6):635-642.
10. Teplan V. Nefrotický syndrom, in V. Teplan a kol. Metabolismus a ledviny Grada Avicenum Praha 2000 : 249-255.
11. Iijima K, Sako M, Nozu P. Rituximab for nephrotic syndrome in childre. Clin Exp Nephrol. 20187;21(2):193-202.
12. Meena J, Bagga A. Current perspectives in management of edema in nephrotic syndrome. Indian J Pediatr. 2022;87(8):633-640.
13. Vaziri ND. Disorders of lipid metabolism in nephrotic syndrome: mechamisms and consequences. Kidney Int. 2016;90(1):41-52.
14. Seigneux S, Martin PY. Management of patients with nephrotic syndrome. Swiss Med Wkly. 2009;139(29-30):410-422.
15. Rovin BH,Adler SG,Barrat J, et al.Executive summary of the KDIGO 2021 for management of glomerular disease. Kidney Int 2021;100 : 753-779
16. Hoorn EJ, Ellison DH. Diuretic resistence. Am J Kidney, DiS. 2017;69(1):136-142.
17. Duffy M, Jain S, Harrel N, et al. Albumin and Furosemide Combination for management of edema in nephrotic syndrome : a review of clinical studies. Cells. 2015;4 : 622-630.
18. Derebail VK, Rheault MN, Kerlin BA. Role of direct anticoagulants in patients with kidney disease. Kidney Int. 2020;97(4):664-675.
19. Teplan V,Mengerová O. Dieta a nutriční opatření u chorob ledvin a močových cest. Mladá fronta ed. Aesculap, Praha 2010.
20. Stoycheff N, Stevens LA,Schmid C, et al. Nephrotic syndrome in diabetic kidney disease : an evaluation and update of the definition.Am J Kidney, DiS. 2009;54(5):840-849.
21. Buse JB, Wexler DJ, Tsapas A, et al. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2020;43(2):487-493.
22. Ceriello A, Prattichizzo F, Phillip M, Hirsch IB, Mathieu C, Battelino T. Glycaemic management in diabetes: old and new approaches. Lancet Diabetes Endocrinol. 2022;10(1):75-84.
23. de Boer IH, Caramori ML, Chan JCN, et al. Executive summary of the 2020 KDIGO Diabetes Management in CKD Guideline: evidence‑based advances in monitoring and treatment. Kidney Int. 2020;98 : 839-848.
24. Neuen BL, Jardine MJ, Perkovic V. Sodium‑glucose cotransporter 2 inhibition: which patient with chronic kidney should be treated in the future? Nephrol Dial Transplant. 2020;35:i48–i55.
25. Imai T, Akimoto T, Ito C, et al. Management of diabetes associated with nephrotic syndrome : therapeutic potential of dapagliflozin for protracted volume retention. Drug Target Insights. 2015;9 : 29-31.
26. Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016;375(4):323-334.
27. van Bommel EJM,Muskiet MHA,Tonneijick L et al. SGLT2 inhibition in the diabetic kidney – from mechanism to clinical outcome.Cli j Am Soc Nephrol. 2017;12(4):700-710.
28. Perkovic V, Jardine MJ, Neal B, et al. CREDENCE Trial Ivestigators. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med. 2019;380(24):2295-2306.
29. Heerspink HJL, Stefansson BV,Correa‑Rottwe J, et al. Dapagliflozin in patients with chronic kidnery disease.N Engl j Med. 2020;383(15):1436-1446.
30. Zavačová D, Václavík J. SGLT2 inhibiotors – a new pillar for the treatment of heart failure. Vnitř Lék. 2021;67(8):475-478.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2023 Issue 3-
All articles in this issue
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Perioperative care about a patient with multimorbidity
- Multimorbidity in nephrotic syndrome
- Critical care for multimorbid patients
- Clinical assessment and management of patients with multimorbidity
- JAK inhibition in the treatment of inflammatory rheumatic diseases
- Effect of sodium-glucose co-transporter-2 inhibitor empagliflozin on disease progression in a patient with heart failure and preserved ejection fraction
- Differential diagnostics of interstitial lung diseases
- News in gastroenterology, hepatology and digestive endoscopy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Differential diagnostics of interstitial lung diseases
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Multimorbidity in nephrotic syndrome
- Critical care for multimorbid patients
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

