-
Medical journals
- Career
Novinky v diagnostice a léčbě kardiomyopatií
Authors: Hana Poloczková 1; Tomáš Honek 1; MUDr. Anna Chaloupka, Ph.D. 1; Lukáš Opatřil 1,2; Mária Bakošová 1; Jan Krejčí 1
Authors‘ workplace: I. interní kardioangiologická klinika Fakultní nemocnice u sv. Anny v Brně, a Lékařské fakulty Masarykovy univerzity 1; Mezinárodní centrum klinického výzkumu Fakultní nemocnice u sv. Anny v Brně 2
Published in: Vnitř Lék 2023; 69(2): 89-104
Category: Main Topic
doi: https://doi.org/10.36290/vnl.2023.016Overview
Kardiomyopatie jsou definovány jako onemocnění srdečního svalu, která vedou k poruše jeho struktury a funkce a nejsou způsobena jinou příčinou (ischemickou chorobou srdeční, hypertenzí, chlopenní či vrozenou srdeční vadou). Podle fenotypového vyjádření je rozdělujeme na dilatační, hypertrofické, restriktivní, arytmogenní a zvláštní skupinu představují tzv. neklasifikované kardiomyopatie, mezi něž je řazena nonkompaktní kardiomyopatie a takotsubo kardiomyopatie. Pod stejným fenotypovým vyjádřením se mohou skrývat etiologicky odlišné formy onemocnění a současně se fenotypové vyjádření může u řady kardiomyopatií v průběhu vývoje onemocnění měnit. U každého typu kardiomyopatie dále rozlišujeme formu familiární (geneticky podmíněnou) a získanou. Klinicky se onemocnění manifestuje především symptomy srdečního selhání, ať s redukovanou, mírně sníženou či zachovanou ejekční frakcí, příznaky plynoucími z řady arytmií, přítomny mohou být projevy extrakardiální, v některých případech však nemusí být po relativně dlouhou dobu symptomy vyjádřeny. Pokud není onemocnění včas rozpoznáno a léčeno, může vést k významné morbiditě a mortalitě, a to zejména u mladých osob, jež kardiomyopatie často postihují. Díky rozvoji řady diagnostických a terapeutických metod došlo v posledních letech k významnému posunu v diagnostice i léčbě řady kardiomyopatií, a tím i zlepšení prognózy nemocných.
Klíčová slova:
genetické testování – srdeční selhání – magnetická rezonance – kardiomyopatie
Úvod
Kardiomyopatie jsou nesmírně heterogenní skupinou onemocnění vedoucích k širokému spektru symptomů s odlišným klinickým obrazem. Sama definice kardiomyopatií se postupně vyvíjí, tak jak se prohlubují naše poznatky o jejich patofyziologii – u řady z nich, dříve označovaných jako „idiopatické“, byly objeveny genetické či metabolické příčiny, byly popsány přechody jednotlivého fenotypu do jiného, byl identifikován genotypově‑fenotypový překryv, což vše vede k určité míře nejistoty v tom, jak bychom k celé skupině kardiomyopatií měli přistupovat.
Když budeme hledat optimální definici „kardiomyopatie“, zdá se stále jako nejvhodnější ta, kterou již v roce 2008 použil P. Elliot a která hovoří o kardiomyopatiích jako o onemocněních srdečního svalu vedoucích k jeho strukturálním či funkčním poruchám, při nichž jako příčinu vyloučíme ischemickou chorobu srdeční, hypertenzi a/nebo chlopenní či vrozené srdeční vady (1).
Nejčastějšími klinickými projevy bývají symptomy srdečního selhání, ať s redukovanou, mírně sníženou či zachovanou ejekční frakcí levé komory, dále se často objevují poruchy srdečního rytmu, které jsou pro obraz některých kardiomyopatií zcela určující a které jsou také z hlediska prognózy velké části kardiomyopatií zásadní. V některých případech ale mohou nemocné k lékaři přivést bolesti na hrudi, námahové synkopy či dokonce extrakardiální projevy, které mohou být patofyziologicky s některými kardiomyopatiemi propojeny a které nás přivedou k pátrání po přítomnosti poruchy srdečního svalu.
Základem diagnostiky drtivé většiny kardiomyopatií je jejich morfologická charakteristika při vyšetření některou ze zobrazovacích metod, což je obvykle echokardiografie. Právě proto se stále nejčastěji používá klasifikace kardiomyopatií vycházející z jejich fenotypu, přestože byla činěna snaha jako základní diskriminátor použít např. genotyp či přítomnost arytmií (2). Samozřejmě tyto parametry mohou být při stanovení definitivní diagnózy velmi nápomocné, podobně jako specifické laboratorní nálezy, histologická či imunohistochemická charakteristika vzorků myokardu získaných pomocí endomyokardiální biopsie či využití dalších zobrazovacích metod přesahujících pouhou morfologickou charakteristiku srdečního svalu.
Za základní typy kardiomyopatií dnes považujeme dilatační kardiomyopatii, hypertrofickou kardiomyopatii, arytmogenní kardiomyopatii a restriktivní kardiomyopatii. Do kategorie tzv. neklasifikovaných kardiomyopatií potom řadíme např. nonkompaktní kardiomyopatii a takotsubo kardiomyopatii (někdy označovanou jako takotsubo syndrom) (Obr. 1). V jednotlivých kapitolách tohoto textu se pokusíme přiblížit vám novinky u jednotlivých konkrétních typů či podtypů kardiomyopatií.
Image 1. Klasifikace kardiomyopatií Evropské kardiologické společnosti z roku 2008. Upraveno podle (1) 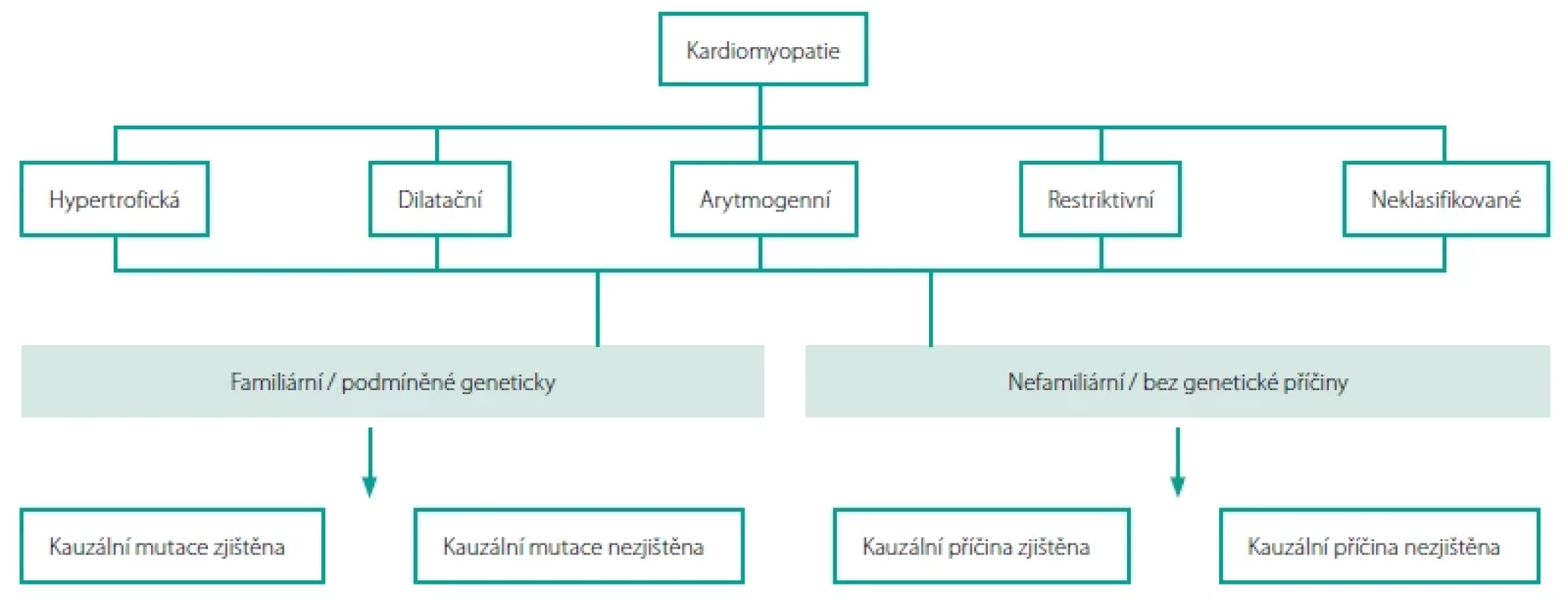
Cílem tohoto textu nemůže být komplexní vyčerpávající pohled na celou problematiku kardiomyopatií. Jeho ambicí je ukázat nové diagnostické přístupy, které nám v narůstajícím procentu případů umožní přesnou a detailní diagnostiku. Základním a mimořádně důležitým momentem, který musíme při diagnostice kardiomyopatií mít vždy na mysli, je skutečnost, že pod jedním kardiomyopatickým fenotypem se může skrývat řada etiologicky, klinicky, prognosticky a terapeuticky odlišných onemocnění. Jejich identifikace je tím důležitější, že se objevily a objevují nové specificky cílené terapeutické možnosti pro konkrétní etiologické podtypy toho či onoho fenotypu kardiomyopatie. Nejde tedy o „diagnózu pro diagnózu“, ale o otevření cesty ke zcela praktickým krokům v péči o nemocné, které jsou spojeny se zlepšením klinického stavu i prognózy nemocných s kardiomyopatiemi. V neposlední řadě chceme ukázat možnosti moderní nefarmakologické léčby, která v léčbě kardiomyopatií hraje významnou roli.
Diagnostika
Jak již bylo zmíněno v úvodu, je to zejména rozvoj diagnostických metod, který v posledních letech umožnil detailnější odlišení jednotlivých typů kardiomyopatií a v řadě případů také včasnější stanovení diagnózy u dosud asymptomatických jedinců či přesnější stratifikaci rizika nemocných. V tomto ohledu se jedná především o rozšíření možností neinvazivní diagnostiky při využití magnetické rezonance, diagnostiky v oblasti genetické analýzy a v rámci invazivní diagnostiky zaznamenáváme především posun v indikaci k provádění endomyokardiálních biopsií.
Magnetická rezonance srdce (MRI) patří mezi nejmodernější zobrazovací metody v kardiologii. I když je MRI zlatým standardem v měření objemů, funkce i masy levé komory (LK), její nezastupitelnost je především v možnostech zobrazení strukturálních vlastností myokardu, především detekce edému, jizvy či fibrotizace pomocí techniky pozdního sycení (LGE) a také akumulace různých substancí jako například amyloidu, tuku nebo železa (3). Důležitou novinkou je T1 mapping myokardu, pomocí kterého lze vypočítat extracelulární volum (ECV) myokardu popisující množství mezibuněčné hmoty a odhadnout i difuzní fibrózu myokardu. Další velkou výhodou je absence ionizujícího záření při vyšetření. Jako vše má i MRI své nevýhody – především cenu, náročnost, délku vyšetření a omezenou výtěžnost u pacientů po implantaci kardiostimulátorů či implantabilních kardioverterů‑defibrilátorů (ICD). I přes uvedená omezení se jedná o nezastupitelnou metodu, jejíž dostupnost se v posledních letech významně zvýšila.
Další významný posun se týká genetického testování, které hraje v současné diagnostice kardiomyopatií nezastupitelnou roli. Již samotná klasifikace kardiomyopatií dělí jednotlivé fenotypové podtypy na familiární (dědičné) a nefamiliární (nedědičné formy) (1). Jako familiární (geneticky podmíněné) jsou označovány případy, kdy se kardiomyopatie vyskytuje u alespoň dvou členů rodiny, nebo je rodinná anamnéza pacienta s dokumentovaným příbuzným zemřelým náhlou srdeční smrtí (NSS) před 35. rokem věku. Řadí se sem i pacienti s de‑novo zjištěnými patogenními variantami, neboť tyto mohou být dále přeneseny na jejich potomky. Prevalence záchytu příčinných patogenních variant je u jednotlivých kardiomyopatií variabilní, u pacientů s familiárním výskytem může u hypertrofické kardiomyopatie (HCM) dosahovat až 60 %, u dilatační kardiomyopatie (DCM) se pohybuje kolem 30–40 %. Odhalení patogenní varianty umožňuje identifikaci rizikových jedinců ještě před rozvojem klinického obrazu, řídí doporučení stran úpravy životního stylu (například zákaz závodního sportu u arytmogenní kardiomyopatie), poskytuje možnost preimplantační diagnostiky, zpřesňuje predikci prognózy, a v neposlední řadě otevírá nové možnosti terapeutické – profylaktickou implantaci ICD u pacientů s rizikem náhlé srdeční smrti a recentně také nové terapeutické přístupy zahrnující malé molekuly a genovou terapii, které mají potenciál zcela transformovat klinickou péči o tyto pacienty.
Dle doporučených postupů ESC pro diagnostiku a léčbu srdečního selhání je v diagnostice hypertrofické, dilatační i arytmogenní kardiomyopatie doporučeno genetické testování, a to u všech pacientů s potvrzenou diagnózou a u prvostupňových příbuzných pacientů s kauzální mutací, nezávisle na fenotypu (4). Pokud není identifikována patogenní mutace či není genetické vyšetření provedeno, měli by tito příbuzní opakovaně podstupovat opakované kardiologické vyšetření v 2–5letých intervalech.
V současnosti se ke genetickému vyšetření nejčastěji využívají vysokokapacitní metody sekvenování nové generace (NGS), které umožňují sekvenovat předem vybrané soubory genů (panely), celý exom či dokonce celý genom. Se zvyšující se dostupností genetického testování a počtem popsaných variant se nejproblematičtějším bodem stává interpretace výsledků těchto analýz. Většina kardiomyopatií se totiž vyznačuje výraznou genotypovou heterogenitou, neúplnou penetrancí a variabilní expresivitou. Proto je ve správné klinické a genetické korelaci a managementu péče zcela zásadní spolupráce erudovaného kardiologa, klinického genetika, pacientů a jejich rodin (5). Typické rodokmeny rodin s jednotlivými typy dědičnosti ukazuje obrázek 2.
Image 2. Typické rodokmeny rodin s různými druhy dědičnosti. A – autozomálně dominantní typ dědičnosti, B – autozomálně recesivní typ a C – X-vázaný typ dědičnosti. Pacient je označen černě, přenašeč mutace/varianty je označen částečným zabarvením obrazce 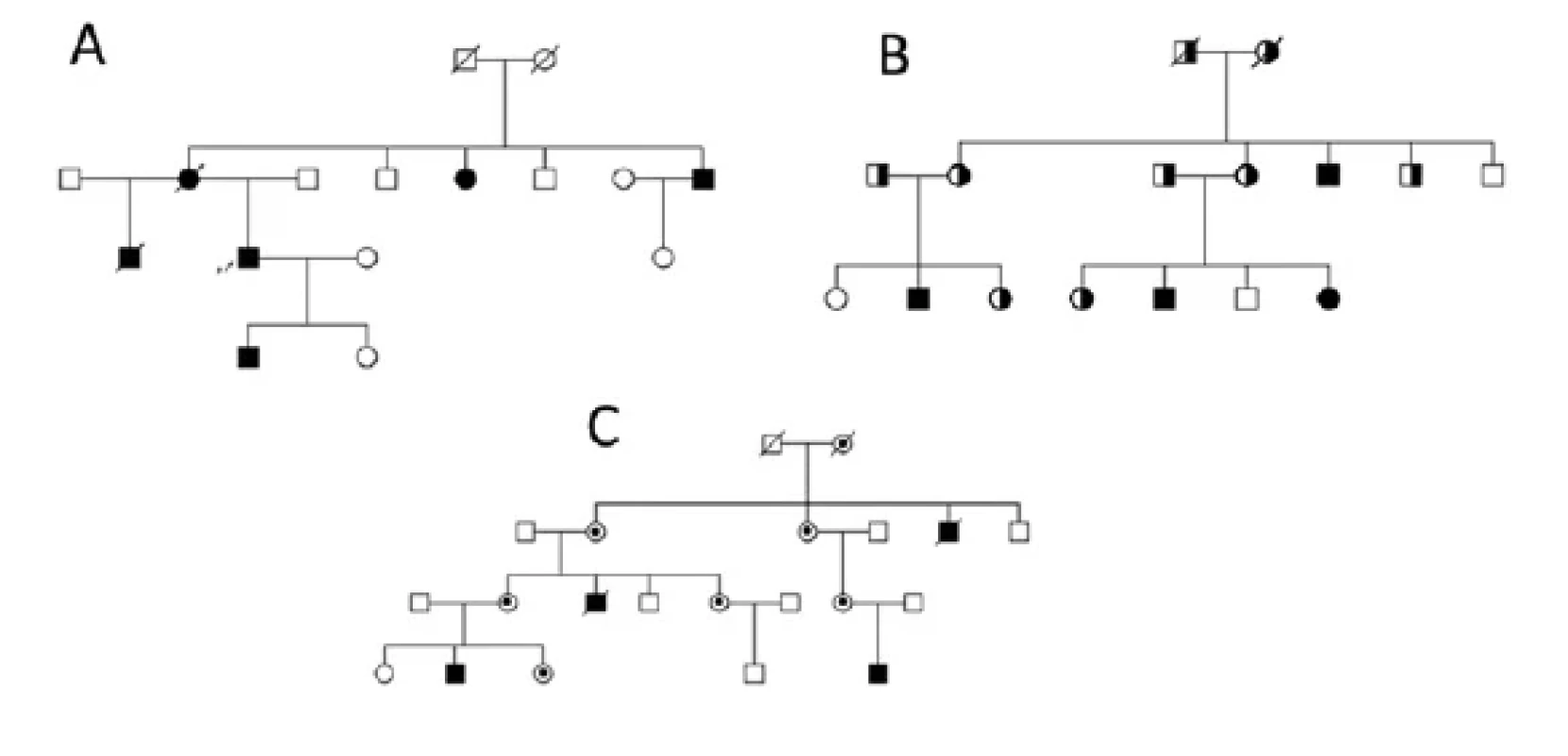
V případech, kdy provedená neinvazivní vyšetření nepřinesou v pátrání po příčině onemocnění očekávaný výsledek, může být indikováno provedení endomykardiální biopsie (EMB) (6) (Obr. 3). Jedná se zejména o diagnostiku střádavých a infiltrativních onemocnění, jež mohou být fenotypově vyjádřena jako restriktivní nebo hypertrofická KMP. Další z indikací je recentně vzniklá dilatační KMP s projevy srdečního selhání nereagující na terapii či akutní srdeční selhání vzniklé v souvislosti s podáním chech‑point inhibitorů v rámci onkologikcé léčby. Indikací k provedení EMB jsou dále nově vzniklé klinicky významné poruchy srdečního rytmu (významné bradykardie, převodní poruchy a komorové arytmie) neovlivnitelné terapií po vyloučení jiné příčiny arytmie. Méně častou indikací jsou autoimunitní onemocnění (systémový lupus erytomatodes, revmatoidní artritida, systémová skleróza, polymyozitida) s projevy progredujícího srdečního selhání nebo významnými arytmiemi nereagujícími na obvyklou terapii (6, 7). „Position statement“ pracovní skupiny pro choroby myokardu a perikardu Evropské kardiologické společnosti (ESC) pro diagnostiku a léčbu myokarditidy z roku 2013 doporučoval provedení EMB vždy při podezření na zánět srdečního svalu (myokarditidu), EMB tak byla považována za „zlatý standard“ v diagnostice tohoto onemocnění (8). Aktuální stanovisko k provádění endomyokardiálních biopsií z roku 2021 doporučuje v současné době provedení EMB v diagnostice myokarditidy u nemocných s akutním až fulminantním průběhem onemocnění, s hemodynamickou nestabilitou a/nebo přítomností závažných arytmií, kde je nutné zavedení rychlé a účinné terapie (6, 7).
Image 3. Endomyokardiální biopsie pod echokardiografickou kontrolou. Apikální čtyřdutinová projekce, bioptom směřující do hrotu pravé komory 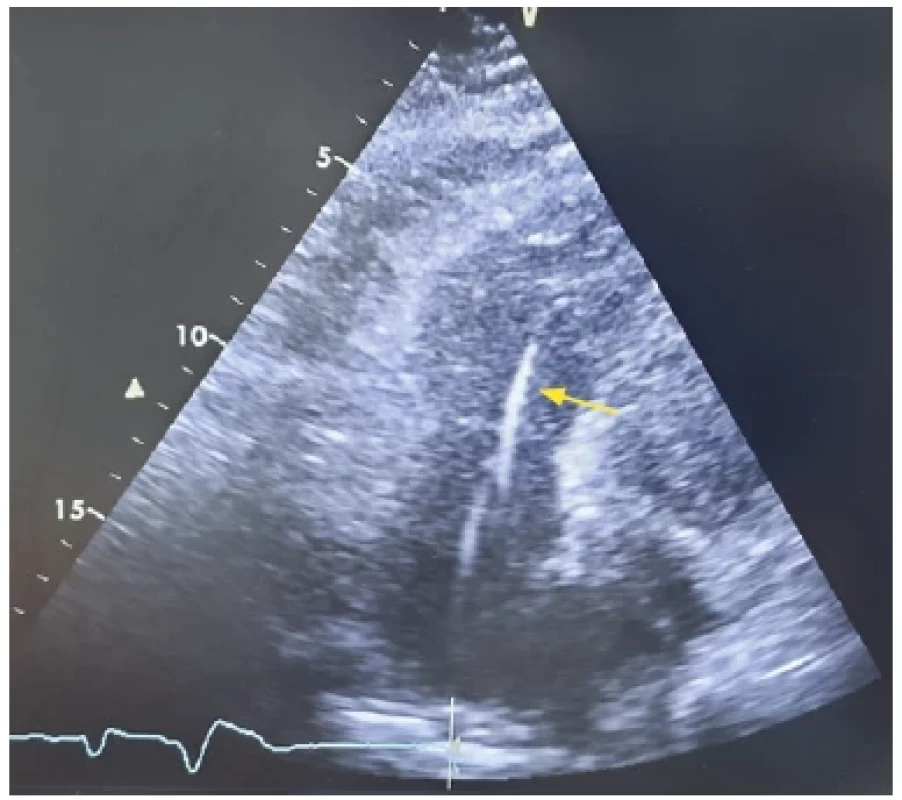
Hypertrofická kardiomyopatie
Hypertrofická kardiomyopatie (HCM) je charakterizovaná ztluštěním stěn či zvětšením masy myokardu nedilatované levé komory bez přítomnosti vyvolávajících hemodynamických příčin (arteriální hypertenze, chlopenní vady a další) schopných zapříčinit danou míru hypertrofie. Jedná se o jednu z nejčastějších kardiomyopatií vůbec s prevalencí 1 : 500 (0,2 %) v neselektované populaci. HCM patří mezi nejčastější dědičná srdeční onemocnění (až 60 % případů), dědičnost je autozomálně dominantní. Familiární formy HCM zahrnují patogenní varianty genů kódujících sarkomerické proteiny, nejčastěji gen pro těžký řetězec beta‑myosinu – MYH7 (20–25 %), vazebný protein C – MYBPC3 (15–20 %), troponin T – TNNT2 (3–5 %) a troponin I – TNNI3 (1–2 %). Dále se k familiárním formám řadí glykogenózy (Danonova nemoc – LAMP2, Pompeho nemoc – GAA), lysozomální střádavá onemocnění (Anderson‑Fabryho nemoc – GLA), poruchy metabolismu mastných kyselin a syndromická HCM (syndrom Noonanové PTPN11, Friedrichova ataxie – FXN) (1). Vzhledem k relativně nižší heterogenitě genů a variant ve srovnání s jinými kardiomyopatiemi je HCM primárním terapeutickým cílem jak genové terapie, tak nových malých molekul (mavacamtenu a aficamtenu) působících jako inhibitory myosinu. Genetická diagnostika také pomáhá identifikovat tzv. „fenokopie HCM“, u kterých může být využita specifická terapie (například enzymoterapie u Anderson‑Fabryho choroby) nebo indikována časná srdeční transplantace (u Danonovy choroby).
Morfologický obraz HCM je charakterizován hypertrofií stěn LK, nejčastěji mezikomorové přepážky, s tloušťkou stěny LK ≥ 15 mm (Obr. 4), popř. ≥ 13 mm v přítomnosti mutací v genech typických pro HCM či u prvostupňových příbuzných nemocných s HCM. Na základě přítomnosti nitrokomorové obstrukce rozlišujeme dva typy – obstrukční typ s gradientem ve výtokovém traktu LK (LVOTG – left ventricle outflow tract obstruction) ≥ 30 mm Hg (v klidu či po zátěži) a neobstrukční typ s LVOTG < 30 mm Hg (9). Obstrukce vzniká na podkladě zúžení výtokového traktu levé komory při hypertrofii bazální části mezikomorového septa (IVS), hypertrofii papilárních svalů s jejich antero‑apikálním posunem a přítomnosti dopředného pohybu předního cípu mitrální chlopně (SAM – systolic anterior motion) (Obr. 5). Jedná se o obstrukci dynamickou s pozdně systolickým vrcholem (Obr. 6). Přítomnost nitrokomorové obstrukce spolu s diastolickou dysfunkcí jsou jedním z faktorů podílejících se na symptomech pacientů, zejména dušnosti, popř. náhlé srdeční smrti (NSS). Incidence NSS je okolo 1 % za rok a nejohroženější skupinou pacientů jsou dospívající a mladí dospělí, včetně sportovců (až 36 % náhlých úmrtí sportovců je na podkladě HCM) (10).
Image 4. Echokardiografický nález u nemocného s hypertrofickou obstrukční kardiomyopatií. V apikální čtyřdutinové projekci je patrná výrazná hypertrofie mezikomorové přepážky 
Image 5. Echokardiografický nález u nemocného s hypertrofickou obstrukční kardiomyopatií. Barevné dopplerovské mapování zobrazující mitrální regurgitaci vznikající v důsledku dopředného pohybu předního cípu mitrální chlopně (SAM – systolic anterior motion). Regurgitační jet je typicky orientován posterolaterálně 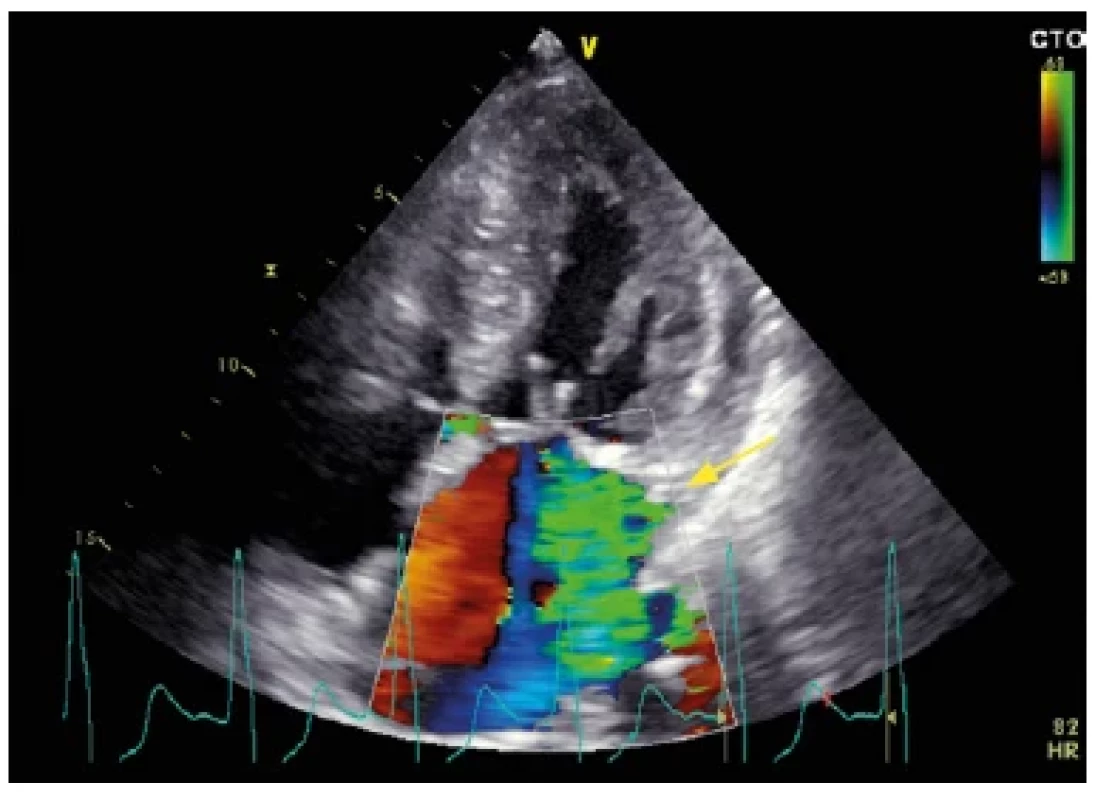
Image 6. Kontinuálně dopplerovský záznam u nemocného s hypertrofickou obstrukční kardiomyopatií. Je patrný vysokorychlostní tok dynamické obstrukce výtokového traktu levé komory. Jedná se o obstrukci dynamickou s pozdně systolickým vrcholem 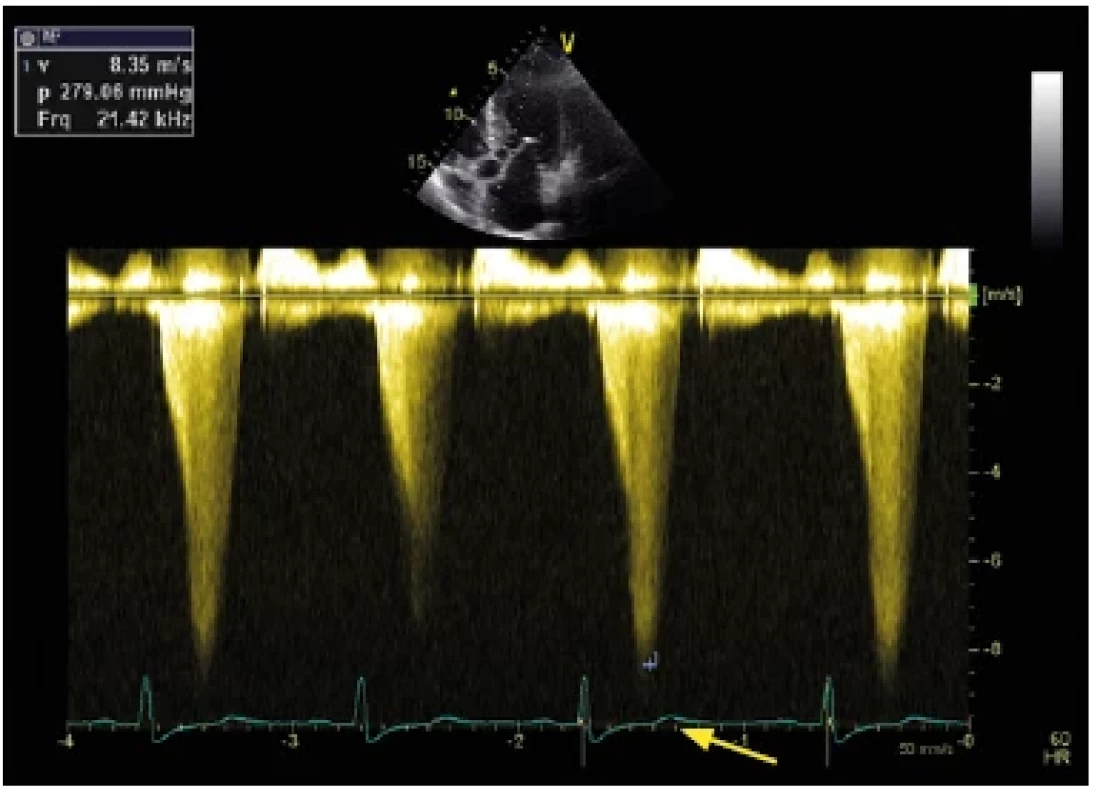
Diagnostika
Základní diagnostickou metodou je echokardiografie, která kromě jiného určí velikost a rozsah hypertrofie, významnost LVOTG či přítomnost SAM. U části pacientů může být tato metoda nevýtěžná z důvodu omezené, respektive špatné vyšetřitelnosti. Zde je pak stěžejní MRI, která umožní tkáňovou charakteristiku myokardu, což je důležité v diferenciální diagnostice k odlišení „prosté“ HCM od jejích fenokopií (střádavá či infiltrativní onemocnění, metabolická onemocnění a další). Pomocí MRI můžeme také přesněji určit fenotypy HCM (apikální, reverzní, sigmoideální), detailněji zhodnotit hypertrofii, výpočítat masu myokardu LK, zobrazit SAM či turbulentní tok v LVOT jako známky obstrukce (11). Pozdní sycení gadoliniem (LGE) jako průkaz fibrózy myokardu je důležité především pro prognostifikaci, neboť u pacientů s pozitivním LGE je popisováno větší množství arytmií či riziko vzniku srdečního selhání (11). Důležitý je také T1 mapping a výpočet extracelulárního objemu, a to především v již výše zmiňované diferenciální diagnostice.
Terapie
Terapii zahajujeme u symptomatických pacientů s přítomnou obstrukcí v LVOT jedním z léků s negativně inotropním účinkem (beta‑blokátory, popř. verapamil) (12). Výše zmíněná farmakologická terapie je zaměřena na symptomatickou úlevu potíží, často se ale jedná o nedostatečnou nebo špatně tolerovanou léčbu. Tyto léky navíc neovlivňují základní podstatu onemocnění, tj. patologicky zesílené interakce aktinu a myosinu zodpovědné za hyperkontraktilitu myofilament. V této oblasti se výrazně nadějným lékem jeví mavacamten, což je selektivní alosterický inhibitor srdeční myosinové ATPázy, jehož podstatou je právě redukce utváření vazeb aktinu a myosinu, a tím oslabení kontraktility, zlepšení relaxace a energetiky myokardu. Příznivé výsledky máme k dispozici z několika klinických studií (PIONEER‑HCM, EXPLORER‑HCM), ve kterých došlo k poklesu LVOTG (klidového i pozátěžového), zlepšení symptomů a zlepšení funkční kapacity při zátěžovém vyšetření. Stejně tak došlo k poklesu hodnoty markeru srdečního selhání (NT‑proBNP) a markeru poškození myokardu (troponin) (13). V echokardiografické podstudii došlo k ústupu SAM a s tím spojené mitrální regurgitace, dále došlo k redukci hypertrofie a zlepšení plnicích tlaků LK a zmenšení objemu levé síně (14). Řada autorů přirovnává účinek mavacamtenu k účinku septální redukční terapie. Léčba mavacamtenem prozatím není schválena a nadále probíhají klinické studie, a to dokonce i u pacientů bez obstrukce v LVOT (MAVERICK‑HCM), u kterých jsou jinak terapeutické možnosti velmi omezené (15). V případě trvání symptomů i přes adekvátně vedenou terapii je u nemocných s perzistujícím významným LVOTG indikována septální redukční terapie. Implantace dvoudutinové kardiostimulace je prakticky opuštěna, má jen své úzké specifické indikace. Rozšířená septální myektomie je jako metoda 1. volby používána především ve Spojených státech. V Evropě je metodou volby alkoholová septální ablace, která byla poprvé provedena v roce 1994 (16). Obě metody mají srovnatelný efekt na redukci LVOTG a zlepšení symptomů, s udávanou periprocedurální mortalitou nižší než 1 % (17). Alkoholová septální ablace je vázána na anatomii koronárních, respektive septálních větví, až u 15 % pacientů je anatomie septálních větví nevhodná či suboptimální s nejistým dopadem na výsledek. Proto u těchto pacientů může být volena endokardiální radiofrekvenční ablace septální hypertrofie (ERASH), která byla poprvé provedena v roce 2004 (18). Podstatou výkonu je radiofrekvenční ablace (RFA) hypertrofického septa pomocí standardního proplachového ablačního katétru většinou z levé komory retrográdním či transseptálním přístupem za podpory 3D elektroanatomického mapovacího systému a za kontroly intrakardiálním ultrazvukem. Dřívější práce také uváděly RFA septa z dutiny pravé komory, zde však byly výsledky suboptimální. Výhodou ERASH je zmapování převodního systému před výkonem, stejně tak vyznačení místa největší hypertrofie, kde je následně aplikována radiofrekvenční energie. Výsledky ohledně poklesu LVOTG, ztenčení IVS a zlepšení symptomů jsou opět příznivé, nicméně aktuálně dostupná data jsou prozatím získána jen z malých souborů pacientů a chybí větší prospektivní randomizované studie, popřípadě srovnávací studie mezi ERASH a ASA. Jedním z bezpečnostních opatření je velikost radiofrekvenční energie, jelikož při vyšších energiích (50, resp. 70 a více Wattů) byl popsán paradoxní nárůst LVOTG z důvodu edému tkáně s následným úmrtím na podkladě úplné obstrukce výtoku LK (19), nicméně při adekvátních energiích je toto riziko zanedbatelné. Výhodou této metody je kratší doba hospitalizace z důvodu nižšího výskytu převodních poruch a také možnost opakování výkonu v jiné části septa.
Co se týče stratifikace rizika náhlé srdeční smrti a případné implantace kardioverteru‑defibrilátoru v rámci primární prevence, byla v průběhu posledních 20 let publikována řada postupů. Evropská a americká doporučení se v tomto směru mírně odlišují. Nejnovější americká doporučení z roku 2020 nadále vycházejí z přítomnosti rizikových faktorů (rodinná anamnéza náhlé srdeční smrti (NSS), hypertrofie LK ≥ 30 mm, synkopa nejasné etiologie, apikální aneuryzma LK, ejekční frakce LK ≤ 50 %) a v případě výskytu alespoň jednoho z nich je implantace ICD indikovaná. V případě záchytu nesetrvalých komorových tachykardií (nsKT) či extenzivního rozsahu fibrózy při magnetické rezonanci (MRI) (≥ 15 % myokardu) je implantace ICD rovněž ke zvážení (20). Evropská doporučení z roku 2014 se zakládají na výpočtu absolutního rizika NSS v nadcházejících 5 letech. Po zadání parametrů (věk, tloušťka IVS, velikost levé síně, maximální LVOTG, výskyt náhlého úmrtí v rodině, synkopa a výskyt komorové tachykardie/nsKT) do kalkulátoru je vypočítáno procentuální riziko NSS i s doporučením případné implantace ICD (21).
Anderson‑Fabryho choroba
Anderson‑Fabryho choroba (AFCH) je vzácné, geneticky podmíněné (X‑vázané) onemocnění způsobené mutací v genu kódujícího alfa galaktozidázu A (AGALA). Deficit AGALA vede k intralysozomální akumulaci neutrálních glykosfingolipidů, dominantně globotriaosylceramidu, v různých tkáních zapříčiňujících jejich strukturální a funkční poškození. Prevalence je přibližně 1 : 40 000. Postižení orgánů je věkově závislé a nejčastěji jsou postiženy periferní a centrální nervový systém, dále kůže, oči, ledviny, gastrointestinální trakt a srdce. Pro srdeční postižení je typický obraz blízký hypertrofické kardiomyopatii při echokardiografickém vyšetření, popř. magnetickou rezonancí, při které je typicky LGE neischemické, mid‑myokardiální, v bazální až střední části inferolaterální stěny LK (nicméně obdobný obraz může být i např. u sarkoidózy) (22). Skutečně patognomické je zde snížení hodnot T1 mappingu, které je způsobeno intracelulární/nitrobuněčnou akumulací glykosfingolipidů (22, 23). Nejrozšířenějším způsobem diagnostiky tohoto onemocnění je analýza suché kapky krve. Nízká aktivita AGALA potvrzuje u mužů diagnózu FCH. U žen heterozygotek může být hladina AGALA hraniční či normální, zde je pak zásadní genetické testování k průkazu mutace v genu pro AGALA. Jedná se o jednoduché vyšetření, které by mělo být indikováno v rámci screeningu pacientů s nevysvětlitelnou hypertrofií LK (24). V současnosti existují dva terapeutické přístupy. Prvním z nich je chaperonová terapie, která je vhodná pouze pro osoby se specifickými mutacemi enzymu AGALA. Chaperony jsou malé molekuly pomáhající enzymům stát se funkčními tím, že jim umožňují zaujmout správný tvar, a tím zůstat stabilní. Zástupcem je migalastat. Tento preparát se vyrábí v perorální formě a užívá se obden (25). Druhým přístupem je enzymatická substituční terapie (ERT – enzym replacement therapy). Tato léčba je dlouhodobá a podstatou je dodání enzymu intravenózní infuzí. Aplikuje se každých 14 dnů (26). Cílem obou terapeutických přístupů je zabránit dalšímu poškození orgánů a výrazně zlepšit kvalitu života pacientů. Příslibem do budoucna je genová terapie, jejíž podstatou je vpravení „zdravého“ genu, který zajistí produkci enzymu AGALA. Tento přístup je na rozdíl od obou předchozích kauzální, nikoliv symptomatický (27).
Dilatační kardiomyopatie
Dilatační kardiomyopatie (DCM) je charakterizována dilatací a systolickou dysfunkcí levé komory, která není vysvětlitelná abnormním zatížením v důsledku arteriální hypertenze, chlopenní nebo vrozené srdeční vady nebo ischemické choroby srdeční (1). Současně bývá přítomen různý stupeň diastolické dysfunkce a zejména v pokročilejších fázích onemocnění také dilatace a dysfunkce pravé srdeční komory. Pokud není přítomna dilatace LK, ale ejekční frakce LK (EF LK) je snížena pod 45 %, hovoříme o hypokinetické nedilatované kardiomyopatii (HNDCM) (28). Prevalence onemocnění je udávána 1 : 2500, nicméně některé novější práce předpokládají skutečnou prevalenci až 1 : 250. V současnosti se jedná o nejčastější příčinu srdečního selhání, která vede k srdeční transplantaci, a to zejména u mladých osob (29, 30). Původ onemocnění je geneticky podmíněný, nebo se jedná o získané formy DKMP. Fenotypové vyjádření je dále ovlivněno působením zevního prostředí, způsobem dědičnosti, penetrací, imunitními vlivy a dalšími tzv. modifikujícími geny. V případech získaných forem onemocnění hrají roli zánětlivé a autoimunitní vlivy, endokrinopatie, toxonutritivní vlivy, kardiotoxické působení aplikované chemoterapie nebo se může jednat o důsledek déletrvající tachyarytmie (posttachykardická DCM). Zvláštní jednotkou je peripartální kardiomyopatie vznikající v souvislosti s těhotenstvím. Pokud nejsme schopni příčinu onemocnění ani po vyčerpání dostupných diagnostických metod odhalit, označujeme ji potom jako idiopatickou dilatační kardiomyopatii (1).
Genetika
Familiární formy DCM představují asi 40 % případů (1). Většinou se jedná o varianty v genech kódujících cytoskeletální či sarkomerické proteiny, dále pak proteiny jaderné obálky a interkalačního disku. Mezi nejčastěji postižené geny patří titin – TTN (15–25 %), lamin A/C – LMNA (4–7 %), těžký řetězec beta‑myosinu – MYH7 (3–5 %), filamin‑C – FLNC (3 %), troponin T – TNNT2 (2 %), RNA‑binding motif 20 – RBM20 a desmoplakin – DSP. Dědičnost je ve většině případů autozomálně dominantní, dále pak X‑vázaná a autozomálně recesivní. Jsou popsány i případy s mitochondriální dědičností (MELAS syndrom). Přínos genetického testování dokumentuje podskupina pacientů, která bývá označována jako arytmogenní DCM či dominantně levokomorová forma arytmogenní kardiomyopatie (ALVC) a geneticky bývá způsobena nejčastěji mutacemi v LMNA genu a FLNC genu. Dle expertního konsenzu ESC z roku 2019 je doporučena implantace ICD u pacientů s DCM a potvrzenou patogenní mutací LMNA a/nebo FLNC genu a klinickými rizikovými faktory (nesetrvalá komorová tachykardie, EF LK < 45 %, mužské pohlaví a zkrácené (trunkující) mutace) (31). Nositelé patogenních variant genů LMNA, RBM20 a DSP jsou ve zvýšeném riziku srdečního selhání s nutností srdeční transplantace a vyžadují proto těsnou monitoraci (32).
Echokardiografie
Diagnóza DCM je nejčastěji stanovena u nemocných s recentně vzniklými symptomy srdečního selhání nebo u dosud asymptomatických či málo symptomatických osob, jež jsou vyšetřeny v rámci familiárního screeningu. Základní diagnostickou metodou zůstává echokardiografie, jež je také využívána v následném dlouhodobém sledování (Obr. 7). Provedeno by mělo být také tkáňově dopplerovské hodnocení (TDI – tissue Doppler imaging) k posouzení longitudinální funkce levé a pravé srdeční komory. Zejména u asymptomatických jedinců s dosud zachovalou systolickou funkcí LK vyjádřenou ejekční frakcí (EF LK) je doporučováno hodnocení globálního longitudinálního strainu (GLS). Tento parametr je schopen detekovat již preklinickou fázi onemocnění a díky dobré reproducibilitě je vhodný pro dlouhodobé sledování nemocných (33). Stále více je v praxi také využíváno 3D zobrazení, přínosné zejména k podrobnějšímu hodnocení struktury a funkce pravé komory a mitrální regurgitace. K vyloučení přítomnosti trombu či dosažení lepšího zobrazení při měření objemů a ejekční frakce LK zejména u hůře vyšetřitelných pacientů může být použita kontrastní echokardiografie. Echokardiografické vyšetření rovněž slouží k vyloučení jiné příčiny srdečního selhání. Spektrum nálezů při echokardiografickém vyšetření může být velmi různorodé a může zahrnovat jen mírné změny vyjádřené např. pouze patologickými hodnotami GLS u zatím asymptomatických osob až po závažné nálezy s obrazem významné dilatace, remodelace a dysfunkce levé komory či biventrikulárním postižením u nemocných s klinickými projevy srdečního selhání.
Image 7. Echokardiografický nález u nemocného se srdeční amyloidózou. V apikální čtyřdutinové projekci je patrná hypertrofie srdečních komor, zesílení mezisíňové přepážky a dilatace obou síní. Dále je patrný typický obraz tzv. „apical sparing“ při vyšetření globálního longitudinálního strainu 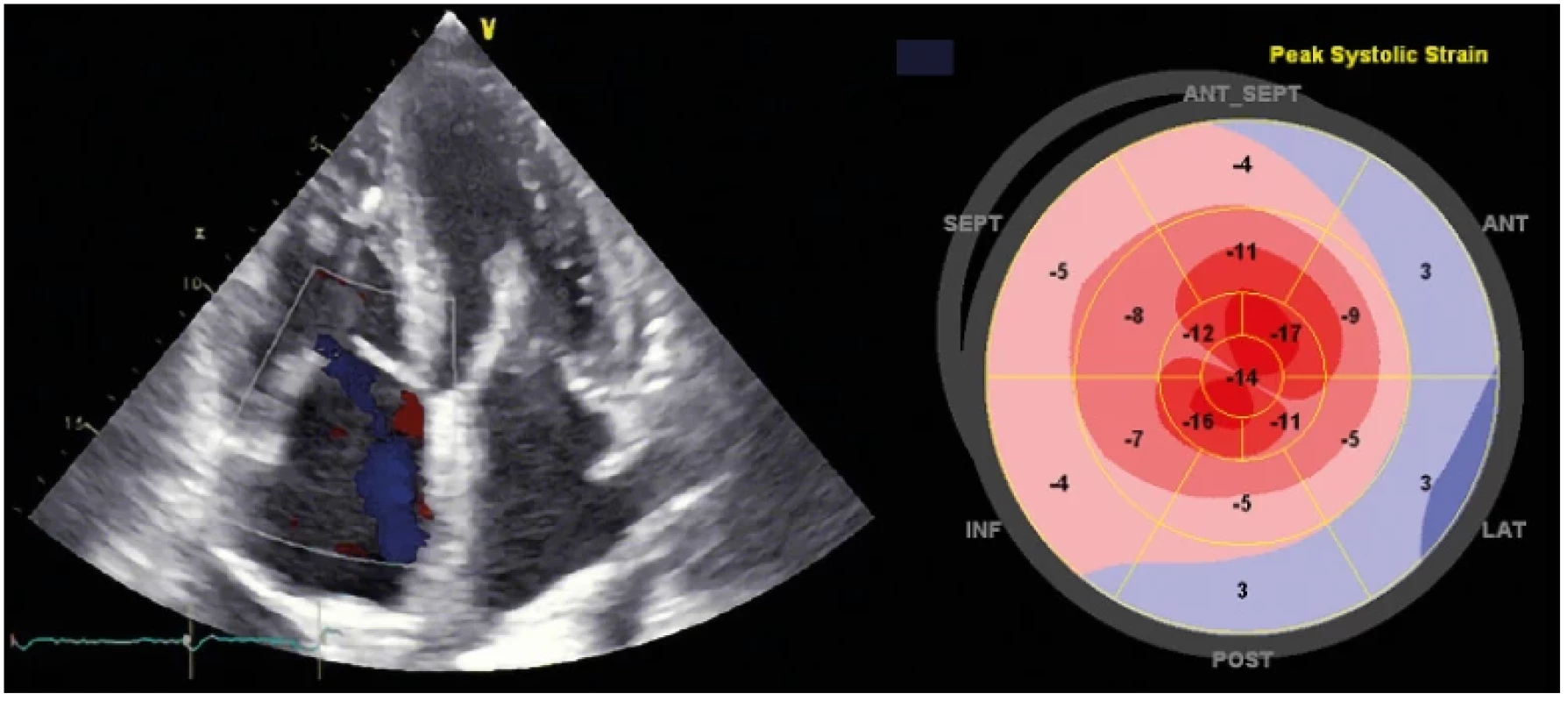
Obr. 7. Echokardiografický obraz dilatační kardiomyopatie, parasternální projekce na dlouhou osu. Významná dilatace levé komory a levé síně 
Magnetická rezonance
Jak již bylo zmíněno v úvodu, zlatým standardem ve stanovování objemů LK, masy LK i EF LK je magnetická rezonance. Postkontrastní metody v rámci vyšetření MRI navíc nabízejí možnosti stanovení LGE, které je důležité zejména pro zpřesnění prognózy nemocných. Typickým nálezem je v případě DCM popisováno midmyokardiální LGE v oblasti septa LK (34) (Obr. 8). Obecně je LGE popisováno u zhruba 30–40 % pacientů s dilatační kardiomyopatií. U těchto pacientů byla již dříve zdokumentována horší prognóza související se zvýšeným výskytem komorových arytmií a náhlé srdeční smrti. Novější výsledky však ukazují významně zhoršenou prognózu i u pacientů s DCM bez prokázaného LGE, ale se zvýšením hodnot T1 mappingu nebo ECV (35). Pro stratifikaci těchto pacientů je tudíž optimální kombinace všech 3 výše zmíněných metod. Je tedy doporučováno, aby všichni pacienti s DCM podstoupili vyšetření magnetickou rezonancí (3).
Image 8. Pacient s dilatační kardiomyopatií, vyšetření MRI. Nález dilatace všech srdečních oddílů, postkontrastně s přítomným typickým neischemickým midmyokardiálním LGE v oblasti baze interventrikulárního septa a perikardiálním výpotkem 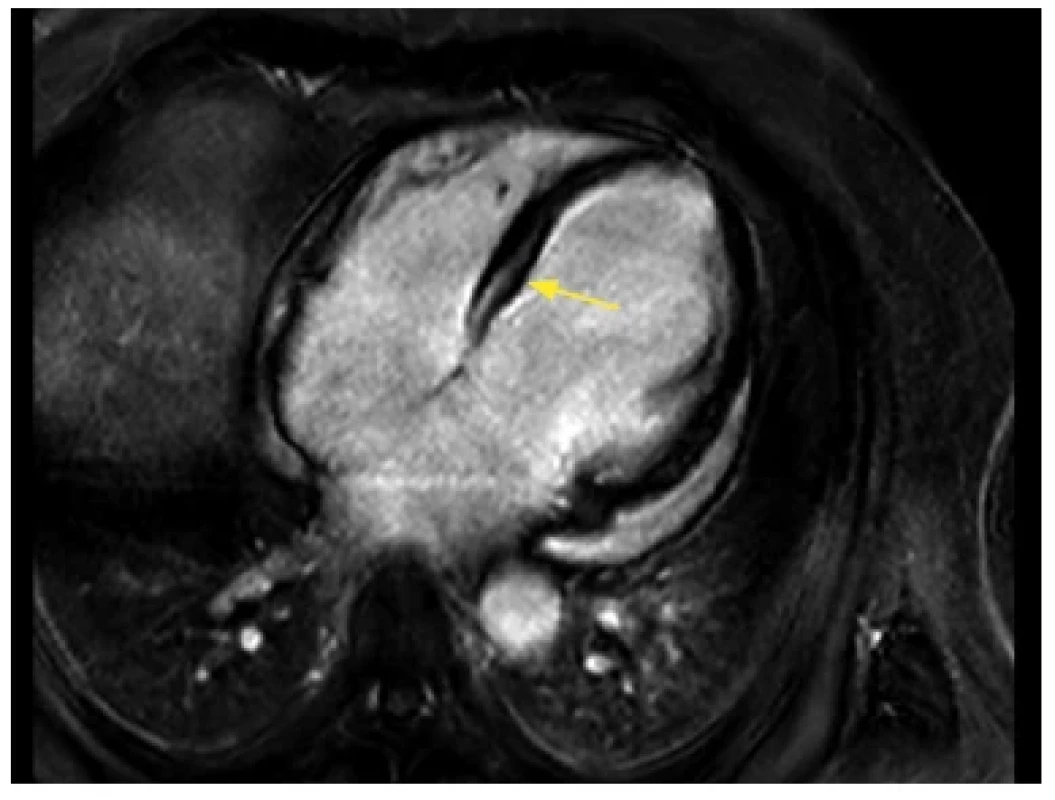
Další vyšetřovací metody
Využití CT vyšetření pro diagnostiku DCM je limitované. Nápomocné může být v pátrání po perikardiálním postižení. K vyloučení koronární nemoci zejména u mladších nemocných bez rizikových faktorů je využívána CT koronarografie.
Součástí laboratorního vyšetření je kromě základních parametrů (zahrnujících ledvinné a jaterní funkce, svalové enzymy a srdeční enzymy včetně troponinu, kompletní mineralogram včetně kalciofosfátového metabolismu, funkce štítné žlázy, CRP a natriuretické peptidy) také vyšetření metabolismu železa a přítomnosti proteinurie. Zhodnocen by měl být krevní obraz včetně diferenciálního rozpočtu k posouzení eozinofilie.
V případech familiárního výskytu DCM, jak jsme již uvedli výše, je indikován genetický screening u prvostupňových příbuzných s cílem stanovení diagnózy, stratifikace rizika a zahájení časné léčby u dosud asymptomatických jedinců.
Endomyokardiální biopsie je indikována v případech recentně vzniklého srdečního selhání s významnou dysfunkcí levé komory nereagující na standardní léčbu (7).
V diagnostice DCM obecně je snahou především včasná diagnostika onemocnění, ještě před rozvojem těžké dysfunkce LK, která je již často odrazem ireverzibilních změn. Onemocnění probíhá po určitý čas latentně, kdy je ještě zachována EF LK, případně může být přítomný určitý stupeň dilatace LK při dosud zachovalé funkci LK. Pokud je onemocnění diagnostikováno v této fázi, může být jeho další vývoj příznivě ovlivněn například změnou některých rizikových faktorů, doporučeními týkajícími se změn pohybové aktivity či včasným zavedením farmakologické nebo přístrojové léčby, zejména u některých forem spojených s vysokým rizikem náhlé srdeční smrti.
Terapie
Farmakologická léčba nemocných s DCM se řídí dostupnými doporučeními pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2021 (4). Základem léčby ovlivňujícím prognózu nemocných se sníženou EF (HFrEF) jsou betablokátory, inhibitory angiotenzinového receptoru a neprilysinu (ARNI), případně inhibitory angiotenzin konvertujícího enzymu (ACEI) nebo blokátory angiotenzinového receptoru (ARB) v případě intolerance ARNI, dále blokátory mineralokortikoidních receptorů (MRA) a inhibitory sodíko‑glukózového kontransportéru-2 (SGLT2i). Vericiguat může být přidán do terapie u nemocných horšících se i přes léčbu ARNI či ACEI. V případě hyperhydratace jsou podávána diuretika, zejména kličková, součástí léčby může být dále digitalis. V případě prokázaného deficitu železa je doporučována jeho intravenózní substituce (4). V průběhu dvouletého sledování dochází asi u 40–50 % pacientů s nově diagnostikovanou DCM na optimální farmakoterapii (OMT) k reverzní remodelaci LK, která je spojena s příznivou prognózou (36). Jak ale ukázala data z pilotní studie TRED‑HF, měla by být tato léčba i po dosažení reverzní remodelace LK ponechána trvale, neboť až u 40 % nemocných došlo po jejím vysazení v průběhu 6měsíčního sledování k opětovnému poklesu EF LK (37). Indikace k primárně preventivní implantaci ICD v prevenci NSS by měla být zvážena u nemocných ve funkční třídě NYHA II–III, u nichž i přes optimální farmakologickou léčbu podávanou nejméně po dobu 3 měsíců přetrvává EFLK ≤ 35 %. V přítomnosti bloku levého Tawarova raménka (LBBB) a rozšíření QRS komplexu nad 130 ms je indikována i léčba resynchronizační (4). V případě významné mitrální regurgitace může být indikována chirurgická nebo perkutánní (implantace mitra‑clipu) léčba. Pacienti, u nichž dochází i přes výše uvedenou léčbu k další progresi symptomů srdečního selhání, mohou být při splnění indikačních kritérií kandidáty implantace mechanické srdeční podpory nebo srdeční transplantace.
Zánětlivá kardiomyopatie
Publikované práce udávají, že až polovina případů dilatační kardiomyopatie se rozvíjí v důsledku prodělané myokarditidy, tedy zánětlivého postižení srdečního svalu. Pokud je zánět myokardu spojen s jeho dysfunkcí, označuje se jako zánětlivá kardiomyopatie (ICM inflammatory cardiomyopathy). Přechod akutního zánětu do subakutního až chronického stadia spojeného s remodelací myokardu, rozvojem fibrózy a ztrátou kontraktilní funkce myokardu vede k rozvoji již zmiňované dilatační kardiomyopatie. V diagnostickém algoritmu myokarditidy má nyní zásadní postavení zejména vyšetření pomocí MRI, kdy po aktualizaci tzv. Lake Louis diagnostických kritérií v roce 2018 došlo ke zvýšení senzitivity i specificity vyšetření, která je pro danou diagnózu udávána 88 %, resp. 96 % (38). Pro potvrzení myokarditidy je potřeba splnit: T2-vážené kritérium (obraz edému na T2-vážených snímcích nebo zvýšené hodnoty T2 mappingu) a zároveň T1-vážené kritérium (pozitivní LGE, zvýšený signál T1 mappingu nebo zvýšené ECV). Pozitivita obou kritérií současně svědčí pro dg. myokarditidy, nicméně i splnění pouze 1 z kritérií může svědčit pro přítomnost myokarditidy s nižší specifitou, pokud tomu odpovídá klinický obraz pacienta (38).
Významné místo má MRI také pro další monitoraci vývoje onemocnění, kdy je kontrolní vyšetření indikováno většinou s odstupem 6 až 12 měsíců od vstupního vyšetření (39, 40). Současně také dochází k posunu v indikaci EMB, která je nyní doporučena v případech hemodynamické nestability (fulminantně probíhající myokarditida) nebo pokud je suspekce na specifickou, léčbou potenciálně ovlivnitelnou příčinu onemocnění (eozinofilní nebo obrovskobuněčná myokarditida, sarkoidóza, myokarditida v souvislosti s podáním check‑point inhibitorů), případně u nemocných, kteří nemohou podstoupit MRI vyšetření. Výtěžnost EMB je nejvyšší, pokud je provedena co nejdříve od vzniku symptomů, optimálně do 2 týdnů (39). Léčba opět vychází z aktuálních doporučených postupů ESC pro léčbu akutního a chronického srdečního selhání, jak již bylo uvedeno výše (4). U pacientů se závažným průběhem s hemodynamickou nestabilitou progredující až do obrazu kardiogenního šoku je nutné zavedení inotropní podpory dobutaminem, podání levosimendanu či milrinonu. Vzhledem k tomu, že se jedná o potenciálně reverzibilní onemocnění, může být indikováno zavedení krátkodobé mechanické podporu oběhu pomocí extrakorporální membránové oxygenace (ECMO), axiální levokomorové pumpy (Impella) či dlouhodobé levostranné mechanické srdeční podpory (LVAD) do zotavení myokardu a stabilizace stavu (bridge to recovery) nebo jako překlenutí do doby srdeční transplantace (bridge to transplantation).
Pro léčbu arytmií rovněž neexistují specifická doporučení a léčba se opírá o platné postupy ESC pro léčbu arytmií (41). Vzhledem ke skutečnosti, že ve více než polovině případů akutní myokarditidy dochází ke spontánnímu odeznění zánětu a úpravě systolické dysfunkce, lze k přístrojové terapii, zejména co se týká primárně preventivní implantace ICD, zaujmout spíše zdrženlivější přístup a vyčkat s rozhodnutím o implantaci na odeznění akutní fáze onemocnění. V případech významných symptomatických bradyarytmií může být indikováno zavedení dočasné či trvalé kardiostimulace. Imunosupresivní léčba je v současné době indikována v případě potvrzení eozinofilní či obrovskobuněčné myokarditidy, srdeční sarkoidózy a v případě lymfocytární myokarditidy způsobené check‑point inhibitory, popřípadě asociované s autoimunitním onemocněním (39, 40). V případech fulminantně probíhající myokarditidy je možné bolusové podání kortikoidů bez znalosti bioptického nálezu, podání intravenózních imunoglobulinů je indikováno v pediatrii, u dospělých pacientů není dostatek důkazů o prospěšnosti této léčby. Imunosuprese založená na podání kortikoidů a azthioprinu nebo mykofenolátu mofetilu může být zvážena u nemocných s nedostatečným zlepšením funkce LK a přetrvávajícími symptomy srdečního selhání při trvající pozitivitě troponinu nebo s přetrvávající zánětlivou infiltrací myokardu (39, 40).
Arytmogenní kardiomyopatie
Arytmogenní kardiomyopatie (ACM), dříve označována jako arytmogenní kardiomyopatie nebo též arytmogenní dysplazie pravé komory (ARVC) je geneticky podmíněné onemocnění s prevalencí 1 : 1000 až 1 : 5000 (42). Charakteristická je přítomnost funkčních a morfologických změn (v důsledku progresivního úbytku srdeční svaloviny) komorového myokardu pravé, levé nebo obou srdečních komor. Onemocnění je provázeno výskytem komorových arytmií, jež mohou být příčinou náhlé srdeční smrti zejména u mladých osob. Původně bylo onemocnění považováno za typicky postižení pravé komory, ale díky rozvoji diagnostických metod bylo potvrzeno časté biventrikulární postižení a v řadě případů pouze izolované postižení levé komory (ALVC). Velká část případů ACM má familiární výskyt s autozomálně dominantním přenosem, některé země, jako například Itálie, se vyznačují endemickým výskytem onemocnění. Familiární formy zahrnují mutace v genech pro desmozomální proteiny plakophilin 2 – PKP2 (20–45 %), desmoplakin – DSP (2–15 %), desmoglein 2 – DSG2 (4–15 %), desmocollin 2 – DSC2 (2–7 %), filamin A/C – FLNC (3 %) a plakoglobin – JUP odpovědný za tzv. chorobu Naxos (32). Postižení desmozomů, které jsou odpovědné za mechanické a elektrické propojení kardiomyocytů, se projevuje vznikem arytmií (43). Prevalence záchytu patogenních variant u familiárních forem ACM je skoro 50 %, nejčastější jsou varianty genu PKP2. Biventrikulární či levostranné formy ACM jsou nejčastěji spojeny s patogenními variantami DSP, FLNC, RBM20 a DES (43).
Diagnostika
Diagnostika onemocnění je často poměrně obtížná a je založena na komplexním přístupu. Důležitý je pečlivý odběr rodinné anamnézy, zhodnocení klidového EKG a 24hodinové EKG monitorace, podrobné echokardiografické vyšetření a především provedení magnetické rezonance, která má pro diagnózu zásadní úlohu. Na podkladě těchto vyšetření byla sestavena diagnostická kritéria, původně již v roce 1994 pro ARVC, aktualizována a rozšířena byla v roce 2010 právě o výsledek genetického vyšetření a magnetické rezonance. Tato kritéria hodnotí morfologicko‑funkční změny, tkáňovou charakteristiku, repolarizační a depolarizační EKG změny, přítomnost komorových arytmií, rodinnou anamnézu a genetické testování. Každá z kategorií zahrnuje „velká“ a „malá“ kritéria a podle počtu splněných kritérií je diagnóza považována za možnou, pravděpodobnou nebo potvrzenou. V roce 2020 byla publikována tzv. Padovská kritéria, která na základě nových poznatků berou v úvahu také podtypy s postižením levé komory (44, 45). Jak již bylo zmíněno, pro diagnózu je nejdůležitější metodou magnetická rezonance. V roce 2021 byla vydána aktualizovaná mezinárodní diagnostická kritéria pro ACM, ve kterých má MRI stěžejní místo (46). Oproti kritériím z roku 2010 je stále důležité hodnocení funkce pravé komory (PK) – nově je však pouze izolovaná porucha kontraktility PK počítána jako malé kritérium pro diagnózu; kombinace poruchy kontraktility a dilatace či poklesu ejekční frakce (EF) PK poté jako velké kritérium. Navíc byly upraveny i tyto hodnoty, kdy dilatace PK je definována jako EDV/BSA nad 112 ml/m2, porucha systolické funkce jako EF pod 51 %. Další novinkou je zařazení přítomnosti transmurálního LGE alespoň 1 regionu PK jako další velké kritérium pro stanovení diagnózy (46).
Případy biventrikulárního postižení nebo izolované postižení pouze LK byly v minulosti často mylně diagnostikovány jako například DCM a až donedávna chyběla větší studie, která by se tímto postižením zabývala. V současných diagnostických kritériích pro ALVC je jako malé kritérium uváděna globální systolická dysfunkce LK s/nebo bez dilatace a jako druhé kritérium regionální hypokineza či akineza volné stěny nebo septa LK. Jako velké kritérium přítomnost neischemického LGE či fibrózy alespoň 1 segmentu, kdy vysoce specifický je tzv. „ring pattern“ – subepikardiální pozdní sycení podél celé volné stěny LK včetně septa (47). Endomyokardiální biopsie není pro diagnózu nezbytná a je vyhrazena pro případy, kdy je nutné vyloučit jiné fenotypově shodné onemocnění, jako je sarkoidóza, myokarditida nebo dilatační kardiomyopatie (46). Součástí diagnostického postupu může být také provedení elektroanatomického mapování, které může současně pomocí radiofrekvenční ablace terapeuticky ovlivnit arytmogenní substrát.
Klinický obraz onemocnění může kolísat od mírného postižení s asymptomatickým průběhem, přes palpitace, synkopy až po závažný průběh s život ohrožujícími arytmiemi a rozvojem srdečního selhání. Prvním projevem onemocnění může být náhlá srdeční smrt u dosud asymptomatických osob. V některých případech se může onemocnění manifestovat akutní myokarditidou, která představuje tzv. „hot phase“ onemocnění projevující se bolestmi na hrudi, vzestupem kardiospecifických enzymů, EKG změnami s normálním koronarogramem (48). V léčbě jsou důležitá jednak režimová opatření, která nedovolují intenzivní sportovní aktivity u nemocných s potvrzenou diagnózou, toto omezení může být zváženo i u genotyp pozitivních/fenotyp negativních jedinců. Základem farmakoterapie jsou betablokátory, které by měly být v terapii zváženy u všech nemocných s potvrzenou diagnózou, podáván může být také amiodaron či sotalol. V případě rozvoje srdečního selhání je indikována standardní léčba dle platných guidelines. Implantace ICD je indikována v sekundární prevenci u nemocných s hemodynamicky netolerovanou komorovou tachykardií nebo komorovou fibrilací, v primární prevenci u nemocných s potvrzenou diagnózou a arytmogenní synkopou, s těžkou systolickou dysfunkcí LK popř. PK a u nemocných se středně těžkou systolickou dysfunkcí LK nebo PK a výskytem nesetrvalých komorových arytmií či setrvalé komorové arytmie vyvolané při programované stimulaci komor. U pacientů se sníženou ejekční frakcí levé komory a trunkujícími patogenními variantami genů FLNC, LMNA DSP, DES a PLN může být zvážena časná profylaktická implantace ICD (43). U nemocných s pokročilou formou onemocnění spojenou s refrakterním srdečním selháním nebo nekontrolovatelnými arytmiemi je indikována srdeční transplantace.
Restriktivní kardiomyopatie
Restriktivní kardiomyopatie (RCM) je definována jako restriktivní plnění v přítomnosti normálních nebo snížených diastolických a systolických objemů (jedné nebo obou komor), přičemž tloušťka stěn je většinou normální (Obr. 9, 10, 11). V případě střádavého nebo infiltrativního postižení je přítomen různý stupeň hypetrofie (49). Jedná se o poměrně heterogenní skupinu onemocnění zahrnující hereditární, idiopatické a získané formy restriktivní kardiomyopatie. Mezi získané formy RCM se řadí infiltrativní a střádavá onemocnění a choroby s endomyokardiálním postižením (50). Mezi genetické formy restriktivní kardiomyopatie se řadí familiární formy bez definovaného genu, dále formy podmíněné mutacemi sarkomerických proteinů, troponinu T a lehkého řetězce myosinu a desminopatie. Mezi další důležité podjednotky bývá řazena Anderson‑Fabryho choroba, familiární amyloidóza (transthyretinová), dále hemochromatóza a vzácněji glykogenózy (1). Klinicky se RCM projevuje jako srdeční selhání se zachovalou ejekční frakcí (HFpEF), v pozdních stadiích onemocnění dochází také k rozvoji systolické dysfunkce jedné nebo obou srdečních komor, jež je spojena s klinickými projevy HFrEF. Obecně má restriktivní kardiomyopatie špatnou prognózu bez ohledu na vyvolávající příčinu onemocnění (50). Ve skupině nemocných starších 65 let je nejčastější příčinou restriktivní kardiomyopatie srdeční amyloidóza.
Image 9. Echokardiografický obraz restriktivní kardiomyopatie. Apikální čtyřdutinová projekce. Významná dilatace obou srdečních síní 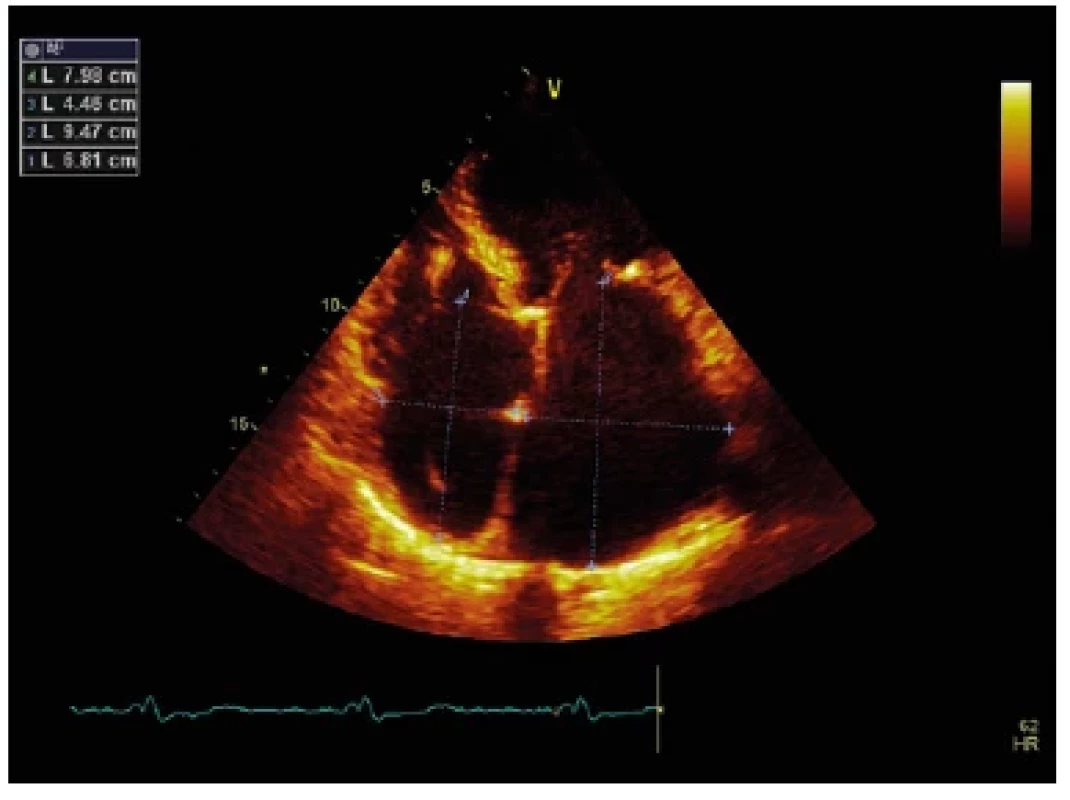
Image 10. Restriktivní typ plnění levé komory, pulzně dopplerovský záznam transmitrálního toku u nemocného s restriktivní kardiomyopatií 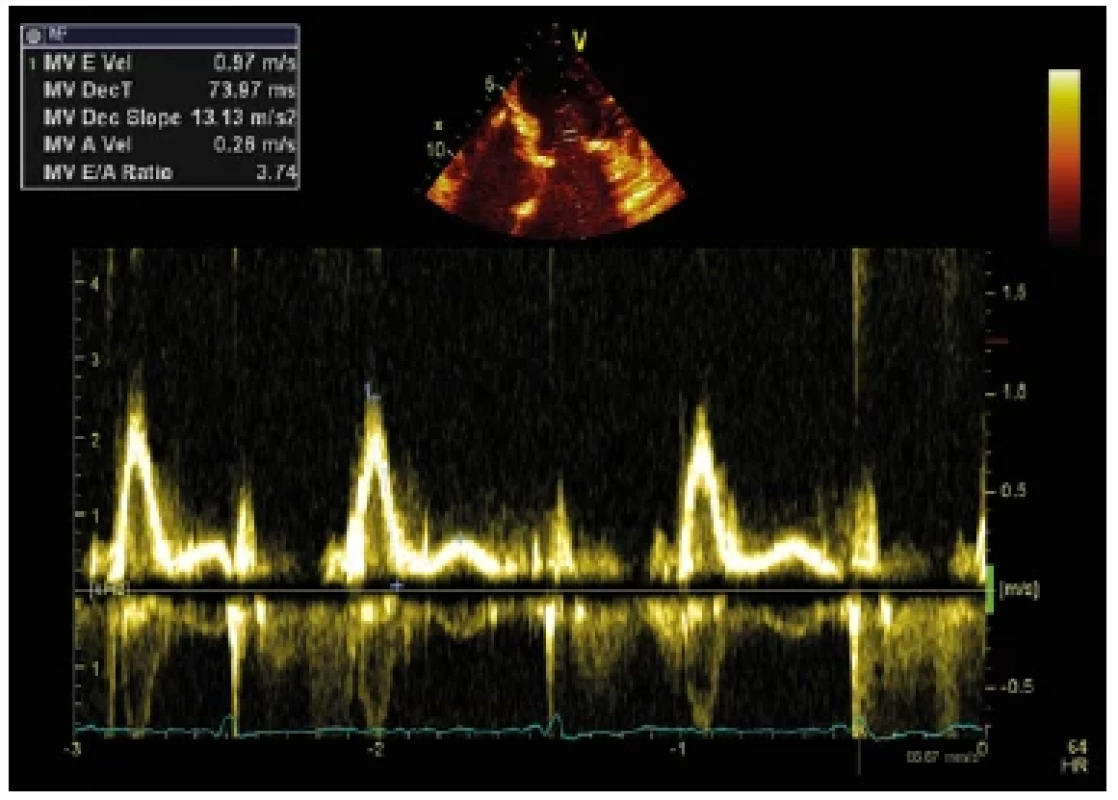
Image 11. Tkáňově pulzní dopplerovský záznam pohybu septálního okraje mitrálního anulu u nemocného s restriktivní kardiomyopatií. Významné snížení rychlosti vlny e´(znázorněno šipkou) 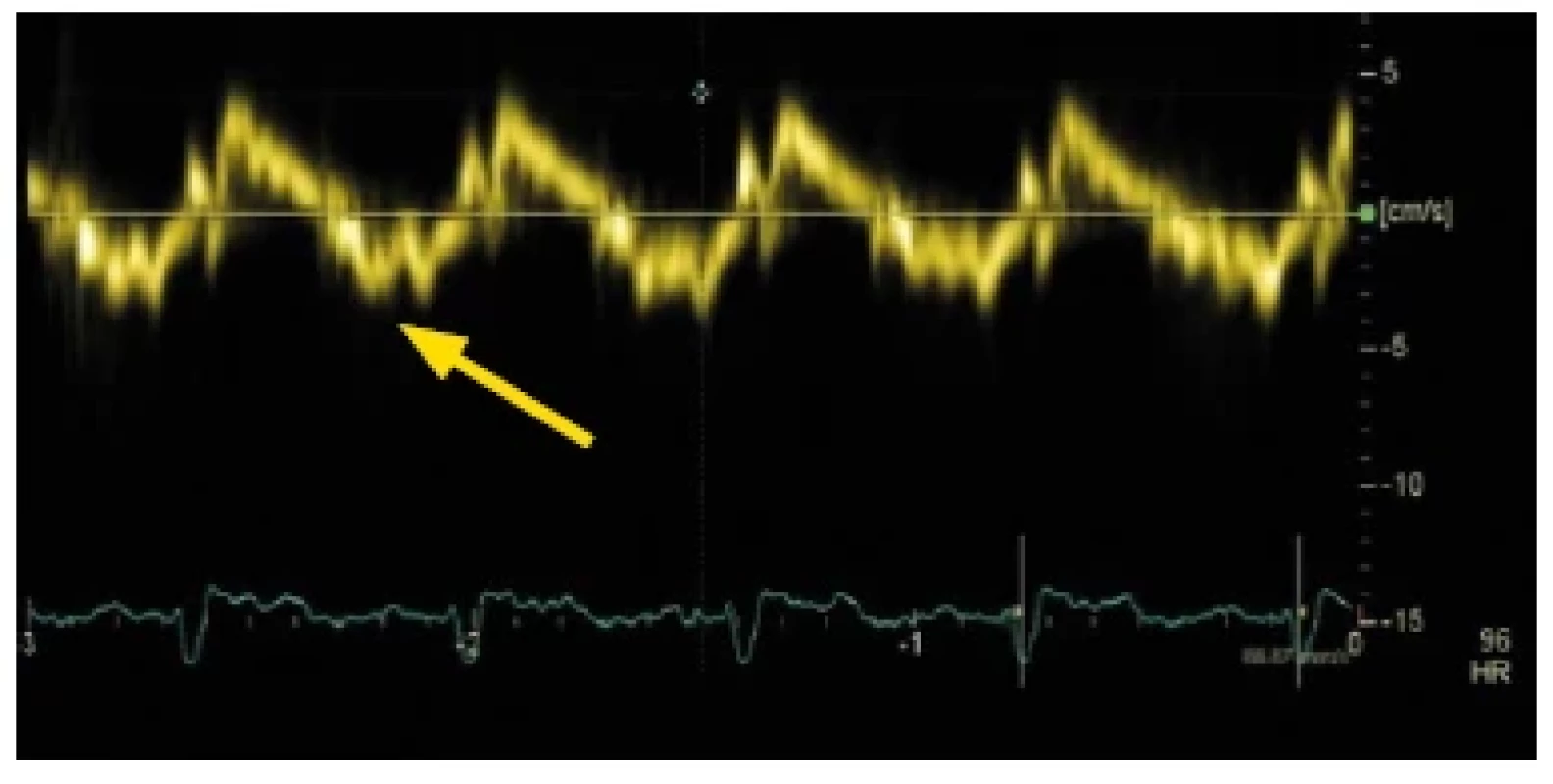
Srdeční amyloidóza
Amyloidóza je infiltrativní, v převážné většině případů systémové onemocnění charakterizované ukládáním amyloidových fibril do extracelulárních depozit tkání a orgánů, což vede k poruše jejich struktury a funkce. Pokud je depozicí amyloidu postižen srdeční sval, dochází k rozvoji kardiomyopatie s fenotypovým vyjádřením hypertrofické kardiomyopatie s restriktivní hemodynamikou. Postižení myokardu je určující pro prognózu a dochází k němu ve více než 95 % případů. Donedávna bylo onemocnění mylně považováno za vzácné a dřívější práce uváděly postižení méně než 5 pacientů na 10 000 obyvatel (51); s rozvojem diagnostiky se ale ukazuje, že se spíše jedná o onemocnění poddiagnostikované (52). Podle recentních studií je prevalence udávána dle studované populace kolem 1 % u nemocných podstupujících kostní scintigrafii až po 21 % z autopsií osob vysokého věku (53). Se zlepšující se dostupností vyšetřovacích metod roste tedy i prevalence potvrzených případů (54, 55). Dosud bylo identifikováno více než 35 amyloidogenních proteinů, které mohou být příčinou onemocnění. Z klinického hlediska je podstatné, že většina amyloidóz vzniká v důsledku ukládání dvou typů amyloidních fibril, a to z lehkých řetězců imunoglobulinů (AL amyloidóza) a z tranthyretinu (TTR amyloidóza), jež jsou podkladem více než 90 % amyloidóz. Diagnostika amyloidóz vyžaduje především povědomí o této nemoci, znalost rizikových faktorů a hledání tzv. „red flags“, které mohou pomoci ve správném nasměrování dalších diagnostických kroků.
Jak jsme již zmínili, v rozdělení amyloidóz hraje klíčovou roli identifikace prekurzorové (amyloidogenní) bílkoviny. V případě AL amyloidózy jsou dominantním proteinem lehké řetězce imunoglobulinů κ a λ produkované v nadbytečném množství plazmatickými buňkami s poruchou klonality, jedná se tedy o primárně hematologické onemocnění. Jelikož klonální lehké řetězce cirkulují v krevním řečišti, mohou se ukládat jako amyloidní fibrily téměř v každém orgánu, nejčastěji je ale postiženo srdce a ledviny. Pokud se amyloidní fibrily deponují do myokardu, jsou depozita nejčastěji difuzně přítomna v celém myokardu, méně často lze nalézt i fokální depozita (56).
Dalším prekurzorovým proteinem je transthyretin, protein syntetizovaný v játrech pro transport thyroxinu a retinol vázajícího proteinu, který způsobuje dva typy amyloidózy – dědičnou a získanou. Nejčastějším typem srdeční amyloidózy vůbec je získaná nebo tzv. divoká forma „wild type“ (wtATTR), dříve nazývaná senilní. Tento druh amyloidózy postihuje především muže starší 60 let. Průměrný věk v době stanovení diagnózy je udáván 74 let (57). Druhým, méně častým typem s endemickým výskytem je dědičná (hereditární) forma (hATTR) označovaná také jako variantní (vATTR), u níž lze identifikovat řadu mutací v genu pro transthyretin na chromozomu 18 (58, 59). U obou forem onemocnění je jeho podstatou nestabilita molekuly transthyretinu, v důsledku které dochází následně k tvorbě amyloidních fibril. Sekundární (AA) amyloidóza je vzácná a je způsobena depozity sérového amyloidu A, který je produkován u stavů s přítomností chronického zánětu. Raritní je izolovaná síňová amyloidóza způsobená depozity amyloidu tvořeného z atriálního natriuretického peptidu (54). Drtivou většinu amyloidóz ale tvoří AL a TTR amyloidóza (Obr. 12).
Image 12. Zjednodušené rozdělení srdečních amyloidóz. Upraveno podle (70) 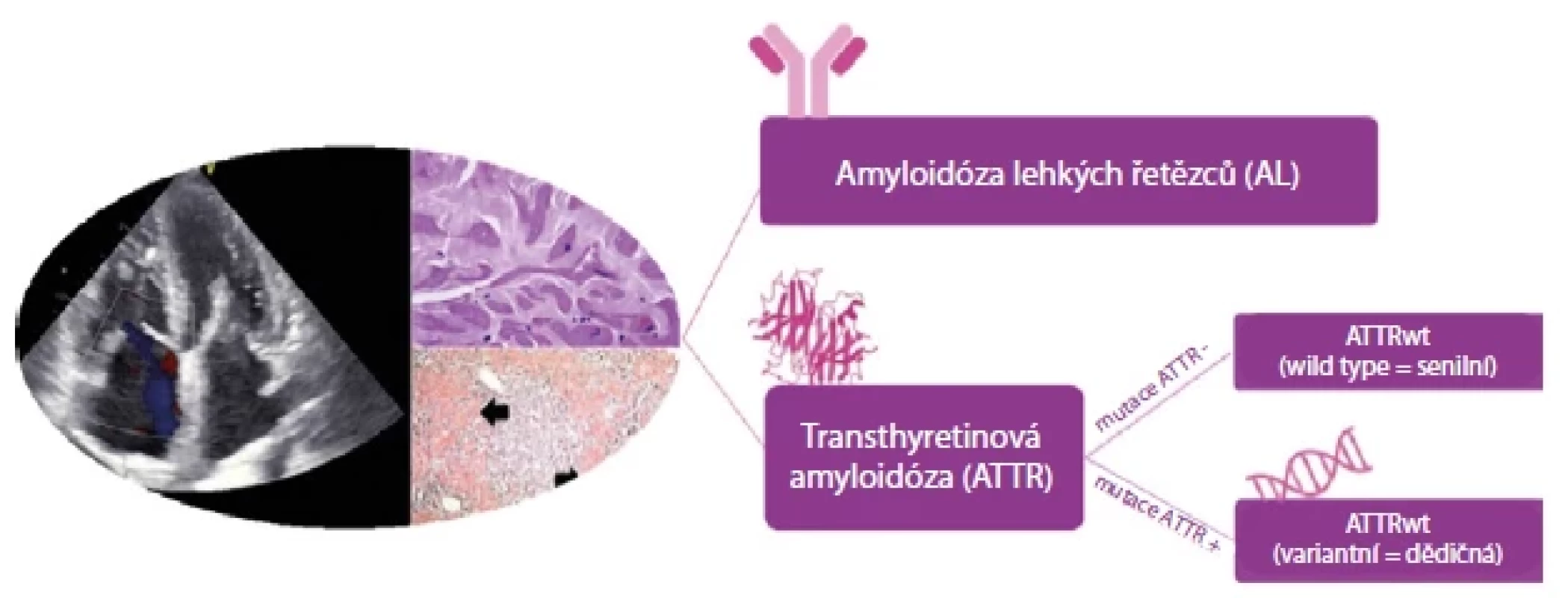
Klinický obraz
Klinická manifestace je vzhledem k systémovému postižení poměrně pestrá, některé klinické projevy jsou společné pro oba typy amyloidóz, jiné jsou pro jednotlivé typy specifické. U AL amyloidózy jsou nejčastěji postiženými orgány ledviny, srdce, játra a periferní nervový systém. Zejména zpočátku jsou přítomny nespecifické symptomy jako únava, slabost, hmotnostní úbytek, dyspepsie, dále především proteinurie se známkami renálního selhávání. Popisována bývá snadná tvorba hematomů, periorbitální purpura či makroglosie. Přítomny mohou být jak trombotické, tak krvácivé komplikace. Kardiomyopatie bývá přítomna až v 70 % případů, izolované postižení srdce asi jen u 5 % případů AL amyloidózy.
U hereditární formy ATTR je klinický obraz závislý na typu mutace. Může se jednat o dominantně neurologické nebo kardiální postižení, nebo se jedná o postižení smíšené. Neurologické projevy mají charakter periferní polyneuropatie, postižen bývá i autonomní nervový systém. U získané „wild type“ amyloidózy je dominující postižení kardiální, přičemž extrakardiální projevy jsou také součástí kliniky a často předcházejí projevům kardiálním. Infiltrace amyloidem postihuje všechny srdeční struktury a klinicky se manifestuje převážně symptomy chronického srdečního selhání, arytmiemi – především fibrilací síní a převodními poruchami, kardioembolickými příhodami z důvodu časté intrakardiální trombózy. Frekventně se setkáváme s hypotenzí nebo dekapitovanou hypertenzí. Z extrakardiálních projevů se jedná o syndrom karpálního tunelu (až u 50 % nemocných), spontánní rupturu šlachy bicepsu, stenózu páteřního kanálu nebo projevy periferní a autonomní neuropatie.
Diagnostika
Některé z uvedených příznaků a nálezů jsou pro onemocnění amyloidózou typické a představují jakési varovné příznaky označované jako tzv. „red flags“, které nám mohou diagnostiku poněkud usnadnit (60). Jedná se jak o výše zmíněné klinické příznaky (kardiální a extrakardiální), hodnoty biohumorálních působků, typický obraz na elektrokardiogramu, echokardiografii či magnetické rezonanci. Extrakardiální red flags jsou pro AL a ATTR často odlišné. S diagnózou ATTRwt je vysoce asociován syndrom karpálního tunelu, ruptura šlachy bicepsu a „trigger finger“. U AL amyloidózy je častá spontánní tvorba hematomů, často kolem očí, tzv. „raccoon eyes“ a makroglosie. Pro oba typy amyloidózy je společná polyneuropatie a autonomní dysfunkce. Většina kardiálních red flags je pro obě amyloidózy společná; z klinických příznaků jsou to projevy srdečního selhání – dušnost, únavnost, periferní otoky, hepatomegalie, ascites, zvýšená náplň krčních žil, hypotenze. U starších pacientů s ATTRwt dříve léčených s hypertenzí může být prvním příznakem zdánlivé „vyléčení vysokého tlaku“, tedy tzv. dekapitovaná hypertenze, s nutností down‑titrace antihypertenziv. Vzhledem k nízkému srdečnímu výdeji dochází k horší toleranci betablokátorů. Často je přítomna autonomní neuropatie, což vede k ortostatické hypotenzi. Dalším důvodem případných synkop jsou brady i tachyarytmie.
V laboratorním nálezu je nápadně zvýšená hodnota natriuretických peptidů (BNP, NT‑proBNP) nepoměrně vysoká k tíži srdečního selhání a trvalá elevace troponinu v důsledku postižení stěn drobných koronárních tepen amyloidem.
Na EKG je typicky nízká voltáž QRS kmitů v končetinových svodech (častěji u AL amyloidózy), která je v kontrastu k hypertrofii srdečních komor na echokardiografii. Dále mohou být přítomné pseudoinfarktové změny a arytmie – nejčastěji fibrilace síní a převodní poruchy (Obr. 13).
Image 13. EKG křivka nemocného se srdeční amyloidózou. Patrná je nízká voltáž QRS komplexů a pseudoinfarktové změny 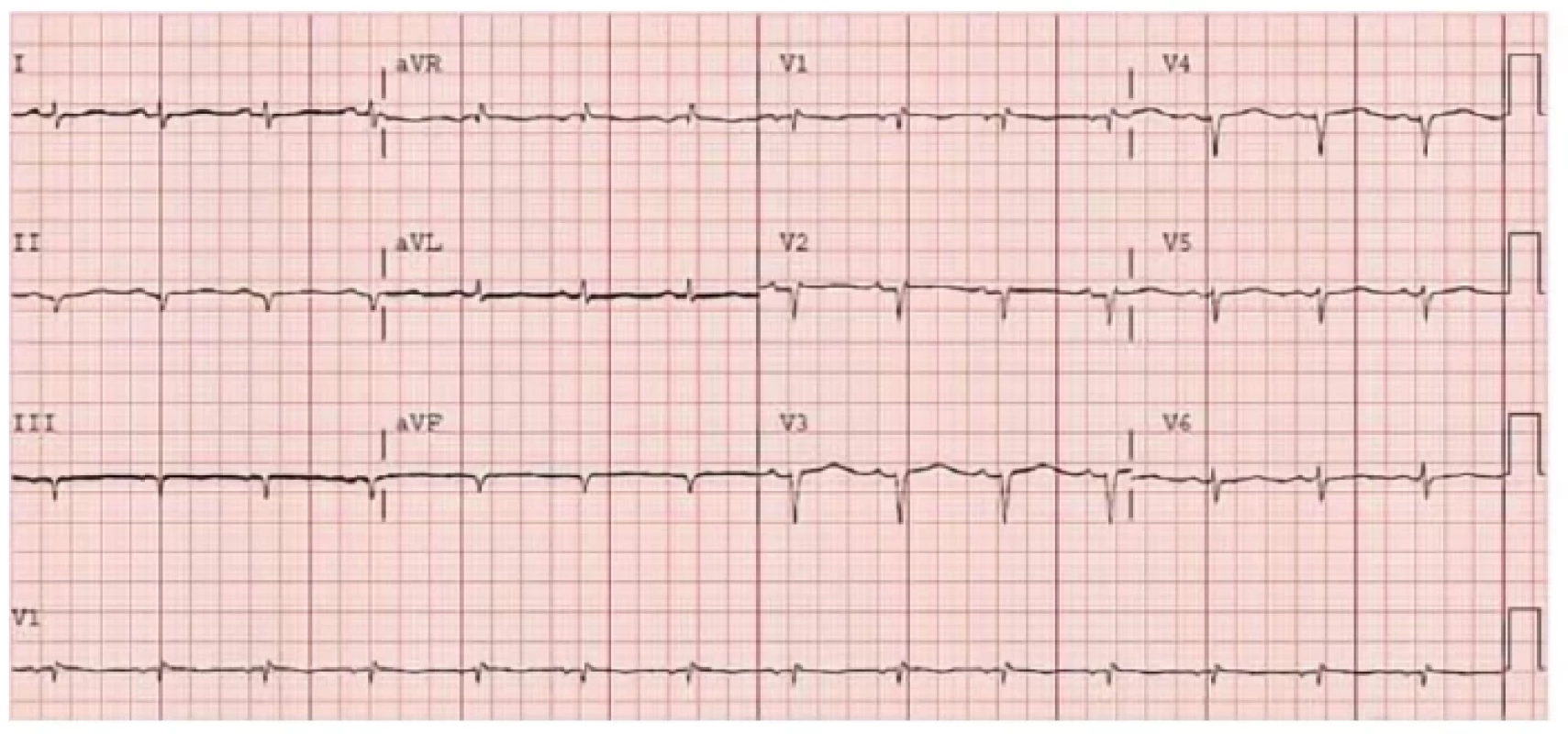
Zobrazovací metody
Základní diagnostickou metodou je echokardiografie. Typickým obrazem je hypertrofie (či spíše „pseudohypertrofie“) stěn levé komory (≥ 12 mm), papilárních svalů a volné stěny pravé komory. Dále je patrné zesílení mezisíňové přepážky a chlopenního aparátu. Diastolická dysfunkce a zvýšené plnicí tlaky LK vedou k dilataci síní a plicní hypertenzi. Často je přítomen perikardiální výpotek (61). Typické je postižení longitudinální kontraktility, které lze vyjádřit snížením systolických rychlostí při tkáňově dopplerovském zobrazení nebo při hodnocení globálního longitudinálního strainu, typickým nálezem je tzv. „apical sparing“, představující relativní zachování systolické deformace apikálních segmentů vzhl. k segmentům bazálním (Obr. 14). Tzv. „granular sparkling“ – hyperechogenní zrnitá struktura myokardu – již ztratil v diagnostice na významu, neboť je závislý na nastavení konkrétního přístroje. Podkladem srdečního selhání je těžká diastolická dysfunkce, v pokročilých stadiích onemocnění zejména u AL amyloidózy dochází i k selhání systolické funkce. Častým nálezem zejména u pacientů s ATTRwt je aortální stenóza typu low‑flow low‑gradient.
Při vyšetření magnetickou rezonancí byl v případě amyloidózy popisován jako patognomický obraz difuzního subendokardiálního LGE LK. Novější data ukazují, že obraz může být při této diagnóze různý (3). Především v počátečních fázích bývají obrazy spíše atypické nebo fokální popisované jako „patchy pattern“. Poměrně typické je v pokročilých případech obtížné nabírání LGE sekvencí, neboť myokard infiltrovaný amyloidem mívá signál podobný signálu krve (3). Nejdůležitější technikou je zde T1 mapping a především hodnocení ECV – amyloid se ukládá do mezibuněčného prostoru, což vede k velkému zvýšení hodnot ECV. MRI však nedokáže od sebe spolehlivě odlišit různé typy amyloidózy.
Podle výsledků výše uvedených vyšetření a tzv. „red flags“ je vysloveno podezření na srdeční amyloidózu, na jejich základě ale nelze jednotlivé typy amyloidózy odlišit. Následují tedy další diagnostické kroky vedoucí k odlišení AL a TTR amyloidózy, neboť toto odlišení je zásadní pro další léčbu a prognózu. Diagnostický algoritmus je založený na stanovení volných lehkých řetězců v séru a poměru koncentrací řetězců κ/λ a imunoelektroforéze séra a moči k průkazu monoklonálního proteinu. V případě negativního nálezu můžeme AL amyloidózu považovat za vyloučenou. Dalším krokem neinvazivní diagnostiky je provedení tzv. DPD‑scintigrafie, za použití techneciem značené diphosphonodikarbxylové kyseliny. Intenzivní vychytávání 99mTc‑DPD má patognomický význam pro ATTR kardiomyopatii, pokud k vychytávání radiofarmaka nedochází, diagnózu můžeme vyloučit. Pokud je stupeň vychytávání 2 nebo 3 dle Peruginiové a laboratorně je vyloučena AL amyloidóza, lze ATTR diagnostikovat bez nutnosti histologického potvrzení, tedy neinvazivně (62). V případě nejednoznačných nálezů při neinvazivním vyšetření je k potvrzní diagnózy indikováno provedení endomyokardiální biopsie. Při podezření na AL amyloidózu je možné provést biopsii extrakardiální, nejčastěji odběrem vzorku podkožní tukové tkáně z oblasti břicha. Následně je proveden odběr kostní dřeně k identifikaci klonální populace plazmatických buněk a další vyšetření k vyloučení myelomu (63).
Vzhledem k pozdnímu věku nástupu projevů onemocnění u dědičných forem by mělo být u všech pacientů s TTR amyloidózou provedeno i genetické vyšetření (55, 59, 61).
Terapie
Terapie srdeční amyloidózy zahrnuje jak léčbu nespecifickou k ovlivnění symptomů, tak specifickou terapii, která je zaměřena na příčinu onemocnění.
Nespecifická léčba zahrnuje podpůrnou terapii srdečního selhání, léčbu arytmií, poruch vedení vzruchu či tromboembolických komplikací a u jednotlivých podtypů amyloidózy se zásadně neliší. U srdečního selhání zůstávají základními možnostmi léčby kličková diuretika a antagonisté mineralokortikoidních receptorů. Běžná terapie srdečního selhání zahrnující blokátory systému renin‑angiotenzin‑aldosteron (RAAS) a betablokátory není indikována, pacienty jsou tyto preparáty špatně tolerovány a mohou naopak symptomy ještě zhoršit. Digoxin má tendenci vázat se na amyloidní fibrily, což zvyšuje riziko jeho toxicity a v minulosti bylo jeho podávání kontraindikováno; při pečlivé monitoraci hladin může být ale s opatrností použit ke kontrole frekvence u pacientů s fibrilací síní s rychlou odpovědí komor. Ke kontrole rytmu může být použit amiodaron. U flutteru síní se lze často s úspěchem pokusit o katétrovou ablaci, u fibrilace síní je po ablaci vysoká míra recidivy. Vzhledem k vysokému riziku trombembolických komplikací přítomnost fibrilace síní vyžaduje antikoagulační terapii bez ohledu na hodnotu CHA2DS2VASc.
V případě indikace k trvalé kardiostimulaci by měla být zvolena stimulace biventrikulární, neboť pouze pravokomorová stimulace vede k další progresi srdečního selhání. Implantace kardioverter‑defibrilátoru je indikována v sekundární prevenci, v primární prevenci nebyl její přínos potvrzen.
Specifická léčba je cílena proti produkci amyloidního prekurzorového proteinu nebo proti tvorbě amyloidních fibril a liší se podle typu amyloidózy.
U neléčené AL amyloidózy je průměrná doba přežití pouze 4 až 24 měsíců, a právě kardiální postižení je pro prognózu limitující. Terapie musí být nasazena co nejdříve a zůstává v rukou hematologa, spolupráce kardiologa zahrnuje především léčbu srdečního selhání, řešení arytmií, popř. dalších kardiovaskulárních komplikací. Cílem léčby AL‑A je snížení populace klonálních plazmocytů a produkce lehkých řetězců. V případě stabilního kardiálního stavu je kurativní terapeutickou možností autologní transplantace kmenových buněk (ASCT). U AL se symptomatickým kardiálním postižením je však ASCT vysoce riziková a u těchto pacientů, kteří nejsou indikováni k ASCT, je zásadním průlomem v terapii z roku 2021 zařazení monoklonální protilátky anti‑CD38 (daratumumab) do kombinace s bortezomibem, cyklofosfamidem a dexametazonem. Zavedení této terapie zásadně zlepšilo prognózu nemocných. U refrakterních a relabujících AL je slibnou molekulou venetoclax (64, 65). Ve vysoce selektovaných případech AL amyloidózy zejména s izolovaným kardiálním postižením je možné zvážit ortotopickou transplantaci srdce (OTS) s následnou ASCT (52).
Pacienti s ATTRv mohou být kandidáty transplantace jater nebo kombinované transplantace jater a srdce. U nemocných s ATTRwt vzhledem k vyššímu věku v době diagnózy nejsou tito pacienti k transplantaci indikováni. V posledních letech dochází k významnému posunu v oblasti specifické farmakoterapie. V současné době je nejvýznamnějším preparátem tafamidis, stabilizér tetrameru transthyretinu, který na základě výsledkům studie ATTR‑ACT prokázal u nemocných s TTR amyloidózou významné snížení mortality a hospitalizací z kardiovaskulárních příčin. Tento lék je schválen pro léčbu ATTR kardiomyopatií, nicméně vzhledem k finanční náročnosti léčby není tato zatím hrazena z veřejného zdravotního pojištění. Řada dalších preparátů, které by mohly najít uplatnění v léčbě amyloidózy, nyní prochází klinickými studiemi. Jedná se o další molekuly stabilizující molekulu transthyretinu, dále malé interferující RNA molekuly (patisiran) nebo tzv. antisense oligonukleotidy (inotersen) ovlivňující tvorbu transthyretinu v játrech.
Non‑kompaktní kardiomyopatie
Jedná se o vzácný typ kardiomyopatie, která je řazena mezi tzv. neklasifikované kardiomyopatie. Onemocnění vzniká v průběhu nitroděložního vývoje, kdy dochází k poruše přeměny tzv. nekompaktní (spongiformní) vrstvy myokardu na myokard kompaktní. Nonkompaktní myokard se nachází hlavně v apikální části levé komory, ale může přetrvávat i ve střední části laterální nebo spodní stěny. Nonkompaktní myokard se může vyskytovat také v oblasti pravé komory, postižení může být tedy biventrikulární nebo může být izolovaně postižena pouze pravá komora (66). Přítomnost nonkompaktního myokardu se vyskytuje buď izolovaně, nebo je součástí některých vrozených srdečních vad, jako je defekt komorového septa nebo vrozené anomálie koronárních tepen. Stále není zcela jasné, zda je nonkompaktní kardiomyopatie (LVNC – left ventricular noncompaction cardiomyopathy) samostatnou etiologickou jednotkou, či morfologickým znakem jiných kardiomyopatií. U familiárních forem se podařilo identifikovat mutace v genech pro sarkomerické proteiny, v genu pro lamin A/C a v některých dalších genech, v důsledku čehož často dochází k překryvu s jinými kardiomyopatiemi, především dilatační a hypertrofickou kardiomyopatií. Mutace genu pro tafazzin (TAZ) přenášené jako X‑vázané způsobují Bártův syndrom, často pod obrazem kombinace DCM a LVNC (67). Diagnostika onemocnění je poměrně složitá, neboť fenopové vyjádření „nonkompakce“ může být přítomno i u zdravých osob nebo být přechodným obrazem jiných kardiomyopatií. Základní diagnostickou metodou je echokardiografie, jež používá pro diagnózu následující kritéria: 1) přítomnost tenké kompaktní vrstvy myokardu a silné nonkompaktní vrstvy (poměr vrstvy nekompaktní ke kompaktní je větší než 2, 2), nekompaktní myokard je typicky v oblasti hrotu a středního segmentu dolní a laterální stěny, 3) promývání recesů mezi trabekulami lze demonstrovat pomocí barevného dopplerovského zobrazení. Tato kritéria doplňuje ještě další – a to kritérium Stölbergerové, které pro diagnózu požaduje přítomnost více než 3 trabekul prominujících do levé komory v úrovni nad palpilárními svaly s echogenitou odpovídající myokardu. Pro přesnější echokardiografické zobrazení je možné využít podání kontrastu. Diagnostika této vzácné KMP se jeví obtížná i z pohledu magnetické rezonance. Původně bylo popisováno jako kritérium poměr trabekulizace k tloušťce kompaktní stěny LK ≥ 2,3 (tzn. „tloušťka“ trabekul je 2,3× větší než kompaktní stěny LK). Nicméně v současné době je zlatým standardem kritérium dle Jacquira, dle kterého tvoří celková masa trabekul v LK ≥ 20 % celkové masy LK (68). Ani toto kritérium ovšem není dokonalé a dle některých studií má velké množství falešně pozitivních nálezů – lze tedy konstatovat, že v této oblasti nejsou spolehlivá a přesná kritéria dosud známá. Klinicky může onemocnění zůstávat asymptomatické, mohou se objevit symptomy vyplývající z arytmií nebo projevy srdečního selhání. Léčba se tedy řídí platnými doporučeními ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání a doporučeními pro léčbu arytmií. Vzhledem k riziku tvorby intrakardiálních trombů a následné kardioembolizaci je u nemocných s EFLK pod 40 % doporučena trvalá antikoagulační léčba (69).
Závěr
Problematika kardiomyopatií je velice široká a obsáhnout možnosti jejich správné diagnostiky, diferenciální diagnostiky a léčby není snadné. Současně jde o poměrně často se vyskytující onemocnění, nezřídka u mladých jedinců, které – není‑li včas a správně diagnostikováno a léčeno – může být spojeno s významnou morbiditou i mortalitou. Jejich projevy mohou být v některých případech multisystémové a přesahují tak rámec kardiologie. Současně došlo v posledních letech k dramatickým změnám v dostupnosti řady moderních diagnostických metod i terapeutických postupů, které jsme se v textu pokusili shrnout.
Podpořeno grantem AZV MZ ČR NU22-02-00418
prof. MUDr. Jan Krejčí, Ph.D., FHFA
I. interní kardioangiologická klinika Fakultní nemocnice u sv. Anny v Brně a Lékařské fakulty Masarykovy univerzity
jan.krejci@fnusa.cz
Cit. zkr: Vnitř Lék. 2023;69(2):89-104Článek přijat redakcí: 21. 2. 2023
Článek přijat po recenzích: 13. 3. 2023
Sources
1. Elliott P, Andersson B, Arbustini E, et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2008;29(2):270-276. doi:10.1093/eurheartj/ehm342
2. Arbustini E, Narula N, Tavazzi L, et al. The MOGE(S) classification of cardiomyopathy for clinicians. J Am Coll Cardiol. 2014;64(3):304-318. doi:10.1016/j.jacc.2014. 05. 027
3. Merlo M, Gagno G, Baritussio A, et al. Clinical application of CMR in cardiomyopathies: evolving concepts and techniques : A position paper of myocardial and pericardial diseases and cardiac magnetic resonance working groups of Italian society of cardiology. Heart Fail Rev. 2023;28(1):77-95. doi:10.1007/s10741-022-10235-9
4. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-3726. doi:10.1093/ eurheartj/ehab368
5. Arbustini E, Behr ER, Carrier L, et al. Interpretation and actionability of genetic variants in cardiomyopathies: a position statement from the European Society of Cardiology Council on cardiovascular genomics. Eur Heart J. 2022;43(20):1901-1916. doi:10.1093/ eurheartj/ehab895
6. Ammirati E, Buono A, Moroni F, et al. State‑of‑the‑Art of Endomyocardial Biopsy on Acute Myocarditis and Chronic Inflammatory Cardiomyopathy. Curr Cardiol Rep. 2022;24(5):597 - 609. doi:10.1007/s11886-022-01680-x
7. Seferović PM, Tsutsui H, McNamara DM, et al. Heart Failure Association of the ESC, Heart Failure Society of America and Japanese Heart Failure Society Position statement on endomyocardial biopsy. Eur J Heart Fail. 2021;23(6):854-871. doi:10.1002/ejhf.2190
8. Caforio ALP, Pankuweit S, Arbustini E, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34(33):2636-2648, 2648a-2648d. doi:10.1093/eurheartj/eht210
9. Veselka J, Anavekar NS, Charron P. Hypertrophic obstructive cardiomyopathy. Lancet Lond Engl. 2017;389(10075):1253-1267. doi:10.1016/S0140-6736(16)31321-6
10. Bláha M. (Athlete’s heart vs hypertrophic cardiomyopathy - differential diagnostics according to current guidelines). Cor Vasa. 2020;62(1):50-55. doi:10.33678/cor.2019.087
11. Brenes JC, Doltra A, Prat S. Cardiac magnetic resonance imaging in the evaluation of patients with hypertrophic cardiomyopathy. Glob Cardiol Sci Pract. 2018;2018(3):22. doi:10.21542/gcsp.2018.22
12. Palandri C, Santini L, Argirò A, et al. Pharmacological Management of Hypertrophic Cardiomyopathy: From Bench to Bedside. Drugs. 2022;82(8):889-912. doi:10.1007/s40265 - 022-01728-w
13. Olivotto I, Oreziak A, Barriales‑Villa R, et al. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER‑HCM): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet Lond Engl. 2020;396(10253):759-769. doi:10.1016/ S0140-6736(20)31792-X
14. Hegde SM, Lester SJ, Solomon SD, et al. Effect of Mavacamten on Echocardiographic Features in Symptomatic Patients With Obstructive Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2021;78(25):2518-2532. doi:10.1016/j.jacc.2021. 09. 1381
15. Ho CY, Mealiffe ME, Bach RG, et al. Evaluation of Mavacamten in Symptomatic Patients With Nonobstructive Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2020;75(21):2649 - 2660. doi:10.1016/j.jacc.2020. 03. 064
16. Sigwart U. Non‑surgical myocardial reduction for hypertrophic obstructive cardiomyopathy. The Lancet. 1995;346(8969):211-214. doi:10.1016/S0140-6736(95)91267-3
17. Bytyçi I, Nistri S, Mörner S, Henein MY. Alcohol Septal Ablation versus Septal Myectomy Treatment of Obstructive Hypertrophic Cardiomyopathy: A Systematic Review and Meta‑Analysis. J Clin Med. 2020;9(10):3062. doi:10.3390/jcm9103062
18. Lawrenz T, Kuhn H. Endocardial radiofrequency ablation of septal hypertrophy. A new catheter‑based modality of gradient reduction in hypertrophic obstructive cardiomyopathy. Z Kardiol. 2004;93(6):493-499. doi:10.1007/s00392-004-0097-x
19. Lawrenz T, Lawin D, Radke K, Stellbrink C. Acute and chronic effects of endocardial radiofrequency ablation of septal hypertrophy in HOCM. J Cardiovasc Electrophysiol. 2021;32(10):2617-2624. doi:10.1111/jce.15203
20. Ommen SR, Mital S, Burke MA, et al. 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2020;76(25):3022-3055. doi:10.1016/j. jacc.2020. 08. 044
21. Authors/Task Force members, Elliott PM, Anastasakis A, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(39):2733-2779. doi:10.1093/eurheartj/ehu284
22. Tower‑Rader A, Jaber WA. Multimodality Imaging Assessment of Fabry Disease. Circ Cardiovasc Imaging. 2019;12(11):e009013. doi:10.1161/CIRCIMAGING.119.009013
23. Pieroni M, Moon JC, Arbustini E, et al. Cardiac Involvement in Fabry Disease: JACC Review Topic of the Week. J Am Coll Cardiol. 2021;77(7):922-936. doi:10.1016/j.jacc.2020. 12. 024
24. Zemánek D, Januška J, Honěk T, et al. Nationwide screening of Fabry disease in patients with hypertrophic cardiomyopathy in Czech Republic. ESC Heart Fail. 2022;9(6):4160 - 4166. doi:10.1002/ehf2.14135
25. Weidemann F, Jovanovic A, Herrmann K, Vardarli I. Chaperone Therapy in Fabry Disease. Int J Mol Sci. 2022;23(3):1887. doi:10.3390/ijms23031887
26. El Dib R, Gomaa H, Carvalho RP, et al. Enzyme replacement therapy for Anderson‑Fabry disease. Cochrane Database Syst Rev. 2016;7(7):CD006663. doi:10.1002/14651858. CD006663.pub4
27. Simonetta I, Tuttolomondo A, Daidone M, Miceli S, Pinto A. Treatment of Anderson‑Fabry Disease. Curr Pharm Des. 2020;26(40):5089-5099. doi:10.2174/1381612826666200317142412
28. Pinto YM, Elliott PM, Arbustini E, et al. Proposal for a revised definition of dilated cardiomyopathy, hypokinetic non‑dilated cardiomyopathy, and its implications for clinical practice: a position statement of the ESC working group on myocardial and pericardial diseases. Eur Heart J. 2016;37(23):1850-1858. doi:10.1093/eurheartj/ehv727
29. Diagnosis and Management of Rare Cardiomyopathies in Adult and Paediatric Patients. A Position Paper of the Italian Society of Cardiology (SIC) and Italian Society of Paediatric Cardiology (SICP) | Elsevier Enhanced Reader. doi:10.1016/j.ijcard.2022. 03. 050
30. Schultheiss HP, Fairweather D, Caforio ALP, et al. Dilated cardiomyopathy. Nat Rev Dis Primer. 2019;5(1):32. doi:10.1038/s41572-019-0084-1
31. Towbin JA, McKenna WJ, Abrams DJ, et al. 2019 HRS expert consensus statement on evaluation, risk stratification, and management of arrhythmogenic cardiomyopathy. Heart Rhythm. 2019;16(11):e301-e372. doi:10.1016/j.hrthm.2019. 05. 007
32. Wilde AAM, Semsarian C, Márquez MF, et al. European Heart Rhythm Association (EHRA)/ Heart Rhythm Society (HRS)/Asia Pacific Heart Rhythm Society (APHRS)/Latin American Heart Rhythm Society (LAHRS) Expert Consensus Statement on the State of Genetic Testing for Cardiac Diseases. Heart Rhythm. 2022;19(7):e1-e60. doi:10.1016/j.hrthm.2022. 03. 1225
33. Donal E, Delgado V, Bucciarelli‑Ducci C, et al. Multimodality imaging in the diagnosis, risk stratification, and management of patients with dilated cardiomyopathies: an expert consensus document from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2019;20(10):1075-1093. doi:10.1093/ehjci/jez178
34. Di Marco A, Anguera I, Schmitt M, et al. Late Gadolinium Enhancement and the Risk for Ventricular Arrhythmias or Sudden Death in Dilated Cardiomyopathy: Systematic Review and Meta‑Analysis. JACC Heart Fail. 2017;5(1):28-38. doi:10.1016/j.jchf.2016. 09. 017
35. Li S, Zhou D, Sirajuddin A, et al. T1 Mapping and Extracellular Volume Fraction in Dilated Cardiomyopathy: A Prognosis Study. JACC Cardiovasc Imaging. 2022;15(4):578-590. doi:10.1016/j.jcmg.2021. 07. 023
36. Halliday BP. State of the art: multimodality imaging in dilated cardiomyopathy. Heart Br Card Soc. 2022;108(23):1910-1917. doi:10.1136/heartjnl-2022-321116
37. Halliday BP, Wassall R, Lota AS, et al. Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED‑HF): an open‑label, pilot, randomised trial. Lancet Lond Engl. 2019;393(10166):61-73. doi:10.1016/S0140-6736(18) ‑ 32484-X
Další literatura u autorů a na www.casopisvnitrnilekarstvi.cz
Labels
Diabetology Endocrinology Internal medicine Cardiology
Article was published inInternal Medicine

2023 Issue 2-
All articles in this issue
- Hlavní téma – kardiologie
- Kam kráčí preventivní kardiologie?
- Co je nového v léčbě chronického srdečního selhání?
- Novinky v diagnostice a léčbě kardiomyopatií
- Dopady nekontrolované hypertenze na CNS
- Dávkování základní farmakoterapie a jeho vliv na prognózu pacientů hospitalizovaných pro srdeční selhání
- Možnosti léčby bolesti u osteoartrózy
- Supresní terapie levothyroxinem v léčbě karcinomu štítné žlázy
- Novinky v imunologii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Novinky v diagnostice a léčbě kardiomyopatií
- Co je nového v léčbě chronického srdečního selhání?
- Novinky v imunologii
- Supresní terapie levothyroxinem v léčbě karcinomu štítné žlázy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

