-
Medical journals
- Career
Histiocytóza z Langerhansových buněk. Přehled příznaků, které přivádějí pacienty k lékařům všech medicínských odborností
Authors: Zdeněk Adam 1; Luděk Pour 1; Miroslav Tomíška 1; Karel Starý 2; Teodor Horváth 4; Martina Doubková 3; Tomáš Nebeský 5; Zdeněk Řehák 6; Renata Koukalová 6; Marta Krejčí 1; Martin Krejčí 1; Ivanna Boichuk 1; Martin Štork 1; Sabina Ševčíková 7; Zuzana Adamová 8; Zdeněk Král 1
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Interní gastroenterologická klinika, endokrinologická ambulance LF MU a FN Brno 2; Klinika nemocí plicních a TBC FN Brno a LF MU 3; Klinika chirurgie LF MU a FN Brno 4; Klinika radiologie a nukleární medicíny LF MU a FN Brno 5; Oddělení nukleární medicíny, Masarykův onkologický ústav Brno 6; Ústav patologické fyziologie LF MU Brno 7; Chirurgické oddělení, Nemocnice Frýdek-Místek 8
Published in: Vnitř Lék 2022; 68(E-2): 11-21
Category: Review Articles
Overview
Histiocytóza z Langerhansových buněk (Langerhans cell histiocytosis – LCH) je vzácné onemocnění s indicencí 1–2 případy /1 milion dospělých, jehož podstatou je proliferace abnormálních (klonálních) Langerhansových buněk, které mohou poškodit různé orgány, nejčastěji kosti, kůži, plíce, hypofýzu, lymfatické uzliny, ale i dásně a další orgány. Průběh LCH je variabilní, od samoodeznívající choroby do postupně progredující, ale jen velmi vzácně končící úmrtím. Cílem následujícího textu je podat přehled všech nejčastějších příznaků a manifestací LCH.
Klíčová slova:
histiocytóza z Langerhansových buněk
Úvod
Histiocytóza z Langerhansových buněk (LCH) je choroba, která postihuje jak dětské pacienty, tak i osoby ve věku dospělém. Projevy LCH jsou natolik různorodé, že mohou přivést dětské i dospělé nemocné ke specialistům jakéhokoliv medicínského oboru, tedy i k internistům. Tato skutečnost se odráží i v české a slovenské lékařské literatuře, v níž jsou jednotlivé formy manifestace LCH dobře popsány příslušnými specialisty, jak dokazují citace v tomto článku. Morfologický podklad této nemoci je vždy stejný – klonální expanze Langerhansových buněk, jak popisuje Roman Kodet (1). Formy LCH, s nimiž se lze setkat u dětských pacientů, popisuje Hubert Mottl a Jan Starý, kteří mají s jejich léčbou dlouholeté zkušenosti (2).
Časopis Vnitřní lékařství této málo známé nemoci věnoval v roce 2010 celé supplementum (roč. 56, suppl 2). Tento článek je určen jak pro lékaře všech odborností, aby jim připomněl velmi rozličné manifestace LCH, protože povědomí lékařů o tom, co tato nemoc může člověku způsobit, je důležité pro časnou diagnostiku. Článek je však určen i pro hematology, kteří tyto nemocné léčí a kteří před léčbou musí stanovit rozsah nemoci, k čemuž potřebují informace o všech možných projevech této nemoci. V dalším navazujícím článku pak přinášíme přehled léčebných postupů dostupných v roce 2022, v nichž má biologická léčba (vemurafenib, dabrafenib a cobimetinib) již své místo.
Epidemiologie, průběh nemoci a stanovení jejího rozsahu
Epidemiologie
LCH je velmi vzácná choroba, její incidence v dospělé bělošské populaci se udávala a stále udává kolem 1–2 případů / 1 milion dospělých. Epidemiologické studie za posledních 20 let shrnuje tabulka 1. Všechny citované studie se shodují jak v incidenci, tak v názoru, že hodně případů stále uniká diagnostice (3–8).
Table 1. Incidence histiocytózy z Langerhansových buněk 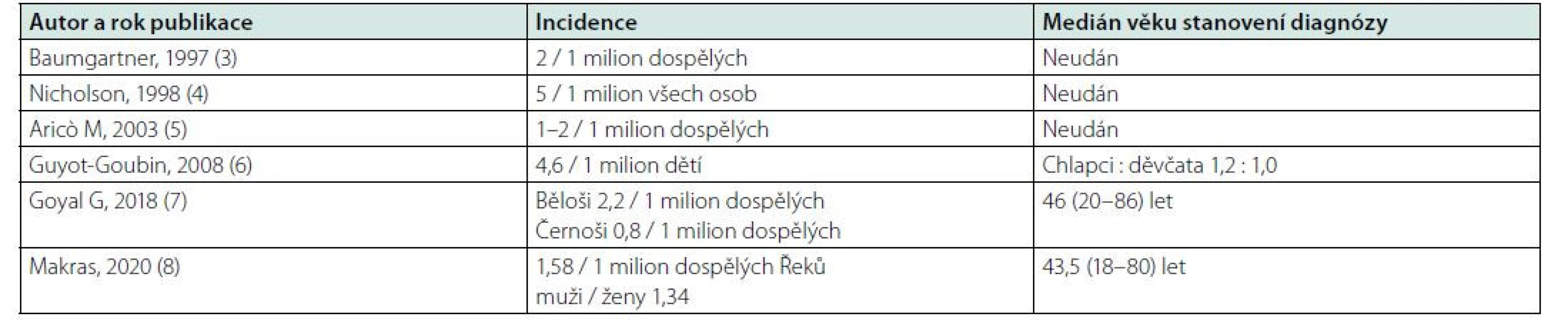
Průběh
Choroba má neagresivní průběh. Goayl na základě analýzy registru v USA uvádí, že při mediánu sledování 83 (16–323) měsíců zemřelo 19 dospělých osob s LCH, z toho sedm na jiné malignity, šest na kardiovaskulární příhody, jeden nehodou, pět z jiných příčin. Proti průměrné populaci pozorovali vyšší riziko AML. V tomto souboru nebylo žádné z úmrtí zapříčiněno LCH. Autoři z toho vyvozují, že LCH je chronická choroba, která ve sledovaném souboru nebyla příčinou žádného úmrtí, která ale zvyšuje riziko jiných malignit, hlavně akutní myeloidní leukemie (7). Z našich zkušeností neagresivnost této nemoci nemůžeme potvrdit. V devadesátých letech jsme léčili pacienta veškerou v té době dostupnou chemoterapií včetně vysokodávkované chemoterapie s autologní transplantací, a přesto nemoc u něj recidivovala a zemřel na infekční komplikaci při poškození plic. Druhým případem s život ohrožující chorobou byl pacient s LCH s neobvykle vysokým proliferačním indexem a generalizovaným postižením uzlin. Jeho choroba po všech léčebných alternativách rychle recidivovala a zachránila jej až alogenní transplantace. Nebýt možnosti alogenní transplantace, tak by asi nemoci podlehl. Takže ač Goayl uvádí, že LCH v jejich souboru neměla u žádného pacienta agresivní průběh (7), tak na našem pracovišti jsme v průběhu 30 let měli dva případy ze 35 s neobvykle agresivním průběhem.
Souhlasíme však s tvrzením, že u většiny pacientů má choroba neagresivní průběh, ale je nutno počítat i s agresivně se chovajícími formami nemoci. Vysoký počet mitóz a vysoký proliferační index Ki67 signalizuje agresivní průběh (1). Vzhledem k příznivé prognóze této nemoci bude prevalence LCH v naší populaci 10 až 20× vyšší, než je incidence.
Průběh LCH je u dospělých velmi různorodý. U některých se vyskytne pouze v jednom ložisku a po léčbě se již neobjeví, u jiných má recidivující charakter, objevují se stále nová a nová ložiska a choroba může být příčinou omezení hybnosti či může dokonce přivodit smrt.
Stanovení rozsahu choroby
Po zjištění diagnózy LCH je, jako u všech maligních chorob, nutno stanovit rozsah choroby. A jako u všech krevních chorob existuje i zde specifická klasifikace rozsahu LCH. Cílem vyšetření je zjistit, zda je postiženo jen jedno ložisko nebo je ložisek, více. A pokud je ložisek více, zda jsou pouze v rámci jednoho orgánu či tkáně, anebo zda postihují více orgánů či tkání. Teprve pak lze provést klasifikaci rozsahu LCH dle tabulky 2. Od klasické TNM klasifikace se zde postup liší, protože vyžaduje pátrání po specifických formách LCH v jednotlivých tkáních, a proto lékař stanovující rozsah nemoci musí tyto formy manifestace znát a cíleně po nich pátrat. Z tohoto důvodu následuje popis manifestací této nemoci v jednotlivých tkáních a orgánech.
Table 2. Klasifikace Langerhansovy histiocytózy u dospělých (3) 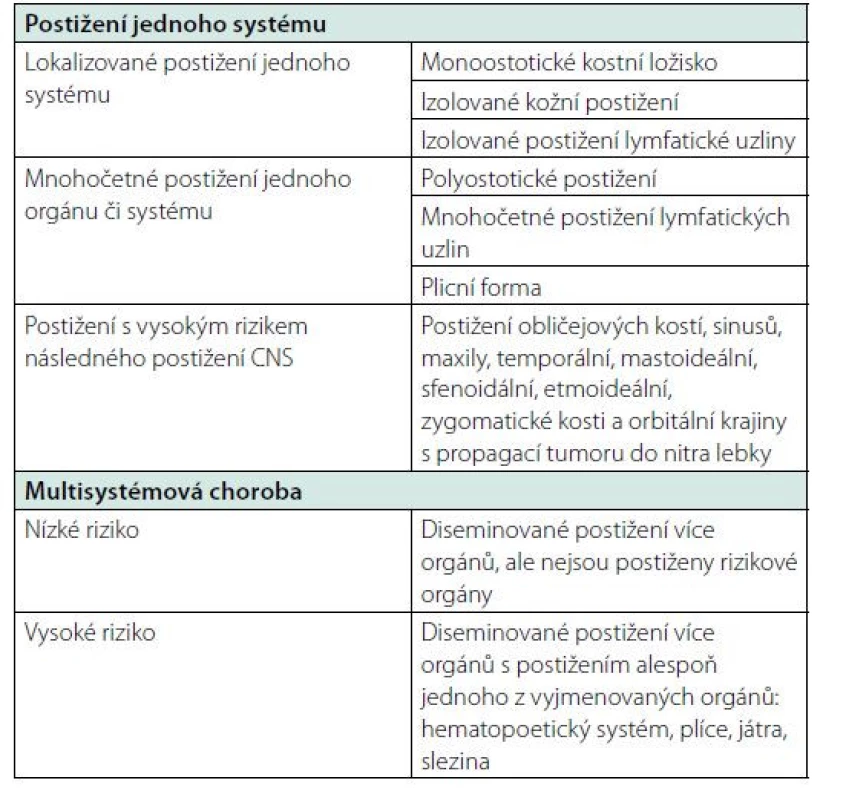
Klinické příznaky LCH aneb jaké potíže přivedou osoby s LCH k lékaři
Co vše tato choroba může postihnout? Odpověď je jednoduchá: „vše“. Při pohledu do databáze PUBMED na přehled publikovaných případů lze říci, že nemoc může i u dospělého postihnout každý orgán. Ale pravda je, že některé lokalizace jsou častější a některé méně časté. Analýzu nejčastějších lokalizací u dospělých zveřejnil poprvé Baumgarner (3) a následně pak byla zveřejněna data z mezinárodního registru pro tuto chorobu (International Registry of the Histiocyte Society) (5), viz tabulka 3. V lékařské literatuře lze nalézt více podobných analýz, v procentech se liší, ale pořadí manifestací je podobné – ne‑li shodné.
Table 3. Nejčastější lokalizace LCH u dospělých 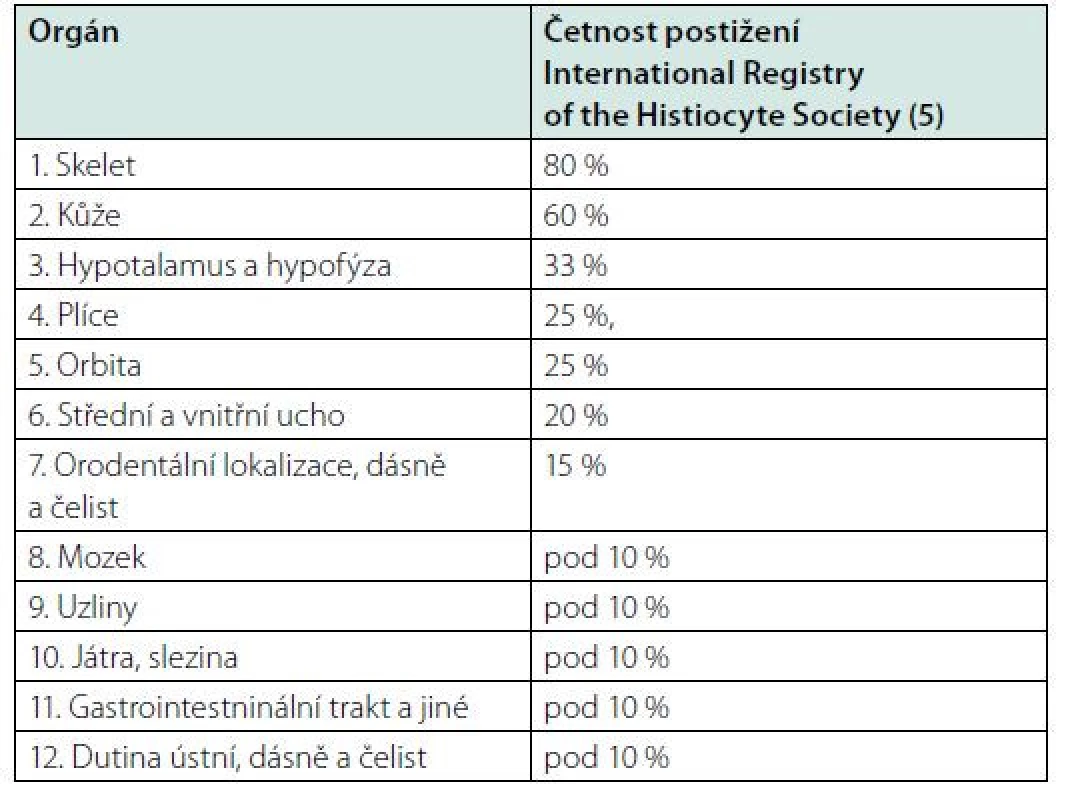
Kostní projevy
LCH Histiocytóza z Langerhansových buněk v dospělosti postihuje dominantně skelet, vytváří osteolytická ložiska podobná osteolýze při mnohočetném myelomu. Nejčastěji je uváděno postižení kalvy (Obr. 1), následuje pak osteolytické postižení žeber. S menší frekvencí bývají postiženy další části skeletu, například dlouhé kosti jako na obrázku 2. U některých pacientů jsou kostní ložiska různého stáří, hojící se místa mají sklerotický lem. Všechna ložiska nemusí bolet. Zduření tkání přiléhajících ke kosti signalizuje, že choroba prorůstá do okolí a mnohdy až zduření nad kostí upozorní na přítomnost kostního ložiska. Kostní ložiska často způsobují zvýšený kostní obrat, a proto jsou znázornitelná metodou scintigrafie skeletu pomocí technecium‑pyrofosfátu. Znázornění metodou FDG‑PET/ CT má výhodu v zachycení i mimokostních ložisek, proto ji preferujeme. FDG‑PET/ CT zobrazení vypovídá o aktivitě či neaktivitě ložiska a může pomoci při plánování radioterapie a vyhodnocování léčebné odpovědi. Velmi citlivou metodou zobrazení patologického děje v kosti je však magnetická rezonance (MR), která je optimální zobrazovací metodou pro plánování rozsahu radioterapie.
Image 1. LCH postihuje velmi často lebeční kosti, ale může postihnout kteroukoliv kost v těle. Kostní ložiska LCH mají osteolytický charakter, ale tumorózní hmoty mohou expandovat do okolí kosti a způsobovat hmatné zduření, pokud expandují zevně. Na MR zobrazení je zřetelný osteolytický proces okcipitálně, který expandoval jak vně kosti, takže pacient udával v tom místě hmatné zduření, tak také expandoval do nitra kalvy a komprimoval šedou koru mozkovou v oblasti zrakového centra, což se projevilo poruchou zraku. Po léčbě kladribinem se vše upravilo a pacient je více než 10 let v remisi. K podobné osteolýze s expanzí zevně i dovnitř může dojít v kterékoliv lebeční kosti 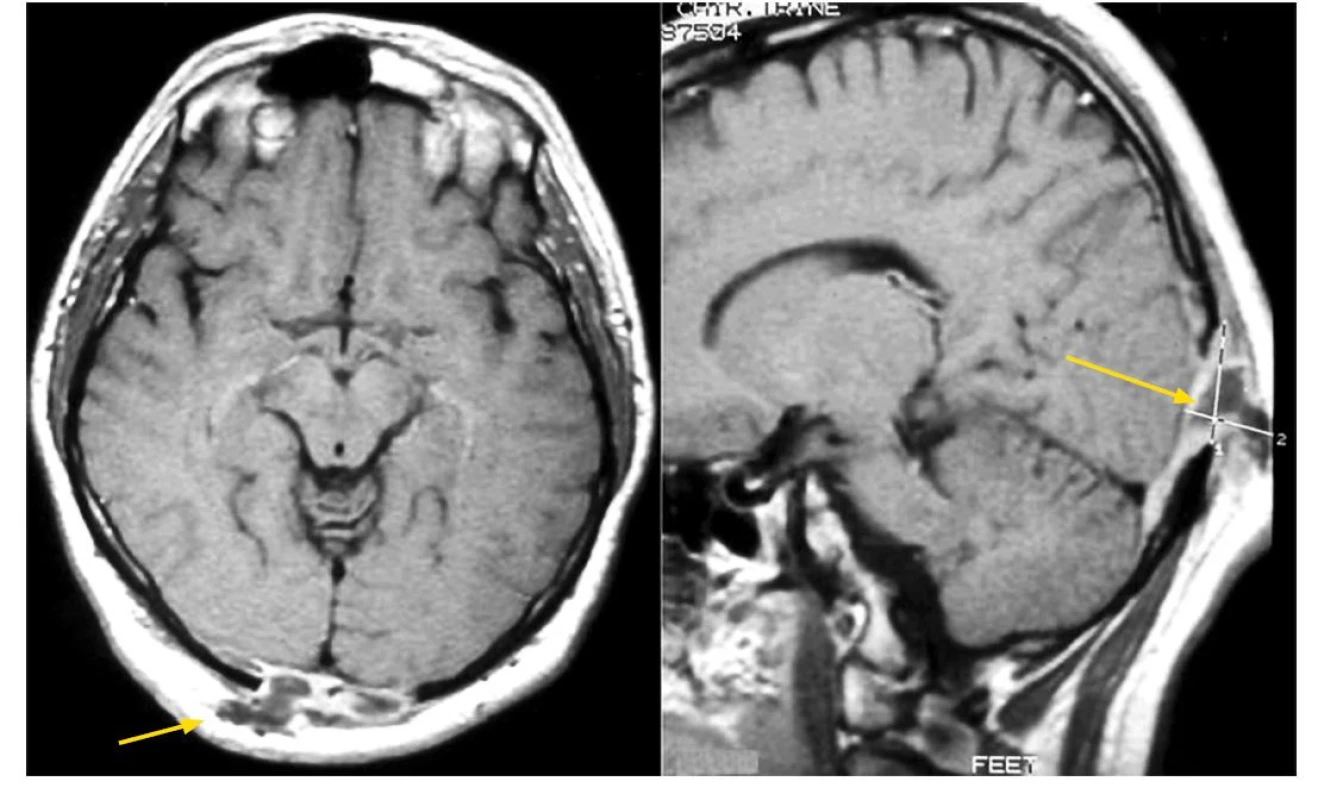
Image 2. Osteolytické ložisko ve femuru narušující kortikalis. Snímek zapůjčil pro tuto publikaci prof. Claus Doberaurer z Gelsenkirchenu, Německo 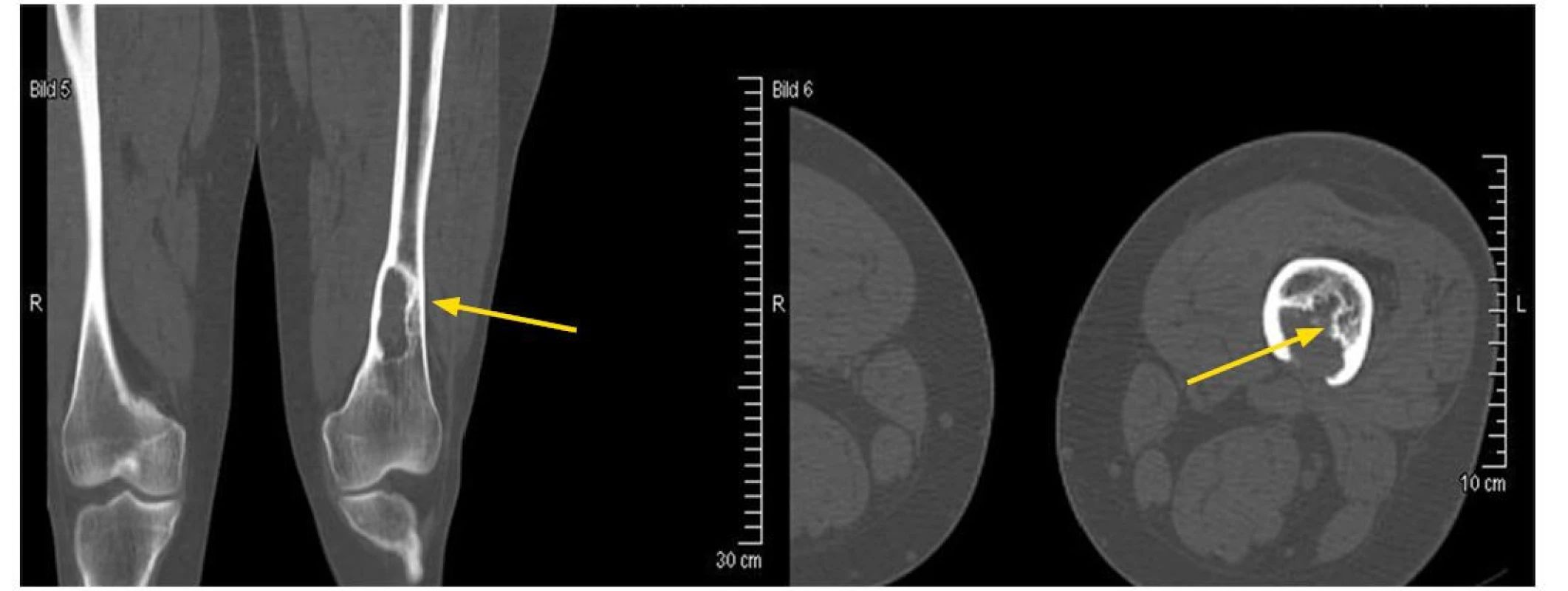
Za zvláště rizikové kostní lokalizace jsou považovány kostní defekty v oblasti orbity se supraorbitálními infiltráty a obecně postižení obličejových kostí. Uvedené postižení bývá s vyšší pravděpodobností provázeno pozdějším postižením hypotalamu a CNS (9–11).
Kožní projevy LCH
Kožní manifestace jsou u Langerhansovy histiocytózy velmi časté a mohou být vůbec prvními zachytitelnými projevy nemoci. Infiltrace kůže buňkami Langerhansovy histiocytózy často postihuje intertriginózní oblasti (perianální oblast, vulva, třísla, pupek, viz Obr. 3) Typickou morfou je hnědorůžová papula velikosti 1–5 mm, při tendenci ke splývání, zvláště v oblasti kůže kštice, se objevuje i šupení (Obr. 4). Popisovány jsou i vezikuly a pustuly. Papulózní projevy jsou často hodnoceny jako nespecifické či ekzémové. Šupící plošky jsou zaměňovány se seboroickou dermatitidou, zvláště u kojenců a malých dětí při postižení vlasaté části hlavy (12).
Image 3. Fotografie análního otvoru. Prvním příznakem onemocnění byla bolest a svědění anální krajiny po jízdě na horském kole. LCH zde mělo formu připomínající kondylomata, ale histologické vyšetření v těchto morfách prokázalo LCH. Anus byl ozářen 20 Gy a proces zcela vymizel 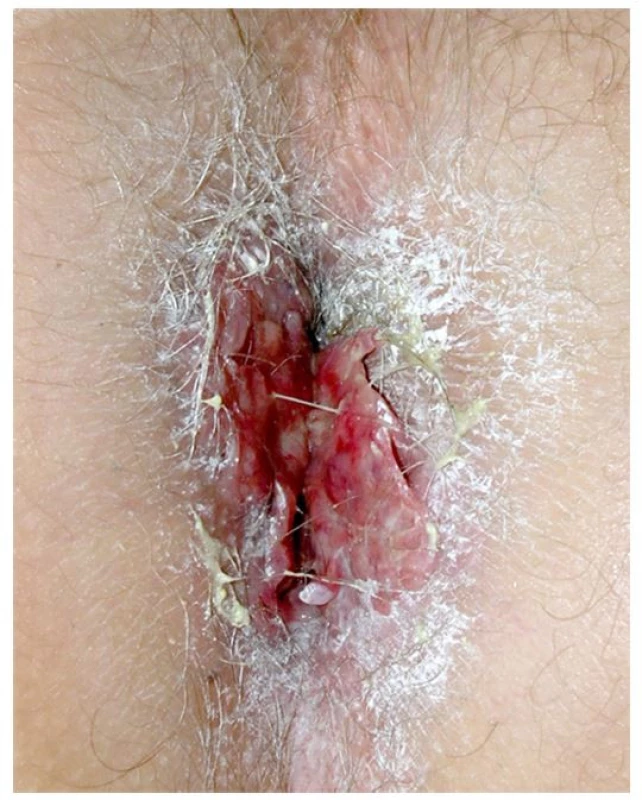
Image 4. LCH infiltruje často intertriginózní oblasti, ale může se objevit i na obličeji a na paži. Makroskopicky může připomínat folikulitidu a jedině histologické vyšetření excize kůže může správně stanovit diagnózu. Proto u špatně se hojících či nehojících se kožních morf je na místě vždy histologická verifikace kožního onemocnění 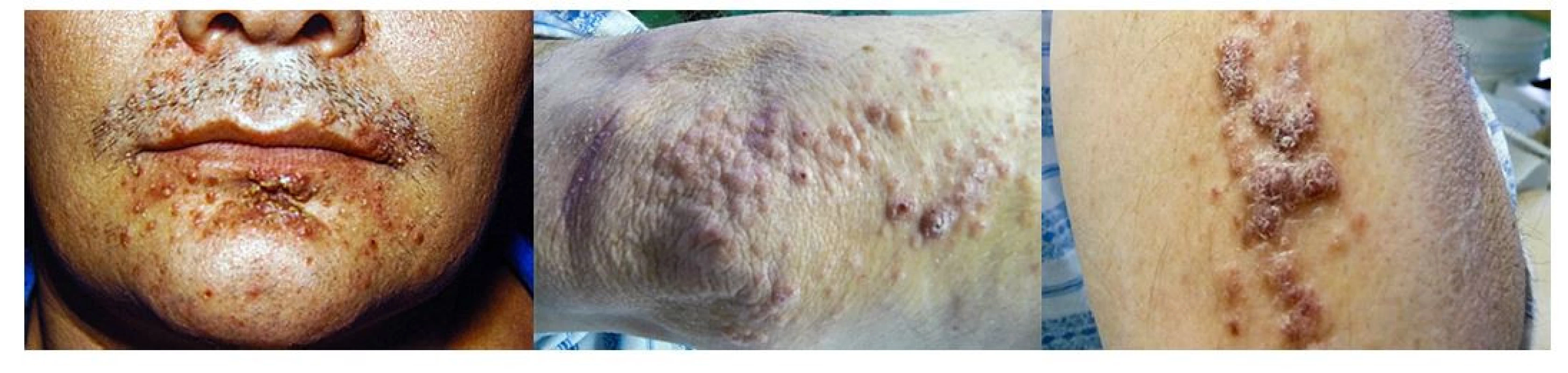
Vezikulózní projevy mohou napodobovat varicelu i ekzematizovaný scabies. U nejbenignější formy choroby, Hashimoto‑Pritzkerovy nemoci, se již krátce po narození dítěte objevují mnohočetné nebo solitární červenohnědé uzlíky. Kožní projevy se mohou sdružovat s kostním či viscerálním postižením, v případě závažnějšího průběhu splývají, exulcerují a stav se může komplikovat bakteriální či mykotickou superinfekcí. To, že jde o kožní projev LCH, nelze obvykle rozpoznat při makroskopickém pohledu, ale pro rozpoznání je potřeba provést excizi a histologické hodnocení vzorku. Proto také dermatolog St Claire nazval tuto chorobu velkým imitátorem (13). Intertriginózní postižení v axilách, inguinách a v anogenitální oblasti spojené s erytémem a erozemi jsou často špatně interpretovány jako ekzém a psoriáza, kandidové infekce nebo intertrigo. Generalizované kožní erupce mohou být mylně interpretovány jako psoriasis guttata, prurigo nodularis nebo lichen planus. Bez odebrání kožní biopsie není možné kožní formu LCH rozpoznat.
Změny na nehtech zahrnují paronychia, onycholysis, subunguální hyperkeratózu a purpurové strie nehtového lůžka. Někdy jsou subunguálně viditelné tmavohnědé strie, podobné jako způsobují některé medikamenty. Kožní projevy se mohou sdružovat s kostním či viscerálním postižením, může však jít také o izolovaný projev, který často spontánně regreduje (14–19).
Rozdílnost izolovaného postižení plic od postižení plic v rámci multiorgánového postižení
Úvodem chceme zdůraznit, že zatímco u všech ostatních forem LCH se jedná o klonální proliferaci a expanzi Langerhansových buněk, tak u plic existují dvě etiopatogeneticky i léčebně odlišné formy LCH, ačkoliv na HRCT vyšetření i při histologickém vyšetřením plicní tkáně mají stejný obraz.
• Izolovaná plicí forma vznikající jako atypická imunitní reakce na cigaretový kouř.
• Plicní forma LCH, které je součástí multiorgánového poškození.
Pokud se jedná o izolované plicní postižení, může jít o reaktivní proces vyvolaný kouřením. A proto ukončení kouření a vyhýbání se místům, v nichž se kouří, může vést k regresi procesu, dokumentovaném i kontrolními HRCT vyšetřeními (20–23).
Z prognostického a léčebného pohledu je proto zásadní otázka: jde jen o izolované plicní postižení u kuřáka? Nebo jde o plicní postižení s dalšími ložisky mimo plíce? Zodpovězení této otázky je klíčové pro plánování léčby. Plicní forma se považuje za relativně příznivou, pokud jde o izolovanou formu u kuřáka. Základním předpokladem ke zlepšení je nejen přestat kouřit, ale také se vyhýbat místům, v nichž je kouř z cigaret. Teprve pokud po půl roce není na HRCT viditelné zlepšení, je na zvážení medikamentózní léčba. Pokud však jde o plicní formu navazující na generalizované postižení skeletu a dalších orgánů, tak je průběh relativně nepříznivý a léčba je nutná ihned po stanovení diagnózy (20–23).
Klinické projevy plicní formy LCH
Respirační cesty jsou postiženy častěji u dospělých než u dětí. Pacienti přicházejí k lékaři s anamnestickým údajem dušnosti, ale i s bolestmi na hrudníku, neproduktivním kašlem, někdy udávají teploty a úbytek hmotnosti. LCH v plicním parenchymu má charakter intersticiálního postižení a jak víme, intersticiální plicní postižení obvykle není viditelné na klasickém snímku plic, ale vyžaduje zobrazení plicního parenchymu metodou HRCT. A proto pokud plicní problémy trvají déle než obvyklá bronchitida, což lze zjistit z anamnézy, měl by ošetřující lékař zvážit zobrazení plicního parenchymu metodou HRCT (21–23).
Tento častý diagnostický problém dokumentuje obrázek 5, na němž je vidět v tom samém týdnu provedený snímek plic, který je zdánlivě normální, a HRCT plic, které je značně patologické.
Image 5. Pacientka s diagnózou LCH stanovenou před 20 lety z kožního infiltrátu byla přijata pro infekci. Na snímku plic není zřetelná patologie. Pro dušnost však ihned provedeno HRCT i s trojrozměrnou rekonstrukcí. HRCT prokázalo cystické změny plicního parenchymu. Proto máme-li podezření na plicní formu LCH, je nutno provést HRCT zobrazení i při normálním snímku plic 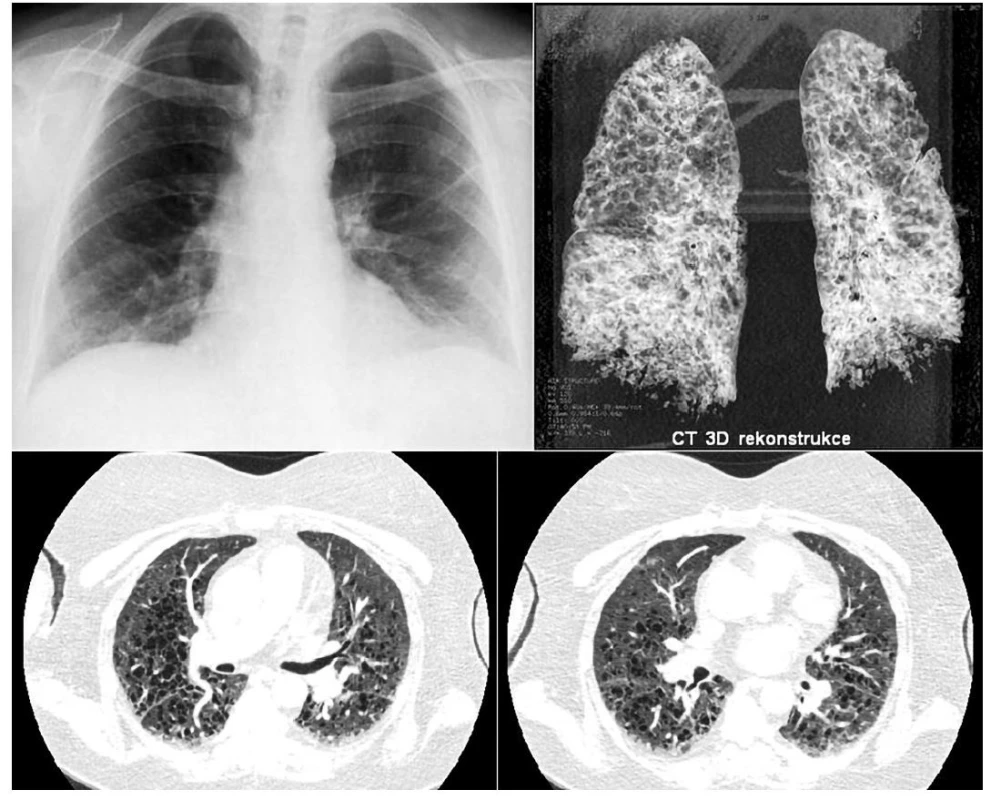
Image 6. Schematické znázornění vývoje plicní formy LCH. Počátečný morfou je nodulus, v němž postupně vzniká kavita, které se promění v cystu. Více cyst pak může splývat a vytvořit značně velké cysty, jak ukazuje další obraz. Tyto velké cysty pak mohou způsobit spontánní pneumotorax 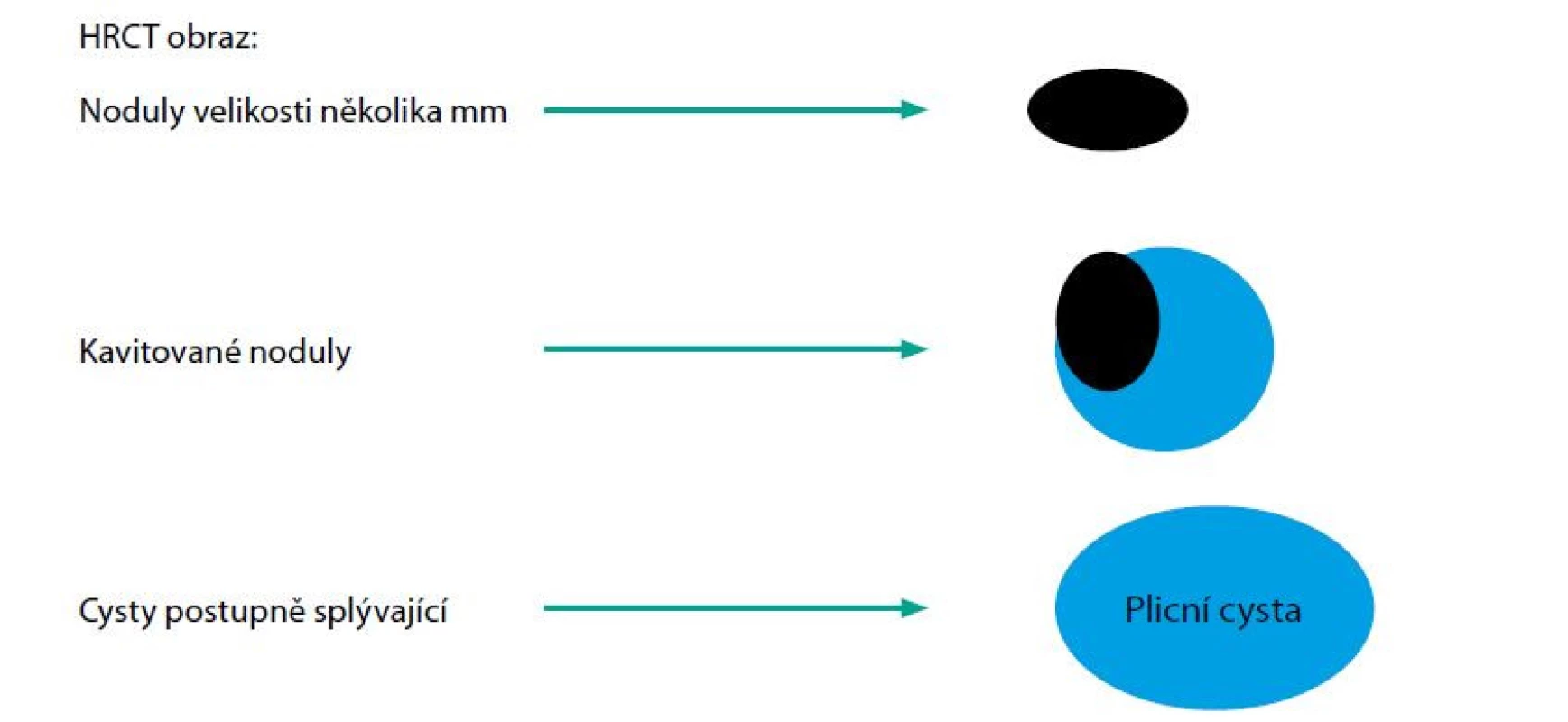
Proces je zřetelně vidět pouze na HRCT plic, nikoliv na rentgenovém snímku Plicní forma LCH začíná jako diseminované drobné plicní nodularity, viditelné na HRCT, ale neviditelné na klasickém snímku plic. Tyto nodularity procházejí vývojem, postupně v nich vznikají dutinky (kavity) neboli kavitované nodularity a ty se pak vyvíjejí směrem do plicních cyst. Ty se pak mohou spojovat do cyst velkých rozměrů. Tento vývoj ilustruje schéma na obázku 6. Cysty a intersticiální nodularity opacity jsou uložené obvykle blíže hilům. Cysty jsou častěji v horních lalocích, méně jich je ve středních lalocích a vynechávají kostodiafragmatický úhel. Zesílení intersticia je při HRCT vyšetření zřetelné hlavně bazálně, viz Obr. 7. Prasknutí cyst může vést k vytvoření komunikace s pleurální dutinou a vznikne spontánní pneumotorax.
Image 7. Pokročilá forma plicní HRCT plic. Nodularity přecházejí v kavitované nodularity, později v cysty, které mají tendenci ke splývání. A velké plicní cysty pak mohou být příčinou spontánního pneumothoraxu. U tohoto pacienta byla diagnóza stanovena až po třetím spontánním pneumothoraxu, kdy byla provedena thorakoskopie a odběr vzorku na histologii 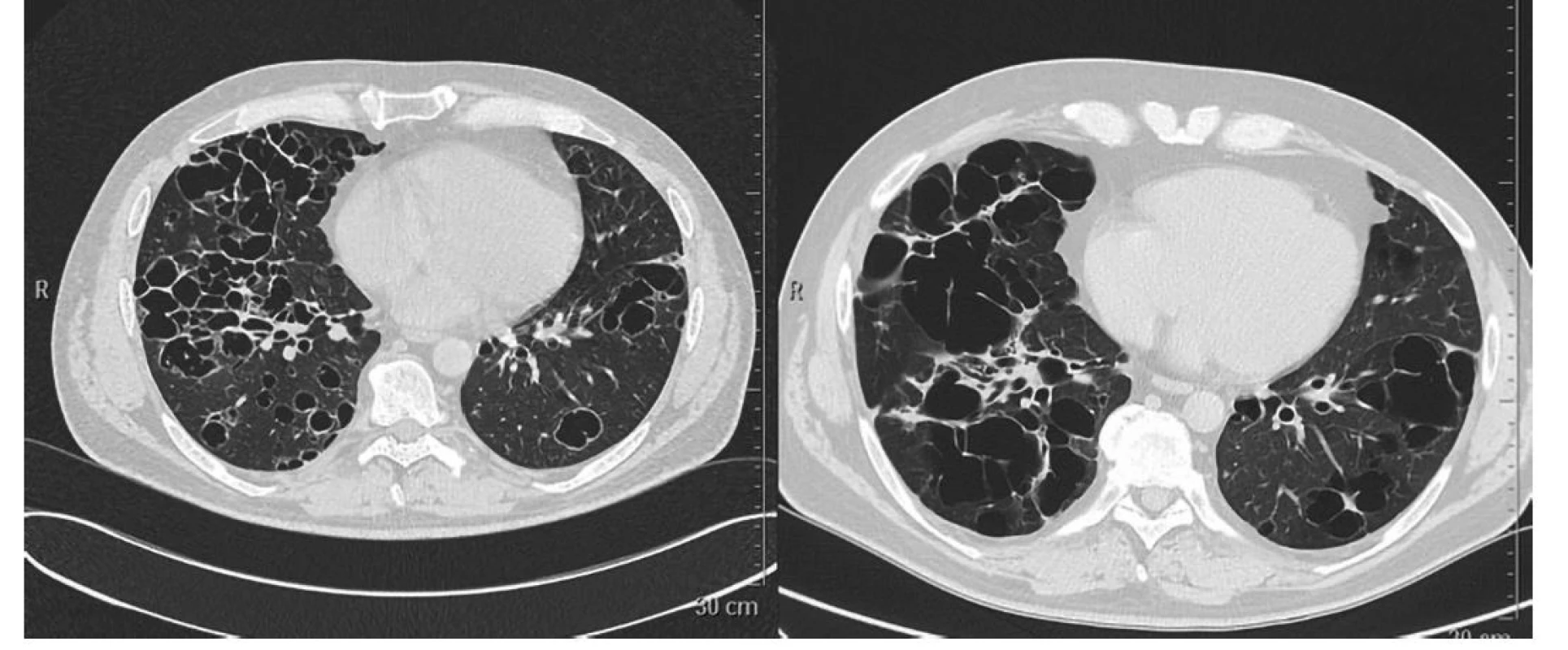
Asi 20 % osob s postižením plic LCH neudává žádné symptomy a prvním příznakem plicní formy LCH je spontánní pneumotorax. Obzvláště při cestování letadlem je vyšší riziko vzniku spontánního pneumotoraxu (24, 25). Vzduch může být uzavřen v plicní cystě při poklesu tlaku v letadle zvětší svůj objem, praskne a vznikne pneumotorax. Na riziko spojené s rychlými změnami atmosférického tlaku, jako je například cestování letadlem, ale i potápění a podobně, by měli být upozorněni všichni pacienti s plicní formou LCH. V případě kašle a/nebo bolestí na hrudníku by pacienti s plicní formou LCH měli konzultovat před letem svého plicního specialistu a probrat míru rizika spontánního pneumotoraxu v letadle. A naopak při každém spontánním pneumotoraxu by mělo být v rámci diferenciální diagnostiky pomýšleno i na možnost plicní formy LCH (24, 25).
Diagnostika a sledování plicní formy LCH
Postižení plic histiocytózou bývá často komplikováno nasedající oportunní infekcí. Odlišit infekci od LCH může být problém, neboť teplota a váhový úbytek mohou být jak prvními projevy plicní histiocytózy, tak mohou mít i jiné, například infekční příčiny (20–23).
Za standardní diagnostickou metodu plicní formy LCH se stále považuje plicní biopsie, kde místo odběru je určeno podle HRCT nálezu. U asymptomatických pacientů s makrofágovou alveolitidou a typickým nálezem na HRCT hrudníku (viz výše) se považuje zvýšený průkaz CD1a+ v brochoalvelolární tekutině dostatečně senzitivní. V případě plicní formy histiocytózy bývá v laváži více než 5 % CD1a+ buněk, zatímco u zdravých pacientů je počet CD1a+ menší než 1 % (26).
V případě, kdy nález z BAL není diagnostický a dle HRCT hrudníku je podezření na plicní formu LCH, je indikována plicní biopsie (transbronchiální, chirurgická plicní biopsie). U pacientů s velkými cystickými ložisky je nutno zvážit riziko a přínos plicní biopsie. Výhodou chirurgické plicní biopsie (videotorakoskopie) je možnost získat reprezentativní vzorek plicní tkáně s histologickým průkazem LCH a možnost průkazu mutace genu BRAF, což pak ovlivní léčebný postup. Výtěžnost jednotlivých diagnostických metod dokumentuje tabulka 4 (27).
Table 4. Vyšetření, které vedla u pacientů s LCH k průkazu plicního postižení. V případě typického nálezu na HRCT a průkazu LCH v kostní biopsii se považoval plicní nález za LCH (27) 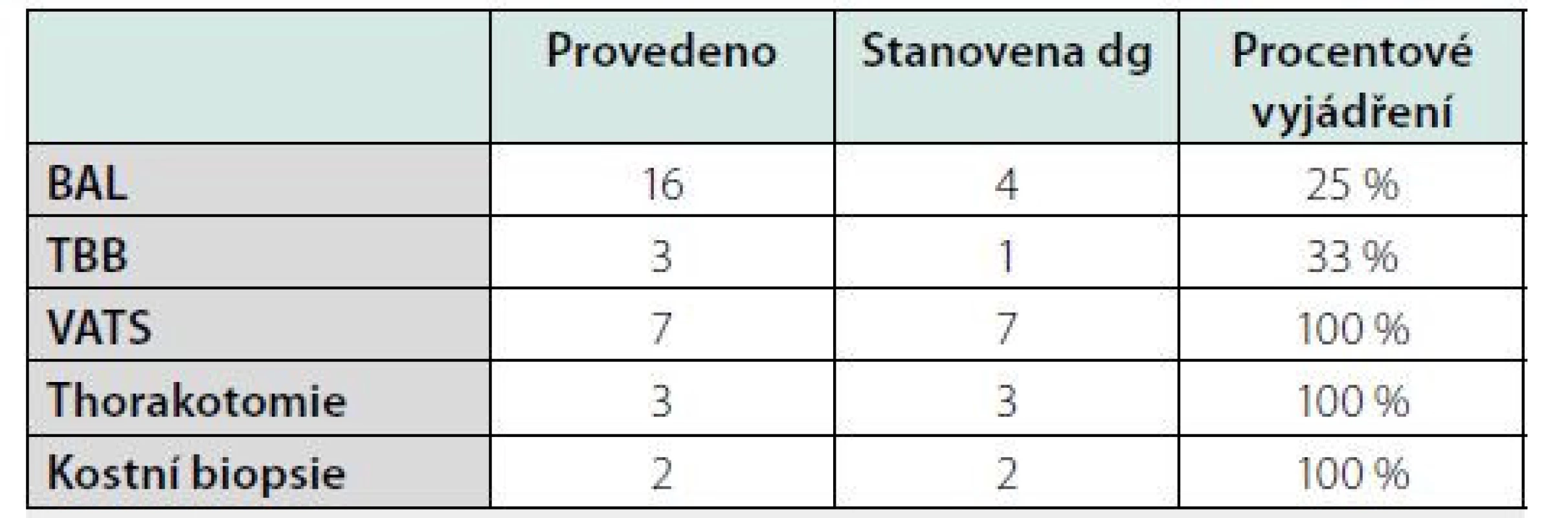
BAL = bronchoalveolární laváž Pozor, v případech, kdy plicní postižení je součástí generalizovaného onemocnění, má plicní forma LCH charakter klonálního onemocnění a to, že pacient přestane kouřit, nemá na progresi nemoci vliv.
Sledovat vývoj plicní formy LCH bylo donedávna obtížné. Základním vyšetřením bylo HRCT plic se semikvantitativním hodnocením počtu nodularit. Pokud nodularity ubývaly, byl to pozitivní vývoj. Počítat nodularity na HRCT zobrazení je však časově náročné. Funkční plicní vyšetření má pomocný informační přínos (28).
Značným pokrokem je hodnocení vývoje v plicích pomocí FDG‑PET/ CT vyšetření, tak jak je poprvé popsal kolektiv z oddělení nukleární medicíny Masarykova onkologického institutu a posléze i další autoři (29–32).
Endokrinní projevy LCH
LCH má velkou afinitu k postižení hypotalamo‑pituitární osy, vedoucí k permanentnímu hypopituitarismu, nejčastěji se jedná o postižení zadního laloku hypofýzy, méně často pozorujeme výpadek hormonů adenohypofýzy. Na MR mozku se nejčastěji manifestuje jako zbytnění hypofýzy (Obr. 8), případně infiltrace její stopky.
Image 8. Kulovité zbytnění, infiltrace stopky hypofýzy při LCH. Řez v koronární rovině, T1 vážený MR obraz po aplikaci kontrastní látky. Tato infiltrace byla příčinou diabetu insipidu. Po léčbě 2-chlorodeoxyadenosinem infiltrace vymizela, ale funkční poškození přetrvává 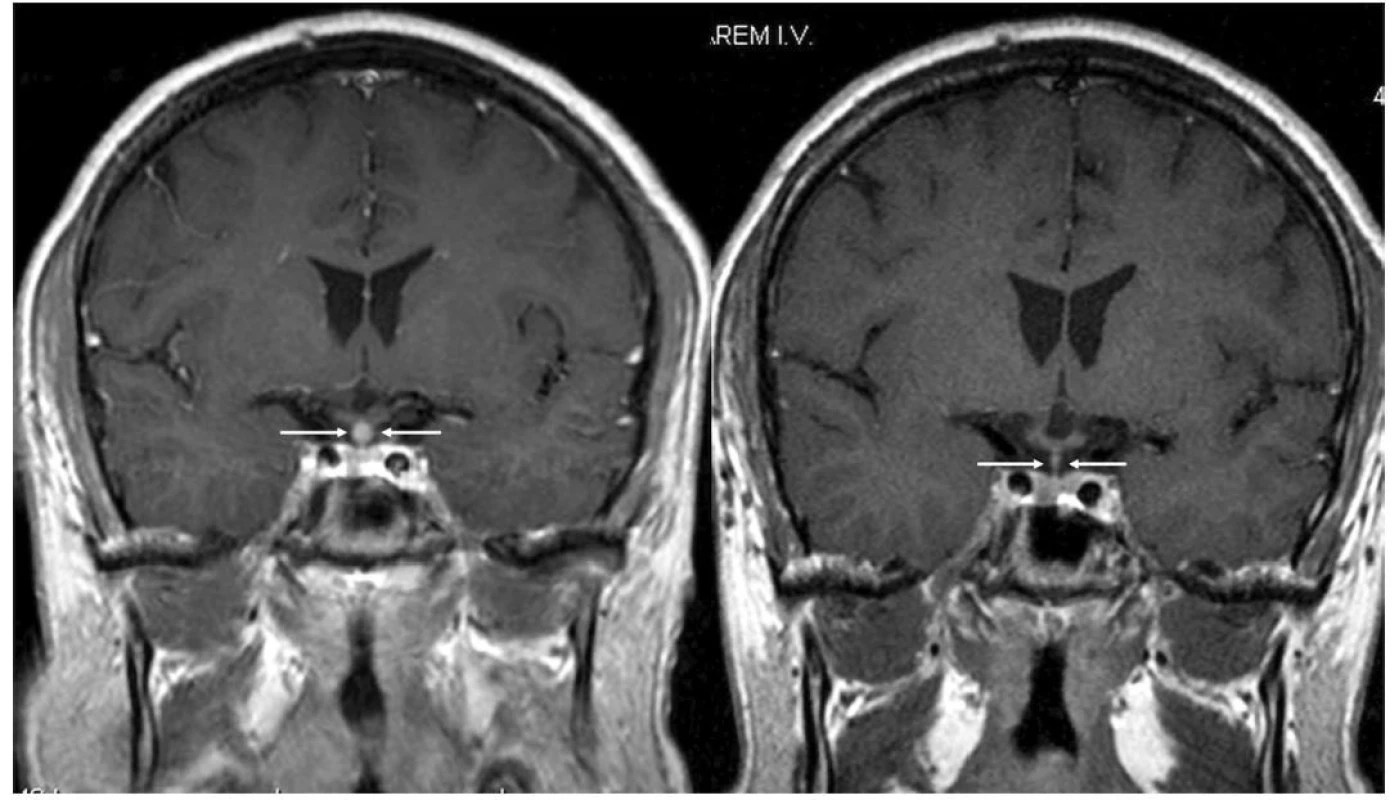
Diabetes insipidus je nejčastější hormonální komplikací LCH, jeho manifestace může být prvním příznakem nemoci v dospělosti, anebo se může rozvinout v průběhu choroby. Diabetes insipidus bývá prokázán až u 30 % dospělých pacientů v průběhu LCH (33, 34).
Pro ilustraci četnosti endokrinního postižení uvedeme výsledky analýzy 63 pacientů s LCH. Snížení alespoň jednoho hypofyzárního hormonu bylo v průběhu sledování nalezeno u 63,2 %, nejčastěji to byl deficit adiuretinu a somatotropinu 55,3 %, dále pak deficit gonadotropinů 34,2 %, thyreotropinu 23,7 % (35).
Deficit somatotropinu (STH) bývá nalézán až u 50 % pacientů s diabetem insipidem iniciovaným LCH. U dospělých většinou není žádného specifického projevu nedostatku STH. Nedostatek STH se ale projeví u žen, které bez dostačující hladiny STH nejsou schopné donosit dítě. Jedna z našich pacientek s LCH a diabetem insipidem si přála mít dítě a použila metodu in vitro fertilizace. První pokusy byly neúspěšné, ale její endokrinolog začal se substitucí STH, podařilo se jí porodit zdravé dítě, s nímž se pak přišla pochlubit na naši ambulanci.
Deficit gonadotropinů je druhou nejčastější poruchou z oblasti adenohypofýzy. Projeví se poruchou menstruačního cyklu u žen a sníženým libidem u mužů (3, 5).
Deficit ACTH může být parciální či kompletní a projeví se nespecifickými příznaky subklinického addisonismu nebo akutním selháním nadledvin při zátěži.
Hyperprolaktinemie bývá způsobena většinou infiltrací stopky hypofýzy, může způsobit galaktorhoe u žen, sekundární hypogonadismus a poruchy fertility.
Hormonální deficit, pokud již jednou vznikne, je trvalý, i když abnormality MR při zobrazení hypofýzy a hypotalamu regredují po účinné léčbě (36).
Podle frekvence pituitárních poruch se za základní endokrinologické vyšetření považuje vyšetření mineralogramu, osmolality séra, bilance tekutin a stanovení hladiny TSH, f‑T4.
V případě podezření na endokrinologické postižení se pak doplňují další testy (test s odnětím tekutin), vyšetření sérového kortizolu, růstového hormonu, resp. IGF-1, gonadálních steroidních hormonů a gonadotropinů (36).
Mozkové projevy LCH
Velmi vzácnou manifestací LCH v dospělosti je extrahypotalamické postižení CNS. Není jasné, proč Langerhansovy buňky mají podstatně vyšší afinitu k hypotalamu a jeho stopce než k ostatní mozkové tkáni. Podezření na tuto formu je nutno mít u všech nemocných s LCH, u nichž se objeví jakékoliv neurologické příznaky.
Po dlouhém průběhu nemoci se objevují neurodegenerativní ložiska, postrádající infiltraci CD1a+ buňkami. Nejčastěji bývá postižen mozeček, nucleus dentatus, cerebelární bílá hmota a mozkový kmen, s výraznou zánětlivou infiltrací obsahující CD8 lymfocyty. Tento proces vede k degeneraci a glióze nervové tkáně. Neurodegenerativní proces se objevuje na základě T‑buněčného zánětlivého procesu. Je provázen destrukcí neuronů a axonů se sekundární demyelinizací, připomínající paraneoplastickou encefalitidu.
Tento typ postižení se objevuje až za dlouhou dobu od stanovení diagnózy, je progredující a nevratný, viz Obr. 9. Klinicky se projevuje hyporeflexií, ataxií, závratěmi, dysartrií, nystagmem, tremorem, diplopií, psychomotorickou retardací a neuropsychologickými defekty (37).
Image 9. PET CT zobrazení mozku, červená barva znázorňuje intenzivní akumulaci fluorodeoxyglukózy (FDG), zatímco zelená barva odpovídá snížené akumulaci FDG. V oblasti cerebella, které je postiženo neurodegenerativními změnami, je zřetelné výrazně snížené vychytávání FDG a neurodegenerativní změny byly u tohoto pacienta zřetelné i na MR zobrazení 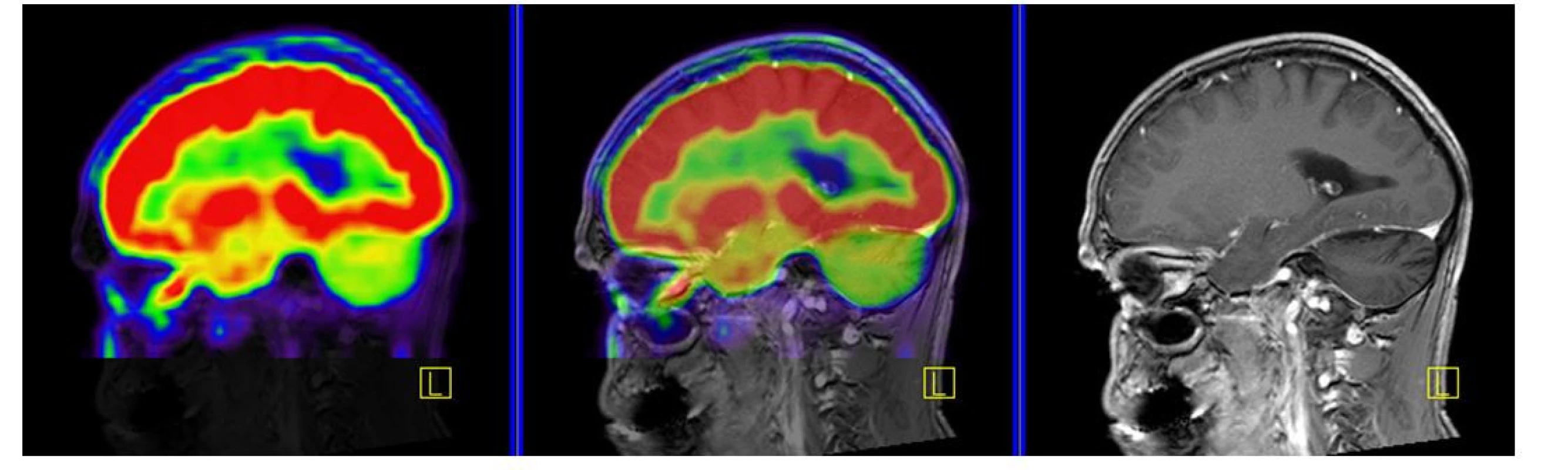
Lymfadenopatie na podkladě LCH
Histiocytóza obvykle nedělá výraznou lymfadenopatii. Pokud ano, jde spíše o ložiskové než generalizované postižení (38). U našich pacientů jsme se setkali jak s případem lokalizované lymfadenopatie, kterou vyléčil operační výkon (exstirpace uzliny), tak s případem generalizované lymfadenopatie, která měla stejný obraz při PET/CT zobrazení jako generalizovaný nehodgkinský lymfom (Obr. 10) (39).
Image 10. LCH může postihnout lymfatické uzliny podobně jako u lymfomů. PET‑CT znázorňuje postižení lymfatických uzlin od krku až po třísla. LCH u tohoto pacienta měla neobvykle vysoký proliferační index a vysoký počet mitóz, onemocnění se chovalo velmi agresivně, takže po remisi navozené lenalidomidem byla provedena alogenní transplantace krvetvorné tkáně a pacient je nyní 8 let od transplantace v remisi LCH 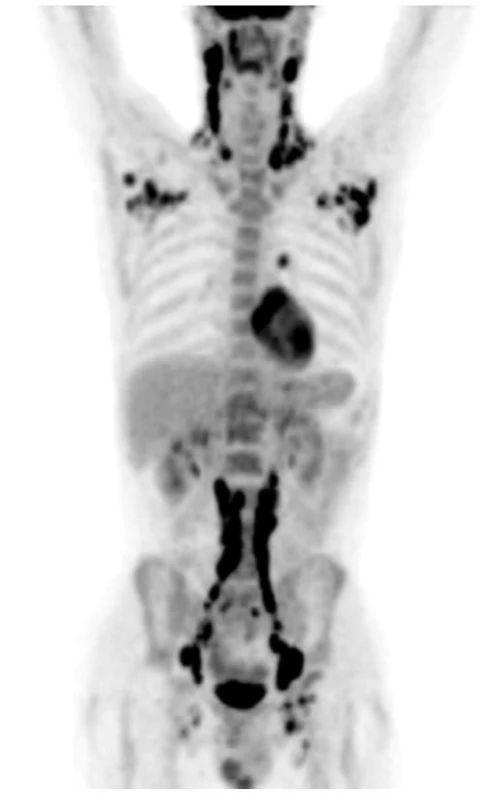
Ušní projevy LCH
Ušní forma začíná jako zánět zevního zvukovodu, neodlišitelný od infekčního zánětu. Jenže tento proces posléze přejde na tkáně kolem zvukovodu, a nakonec způsobí osteolyticku destrukci okolních struktur. Poruchy sluchu mohou nastat jak postižením zevního sluchového kanálu, tak poruchou středního či vnitřního ucha propagací choroby z processus mastoideus. Infiltrace je nebolestivá a postupně vede k hluchotě. Časté jsou sekundární infekce, které jsou příčinou záměny za chronickou otitidu. Proto by u každé dlouhodobé afekce připomínající zánět zevního zvukovodu mělo být histologicky ověřeno, zda se nejedná o první projev LCH. Nemoc totiž dále progreduje do vnitřního ucha a bohužel je často diagnostikovaná až při operaci pro proces, který destruuje celé vnitřní ucho, jak je ukázáno na obrázku 11 (40–45).
Image 11. Histiocytóza z Langerhansových buněk (LCH) někdy postihuje zevní zvukovod. Způsobí zánět makroskopicky neodlišitelný od klasického zánětu zevního zvukovodu. Pouze histologické vyšetření postižené kůže by mohla prokázat, že se jedná o LCH. Postupně infiltrace přestoupí na spánkovou kost a vytvoří v ní osteolytická ložiska, jak dokumentuje tento CT obraz pacientky s pokročilým procesem ve spánkové kosti. Šipky ukazují místa destrukce spánkové kosti 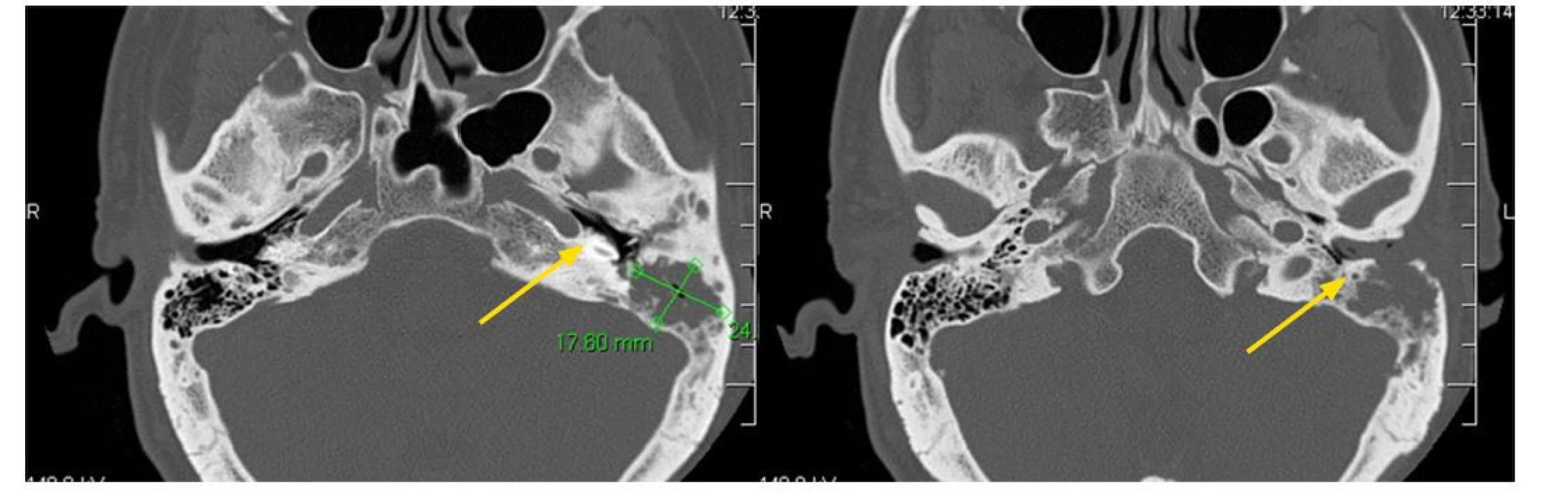
Orbitální projevy LCH
Intraokulární postižení je vzácné, zatímco infiltrace orbitálního prostoru je relativně častá. Dětští lékaři se s ní setkávají u 20 až 30 % nemocných histiocytózou z Langerhansových buněk. Projevuje se ptózou víčka, edémem papily a poruchou funkce VII. nervu. Může být poškozen i optický nerv, což si někdy kromě systémové léčby vynutí i akutní léčbu nitroložiskovou aplikací kortikosteroidů a radioterapii (46–49).
Sami jsme se setkali pouze s případy postižení zevní stěny orbity, které vyřešil operační výkon.
Postižení jater a sleziny LCH
Postižení jater je charakterizováno někdy infiltráty, které obsahují CD1a pozitivní buňky, ale mohou být i lymfocytární infiltráty kolem portálního traktu, které nakonec vedou ke sklerotizující cholangitidě. Postižení pankreatu je extrémně vzácné. Postižení jater se projeví jejich zvětšením. Infiltrace jater může vyvolat příznaky jaterního selhání (pokles koncentrace albuminu, snížení aktivity koagulačních faktorů, žloutenka bez výrazného zvýšení jaterních enzymů). U chronických forem může vzniknout periportální fibrotizace s příznaky shodnými se sklerotizující cholangoitidou a obstrukční biliární žloutenkou, kterou je nutno na základně biopsie odlišit od primární sklerotizující cholangitidy, anebo od nemoci související s imunuglobulinem IgG4 (IgG4-related disease) a adekvátně léčit (50–52).
Postižení dutiny ústní LCH
Počínající infiltrace se v dutině ústní projevuje zduřením dásní a sliznice patra. Může dojít i k postižení kostí a uvolňování zubů či hypertrofii dásní. Progrese infiltrátů pak vytváří ulcerace v ústech. Někdy je projev LCH v ústech bez histologického vyšetření těžko rozeznatelný od paradentózy, projevuje se zánětem dásní, a někdy proces přechází i na kostní strukturu čelisti (Obr. 12). Toto postižení ilustruje snímek dutiny ústní dospělého člověka (53). Diagnostické je až histologické vyšetření. Gingivální postižení je často spojeno s postižením alveolární části čelisti a ztrátou zubů. V případně uvolnění zubů se tyto zuby nemají extrahovat, protože pokud se však včas zahájí léčba, je možné opětovné zpevnění zubního lůžka. Orodentální forma LCH není až tak vzácná, jak je zřetelné z četných popisů případů v naší i zahraniční literatuře (53–60).
Image 12. Postižení dásní LCH může způsobit proces podobný parodontóze a může vést k uvolňování zubů. V některých případech však postihuje i kost a vede k destrukci čelisti. Tyto snímky zapůjčil prof. Fassmann ze svého archivu 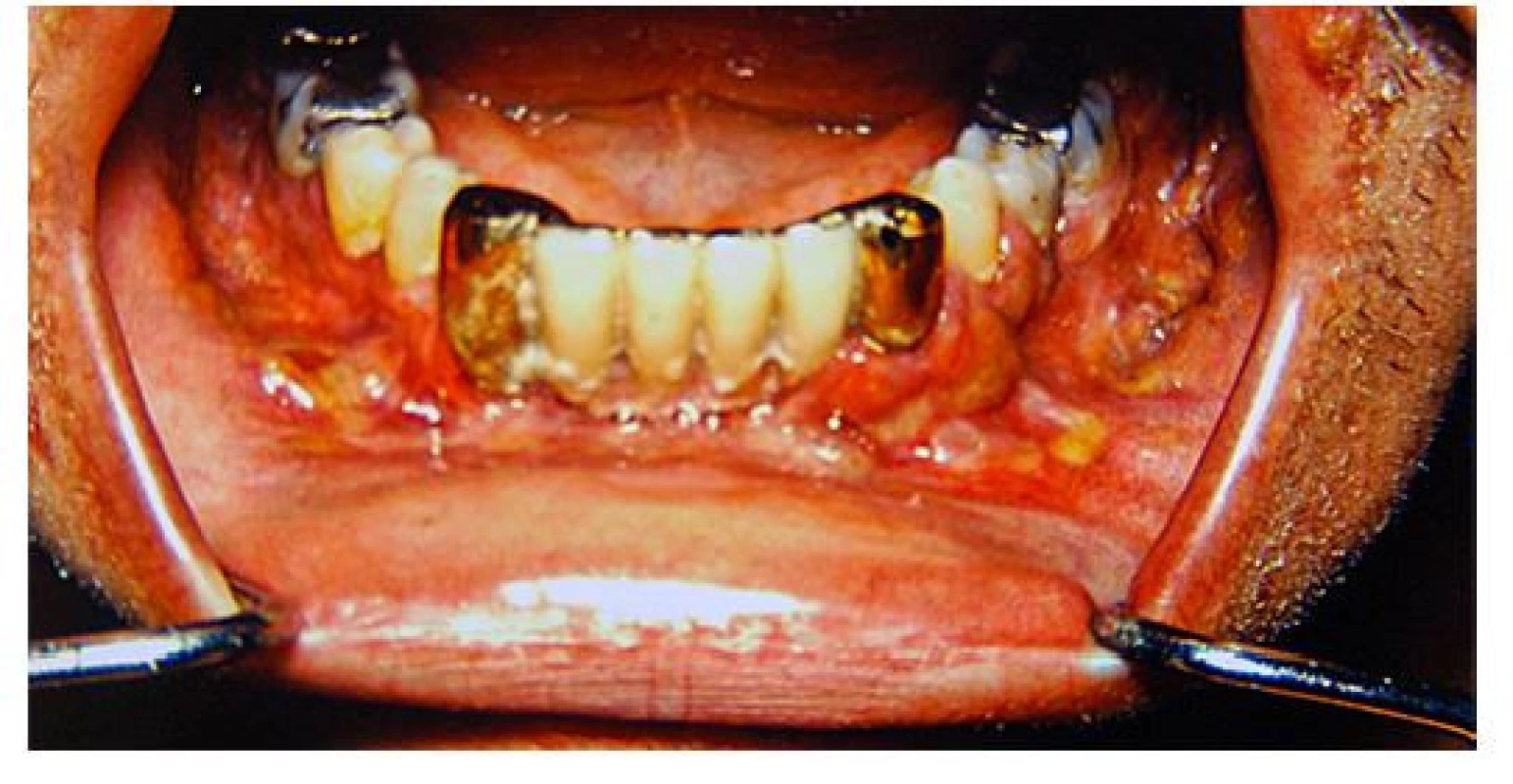
Postižení trávicího traktu LCH
Sliznice střevního traktu je postižena jen zřídka. Prvními příznaky je celkové neprospívání a hubnutí. Klasické projevy malabsorpce se objevují až při rozsáhlejším postižení trávicího traktu. Anální kanál a perianální oblast jsou infiltrovány často a tvoří tak součást kožního postižení. Infiltrace kůže perianálně je makroskopicky nerozeznatelná od ekzému, pouze histologické vyšetření kůže může identifikovat LCH. Někdy má nemoc v této oblasti podobu verukovitých výrůstků podobných kondylomatům. Obecně je postižení trávicího traktu vzácné. Může se projevit jako solitární kolorektální polyp či mnohočetná granulomatózní ložiska v mukóze horní či dolní části trávicího traktu. Postižení trávicího traktu je často asymptomatické. Mnohočetné infiltráty jsou spojené s bolestmi břicha, průjmem a hypoalbuminemií (61, 62).
Závěr
Histiocytóza z Langerhansových buněk je choroba málo známá, s velmi různorodými příznaky. V případě bolestí kosti přivedou pacienta za ortopedem, v případě kašle či pneumothoraxu za plicním chirurgem či pneumologem, při diabetu insipidu za endokrinologem atd. A je na lékařích jednotlivých specializací, aby mohli pojmenovat morfologickou podstatu potíží pacienta a odeslali na histologické vyšetření, aby tyto pacienty vedli pod nějakou pro ně častou a běžnou diagnózou. Jakmile je stanovena histologická diagnóza nemoci, je pacient nasměřován k hematologovi. Ten musí cíleně pátrat po dalších možných manifestacích této choroby, aby ji mohl klasifikovat dle tabulky 2. A pak teprve je možno se rozhodnout o léčbě, jejíž popis uvádíme v dalším článku.
Článek vznik v souvislosti s Institucionální podporou MOÚ: MZ ČR – RVO (MOÚ, 00209805)
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika, LF MU a FN Brno
Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék 2022;68(2):E11-E21
Článek přijat redakcí: 6. 10. 2021
Článek přijat po recenzích: 16. 1. 2022
Sources
1. Kodet R, Mrhalová M. Histiocytóza z Langerhansových buněk z pohledu patologa, Vnitřní lékařství. 2010, roč. 56, suppl. 2, s. 2S27-2S38.
2. Mottl H, Starý J. Histiocytóza z Langerhansových buněk u dětí – klinické projevy, diagnostika a současná léčba. Československá pediatrie. 2007, Roč. 62, č. 4, s. 220-225.
3. Baumgartner I, Hochstetter A, Baumert B et al. Langerhans cell histiocytosis in adults. Med Pediatric Oncol 1997; 28 : 9-14.
4. Nicholson SH, Egeler M, Nesbit ME. The epidemiology of Langerhans cell histiocytosis. Hematol Oncol Clin North Amer 1998; 12 : 379–348.
5. Aricò M, Girschikofsky M, Généreau T et al. Langerhans cell histiocytosis in adults: report from the International Registry of the Histiocyte Society. Eur J Cancer 2003;39 : 2341–8
6. Guyot‑Goubin A, Donadieu J, Barkaoui M, Bellec S, Thomas C, Clavel J. Descriptive epidemiology of childhood Langerhans cell histiocytosis in France, 2000-2004. Pediatr Blood Cancer 2008;51 : 71–5.
7. Goyal G, Shah MV, Hook CC et al. Adult disseminated Langerhans cell histiocytosis: incidence, racial disparities and long‑term outcomes. Br J Haematol. 2018;182(4):579-581.
8. Makras P, Stathi D, Yavropoulou M. The annual incidence of Langerhans cell histiocytosis among adults living in Greece. Pediatr Blood Cancer. 2020;67(9):e28422. doi: 10.1002/pbc.28422.
9. Rodriguez‑Galindo C, Allen CE. Langerhans cell histiocytosis. Blood. 2020; 135 (16): 1319-1331.
10. Reisi N, Raeissi P, Harati Khalilabad T et al. Unusual sites of bone involvement in Langerhans cell histiocytosis: a systematic review of the literature. Orphanet J Rare Dis 2021; 16 (1): 1. doi: 10.1186/s13023-020-01625-z.
11. Křenová Z, Štěrba J. Langerhans Cell Histiocytosis: The Time has Come to Consider a CNS‑directed Prophylactic Approach Journal of pediatric hematology/oncology. 2016; 38 (6): 493-495.
12. Čapková Š. Seboroická dermatitida v kojeneckém věku. Dermatologie pro praxi. 2021;15(1): 37-41.
13. St Claire K, Bunney R, Ashack KA et al. Langerhans cell histiocytosis: A great imitator. Clin Dermatol. 2020; 38 (2): 223-234.
14. Hamdan M, Qiao JC, Fikfak F. Adult‑onset perianal Langerhans cell histiocytosis presenting as pruritus ani: a case report and review of the literature J Med Case Rep. 2021; 15 : 357. Published online 2021 Jul 22. doi: 10.1186/s13256-021-02924-0.
15. Mlynček M, Uharček P. Vulvárna histiocytóza z Langerhansových buniek. Klinická onkologie. 2005;18 (4): 134-137.
16. Mottl H, Rob L, Starý J et al. Langerhans cell histiocytosis of vulva in adolescent International journal of gynecological cancer. 2007, roč. 17, č. 2, s. 520-524.
17. Kružicová Z, Vaňousová D, Jůzlová K et al. Nevenerické nemoci zevního genitálu u mužů. Česká dermatovenerologie. 2013, roč. 3, č. 3, s. 143-157.
18. Konášová K, Sýkorová T. Kožní histiocytózy Česká dermatovenerologie. 2019, roč. 9, č. 3, s. 153-163
19. Lacina L, Kojanová M, Štork J. Klinický případ: Intertriginózní mokvavé plochy. Československá dermatologie. 2005, Roč. 80, č. 6, s. 329-331.
20. Nová M, Hornychová H, Matěj R. Intersticiální plicní onemocnění asociovaná s kouřením. Česko‑slovenská patologie a Soudní lékařství. 2016, roč. 52-61, č. 2, s. 100-105.
21. Doubková M, Tomíšková M, Skřičková J. Plicní histiocytóza z Langerhansových buněk - nemoc kuřáků. Studia pneumologica et phtiseologica. 2014, roč. 74, č. 5, s. 158-161.
22. Šterclová M, Votrubová J, Kočová E. Plicní histiocytóza z Langerhansových buněk I HRCT u intersticiálních plicních procesů v instruktivních kazuistikách. Praha : Maxdorf, [2017]. 2017, s. 43-46. 978-80-7345-532-3.
23. Doubková M, Doubek M, Horváth T et al. Diagnostika a léčba plicní formy histiocytózy z Langerhansových buněk. Studia pneumologica et phtiseologica. 2020, roč. 80, č. 2, s. 70-75.
24. Singla A, Kopras EJ, McCormack FX, Gupta N. Management of Spontaneous Pneumothorax and safety of air travel in patients with Pulmonary Langerhans Cell Histiocytosis. Am J Respir Crit Care Med. 2017 : 195: A1591.
25. Wajda N, Air Travel‑Related Spontaneous Pneumothorax in Diffuse Cystic Lung Diseases. Curr Pulmonol Rep. 2018 Jun;7(2):56-62.
26. Lommatzsch M, Bratke K, Stoll P et al. Bronchoalveolar lavage for the diagnosis of pulmonary Langerhans cell histiocytosis. Respir Med. 2016;119 : 168-174.
27. Harari S, Torre O, Cassandro R et al. Bronchoscopic diagnosis of Langerhans cell histiocytosis and lymphangioleiomyomatosis. Respir Med. 2012;106(9):1286-92.
28. Tazi A, Marc K, Dominique S et al. Serial CT and lung function testing in pulmonary Langerhans cell histiocytosis. Eur Respir J. 2012;40(4):905–912.
29. Řehák Z, Koukalové R, Adam Z et al. Pulmonary Langerhans cell histiocytosis--evaluation of the disease activity and treatment response using PET‑CT (SUV(max) Pulmo/SUV(max) Hepar index). Description of own experience and literature review]. Vnitř Lék. 2010; 56 (12):1228-50.
30. Řehák Z, Szturz P, Koukalové R et al. Measuring diffuse metabolic activity on FDG‑PET/ CT: new method for evaluating Langerhans cell histiocytosis activity in pulmonary parenchyma. Nucl Med Biol. 2012 Apr;39(3):429-36.
31. Hansen NJ, Hankins JH. Pulmonary langerhans cell histiocytosis: PET/CT for initial workup and treatment response evaluation. Clin Nucl Med. 2015;40(2):153-5.
32. Prabhu MR. Spectrum of 18 F‑FDG Uptake in Bilateral Lung Parenchymal Diseases on PET/ CT. Clin Nucl Med. 2020;45(1):e15-e19.
33. Lourenço J, Ferreira C, Marado D. Adult pulmonary Langerhans cell histiocytosis revealed by central diabetes insipidus: A case report and literature review. Mol Clin Oncol. 2020;13(4):30. doi:10.3892/mco.2020.2100.
34. Nicholas PD Garrahy I. A case of multisystem Langerhans cell histiocytosis presenting as central diabetes insipidus. J Community Hosp Intern.Med Perspect. 2019;9(6):515-517.
35. Sagna Y, Courtillot C, Drabo JY et al. Endocrine manifestations in a cohort of 63 adulthood and childhood onset patients with Langerhans cell histiocytosis. Eur J Endocrinol. 2019;181(3):275-285. doi: 10.1530/EJE-19-0177.
36. Yavropoulou MP, Tsoli M, Kaltsas G. Neuroendocrine manifestations of Langerhans cell histiocytosis. Handb Clin Neurol. 2021;181 : 127-135. doi: 10.1016/B978-0-12-820683-6.00009-9.
37. Cohen AF. Histiocytosis and the nervous system: from diagnosis to targeted therapies. Neuro Oncol. 2021;23(9):1433–46.
38. Melzer JM, Winters J, Mitchell AO. Isolated adult lymphadenopathy: a rare presentation of Langerhans cell histiocytosis. Am J Otolaryngol. 2015;36(1):103-5. doi: 10.1016/j.amjoto. 2014. 10. 016.
39. Adam Z, Řehák Z, Koukalová R et al. Lenalidomid indukoval léčebnou odpověď u pacienta s agresivní multisystémovou formou histiocytózy z Langerhansových buněk (LCH), rezistentní ke 2-chlorodeoxyadenosinu a časně relabující po vysokodávkované chemoterapii BEAM s autologní transplantací kmenových hemopoetických buněk Vnitř Lék. 2012;58(1):62-71.
40. Smilek P. Histiocytóza z Langerhansových buněk - případ postižení spánkové kosti Otorinolaryngologie a foniatrie. 199; 43(4): 263-265.
41. Smilek P. Projevy histocytózy z Langerhansových buněk v ORL oblasti. Vnitřní lékařství. 2010; 56, suppl. 2, s. 2S76-2S84.
42. McCullough WP, Pollock AN. Langerhans Cell Histiocytosis Presenting as Chronic Otitis Externa. Pediatr Emerg Care. 2017;33(1):67-69.
43. Zeleník K, Mrázek J, Mrázková E et al. Histiocytóza z Langerhansových buněk a její manifestace v oblasti spánkové kosti (Eozinofilní granulom spánkové kosti) Otorinolaryng. a Foniat. /Prague/, 2005;54 (4): 218-222.
44. Tóthová E, Kulinich T, Horáková Z et al. Histiocytóza z Langerhansových buněk v ORL oblasti. Onkologie 2010; 4(3): 209–210.
45. Zeleník K, Mrázek J, Mrázková E et al. Histiocytóza z Langerhansových buněk a její manifestace v oblasti spánkové kosti (Eozinofilní granulom spánkové kosti. Otorinolaryngologie a foniatrie. 2005, Roč. 54, č. 4, s. 218-222.
46. Koka K, Alam S, Subramanian N. Clinical spectrum and management outcomes of Langerhans cell histiocytosis of the orbit. Indian J Ophthalmol. 2020;68(8):1604-1608.
47. Anton M, Holoušová, M Řehůřek J. Histiocytóza X a dětská očnice. Československá oftalmologie. 1992, Roč. 48, č. 3, S. 176-180.
48. Naik M, Mehta A, Mehrotra N. Isolated Langerhans Cell Histiocytosis of Orbit: A Case Report and Review of the Literature Case Rep Ophthalmol Med. 2018; 2018 : 1529281. Published online 2018 Apr 4. doi: 10.1155/2018/1529281.
49. Kiratli H, Tarlan B, Söylemezoglu F. Langerhans cell histiocytosis of the orbit. Eur J Ophthalmol. 2013;23(4):578-83.
50. Reginelli A, Pignatiello M, Urraro F et al. Langerhans Cell Histiocytosis with Uncommon Liver Involvement: A Case Report. Am J Case Rep. 2020;21:e923505. doi: 0.12659/AJCR.923505.
51. Murakami M, Onishi S, Ohya Y et al. Langerhans cell histiocytosis confined to extrahepatic bile duct causing sclerosing cholangitis in child: a case report. Surg Case Rep. 2020;6(1):137. doi: 10.1186/s40792-020-00899-6.
52. Tang Y, Zhang Z, Chen M et al. Severe sclerosing cholangitis after Langerhans cell histiocytosis treated by liver transplantation: An adult case report. Medicine (Baltimore). 2017;96(9):e5994. doi: 10.1097/MD.0000000000005994.
53. Fassmann A, Izakovičová‑Hollá L, Augustín P et al. Projevy histiocytózy z Langerhansových buněk v orofaciální oblasti Vnitřní lék 2010; 56 (Supll 2) 85-90.
54. Hubáček M, Kozák J, LCH – histiocytóza z Langerhansových buněk v kraniofaciální oblasti Česká stomatologie a Praktické zubní lékařství. 2005, roč. 105-53, č. 3, s. 78-81
55. Merglová V. Hrušák D, Boudová L et al. Langerhans cell histiocytosis in childhood - review, symptoms in the oral cavity, differential diagnosis and report of two cases Journal of cranio‑maxillofacial surgery. 2014, roč. 42, č. 2, s. 93-100.
56. Panis VA. Langerhans cell histiocytosis mimicking aggressive periodontitis: Challenges in diagnosis and management. Quintessence Int. 2016;47(9):731-8.
57. Cherian LM. Langerhans cell histiocytosis: A diagnostic enigma in the oral cavity. J Oral Maxillofac Pathol. 2021;25(Suppl 1):S27-S31.
58. Luz J. Oral manifestation of Langerhans cell histiocytosis: a case report. BMC Oral Health. 2018 Jun 8;18(1):106.
59. Raviraj J. Multifocal Eosinophilic Granuloma of Jaws and Skull with Classical and Unusual Radiographic/Imaging Findings. J Clin Diagn Res. 2017;11(1) :ZD09-ZD11.
60. Difloe‑Geisert JC, Bernauer SA, Schneeberger N et al. Periodontal manifestations of Langerhans cell histiocytosis: a systematic review. Clin Oral Investig. 2021;25(6):3341-3349.
61. Singhi AD, Montgomery EA. Gastrointestinal tract langerhans cell histiocytosis: A clinicopathologic study of 12 patients. Am J Surg Pathol 2011, 35(2):305–310.
62. Gotesman M, Getachew R, Morales S. A Case of Langerhans Cell Histiocytosis With Multifocal, Single‑System GI Tract Involvement and Literature Review. J Pediatr Hematol Oncol. 2020;42(6):e491-e493. doi: 10.1097/MPH.0000000000001662.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue E-2-
All articles in this issue
- Gut microbiome in heart failure and aortic stenosis
- Langerhans cell histiocytosis (LCH). Overview of symptoms of LCH, which may lead the patients to any of these medical specialists.
- Medication adherence terminology – the first consensual translation using the Delphi method
- prof. MUDr. Jarmila Siegelová, DrSc. – 80 let
- Rare cause of spontaneous spleen bleeding: a case report and literature review
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Gut microbiome in heart failure and aortic stenosis
- Langerhans cell histiocytosis (LCH). Overview of symptoms of LCH, which may lead the patients to any of these medical specialists.
- Medication adherence terminology – the first consensual translation using the Delphi method
- Rare cause of spontaneous spleen bleeding: a case report and literature review
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

