-
Medical journals
- Career
Recidivující asfyktická zástava oběhu – neobvyklá manifestace SLE
Authors: Adam Lukáč; Hana Matějovská Kubešová
Authors‘ workplace: Klinika interní, geriatrie a praktického lékařství, Fakultní nemocnice Brno
Published in: Vnitř Lék 2021; 67(E-3): 24-27
Category: Case Report
Overview
Případ čtyřicetileté ženy po dvou asfyktických zástavách v intervalu několika měsíců s nálezem difuzní alveolární hemoragie nejasné etiologie zjištěné až v průběhu hospitalizace v našem zdravotnickém zařízení. Po stanovení správné diagnózy systémového lupusu erythematodes byla zahájena adekvátní terapie s úspěšným navozením remise onemocnění a navrácením pacientky do normálního života.
Klíčová slova:
systémový lupus erythematodes – oběhová zástava – difuzní alveolární hemoragie – diagnostika – terapie
Úvod
Systémový lupus erythematodes (SLE) je autoimunitní onemocnění charakterizované širokým spektrem klinických projevů, které jsou vyjádřením různorodého postižení orgánově nespecifickými autoprotilátkami. Toto onemocnění postihuje kůži, klouby, ledviny, srdce, cévy, plíce a centrální nervový systém. Uvedená rozmanitost možných klinických projevů vede ve většině případů k opožděnému stanovení správné diagnózy.
Nejčastějším je postižení kůže, týká se až 80 % nemocných. V obecném povědomí je motýlovitý exantém obličeje. Kožní postižení se vyskytuje i ve formě akutního papulózního exantému obličeje, šíje a horní části trupu. Méně častý je diskoidní lupus, který se projevuje hypopigmentací a atrofií kůže na oslněných částech těla. Kloubní postižení zasahuje přibližně stejně vysoký podíl nemocných SLE, jako kožní postižení, projevuje se akutním nebo chronickým zánětem jednoho nebo vícero kloubů. Rovněž postižení nervového systému patří k častým manifestacím lupusu, bylo popsáno až 19 různých typů neuropsychiatrických projevů této nemoci. Nejčastějším plicním postižením je pleuritida, která postihuje 30–60 % nemocných SLE, vážnější je však lupusová pneumonitida, která může vést k difuznímu alveolárnímu krvácení (1). Alveolární krvácení se projevuje rychlou alterací stavu nemocného, která může progredovat až do syndromu dechové tísně dospělých – ARDS (Adult Respiratory Distress Syndrome). Histopatologickým korelátem difuzního alveolárního krvácení je mikroangiitida s nekrózou alveolárních kapilár, arteriol a malých muskulárních arteriol (2). Následující kazuistika nabízí retrospektivní pohled na případ čtyřicetileté pacientky s opakující se respirační a oběhovou zástavou nejasné etiologie.
Případová studie
V předchorobí pacientka již trpěla dlouhodobými potížemi – námahovou dušností, chronickými otoky dolních končetin a recidivujícími infekcemi. Pacientka byla delší dobu rezignovaná k dlouhodobému řešení svých zdravotních problémů. Na pacientku bylo, i přes její relativně nízký věk, nahlíženo jako na polymorbidní osobu s nižší compliance. V anamnéze se kromě chronických otoků dolních končetin při lymfedému s recidivujícím erysipelem vyskytovala Hashimotova struma s tyreotoxikózou a asthma bronchiale. Přes dispenzarizaci u ambulantních specialistů absentovala zmínka o laboratorním vyšetření proteinurie. Po dramatickém zhoršení stavu pacientky a úspěšné resuscitaci, 5 měsíců před hospitalizací v našem zařízení, byla tato alterace vyhodnocena jako ARDS při těžkém dekompenzovaném asthma bronchiale, bez hlubšího došetření etiologie. Bez objasněné příčiny a kauzální léčby směřovala pacientka k dalšímu, nebezpečnému relapsu onemocnění.
Pacientka byla přivezena na urgentní příjem naší nemocnice rodinou pro akutní dechovou tíseň. Při přijetí byla pacientka somnolentní, reagující motoricky na slovní výzvu, patrná byla cyanóza rtů. Vstupní saturace krve kyslíkem byla 77 %. Sestra pacientky oznamuje, že obdobný stav již nastal před 5 měsíci, kdy byla pacientka hospitalizována v jiném zdravotnickém zařízení. Vzhledem k poruše vědomí a hyposaturaci předáváme pacientku kolegům anesteziologům. Bezprostředně po předání pacientky dochází k prohloubení desataruce, zástavě dechu a oběhu. Po zahájení resuscitace, při intubaci, bylo odsáváno množství zpěněné krve z dýchacích cest. Po 5 minutách resuscitace došlo k obnově oběhu. Po iniciální stabilizaci byla provedena akutní bronchoskopie, která odhalila krvácení z periferních bronchů bilaterálně, bez nálezu jasného zdroje krvácení. V hlavních dechových cestách byla intaktní sliznice bez známek krvácení. Byla doplněna CT angiografie plicnice, která sice nepotvrdila plicní embolii, ale v parenchymu plic detekovala rozsáhlé nespecifické bilaterální okrsky konsolidace plicní tkáně (Obr. 1).
Image 1. CT hrudníku při přijetí – splývavé konsolidace plic bilaterálně. Publikováno se svolením KRMN FN Brno 
Image 2. Kontrolní CT s odstupem 3 let od primodiagnostiky SLE. Publikováno se svolením KRDG FN Brno 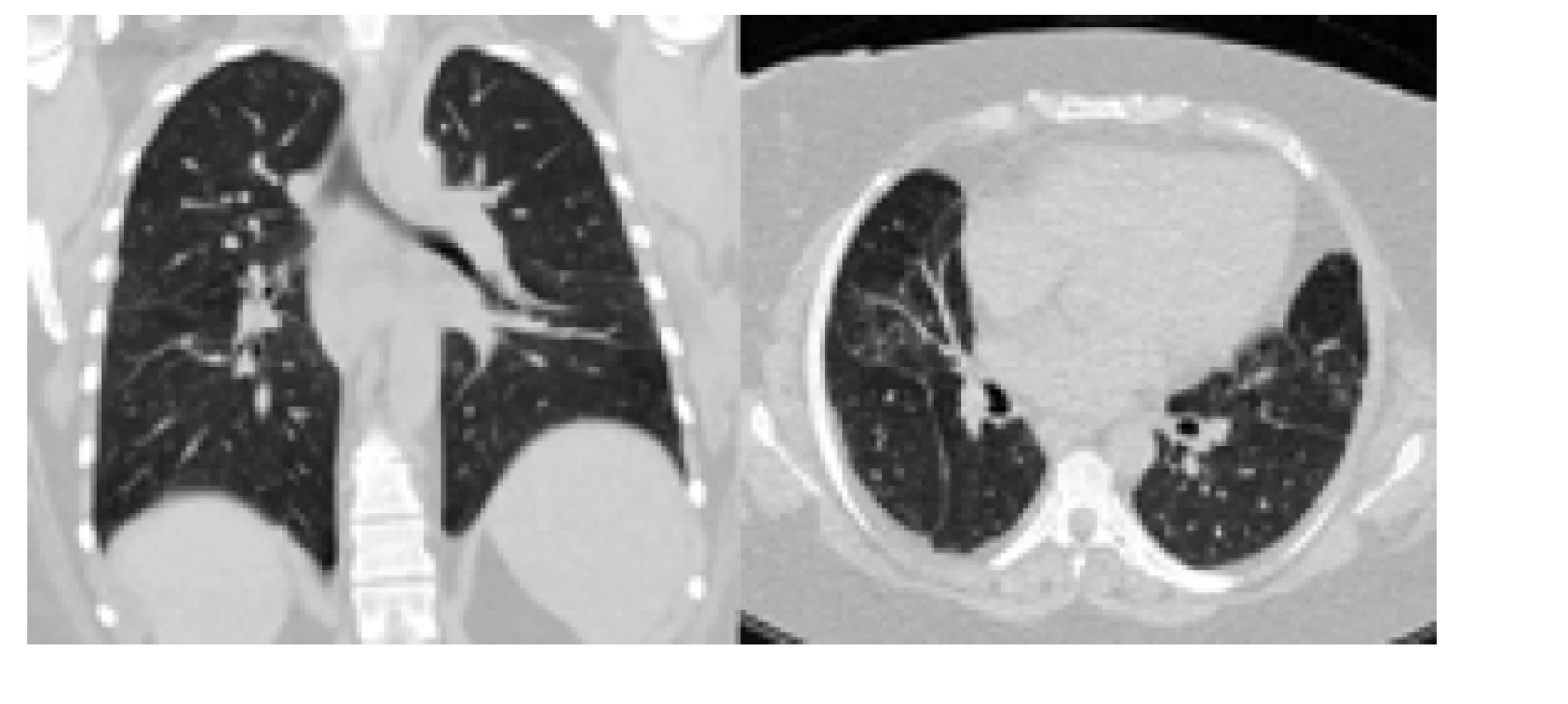
V laboratorních vyšetřeních vstupně dominovala těžká respirační acidóza (pH: 6,8, pCO2: 12 kPa, pO2: 11,3 kPa), leukocytóza (22,7 x 109/l; norma: 4–9 x 109/l) a lehká mikrocytární anémie (hemoglobin: 102 g/l; norma: 120–160 g/l; MCV: 75,9 fl; norma: 84–96 fl), lehká elevace CRP (25,1 mg/l; norma: 0–5 mg/l). Následující den po přijetí byla provedena bronchoskopická kontrola – nález na dechových cestách byl bez zásadní změny (ulpívající čerstvá krev na stěnách bronchu). Při bronchoskopii byla provedena transbronchiální biopsie. Histologický nález popisoval známky minimální chronické bronchitidy. Též byla provedena bronchoalveolární laváž, kde mikrobiologické nálezy byly negativní a cytologie pouze s nálezem erytrocytů a neutrofilů. Vzhledem k bronchoskopickému nálezu bylo pomýšleno na ANCA asociovanou vaskulitidu, proto byl odebrán panel autoprotilátek a zahájena terapie cyklofosfamidem s kortikoidy ve vysokých dávkách (125 mg methylprednisolonu na den). Následovalo promptní zlepšení klinického stavu pacientky s odpojením od UPV, extubací a probuzením do plného vědomí.
Pacientka byla poté přeložena do naší péče na standardní oddělení. Po kolektivní domluvě jsme ukončili terapii cyklofosfamidem, pokračovali jsme v kortikoterapii ve schématu dle Meduriho (léčba ARDS) s postupnou deeskalací dávky. Laboratorně progredovala středně těžká mikrocytární anémie (hemoglobin: 84 g/l, MCV 77 fl), těžká hypoproteinemie (celková bílkovina séra: 41,2 g/l; norma: 64–79 g/l), hypoalbuminemie (albumin: 27,2 g/l; norma: 34–53 g/l), a nízké hladiny zánětlivých parametrů (CRP 3,1 mg/l). V klinickém nálezu byly nápadné masivní, tuhé otoky dolních končetin chronického charakteru, poslechově byly přítomné krepitace při bázích plic bilaterálně.
V moči detekována masivní proteinurie, došetřením prokázán plně vyjádřený nefrotický syndrom.
Pro obezitu pacientky jsme, po konzultaci s nefrologickým pracovištěm, požadovali bioptické vyšetření ledviny na nefrologické klinice VFN Praha. Mezinemocniční překlad nicméně neproběhl – musel být odložen pro recidivu dušnosti, s drobnou hemoptýzou. Následovalo doplnění další bronchoskopie, kde byl tentokrát zachycen obraz difuzní alveolární hemoragie. V mezičase již byly k dispozici výsledky vyšetření autoprotilátek, pozitivní výsledky byly v třídě autoprotilátek ANA a anti-dsDNA a snížení hladin proteinů komplementu (C3 : 0,68 g/l; norma: 0,83–1,93 g/l; C4 : 0,12 g/l; norma: 0,13–039 g/l). I bez histologické verifikace navracíme terapii cyklofosfamidem a vysokou dávku kortikoidů (střídaní dávky 1 g metylprednisolonu à 2 dny, společně s 80 mg metylprednisolonu à 2 dny), a to vzhledem k vysoce suspektní akutní lupusové pneumonitidě. Opět nastává promptní regrese potíží, stav dovolil překlad na nefrologickou kliniku VFN v Praze. Po překladu byla biopticky verifikovaná difuzní sklerotizující lupusová nefritida. Na základě upřesnění diagnózy bylo pokračováno v zahájení terapie cyklofosfamidem a vzhledem k rychlému zlepšení stavu bylo možno již po 7 dnech přejít do ambulantního režimu podání.
Následující měsíce bylo v indukční terapii podáno celkem 7 cyklů cyklofosfamidu à 1 g současně s kortikoidy. Pacientka se vrací do běžného života, a to bez větších potíží. Po čtyřech měsících indukční terapie byla pacientka převedena na terapii mykofenolátem mofetilem v dávce 1 g/den. Dávka kortikoidů byla postupně deeskalována na 4 mg methylprednisolonu na den. Do udržovací terapie byl přidán hydroxychlorochin v dávce 200 mg/den. Po 20 měsících této terapie v kontrolních laboratorních vyšetřeních trvá regrese laboratorních patologií včetně proteinurie a zlepšení parametrů funkčního vyšetření plic (Tab. 1). Nicméně pro nově diagnostikovanou trombocytopenii, která je vyhodnocena jako nežádoucí účinek imunosupresivní léčby, je mykofenolát mofetil nahrazen azathioprinem. Po měsíci nové terapie byl však stav pacientky komplikován komunitní pneumonií, která vyžadovala parenterální antibiotickou terapii za hospitalizace. Po této infekční komplikaci byla opět navrácena imunosupresivní terapie mykofenolátem mofetilem. Pacientka pokračuje na této zavedené udržovací terapií v ambulantním režimu dosud, tedy více než pět let po primodiagnostice SLE.
Table 1. Parametry funkčního vyšetření plic a proteinurie před imunosupresivní terapií a po stabilizaci stavu. Použité zkratky: n. h.: náležité hodnoty; IVC: inspirační vitální kapacita; FEV1: usilovně vydechnutý objem za 1 sekundu; TLC: celková plicní kapacita 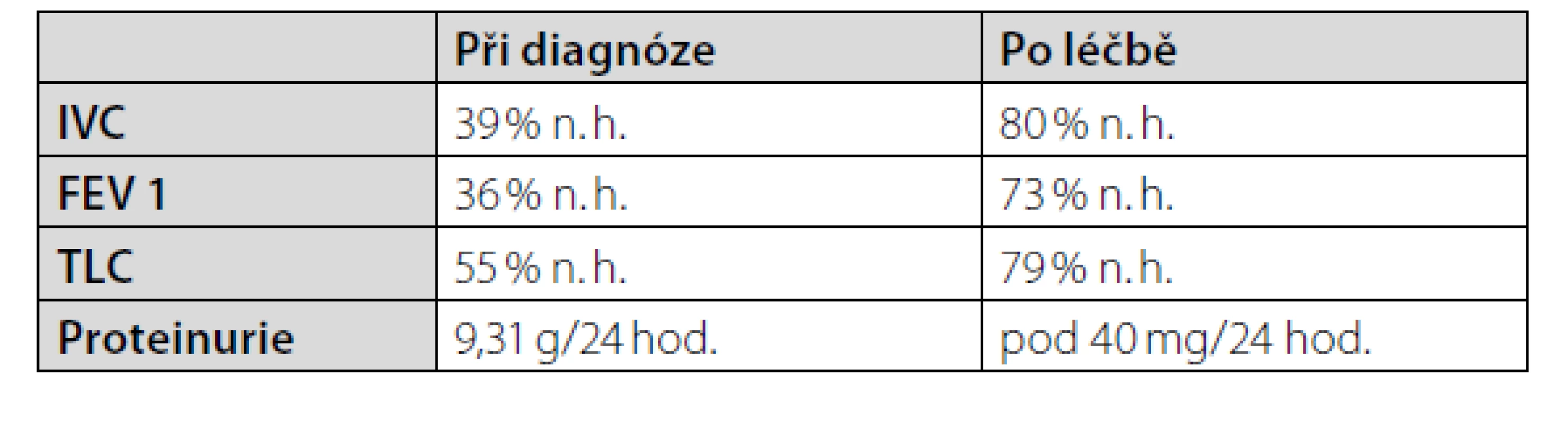
Diskuze
Nejzávažnější z plicních postižení při SLE je akutní pneumonitida s difuzní alveolární hemoragií (DAH). Tato patologie byla diagnostikována ve výše popsaném případu. Difuzní alveolární hemoragie je projevem plicní vaskulitidy asociované s SLE. Je to vzácná, ale závažná manifestace SLE, která je spojená až s 90% mortalitou. Tento projev postihuje nicméně méně než 5 % nemocných lupusem. Vice versa až u 20 % pacientů s difuzní alveolární hemorrhagii vede tento stav k primodiagnostice SLE (3). Zásadní je tedy zvažovat autoimunitní postižení vždy v případě difuzního alveolárního krvácení. Pro časnou diagnostiku s určením etiologie DAH má podstatný vliv provedení emergentní bronchoskopie s bronchoalveolární laváží (BAL). Pro DAH je charakteristické progresivní hemorhagické zbarvení v následujících porcích BAL s cytologickým nálezem siderofágů. V rámci diferenciální diagnostiky difuzní alveolární hemoragie je nutno primárně pomýšlet na ANCA-asociované vaskulitidy. Nejčastější příčinou DAH je granulomatóza s polyangiitidou a mikroskopická polyangiitida, které jsou etiologií téměř poloviny všech případů DAH (1). Dalšími častými příčinami DAH je Goodpastureův syndrom a SLE (4). Nejčastější neinfekční příčiny difuzní alveolární hemoragie shrnuje přehledová tabulka (Tab. 2).
Table 2. Nejčastější neinfekční příčiny difuzní alveolární hemoragie, typický klinický obraz a paraklinický nález (9) 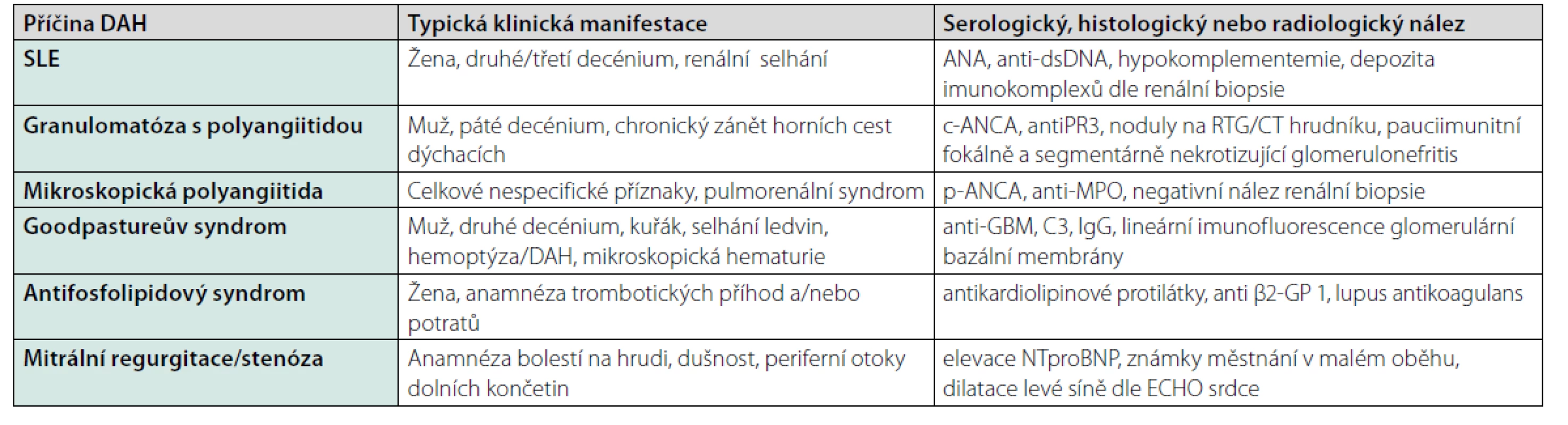
Pacienti se sekundárním antifosfolipidovým syndromem (hyperkoagulační stav způsobený autoprotilátkami proti koagulačním faktorům, které obsahují fosfolipidy) jsou ve vyšším riziku difuzní alveolární hemoragie, obzvláště pokud nemají anamnézu trombotické příhody. Tento fakt naznačuje, že se nejedná o komplikaci antikoagulační terapie, ale o výsledek dosud ne zcela objasněného mechanismu cévního postižení (5). Ve výše popsaném případě pacientky nebyly autoprotilátky patognomické pro antifosfolipidový syndrom (ACLA, anti β2-glykoprotein I) detekovány.
Léčba těžkého postižení plic při SLE je založena na podání intravenózních kortikoidů, cyklofosfamidu, eventuálně plazmaferéze, či podání intravenózních imunoglobulinů (6). Kombinace kortikoterapie a cyklofosfamidu se jeví jako nejoptimálnější terapie DAH, která je asociovaná s největším přežitím těchto pacientů. Plazmaferéza je léčebná strategie vyhrazená pro pacienty s DAH, u kterých nebylo dosažené adekvátní terapeutické odpovědi terapií cyklofosfamidem a kortikoidy (7).
Terapie intravenózními imunoglobuliny (IVIG) bývá indikovaná u pacientů s DAH až po selhání předchozích terapeutických možností. Další skupinou indikací IVIG jsou pacienti s vážným orgánovým postižením při SLE, u kterých konkomitantně probíhá infekce, je přítomna hypogammaglobulinemie, nebo je přítomná autoimunitní trombocytopenie, či autoimunitní anémie (8).
U naší pacientky byla, vzhledem k závažnému multiorgánovému postižení, zvolena pulzní terapie cyklofosfamidem v režimu v dávce 1 g á 3 týdny s kortikoterapií. Při velice dobré klinické odpovědi na zvolenou terapii nebyla indikována plazmaferéza ani podání IVIG. Celkem bylo podáno 7 pulzů cyklofosfamidu, postupně byla detrahována dávka kortikoidů, jak již bylo zmíněno výše. Velice uspokojivý klinický stav pacientky umožnil časný převod na udržovací terapii mykofenolátem mofetilem a malou dávku kortikoidů, na které je pacientka stabilní do dnešních dní.
Závěrem: komplexní přístup v rámci diferenciální diagnostiky nejasné etiologie různorodých potíží může adekvátní diagnostikou předejít katastrofálním fulminantním stavům. Zejména pohled internisty může časně rozlišit autoimunitní etiologii, rychle nasměrovat pacienta ke specialistovi a takto významně snížit riziko vážného poškození zdraví.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Adam Lukáč
Klinika interní, geriatrie a praktického lékařství, Fakultní nemocnice Brno
Jihlavská 20, 625 00 Brno
Článek přijat redakcí: 24. 2. 2021
Článek přijat po recenzích k publikaci: 29. 4. 2021
Sources
1. Češka R, Štulc T, Tesař V, Lukáš M. Interna. Svazek 3 / Richard Češka a kolektiv; pořadatelé T. Šulc, V. Tesař, M. Lukáš. 2020. ISBN 9788075537829.
2. Horák P, Skácelová M, Vymětal J, Schubertová M. [Life threatening manifestations of lupus and antiphospholipid syndrome in internal medicine]. Vnitrni lekarstvi [online]. 2018, 64(2), 136-145 [cit. 2021-02-24]. ISSN 0042773X.
3. Kobe H, Arita M, Kadoba K, Niwa T, Tokioka F, Ishida T. Acute onset systemic lupus erythematosus interstitial lung disease: A case report. Respiratory Medicine Case Reports [online]. 2021, 32(101329-) [cit. 2021-02-08]. ISSN 22130071. Dostupné z: doi:10.1016/j.rmcr.2020.101329
4. Němec P et al. Revmatologie pro praxi. První vydání. Praha: Mladá fronta, 2016. 639 s. Edice postgraduální medicíny. ISBN 978-80-204-4132-4.
5. Amarnani R, Yeoh S, Wincup C. Lupus and the Lungs: The Assessment and Management of Pulmonary Manifestations of Systemic Lupus Erythematosus. Frontiers in Medicine [online]. 2021, 7 [cit. 2021-02-17]. ISSN 2296858X. Dostupné z: doi:10.3389/fmed.2020.610257
6. Daniel JW. Lupus: The Essential Clinician‘s Guide. 2014. ISBN 9780199361960.
7. Nieto-Aristizábal I, Martínez T, Urbano MA et al. Treatment with intravenous immunoglobulins in systemic lupus erythematosus: a single-center experience with 63 patients. Lupus [online]. 2019, 28(13), 1566-1570 [cit. 2021-02-20]. ISSN 14770962. Dostupné z: doi:10.1177/0961203319883680.
8. Al-Adhoubi NK, Bystrom J. Systemic lupus erythematosus and diffuse alveolar hemorrhage, etiology and novel treatment strategies. Lupus [online]. 2020; 29(4): 355–363 [cit. 2021-02-20]. ISSN 09612033. Dostupné z: doi:10.1177/0961203320903798 .
9. Lundgren MC, Molitor JA, Spilseth B, Adeyi O. A Fatal Case of Diffuse Alveolar Hemorrhage in the Setting of Systemic Lupus Erythematosus: A Case Report and Review of Noninfectious Causes of Acute Pulmonary Hemorrhage in Adults. Case Reports in Rheumatology [online]. 2021 : 1–7 [cit. 2021-04-13]. ISSN 20906889. Dostupné z: doi:10.1155/2021/6620701.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue E-3-
All articles in this issue
- Rituximab v liečbe primárnych glomerulopatií – naše skúsenosti
- Diferenciální diagnóza: „primární“ nebo sekundární diabetes aneb má význam u pacientů s diabetes mellitus 2. typu skrínovat Cushingův syndrom?
- Biomarker GDF-15 v kardiologii
- Transformace IgM-MGUS do Waldenströmovy makroglobulinemie u 2 z 6 pacientů v průběhu léčby syndromu Schnitzlerové
- Recidivující asfyktická zástava oběhu – neobvyklá manifestace SLE
- Jaterní cirhóza a těhotenství: kazuistika a přehled literatury
- Co může diabetolog udělat pro svého pacienta po iCMP?
- Zkušenost s péčí o pacienty s covidem-19 ve Velké Británii
- Právní aspekty aplikace střevního mikrobiomu
- Evropský a světový kongres o hypertenzi 2021
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaterní cirhóza a těhotenství: kazuistika a přehled literatury
- Biomarker GDF-15 v kardiologii
- Recidivující asfyktická zástava oběhu – neobvyklá manifestace SLE
- Rituximab v liečbe primárnych glomerulopatií – naše skúsenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

