-
Medical journals
- Career
Renoparenchymatózní hypertenze – aktuality v diagnostice a léčbě
Authors: Jan Vachek 1,2; Oskar Zakiyanov 1; Kateřina Oulehle 2; Hana Ciferská 3; Vladimír Tesař 1
Authors‘ workplace: Klinika nefrologie 1. LF UK a VFN v Praze 1; Interní oddělení a hemodialyzační středisko, Klatovská nemocnice, a. s. 2; Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha 3
Published in: Vnitř Lék 2021; 67(8): 479-484
Category: Review Articles
Overview
Nejčastější příčinou sekundární hypertenze je onemocnění ledvinného parenchymu, které představuje až 5 % případů arteriální hypertenze. Renoparenchymatózní hypertenze se vyskytuje jako komplikace většiny glomerulárních a tubulointersticiálních onemocnění a může urychlit zhoršování renální funkce. Patofyziologie renoparenchymatózní hypertenze je komplexní a zahrnuje poruchy homeostázy a exkrece sodíku a z toho rezultující volumovou expanzi, alteraci systému renin‑angiotenzin‑aldosteron, abnormality endogenních vazodepresorů a také zvýšení aktivity vazoaktivních látek. Renoparenchymová hypertenze se může vyskytnout u akutního i chronického onemocnění ledvin a manifestuje se již v časné fázi renálního postižení. Často vyžaduje komplexní farmakologickou léčbu krevního tlaku a je prognosticky nepříznivá z hlediska kardiovaskulárních a renálních komplikací. Tuto formu sekundární hypertenze lze často úspěšně léčit terapií základního renálního onemocnění. V případě nedostatečné kompenzace krevního tlaku dochází k progresi poruchy ledvinných funkcí. Cílem tohoto sdělení je podat stručný přehled o renoparenchymatózní hypertenzi, o aktuálních diagnostických možnostech a principech terapie.
Klíčová slova:
arteriální hypertenze – chronické onemocnění ledvin – diabetické onemocnění ledvin – renoparenchymatózní hypertenze
Úvod
Mezi arteriální hypertenzí a onemocněním ledvin existuje těsný vzájemný vztah: arteriální hypertenze často vede k poškození ledvin (hypertenzní nefropatie), může urychlit progresi jakéhokoli onemocnění ledvin a také se často vyskytuje jako důsledek onemocnění ledvin (renoparechymatózní hypertenze).
Hlavními patofyziologickými mechanismy zodpovědnými hypertenzi při onemocnění ledvin jsou:
aktivace intrarenálního systému renin-angiotenzin-aldosteron (RAAS) v důsledku intrarenální ischemie,
intrarenální aktivace sympatiku při onemocnění ledvin,
retence sodíku a vody ledvinami (zejména při pokročilém selhání ledvin),
akumulace endogenních inhibitorů syntézy NO,
zvýšení hladin endotelinu v důsledku poškození endotelu vlivem hypertenze, což vede k prohloubení vazokonstrikce a dalšímu zhoršení hypertenze. Cílem antihypertenzní léčby u onemocnění ledvin je na jedné straně snížit progresi renální insuficience a na druhé straně zabránit kardiovaskulárním příhodám. Jakékoli jednostranné nebo oboustranné onemocnění ledvin může vést k renoparenchymatózní hypertenzi, pokud toto onemocnění není spojeno se zvýšenými ztrátami NaCl. Nejpozději v preterminálním stadiu selhání ledvin s hodnotami eGFR < 30 ml/min je hypertenze diagnostikována u > 80 % pacientů.
Renoparenchymatózní hypertenze je forma sekundární hypertenze způsobená onemocněním ledvin. Může se vyskytnout jako komplikace řady renálních onemocnění – glomerulonefritidy, diabetické nefropatie (diabetické onemocnění ledvin), poškození ledvin v průběhu systémových onemocnění pojivové tkáně (systémový lupus erythematodes, systémová sklerodermie, systémová vaskulitida), tubulointersticiální nefritida, obstrukční nefropatie, polycystické onemocnění ledvin, velké solitární cysty ledvin (vzácně), postirradiační nefropatie, hypoplastická ledvina, tuberkulóza ledvin (vzácně).
Odhaduje se, že asi 5 % všech případů arteriální hypertenze je způsobeno renoparenchymatózní hypertenzí. Na její výskyt mají vliv následující faktory:
pohlaví (muži častěji než ženy),
etnická příslušnost (Afroameričané častěji než běloši),
věk,
rozsah poškození funkce ledvin,
příjem NaCl v dietě.
Nejčastější onemocnění ledvin, která vedou k rozvoji renoparenchymatózní hypertenze, jsou uvedena v tabulce 1.
Table 1. Možné příčiny renoparenchymatózní hypertenze (podle 1) 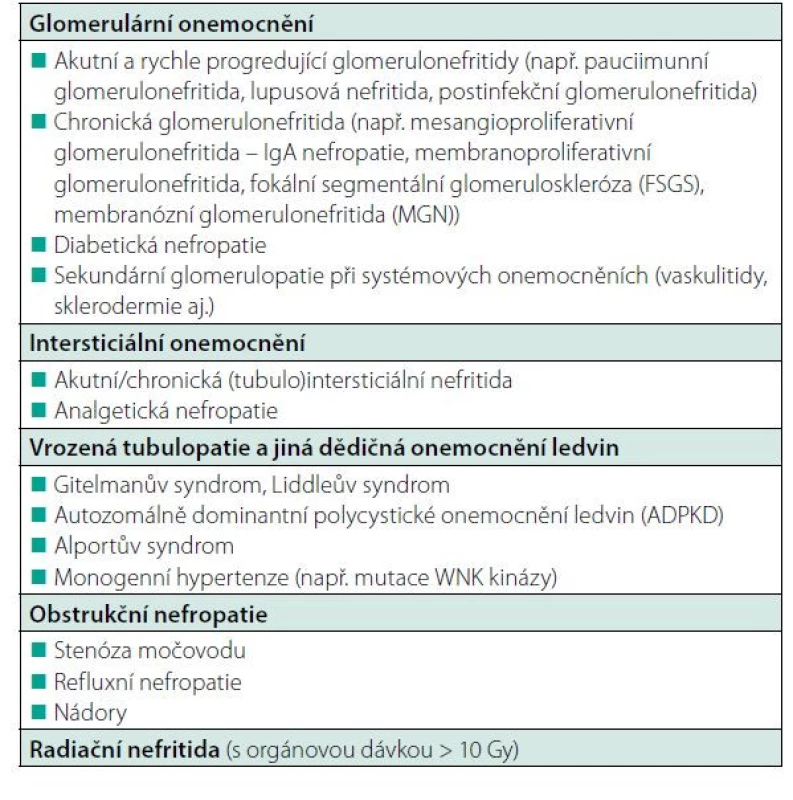
Role ledvin v regulaci krevního tlaku
Krevní tlak je regulován více mechanismy, které lze rozdělit podle rychlosti odezvy: systémy okamžité regulace (srdeční a cévní systémy), systémy krátkodobé regulace (reflexní oblouky), systémy střednědobé regulace (humorální regulační systémy), systémy dlouhodobé regulace (tlaková natriuréza) a konečně na systémy vyšší ho řádu (např. cirkadiánní ří zení tlaku krve).
Ledviny hrají ústřední roli v regulaci krevního tlaku. Vzájemný vztah mezi změnami systémového krevního tlaku a změnami vylučování sodíku ledvinami je dobře zdokumentován. Zvýšení perfuzního tlaku v renálních tepnách vede k rychlému zvýšení vylučování sodíku a vody ledvinami, takzvané „tlakové natriuréze“. Při zvýšení systémového tlaku tedy aktivace tohoto mechanismu tlakové natriurézy navodí dostatečné vylučování sodíku a vody, což má za následek snížení systémového tlaku. Porucha exkreční funkce ledvin má za následek chronické zvýšení intraarteriálního tlaku.
Systém renin‑angiotenzin‑aldosteron (RAS) má značný vliv na vzájemný vztah mezi TK a natriurézou v ledvinách jak ve zdraví, tak v nemoci. Při experimentálním podání angiotenzinu II dochází k posunu křivky tlak‑natriuréza doprava, což nasvědčuje tomu, že při aktivaci RAS je k vyloučení ekvivalentního množství natria zapotřebí vyššího tlaku krve. Naopak podávání inhibitorů ACE nebo blokátorů receptorů pro angiotenzin posouvá křivku doleva – k natriuréze dochází i při nižších hodnotách TK. RAS je aktivován při nízkých hladinách příjmu soli, což stimuluje renální reabsorpci sodíku a zachování volemie n a krevního tlaku. Naopak při vysokém příjmu sodíku je systém suprimován, což usnadňuje natriurézu. Komplexní souhra RAS, ADH (antidiuretickým hormonem) a ANP (atriálním natriuretickým faktorem) je znázorněna na obrázku 1.
Image 1. Regulace krevního tlaku souhrou RAS, ADH a ANP. Zdroj: upraveno podle (5, 17) 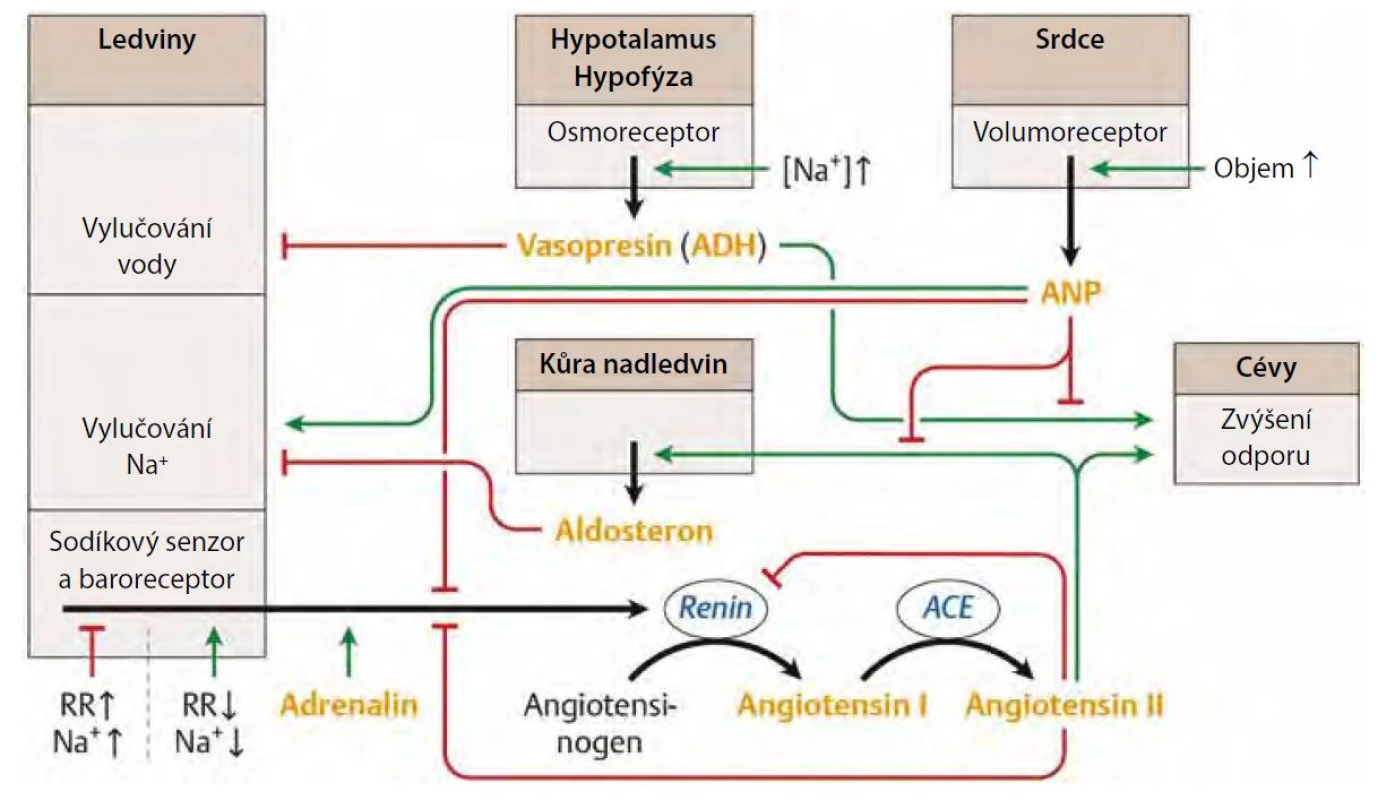
Patofyziologie renoparenchymatózní hypertenze
K rozvoji renoparenchymatózní hypertenze přispívají dva základní mechanismy: aktivace vasopresorických systémů ledvin a expanze cirkulujícího objemu (volumová složka).
V průběhu chronického onemocnění ledvin dochází k redukci funkčních nefronů s následným poklesem GFR. To vede k kompenzatorní aktivaci systému RAAS, což má za následek konstrikci eferentní arterioly se současnou vazodilatací aferentní arterioly. To vede ke glomerulární hypertenzi a hyperfiltraci. Aktivace RAAS dále způsobuje zvýšení krevního tlaku, intrarenální a systémové účinky aktivace RAAS vedou k dalšímu poškození glomerulů s následnou glomerulární sklerózou. Glomeruloskleróza způsobuje proteinurii, která následně iniciuje procesy intersticiální fibrózy.
V případě renoparenchymatózního poškození dochází také k trvalé aktivaci sympatiku a zvýšenému uvolňování endotelinu s odpovídajícím účinkem zvyšujícím krevní tlak.
Kromě aktivace těchto vazopresorických systémů se na zvýšení krevního tlaku podílí také endoteliální dysfunkce s narušením vazodilatačního systému NO a snížením vazodilatačních prostaglandinů.
Další mechanismus zvyšování krevního tlaku u renoparenchymatózních onemocnění je způsoben retencí sodíku a vody s následným rozvojem hypertenze z objemového přetížení.
U akutního glomerulárního onemocnění (např. akutní postinfekční glomerulonefritida) tento mechanismus převažuje, naproti tomu u cévních onemocnění jako vaskulitida nebo sklerodermie je hypertenze primárně způsobena stimulací systému RAAS vyvolanou ischemií; ta může vést k závažné dekompenzaci hypertenze, např. při tzv. sklerodermické renální krizi.
Jako další patofyziologický mechanismus renoparenchymatózní hypertenze se předpokládá deficit medulárních vazodilatačních substancí (3–5).
U onemocnění ledvin v terminálním stadiu s potřebou náhrady funkce ledvin je hypertenze podmíněna také volumovou složkou. Nicméně i v této fázi dysfunkční ledviny stále stimulují sympatický nervový systém a produkují renin, takže v některých případech umožňuje trvalé snížení krevního tlaku pouze nefrektomie.
U pacientů s renoparenchymatózní hypertenzí se nadměrně často vyskytuje syndrom obstrukční spánkové apnoe, přičemž souvislost tohoto jevu není uspokojivě vysvětlena.
V posledních několika letech se objevily nové poznatky o patofyziologii renoparenchymatózní hypertenze (endotelin, dráhy oxidu dusnatého (NO) a argininu). V plazmě a v moči se například nacházejí metylované deriváty L‑argininu, které mají schopnost inhibitoru NO syntázy, včetně NG‑N‑dimethylargininu a N‑monomethyl‑L‑argininu. U pacientů s chronickou uremií dochází ke snížení eliminace těchto sloučenin a jejich cirkulující koncentrace se mohou zvýšit natolik, že vedou k inhibici produkce NO. Akumulace endogenních inhibitorů syntetázy NO tak může přispívat k hypertenzi při pokročilém selhání ledvin. K vazokonstrikci a zhoršení hypertenze může přispět i endotelová dysfunkce (6).
K progresi renoparenchymatózní hypertenze přispívají i další endokrinní a metabolické poruchy, včetně zvýšeného ukládání produktů pozdní glykosylace (AGEs) a také poruchy kalciofosfátového metabolismu – CKD MBD, tj. minerálová a kostní choroba doprovázející chronické onemocnění ledvin (7).
Zrychlený rozvoj aterosklerózy, kalcifikace cévní stěny, ale i ztluštění intimy zůsobené hypertenzí vedou ke zvýšené tuhosti stěn velkých tepen, což má za důsledek další komplikace, mj. rozvoj srdečního selhání.
Rychlost pulzové vlny (pulse wave velocity – PWV), která je markerem tuhosti tepen, je u této populace s chronickým onemocněním ledvin silným nezávislým prediktorem úmrtnosti (8).
V této souvislosti je třeba zmínit recentní pokroky v pochopení patofyziologie diabetického onemocnění ledvin – jedné nejčastějších příčin renoparenchymatózní hypertenze. Dosud bylo diabetické onemocnění ledvin (DKD) pojímáno jako stav, kdy dochází k lineární progresi od normo - přes mikro - k makroalbuminurii, přičemž tento poslední krok předchází úbytek glomerulární filtrace (GFR). V současné době však přibývá důkazů, které naznačují, že mnoho pacientů s diabetem 1. nebo 2. typu může progredovat do stadia renální insuficience i bez progrese albuminurie, a to i při nefroprotektivní léčbě. Tento průběh diabetického onemocnění se v současnosti označuje jako non‑albuminurická varianta diabetického onemocnění ledvin (NADKD). Pozorován je nejčastěji u pacientů s manifestací DM 2. typu ve vyšším věku, léčených inhibitory RAS, je spojen s makrovaskulárními komplikacemi DM. Ačkoli recentní studie významně přispěly k pochopení významu poklesu renálních funkcí u normoalbuminurické DKD, mechanistických studií je stále málo. Je známo, že rezistence intrarenálních tepen, odhadovaná pomocí indexu rezistence renálního parenchymu, je zvýšená u většiny osob s diabetem 2. typu a zhoršenou funkcí ledvin v podobném rozsahu bez ohledu na tíži albuminurie. Je tedy možné, že zvýšená intrarenální cévní rezistence přispívá k poklesu GFR u všech osob s DKD a že se k ní následně přidávají další vlivy, které způsobují další urychlení poklesu eGFR při zvýšené albuminurii (9, 10, 11).
Vyšetřovací metody
Primární diagnostika zahrnuje základní biochemické a hematologické vyšetření krve (krevní obraz, iontogram vč. Ca, P, vyšetření renální funkcí, glykemie, lipidogram), zhodnocení albuminurie/proteinurie, vyšetření močového sedimentu, stanovení glomerulární filtrace (GFR) a sonografické vyšetření ledvin. Zobrazovací vyšetření ledvin je významné například k detekci některých renálních onemocnění, která se zatím neprojeví ani poklesem GFR, ani abnormálním močovým nálezem (například iniciální stadium polycystické choroby ledvin).
Výběrově pak může být indikováno vyšetření imunologických parametrů, případně renální biopsie.
V další stati se nebudeme zabývat stanovováním GFR, ale jen dalšími parametry renálních funkcí.
Protože zastoupení sekundární hypertenze je celkově méně než 10 %, je podrobnější vyšetřování prováděno především u pacientů s vyšší pravděpodobností této formy hypertenze:
věk pod 30 let
rezistentní hypertenze
anamnestické nebo klinické známky svědčící pro možnost sekundární hypertenze
recidivující hypertenzní emergence/urgence s poklesem tělesné hmotnosti, flush
obezita a denní únavnost
cushingoidní vzhled
nehmatné pulzace na akrách DKK
rozdíl naměřených hodnot TK na obou pažích
hypokalemie a metabolická acidóza
abnormální nález v zobrazení ledvin, např. rozdílná velikost
abnormální močový nález
K posouzení proteinurie se dnes obvykle stanovuje poměr albumin/ kreatinin nebo protein/kreatinin v libovolném vzorku moči (spot urine). K přesnější kvantifikaci je stále často prováděn sběr odpadů bílkovin ve 24hodinovém sběru moči. Diferenciace bílkovin v moči může být přispět k rozlišení poškození nefronu:
selektivní glomerulární proteinurie
albuminurie
neselektivní glomerulární proteinurie
smíšená proteinurie s detekcí všech sérových proteinů včetně imunoglobulinů
tubulární proteinurie
α1-mikroglobulin
Přetrvávající proteinurie by měla být vždy představovat indikaci k dovyšetření (imunologické odběry, z indikace nefrologa pak renální biopsie). V této souvislosti je také důležité rozlišovat mezi nefrotickým a nefritickým syndromem, přičemž v každém případě musí být splněna všechna požadovaná kritéria:
nefrotický syndrom
proteinurie > 3,5 g/24 hodin
hypoalbuminemie
dysproteinemie
edém
hypercholesterolemie
nefritický syndrom
erytrocyturie
válce v sedimentu
granulované válce
erytrocytární válce
smíšené válce
hypertenze
Zvláštní pozornost zasluhuje záchyt erytrocyturie a válců v močovém sedimentu. Detekce dysmorfních erytrocytů svědčí pro jejich glomerulární nebo tubulární původ. Pokud podíl dysmorfních erytrocytů přesáhne 40 % všech erytrocytů v moči, je to známkou onemocnění glomerulů nebo tubulů. Záchyt erytrocytárních válců je dokonce často známkou většinou rychle progredující glomerulonefritidy (RPGN) a měl by být důvodem k rychlému zásahu, protože jinak hrozí ztráta funkce ledvin – někdy i během několika dnů. Podezření na systémové onemocnění může podpořit i přítomnost celkových příznaků (např. hemoptýza, anémie, nevysvětlitelná únava).
Důležitou roli hraje močový sediment při odhalování rychle progredujících onemocnění ledvin.
Syntézou anamnézy, proteinurie a močového sedimentu a posouzením zobrazovacího vyšetření je většinou možné stanovit alespoň pravděpodobnou renální diagnózu, definitivní nález pak přinese renální biopsie.
Cílové hodnoty TK u chronického onemocnění ledvin
Cílové hodnoty krevního tlaku obecně (a zejména u renální insuficience) byly v posledních letech vícekrát diskutovány a upravovány, někdy s rozpory v různých doporučeních odborných společností. Pokud jde o progresi selhání ledvin, pozitivní vliv nižších (< 130/80 mmHg) oproti méně nízkým (< 140/90 mmHg) cílovým hodnotám byl prokázán pouze u proteinurického onemocnění ledvin. Podle nejnovějších údajů se však zdá, že nižší cílová hodnota má pozitivní vliv na kardiovaskulární ukazatele nezávisle na proteinurii. U jednotlivých onemocnění ledvin (např. polycystická choroba ledvin, IgA nefropatie) by mohly být užitečné i přísnější cílové hodnoty (< 125/75 mmHg) – zde se však jedná data z malých studií bez tvrdých endpointů. Naopak zejména u renální insuficience na cévním podkladě je třeba se vyvarovat příliš nízkých hodnot krevního tlaku – důvodem je omezená autoregulační schopnost ledvin a riziko akutního poškození ledvin. Cílové hodnoty by tedy měly být individualizovány; u proteinurických onemocnění ledvin by měly být cílem nižší hodnoty.
Principy terapie renoparenchymatózní hypertenze
Nefarmakologické intervence pomáhají snížit denní dávku antihypertenziv a oddálit přechod z prehypertenze do stadia hypertenze (12, 18–19). Tato opatření zahrnují úpravy životního stylu (dieta, cvičení, eliminace stresu a minimalizace konzumace alkoholu). Vhodný dietní systém představuje např. DASH (Dietary Approach to Stop Hypertension) nebo tradiční středomořská dieta. Principem je zvýšená konzumace ovoce, zeleniny, obilovin, mléčných výrobků a potravin bohatých na draslík a hořčík. Největší roli při snižování krevního tlaku má omezení příjmu Na+. Samotná dieta DASH má srovnatelný účinek jako farmakoterapie jedním antihypertenzivem. Po úpravě stravy je cvičení a snížení hmotnosti druhou hlavní intervencí při léčbě hypertenze. Ke snížení zvýšeného krevního tlaku přispívá také vyhýbání se stresujícímu životnímu stylu, depresi a úzkosti, příznivý efekt má omezení alkoholu. Úprava životního stylu je však dynamický proces a vyžaduje trvalé dodržování.
Specifická terapie glomerulárních nebo tubulárních onemocnění ledvin by se měla řídit doporučeními národních nebo mezinárodních odborných společností (12, 18–19); podrobný popis by přesáhl rozsah tohoto sdělení. Další opatření jsou obecně platná:
Kromě kontroly krevního tlaku je nutné též omezení soli (max. 2,4 g sodíku denně)1. Důsledná kontrola krevního tlaku může také snížit proteinurii. Ze studií na pacientech s diabetem je známo, že kumulativní výskyt konečného stadia selhání ledvin během tří let závisí také na rozsahu proteinurie. Kromě pravidelné kontroly krevního tlaku je proto třeba sledovat také proteinurii a funkci ledvin.
Omezení bílkovin na přibližně 0,8 g/kg tělesné hmotnosti při pokročilejší CKD je také doporučováno většinou odborných společností, rovněž je doporučena normalizace hmotnosti.
Blokátory RAAS jsou vhodné jako základ farmakoterapie renoparenchymatózní hypertenze, zejména u diabetiků a všech pacientů s proteinurií nad 0,5 g/d. Inhibitory ACE a blokátory angiotenzinových receptorů (ARB) jsou považovány za rovnocenné. Jejich kombinace se však se nedoporučuje z důvodu zvýšeného výskytu renálních a kardiovaskulárních komplikací.
Po zahájení léčby blokátory RAAS je třeba monitorovat kalemii a kontrolovat renální funkce. Zvýšení kreatininemie o více než 30 % výchozí hodnoty by mělo vést k úvaze o možné vaskulárně‑ischemické složce poškození ledvin a v případě event. jasných terapeutických konsekvencí (např. angioplastika) by mělo být provedeno další vyšetření s cílem odhalit např. stenózu renálních tepen. Ani při vzestupu kreatininemie nad 30 % výchozích hodnot by se však inhibitory RAAS neměly vysazovat pro jejich kardiovaskulární benefity (13).
U renoparenchymatózní hypertenze je často nutná kombinovaná léčba několika antihypertenzivy. Thiazidová diuretika lze doporučit jako kombinaci s blokátorem RAAS, protože zvyšují účinek blokátoru RAAS u renální hypertenze a působí proti objemové složce hypertenze prostřednictvím navození natriurézy. Diuretika jsou nezbytná zejména v případě otoků. Účinnou strategií u rezistentní hypertenze nebo refrakterních otoků může být sekvenční blokáda nefronu, tj. kombinace diuretik působících na různých segmentech nefronu.
Blokátory kalciových kanálů jsou vhodnými kombinačními partnery blokátorů RAAS. Často se však po nich vyskytují otoky, které mohou komplikovat posouzení případné hyperhydratace a následné objemové hypertenze.
Jako další součást antihypertenzní strategie může být užitečná inhibice aktivovaného sympatického nervového systému beta‑blokátory nebo centrálně působícími sympatomimetiky (např. moxonidin).
Antagonisté aldosteronu jsou obecně účinnými antihypertenzivy u renoparenchymatózní hypertenze. Jejich použití je však omezeno nezanedbatelným rizikem hyperkalemie. Z diuretik by měla být před hydrochlorothiazidem upřednostněna diuretika s dlouhou dobou účinku, jako je chlorthalidon nebo indapamid. Pokud se GFR sníží na méně než 30 ml/min, účinek thiazidových diuretik se snižuje, takže by měla být doplněna nebo nahrazena kličkovým diuretikem. V případě výrazných otoků je někdy nutné nasadit kličková diuretika ještě před dosažením této hodnoty GFR.
Je třeba se vyvarovat předávkování diuretiky, protože zvýšená natriuréza způsobuje sekundární hyperaldosteronismus a hypovolemie způsobuje další aktivaci RAAS.
Při farmakoterapii je nutné věnovat pozornost také látkám zvyšujícím krevní tlak v komedikaci. To platí zejména pro nesteroidní antiflogistika, glukokortikoidy, kontraceptiva, inhibitory kalcineurinu a erytropoeitin.
Zcela novou terapeutickou modalitou u chronického onemocnění ledvin jsou inhibitory sodíko‑glukózového transportéru 2 (SGLT2-i), které byly původně zavedeny jako léky pro léčbu DM 2. typu. V následujícím textu budou zmíněny i přesto, že nejde o léčiva určená k léčbě arteriální hypertenze, přestože vykazují efekt na pokles TK. Tato léčiva selektivně inhibují sodíko‑glukózový kotransportér typu 2 (SGLT2) v proximálním tubulu ledvin a vedou ke zvýšenému vylučování glukózy. Mají také příznivé pleiotropní účinky na tělesnou hmotnost, arteriální hypertenzi a cévní rigiditu (arterial stiffness), stejně jako i na albuminurii. Proto se kromě svých indikací v diabetologii na základě randomizovaných studií dostaly do popředí zájmu také jako substance pro léčbu kardiální a také renální insuficience (DAPA CKD, EMPA KIDNEY) (14, 15).
Pozn. pod čarou:
1Zhruba polovina hypertenzní populace a čtvrtina normotenzní populace vykazuje citlivost TK na sůl. U těchto nemocných s tzv. salt-sensitive hypertension (SSH) bývá vystupňovaná aktivita sympatického nervového systému a dochází k retenci NaCl. Je také známo, že noradrenalin stimuluje ledvinový kotransportér sodíku a chloridu (NCC) v buněčných membránách ledvinových tubulů, takže se více sodíku transportuje z moči zpět do krve. Přesný mechanismus vlivu noradrenalinu na retenci sodíku v ledvinách však není jasný. Studie (16) zkoumající signální dráhy sympatického nervového systému řízené adrenalinem nebo noradrenalinem, které regulují aktivitu NCC, zatím neprokázaly konzistentní výsledky. Přestože přesné patomechanismy nebyly dosud objasněny, zdá se, že selektivní blokátory alfa1-receptorů jsou schopny specificky zabránit hypertenzi citlivé na sůl. Pokud by se tyto poznatky na zvířatech z recentní studie z roku 2020 potvrdily v klinických studiích, mělo by to velký praktický význam, protože tyto léky by mohly prolomit začarovaný kruh a vést k normalizaci TK u mnoha nemocných, u nichž běžná antihypertenziva nezabírají (pacienti s tzv. refrakterní hypertenzí). Doposud bylo možné těmto pacientům pouze doporučit, aby omezili příjem soli na minimum, což však není snadné, mimo jiné kvůli skryté soli v mnoha potravinách. Cílená léčba hypertenze citlivé na sůl by pomohla snížit hladinu krevního tlaku u mnoha dalších pacientů do cílového rozmezí a snížit výskyt sekundárních onemocnění (16).
Výsledky studie DAPA CKD (14, 15) ukazují, že dapagliflozin má příznivý vliv na funkci ledvin u pacientů s CKD s DM nebo bez něj, kteří již užívají maximální tolerované dávky inhibitoru angiotenzin konvertujícího enzymu/blokátoru angiotenzinových receptorů. Byly rovněž zaznamenány příznivé účinky na mortalitu jinou než KV a mortalitu ze všech příčin. Výsledky byly trvalé u pacientů se známým KV onemocněním nebo KV onemocněním na počátku léčby i bez nich.
Za zmínku rovněž stojí, že u dapagliflozinu došlo ke snížení sekundárního cílového ukazatele úmrtnosti ze všech příčin (4,7 % oproti 6,8 %, ARR = 2,1 %, RRR = 30,8 %, NNT = 48, p = 0,004).
Studie s renálními endpointy DAPA‑CKD byla předčasně ukončena, protože již průběžná analýza prokázala statisticky významný benefit pro skupinu léčenou dapagliflozinem. Výsledky této studie (DAPA‑CKD) a podobných studií dokazují jasný přínos v léčbě CKD. Studie CREDENCE prokázala podobný přínos u pacientů s CKD a DM 2. typu; DAPA‑CKD nicméně rozšiřuje přínos i na pacienty bez DM a s nižší GFR. Podobné výsledky byly zaznamenány i u pacientů se srdečním selháním a sníženou ejekční frakcí, u kterých došlo ke snížení výskytu srdečního selhání pomocí těchto léků, a to nezávisle na stavu DM.
Velmi slibnou novou nefarmakologickou léčebnou metodou, která se zdá být velmi efektivní u pacientů s rezistentní hypertenzí, je renální denervace. Data týkající se kontroly krevního tlaku u rezistentní hypertenze z dlouhodobého hlediska stále chybí.
Ultimum refugium může představovat jednostranná nebo oboustranná nefrektomie (jednostranný výkon zpravidla při afunkci ledviny vlivem svráštění, oboustranný výkon při terminální renální insuficienci, většinou u pacientů léčených dialýzou, u nichž se nepodařilo docílit snížení TK jinými prostředky).
Závěr
Renoparenchymatózní hypertenze představuje asi 5 % případů arteriální hypertenze a jde o častý doprovodný projev akutního i chronického onemocnění ledvin. Ke stanovení správné diagnózy je nutné kromě vyšetření renálních funkcí i vyšetření močového nálezu i zobrazovací vyšetření ledvin (nejčastěji ultrazvukové vyšetření).
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jan Vachek
Klinika nefrologie 1. LF UK a VFN v Praze U Nemocnice 2, 128 08 Praha 2
Cit. zkr: Vnitř Lék 2021; 67(8): 479–484
Článek přijat redakcí: 19. 10. 2021
Článek přijat po recenzích: 29. 11. 2021
Sources
1. Haffner D, Khalil M. Hypertonie. Pädiatrie. 2019; 485-491. doi:10.1007/978-3-662-57295-5_21.
2. Charles L, Triscott J, Dobbs B. Secondary Hypertension: Discovering the Underlying Cause. Am Fam Physician. 2017 Oct 1; 96(7): 453–461. PMID: 29094913.
3. Brooks B, Byers LW, Muirhead EE et al. Purification of class I medullipins from the venous effluent of isolated normal kidneys perfused under high pressure with saline. Blood Press 1994; 3 : 407–417.
4. Muirhead EE, Brooks B, Byers LW. Biologic differences between vasodilator prostaglandins and medullipin I. Am J Med Sci 1992; 303 : 86–89.
5. Mattson DL. Importance of the renal medullary circulation in the control of sodium excretion and blood pressure. American Journal of Physiology‑Regulatory, Integrative and Comparative Physiology 2003; 284 : 1, R13–R27.
6. Kohan DE. Endothelin, hypertension and chronic kidney disease: new insights. Curr Opin Nephrol Hypertens. 2010; 19(2): 134-139. doi: 10.1097/MNH.0b013e328335f91f.
7. Chen NX, Srinivasan S, O’Neill K, Nickolas TL, Wallace JM, Allen MR, Metzger CE, Creecy A, Avin KG, Moe SM. Effect of Advanced Glycation End‑Products (AGE) Lowering Drug ALT - 711 on Biochemical, Vascular, and Bone Parameters in a Rat Model of CKD‑MBD. J Bone Miner Res. 2020 Mar; 35(3): 608-617. doi: 10.1002/jbmr.3925. Epub 2019 Dec 30. PMID: 31743501.
8. Lioufas N, Hawley CM, Cameron JD, Toussaint ND. Chronic Kidney Disease and Pulse Wave Velocity: A Narrative Review. Int J Hypertens. 2019;2019 : 9189362. Published 2019 Feb 17. doi:10.1155/2019/9189362.
9. Chen C, Wang C, Hu C et al. Normoalbuminuric diabetic kidney disease. Front. Med. 11, 310–318 (2017). https://doi.org/10.1007/s11684-017-0542-7
10. Vistisen D, Andersen GS, Hulman A, Persson F, Rossing P, Jørgensen ME. Progressive decline in estimated glomerular filtration rate in patients with diabetes after moderate loss in kidney function—even without albuminuria. Diabetes Care 2019; 42 : 1886–1894 pmid:31221677.
11. Maksoud AAA, Sharara SM, Nanda A, Khouzam RN. The renal resistive index as a new complementary tool to predict microvascular diabetic complications in children and adolescents: A groundbreaking finding. Ann. Transl. Med. 2019; 7 : 422. doi: 10.21037/atm.2019. 08. 65.
12. Rovin BH, Adler SG, Barratt J et al. Executive summary of the KDIGO 2021 Guideline for the Management of Glomerular Diseases, Kidney International, Volume 100, Issue 4, 2021, Pages 753-779, ISSN 0085-2538, https://doi.org/10.1016/j.kint.2021. 05. 015.
13. Murphy T P, Cooper C J, Dworkin L D, Henrich W L, Rundback J H, Matsumoto A H, Jamerson K A, D‘Agostino R B. (2005). The Cardiovascular Outcomes with Renal Atherosclerotic Lesions (CORAL) study: Rationale and methods. Journal of Vascular and Interventional Radiology, 16(10), 1295-1300. https://doi.org/10.1097/01.RVI.0000176301.69756.28
14. Heerspink HJL, Stefánsson BV, Correa‑Rotter R, Chertow GM, Greene T, Hou FF, Mann JFE, McMurray JJV, Lindberg M, Rossing P, Sjöström CD, Toto RD, Langkilde AM, Wheeler DC; DAPA‑CKD Trial Committees and Investigators. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020 Oct 8; 383(15): 1436-1446. doi: 10.1056/ NEJMoa2024816. Epub 2020 Sep 24. PMID: 32970396.
15. Dumann E, Menne J. SGLT2-Inhibitoren: Was gibt es Neues?. Nephrologe 16, 241–255 (2021). https://doi.org/10.1007/s11560-021-00511-4.
16. Puleo F, Kim K, Frame AA, Walsh KR, Ferdaus MZ, Moreira JD, Comsti E, Faudoa E, Nist KM, Abkin E, Wainford RD. Sympathetic Regulation of the NCC (Sodium Chloride Cotransporter) in Dahl Salt‑Sensitive Hypertension. Hypertension. 2020 Nov;76(5):1461 - 1469. doi: 10.1161/HYPERTENSIONAHA.120.15928. Epub 2020 Sep 28. PMID: 32981364; PMCID: PMC7727920.
17. Püschel et al. Taschenlehrbuch Biochemie, Thieme, 2019.
18. Whelton PK, Carey RM, Aronow WS et al. 2017ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension 2018; 71 : 1269–1324.
19. Williams B, Mancia G, Spiering W et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018; 39 : 3021–3104.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 8-
All articles in this issue
- Problematika antibiotické léčby u pacientů s covidem-19
- Aktivní vyhledávání a časná diagnostika HCV infikovaných osob
- Optimální hladina kalia u pacientů se srdečním selháním
- Lokalizovaná (unicentrická) forma Castlemanovy nemoci. Klinické projevy, diagnostika a léčba
- Glifloziny – nové léky pro pacienty se srdečním selháním?
- Renoparenchymatózní hypertenze – aktuality v diagnostice a léčbě
- Oboustranné vícečetné pneumatokély jako vzácná pozdní komplikace pneumonie covid-19
- Jaká jsou specifika syndromu diabetické nohy a proč potřebujeme mezioborová doporučení pro jeho diagnostiku a léčbu?
- Expertní konsenzus k významu deficitu železa a možnosti jeho korekce u pacientů se srdečním selháním
- Memorandum z jednání zástupců ČIS a ČPFS dne 6. 5. 2021 v Lékařském domě ČLS JEP v Praze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Renoparenchymatózní hypertenze – aktuality v diagnostice a léčbě
- Glifloziny – nové léky pro pacienty se srdečním selháním?
- Optimální hladina kalia u pacientů se srdečním selháním
- Problematika antibiotické léčby u pacientů s covidem-19
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

