-
Medical journals
- Career
Problematika antibiotické léčby u pacientů s covidem-19
Authors: Milan Kolář 1; Lenka Doubravská 2; Petr Jakubec 3; Miroslava Htoutou Sedláková 1; Kateřina Fišerová 1
Authors‘ workplace: Ústav mikrobiologie, Fakultní nemocnice Olomouc 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Olomouc 2; Klinika plicních nemocí a tuberkulózy, Fakultní nemocnice Olomouc 3
Published in: Vnitř Lék 2021; 67(8): 448-454
Category: Review Articles
Overview
Pandemie covidu-19 může zvýšit stávající hrozbu antimikrobiální rezistence a zesílit další, spíše tichou pandemii, kterou představuje rostoucí frekvence multirezistentních bakteriálních patogenů a s tím spojená možnost ztráty účinných antibiotik. U pacientů hospitalizovaných pro covid-19 byla často aplikována antibiotická léčba z důvodu obav z možné bakteriální koinfekce, což potvrzovaly i předchozí zkušenosti s virovými respiračními infekcemi, například H1N1 chřipkou, SARS a MERS. Obavy nebo neznámé související s pandemií covid-19 rovněž ovlivnily chování lékařů, včetně používání antibiotik. Nicméně vysoká míra aplikace antibiotik u pacientů, především s mírným nebo středně závažným onemocněním covid-19, je v rozporu s reálným výskytem bakteriálních koinfekcí a/nebo sekundárních respiračních infekcí. Je tedy zřejmé, že je nutné pečlivé posouzení role antibiotické léčby u pacientů hospitalizovaných pro covid-19. Dle aktuálního doporučení WHO je aplikace antibiotik vhodná především u pacientů se závažným/kritickým stupněm respirační insuficience vyžadujícím intenzivní oxygenoterapii, umělou plicní ventilaci či podporu extrakorporální membránovou oxygenací.
Klíčová slova:
antibiotiká – baktérie – COVID-19 – pneumonie
Současné zdravotnictví se stále potýká se světovou pandemií vyvolanou virem SARS‑CoV - 2. V souvislosti s infekcí covid-19 se otevírá další důležitá otázka, a to indikace antibiotické léčby. SARS‑CoV - 2 může způsobit široké spektrum onemocnění, od velmi mírných příznaků infekce horních cest dýchacích až po život ohrožující pneumonii. Je tedy zřejmé, že pandemie covid-19 vedla k dramatickému nárůstu hospitalizovaných pacientů splňujících kritéria pro komunitní pneumonii (CAP). Současně je nutné konstatovat, že těžce probíhající tzv. „kovidová pneumonie“ je často spojena s vysokou hladinou zánětlivých markerů. Je proto náročné definovat, zdali pacient splňující kritéria pro těžkou CAP, který je pozitivní na SARS‑CoV - 2, má při přijetí bakteriální koinfekci, či nikoliv. Rovněž během hospitalizace může být obtížné rozlišit mezi závažným onemocněním covid-19 a rozvojem sekundární bakteriální pneumonie. Aplikace antibiotik dále vycházela ze skutečnosti, že sekundární bakteriální infekce byly častou příčinou úmrtí u pacientů s těžce probíhající chřipkou H1N1 (1, 2). Současné doporučení americké odborné společnosti Infectious Disease Society of America však uvádí, že nejsou k dispozici žádné údaje podporující účinnost antibiotik v prevenci bakteriálních komplikací u pacientů s chřipkou (3). Retrospektivní studie provedená ve Wuhanu u 191 hospitalizovaných pacientů dokumentuje rozvoj sekundárních bakteriálních infekcí u 15 % případů, přičemž výskyt bakteriálních komplikací byl u přeživších pacientů významně nižší (< 1 %) ve srovnání s pacienty, kteří nepřežili (50 %) (4). Zhou et al. dále uvádějí, že rozvoj ventilátorové pneumonie byl zaznamenán u 31 % pacientů na umělé plicní ventilaci (UPV) (4). Zdálo se tedy, že aplikace antibiotik bude hrát v léčbě hospitalizovaných pacientů s covid-19 významnou roli. V tomto přehledném sdělení se zabýváme aplikací antibiotik u pacientů hospitalizovaných pro covid-19. Úvodem je vhodné definovat klinická stadia covid-19 a termíny bakteriální koinfekce a sekundární infekce (Tabulka 1).
Table 1. Definice základních termínů 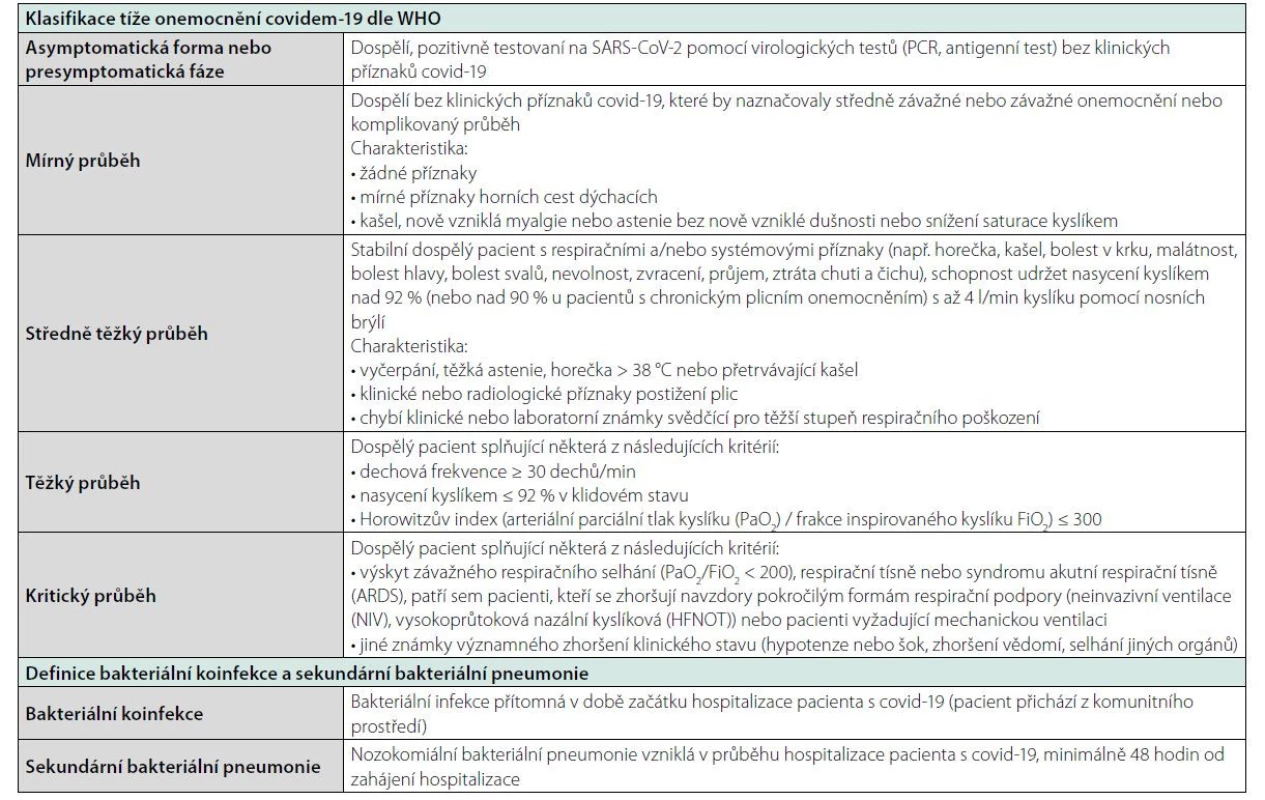
Pandemie vyvolaná virem SARS‑CoV - 2 jasně ukázala na poněkud podceňovaný problém infekčních nemocí a prokázala jejich zásadní negativní dopad na národní zdravotnické systémy a ekonomiky. Na začátku pandemie covid-19 bylo, bez jasného důkazu účinnosti, použito k léčbě řady léčiv, včetně antibiotik. Přínos prvního doporučeného postupu založeného na kombinaci azitromycinu a hydroxychlorochinu nebyl prokázán (5–7). Postupně se v odborné literatuře začaly objevovat studie poukazující na rozpor mezi masivní antibioterapií a výskytem bakteriálních infekcí. Studie Yanga et al. u kriticky nemocných pacientů s covid-19 uvádí, že sekundární bakteriální infekce byla prokázána u 14 % pacientů, přičemž antibiotická léčba byla nasazena u 94 % (8). Další studie zahrnující 99 pacientů, z nichž u 71 % byla podávána antibiotika, prokázala současnou bakteriální infekci pouze u jednoho pacienta (9). Nori et al. v retrospektivní studii uvádějí nesoulad mezi antibiotickou léčbou u 71 % pacientů a výskytem bakteriální infekce pouze u 4 % (10). Systematické review a metaanalýza 31 studií ukázala, že pouze 7 % pacientů hospitalizovaných s covid-19 mělo současně probíhající bakteriální infekci, naproti tomu však více než 90 % pacientů bylo léčeno antibiotiky (11). Podobně práce Vaughna et al. na souboru 1705 pacientů uvádí, že 57 % pacientů dostalo při hospitalizaci antibiotika, ale jen u 59 (4 %) byla prokázána bakteriální komunitní pneumonie, resp. koinfekce (12). Buetti et al. retrospektivně hodnotili 48 intubovaných pacientů s covid-19 s cílem určit, zdali časná antibiotická léčba snižuje mortalitu (13). Antibiotika byla nasazena při přijetí u 19 pacientů, přičemž nebyl prokázán rozdíl v mortalitě mezi pacienty s antibioterapií (26 %) a bez ní (24 %) (13). Nízký podíl pacientů s covid-19 se souběžnou koinfekcí nebo sekundární bakteriální infekcí odpovídá dalším zjištěním. Ve Španělsku z 989 po sobě jdoucích pacientů s covid-19 byla bakteriální infekce potvrzena pouze u 7 % (14). Chedid et al. publikovali v květnu 2021 review zahrnující devatenáct studií s 2834 hospitalizovanými pacienty (15). Souhrnná úmrtnost byla 14 % (405 pacientů z 2834), 36 % pacientů bylo klasifikováno jako závažní pacienti (15). Charakteristiky pacientů z těchto studií jsou shrnuty v Tabulce 2.
Table 2. Údaje z vybraných studií týkajících se charakteristik covid-pozitivních pacientů a aplikace antibiotik 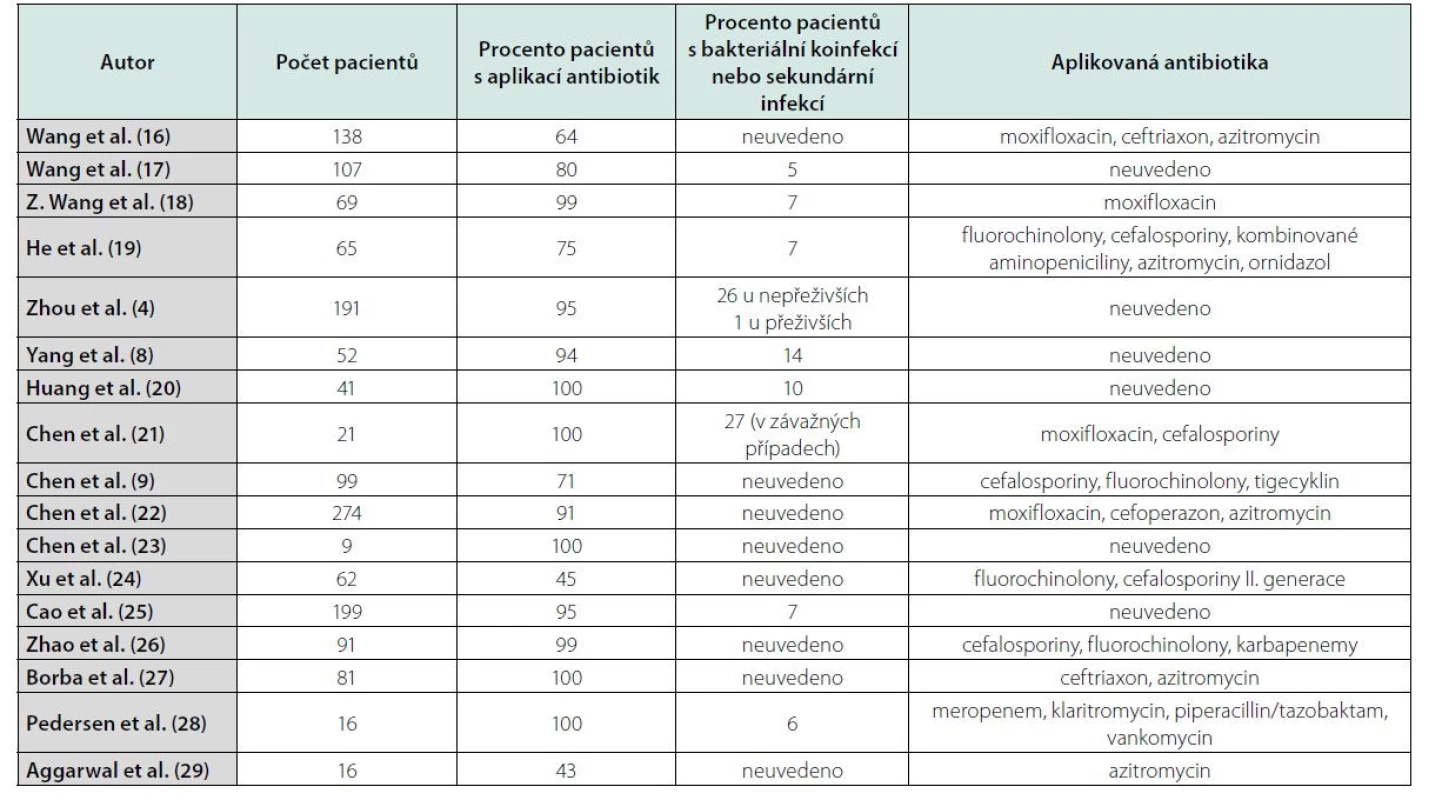
Chedid et al. ve svém review uvádějí průměrnou aplikaci antibiotik u 74 % hospitalizovaných pacientů s covid-19. Nejčastěji používanými antibiotiky byly fluorochinolony, makrolidy, cefalosporiny, meropenem a piperacilin/tazobaktam (15). Pouze 3 studie současně uvedly délku antibiotické léčby, He et al. 3 až 17 dnů s mediánem 5 dnů, Borba et al. uvádějí 7 dní aplikace ceftriaxonu a 5 dní u azithromycinu, Pedersen et al. upřesňují, že klaritromycin byl vysazen po vyloučení etiologické role atypických bakterií, zatímco meropenem nebo piperacilin/tazobaktam byly aplikovány alespoň osm dní (19, 27, 28). Velice zajímavé jsou údaje týkající se výskytu bakteriálních koinfekcí a sekundárních infekcí. Pouze u 18 % pacientů, kteří dostávali antibiotika, byla prokázána sekundární bakteriální infekce (15). Dalším zajímavým údajem je skutečnost, že polovina pacientů, kterým byla podávána antibiotika, neměla závažný průběh infekce covid-19 (15). Tyto výsledky svědčí o významné tendenci zahajovat antibiotickou léčbu i v případě mírných nebo středně těžkých pacientů. Některé studie však poukazují na vyšší míru aplikace antibiotik u pacientů s těžkým průběhem covid-19. Například Guan et al. uvádějí aplikaci antibiotik u 80 % pacientů s těžkým průběhem covid-19 v porovnání s 50 % u pacientů bez závažných obtíží (30). V případě 5 studií s údaji výhradně od závažných nebo kritických pacientů je dokumentována aplikace antibiotik u více než 90 %, kromě studie He et al. s aplikací antibiotik v případě 75 % pacientů (19, 8, 25, 27, 28). Některé studie blíže charakterizují mortalitu pacientů ve vztahu k bakteriálním infekcím. He et al. dokumentují, že mortalita u pacientů se sekundárními infekcemi byla 15 % oproti 7 % u pacientů bez sekundárních infekcí (19). Wang et al. poznamenali, že u pacientů, kteří nepřežili, bylo podstatně více bakteriálních infekcí než u přeživších (17). Zhou et al. uvedli, že 50 % úmrtí lze přičíst sekundárním infekcím (4). Ačkoliv ve většině uvedených studií chybí podrobné klinické odůvodnění předepisování antibiotik, lze definovat následující obecné tendence:
pouze u 18 % pacientů s aplikací antibiotik byla prokázána bakteriální infekce, což naznačuje velkou míru zbytečné aplikace antibakteriálních přípravků, za zmínku však stojí možnost limitovaného přístupu k mikrobiologickému vyšetření z důvodu přetíženosti zdravotnických systémů (30),
léčba antibiotiky byla preferována u závažnějších pacientů, nicméně polovina pacientů, kteří dostávali antibiotika, neměla závažný průběh infekce covid-19,
fluorochinolony byly nejčastěji aplikovanými antibiotiky, což vzhledem k jejich tendenci stimulovat šíření bakteriální rezistence a možným nežádoucím účinkům není optimální,
nebyl zkoumán typ antibiotické léčby podle závažnosti pacienta.
Z výše uvedených údajů je zřejmá naléhavá potřeba dalšího výzkumu, od vypracování doporučených postupů založených na důkazech, přehodnocení role antibiotické léčby u pacientů s covidem-19, porozumění výhodám a nevýhodám používání antibiotik, posouzení širšího dopadu pandemie vyvolené vírem SARS‑CoV - 2 na vývoj antimikrobální rezistence (AMR). Účinnost antibiotik by měla být u pacientů s covidem-19 dále studována především z důvodu, aby se minimalizovalo jejich nerelevantní použití. Současně jsou nutné další studie hodnotící úlohu biochemických a mikrobiologických vyšetření s cílem definovat jejich výpovědní hodnotu a roli v rozhodovacím algoritmu pro zahajování, řízení a délku antibiotické léčby. Dopad covid-19 na AMR je v současné době intenzivně studován, především z důvodu, že většina studií uvádí masivní empirické použití antibiotik, které je v kontrastu s relativně nízkou frekvencí souběžné bakteriální koinfekce a sekundárních bakteriálních infekcí. Je nutné zdůraznit, že aplikace antibiotik byla prokázána jako rizikový faktor pro zvyšování AMR a vznik nozokomiálních infekcí s etiologickou rolí multirezistentních (MDR) bakterií (31-33). Dále je zřejmé, že u pacientů se změněnou střevní mikroflórou vlivem širokospektré antibiotické léčby se mohou projevit závažnější příznaky covidu-19 (34). Zvýšené používání antibiotik rovněž zvyšuje riziko rozvoje infekce vyvolané Clostridioides difficile (CDI) (35, 36).
Z dosavadních studií vyplývá závěr, že pacientům s covidem-19 byla často podávána antibiotika bez ohledu na závažnost onemocnění. V současné době WHO nedoporučuje aplikaci antibiotik u pacientů s mírným nebo středně závažným onemocněním covid-19, pokud nejsou přítomny klinické a laboratorní známky bakteriální infekce. U závažných/kritických fází covidu-19 lze antibiotika aplikovat, ale je doporučeno každodenní posouzení klinického stavu, biochemických markerů a mikrobiologických výsledků s cílem včasné deeskalace nebo ukončení antibiotické léčby (37). Dle konsenzuálního doporučení britského NICE rovněž nejsou antibiotika k prevenci nebo léčbě u pacientů s covidem-19 primárně indikována a jejich aplikace je opodstatněná pouze u pacientů s klinickým podezřením na souběžnou bakteriální infekci a/nebo těžkých/kriticky nemocných pacientů se zvýšeným rizikem rozvoje sekundárních bakteriálních infekcí, například v důsledku imunosuprese (38). Odlišení bakteriální infekce od závažné zánětlivé reakce vyvolané virem SARS‑CoV - 2 je však klinicky obtížné. Diagnostické potvrzení bakteriálních infekcí mikrobiologickým vyšetřením je navíc časově náročné a není k dispozici v prvních hodinách hospitalizace pacienta s covidem-19 (s určitými výjimkami, např. průkaz pneumokokového antigenu v moči či PCR průkaz bakteriálních patogenů v klinických vzorcích z dýchacích cest), což rozhodování o zahájení antibiotické léčby značně ztěžovalo a nadále ztěžuje. Cong et al. uvádějí, že pacienti, kterým byla poskytnuta antibiotika s klinickým zdůvodněním, ve srovnání s těmi, kterým byla podávána antibiotika bez klinických příznaků bakteriální infekce, vykazovali nižší úmrtnost (9 % vs. 13 %) a kratší dobu hospitalizace (9 dnů vs. 12 dnů) (39). Tyto údaje podporují a posilují současná doporučení neaplikovat antibiotika pacientům s covidem-19 bez potvrzené nebo velmi pravděpodobné (na základě klinických/mikrobiologických parametrů) bakteriální infekce. Tento postup je v souladu s výsledky retrospektivní studie zkoumající výsledky léčby u 1123 pacientů s covidem-19 z Wuchanu, která srovnávala léčbu antibiotiky mezi pacienty s podezřením na bakteriální infekci ve srovnání s těmi, u nichž nebyla prokázána bakteriální infekce. Bylo zjištěno, že antibiotická léčba byla u pacientů bez známek bakteriální infekce spojena se zvýšenou mortalitou a autoři dospěli k závěru, že většina pacientů bez podezření na bakteriální infekci neměla prospěch z léčby antibiotiky (40). Retrospektivní studie, která přezkoumala 48 kriticky nemocných a intubovaných pacientů s covidem-19 v intenzivní péči přijatých v období od dubna do května 2020 ve Švýcarsku, rovněž uvádí, že časně podaná antibiotika nijak zásadně neovlivňují mortalitu a ani neoddalují event. rozvoj nozokomiální infekce (13).
Ačkoliv je aplikace antibiotik u těžkých/kritických pacientů s covidem - 19 dle WHO a NICE doporučena, nemusí to přinést očekávané výhody (37, 38). Sieswerda et al. uvádí bakteriální koinfekci při přijetí u cca u 4 % pacientů, rozvoj bakteriální respirační infekce během hospitalizace u 15 % (36). Lze tedy doporučit omezení aplikace antibiotik, zejména při přijetí, a vynaložení maximálního úsilí na mikrobiologická vyšetření, především vzorků sputa, hemokultur a také k testování pneumokokového antigenu v moči. U pacientů se zahájenou antibiotickou léčbou při přijetí bezodkladně vysadit antibiotika, pokud jsou mikrobiologická vyšetření negativní po 48 hodinách. V případě prokázaného nebo alespoň vysoce pravděpodobného rozvoje sekundární bakteriální pneumonie (HAP) je vhodné dodržovat doporučené klinické postupy týkající se antibiotické léčby u pacientů s HAP. Při zlepšení klinického stavu a poklesu zánětlivých markerů lze antibiotickou léčbu ukončit po 5–7 dnech. Jelikož neexistují důkazy, které by podporovaly použití specifické antibiotické strategie u pacientů s covidem-19 a bakteriální pneumonií, je doporučeno dodržovat místní a/nebo národní směrnice pro antibakteriální léčbu CAP/HAP (41, 42). V případě rozvoje HAP u hospitalizovaného pacienta s covidem-19 v České republice, je vhodné postupovat podle Klinického doporučeného postupu Nozokomiální pneumonie – antibiotická léčba (43). Tabulka 3 dokumentuje hlavní zásady pro aplikaci antibiotik u hospitalizovaných covid-19 pozitivních pacientů.
Table 3. Hlavní zásady pro aplikaci antibiotik u hospitalizovaných pacientů s covidem-19 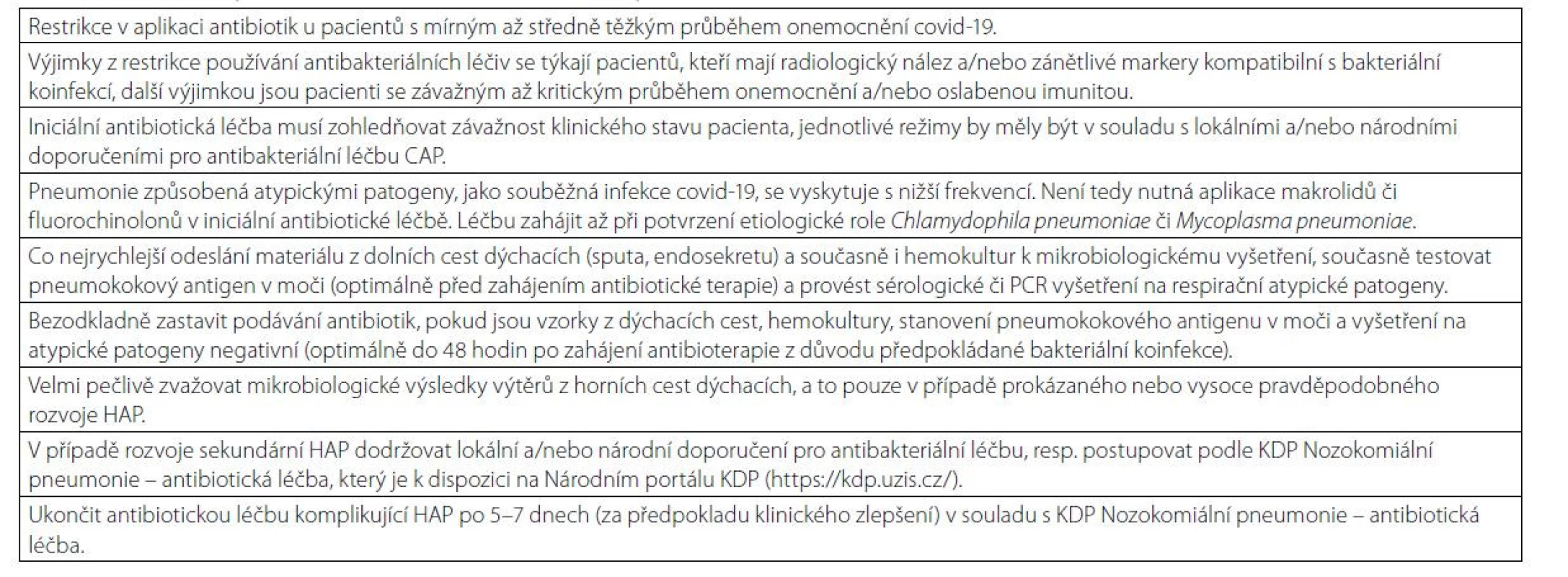
V případě covid-19 pozitivních pacientů se závažným/kritickým stupněm pneumonie vyžadujícím vysokoprůtokovou nazální kyslíkovou terapii (HFOT), umělou plicní ventilaci (UPV) či dokonce podporu extrakorporální membránovou oxygenací (ECMO) je dle doporučení WHO aplikována antibiotická léčba (37). Dostupné důkazy naznačují u vážně/kriticky nemocných pacientů 20–30% riziko rozvoje HAP, především u ventilovaných pacientů (4, 36). Je doporučeno u pacientů s covid-19 a podezřením na sekundární bakteriální HAP postupovat v souladu s místními a/nebo národními doporučeními (43). Současně je nutné zdůraznit potřebu vhodné deeskalace, aby se co nejvíce omezilo zbytečné používání širokospektré antibiotické léčby. Role antibiotické léčby u této nejzávažnější skupiny covid-19 pozitivních pacientů však zůstává stále nejasná a je zřejmé, že incidence sekundárních bakteriálních infekcí je nižší, než byl původní předpoklad vycházející z předchozích epidemií virových respiračních onemocnění (SARS, MERS, H1N1 chřipka) (1, 2). Stále přetrvávají otázky, zdali je nutné při hospitalizaci pacienta s covidem-19, vyžadujícího napojení na invazivní oxygenoterapii, UPV či ECMO, antibakteriální léčbu ihned nasadit, či nikoliv. Doporučení zahájit antibiotickou léčbu vychází z obavy jejího pozdního zahájení, což by mohlo mít pro pacienta závažné následky, včetně rozvoje sepse a související vyšší mortality (44). Současně je nutné zdůraznit, že zhodnocení přítomnosti bakteriální respirační superinfekce u pacientů s těžkým/kritickým průběhem covidu-19 se ukázalo jako problematické. Klasická kritéria (klinické příznaky, radiologický nález, celkové a laboratorní známky infekce/zánětu) jsou u pacientů s hypoxemickým selháním a/nebo ARDS obtížně aplikovatelná. Radiologický nález je v terénu obrazu tzv. „kovidové plíce“ obtížně hodnotitelný a klinická kritéria (poslechový nález a produkce sputa) jsou obecně v intenzivní péči u pacientů na UPV málo senzitivní či specifická. Význam zánětlivých markerů je nejasný a na základě mikrobiologických vyšetření, především tracheálních endosekretů, je obtížné zhodnotit, zdali se jedná o bakteriálního původce infekce či pouhou kolonizaci. Je tedy zřejmé, že lze v této otázce očekávat další specifikace na základě dalších studií. Tabulka 4 uvádí pro názornost stávající indikace a režimy antibiotické léčby u pacientů s covidem-19 hospitalizovaných ve Fakultní nemocnici Olomouc.
Table 4. Doporučený postup u pacientů s covid-19 hospitalizovaných ve Fakultní nemocnici Olomouc 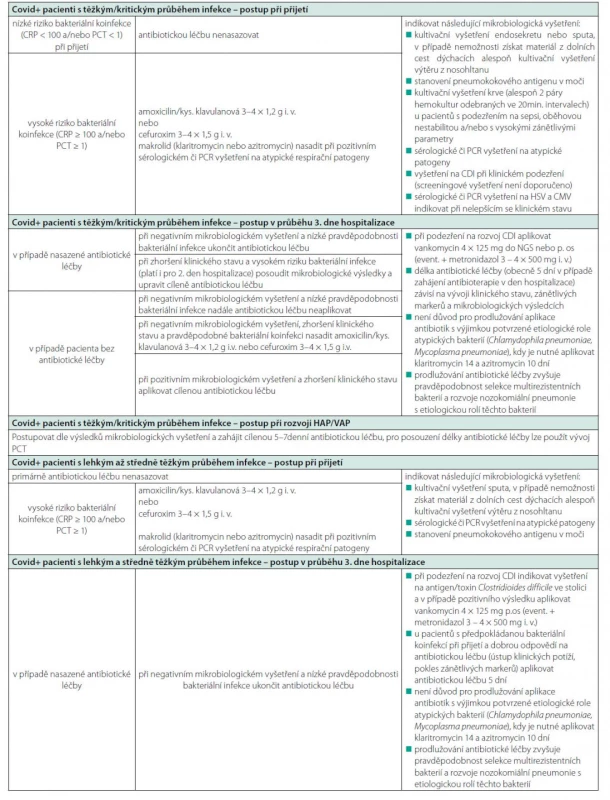

Legenda: CRP – C reaktivní protein, PCT – prokalcitonin, CDI – Clostridioides difficile infection, HAP – nozokomiální pneumonie, CAP – komunitní pneumonie Závěr
Názory na antibiotickou léčbu u hospitalizovaných pacientů s covid - 19 se postupně vyvíjely. Je nutné zdůraznit, že aplikace antibiotik, resp. jejich selekční tlak, spolu s intenzivní oxygenoterapií nebo umělou plicní ventilací, event. napojením na ECMO, představují riziko pro rozvoj nozokomiální infekce, především HAP s etiologickou rolí MDR bakterií. Dále může docházet k šíření MDR bakterií mezi pacienty, včetně Clostridioides difficile. Je vhodné připomenout, že v souvislosti s nástupem pandemie covid-19 a prudkým nárůstem počtu hospitalizovaných pacientů byla většina nemocnic nucena provést změny v organizaci i prostorovém uspořádání, aby byly schopny pokrýt zvýšené požadavky na poskytování zdravotní péče, což mohlo ovlivnit účinnost standardních hygienicko‑epidemiologických režimů a usnadnit šíření MDR bakterií mezi pacienty. V současné době není aplikace antibiotik u pacientů s mírným nebo středně závažným onemocněním covid-19 doporučena. V případě závažných/kritických fází covidu-19 lze antibiotika aplikovat, ale je vhodné denní posouzení klinického stavu, biochemických markerů a mikrobiologických výsledků s cílem včasné deeskalace nebo ukončení antibiotické léčby.
Podpořeno projektem DRO FNOL 00098892.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Lenka Doubravská, Ph.D.
Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Olomouc I. P. Pavlova 6, 775 20 Olomouc
Cit. zkr: Vnitř Lék 2021; 67(8): 448–454
Článek přijat redakcí: 7. 10. 2021
Článek přijat po recenzích: 28. 10. 2021
Sources
1. Rice TW, Rubinson L, Uyeki TM et al. Critical illness from 2009 pandemic influenza A virus and bacterial coinfection in the United States. Crit Care Med 2012; 40(5): 1487–1498. Dostupné z DOI: <https://doi.org/10.1097/CCM.0b013e3182416f23>.
2. Shah NS, Greenberg JA, McNulty MC et al. Bacterial and viral co‑infections complicating severe influenza: Incidence and impact among 507 U.S. patients, 2013–2014. J Clin Virol 2016; 80 : 12–19. Dostupné z DOI: <https://doi.org/10.1016/j.jcv.2016. 04. 008>.
3. Uyeki TM, Bernstein HH, Bradley JS, et al. Clinical Practice Guidelines by the Infectious Diseases Society of America: 2018 Update on Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management of Seasonal Influenzaa. Clin Infect Dis 2019; 68(6): e1–e47. Dostupné z DOI: <https://doi.org/10.1093/cid/ciy866>.
4. Zhou F, Yu T, Du R et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020; 395(10229): 1054–1062. Dostupné z DOI: <https://doi.org/10.1016/S0140-6736(20)30566-3>.
5. Arshad S, Kilgore P, Chaudhry ZS et al. Treatment with hydroxychloroquine, azithromycin, and combination in patients hospitalized with COVID-19. Int J Infect Dis 2020; 97 : 396 – 403. Dostupné z DOI: <https://doi.org/10.1016/j.ijid.2020. 06. 099>.
6. Chen J, Liu D, Liu L et al. [A pilot study of hydroxychloroquine in treatment of patients with moderate COVID-19]. Zhejiang Da Xue Xue Bao Yi Xue Ban 2020; 49(2): 215–219. Dostupné z DOI: <https://doi.org/10.3785/j.issn.1008-9292.2020. 03. 03>.
7. Gautret P, Lagier JC, Parola P et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open‑label non‑randomized clinical trial. Int J Antimicrob Agents 2020; 56(1): 105949. Dostupné z DOI: <https://doi.org/10.1016/j.ijantimicag.2020.105949>.
8. Yang X, Yu Y, Xu J et al. Clinical course and outcomes of critically ill patients with SARS‑CoV - 2 pneumonia in Wuhan, China: a single‑centered, retrospective, observational study. Lancet Respir Med. 2020; 8(5): 475–481. Dostupné z DOI: <https://doi.org/10.1016/S2213-2600(20)30079-5>.
9. Chen N, Zhou M, Dong X et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020; 395(10223): 507–513. Dostupné z DOI: < https://doi.org/10.1016/S0140-6736(20)30211-7>.
10. Nori P, Cowman K, Chen V, et al. Bacterial and fungal coinfections in COVID-19 patients hospitalized during the New York City pandemic surge. Infect Control Hosp Epidemiol 2021; 42(1): 84–88. Dostupné z DOI: <https://doi.org/10.1017/ice.2020.368>.
11. Lansbury L, Lim B, Baskaran V, Lim WS. Co‑infections in people with COVID-19: a systematic review and meta‑analysis. J Infect 2020; 81(2): 266–275. Dostupné z DOI: < https://doi.org/ 10.1016/j.jinf.2020. 05. 046>.
12. Vaughn VM, Gandhi T, Petty LA et al. Empiric Antibacterial Therapy and Community‑onset Bacterial Co‑infection in Patients Hospitalized with COVID-19: A Multi‑Hospital Cohort Study. Clin Infect Dis 2021; 72(10): e533–e541. Dostupné z DOI: < https://doi.org/10.1093/cid/ciaa1239>.
13. Buetti N, Mazzuchelli T, Lo Priore E et al. Early administered antibiotics do not impact mortality in critically ill patients with COVID-19. J Infect 2020; 81(2): e148–e149. Dostupné z DOI: <https://doi.org/10.1016/j.jinf.2020. 06. 004>.
14. Garcia‑Vidal C, Sanjuan G, Moreno‑García E et al. Incidence of co‑infections and superinfections in hospitalized patients with COVID-19: a retrospective cohort study. Clin Microbiol Infect 2021; 27(1): 83–88. Dostupné z DOI: < https://doi.org/10.1016/j.cmi.2020. 07. 041>.
15. Chedid M, Waked R, Haddad E et al. Antibiotics in treatment of COVID-19 complications: a review of frequency, indications, and efficacy. J Infect Public Health 2021; 14(5): 570–576. Dostupné z DOI: < https://doi.org/10.1016/j.jiph.2021. 02. 001>.
16. Wang D, Hu B, Hu C et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China. JAMA 2020; 323(11): 1061–1069. Dopstupné z DOI: <https://doi.org/10.1001/jama.2020.1585>.
17. Wang D, Yin Y, Hu C et al. Clinical course and outcome of 107 patients infected with the novel coronavirus, SARS‑CoV - 2, discharged from two hospitals in Wuhan, China. Crit Care 2020; 24(1): 188. Dostupné z DOI: < https://doi.org/10.1186/s13054-020-02895-6>.
18. Wang Z, Yang B, Li Q et al. Clinical Features of 69 Cases With Coronavirus Disease 2019 in Wuhan, China. Clin Infect Dis 2020; 71(15): 769–777. Dostupné z DOI: <https://doi.org/10.1093/cid/ciaa272>.
19. He Y, Li W, Wang Z, et al. Nosocomial infection among patients with COVID-19: a retrospective data analysis of 918 cases from a single center in Wuhan, China. Infect Control Hosp Epidemiol 2020; 41(8): 982–983. Dostupné z DOI: <https://doi.org/10.1017/ice.2020.126>.
20. Huang C, Wang Y, Li X et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395(10223): 497–506. Dostupné z DOI: <https://doi.org/10.1016/S0140-6736(20)30183-5>.
21. Chen G, Wu D, Guo W et al. Clinical and immunological features of severe and moderate coronavirus disease 2019. J Clin Invest 2020; 130(5): 2620–2629. Dostupné z DOI: <https://doi.org/10.1172/JCI137244>.
22. Chen T, Wu D, Chen H et al. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study. BMJ 2020; 368: m1295. Dostupné z DOI: <https://doi.org/10.1136/bmj.m1295>.
23. Chen H, Guo J, Wang C et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records Lancet 2020; 395 (10226): 809–815. Dostupné z DOI: <https://doi.org/10.1016/S0140-6736(20)30360-3>.
24. Xu XW, Wu XX, Jiang XG et al. Clinical findings in a group of patients infected with the 2019 novel coronavirus (SARS‑Cov - 2) outside of Wuhan, China: retrospective case series. BMJ 2020; 368: m606. Dostupné z DOI: <https://doi.org/10.1136/bmj.m606>.
25. Cao B, Wang Y, Wen D et al. A trial of Lopinavir–Ritonavir in adults hospitalized with severe Covid-19. N Engl J Med 2020; 382(19): 1787–1799. Dostupné z DOI: <https://doi.org/10.1056/NEJMoa2001282>.
26. Zhao XY, Xu XX, Yin HS et al. Clinical characteristics of patients with 2019 coronavirus disease in a non‑Wuhan area of Hubei Province, China: a retrospective study. BMC Infect Dis 2020; 20(1): 311. Dostupné z DOI: <https://doi.org/10.1186/s12879-020-05010-w>.
27. Borba MGS, Val FFA, Sampaio VS et al. Effect of high vs low doses of chloroquine diphosphate as adjunctive therapy for patients hospitalized with severe acute respiratory syndrome coronavirus 2 (SARS‑CoV - 2) infection: a randomized clinical trial. JAMA Netw Open 2020; 3(4): e208857. Dostupné z DOI: <https://doi.org/10.1001/jamanetworkopen.2020.8857>.
28. Pedersen HP, Hildebrandt T, Poulsen A, et al. Initial experiences from patients with COVID - 19 on ventilatory support in Denmark. Dan Med J 2020; 67(5): A04200232. PMID: 32351196.
29. Aggarwal S, Garcia‑Telles N, Aggarwal G et al. Clinical features, laboratory characteristics, and outcomes of patients hospitalized with coronavirus disease 2019 (COVID-19): Early report from the United States. Diagnosis 2020; 7(2): 91–96. Dostupné z DOI: <https://doi.org/10.1515/dx-2020-0046>.
30. Guan W, Ni Z, Hu Y et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med 2020; 382(18): 1708–1720. Dostupné z DOI: <https://doi.org/10.1056/NEJMoa2002032>.
31. Htoutou Sedláková M, Vojtová V, Hanulík V, et al. Rezistence enterobakterií k vybraným antibiotikům v souvislosti s jejich spotřebou. Klin Farmakol Farm 2012; 26(2): 61–66.
32. Urbanek K, Kolar M, Loveckova Y et al. Influence of 3rd generation cephalosporin utilization on the occurrence of ESBL‑positive Klebsiella pneumoniae strains. J Clin Pharm Ther 2007; 32(4): 403–408. Dostupné z DOI: <https://doi.org/10.1111/j.1365-2710.2007.00836.x>.
33. Kolar M, Urbanek K, Latal T. Antibiotic selective pressure and development of bacterial resistance. Int J Antimicrob Agents 2001; 17(5): 357–363. Dostupné z DOI: <https://doi.org/10.1016/s0924-8579(01)00317-x>.
34. Kim HS. Do an altered gut microbiota and an associated leaky gut affect COVID-19 severity? mBio 2021; 12 (1): e03022-20. Dostupné z DOI: <https://doi.org/10.1128/mBio.03022-20>.
35. Martin E, Philbin M, Hughes G et al. Antimicrobial stewardship challenges and innovative initiatives in the acute hospital setting during the COVID-19 pandemic. J Antimicrob Chemother 2021; 76(1): 272–275. Dostupné z DOI: <https://doi.org/10.1093/jac/dkaa400>.
36. Sieswerda E, De Boer MGJ, Bonten MM et al. Recommendations for antibacterial therapy in adults with COVID-19 – An evidence based guideline. Clin Microbiol Infect 2021; 27(1): 61–66. Dostupné z DOI: <https://doi.org/10.1016/j.cmi.2020. 09. 041>.
37. World Health Organization. COVID-19 Clinical management: living guidance. WHO. [cit. 2021-09-01]. Dostupné z WWW: <https://www.who.int/publications/i/item/WHO-2019-nCoV‑clinical-2021-1>.
38. National Institute for Health and Care Excellence. COVID-19 rapid guideline: managing COVID - 19. NICE. [cit. 2021-09-01]. Dostupné z WWW: <https://www.nice.org.uk/guidance/ng191>.
39. Cong W, Poudel AN, Alhusein N et al. Antimicrobial Use in COVID-19 Patients in the First Phase of the SARS‑CoV - 2 Pandemic: A Scoping Review. Antibiotics 2021; 10(6): 745. Dostupné z DOI: <https://doi.org/10.3390/antibiotics10060745>.
40. Liu C, Wen Y, Wan W et al. Clinical characteristics and antibiotics treatment in suspected bacterial infection patients with COVID-19. Int Immunopharmacol 2021; 90 : 107157. Dostupné z DOI: <https://doi.org/10.1016/j.intimp.2020.107157>.
41. Kolář M. Respirační infekce a jejich léčba. Maxdorf: Praha 2016. ISBN 978-80-7345-481-4.
42. Kolář M, Bardoň J, Rejman D. Zásady antibiotické léčby. VUP: Olomouc 2020. ISBN 978-80-244-5740-6.
43. Kolář M, Beneš J, Kolek V, et al. Klinický doporučený postup Nozokomiální pneumonie – antibiotická léčba. Národní portál klinických doporučených postupů [cit. 2021-09-01]. Dostupné z WWW: <https://kdp.uzis.cz>.
44. Torres A, Niederman M, Chastre J et al. International ERS/ESICM/ESCMID/ALAT guidelines for the management of hospital‑acquired pneumonia and ventilator‑associated pneumonia. Eur Respir J 2017; 50(3): 1700582. Dostupné z DOI: <https://doi.org/10.1183/13993003.00582-2017>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 8-
All articles in this issue
- Antibiotic treatment issues in patients with COVID-19
- Acute searching and early diagnosis of HCV infected persons
- Optimal potassium levels in patients with heart failure
- Unicentric Castleman’s disease. Symptoms, diagnostics and therapy
- SGLT2 inhibitors – a new pillar for the treatment of heart failure
- Renal parenchymal hypertension: relevant new aspects
- Bilateral multiple pneumatocele as a rare late complication of COVID-19 pneumonia
- What are the specifics of diabetic foot syndrome and why we need interdisciplinary recommendations for its diagnosis and treatment?
- Expert consensus on the importance of iron deficiency and the possibility of its correction in patients with heart failure
- Memorandum z jednání zástupců ČIS a ČPFS dne 6. 5. 2021 v Lékařském domě ČLS JEP v Praze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Renal parenchymal hypertension: relevant new aspects
- SGLT2 inhibitors – a new pillar for the treatment of heart failure
- Optimal potassium levels in patients with heart failure
- Antibiotic treatment issues in patients with COVID-19
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

