-
Medical journals
- Career
Mimostřevní komplikace idiopatických střevních zánětů
Authors: Vít Navrátil 1; Silvia Cveková 1; Peter Slodička 1; Květoslava Aiglová 1; Barbora Pipek 1,2,3; Přemysl Falt 1
Authors‘ workplace: II. interní klinika – gastroenterologická a geriatrická LF UP a FN Olomouc 1; Centrum péče o zažívací trakt, Nemocnice AGEL Ostrava Vítkovice, a. s. 2; Ostravská univerzita, Lékařská fakulta, Ostrava 3
Published in: Vnitř Lék 2021; 67(2): 92-96
Category: Main Topic
Overview
Idiopatické střevní záněty (IBD – inflammatory bowel disease) zahrnují Crohnovu chorobu (CN) a ulcerózní kolitidu (UC). Jedná se o chronická zánětlivá onemocnění trávicího traktu ne zcela známé etiologie. Vzhledem k jejich imunitně mediovanému mechanismu a komplexnímu působení na celý organismus mohou být různým způsobem postiženy i jiné orgány než jen gastrointestinální trakt. Tyto extraintestinální manifestace (EIM) a komplikace mohou závažným způsobem ovlivňovat prognózu pacienta, působit jeho morbiditu a snižovat kvalitu života. Zatímco klasické extraintestinální manifestace, jako jsou enteropatické artropatie, kožní či oční postižení nebo primární sklerozující cholangitida, sdílejí s IBD společný imunopatologický mechanismus, celá řada dalších chorobných stavů může vznikat na podkladě různých anatomických či metabolických abnormalit způsobených IBD či vlivem jejich léčby. Tato přehledová práce se zaměřuje na nejčastější mimostřevní komplikace, jako jsou anémie, metabolická kostní nemoc či biliární a nefrolitiáza, se kterými se setkáváme v běžné klinické praxi.
Klíčová slova:
anémie – idiopatické střevní záněty – litiáza – metabolická kostní nemoc – mimostřevní komplikace
Úvod
Idiopatické střevní záněty (inflammatory bowel disease, IBD) jsou chronická zánětlivá onemocnění neznámé etiologie, jejichž hlavními zástupci jsou Crohnova choroba (CD) a ulcerózní kolitida (UC). Vzhledem k jejich k imunitně mediovanému mechanismu mohou být zánětlivým procesem postiženy i jiné orgány než jen zažívací trakt. Tyto projevy, označované jako extraintestinální manifestace (EIM), sdílejí se základním onemocněním některé společné patofyziologické mechanismy (1). Projevy, které vznikají jiným mechanismem, označujeme jako mimostřevní komplikace. Ty se rozvíjí jako důsledek metabolických, anatomických či jiných změn v rámci IBD, popř. jako nežádoucí projev jejich léčby. Nicméně hranice mezi těmito pojmy je mnohdy tenká a je obtížné ji jednoznačně určit.
Výskyt EIM a mimostřevních komplikací bývá udáván v širokém procentuálním rozmezí 6–47 % ze všech IBD pacientů. Přibližně čtvrtina těchto nemocných pak trpí více než jednou EIM. Více než čtvrtina EIM se manifestuje ještě před stanovením diagnózy IBD. Riziko rozvoje EIM zvyšuje perianální forma CD, postižení tračníku a kouření (2).
Patofyziologie extraintestinálních komplikací IBD
Patofyziologie extraintestinálních projevů u IBD není zcela známa. Pravděpodobně se na ní podílí zánětlivá povaha základního onemocnění, zejména mohou mít vliv cirkulující komplexy antigen‑protilátka a produkce autoprotilátek (1), dále pak mikrobiální patogeny a faktory životního stylu, v neposlední řadě i faktory genetické. Mezi extraintestinální projevy IBD patří zejména postižení kloubů ve formě axiální a periferní spondylartropatie I. a II. typu, kožní projevy s typickými zástupci pyoderma gangrenosum, erythema nodosum, vzácněji pak Sweetův syndrom. Při očním postižení se nejčastěji setkáváme s episklerititou, konjunktivitidou a uveitidou. Nejznámějším zástupcem postižení jater je primární sklerozující cholangitida (3).
Mimostřevní komplikace mohou být samotným imunopatologickým procesem ovlivněny, jsou však na rozdíl od extraintestinálních projevů primárně vyvolány jinými mechanismy. Vznikají na podkladě anatomických či metabolických abnormalit způsobených IBD, popřípadě jako nežádoucí účinek jejich terapie (2). Anatomickými změnami jsou myšleny například stavy po resekcích, při kterých může docházet k malabsorpci důležitých látek, či vzniku píštělí, které vedou ke ztrátám iontů a podobně. Metabolickými abnormalitami rozumíme různé změny ve vnitřním prostředí, hladinách makro - i mikronutrientů, hormonů a dalších faktorů, které mohu vést k rozvoji chorobných změn a komplikací. Nejčastěji se setkáváme s anémií, metabolickou kostní nemocí, urolitiázou, tromboembolickou nemocí, cholecystolitiázou a nealkoholickou jaterní steatózou, vzácně s amyloidózou (Tab. 1).
Table 1. Mimostřevní projevy a komplikace IBD dle četnosti výskytu 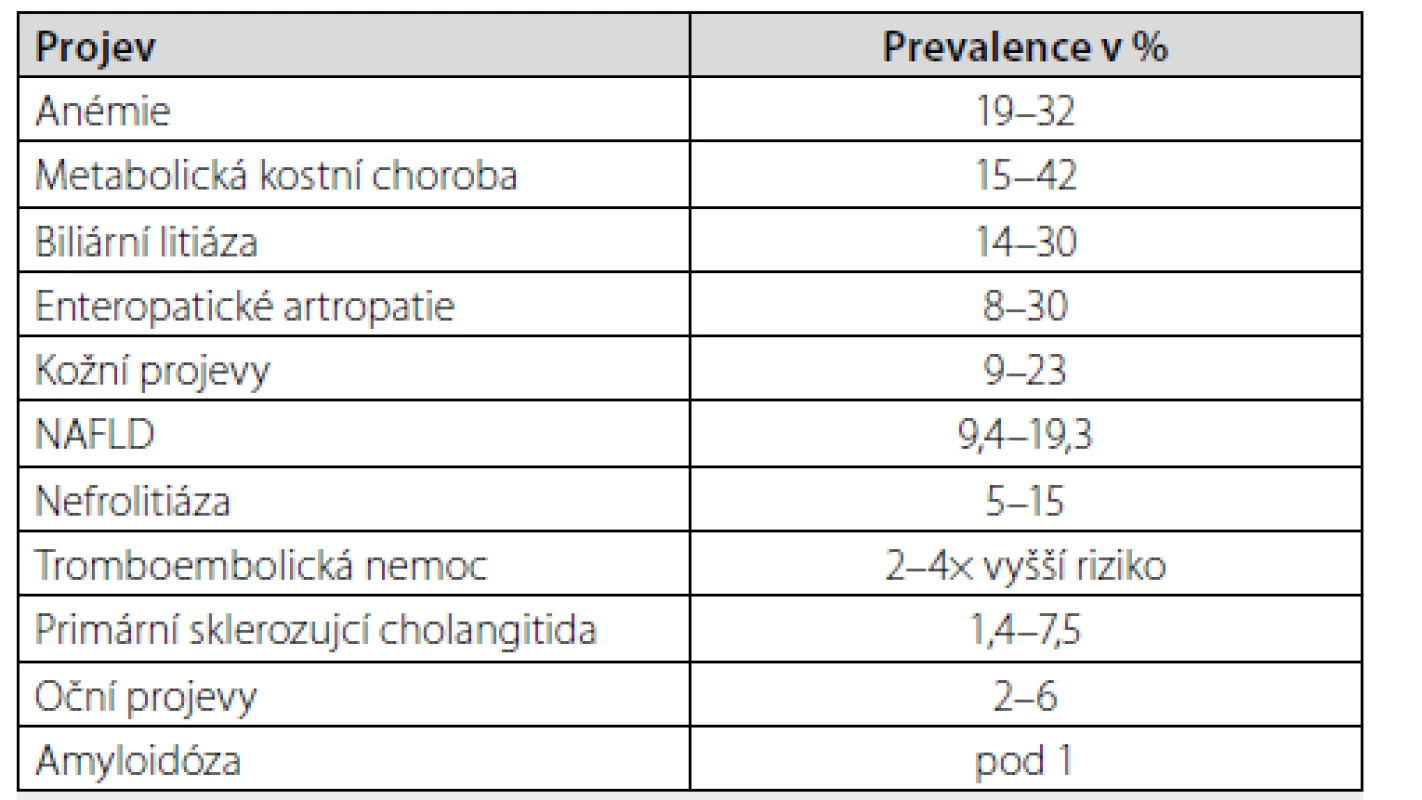
Upraveno dle Ott C, Schölmerich J. Extraintestinal manifestations and complications in IBD. Nat Rev Gastroenterol Hepatol 2013; 10: 585–595. Četné jsou i nežádoucí účinky léčby a infekční komplikace, které jsou zde zmíněny jen okrajově a jsou již nad rámec našeho sdělení.
Anémie
Prevalence anémie u IBD se v literatuře pohybuje mezi 6 a 74 % a jedná se o poměrně častou příčinu nespecifických a vleklých obtíží sužujících nemocné (4). Jejími primárními projevy jsou únava, nevýkonnost, slabost, dušnost či pocit palpitace. Intenzita klinické manifestace však dominantně závisí na rychlosti poklesu hemoglobinu a vzhledem k tomu, že u Crohnovy choroby či ulcerózní kolitidy je pokles pozvolný, je řada pacientů na tento stav postupně adaptována a typické klinické vyjádření u nich postrádáme.
Základními typy anémie jsou anémie sideropenická, chronických chorob či jejich kombinace. Ostatní typy anémií se vyskytují vzácněji. Jedná se o makrocytární anémii z nedostatku vitaminu B12 a kyseliny listové, kterou typicky nacházíme u nemocných po ileokolické resekci nebo při syndromu bakteriálního přerůstání. S polékovou anémií se setkáváme nejčastěji při terapii thiopuriny či methotrexátem.
Základním patofyziologickým rysem u sideropenické anémie je porucha resorpce železa při chronickém zánětlivém procesu (nebo při deficitu resorpční plochy po resekcích), při které dochází zvýšením hladiny hepcidinu k poruše transportu železa z enterocytů a z makrofágů. Železo tudíž není k dispozici pro krvetvorbu, je snížená hladina erytropoetinu a je zkrácená doba přežívání erytrocytů. Na vzniku sideropenie se mohou podílet i chronické ztráty do GIT, např. krvácením při aktivní kolitidě. Prevalence samotné sideropenie je udávána mezi 36 a 90 % (4). U anémie chronických chorob sehrává svou roli samotný zánět a jeho mediátory, které spolu vedou k poruše metabolismu železa a indukují poruchu erytropoézy.
Terapie spočívá v úpravě vyvolávající příčiny, tedy v léčbě IBD, úpravě sideropenie preparáty železa (Tab. 2) či substituci vitaminu B12 či foláty, ev. změně léčby při polékové anémii. Při výrazné anémii s vyjádřeným anemickým syndromem je možná i terapie krevními převody (4).
Table 2. Terapie sideropenické anémie 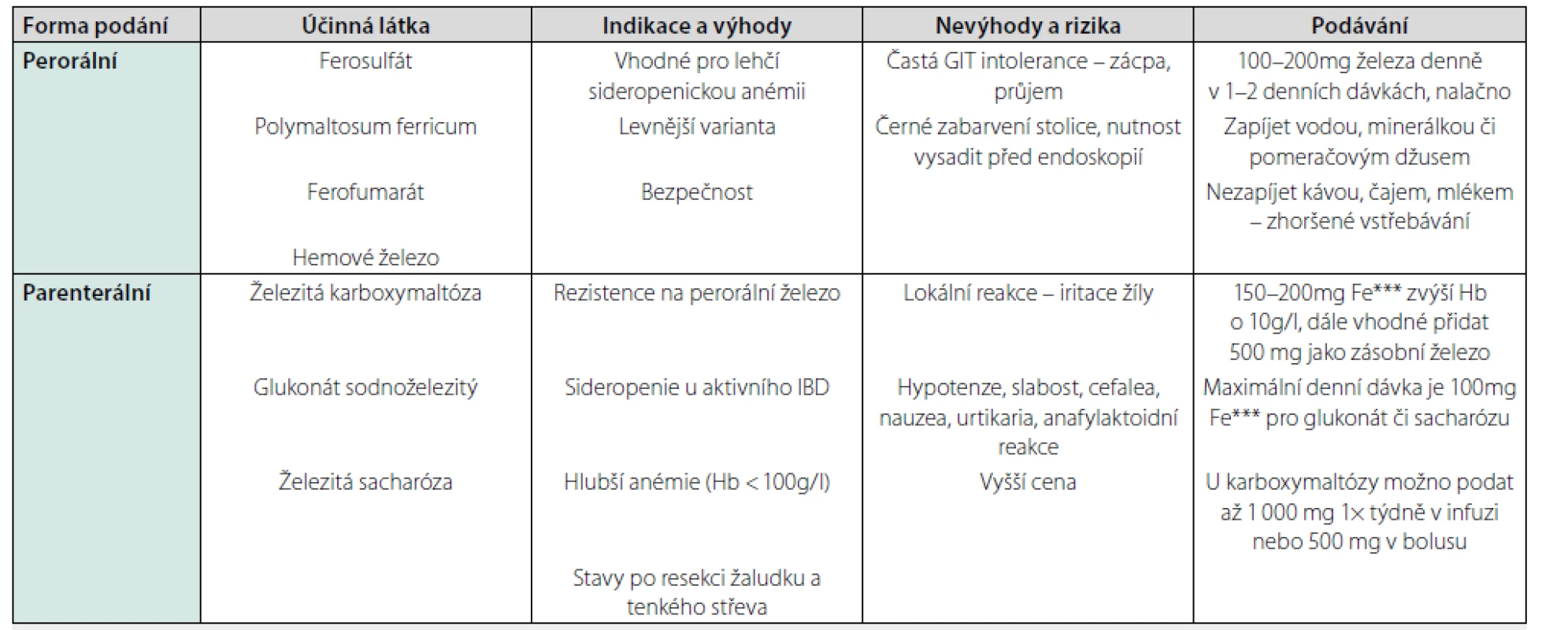
Upraveno dle Čermák J. Léčba anémie a nedostatku železa z pohledu hematologa. Kardiol Rev Int Med 2014, 16(5): 359–363.
Hrdlička L, Kohout P, Liberda M, et al. Doporučený postup pro diagnostiku a léčbu anémie u IBD. Gastroent Hepatol 2012; 66(4): 280–285.Metabolická kostní nemoc
Sekundární osteoporóza je spojena s vysokou mírou morbidity a je rizikovým faktorem pro vznik zlomenin. U pacientů s IBD je pozorován zvýšený výskyt osteopenie a osteoporózy s prevalencí 18–42 % (5). Její etiologie je multifaktoriální a zahrnuje především terapii kortikosteroidy, malabsorpci po chirurgických výkonech nebo při rozsáhlém postižení střevní sliznice, méně často se uplatňuje hypogonadismus, genetické faktory a nesprávná životospráva. Negativní vliv na kostní tkáň má i samotná zánětlivá složka onemocnění vedoucí k cytokinové dysbalanci, která negativně ovlivňuje osteogenezi a osteoblastickou aktivitu (5). Na rozvoj metabolických kostních nemocí má vliv i karence vitaminů a stopových prvků. Vitamin K je důležitý kofaktor karboxylace kostních sialoproteinů. U pacientů s IBD léčených širokospektrálními antibiotiky, jako je metronidazol a ciprofloxacin, dochází k redukci přirozené střevní mikroflóry, která produkuje 60 % vitaminu K, co vede k jeho deficitu (7). Další faktor vzniku osteoporózy je deficit vápníku a vitaminu D. Resekční výkony na tenkém střevě mohou vést k steatorei. Již odstranění 6 cm terminálního ilea má vliv na vstřebávání žlučových solí a trávení tuků (8). Malabsorpce vápníku, fosforu a hořčíku se také rozvíjí při současném postižení ledvin, která souvisí s poruchou sekundární hydroxylace vitaminu D. U 15 % pacientů je popisována asociace s laktózovou intolerancí, kdy pro následné vyloučení mléčných výrobků dochází k významnému snížení přísunu vápníku (8).
Hustota kostního minerálu se hodnotí denzitometrií (DXA) a její provedení je indikováno, pokud u pacienta zaznamenáme víc než 2 rizikové faktory z následujících: věk nad 70 let, BMI pod 20, léčba steroidy a/nebo přetrvávající aktivita onemocnění (5). Samotné glukokortikoidy zvyšují dvojnásobně riziko fraktur krčku stehenní kosti a 4,5násobně riziko vertebrálních fraktur. Riziko osteoporózy narůstá s velikostí dávky a délkou terapie. Po půl roce medikace dosahuje riziko osteoporózy až na 50 %. Proto se doporučuje provedení DXA na počátku a po půl roce léčby (5).
Terapie zahrnuje kombinaci základních preventivních opatření: přestat kouřit, nepít alkoholické nebo slazené nápoje, adekvátní po - hybová aktivita (6). Dále se doporučuje minimalizovat terapii steroidy a při jejich nasazení substituce vitaminem D 400–800 IU/d) a kalciem (1000 mg/den). Je vhodné suplementovat mikronutrienty selen a zinek. V recentních studiích se uvádí příznivý efekt vitaminu K2 na aktivaci proteinů a pro jeho antioxidační účinky (6).
Onemocnění ledvin a močových cest
Choroby ledvin a močových cest se jako projev či komplikace základního onemocnění vyskytují u 4–23 % pacientů s IBD (9). Na jejich vzniku se podílí celá řada mechanismů, zejména aktivita střevního zánětu cestou společného imunopatologického mechanismu, vliv genetických faktorů a systémové dysregulace imunitního systému, která může vést k rozvoji dalších, na IBD nezávislých, autoimunitních onemocnění, dále ukládání cirkulujících imunokomplexů s rizikem rozvoje glomerulonefritid či tubulointersticiálních nefritid (TIN) a v neposlední řadě též chorobné procesy na podkladě metabolických či anatomických změn vzniklých v důsledku choroby samotné či její léčby. Močový systém může být postižen v kterékoli etáži, nejčastěji však v oblasti ledvin. Zde se vyskytuje onemocnění kalichopánvičkového systému (nejčastěji při litiáze) a parenchymu (změny tubulointerstiální i glomerulů) (10). Riziko morbidity a ev. i mortality při renálních chorobách u IBD pacientů není zanedbatelné, je tedy vhodné pravidelné sledování renálních funkcí, popřípadě provedení sonografického vyšetření ledvin. V případě přetrvávající renální insuficience, proteinurie či hematurie, a to i po vysazení nefrotoxické léčby, by měla být zvážena biopsie ledvin (9).
Urolitiáza, zejména nefrolitiáza, je nejčastější komplikací IBD v močovém systému. Prevalence litiázy u IBD pacientů je 12–28 %, vyšší je zejména u pacientů po rozsáhlejších střevních resekcích a u pacientů s Crohnovou chorobou (11). Recidivy litiázy jsou velmi časté, za 10 let se vyskytují u 50–80 % případů (10) a mohou vést k rozvoji chronické renální insuficience. Tvorba litiázy je podmíněna kombinací několika faktorů. Jedná se o zvýšenou koncentraci lithogenních substancí v moči, vhodné fyzikální a chemické podmínky, např. pH moči a přítomnost urátových krystalů jako krystalizačních jader a snížení účinnosti antilithogenních mechanismů, např. snížená hladina magnezia či citrátů v moči (12). Ledvinové kameny u IBD pacientů se nejčastěji skládají z oxalátu vápenatého, běžná je i litiáza urátová, jiné složení, jako např. u dětských pacientů obvyklejší kalcium‑fosfátová litiáza či příměs buněčného detritu, je méně časté. Oxalátová litiáza je typická pro pacienty s CD s ileokolickým postižením a po ileokolické resekci, u kterých dochází k malabsorpci žlučových a mastných kyselin. Změny střevního mikrobiomu jsou provázeny zvýšením střevní permeability a snížením počtu oxaláty metabolizujících bakterií, jako např. Oxalobacter formingens. Tento stav vede ke zvýšené resorpci oxalátů ze střeva s následnou hyperoxalurií. V kombinaci s nižším obsahem moči při ztrátách tekutin a při ztrátách magnezia při průjmech je dosaženo vhodných podmínek pro tvorbu litiázy (9).
Prevence urolitiázy se odvíjí od typu konkrementů a vyvolávajících vlivů. Oxalátová litiáza vyžaduje adekvátní léčbu IBD, úpravu dietních návyků s redukcí přijmu oxalátů a tuku a ev. zvýšení příjmu vápníku a citrátů. U pacientů s postižením ilea je možné i použití cholestyraminu. U kalciových kamenů je třeba pátrat po případné hyperparathyreóze, vzácnější příčinou může být sarkoidóza, kostní metastázy atd. Při urátových kamenech je třeba korigovat hyperurikosurii, a to dietou, ev. v kombinaci s alopurinolem. Zvýšenou hladinu kyseliny močové v moči je třeba vyloučit i u jiných typů litiázy, neboť její krystalky mohou sloužit jako krystalizační jádra usnadňující lithogenezi (10). Kameny struvitové vznikají při infekcích močových cest, základem prevence je tedy důsledná prevence těchto infekcí a urologická dispenzarizace.
Tromboembolická nemoc
IBD jsou chronická zánětlivá onemocnění s potenciálním hyperkoagulačním stavem a vyšším výskytem systémových tromboembolických příhod než v běžné populaci. Příčiny jsou rozmanité. Patří mezi ně získané protrombotické faktory, jako je zánět, imobilizace, rozsah onemocnění tlustého střeva, chirurgický zákrok, centrální venózní katétry, kortikosteroidy a kouření (13). Na druhé straně mohou být tromboembolické komplikace u IBD spojeny s koagulačními abnormalitami, zejména zvýšeným počtem krevních destiček a hladiny faktorů V a VIII a hladiny fibrinogenu a se sníženou hladinou antitrombinu III, což může zvýšit riziko trombózy (14).
Venózní tromboembolismus je častější než arteriální a u většiny pacientů s IBD nebyl jednoznačně prokázán predisponující faktor vzniku trombózy jiný než samotné IBD (15). Riziková je léčba systémovými kortikosteroidy a je doporučeno všem hospitalizovaným pacientům s IBD podávat preventivní dávku nízkomolekulárního heparinu pro tromboprofylaxi (15).
Cholecystolitiáza
Také cholecystolitiáza se častěji vyskytuje u pacientů s IBD (asi 10 %) než v běžné populaci (7 %). Převážně jsou postiženi pacienti s CD (při postižení střeva v ileokolické lokalizaci). Rizikovými faktory jsou ženské pohlaví, vyšší věk a předchozí operační výkony (hlavně ileocékální resekce). Mezi hlavní patofyziologické pochody vzniku litiázy patří malabsorpce a deplece žlučových kyselin v ileu, kdy dochází k poruše enterohepatální cirkulace žluči způsobené zánětem nebo ileostomií, což může jedince předurčovat k rozvoji cholesterolových litů (16). Dále neabsorbované žlučové kyseliny solubilizují bilirubin v tlustém střevě, což zvyšuje riziko tvorby pigmentových kamenů, dysmikrobióza a dysmotilita žlučníku pacientů s IBD může vést k dysmetabolismu žlučových kyselin, a tím zvýšit riziko vzniku cholelitiázy (17). Cholecystolitiáza u pacientů s IBD je ve většině případů asymptomatická, nicméně je zde vyšší riziko jejího komplikovaného průběhu (18). Primární prevencí je minimalizace počtu relapsů a hospitalizací, redukce parenterální výživy, která se může podílet na vzniku sludge žlučníku (19). V případě asymptomatického nálezu kamenů žlučníku není terapie potřebná. Při vzniku cholecystitidy nebo jiných komplikací je indikovaná cholecystektomie.
Nealkoholická jaterní steatóza
Mezi nejčastější jaterní komplikace patří nealkoholická steatóza jater (NAFLD, Non‑Alcoholic Fatty Liver Disease). Vyskytuje se u pacientů s IBD s prevalencí do 50 % (20). Je charakterizována steatotickým postižením jaterního parenchymu. Konečné potvrzení diagnózy je na základě zobrazovací metody (ultrasonografie břicha, fibroscan) nebo biopsie. Důležité je vyloučení sekundárního postižení např. alkoholem a léky. Rizikové faktory pro její vznik jsou obezita, inzulinová rezistence, diabetes a hypertriglyceridemie. Její etiologie u IBD není zcela objasněna. Kromě metabolického syndromu přispívají k patogenezi onemocněni, specifické rizikové faktory IBD, jako chronická a dlouhotrvající malnutrice, aktivita střevního zánětu, změny střevní mikrobioty, expozice steroidům a hepatotoxickým lékům (18). Pacienti s pozdní manifestací a dlouhým trváním IBD měli vyšší riziko vzniku NAFLD. Steatóza jater může časem progredovat do fibrózy, a nakonec do cirhózy. Základem terapie je adekvátní léčba IBD s navozením remise, režimová opatření. Při steatohepatitidě je možno použít vitamin E, kyselinu ursodeoxycholovou nebo obeticholovou při rezistenci na léčbu.
Amyloidóza (AA sekundární amyloidóza)
Amyloidóza je patologickým stavem, při kterém dochází ke změně struktury proteinů, které se následně hromadí zejména v extracelulárních prostorech orgánů.
Tradiční klasifikace rozlišuje primární amyloidózou, která probíhá v kontextu monoklonální gamapatie, produkující lehké řetězce imunoglobulinu a sekundární amyloidózu AA, která vzniká jako komplikace chronických zánětlivých onemocnění. Dochází k depozici amyloidových fibril odvozených od sérového amyloidového proteinu A (SAA) (21). Daný reaktivní protein vzniká v důsledku chronického zánětlivého nebo infekčního onemocnění. Crohnova choroba je čtvrtou nejčastější příčinou sekundární amyloidózy po revmatoidní artritidě, juvenilní revmatoidní artritidě a ankylozující spondylitidě. Její výskyt je méně než 1 % pacientů, častější při CD jako u UC (0,9–3 % proti 0,07 %) (22). Výskyt amyloidózy je 4,4× častější při postižení tlustého střeva. Dle recentních studií se zdá, že není korelace mezi extraintestinálními projevy a vznikem amyloidózy. Nejčastějším místem ukládání fibril SAA jsou ledviny a srdce.
Jaterní amyloidóza je vzácné onemocnění, které se může projevovat asymptomatickou hepatomegalií s negativním laboratorním nálezem. Vyskytuje se u pacientů s CD v 0,9 procentech. K diagnóze je nutná biopsie jater a její léčba je kontrola základního onemocnění. Tím se snižuje uvolňování sérového amyloidu A v reaktivní fázi. Dále k terapie možno použít kolchicin, budesonid a infliximab. Domníváme, že tím dochází nejen k snížení syntézy prekurzorů, ale i depozit amyloidu (18).
Amyloidóza ledvin způsobuje renální insuficienci s proteinurií, mnohdy až s nefrotickým syndromem. Terapie spočívá v kontrole základního zánětlivého procesu, používají se i imunosupresiva a biologika, nicméně jejich účinnost není zatím spolehlivě prokázána. V případě progrese do terminálního renálního selhání, ke kterému dochází až v 68 % případů, je nutná náhrada funkce ledvin, ideálně transplantace. Riziko rekurence amyloidózy ve štěpu pravděpodobně není vysoké (23).
Závěr
Idiopatické střevní záněty jsou chronická zánětlivá onemocnění postihující primárně gastrointestinální trakt, mají ale dopad na celý organismus a mimostřevní manifestace a komplikace jsou toho důkazem. Mnoho z nich sdílí společné patofyziologické mechanismy s IBD a souvisí s jejich aktivitou, nicméně další jsou na aktivitě nezávislé, vznikají následkem anatomických či metabolických změn chorobou způsobených, popř. se jedná o komplikace léčby. Základem léčby je nejen dostatečná terapie IBD, u mimostřevních komplikací je často nutný multioborový přístup. Vzhledem k tomu, že mnohdy mohou mít mimostřevní projevy zásadnější vliv na morbiditu pacienta než samotné IBD, je nutné na ně pomýšlet, včas je rozpoznat a adekvátně léčit.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Barbora Pipek
II. interní klinika – gastroenterologická a geriatrická, LF UP a FN Olomouc
I. P. Pavlova 185/6
779 00 Olomouc
Cit. zkr: Vnitř Lék 2021; 67(2): 92–96
Článek přijat redakcí: 6. 12. 2020
Článek přijat po recenzích: 7. 3. 2021
Sources
1. Ferreira SDC, Oliveira BBMD, Morsoletto AM et al. Extraintestinal manifestations of inflammatory bowel disease: Clinical aspects and pathogenesis. J Gastroenterol Dig Dis 2018; 3(1): 4–11.
2. Vavricka SR, Schoepfer A, Scharl M et al. Extraintestinal Manifestations of Inflammatory Bowel Disease. Inflamm Bowel Dis 2015; 21(8): 1982–1992.
3. Zbořil V a kol. Idiopatické střevní záněty. Praha: Mladá fronta, 2018.
4. Hrdlička L, Kohout P, Liberda M et al. Doporučený postup pro diagnostiku a léčbu anémie u IBD. Gastroent Hepatol 2012; 66(4): 280–285.
5. Harpavat M, Keljo DJ, Regueiro MD. Metabolic bone disease in inflammatory bowel disease. J Clin Gastroenterol. 2004 Mar; 38(3): 218–224.
6. Fojtík P, Urban O, Falt P, Novosad P. Výživa a sekundární osteoporóza, Interní Med. 2009; 11(12): 561–568.
7. Conly JM, Stein K, Worobetz L et al. The contribution of vitamin K2 (menaquinones), produced by the intestinal microflora to human nutritional requirements for vitamin K. Am J Gastroenterol 1994; 89 : 915–923.
8. Buchman, A. Metabolic Bone Disease and Inflammatory Bowel Disease, American Journal of Gastroenterology: June 2007 – Volume 102 - Issue - p 49-55.
9. Ambruzs JM, Larsen CP. Renal Manifestations of Inflammatory Bowel Disease. Rheum Dis Clin North Am 2018; 44(4): 699–714.
10. Teplan V, Honsová E, Lukáš M Renální onemocnění pacientů s idiopatickými střevními záněty. Gastroent Hepatol 2020; 74(3): 256–266.
11. Corica D, Romano C. Renal Involvement in Inflammatory Bowel Diseases. J Crohns Colitis 2016; 10(2): 226–235.
12. Katsanos K, Tsianos EV. The kidneys in inflammatory bowel disease. Ann Gastroenterol 2002; 15(1): 41–52.
13. Maconi G, Bolzacchini E, Dell‘Era A et al. Portal vein thrombosis in inflammatory bowel diseases: A single ‑ center case series, Journal of Crohn’s and Colitis, 2012; 6(3): 362–367.
14. Sinagra E, Aragona E, Romano C et. al. The Role of Portal Vein Thrombosis in the Clinical Course of Inflammatory Bowel Diseases: Report on Three Cases and Review of the Literature, Gastroenterology Research and Practice, 2012, 7 pages.
15. Rothfuss KS, Stange EF, Herrlinger KR. Extraintestinal manifestations and complications in inflammatory bowel diseases. World J Gastroenterol. 2006; 12(30): 4819–4831.
16. Chen CH, Lin CL, Kao CH. Association between Inflammatory Bowel Disease and Cholelithiasis: A Nationwide Population‑Based Cohort Study. Int J Environ Res Public Health. 2018 Mar 14; 15(3): 513.
17. Duboc H, Rajca S, Rainteau D et al. Connecting dysbiosis, bile‑acid dysmetabolism and gut inflammation in inflammatory bowel diseases. Gut. 2013; 62 : 531–539.
18. Fousekis FS, Theopistos VI, Katsanos KH et al. Hepatobiliary Manifestations and Complications in Inflammatory Bowel Disease: A Review. Gastroenterology Res. 2018; 11(2): 83–94.
19. Sturdik I, Krajcovicova A, Jalali Y et al. Pathophysiology and Risk Factors for Cholelithiasis in Patients with Crohn’s Disease, Physiol. 68 (2): S173–S1821.
20. Bessissow T, Le NH, Rollet K, et al. Incidence and Predictors of Nonalcoholic Fatty Liver Disease by Serum Biomarkers in Patients with Inflammatory Bowel Disease. Inflamm Bowel, DiS. 2016; 22 (8): 1937–1944.
21. Obici L, Merlini G. Amyloidosis in autoinflammatory syndromes. Autoimmun Rev., 2012; 12(1): 14–17.
22. Sharma P, Aguilar R, Siddiqui OA et al. Secondary systemic amyloidosis in inflammatory bowel disease: a nationwide analysis. Ann Gastroenterol. 2017; 30(5): 504–511.
23. Sattianayagam PT, Gillmore JD, Pinney JH et al. Inflammatory bowel disease and systemic AA amyloidosis. Dig Dis Sci 2013; 58(6): 1689–1697.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 2-
All articles in this issue
- Imonoglobulin G4 asociované onemocnění v gastroenterologii
- Diagnostika a terapie chronické pankreatitidy dle UEG guidelines
- Mimostřevní komplikace idiopatických střevních zánětů
- Aktuální pohled na možnosti diagnostiky a léčby diabetu typu LADA
- Glukagon v léčbě hypoglykemie – novinky
- Hemodynamicky významný perikardiální výpotek jako možný vzácný mimostřevní projev Crohnovy choroby
- Masivní plicní embolie s rozsáhlým trombem ve foramen ovale patens – hrozící paradoxní embolie
- Perindopril – dlouholetá jistota v léčbě hypertenze
- Hlavní téma: gastroenterologie
-
Jak prodloužit životy našich pacientů ve zdraví?
A lze to?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika a terapie chronické pankreatitidy dle UEG guidelines
- Glukagon v léčbě hypoglykemie – novinky
- Perindopril – dlouholetá jistota v léčbě hypertenze
- Mimostřevní komplikace idiopatických střevních zánětů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

