-
Medical journals
- Career
Aktuální pohled na možnosti diagnostiky a léčby diabetu typu LADA
Authors: Jana Urbanová 1; Ludmila Brunerová 1; Jana Malinovská 2; Barbora Pelechová 2; Ludmila Koberová 2; Jan Brož 2
Authors‘ workplace: Centrum pro výzkum diabetu, metabolismu a výživy, II. interní klinika 3. LF UK a FNKV Praha 1; Interní klinika FN v Motole a 2. LF UK, Praha 2
Published in: Vnitř Lék 2021; 67(2): 97-102
Category:
Overview
LADA (Latent Autoimmune Diabetes in Adults) je typ autoimunitního diabetu vznikající v dospělém věku. V porovnání s diabetes mellitus 1. typu je LADA charakterizován nižší intenzitou autoimunitního procesu, pozvolnějším rozvojem a progresí a spíše mírnou hyperglykemií v době manifestace. Objevuje se v dospělém věku (> 30 let), pacienti jsou obvykle bez výrazněji vyjádřených známek metabolického syndromu, inzulinové rezistence či obezity. Přesto, zejména je ‑ li diagnostikován ve vyšším věku, může být mylně klasifikován jako diabetes mellitus 2. typu, a to i proto, že ho lze většinou úspěšně léčit neinzulinovými antidiabetiky po dobu nejméně 6 měsíců od diagnostiky. V léčbě LADA je doporučena časná iniciace inzulinoterapie, u pacientů s výraznější inzulinovou rezistencí v kombinaci s metforminem. Klinické studie naznačují také efektivitu preparátů umožňujících prodloužení životnosti reziduálních β‑buněk, např. inkretinů.
Klíčová slova:
diabetes mellitus – diagnostika – GADA – LADA – léčba
Úvod
LADA (Latent Autoimmune Diabetes in Adults) představuje klinicky heterogenní onemocnění s variabilní úrovní autoimunitní destrukce β‑buněk, různorodou přítomností specifických ostrůvkových autoprotilátek a různým stupněm inzulinové rezistence (1). Sdílí tak řadu klinických a metabolických znaků jak s diabetes mellitus 1. typu (DM1T), tak s diabetes mellitus 2. typu (DM2T) (1). Odlišení LADA od těchto dvou základních typů diabetes mellitus, včetně specifického typu diabetu vznikajícího v časné dospělosti – MODY (Maturity‑Onset Diabetes of the Young) (2, 3), je v klinické praxi podstatné zejména pro možnost lepší predikce průběhu a prognózy choroby a přesnější individualizace léčby. LADA však bývá mylně zaměněn nejčastěji za DM2T, zejména manifestuje‑li se v pozdějším věku a následně je pak i léčen perorálními antidiabetiky, přestože za optimálnější léčbu je obecně považováno časné nasazení inzulinu, jež zároveň prodlužuje životnost reziduálních β‑buněk (4).
V tomto článku shrnujeme současné diagnostické postupy a terapeutické možnosti spojené s diabetem typu LADA.
LADA
Definice
Jednotná definice LADA dosud neexistuje a její přesné znění zůstává předmětem diskuzí. Diagnóza se však nejčastěji opírá o splnění následujících tří kritérií: a) věk v době vzniku diabetu nad 30 (až 35) let, b) přítomnost alespoň jedné ze specifických ostrůvkových autoprotilátek (např. proti dekarboxyláze kyseliny glutamové – GADA, proti tyrozinové fosfatáze 2 – IA2A, proti zinkovému transportéru typu 8 – ZnT8A), a c) možnost úspěšné neinzulinové léčby alespoň šest (až dvanáct) měsíců od diagnostiky (1, 4).
Epidemiologie
Aktuálně se odhaduje, že LADA může být příčinou diabetu u 2–12 % dospělých diabetiků (5). Výsledky epidemiologických studií sledujících frekvenci výskytu LADA mezi pacienty s ostatními typy diabetu se liší mezi jednotlivými zeměmi a populacemi, pravděpodobně i vlivem odlišného studijního designu a vstupních kritérií (1, 6). V multicentrických studiích provedených v Evropě, Asii a Severní Americe bylo zjištěno, že 4 % až 14 % pacientů s diagnózou DM2T má přítomné ostrůvkové autoprotilátky asociované s DM1T (1). Výskyt LADA se zdá být častější v Evropě než v jiných oblastech světa, včetně Asie (4). Evropská multicentrická studie hodnotící 6 000 pacientů se vznikem diabetu v dospělém věku nalezla celkovou frekvenci ostrůvkových autoprotilátek u 9,7 % jedinců s DM2T, s rozdíly mezi pacienty žijícími v severní a jižní Evropě pohybujícími se mezi 4 a 10 % (1, 7), kdy prevalence LADA mezi pacienty s DM2T je nejvyšší v severských zemích, zatímco v Itálii nejnižší (7). Data z ČR dosud k dispozici nejsou. Multicentrická studie provedená v Číně prokázala přítomnost ostrůvkových autoprotilátek u 5,9 % dospělých diabetiků 2. typu (8).
Mezi etniky byla prokázána vyšší prevalence u kavkazského etnika než u Afroameričanů, Hispánců či Arabů (1, 2).
Etiopatogeneze
Doposud provedené studie jasně prokazují podobnost genetického pozadí mezi LADA a DM1T v rámci vysoce rizikových variant v HLA oblasti. Zároveň studie sledující vliv faktorů životního prostředí poukazují na to, že LADA a DM2T mají společných několik (environmentálních) rizikových faktorů ovlivňujících inzulinovou senzitivitu, jako je nadváha, fyzická inaktivita, kouření a protektivní vliv umírněné konzumace alkoholu. Z tohoto lze vyvodit, že klíčovou roli v patogenezi LADA mohou hrát jak inzulinová rezistence, tak i inzulinová deficience (způsobená autoimunitní destrukcí β‑buněk). Na základě současných znalostí je možné usuzovat, že v prvním kroku dochází k rozvoji (geneticky spuštěné) autoimunity, která pomalu (během několika let) ničí β‑buňky a omezuje produkci inzulinu; ve druhém kroku expozice nezdravých faktorů životního stylu vede k inzulinové rezistenci a zvýšeným nárokům na inzulinovou sekreci. Jakmile β‑buňky nejsou schopny vyhovět zvýšeným nárokům na sekreci inzulinu, dochází k vzestupu glykemie a manifestaci diabetu – LADA (4).
Table 1. Základní charakteristiky LADA, DM1T a DM2T 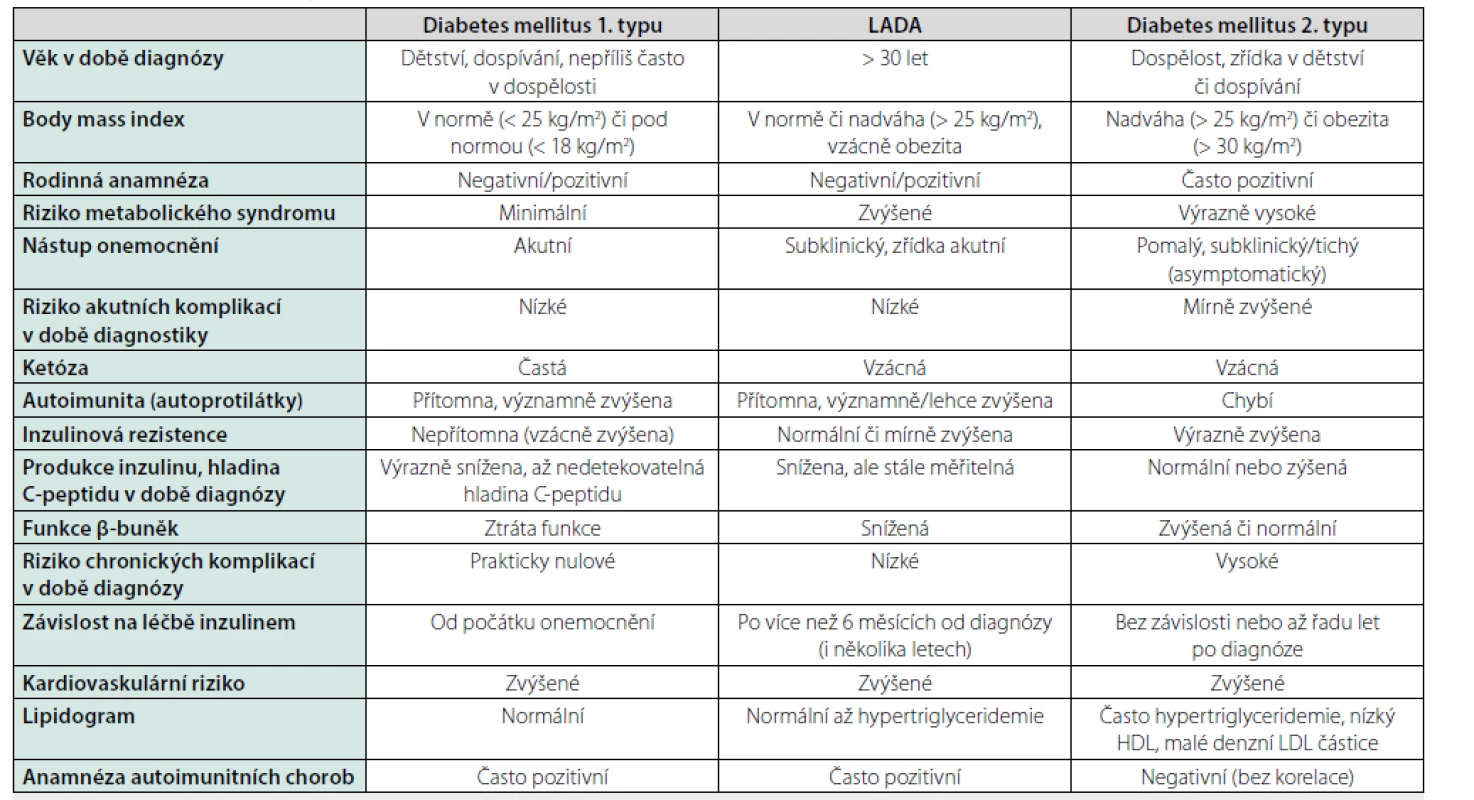
Upraveno podle (1,6): Pozzilli P, Pieralice S. Latent Autoimmune Diabetes in Adults: Current Status and New Horizons. Endocrinol Metab (Seoul). 2018; 33(2): 147–159. Buzzetti R, Zampetti S, Maddaloni E. Adult-onset autoimmune diabetes: current knowledge and implications for management. Nat Rev Endocrinol. 2017; 13(11): 674–686. Klinické charakteristiky
LADA je charakteristický velkou fenotypovou heterogenitou, spojenou s různými stupni přítomné β‑buněčné dysfunkce a inzulinové rezistence. V závislosti na závažnosti imunitní a metabolické dysfunkce tak LADA sdílí v různé míře některé klinické a metabolické znaky jak s DM1T, tak i s DM2T (1). LADA má podobně jako DM2T pozvolný nástup, manifestuje se obvykle mírnou hyperglykemií (bez ketoacidózy) u dospělých pacientů (typicky starších 30 let), kteří mají podobně jako diabetici 1. typu normální (ale i do pásma nadváhy zvýšený) BMI, obvykle bez markantněji vyjádřených známek metabolického syndromu (6). Metabolický syndrom a jeho komponenty (arteriální hypertenze, dyslipidemie, zvýšený poměr pas‑boky) je u pacientů s LADA méně častý než u diabetiků 2. typu (jak kavkazského, tak nekavkazského původu), nicméně častější než u klasických pacientů s DM1T (1). Inzulinová rezistence nebývá u LADA tak vyjádřená jako u DM2T, zřejmě v souvislosti s rozdílným BMI (4), resp. mírou abdominální obezity.
Přítomnost autoprotilátek proti ostrůvkovým antigenům
Stejně jako u DM1T mohou být i u LADA pozitivní všechny ostrůvkové autoprotilátky. Zdaleka nejčastěji (90 % případů) jsou však přítomny GADA, typické pro autoimunitní diabetes vznikající v dospělosti, zbývající (10 %), tedy IA2A a ZnT8A, bývají pozitivní jen u malého procenta pacientů (4, 9), jelikož jejich výskyt je častější mezi dětskou populací (4). V jedné ze studií mělo z testovaných pacientů s LADA 68,6 % pozitivní pouze GADA, 5 % pouze IA2A a 2,3 % pozitivní jen ZnT8A, alespoň 2 protilátky byly přítomny u 24,1 % pacientů (7). Studie provedená v České republice (n = 59) zjistila, že u většiny vyšetřených pacientů s LADA nejsou ZnT8A přítomny (10).
Z klinického pohledu je důležité, že titr ostrůvkových autoprotilátek (zejména GADA) koreluje s klinickým obrazem LADA (1). Pacienti s vysokou hladinou GADA mají v porovnání s jedinci s nízkým titrem těchto autoprotilátek v době diagnózy nižší věk a podobné charakteristiky jako pacienti s DM1T, tj. výraznější znaky inzulinové deficience a těžší autoimunity (nižší hladinu C‑peptidu, náchylnost ke ketóze, vyšší riziko progrese do inzulindependence a prevalenci IA2A a autoprotilátek proti tyroidální peroxidáze/ anti‑TPO, rizikovější HLA profil), a tudíž vyšší glykovaný hemoglobin (HbA1c), nižší BMI a méně často přítomný metabolický syndrom a jeho komponenty (nižší hladina triglyceridemie) či nižší celkový cholesterol (1, 11). Naopak jedinci s nízkým titrem GADA jsou v porovnání s pacienty z předchozí skupiny méně náchylní ke ketóze, ale bývá u nich častější obezita (vyšší BMI), hypercholesterolemie a metabolický syndrom (včetně arteriální hypertenze, hypertriglyceridémie a kardiovaskulárních chorob), který se u nich vyskytuje stejně často jako u pacientů s DM2T (1, 4, 11).
Klinické charakteristiky LADA mohou také korelovat s konkrétním typem přítomné autoprotilátky. Přítomnost pouze IA2A byla u LADA asociovaná s vyšším BMI a fenotypem podobnějším DM2T (1), zatímco přítomnost IA2A spolu s GADA podobnějším DM1T (12).
Bylo též zjištěno, že i počet přítomných typů ostrůvkových autoprotilátek odpovídá tíži autoimunitního procesu, tedy více autoprotilátek predikuje rychlejší inzulinovou insuficienci (1).
Produkce inzulinu
Hladina C‑peptidu bývá v době diagnózy v normálních (nebo nižších, ale stále měřitelných) hodnotách a vykazuje podstatně lepší odpověď na sacharidovou zátěž než u pacientů s DM1T (7). Hodnoty stimulovaného C‑peptidu během tolerančního testu se smíšeným jídlem (mixed‑meal tolerance test) jsou většinou ve všech časových bodech vyšší u LADA než u klasického DM1T (1). Zachovalá produkce inzulinu v době diagnózy většinou umožňuje alespoň na nějakou dobu diabetes úspěšně léčit perorálními antidiabetiky.
Progrese inzulinové deficience je v porovnání s diabetiky 2. typu podstatně rychlejší (4). Nutnost podávání inzulinu se objevuje většinou později než za šest měsíců od diagnózy (13). Podle studie UKPDS (United Kingdom Prospective Diabetes Study) je u většiny pacientů na počátku diagnostikovaných s DM2T, kteří zároveň mají GADA autoprotilátky, nutné zahájení inzulinoterapie do šesti let (4).
Přítomnost diabetických komplikací
Studií zabývajících se přítomností chronických diabetických komplikací u pacientů s LADA není mnoho a data se navíc liší od typu a struktury studie, jejich výsledky byly recentně shrnuty (1). U pacientů s krátkým trváním LADA (do 5 let) se zdá být přítomnost mikrovaskulárních komplikací (nefropatie a retinopatie) v porovnání s diabetiky 2. typu se stejnou dobou trvání nemoci méně častá, což lze vysvětlit delší expozicí hyperglykemie u DM2T vlivem opožděnější diagnózy, než tomu bývá u LADA. Prevalence nefropatie a retinopatie se u LADA a DM2T trvajících déle než 5 let nelišila. Nicméně neuropatie se zdá být častější u LADA než u DM2T. Kardiovaskulární riziko (riziko ischemické choroby srdeční, cévní mozkové příhody a celkové mortality) se navzdory štíhlejšímu habitu, „zdravějšímu“ lipidogramu a hodnotám krevního tlaku (6) zdá být u LADA podle posledních studií stejné jako u DM2T.
Diagnostika
Optimálně by měl být každý pacient se vznikem diabetu v dospělosti testován na přítomnost specifických ostrůvkových autoprotilátek. V praxi toto bohužel z nejrůznějších důvodů (zejména finančních nákladů) není možné. V současné době se vyšetření autoprotilátek obvykle provádí pouze u dospělých pacientů s normálním nebo nižším BMI, tedy u těch, kde existuje vysoké podezření na LADA. Tím se ale opomíjí řada pacientů s LADA, kteří mají nadváhu nebo jsou obézní (1). V retrospektivní studii porovnávající pacienty s LADA a DM2T byly identifikovány klinické znaky, které jsou v době diagnostiky diabetu signifikantně častěji prokazatelné u pacientů s LADA v porovnání s diabetiky 2. typu: věk v době vzniku diabetu < 50 let, akutní symptomy (polydipsie/polyurie/neúmyslný úbytek na váze), BMI < 25 kg/m2, osobní a rodinná anamnéza autoimunitní choroby (14). Při prospektivním šetření bylo následně zjištěno, že přítomnost alespoň dvou těchto znaků (tzv. klinické rizikové skóre LADA ≥ 2) při identifikaci pacientů s LADA poskytuje 90% senzitivitu, 71% specificitu a 99% negativní prediktivní hodnotu (14). Na základě výsledků této studie byl navržen diagnostický algoritmus (1), jenž zahrnuje prvně šetření klinických rizikových znaků (klinické rizikové skóre LADA), následně vyšetření C‑peptidu a konečně (u pacientů s nezvýšeným C‑peptidem) ostrůvkových autoprotilátek (Obr. 1).
Image 1. Navrhovaný algoritmus diagnostiky LADA 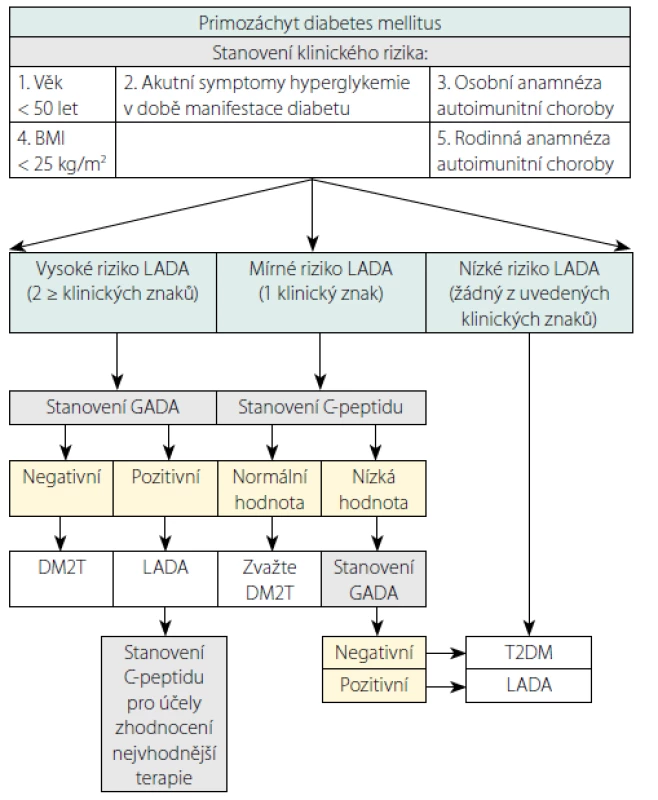
Upraveno podle (1): Pozzilli P, Pieralice S. Latent Autoimmune Diabetes in Adults:
Current Status and New Horizons. Endocrinol Metab (Seoul). 2018; 33(2): 147–159.Léčba diabetu typu LADA
Specifická doporučení pro léčbu LADA dosud publikována nebyla. Fenotypová heterogenita LADA komplikuje ustanovení jednotného léčebného algoritmu. Pacienti jsou obvykle léčeni podobně jako pacienti s DM2T (zejména jsou‑li tak klasifikováni), optimální je však v případě LADA léčbu více individualizovat s ohledem na stupeň inzulinové rezistence a úroveň zbytkové inzulinové sekrece. Cílem léčby LADA je nejen metabolická kontrola onemocnění, ale také snaha o co nejdelší zachování reziduální sekrece β‑buněk, jež dále napomáhá kompenzaci onemocnění a oddálení vzniku chronických diabetických komplikací. Na základě současných poznatků je v léčbě LADA stran medikamentózní léčby doporučena spíše kombinovaná antihyperglykemická léčba, především brzké zahájení léčby inzulinem, které vedle metabolické kontroly přispěje i k prodloužení životnosti β‑buněk (6). Největší pozitivní dopad bude mít zřejmě u mladších pacientů s vyššími titry GADA. Léčbu inzulinem by měla doplnit intervence životního stylu (diety a pohybové aktivity), zejména tam, kde má z klinického pohledu jasný význam (přítomnost nadváhy, obezity, inzulinové rezistence), popř. další preparáty ovlivňující míru inzulinové rezistence (metformin) a prezervaci β‑buněk (viz dále).
Inzulin
Na základě jednotných dat z randomizovaných kontrolovaných studií je časná iniciace léčby inzulinem (i navzdory částečně zachovalé endogenní sekreci inzulinu) považována za optimální léčbu, s níž je možné snadněji dosáhnout cílové glykemické kompenzace a zároveň dlouhodoběji zachovat vlastní sekreci inzulinu (1).
Bylo prokázáno, že pacienti s vyšším titrem GADA dojdou dříve k inzulinové dependenci (15), naopak pacienti s LADA manifestovaným ve vyšším věku mají nižší riziko inzulinové dependence (12). Obě tyto studie tak nastolily otázku, zda je s ohledem na riziko hypoglykemií nutná časná inzulinizace starších pacientů s nízkými hladinami GADA (6).
Inzulinové senzitizéry
U pacientů s obezitou a inzulinovou resistencí může být výhodná kombinace inzulinu s metforminem (6). Kontrolované randomizované studie hodnotící účinek samotného metforminu u LADA však k dispozici nejsou (1). Z dalších inzulinových senzitizérů byl u pacientů s LADA zkoumán pouze vliv rosiglitazonu, prokazující potenciální výhody jeho použití pro zachování funkce β‑buněk (16). Od jeho užití v léčbě diabetu obecně se však již upustilo pro možné zvýšení kardiovaskulárního rizika (17). Výsledek studie nicméně naznačuje možný pozitivní efekt glitazonů obecně, potencionálně tedy i pioglitazonu.
Deriváty sulfonylurey
Při léčbě deriváty sulfonylurey (SUR) studie prokázaly progresivní úbytek reziduální produkce inzulinu a zhoršování glykemické kompenzace v porovnání s léčbou inzulinem (18, 19). SUR proto v léčbě LADA nejsou doporučovány.
Inkretiny
Větší variabilitu v léčbě LADA by mohly zprostředkovat inkretiny, které v několika málo studiích prokázaly dobrou efektivitu a schopnost uchování β‑buněčné funkce, včetně zmírnění inzulitidy (na myších modelech s autoimunitním diabetem) (1). Malá randomizovaná kontrolovaná studie s 30 účastníky prokázala lepší schopnost zachovat funkci β‑buněk (měřeno koncentrací C‑peptidu) po 12 měsících léčby kombinací sitagliptinu a inzulinu než u kontrolní skupiny léčené pouze inzulinem (20). Také linagliptin dokázal v porovnání s glimepiridem zpomalit pokles C‑peptidu u pacientů s LADA během dvouletého sledovacího období (21). Post hoc analýzy pěti randomizovaných placebem kontrolovaných studií prokázaly také u saxagliptinu schopnost zlepšit glykemickou kontrolu a sekreci C‑peptidu po 24 týdnech (22).
Longitudinální observační studie s 610 pacienty s DM2T hodnotící glykemickou odpověď na přidání GLP-1 receptorových agonistů (exenatidu nebo liraglutidu) k běžné léčbě (38 % pacientů bylo léčeno i inzulinem) zjistila, že u podskupiny těchto pacientů s prokázanou přítomností GADA a/nebo IA2A a nízkou hodnotou C‑peptidu nalačno (≤ 250 pmol/l) došlo v porovnání se skupinou pacientů bez těchto autoprotilátek a vyšším C‑peptidem k nižšímu poklesu HbA1c (23). Zároveň ale tato léčba umožnila redukovat celkovou denní dávku inzulinu v průměru o 17 % (23). Autoři studie proto usoudili, že stran glykemické kompenzace budou pacienti s LADA profitovat z léčby GLP-1 receptorovými agonisty méně než pacienti s DM2T, nicméně mohou těžit z podpory sekrece inzulinu β‑buňkami. Efektivita GLP-1 agonistů se ale může lišit mezi jednotlivými preparáty. Post hoc analýzy tří studií léčby GLP-1 receptorovým agonistou dulaglutidem (v porovnání se sitagliptinem, inzulinem glargine a placebem v jednotlivých studiích) u pacientů s DM2T a pozitivitou GADA prokázaly naopak během jednoletého sledovacího období srovnatelnou redukci HbA1c jako u pacientů bez GADA, a také zlepšení β ‑ celulární funkce, bez ovlivnění rizika hypoglykemií (24).
Na základě nejnovějších důkazů tedy mohou být inkretiny (DPP4 inhibitory a někteří GLP-1 receptoroví agonisté) u LADA efektivní jako přídatná léčba k inzulinoterapii, pro udržení reziduální sekreční funkce β‑buněk (1).
Závěr
LADA představuje klinicky heterogenní typ diabetes mellitus, zahrnující u jednotlivých pacientů jak různý stupeň inzulinové deficience, odpovídající různé závažnosti autoimunitního procesu, tak i různou míru inzulinové rezistence. S ohledem na dospělý věk, zachovalou endogenní inzulinovou sekreci, možnou přítomnost metabolického syndromu či iniciální úspěšnost léčby perorálními antidiabetiky může být klinická diferenciální diagnostika zejména mezi LADA a DM2T značně komplikovaná. Přitom správná klasifikace typu diabetu umožňuje vedle nasazení optimální léčby také možnost přesnější predikce průběhu onemocnění a rizika vzniku diabetických komplikací nebo cíleného genetického poradenství a gestační péče. Stanovení ostrůvkových autoprotilátek (alespoň GADA, jelikož tyto bývají pozitivní v 90 % případů LADA) u pacientů s diabetem vznikajícím v dospělosti představuje snadný přístup, jak odlišit pacienty s LADA od DM2T. S ohledem na možnou nedostupnost tohoto vyšetření může lékaře na LADA v době diagnostiky upozornit především nižší věk pacientů, nezvýšená (nižší) hladina C‑peptidu, popř. absence znaků metabolického syndromu. U již léčených pacientů zařazených mezi DM2T může na LADA upozornit rychlejší progrese onemocnění směrem k inzulinové dependenci, než je u DM2T obvyklé. Odlišení LADA od ostatních typů diabetu je důležité především pro možnost lepší individualizace léčby – především výhody časné iniciace inzulinoterapie (z níž markantně profitují zejména mladší pacienti s vysokými titry GADA) v kombinaci s farmaky umožňujícími prodloužení sekreční funkce β‑buněk (tj. protektivním vlivem na β‑buňky). Dostupné studie naznačují potenciálně pozitivní účinek gliptinů a některých GLP-1 receptorových agonistů u pacientů s LADA, nicméně jej bude nutné prokázat u širší kohorty pacientů a v delším časovém horizontu. S ohledem na obdobné kardiovaskulární riziko jako u DM2T by měl být přístup k prevenci a léčbě srdečně ‑ cévních chorob u pacientů s LADA stejný jako v případě diabetiků 2. typu.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jana Urbanová, Ph.D.
Centrum pro výzkum diabetu, metabolismu a výživy, II. interní klinika 3. LF UK a FNKV Praha
Ruská 87
100 00 Praha 10
Cit. zkr: Vnitř Lék 2021; 67(2): 97–102
Článek přijat redakcí: 3. 9. 2020
Článek přijat po recenzích: 12. 1. 2021
Sources
1. Pozzilli P, Pieralice S. Latent Autoimmune Diabetes in Adults: Current Status and New Horizons. Endocrinol Metab (Seoul). 2018; 33(2): 147–159.
2. Šumník Z, Průhová Š. LADA and MODY: How do we know them? Med. Praxi 2016, 13(1): 26-29.
3. Mojto V. Monogénne formy diabetu mellitu a latentný autoimunitný diabetes u dospelých: Monogenic forms of diabetes mellitus and latent autoimmune diabetes in adults. Lekársky obzor: HERBA, 2013, 62(9), 346–349.
4. Carlsson S. Etiology and Pathogenesis of Latent Autoimmune Diabetes in Adults (LADA) Compared to Type 2 Diabetes Front. Physiol., 26 March 2019 | https://doi.org/10.3389/ fphys.2019.00320
5. Naik RG, Brooks‑Worrell BM, Palmer JP. Latent autoimmune diabetes in adults. J Clin Endocrinol Metab 2009; 94(12): 4635–4444.
6. Buzzetti R, Zampetti S, Maddaloni E. Adult‑onset autoimmune diabetes: current knowledge and implications for management. Nat Rev Endocrinol. 2017; 13(11): 674–686.
7. Hawa MI, Kolb H, Schloot N et al., Action LADA consortium.Adult‑onset autoimmune diabetes in Europe is prevalent with a broad clinical phenotype: Action LADA 7. Diabetes Care 2013; 36(4): 908–913.
8. Yang Z et al. Childhood diabetes in China. Enormous variation by place and ethnic group. Diabetes Care 1998; 21 : 525–529.
9. Lampasona V, Petrone A, Tiberti C et al. Zinc transporter 8 antibodies complement GAD and IA-2 antibodies in the identification and characterization of adult‑onset autoimmune diabetes: Non Insulin Requiring Autoimmune Diabetes (NIRAD) 4. Diabetes Care. 2010; 33 : 104–108.
10. Heneberg P, Šimčíková D, Čecháková M et al. Autoantibodies against ZnT8 are rare in Central‑European LADA patients and absent in MODY patients, including those positive for other autoantibodies. Journal of Diabetes and its Complications. 2019 Jan; 33(1): 46 – 52. DOI: 10.1016/j.jdiacomp.2018. 10. 004.
11. Buzzetti R, Di Pietro S, Giaccari A et al. High titer of autoantibodies to GAD identifies a specific phenotype of adult‑onset autoimmune diabetes. Diabetes Care 2007; 30 : 932–938.
12. Maddaloni E, Lessan N, Al Tikriti A, et al. Latent autoimmune diabetes in adults in the United Arab Emirates: clinical features and factors related to insulin ‑ requirement. PLoS One. 2015; 10: e0131837.
13. Thomas CC, Philipson LH. Update on diabetes classification. Med Clin North Am. 2015 Jan; 99(1): 1–16
14. Fourlanos S, Perry C, Stein MS et al. A Clinical screening tool identifies autoimmune diabetes in adults. Diabetes Care. 2006; 29 : 970–975.
15. Zampetti S et al. High GADA titer increases the risk of insulin requirement in LADA patients: a 7-year follow‑up (NIRAD study 7). Eur J Endocrinol 2014; 171, 697–704.
16. Zhou Z et al. Rosiglitazone combined with insulin preserves islet beta cell function in adult‑onset latent autoimmune diabetes (LADA). Diabetes Metab Res Rev 2005; 21, 203–208.
17. Scheen AJ. Suspension of the commercialization of sibutramine and rosiglitazone in Europe. Rev Med Liege 2010; 65 (10): 574–579.
18. Kobayashi T, Nakanishi K, Murase T et al. Small doses of subcutaneous insulin as a strategy for preventing slowly progressive beta ‑ cell failure in islet cell antibody‑positive patients with clinical features of NIDDM. Diabetes 1996; 45 : 622–626.
19. Maruyama, T. et al. Insulin intervention in slowly progressive insulin‑dependent (type 1) diabetes mellitus. J Clin Endocrinol Metab 2008; 93 : 2115–2121.
20. Zhao, Y. et al. Dipeptidyl peptidase 4 inhibitor sitagliptin maintains β ‑ cell function in patients with recent‑onset latent autoimmune diabetes in adults: one year prospective study. J Clin Endocrinol Metab 2014; 99: E876–E880.
21. Johansen OE, Boehm B, Grill V et al. Beta ‑ cell function in latent autoimmune diabetes in adults treated with linagliptin vs glimepiride: exploratory results from a 2-year double‑blind randomized controlled study. Endocr Rev. 2012; 33(4 Suppl): SUN–LB1.
22. Buzzetti R, Pozzilli P, Frederich R et al. Saxagliptin improves glycaemic control and C‑peptide secretion in latent autoimmune diabetes in adults (LADA). Diabetes Metab Res Rev 2016; 32 : 289–296.
23. Jones AG, McDonald TJ, Shields BM et al. for the PRIBA Study Group. Markers of β‑Cell Failure Predict Poor Glycemic Response to GLP-1 Receptor Agonist Therapy in Type 2 Diabetes. Diabetes Care 2016 Feb; 39(2): 250–257.
24. Pozzilli P, Leslie RD, Peters AL et al. Dulaglutide treatment results in effective glycaemic control in latent autoimmune diabetes in adults (LADA): a post‑hoc analysis of the AWARD-2, -4 and -5 trials. Diabetes Obes Metab 2018; 20 : 1490–1498.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 2-
All articles in this issue
- Immunoglobulin G4-related disease in gastroenterology
- Diagnostics and therapy of chronic pancreatitis according to UEG guidelines
- Extraintestinal complications of inflammatory bowel diseases
- Current view of diagnosis and treatment of latent autoimmune diabetes in adults
- Glucagon in treatment of hypoglycemia – novelties
- Hemodynamic significant pericardial effusion as a possible rare extraintestinal manifestation of Crohn’s disease
- Massive pulmonary embolism with a large thrombus stuck in patent foramen ovale – an impending paradoxical embolism
- Perindopril: a long-term certainty in treating hypertension
- Hlavní téma: gastroenterologie
-
How to prolong the lives of our patients in health?
And is it possible?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostics and therapy of chronic pancreatitis according to UEG guidelines
- Glucagon in treatment of hypoglycemia – novelties
- Perindopril: a long-term certainty in treating hypertension
- Extraintestinal complications of inflammatory bowel diseases
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

