-
Medical journals
- Career
Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
Authors: Zdeněk Monhart
Authors‘ workplace: Interní oddělení Nemocnice Znojmo
Published in: Vnitř Lék 2020; 66(6): 386-390
Category: In Brief
Overview
Na kongresu Evropské kardiologické společnosti na podzim roku 2019 byly představeny nové doporučené postupy pro diagnostiku a léčbu plicní embolie, které byly zpracovány ve spolupráci s Evropskou respirační společností. Doporučené postupy jsou dílem kardiologické společnosti, byly představeny na kardiologickém kongresu – v čem jsou tedy důležité pro internisty? Pacienti s plicní embolií jsou běžně léčeni na spádových interních odděleních, protože diagnostika a léčba akutní plicní embolie je méně „kardiocentrum‑dependentní“ než léčba akutního koronárního syndromu. Navíc diferenciální diagnostika akutní dušnosti a/ nebo bolestí na hrudi je denním chlebem internisty na příjmové ambulanci. Co je tedy pro nás internisty nového? Novinky jsou v diagnostických postupech i v léčebné strategii hemodynamicky stabilních pacientů. Máme k dispozici další alternativní cut‑off hodnotu D dimerů, která nám u pacientů s nízkou klinickou pravděpodobností může snížit potřebu zobrazovacích metod. Algoritmus péče o pacienty s plicní embolií nově zahrnuje ambulantní léčbu jako alternativa hospitalizace ve vybraných situacích s nízkým rizikem. Podstatnou změnou v antikoagulační léčbě u pacientů se středním a nízkým rizikem je doporučení týkající se NOAC – již nejsou uváděny jako alternativa ke „klasické“ léčbě warfarinem, ale jako preferovaná strategie. Nově máme též možnost využít NOAC i v léčbě plicní embolie u pacientů s malignitou a nízkým rizikem krvácení. A zcela přepracovaný je v těchto guidelines postoj ke stanovení doporučené délky antikoagulační léčby v sekundární prevenci, kromě změněné stratifikace rizika recidivy TEN je také patrna tendence k prodlužování doby antikoagulační terapie. Na závěr je nutné zmínit aktualizované doporučení pro další sledování pacientů po plicní embolii se zřetelem na včasnou diagnostiku chronické tromboembolické hypertenze.
Klíčová slova:
guidelines – plicní embolie – antikoagulační léčba – sekundární prevence
MOŽNOST POUŽITÍ ALTERNATIVNÍ CUT‑OFF HODNOTY D DIMERŮ
Stanovení hladiny D dimerů je standardně doporučováno k vyloučení plicní embolie u ambulantních pacientů s nízkou nebo střední klinickou pravděpodobností TEN. Jako alternativu k fixní cut‑off hodnotě 500 µg/l můžeme nyní u pacientů ve věku nad 50 let použít na věk adjustovanou cut‑off hodnotu vypočtenou jako věk × 10 (µg/l) – tedy pro pacienta ve věku 75 let bude cut‑off hodnota 750 µg/l (1). Nová doporučení přinášejí možnost využít i další alternativní cut‑off hodnotu D dimerů (1 000 µg/l) v závislosti na klinické pravděpodobnosti PE (v tomto případě u pacientů, kteří vykazují následující známky nízké klinické pravděpodobnosti – není přítomna hemoptýza ani známky hluboké žilní trombózy, a jiná diagnóza se jeví pravděpodobnější než PE) (2). Nadále samozřejmě platí, že D dimery nejsou nástrojem k vyloučení plicní embolie u pacientů s její vysokou klinickou pravděpodobností, v těchto situacích se na ně spolehnout nemůžeme a k vyloučení PE musíme použít zobrazovací vyšetření – CT angiografii nebo perfuzní scintigrafii (3).
ALGORITMUS PRO LÉČBU HEMODYNAMICKY STABILNÍCH PACIENTŮ
Nový algoritmus pro léčbu hemodynamicky stabilních pacientů již zahrnuje eventualitu ambulantní léčby u pacientů s nízkým rizikem. Posouzení rizika konkrétního pacienta zahrnuje stanovení klinického rizika – zde můžeme použít skórovací index PESI (jeho plnou či zjednodušenou formu), případně také HESTIA kritéria (4). Neměli bychom se však spolehnout pouze na stanovení klinického rizika, ale posoudit též funkci pravé komory srdeční pomocí některé zobrazovací metody – echokardiografie nebo CT angiografie. Rozlišit pacienty s vyšším a nižším středním rizikem nám umožní stanovené troponinu jako markeru poškození myokardu. A při rozhodování o možnosti ambulantní léčby pacienta s akutní plicní embolií bychom měli též hodnotit jeho sociální zázemí a dostupnost péče.
ANTIKOAGULAČNÍ LÉČBA U PACIENTŮ SE STŘEDNÍM NEBO NÍZKÝM RIZIKEM
U pacientů se střední a vysokou klinickou pravděpodobností plicní embolie zahajujeme antikoagulační léčbu neodkladně – již během diagnostického procesu první dávkou antikoagulancia. Když zahajujeme antikoagulační léčbu parenterálně, preferujeme nízkomolekulární heparin nebo fondaparinux před nefrakcionovaným heparinem. NOAC jsou nově preferovanou formou antikoagulační perorální léčby, upřednostněnou před léčbou warfarinem (pokud je pacient vhodný kandidát pro léčbu NOAC). I nadále jsou skupiny pacientů, kteří by NOAC léčeni být neměli (pacienti se selháním ledvin s GFR pod 15 ml/min, těhotné a kojící ženy, a pacienti s antifosfolipidovým syndromem).
Image 1. Algorimus léčebného postupu s plicní embolií 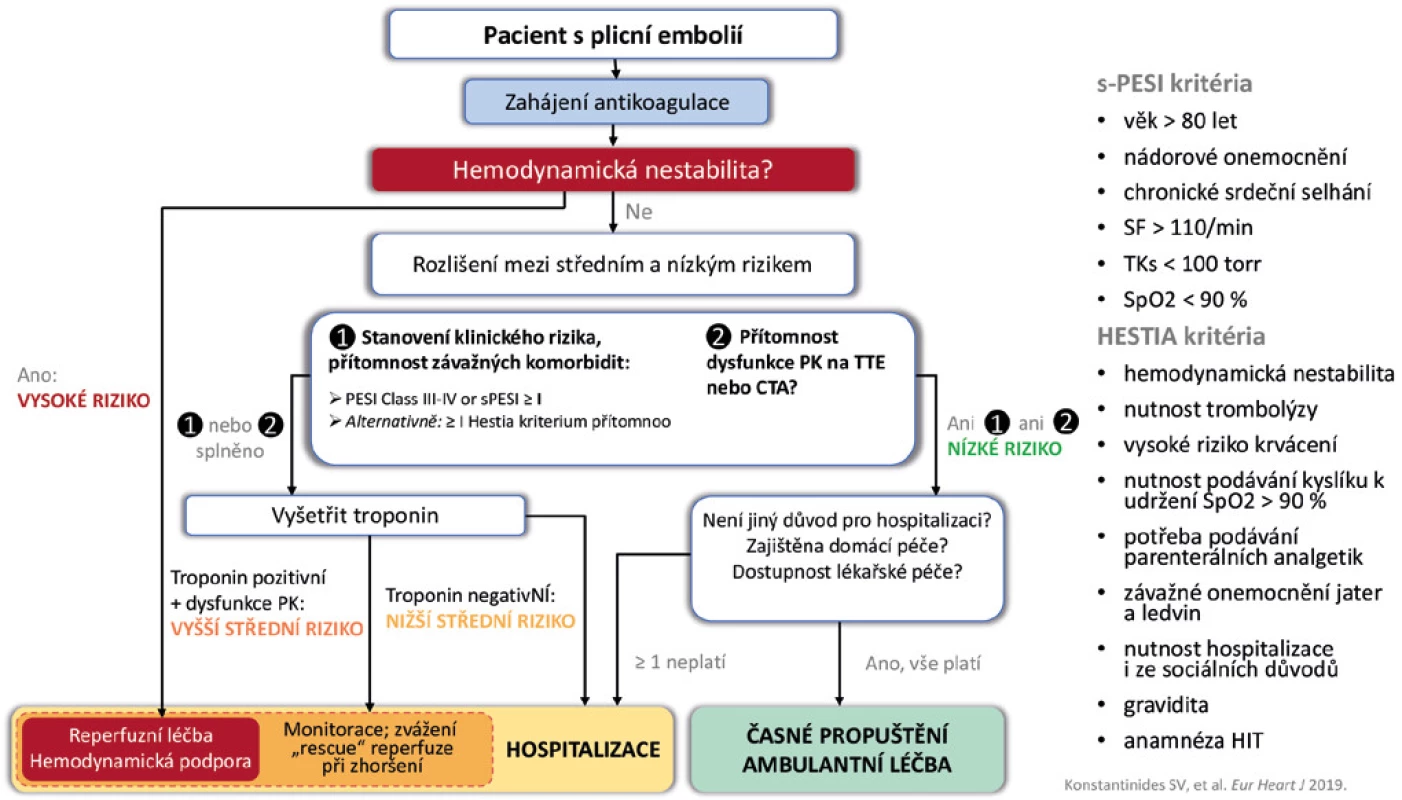
PK – pravá komora, TTE – transthorakální echokardiografie, CTA – CT angiografie plicnice, HIT – heparinem indikovaná trombocytopenie ANTIKOAGULAČNÍ LÉČBA U PACIENTŮ S MALIGNITOU
Léčba LMWH je preferována před terapií warfarinem. Jako alternativa k LMWH u pacientů, kteří nemají malignitu GIT, může být nově zváženo použití edoxabanu nebo rivaroxabanu (5, 6). U pacientů s malignitou je doporučována dlouhodobá antikoagulační terapie – bez omezení doby trvání (nebo do té doby, kdy je maligní onemocnění vyléčeno). K léčbě incidentálních, náhodně zjištěných asymptomatických plicních embolizací bychom měli u pacientů s malignitou přistupovat stejně jako u symptomatických PE – indikována je dlouhodobá antikoagulace. Pokud se ale v tomto případě jedná pouze o nález embolizace v izolované subsegmentální větvi plicnice, měli bychom léčbu zahájit jen tehdy, je‑li současně prokázána přítomnost žilní trombózy.
RIZIKOVÉ FAKTORY PRO VÝVOJ CTEPH
Opakované epizody TEN, velké tromby na CTA, echokardiografické známky PH/dysfunkce PK, nález na CTA svědčící pro předchozí chronickou tromboembolickou nemoc, trombofilní stavy (především antifosfolipidový syndrom a zvýšená hladina f. VIII), infikované chronické žilní vstupy nebo stimulační systém, anamnéza maligního onemocnění, substituovaná hypotyreóza, IBD, myeloproliferativní onemocnění, anamnéza splenektomie, chronická osteomyelitida.
Table 1. Riziko rekurence TEN na základě přítomnosti rizikových faktorů tromboembolismu 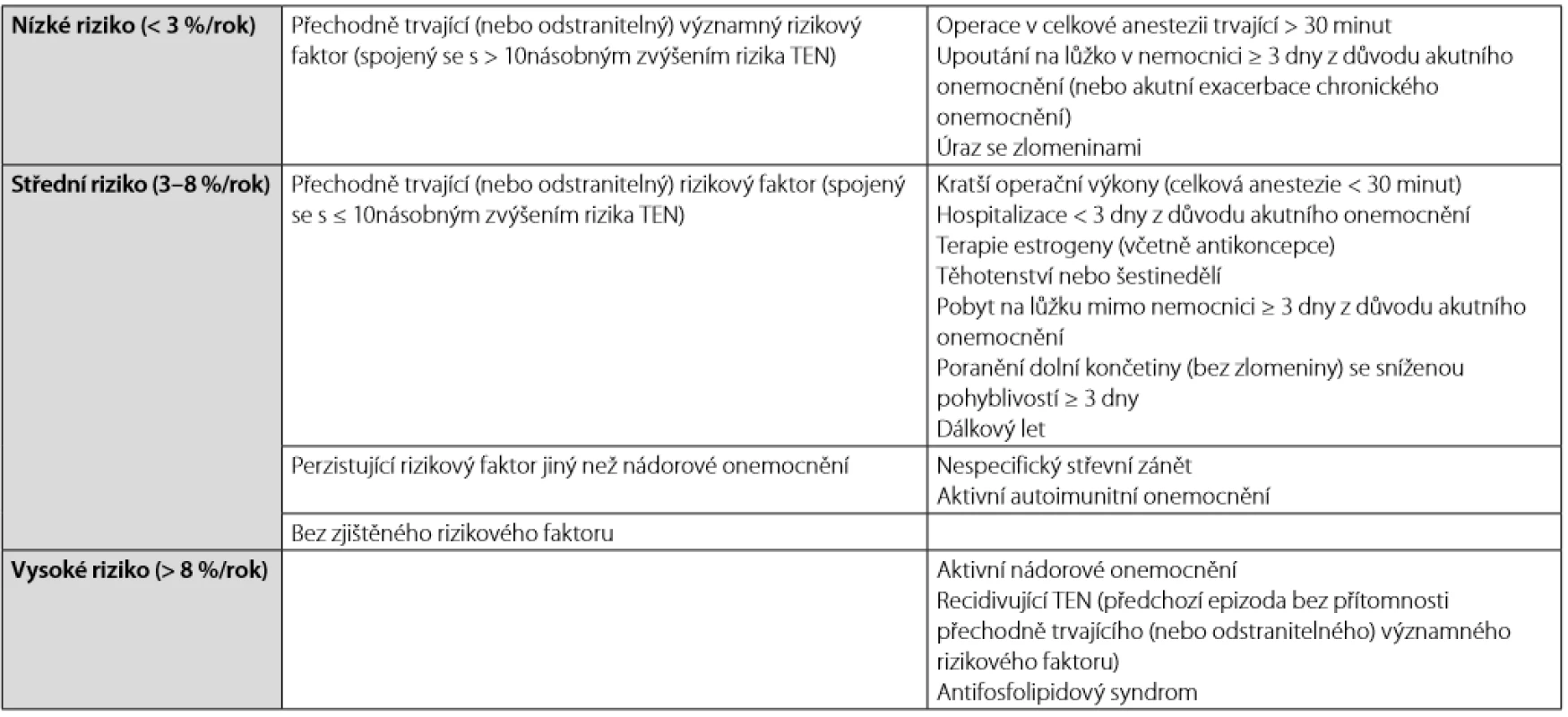
Table 2. Délka antikoagulační léčby 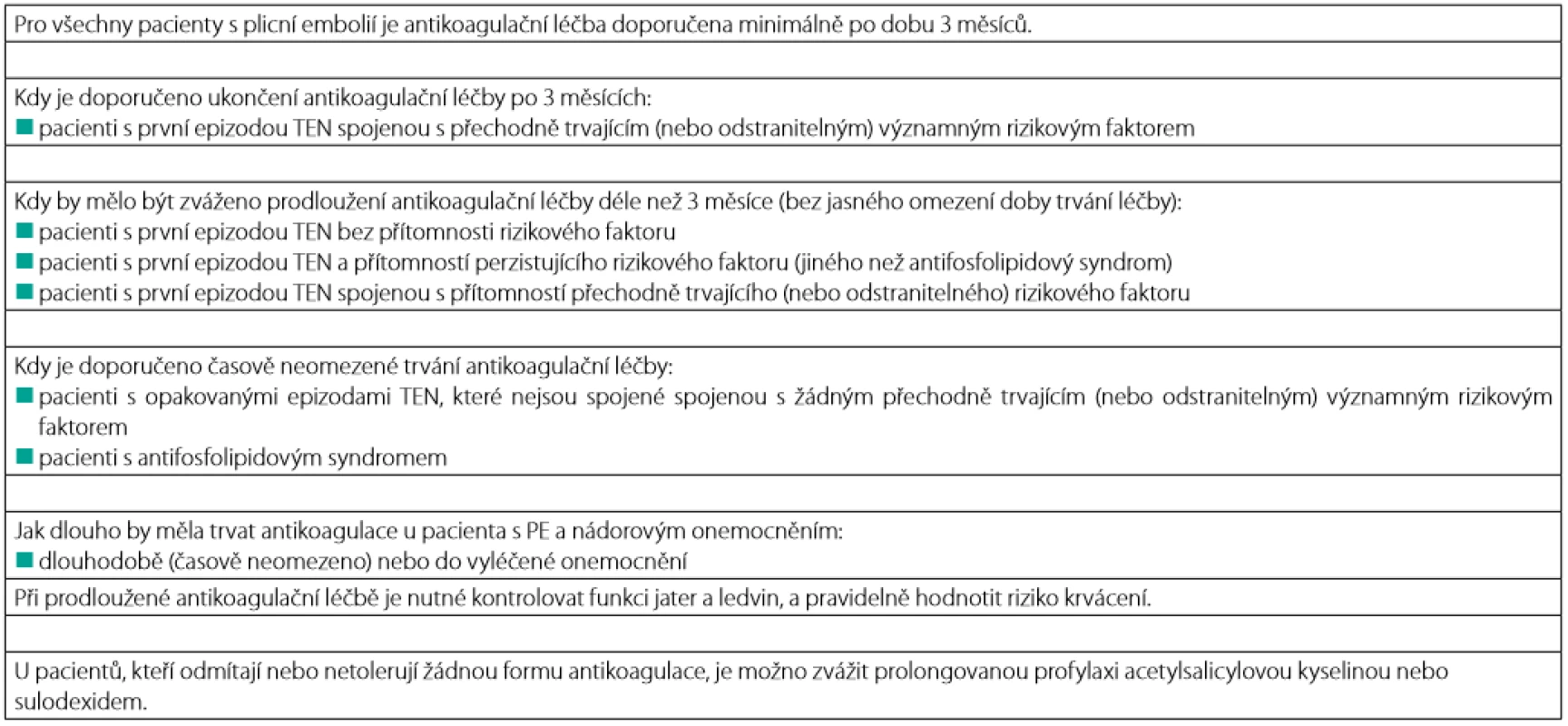
Image 2. Sledování pacientů po plicní embolii 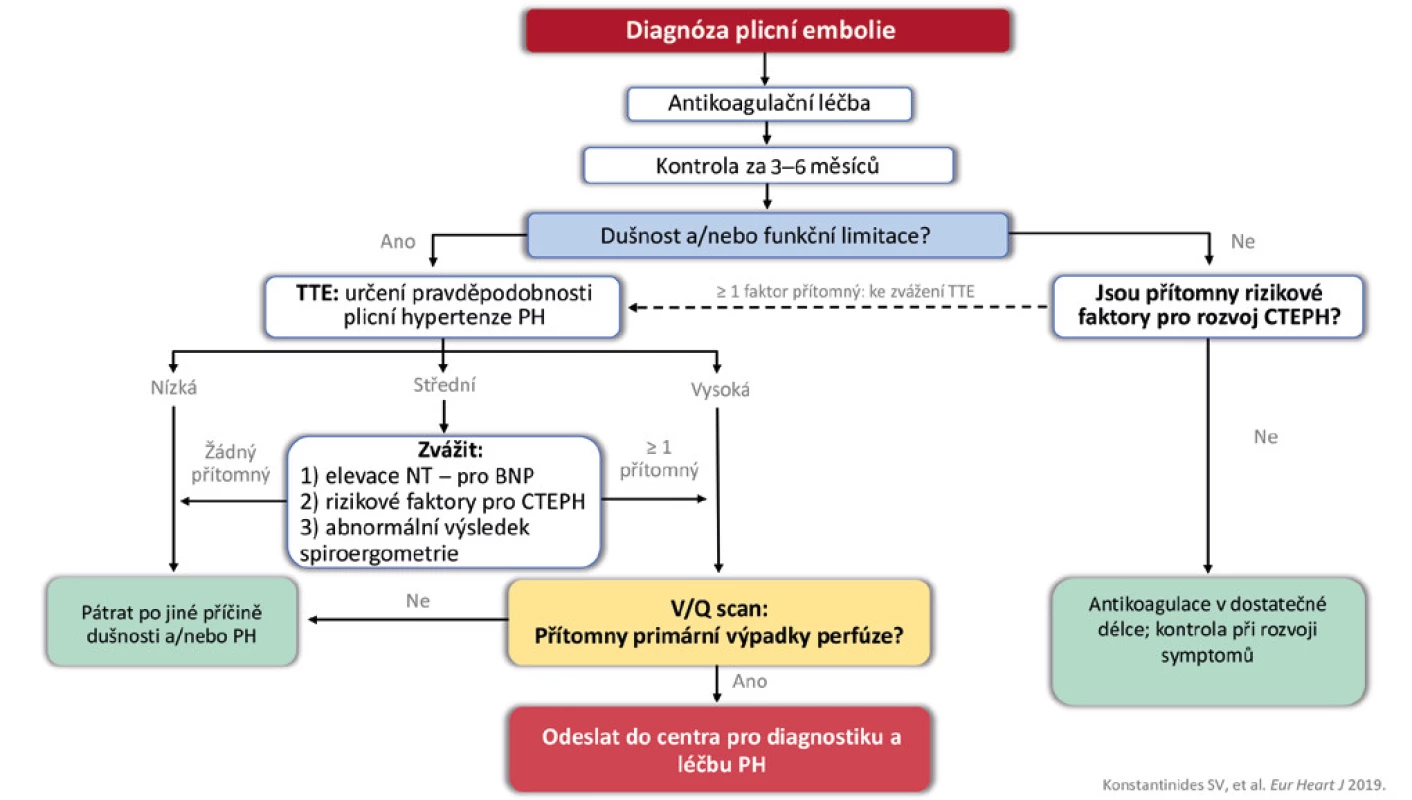
PH – plicní hypertenze, TTE – transthorakální echokardiografie, CTEPH – chronická tromboembolická plicní hypertenze, V/Q scan – ventilačně/perfuzní scan Image 3. Diagnostika plicní embolie v těhotenství 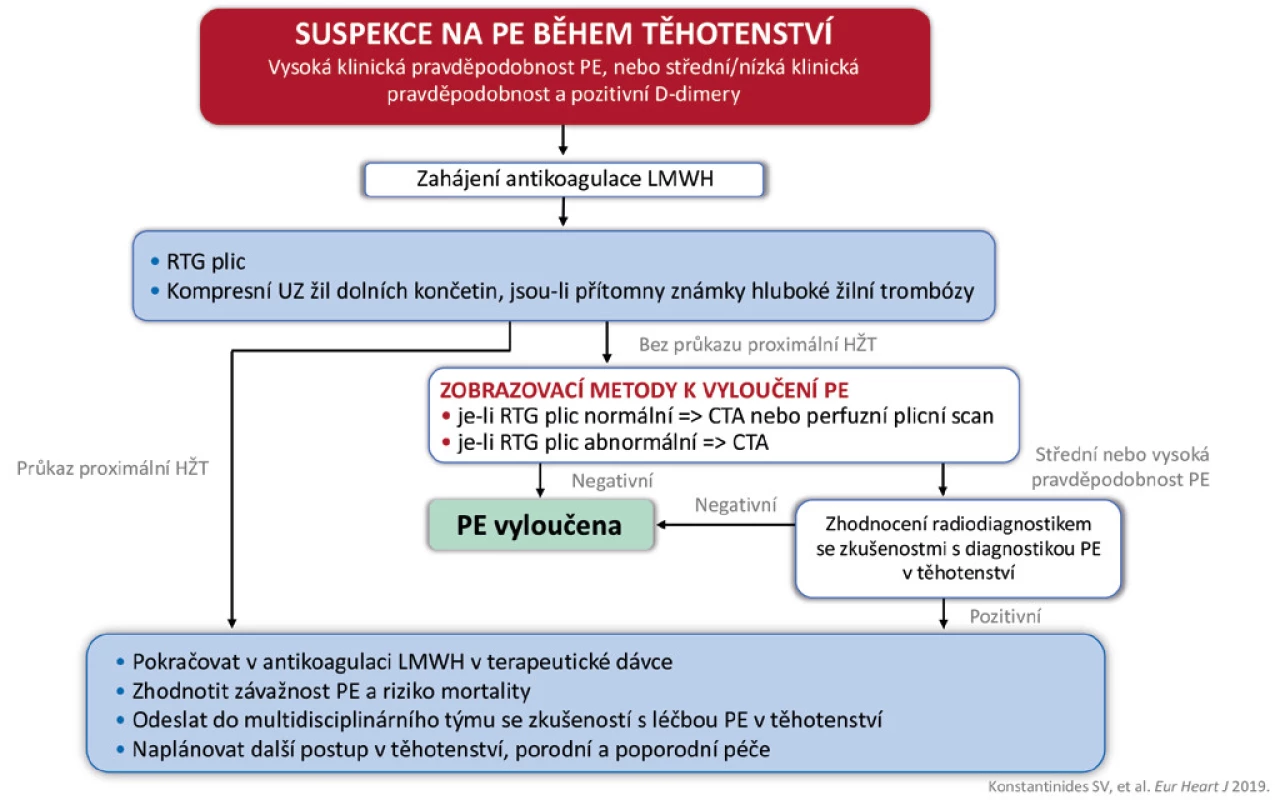
PE – plicní embolie, LMWH – nízkomolekulární heparin, TTE – transthorakální echokardiografie, CTA – CT angiografie plicnice
Sources
1. Righini M, Van Es J, Den Exter PL, et al. Age ‑adjusted Ddimer cutoff levels to rule out pulmonary embolism: the ADJUST ‑PE study. JAMA 2014; 311 : 1117–1124.
2. van der Hulle T, Cheung WY, Kooij S, et al. Years Study Group. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet 2017; 390 : 289–297.
3. Konstantinides SV, Meyer G, et al. The 2019 ESC Guidelines on the Diagnosis and Management of Acute Pulmonary Embolism. Eur Heart J. 2019 Nov 1; 40(42): 3453–3455.
4. Zondag W, Mos IC, Creemers ‑Schild D, et al. Outpatient treatment in patients with acute pulmonary embolism: the Hestia Study. J Thromb Haemost 2011; 9 : 1500–1507.
5. Raskob GE, van Es N, Verhamme P, Carrier M, et al; Hokusai VTE Cancer Investigators. Edoxaban for the treatment of cancer ‑associated venous thromboembolism. N Engl J Med 2018; 378 : 615–624.
6. Young AM, Marshall A, Thirlwall J, et al. Comparison of an oral factor Xa inhibitor with low molecular weight heparin in patients with cancer with venous thromboembolism: results of a randomized trial (SELECT‑D). J Clin Oncol 2018; 36 : 2017–2023.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 6-
All articles in this issue
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Alergie a imunopatologie – hlavní téma
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

