-
Medical journals
- Career
Perkutánní okluze ouška levé síně
Authors: Marek Hozman 1; Pavel Osmančík 2
Authors‘ workplace: Kardiocentrum Karlovarské krajské nemocnice, a. s., Karlovy Vary 1; III. interní – kardiologická klinika 3. LF UK a FN Královské Vinohrady, Praha 2
Published in: Vnitř Lék 2020; 66(6): 1-9
Category:
Overview
Cévní mozková příhoda (CMP) je potencionální závažnou komplikací fibrilace síní. Systémová antikoagulační terapie je první volbou v prevenci kardioembolizačních příhod. Především u pacientů s anamnézou závažného krvácení může být antikoagulační terapie kontraindikována. Perkutánní okluze ouška levé síně je alternativou v profylaxi kardioembolizace. Tento přehledový článek popisuje fyziologii a patofyziologii ouška levé síně, nejpoužívanější okludéry, indikace a racionále jejich použití.
Klíčová slova:
fibrilace síní – cévní mozková příhoda – ouško levé síně – okludér
Úvod
Fibrilace síní (FS) je nejčastěji se vyskytující srdeční arytmie. Celoživotní riziko rozvoje FS činí dle Framinghamské studie přibližně 25 % pro muže i ženy. Pro populaci bez strukturálního onemocnění srdce je výše tohoto rizika 16 %, pro pacienty se strukturálním onemocněním srdce je toto riziko přibližně dvojnásobné (kolem 35 %) (1, 2). FS je spojena s rizikem kardioembolizační příhody, nejčastěji ve formě cévní mozkové příhody (CMP) (3). Roční riziko ischemického iktu je u neantikoagulovaných pacientů starších 65 let minimálně 4 % v závislosti na přidružených onemocněních (4). Dle starších autoptických studií a studií s prováděným jícnovým echokardiografickým vyšetřením (TEE) časně po rozvoji CMP je u nevalvulární FS místem vzniku trombu v 91 % ouško levé síně (5).
Orální antikoagulační terapie antagonisty vitaminu K je efektivní prevencí CMP a redukuje riziko jejího vzniku přibližně o dvě třetiny (6). Velké randomizované studie porovnávající warfarin a nová (direktní) antikoagulancia (NOAK nebo DOAK: dabigatran, apixaban, rivaroxaban a edoxaban) prokázaly noninferioritu těchto preparátů v prevenci CMP a systémové embolizace v porovnání s antagonisty vitaminu K (7).
Antikoagulační terapie představuje riziko krvácivých komplikací. Roční riziko veškerých klinicky relevantních krvácení při dlouhodobé terapii antagonisty vitaminu K se pohybuje v rozmezí 10–17 % (8), při léčbě DOAK přibližně kolem 12 % (9). Roční riziko závažných krvácivých komplikací (krvácení do CNS, smrtelné krvácení či krvácení do kritických orgánů) se dle výše zmíněných randomizovaných studií porovnávajících warfarin s DOAK pohybuje při terapii antagonisty vitaminu K od 3,09 % do 3,61 %, při terapii dabigatranem činilo 3,4 % (2,92 % pro redukovanou dávku), při terapii rivaroxabanem 3,6 %, při léčbě apixabanem 2,13 % a při léčbě edoxabanem 2,75 % (1,61 % pro redukovanou dávku) (7). Dle metaanalýzy těchto studií je četnost především těch nejzávažnějších krvácení při terapii DOAK nižší než při terapii warfarinem, jak je ale z výše uvedeného patrné, nejde o zanedbatelné riziko (10).
Neoptimální adherence k farmakoterapii je dalším důležitým problémem u pacientů užívajících chronicky antikoagulační léčbu. Dle práce Kimmela a spolupracovníků 36 % pacientů užívajících warfarin neužije 20 % svých dávek (11). Pfeilschifter se spolupracovníky neprokázal signifikantní rozdíl v adherenci mezi warfarinem a direktními antikoagulancii (12). Nonadherence k DOAK přitom (pro jejich krátký biologický poločas) je potencionálně zatížena horšími následky.
Rizikovost antikoagulační terapie a problematika adherence vedla k rozvoji technik okluze ouška levé síně (nejprve chirurgických, posléze perkutánních) coby nefarmakologického přístupu k prevenci CMP. Chirurgická okluze ouška levé síně se vyvíjí již 7 desetiletí. Během této doby byla vyvinuta řada technik: resekce ouška s jeho sešitím, ligace ouška (endokardiálními či epikardiálními stehy), epikardiální uzávěr pomocí stapleru a epikardiální „zaklipování“ ouška u jeho baze pomocí AtriClipu. Právě velká různorodost těchto technik a jen několik málo provedených randomizovaných studií neumožňují dodnes jednoznačný závěr stran chirurgické okluze ouška. Některé techniky (především ligace ouška) jsou jednoznačně neefektivní v prevenci CMP (některá observační data dokonce poukazují na horší prognózu pacientů po ligaci ouška ve srovnání s ponecháním ouška in situ) (13). Na druhou stranu dle několika menších randomizovaných studií a řady observačních studií je chirurgická okluze vhodnějšími technikami (resekce či uzávěr AtriClipem) spojena s nižším rizikem výskytu kardioembolizační příhody (14).
Ouško levé síně (anatomie, patofyziologie)
Ouško levé síně je komplexní struktura lišící se od zbytku levé síně svým embryologickým vývojem, anatomickými i patofyziologickými vlastnostmi. Z embryologického hlediska je ouško levé síně derivátem primitivního levého atria, zatímco zbytek levé síně se vyvíjí z embryonální plicní žíly (15, 16).
Ouško levé síně je za normálních okolností menší než ouško síně pravé. U pacientů s FS dosahuje dle post mortem analýz až třikrát většího objemu než u ostatní populace (17). U většiny pacientů ouško levé síně směřuje anterosuperiorním směrem a překrývá ramus interventricularis anterior, ramus circumflexus, v. cordis magna a částečně výtokový trakt pravé komory (Obr. 1). Méně často levé ouško směřuje laterálním nebo dorzálním směrem (18).
Image 1. Topografie ouška levé síně 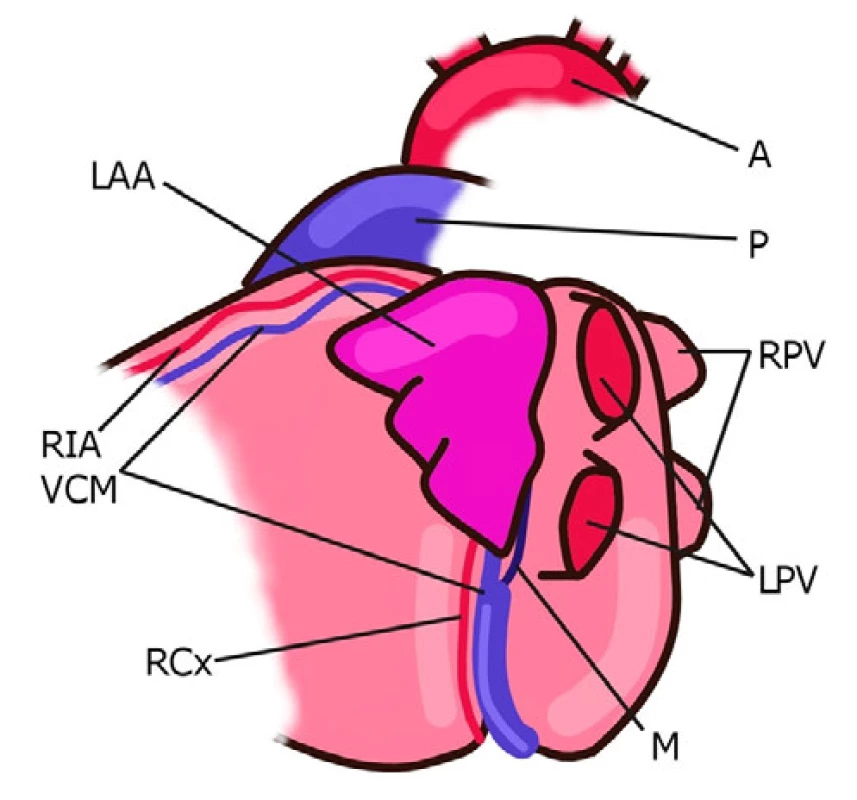
A – aorta, P – truncus pulmonalis, LAA – ouško, RIA – ramus interventricularis anterior, RCx – ramus circumflexus, VCM – v. cordis magna, M – Marshallovo ligamentum, LPV – levé plicní žíly, RPV – pravé plicní žíly Na riziku vzniku trombu v oušku se podílí pravděpodobně již jeho anatomie. Di Biase se spolupracovníky rozdělili morfologii ouška do základních tvarů (chicken wing, cactus, windsock, cauliflower). Tito autoři publikovali v roce 2012 výsledky multicentrické studie sledující prevalenci jednotlivých morfologických typů ouška levé síně a jejich asociaci s anamnézou ischemické CMP. Tato práce analyzující nálezy magnetické rezonance (MRI) nebo výpočetní tomografie (CT) u 932 pacientů ukázala nerovnoměrnou distribuci jednotlivých morfologických typů ouška levé síně s následujícími relativními četnostmi: „chicken wing“ 48 %, „cactus“ 30 %, „windsock“ 19 % a „cauliflower“ 3 %. Morfologický typ „chicken wing“ byl asociován se signifikantně nižším rizikem ischemické CMP v porovnání s ostatními typy. Již tedy morfologická klasifikace by mohla být použita ke stratifikaci rizika kardioembolizační příhody. Bohužel, posouzení morfologie ouška je zatíženo výraznou interindividuální variabilitou ze strany vyšetřujícího, což tuto klasifikaci činí obtížně použitelnou v běžné klinické praxi (19).
Role ouška levé síně v hemodynamice srdeční revoluce sestává z pasivní a aktivní komponenty. Ouško zvyšuje compliance síně, což bylo prokázáno v animálním experimentu (20), a představuje rezervoár během systoly levé komory. Na konci enddiastoly levé komory srdeční ouško levé síně augmentuje její plnění aktivní kontrakcí (15). Při sinusovém rytmu lze pomocí jícnové echokardiografie identifikovat bifazickou ejekci (na počátku diastoly komor a při systole síní), plnění ouška (po systole síní) a vlny o nižších rychlostech během systoly komor (21). U zdravých jedinců dosahuje výtoková rychlost ouška hodnot přes 50 cm/s. Při FS je typicky patrný „pilovitý“ charakter průtoku ouškem, rychlost plnění i vyprazdňování ouška je výrazně snížena (plnění a vyprazdňování ouška při fibrilaci síní je dáno nasávacím efektem komory a ne aktivní kontrakcí svaloviny ouška). U pacientů s pokročilou remodelací levé síně a vysokým rizikem kardioembolické příhody je plnící a ejekční rychlost průtoku výrazně snížena (22). Echokardiografická subanalýza studie SPAF III (Stroke prevention in atrial fibrillation III) prokázala, že ejekční rychlosti ouška levé síně pod 20 cm/s jsou nezávislým prediktorem tromboembolického rizika (23).
Ouško levé síně hraje roli v neurohumorální regulaci cirkulace. Napětí stěny ouška vede prostřednictvím mechanoreceptorů k sekreci natriuretických peptidů. Kardiomyocyty se sekrečními granuly jsou lokalizovány v obou srdečních síních, jejich největší koncentrace je právě v oušku (24).
Ouško levé síně může mít u některých pacientů taktéž proarytmogenní efekt. Může být jedním ze spouštěčů FS (tzv. non-PV trigger – struktura s arytmogenním potenciálem se schopností iniciovat a udržovat FS síní, která není plicní žilou) a je možným cílem selektivní ablace u pacientů s neparoxysmální FS. Lze provést jak ablaci jednotlivých fokusů v oušku, tak kompletní elektrickou izolaci (podobně jako se provádí izolace plicní žíly). Některé mechanické systémy okluze (Lariat či AtriClip) dokáží ouško nejen mechanicky uzavřít, ale zároveň elektricky odizolovat (25). Metaanalýza 7 studií publikovaná v roce 2016 prokázala signifikantní redukci rekurence FS nebo síňové tachykardie u pacientů, u kterých byla součástí ablační procedury elektrická izolace ouška levé síně (26). Bohužel v témže roce Rillig se spolupracovníky publikovali práci, která dokumentuje zvýšené riziko iktu na podkladě trombózy ouška právě u pacientů po elektrické izolaci ouška levé síně (27). U těchto pacientů dochází k úplné absenci elektrické aktivity v oušku. Navzdory antikoagulační léčbě byl u nich ve 21 % identifikován echokardiograficky trombus v nekontrahujícím se oušku během průměrného 6,5měsíčního sledování. Nebyla pozorována asociace mezi četností rekurence FS síní nebo síňové tachykardie a rozvojem trombózy ouška, vznik trombu byl tedy pravděpodobně zapříčiněn pouze a jen absencí elektrické (a tedy mechanické) aktivity ouška. Ve světle výsledků této práce by po elektrické izolaci ouška levé síně měla být zvážena implantace okludéru.
Perkutánní okluze ouška levé síně
Jelikož, jak je výše uvedeno, představuje ouško levé síně predilekční místo vzniku trombu, je již od 50. let 20. století věnována pozornost technikám jeho uzavření. Tyto první techniky byly prováděny kardiochirurgickou cestou, od 90. let se následně objevují techniky katetrizační.
Evropská doporučení pro FS z roku 2016 umožňují zvážit perkutánní okluzi ouška levé síně u pacientů s kontraindikací chronické antikoagulační terapie (třída doporučení IIb, úroveň důkazů B) (7). Aktualizovaná doporučení ACC/AHA/HRS pro management FS z roku 2019 též doporučují (ve stejné třídě doporučení a při stejné úrovni důkazů) zvážit implantaci okludérů u pacientů se zvýšeným rizikem ischemické CMP a s kontraindikací chronické antikoagulační terapie. Je zde též komentováno, že takto rizikoví pacienti nebyli zahrnuti v randomizovaných studiích, nicméně přibývá důkazů o bezpečnosti kratších a méně intenzivních režimů antitrombotické terapie po implantaci (28). Dle AHA/ASA doporučení z roku 2014 pro CMP a jejich prevenci je role perkutánní okluze ouška levé síně v prevenci CMP nejistá a vystupuje zde ve třídě doporučení IIb při úrovni důkazů B (29). Relativně nízká třída doporučení implantace okludéru je dána absencí velkých randomizovaných studií srovnávající antikoagulační léčbu s uzávěrem ouška. Na toto téma byly provedeny jen 2 středně velké studie a několik prospektivních observačních.
Katetrizační uzávěr se provádí v celkové anestezii, hlubší či jen mělké analgosedaci. O typu sedace většinou rozhoduje použití ultrazvukové zobrazovací metody, zákrok lze provést jak pomocí TEE (Obr. 2), tak pomocí intrakardiální echokardiografie (ICE). Zatímco použití TEE vyžaduje celkovou anestezii (nebo alespoň hlubší analgosedaci), při navigaci ICE stačí jen velmi mělká analgosedace. Pacienti podstupující zákrok užívají bezprostředně před výkonem antitrombotickou terapii v různorodých režimech. Zatímco někteří užívají standardní perorální antikoagulaci, někteří užívají pouze antiagregaci a část pacientů je před procedurou zcela bez antitrombotické terapie. Standardní antikoagulace je před zákrokem zpravidla vysazena a přemostěna pomocí nízkomolekulárního heparinu.
Image 2. Nález z transezofageální echokardiografie 3 měsíce po úspěšném uzávěru ouška (vlevo okludérem Watchman, vpravo okludérem Amulet) 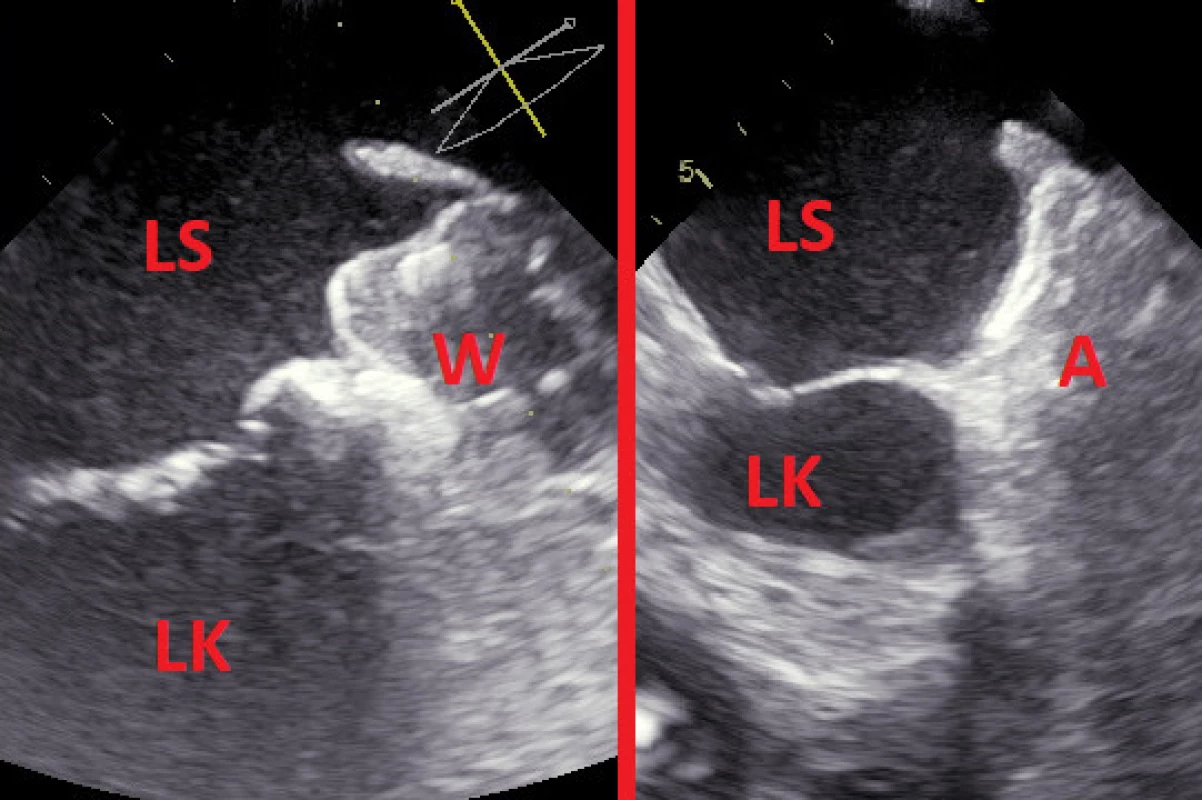
LS – levá síň, LK – levá komora, W – Watchman, A – Amulet Samotná procedura je zahájena punkcí femorální žíly. Navigace je kromě výše uvedené ultrazvukové taktéž skiaskopická s možností angiografie. Řada pracovišť kromě toho ještě provádí většině pacientů CT srdce se zaměřením na ouško. Pomocí transseptální punkce (obvykle v inferoposteriorní nebo alespoň inferiorní části interatriálního septa, aby byla zajištěna optimální posteroanteriorní trajektorie sheathu (30)) je zajištěn přístup do levé síně. Přes vodič je do levé síně zaveden sheath pro implantaci okludéru (10–14 F dle typu a velikosti). Je provedena angiografie ouška levé síně obvykle s použitím pigtail katétru. Po posouzení morfologie ouška a především jeho šíře v místě předpokládaného umístění (tzv. landing zone) je pomocí angiografie a periprocedurální echokardiografie implantován okludér. Je zhodnocena jeho fixace v oušku (tzv. tug test) a echokardiograficky zkontrolována přítomnost leaku. V případě uspokojivé pozice okludéru je tento následně uvolněn od zaváděcího instrumentaria.
Výčet možných komplikací výkonu zahrnuje spektrum stavů od benigních hematomů v třísle po tamponující hemoperikard. Punkce femorální žíly může být komplikována rozvojem hematomu, při punkci tepny je možný rozvoj pseudoaneuryzmatu nebo arteriovenózní píštěle. Další možnou komplikací cévního přístupu je retroperitoneální krvácení. Transseptální punkce a manipulace s instrumentariem v levé síni nese riziko perforace s následným hemoperikardem, embolizaci vzduchu nebo tromboembolů především do centrálního nervového systému (s rozvojem periprocedurálního iktu) nebo do koronárního řečiště (nejčastěji pravá koronární tepna s následujícím rozvojem STEMI). Samotná implantace okludéru může vést k perforaci ouška s následným hemoperikardem, poranění ramus circumflexus a existuje také riziko embolizace okludéru při jeho uvolnění. Vzácně se vyskytují odložené tamponující hemoperikardy, které jsou dle některých zdrojů častěji přítomny u pacientů se sinusovým rytmem v důsledku vyšší kontraktility ouška (31).
Mezi nejpoužívanější okludéry ouška levé síně v současné době patří systém WatchmanTM (Boston Scientific, Marlborough, MA, USA), AmplatzerTM Cardiac Plug a Amplatzer Amulet (St. Jude Medical-Abbot, St Paul, MN, USA) a Lariat® (SentreHEART, Palo Alto, CA, USA), blíže se těmto systémům bude věnovat následující text.
Watchman
Systém Watchman byl vyvinut v roce 2002, jde o samoexpanzivní nitinolovou strukturu opatřenou stabilizačními kotvičkami na povrchu (Obr. 3). Pilotní studie systému Watchman PROTECT AF (Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation) byla historicky první randomizovaná studie okludéru ouška levé síně (32). Zahrnula 707 pacientů, kteří byli 2 : 1 randomizováni k implantaci okludéru nebo ke konvenční terapii antagonistou vitaminu K. Necelá polovina pacientů byla starší 75 let, přibližně čtvrtina pacientů měla anamnézu srdečního selhání a, co se týká rizika kardioembolizace, šlo spíše o méně rizikovou populaci (přibližně u dvou třetin pacientů v obou ramenech bylo CHA2DS2-VASc skóre 1 nebo 2). Průměrná doba sledování činila 18 měsíců. Primární cíl účinnosti byl definován jako iktus, systémová embolizace nebo kardiovaskulární či neobjasněné úmrtí. Stran efektivity terapie studie prokázala noninferioritu okluze ouška systémem Watchman oproti terapii antagonistou vitaminu K. Studie též prokázala trend ke zlepšení kardiovaskulární i celkové mortality v intervenčním rameni. Nicméně byl také pozorován vyšší výskyt primárních bezpečnostních cílů (závažné krvácení nebo komplikace procedury) v intervenčním rameni studie oproti kontrolní skupině (7,4 %, resp. 4,4 %). Z jednotlivých složek primárního kompozitního bezpečnostního cíle byl nejčastější rozvoj hemoperikardu (4,8 % pacientů).
Image 3. Okludér Watchman a schéma jeho implantace do ouška levé síně (publikováno se souhlasem společnosti Boston Scientific) 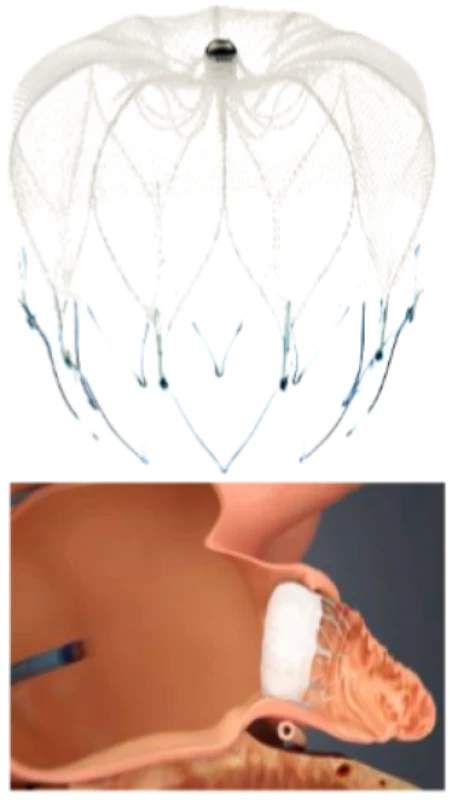
Další prospektivní randomizovaná studie PREVAIL (Prospective Randomized Evaluation of the Watchman LAA Closure Device in Patients with Atrial Fibrillation vs Long-Term Warfarin Therapy) obsahovala 407 pacientů (33). Design studie byl obdobný jako v případě PROTECT AF. Z hlediska efektivity nebyla prokázána noninferiorita intervenční terapie pro primární kompozitní cíl (iktus, systémová embolizace nebo kardiovaskulární či neobjasněné úmrtí), pro sekundární cíl (iktus nebo systémová embolizace) bylo noniferiority dosaženo. Hlavním důvodem, proč nebyla noninferiorita pro primární cíl dosažena, nebyla vysoká frekvence endpointů v intervenční větvi, ale praktická absence endpointů v kontrolní větvi pacientů léčených warfarinem. Důležitá data poskytla tato práce především z hlediska bezpečnosti intervenční terapie. Výskyt bezpečnostních cílů ve skupině pacientů podstoupivších implantaci okludéru činil 4,5 %. Pokles četnosti komplikací ve srovnání se studií PROTECT AF bývá nejčastěji vysvětlován vyšší zkušeností operatérů a lepšími zobrazovacími metodami v době zařazování pacientů do studie PREVAIL.
Schéma antitrombotické terapie po implantaci okludéru bylo v obou výše zmíněných studiích stejné: 45 dnů po implantaci warfarin, dále do 6. měsíce duální antiagregace acetylsalicylovou kyselinou a clopidogrelem; po 6. měsíci pacienti užívali pouze acetylsalicylát. V roce 2013 byla publikována studie ASAP (ASA Plavix Feasibility Study with Watchman Left Atrial Appendage Closure Technology), která testovala použití okludéru Watchman u pacientů s FS a kontraindikací systémové antikoagulace (pacienti s kontraindikací k warfarinu byli z ROCKET a PREVAIL vyloučeni) (34). V této prospektivní nerandomizované studii pacienti po implantaci okludéru užívali 6 měsíců duální antiagregaci acetylsalicylátem a clopidogrelem, následně dlouhodobě pouze kyselinu acetylsalicylovou. Očekávaná roční incidence ischemického iktu pro danou studijní populaci činila 7,3 % (průměrné CHA2DS2-VASc skóre 2,8), pozorovaná četnost ischemického iktu ve studii ASAP byla nicméně pouze 1,7 % (77% relativní redukce rizika). Výsledky prokazují efektivitu antitrombotického režimu bez použití warfarinu bezprostředně po implantaci okludéru.
V metaanalýze studie PREVAIL a PROTECT AF nebyl stran efektivity pozorován během dalšího 5letého sledování signifikantní rozdíl ve výskytu primárního kompozitního cíle, byl ale pozorován signifikantní rozdíl ve prospěch intervenční terapie v četnosti hemoragických iktů, úmrtí z jakékoliv příčiny, iktů se závažným neurologickým reziduem nebo závažných krvácení bez asociace s intervenční procedurou (35).
Jinou velkou studií s tímto typem okludéru byla studie EWOLUTION. Ta se zaměřovala především na akutní úspěch implantace a na akutní bezpečnost. Úspěšnost implantace v této studii byla nejvyšší z doposud zmíněných (98 %), navíc byla pozorována též nejnižší četnost komplikací v prvních 7 dnech po implantaci (2,7 %). Výsledky stran efektu uzávěru ouška na výskyt kardioembolizační příhody nebyly autory publikovány (36).
Amplatzer Cardiac Plug a Amulet
Amplatzer Cardiac Plug a Amulet (jeho modernější 2. generace) jsou samoexpanzní systémy z nitinolu, sestávají z proximální diskovité části a distální části. Distální část je opatřena stabilizačními háčky (Obr. 4).
Image 4. Okludér Amulet a schéma jeho implantace do ouška levé síně (publikováno se souhlasem společnosti St. Jude Medical-Abbot) 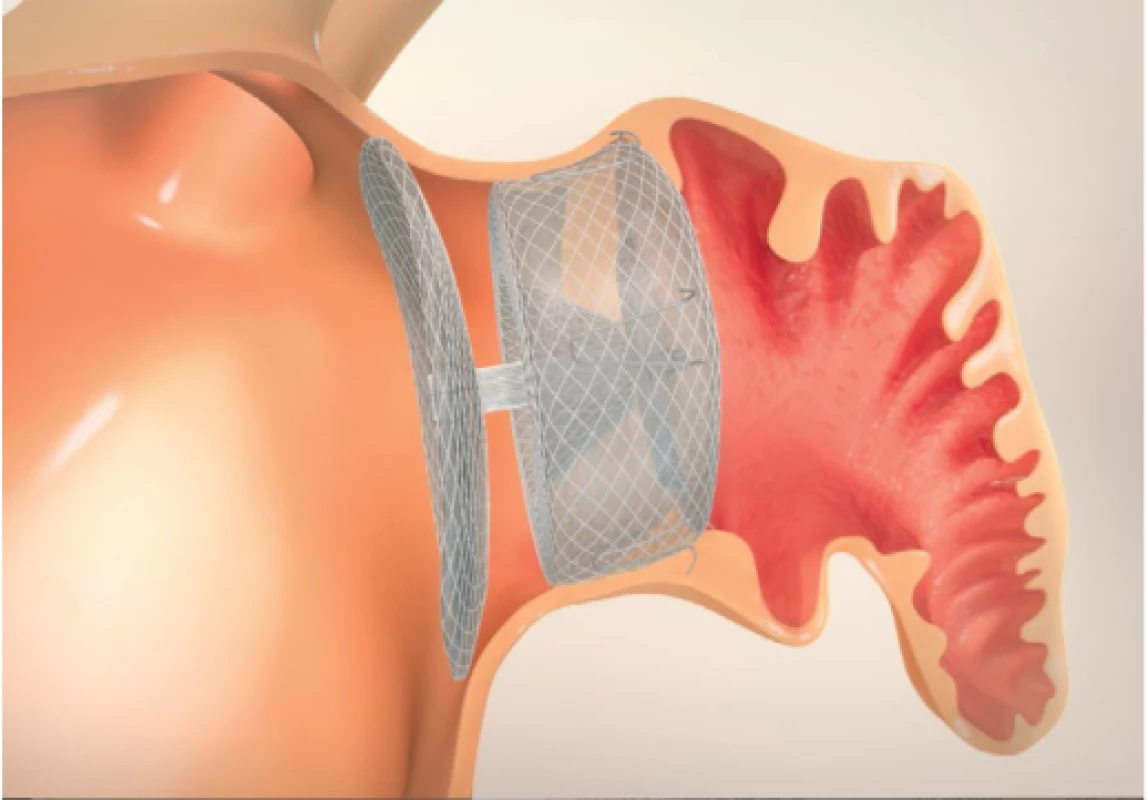
Efektivita a bezpečnost systému Cardiac Plug respektive Amulet byla testována několika nonrandomizovanými observačními studiemi. Asi nejcitovanější je práce, kterou publikoval Tzikas se spolupracovníky v roce 2015. Jde o nonrandomizovanou retrospektivní observační multicentrickou studii zahrnující 1 047 konsekutivních pacientů s FS (37). Roční výskyt iktů nebo systémových embolizací byl u studijní populace 2,3 % (59% relativní redukce rizika oproti predikovaným 5,62 % na základě CHA2DS2-VASc) a roční výskyt krvácivých komplikací studijní populace činil 2,08 % (61% relativní redukce rizika oproti 5,34 % predikovaným na základě HAS-BLED).
Výskyt komplikací byl pozorován u 4,97 % pacientů. Antitrombotická strategie po implantaci tohoto systému je poměrně odlišná od antitrombotické léčby po implantaci okludéru Watchman. Spočívá dle doporučení výrobce v duální antiagregační terapii 1–6 měsíců od výkonu (v průměru 3 měsíce) a dále antiagregační monoterapii nebo žádné antitrombotické léčbě (38). Tento režim antitrombotické terapie po implantaci okludéru Amulet je používán ve většině center. Existují důkazy o absenci vyššího rizika kardioembolizace při redukce duální antiagregační terapie po implantaci na 6 týdnů či dokonce pouze při monoterapii kyselinou acetylsalicylovou (39, 40).
Aktuálně probíhá randomizovaná studie s názvem Amulet IDE s cílem prokázat noninferioritu Amplatzerova okludéru oproti systému Watchman.
Lariat
Systém Lariat umožňuje ligaci ouška levé síně s využitím kombinovaného endokadriálního i epikardiálního přístupu. Po zajištění trans septálního a perikardiálního přístupu je endovazálně do ouška zaveden vodič na konci opatřený balónem a magnetem. Ostium ouška je okludováno balónem, pomocí magnetu je endovazální systém připojen k vodiči v perikardiálním vaku. Následně je na ostium ouška levé síně naložena epikardiální cestou sutura (pouze ta je ponechána in situ, ostatní instrumentarium je extrahováno).
Efektivita a bezpečnost systému byla sledována v několika observačních studiích s relativně malými populacemi pacientů. Srivastava se spolupracovníky v roce 2015 analyzoval do té doby publikované práce se soubory nad 10 pacientů (41). Úspěšnost procedury dosahovala 94 %, dobrý efekt (leak do 5 mm) přetrvával během sledování u 98 % pacientů, četnost akutních komplikací dosahovala 14,7 % (7,5 % hemoperikard) a četnost komplikací během dlouhodobého sledování činila 9,9 %. Antitrombotické režimy po proceduře jsou napříč analyzovanými pracemi individualizovány, zde nepanuje jasný konsenzus.
Naložení sutury a její dotažení vede ve většině případů k akutní redukci elektrických signálů registrovaných uvnitř levého ouška a k eliminaci propagace elektrického vzruchu na zbytek levé síně při stimulaci z ouška (42). Existují důkazy o redukci zátěže fibrilace síní u pacientů po ligaci ouška systémem Lariat (43).
Další v současné době dostupné perkutánní okludéry
Kromě okludérů Watchman a Amulet bylo v poslední vyvinuto několik dalších systémů určených k uzávěru ouška levé síně. Patří k nim WaveCrest Left Atrial Appendsge Occlusion System (Coherex Medical, Salt Lake City, UT, USA), dále LAmbre LAA Closure system (Lifetech Scientific, Shenzhen, Čína) a Occlutech LAA occluder (Occlutech, Helsingborg, Švédsko). Všechny 3 již taktéž obdržely CE-mark k možnému klinickému použití v EU. Reálné klinické zkušenosti s těmito novými typy okludérů jsou ovšem velmi omezené, zejména ve srovnání s dominantně používanými okludéry Watchman a Amulet.
Současné probíhající studie
V posledních 2 letech bylo zahájeno několik randomizovaných multicentrických prospektivních studií a observačních prospektivních registrů. Níže uvádíme nejdůležitější z nich.
Recentně byl dokončen náběr pacientů v prospektivní randomizované multicentrické studii PRAGUE-17 probíhající v České republice. Studie randomizuje pacienty s fibrilací síní rizikové stran kardioembolizace nebo s anamnézou závažného krvácení k perkutánní okluzi ouška levé síně nebo k terapii DOAK. Další důležitou práci patří švédská randomizovaná studie „Prevention of Stroke by Left Atrial Appendage Closure in Atrial Fibrillation Patients After Intracerebral Hemorrhage: A Multicenter Randomized Clinical Trial“ zahájená v roce 2017. Cílovou populací jsou pacienti s fibrilací síní a anamnézou intrakraniálního krvácení, kteří jsou randomizováni ke katetrizačnímu uzávěru ouška či „best medical care“. Další podstatnou studií je dánská studie OCCLUSION-AF zahájená v roce 2018. Pacienti s fibrilací síní a anamnézou ischemické CMP či tranzitorní ischemické ataky jsou v této studii randomizováni ke katetrizačnímu uzávěru ouška či léčbě DOAK. Velmi důležitou studií je americká studie ASAP-TOO; pacienti s fibrilací síní kontraindikováni či nevhodní k antikoagulační terapii jsou randomizováni ke katetrizačnímu uzávěru nebo k antiagregační léčbě jedním lékem či žádné antitrombotické léčbě. Poslední z vybraných důležitých studií je multicentrická německá studie CLOSURE-AF. Je určena pro pacienty s FS s indikací k antikoagulaci, kteří jsou následně randomizováni k LAAO či léčbě antikoagulací (DOAK či Warfarin).
Praktická doporučení – koho referovat ke katetrizační okluzi ouška
V souladu s aktuálními doporučeními ESC a HRS je implantace okludéru ouška levé síně určena pro pacienty se zvýšeným rizikem ischemické CMP (např. pacienti již po prodělaném ischemickém iktu), u kterých je kontraindikována chronická antikoagulační terapie (nejčastěji pro anamnézu závažného krvácení). Pacient indikovaný k této léčebné modalitě by měl tolerovat krátkodobou antikoagulaci nebo duální antiagregační terapii následující po implantaci okludéru. Indikace okluze ouška levé síně coby prostá alternativa antikoagulační terapie u pacientů bez kontraindikace této léčby není v současné době ve většině center uznávána, i když právě pro tuto indikaci máme ze studií PROTECT a PREVAIL nejvíce důkazů, a v této indikaci je taktéž uznávána americkou FDA.
Závěr
Perkutánní okluze ouška levé síně představuje alternativu systémové antikoagulace v prevenci CMP nebo systémové embolizace především u pacientů s fibrilací síní netolerujících chronickou antikoagulační terapii. Několik otázek zůstává nicméně stále nezodpovězeno. Randomizované studie byly provedeny pouze u systému Watchman, a nebyli v nich zahrnuti pacienti s absolutní kontraindikací antikoagulační terapie, což je ze současného klinického pohledu významná populace nemocných indikovaných k implantaci okludéru. Tento fakt vede k jisté zdrženlivosti aktuálních doporučení stran perkutánní okluze ouška levé síně. Nepanuje též zcela jednoznačný konsenzus stran optimálního antitrombotického režimu po implantaci okludéru. Kontrolní ramena studií dosud představovali pacienti užívající antagonisty vitaminu K, proto v současné době probíhají randomizované studie porovnávající účinnost okludérů ouška levé síně s DOAK.
Podpořeno výzkumným grantem Agentury pro zdravotnický výzkum (AZV) číslo 15-29565A ministerstva zdravotnictví České republiky.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Pavel Osmančík, Ph.D.,
Kardiocentrum, III. interní – kardiologická klinika III. LF UK a FN Královské Vinohrady
Šrobárova 50,
100 34 Praha 10
Cit. zkr: Vnitř Lék 2020; 66(6): e3–e9
Článek přijat redakcí: 30. 3. 2018
Článek přijat po recenzích k publikaci: 23. 9. 2019
Sources
1. Lloyd-Jones DM, Wang TJ, Leip EP, et al. Lifetime Risk for Development of Atrial Fibrillation. Circulation 2004; 110 : 1042–1046.
2. Staerk L, Wang B, Preis SR, et al. Lifetime risk of atrial fibrillation according to optimal, borderline, or elevated levels of risk factors: cohort study based on longitudinal data from the Framingham Heart Study. BMJ 2018; k1453. https://doi.org/10.1136/bmj.k1453
3. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22 : 983–988.
4. Libby P, Braunwald E. Braunwald’s heart disease: A textbook of cardiovascular medicine (8th ed.). Philadelphia, Pa 2008, Edinburgh: Saunders Elsevier
5. Blackshear JL, Odell JA. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. The Annals of Thoracic Surgery 1996; 61 : 755–759.
6. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: Antithrombotic Therapy to Prevent Stroke in Patients Who Have Nonvalvular Atrial Fibrillation. Annals of Internal Medicine 2007; 146 : 857.
7. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal 2016; 37 : 2893–2962.
8. Rubboli A. Incidence, clinical impact and risk of bleeding during oral anticoagulation therapy. World Journal of Cardiology 2011; 3 : 351.
9. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus Warfarin in Nonvalvular Atrial Fibrillation. New England Journal of Medicine 2011; 365 : 883–891.
10. Hicks T, Stewart F, Eisinga A. NOACs versus warfarin for stroke prevention in patients with AF: a systematic review and meta-analysis. Open Heart 2016; 3: e000279.
11. Kimmel SE. The Influence of Patient Adherence on Anticoagulation Control With Warfarin. Archives of Internal Medicine 2007; 167 : 229.
12. Pfeilschifter LS, Hohmann C, Niemann D, et al. Adherence to oral anticoagulant therapy in secondary stroke prevention dash; impact of the novel oral anticoagulants. Patient Preference and Adherence 2015; 1695. https://doi.org/10.2147/ppa.s88994
13. Katz ES, Tsiamtsiouris T, Applebaum RM, et al. Surgical left atrial appendage ligation is frequently incomplete: a transesophageal echocardiographic study. Journal of the American College of Cardiology 2000; 36 : 468–471.
14. Friedman DJ, Piccini JP, Wang T, et al. Association Between Left Atrial Appendage Occlusion and Readmission for Thromboembolism Among Patients With Atrial Fibrillation Undergoing Concomitant Cardiac Surgery. JAMA 2018; 319 : 365.
15. Regazzoli D, Ancona F, Trevisi N, et al. Left Atrial Appendage: Physiology, Pathology, and Role as a Therapeutic Target. BioMed Research International 2015; 2015 : 1–13.
16. Sadler TW, Langman J. Langman’s medical embryology (12th ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins 2012.
17. Ho SY, Cabrera JA, Sanchez-Quintana D. Left Atrial Anatomy Revisited. Circulation: Arrhythmia and Electrophysiology 2012; 5 : 220–228.
18. Beigel R, Wunderlich NC, Ho SY, et al. The Left Atrial Appendage: Anatomy, Function, and Noninvasive Evaluation. JACC: Cardiovascular Imaging 2014; 7 : 1251–1265.
19. Di Biase L, Santangeli P, Anselmino M, et al. Does the Left Atrial Appendage Morphology Correlate With the Risk of Stroke in Patients With Atrial Fibrillation? Journal of the American College of Cardiology 2012; 60 : 531–538.
20. Hoit BD, Shao Y, Tsai LM, et al. Altered left atrial compliance after atrial appendectomy. Influence on left atrial and ventricular filling. Circ Res 1993; 72 : 167–175.
21. Bansal M, Kasliwal RR. Echocardiography for left atrial appendage structure and function. Indian Heart Journal 2012; 64 : 469–475.
22. García-fernández MA, Torrecilla EG, San román D et al. Left atrial appendage Doppler flow patterns: implications on thrombus formation. Am Heart J 1992; 124 : 955–961.
23. Transesophageal echocardiographic correlates of thromboembolism in high-risk patients with nonvalvular atrial fibrillation. The Stroke Prevention in Atrial Fibrillation Investigators Committee on Echocardiography. Ann Intern Med 1998; 128 : 639–647.
24. Chapeau C, Gutkowska J, Schiller PW, et al. Localization of immunoreactive synthetic atrial natriuretic factor (ANF) in the heart of various animal species. J Histochem Cytochem 1985; 33 : 541–550.
25. Calkins H, Hindricks G, Cappato R, et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Heart Rhythm 2017; 14: e275–e444.
26. Friedman DJ, Black-Maier EW, Barnett AS, et al. Left Atrial Appendage Electrical Isolation for Treatment of Recurrent Atrial Fibrillation. JACC: Clinical Electrophysiology 2018; 4 : 112–120.
27. Rillig A, Tilz RR, Lin T, et al. Unexpectedly High Incidence of Stroke and Left Atrial Appendage Thrombus Formation After Electrical Isolation of the Left Atrial Appendage for the Treatment of Atrial Tachyarrhythmias. Circulation: Arrhythmia and Electrophysiology 2016; 9: https://doi.org/10.1161/circep.115.003461
28. January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation. Circulation 2019; https://doi.org/10.1161/cir.0000000000000665
29. Kernan WN, Ovbiagele B, Black HR, et al. Guidelines for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack. Stroke 2014; 45 : 2160–2236.
30. Alkhouli M, Rihal CS, Holmes jr. DR. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions 2016; 9 : 2465–2480.
31. Perrotta L, Bordignon S, Dugo D, et al. Complications From Left Atrial Appendage Exclusion Devices. Journal of atrial fibrillation 2014; 7 : 1034.
32. Holmes DR, Reddy VY, Turi ZG, et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial. The Lancet 2009; 374 : 534–542.
33. Holmes jr. DR, Kar S, Price MJ, et al. Prospective Randomized Evaluation of the Watchman Left Atrial Appendage Closure Device in Patients With Atrial Fibrillation Versus Long-Term Warfarin Therapy. Journal of the American College of Cardiology 2014; 64 : 1–12.
34. Reddy VY, Möbius-Winkler S, Miller MA, et al. Left Atrial Appendage Closure With the Watchman Device in Patients With a Contraindication for Oral Anticoagulation. Journal of the American College of Cardiology 2013; 61 : 2551–2556.
35. Reddy VY, Doshi SK, Kar S, et al. 5-Year Outcomes After Left Atrial Appendage Closure. Journal of the American College of Cardiology 2017; 70 : 2964–2975.
36. Boersma LVA, Schmidt B, Betts TR, et al. Implant success and safety of left atrial appendage closure with the WATCHMAN device: peri-procedural outcomes from the EWOLUTION registry. European Heart Journal 2016; 37 : 2465–2474.
37. Tzikas A, Shakir S, Gafoor S, et al. Left atrial appendage occlusion for stroke prevention in atrial fibrillation: multicentre experience with the AMPLATZER Cardiac Plug. EuroIntervention 2016; 11 : 1170–1179.
38. Tzikas A. Left Atrial Appendage Occlusion with Amplatzer Cardiac Plug and Amplatzer Amulet: a Clinical Trials Update. Journal of Atrial Fibrillation 2017; 10: https://doi. org/10.4022/jafib.1651
39. Korsholm K, Nielsen K, Jensen J, et al. Transcatheter left atrial appendage occlusion in patients with atrial fibrillation and a high bleeding risk using aspirin alone for post-implant antithrombotic therapy. EuroIntervention 2017; 12 : 2075–2082.
40. Weise FK, Bordignon S, Perrotta L, et al. Short-term dual antiplatelet therapy after interventional left atrial appendage closure with different devices. EuroIntervention 2018; 13 : 2138–2146.
41. Srivastava MC, See VY, Dawood MY, et al. A review of the LARIAT device: insights from the cumulative clinical experience. SpringerPlus 2015; 4: https://doi.org/10.1186/s40064015-1289-8
42. Han FT, Bartus K, Lakkireddy D, et al. The effects of LAA ligation on LAA electrical activity. Heart Rhythm 2014; 11 : 864–870.
43. Afzal MR, Kanmanthareddy A, Earnest M, et al. Impact of left atrial appendage exclusion using an epicardial ligation system (LARIAT) on atrial fibrillation burden in patients with cardiac implantable electronic devices. Heart Rhythm 2015; 12 : 52–59.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 6-
All articles in this issue
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Alergie a imunopatologie – hlavní téma
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

