-
Medical journals
- Career
Nové dělení krystalopatií z pohledu nefrologa
Authors: Petra Bachroňová; Ivan Rychlík
Authors‘ workplace: I. interní klinika 3. LF UK a FN Královské Vinohrady Praha
Published in: Vnitř Lék 2020; 66(6): 371-377
Category:
Overview
Krystal je pevná látka s geometrickým tvarem, jejíž atomy, ionty nebo molekuly jsou uspořádány v pravidelné struktuře. Při náhodném uspořádání částic mluvíme o látkách amorfních, které mohou také vytvářet krystalu podobné částice. Krystalopatie je onemocnění, u kterého v patogenezi poškození tkáně hrají roli krystaly a krystalu podobné částice. Na vzniku krystalopatií se obecně podílí několik predominantních patofyziologických mechanismů: nekroinflamace, chronická remodelace tkání, která vede k jejich atrofii a jizvení, a obstrukce vývodů, dutin nebo cév většími krystalovými masami či konkrementy. Základní rozdělení krystalopatií v nefrologii je následující: renovaskulární krystalopatie (typ 1), tubulární krystalopatie (typ 2) a nakonec urolitiáza (typ 3) (Tab. 1). Problematika krystalopatií je v dnešní medicíně opomíjena nejen v kruzích široké odborné veřejnosti v oblasti vnitřního lékařství, ale také v okruhu specialistů – nefrologů, urologů a jiných. Jedním z možných důvodu může být i komplikovanost a obtížná uchopitelnost při studiu daného obsáhlého tématu, proto je cílem tohoto článku poskytnout přehled nejnovějších poznatků a možných přístupů k této problematice.
Klíčová slova:
hyperurikemie – cholesterolová embolie – krystalopatie – oxalát – tubulointersticiální nefritida – urolitiáza
Úvod
Krystal je pevná látka s geometrickým tvarem, jejíž atomy, ionty nebo molekuly jsou uspořádány v pravidelné struktuře. Při náhodném uspořádání částic mluvíme o látkách amorfních, které mohou také vytvářet krystalu podobné částice. V přírodě mohou organismy katalyzovat agregaci atomů a iontů do amorfních krystalů, ze kterých pak vytvářejí komplexní struktury, jakými jsou např. korály, kosti nebo zuby. Na nesprávném místě může být tento proces poškozující, klasickým příkladem jsou kalcifikace cévní stěny.
Krystalopatie je onemocnění, u kterého v patogenezi poškození tkáně hrají roli krystaly a krystalu podobné částice. Depozice krystalů, proteinů nebo jiných částic přenášených i vzduchem může způsobit rozličné chorobné stavy, které se mohou manifestovat jako akutní nebo chronické orgánové postižení. Pokud jde o krystaly, v ledvinách mohou indukovat značně široký rozsah poškození, a to v závislosti na lokalizaci a dynamice jejich depozice. Na vzniku krystalopatií se obecně podílí několik predominantních patofyziologických mechanismů nekroinflamace, chronická remodelace tkání, která vede k jejich atrofii a jizvení, a obstrukce vývodů, dutin nebo cév většími krystalovými masami či konkrementy. Na základě dosavadních znalostí o těchto patofyziologických mechanismech vedoucích k různým typům krystaly indukovaného renálního poškození, můžeme krystalové nefropatie rozdělit na 3 základní typy:
- renovaskulární krystalopatie (typ 1)
- tubulární krystalopatie (typ 2),
- urolitiáza (typ 3) (Tab. 1).
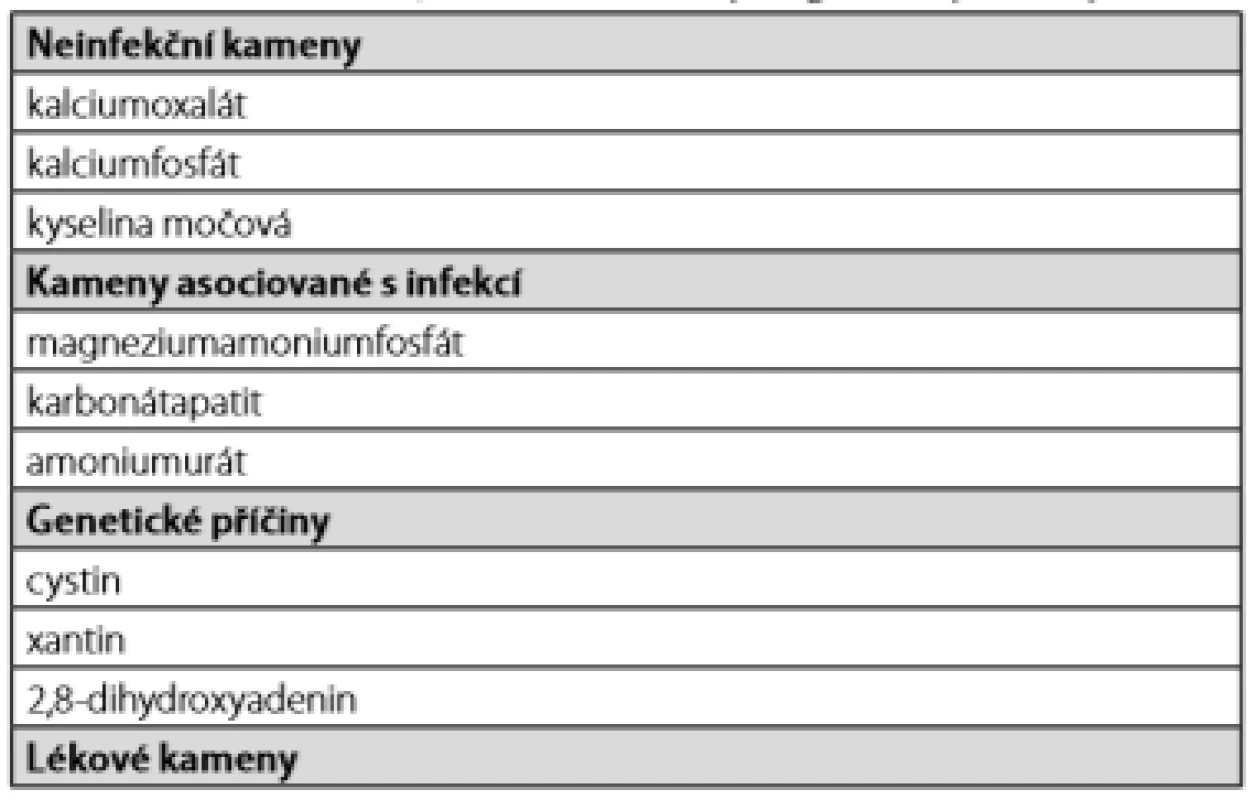
Table 1. Přehled krystalopatií v nefrologii; upraveno podle (1, 19) 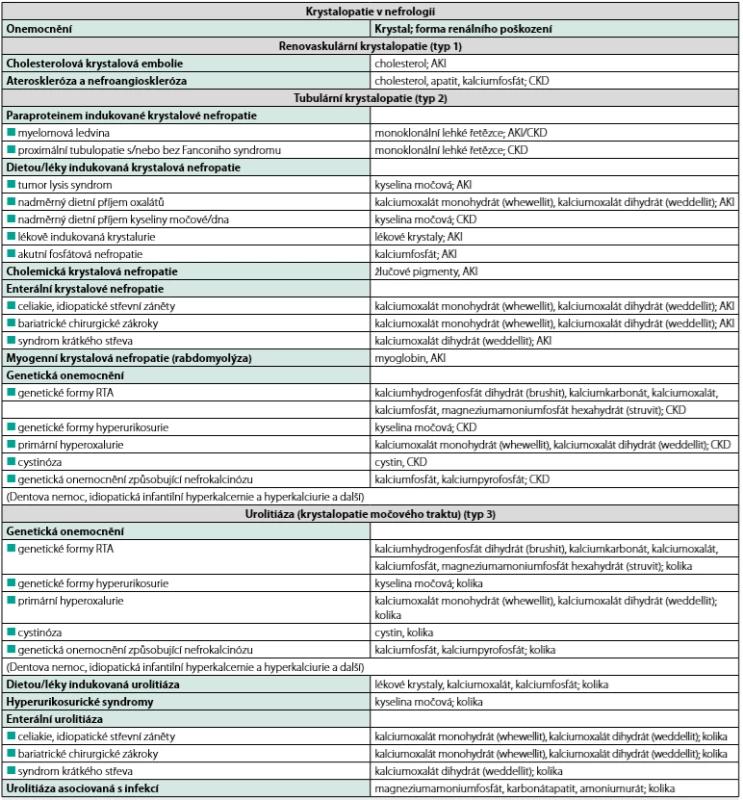
AKI – akutní renální poškození, CKD – chronické onemocnění ledvin, RTA – renální tubulární acidóza Klinicky se mohou manifestovat pod obrazem akutního renálního poškození, progresivního chronického onemocnění ledvin a formou renální koliky (1, 2).Renovaskulární krystalopatie (typ 1)
Renovaskulární poškození u tohoto typu krystalopatie je způsobené krystaly cholesterolu. Nejedná se však o typickou depozici krystalů v pravém slova smyslu, ale spíše o významnou roli cholesterolových krystalů v patogenezi dané entity.
Cholesterolová krystalová embolie
Také známá jako ateroembolická nemoc, je multisystémové onemocnění, které je charakterizované okluzí malých arterií embolií cholesterolových krystalů, pocházejících z erodovaných aterosklerotických plátů z aorty. Jedná se tedy o mikroembolizaci krystalů cholesterolu. Postižení malých arterií (150–200 mm v průměru) se může manifestovat poškozením ledvin, gastrointestinálního traktu, kůže, nervového systému a dalších orgánových soustav, ale anatomická poloha ledvin v blízkosti abdominální aorty je činí nejčastěji postiženým orgánovým systémem. Formace komplikované aterosklerotické léze je základem pro vznik cholesterolové embolie. Pláty s velkým jádrem bohatým na lipidy a tenkou fibrózní čepičkou jsou nejvíce ohroženy rupturou, ke které může dojít v důsledku různých mechanických a hemodynamických vlivů (např. vaskulární chirurgické intervence, katetrizační zákroky, rovněž i antikoagulační terapie či spontánní ruptura). Výsledkem je uvolnění základní matrix bohaté na extracelulární cholesterol. Klinické důsledky cholesterolové embolie mohou být různorodé, od asymptomatického průběhu, kdy je diagnóza stanovena na základě provedené renální biopsie, až po akutní renální poškození, které se rozvine s odstupem několika dnů v návaznosti na vyvolávající moment. Často je přítomna embolizace i do jiných částí orgánů, především do periferie řečiště končetin, např. akutní ischemie prstu („blue toe syndrome“) (3).
Ateroskleróza a nefroangioskleróza
Klinickou jednotkou typickou pro tento typ renovaskulárního poškození, kterého podkladem jsou v principu cholesterolové a jiné typy krystalů (apatit, kalciumfosfát), je stenóza renální arterie. Arteriální hypertenze je jedním z nejčastějších klinických příznaků ischemického renálního poškození v důsledku stenózy renálních arterií, kdy renální hypoperfuze indukuje perzistentní aktivaci reninangiotenzinového systému a hypertenzi. Následně perzistentní renální ischemie vede k renální atrofii a chronickému onemocnění ledvin, které je charakterizované glomerulosklerózou, ztrátou nefronů a intersticiální fibrózou (1).
Tubulární krystalopatie (typ 2)
Tubulární krystalopatie jsou výsledkem precipitace minerálů, proteinů nebo léků uvnitř tubulárního lumen (4). V závislosti na rychlosti depozice krystalů a dalších faktorů, jakými může být zejména stupeň hydratace, může dojít buď k akutnímu renálnímu poškození, nebo chronickému renálnímu onemocnění. Při akutním renálním poškození dochází k poškození renálních funkcí v důsledku akutní supersaturace glomerulárního ultrafiltrátu, která indukuje náhlý začátek formace krystalů, vedoucí k akutnímu krystaly indukovanému poškození tubulárních buněk a zánětu intersticia. Základními patofyziologickými mechanismy podílejícími se na tomto druhu renálního poškození jsou přímá a nepřímá krystalová cytotoxicita, krystaly indukovaný zánět a zánětem zprostředkovaná nekróza buněk, nekroinflamace.
Zejména u některých hematologických onemocnění či u pacientů podstupujících onkologickou léčbu pomocí chemoterapie (monoklonální gamapatie, léčba leukemie či lymfomů), je nutné pomýšlet v rámci diferenciální diagnostiky renálního poškození na přítomnost tubulárního postižení, tubulární krystalopatie. Nemoci plazmatických a B buněk vedoucí k paraproteinemii mohou způsobit různé druhy renálního poškození. Nemoci tubulů u pacientů s myelomem souvisí se zacházením s volnými lehkými řetězci (FLCs – free light chains) v průběhu tubulární části nefronu. FLCs jsou volně filtrovány glomerulem a posléze reabsorbovány a hydrolyzovány proximálními tubuly. Jejich nadprodukce vede k překročení kapacity proximálních tubulárních buněk k jejich zpracování, a ty jsou pak vyloučeny močí. Místo a konkrétní patologické renální postižení jsou specifické pro fyzikálně‑chemické vlastnosti FLCs, a důležitou roli hrají zejména pH tubulární tekutiny a koncentrace chloridu sodného. Ke vzniku tubulární krystalopatie dochází typicky při poškození distálního tubulu volnými lehkými řetězci, které je asociované s mnohočetným myelomem. Označujeme ho jako myelomovou ledvinu (myeloma cast nephropathy, light chain cast nephropathy, odlitková nefropatie). V důsledku interakce filtrovaných FLCs s Tamm‑Horsfallovým proteinem je formace tzv. odlitků (casts) v distálním tubulu s jeho následnou obstrukcí, rupturou a sekundárním zánětem (Obr. 1). Z nejnovějších poznatků vyplývá, že ke krystaly indukovanému poškození dochází i v proximální části tubulu. Může být značně široké, od jemného narušení transportních mechanismů až po buněčnou apoptózu či nekrózu, akutní renální poškození či tubulointersticiální nefritidu. Nejčastějším onemocněním proximálního tubulu asociovaným s přítomností volných lehkých řetězců je proximální tubulární acidóza, s klinickými projevy jedné nebo jako kombinace abnormalit na sodíku závislého transportu, např. bikarbonaturie, glykosurie, aminoacidurie, ztráty draslíku, fosfaturie a hyperurikosurie (částečný či kompletní Fanconiho syndrom). Hlavním patofyziologickým mechanismem je blokáda těchto transportních mechanismů FLCs přímou vazbou na membránové proteiny, ale i cytoplazmatická depozice krystalických nebo nekrystalických FLCs. Fanconiho syndrom se může vyskytovat s/bez krystalického usazování lehkého řetězce v buňkách proximálního tubulu, a naopak, ne všichni pacienti, kteří vykazují krystaly FLCs, mají vždy FS (5).
Image 1. Místa renálního poškození filtrovanými volnými lehkými řetězci v průběhu tubulu; upraveno podle (23) 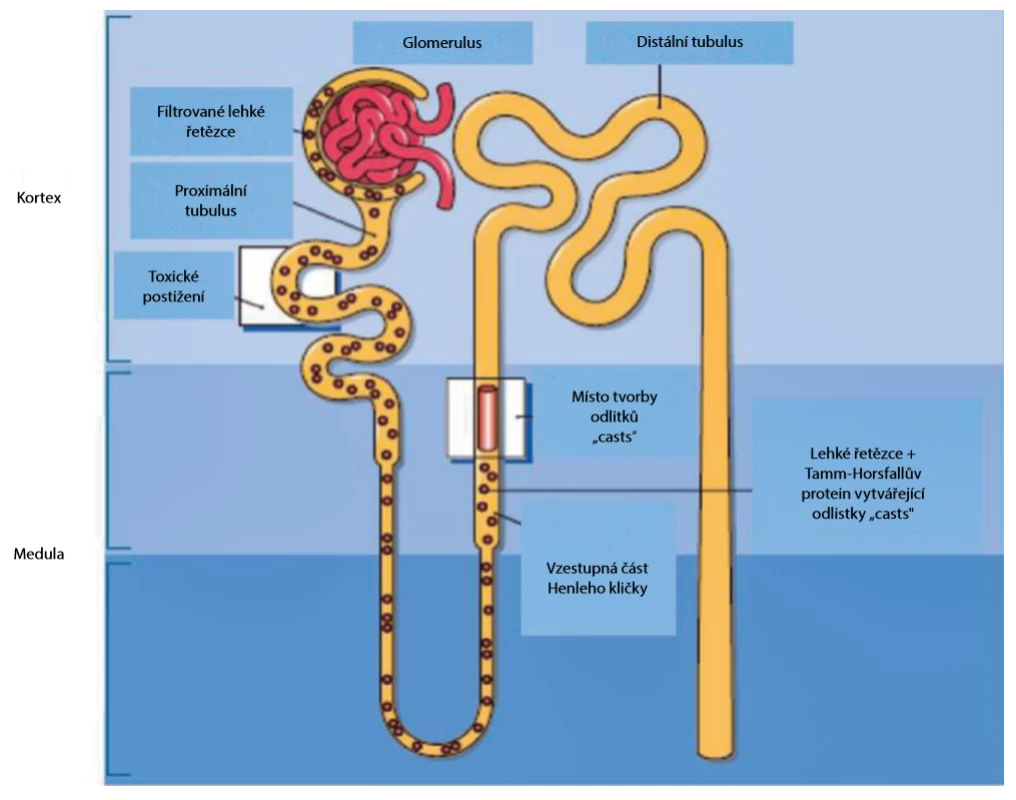
U pacientů podstupujících onkologickou léčbu chemoterapií může rovněž dojít ke vzniku tubulární krystalopatie, a to v důsledku rozvoje tumor lysis syndromu, který nastane, když nádorové buňky uvolní svůj obsah do krevního řečiště, buď spontánně, nebo v reakci na léčbu, což vede k charakteristickým nálezům – hyperurikemii, hyperkalemii, hyperfosfatemii a hypokalcemii (6). V důsledku markantního uvolňování kyseliny močové může docházet k precipitaci urátových krystalů uvnitř nefronu, zejména v podmínkách sníženého stavu hydratace, hypotenze, preexistujícího renálního poškození, snížené diurézy, což následně může vést k obstrukci distálních tubulů a sběrných kanálků.
Další skupinou pacientů, u kterých může dojít ke vzniku tubulární krystalopatie, jsou pacienti s onemocněním jater a střev. Onemocnění gastrointestinálního systému (GIT), jakými jsou celiakie, idiopatické střevní záněty, či předchozí operace GIT (bariatrická chirurgie, střevní bypass) mohou být asociovány s oxalátovou nefropatií (7). Oxalát je iont tvořící sůl kyseliny šťavelové, která může vytvářet tyto soli s různými kationty, jako je sodík, draslík, hořčík a vápník. Ačkoli oxalát sodný, šťavelan draselný a oxalát hořečnatý jsou ve vodě rozpustné, oxalát vápenatý je téměř nerozpustný. Oxalát je produkován endogenní cestou v játrech jako konečný produkt metabolismu některých aminokyselin, nebo je přijímán exogenně a absorbován žaludkem, tenkým střevem a tračníkem. Oxalát může být vylučován, buď rozpuštěn v moči, vysrážen vápníkem ve stolici nebo metabolizován střevní mikroflórou. Obecně v závislosti na dietním příjmu, denní močová exkrece oxalátů se u zdravých jedinců pohybuje mezi 10–40 mg/24 h (0,1–0,45 mmol/24 h). Koncentrace nad 40–45 mg/24 h (0,45–0,5 mmol/24 h) je považována za klinickou hyperoxalurii. Můžeme ji rozdělit do dvou skupin, primární a sekundární hyperoxalurii. Primární hyperoxalurie je důsledkem ve většině případů dědičné deficience hepatálních enzymů, vedoucí k zvýšené endogenní syntéze oxalátů. Ostatní příčiny hyperoxalurie označujeme jako sekundární. Výše zmiňovaná onemocnění GIT jsou spojena se zvýšenou intestinální absorpcí oxalátu v důsledku malabsorpčních syndromů, vedoucí k hyperoxalemii a následně tedy k sekundární hyperoxalurii. U těchto onemocnění dochází ke zvýšení rozpustnosti oxalátu ve střevním lumen a souběžnému vzrůstu propustnosti střev pro oxalát v důsledku přítomných žlučových solí a zánětu střevní sliznice. Za normálních podmínek se vápník ze stravy váže na oxalát ve střevě a vytváří nerozpustný kalciumoxalát, který se vylučuje do stolice. V těchto případech ale neabsorbované mastné kyseliny místo toho váží vápník v tenkém střevě a činí ho tak nedostupným pro vznik kalciumoxalátu, následkem je přítomnost velkého množství rozpustných forem oxalátu ve střevním lumen, které se pasivně resorbuje do krve, a následně do ledvin. Ke krystalizaci oxalátu dochází v distálním tubulu, který je místem tubulární sekrece kalcia. Následná formace mikrokrystalů kalciumoxalátu, jejich adheze a následně růst krystalů mohou vést k difuzní renální kalcifikaci (nefrokalcinóza), nebo méně často k obstrukční nefropatii (nefrolitiáza) (Obr. 2) (1, 7, 8).
Image 2. Schematické znázornění patofyziologie enterální hyperoxalurie; upraveno podle (8) 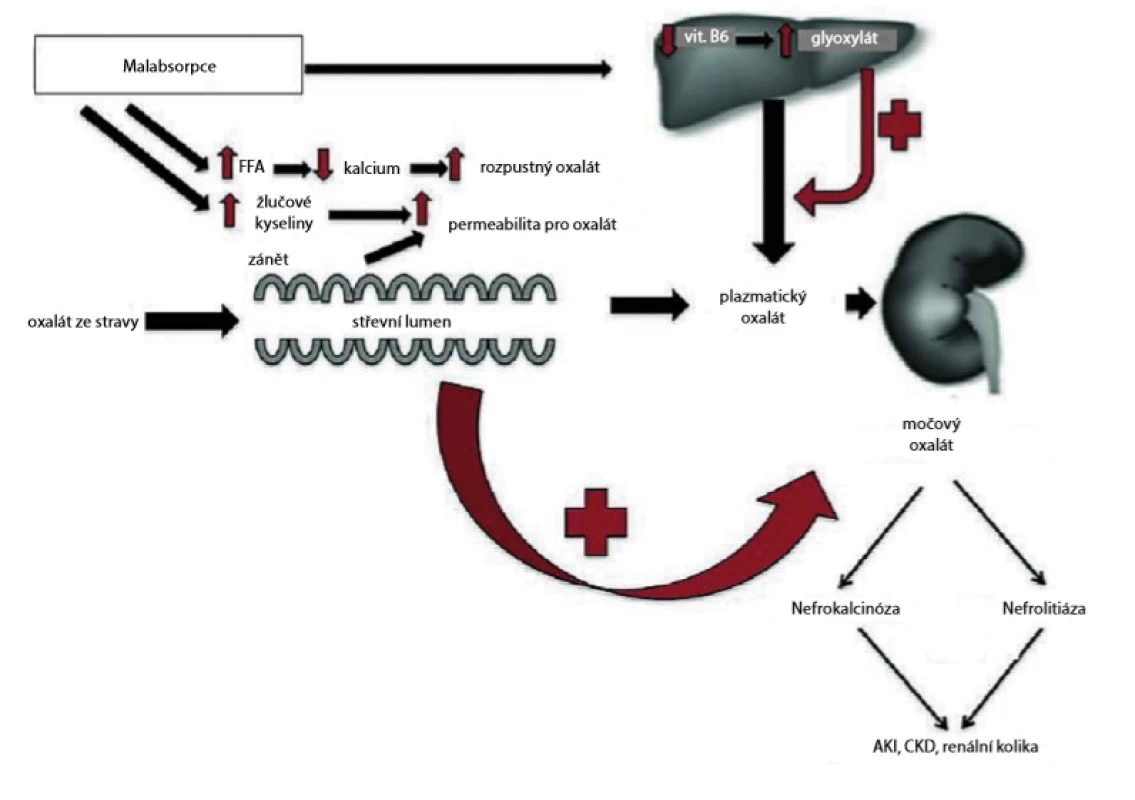
K tubulárnímu poškození dochází také u pacientů s pokročilým onemocněním jater s vysokou hladinou bilirubinu a žlučových kyselin, s klinickými projevy těžkého ikteru, a to v důsledku přímé toxicity bilirubinu či žlučových kyselin na tubulární buňky, nebo jako následek jejich precipitace a tvorby tzv. odlitků (casts), které obturují nefrony, což je mechanismus analogický k poškození u pacientů s mnohočetným myelomem a rabdomyolýzou (1, 9).
Rabdomyolýza
Představuje další patologický stav, u kterého dochází k formaci intratubulárních krystalů, jejich precipitaci a obstrukci tubulů, s následným rozvojem akutního renálního poškození. Při rabdomyolýze dochází k rozpadu příčně pruhovaného svalstva z mnoha různých příčin. Narušení integrity svalových buněk vede k uvolnění nitrobuněčných svalových komponent do extracelulární tekutiny a cirkulace (myoglobin, elektrolyty a ostatní proteiny a enzymy). Hlavními patofyziologickými mechanismy vzniku akutního renálního poškození v důsledku rabdomyolýzy jsou renální vazokonstrikce, intraluminální formace precipitátů a přímá cytotoxicita hemu. Myoglobin je volně vázán na plazmatické globuliny a pouze malé množství se dostává do moči. Když se uvolní masivní množství myoglobinu, dojde k překročení vazební kapacity plazmatických proteinů. Myoglobin je přitom snadno filtrován glomerulární bazální membránou. V tubulech dochází k postupné reabsorbci vody a koncentrace myoglobinu při tom proporcionálně stoupá, dokud nedojde k jeho precipitaci a následně k formaci odlitků (casts). Dehydratace a renální vazokonstrikce, které snižují tubulární tok a zvyšují reabsorpci vody, podporují tento proces. Vysoká míra generace a močová exkrece kyseliny močové (z dezintegrovaných buněčných jader) dále přispívá k tubulární obstrukci tvorbou odlitků kyseliny močové. Dalším faktorem, který podporuje precipitaci myoglobinu a kyseliny močové, je nízké pH tubulární moče, což je časté kvůli přítomné acidóze v důsledku uvolňování organických kyselin z umírajících svalových buněk. Degradace intratubulárního myoglobinu vede k uvolnění volného železa, který katalyzuje produkci volných radikálů a dále zvyšuje ischemické poškození (Obr. 3) (10–13).
Image 3. Patofyziologie vzniku akutního renálního poškození u rabdomyolýzy; upraveno podle (12) 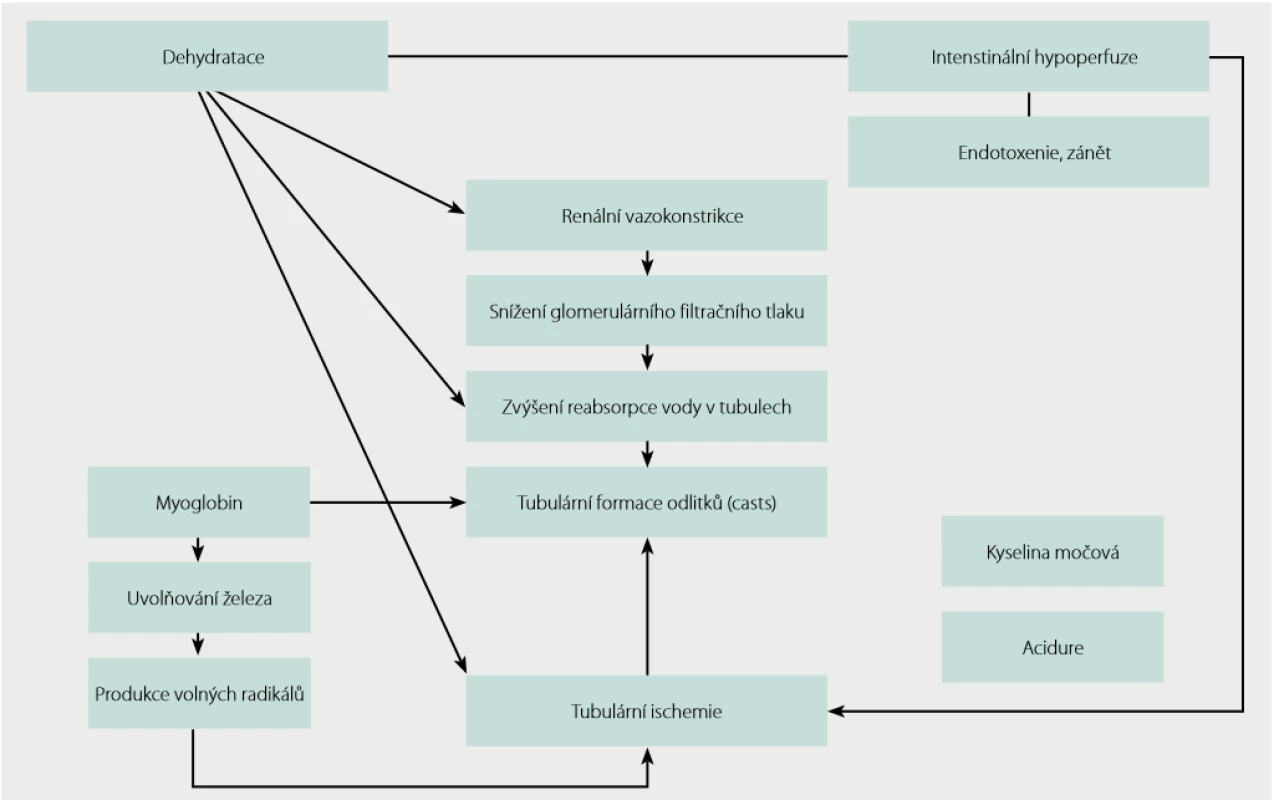
Dalším faktorem, který podporuje rozvoj tubulární krystalopatie, je akutní či chronická léková expozice, dále expozice toxinům nebo výživovým elementům, které mají tendenci ke krystalizaci v moči. Velmi častým příkladem jsou dietní zdroje oxalátů, které mohou způsobovat sekundární hyperoxalurii, zejména pokud jsou přijímány v nadměrném množství. Jedná se o potraviny s vysokým obsahem oxalátů, např. špenátu, červené řepy, fazolí, částečně i mrkve, hroznů, borůvek, pomerančů a grepů. Také obyčejný čaj, zejména silný černý čaj, rovněž kakao a čokoláda jsou vydatnými zdroji šťavelanů. Také v případě nadměrného příjmu suplementů vitaminu C se v těle vytvářejí oxaláty, které mohou vést ke vzniku krystalopatie. Ke vzniku akutní oxalátové nefropatie může dojít i v případě akutní intoxikace etylenglykolem, kdy jeho metabolizace v játrech vede k tvorbě toxických produktů s následným rozvojem těžké metabolické acidózy. Mimo jiné metabolity dochází k produkci velkého množství oxalátů, který akumuluje v krvi a ostatních orgánech, s následnou precipitací s kalciem za vzniku kalciumoxalátu. Dochází k jeho depozici v mozku, srdci, ledvinách a plicích. Následkem je mimo jiné akutní renální selhání, riziková je rovněž možná těžká hypokalcemie (14). Pozornost rovněž zasluhují běžně používaná projímadla sloužící k očistě střev před plánovanými diagnostickými či terapeutickými zákroky na střevě, či při těžké zácpě, natrium‑fosfátová projímadla. Existují četné kazuistiky s popsaným rozvojem akutní fosfátové nefropatie s tvorbou intratubulárních kalciumfosfátových precipitátu v těsné návaznosti na použití výše zmiňovaného prostředku k očistě střev (15, 16). Krystalurie se může rovněž vyskytovat v návaznosti na užití některých léků, např. indinavir (antiretrovirová terapie), acyclovir (antivirová terapie), dále běžně používaný sulfametoxazol (antibiotická terapie), zejména v podmínkách sníženého stavu hydratace a podávání vysokých dávek, kdy dochází k precipitaci těchto léčebných substancí v tubulech (17, 18).
Poslední velkou skupinou onemocnění s možným rozvojem tubulárních krystalopatií jsou nemocní s genetickým metabolickým či renálním onemocněním (genetické formy renální tubulární acidózy, hyperurikosurie, dále primární hyperoxalurie, cystinóza a mnoho dalších onemocnění) (1). Jedná se o skupinu onemocnění s nízkou prevalencí, manifestací zejména v dětském věku a s obtížnější diagnostikou. Při podezření na jedno z výše uvedených onemocnění je potřebná souhra jednotlivých lékařů poskytujících zdravotní péči, pediatr, nefrolog či urolog, a posléze molekulárně genetická analýza se stanovením definitivní diagnózy.
Urolitiáza (krystalopatie močového traktu) (typ 3)
Pod pojmem urolitiáza rozumíme výskyt kamene kdekoliv v močovém systému, v ledvinách (nefrolitiáza), ureteru (ureterolitiáza) nebo močovém měchýři (cystolitiáza) (1). Incidence urolitiázy závisí na zeměpisných, klimatických, etnických, dietních a genetických faktorech. Riziko rekurence je v podstatě determinováno samotným onemocněním nebo poruchou způsobující tvorbu kamenů. Proto se míra prevalence pohybuje od 1 % do 20 %.
Močové kameny lze rozdělit dle jejich etiopatogeneze vzniku do 4 skupin:
- ty, které jsou asociované s infekcí,
- neinfekčními příčinami,
- v důsledku genetických onemocnění,
- jako nežádoucí účinek léčiv (19).
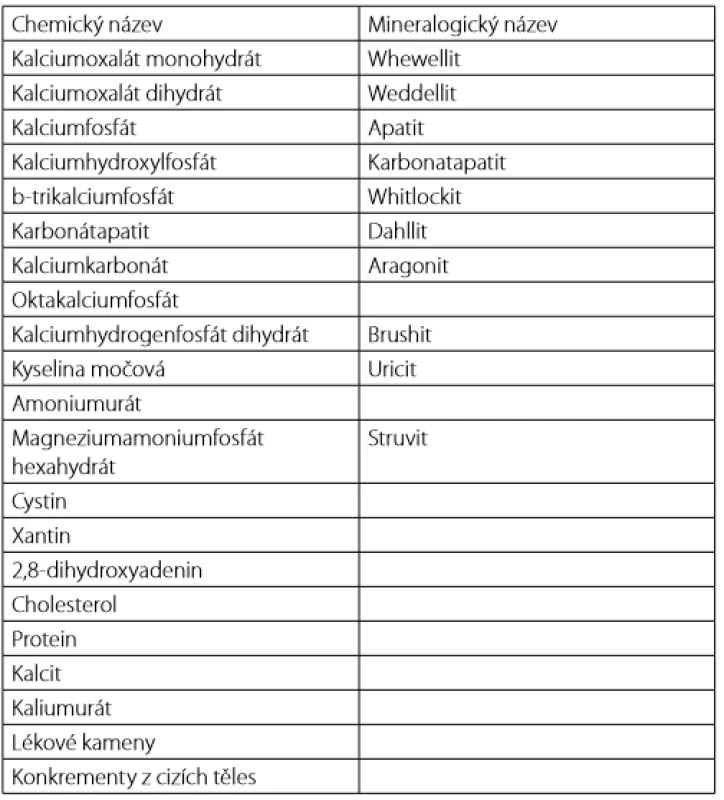
Podrobněji je toto dělení rozvedeno v Tab. 2. Chemické složení ka ‑ menů je základem pro další diagnostická a léčebná rozhodnutí. Kameny jsou často tvořeny směsí více látek. Tab. 3 uvádí klinicky nejdůležitější látky a jejich minerální složky.Mnoho různých faktorů přispívá k tvorbě urolitiázy, ale zejména některé genetické choroby asociované s nadprodukcí cystinu, kyseliny močové či oxalátů představují typický příklad krystalurie vedoucí k formaci močových kamenů (viz Tab. 1). Z nejnovějších výzkumů vyplývá, že existují nemoci, které jsou asociovány s genovými variantami kódujícími transport solutů v průběhu nefronu, s důsledkem jejich abnormálně zvýšené koncentrace v moči, supersaturace a následné tvorbě urolitiázy (1, 20). V neposlední řadě, strava bohatá na fruktózu či oxaláty společně s nízkým příjmem tekutin či jejich nadměrnou ztrátou pocením nebo průjmy, působí společně na tvorbu mikrokrystalů a formaci kamenů. Dalšími rizikovými faktory predisponující k tvorbě urolitiázy mohou být infekce s následnou tvorbou kamenů asociovaných s infekcí (např. struvit, karbonatapatit), zejména u infekčních agens produkujících ureázu, dále anatomické abnormality močového traktu, metabolický syndrom obecně, polycystické onemocnění ledvin, hyperparatyroidismus a mnoho dalších.
Nejčastějším klinickým projevem urolitiázy je renální kolika, bolest proměnlivé intenzity, šířící se obvykle z beder do podbřišku či genitálu, je způsobena obstrukcí vývodných cest močových. Často je doprovázena psychomotorickým neklidem a silným vegetativním doprovodem (pocení, nauzea, zvracení, možný je i rozvoj paralytického ileu). Průchod konkrementu nebo jeho odstranění zmírňuje tlak a bolest. Nejčastěji se kameny náhle mobilizují z kalichů ledvinové pánvičky, ale spouštěcí mechanismus zůstává do značné míry neznámý. Při průchodu konkrementu může hrubý povrch kalkulu spolu s mechanickými silami peristaltiky ureteru způsobit poškození sliznice, krvácení a otok v místě obstrukce. Renální kolika je obvykle asociována s mírnou hydronefrózou, jejíž stupeň se odvíjí od velikosti daného konkrementu. Snížení diurézy není obvyklé, dokud nedojde k obstrukci odtoku moči z obou ledvin. Pacienti s chronickou urolitiázou mohou mít různorodou symptomatologii, od asymptomatického průběhu, přes tupou bolest v obdobné lokalizaci jako u renální koliky, dále hematurii, dysurické potíže, často v spojení s infekcí močových cest. Navzdory až alarmujícímu klinickému obrazu nemusí renální kolika nutně souviset s dlouhodobým poškozením funkce močových cest, pokud chronická obstrukce nevede k obstrukční nefropatii a nevratné ztrátě nefronů (1, 21). Tvorba močových konkrementů se často iniciuje na Randallových placích uvnitř ledvinné pánvičky. Představují bílé intersticiální apatitové plaky (kalciumfosfátové), které se vytvářejí podél tenkých částí Henleovy kličky. Randallovy plaky jsou hlavním místem tvorby konkrementů oxalátu vápenatého. Rozhraní mezi konkrementem a plakem představuje vícevrstvý lem sestávající z matrixových molekul jako je Tamm‑Horsfallův protein (uromodulin) a krystalů oxalátu vápníku. Apatit ale není jedinou složkou, v chemické kompozici kamene je možné stanovit i přítomnost urátu sodného či jiných krystalů (Obr. 4). Ačkoliv uromodulin může inhibovat tvorbu krystalů v lumen distálního tubulu, je pravidelnou součástí krystalových plaků. Tubulární plaky ve sběrných kanálcích jsou rovněž místem tvorby konkrementů (brushitové a hydroxyapatitové kameny), protože v tomto segmentu renálních tubulů dosahuje koncentrace moči svého maxima. Tyto plaky se vyskytují u pacientů s močovými konkrementy v důsledku bariatrických operací, střevních resekcí, po ileostomii, nebo v důsledku onemocnění, jakými jsou primární hyperparatyreóza, primární hyperoxalurie nebo cystinurie (1,21).
Image 4. a) Mikroskopický aspekt Randallova plaku (RP), který se sestává z kombinace urátu sodného a apatitu (černá šipka) b) RP (oblasti 1 a 2) připojené ke konkrementu z whewellitu (oblast 3). Krystalky urátu sodného jsou viditelné v oblasti 2; převzato a upraveno podle (22) 
Závěr
Tento stručný přehled značně různorodé problematiky krystalopatií v nefrologii dokládá široké spektrum možností poškození ledvin krystaly, a to v závislosti na jejich velikosti, renálním kompartmentu ve kterém působí a časovém vývoji onemocnění. Klasifikace krystalových nefropatií vychází klasického konceptu prerenálního, renálního a postrenálního poškození, a to z důvodu rozličné klinické symptomatologie jednotlivých patologických stavů. Další studium problematiky krystalopatií nám může přinést lepší porozumění patofyziologických mechanismů vedoucích k jednotlivým druhům poškození, a povede též k rozvoji nových diagnostických a následně i terapeutických postupů, s cílem zlepšení péče o pacienty s krystalovými nefropatiemi.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Petra Bachroňová,
I. interní klinika 3. LF UK a FN Královské Vinohrady,
Šrobárova 50,
100 34 Praha 10
Cit. zkr: Vnitř Lék 2020; 66(6): 371–377 Článek přijat redakcí: 29. 1. 2019 Článek přijat po recenzích k publikaci: : 15. 11. 2019
Sources
1. Mulay SR, Anders HJ. Crystal nephropathies: mechanisms of crystal‑induced kidney injury. Nat Rev Nephrol 2017; 13 : 226–240.
2. Mulay SR, Anders HJ. Crystallopathies. N Engl J Med 2016; 374 : 2465–2476.
3. Venturelli Ch, Jeannin G, Sottini L, et al. Cholesterol crystal embolism (atheroembolism). Heart Int 2006; 2 : 155.
4. Herlitz LC, D‘Agati VD, Markowitz GS. Crystalline nephropathies. Arch Pathol Lab Med 2012; 136 : 713–720.
5. Doshi M, Lahoti A, Danesh FR, et al. Paraprotein ‑Related Kidney Disease: Kidney Injury from Paraproteins ‑What Determines the Site of Injury? Clin J Am Soc Nephrol 2016; 11 : 2288–2294.
6. Howard SC, Jones DP, Pui ChH. The Tumor Lysis Syndrome. N Engl J Med 2011; 364 : 1844–1854.
7. Robijn S, Hoppe B, Vervaet BA, et al. Hyperoxaluria: a gut‑kidney axis? Kidney Int 2011; 80 : 1146–1158.
8. Nazzal L, Puri S, Goldfarb DS Enteric hyperoxaluria: an important cause of end‑stage kidney disease. Nephrol Dial Transplant 2015; 31 : 375–382.
9. van Slambrouck CM, Salem F, Meehan MM, et al. Bile cast nephropathy is a common pathologic finding for kidney injury associated with severe liver dysfunction. Kidney Int 2013; 84 : 192–197.
10. Bosch X, Poch E, Grau JM. Rhabdomyolysis and acute kidney injury. N Engl J Med 2009; 361 : 62–72.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 6-
All articles in this issue
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Alergie a imunopatologie – hlavní téma
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career