-
Medical journals
- Career
Význam ultrasonografického vyšetření v diagnostice akutních stavů
Authors: Martin Balík
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní medicíny 1.
Published in: Vnitř Lék 2019; 65(3): 177-186
Category:
Overview
Ultrasonografie významně rozšiřuje diagnostiku a zefektivňuje management akutních onemocnění. Přibývající množství publikací potvrzuje fakt, že kvalifikovaní intenzivisté s odborným zázemím v interně a anesteziologii mohou zajistit přesnou, bezpečnou a obsažnou diagnostiku hemodynamiky s pomocí echokardiografie. Intenzivisté zapojení do managementu kriticky nemocných si jsou vědomi všech klinických a laboratorních parametrů a měli by být schopni interpretovat echokardiografické vyšetření komplexním způsobem a s okamžitou aplikací pro další terapii. Vyšetření plic a pleurální dutiny, kvantifikace pleurální tekutiny a případné vyloučení ventrálního pneumotoraxu by mělo být integrální součástí transtorakálního echokardiografického vyšetření. Vyšetření břicha u sepse nejasné etiologie, náhlých příhod břišních či u renálního selhání může nasměrovat další diagnostické a terapeutické kroky u kriticky nemocného pacienta. Časový faktor je zvláště naléhavý u šokových stavů a příjmu těžkých traumat, u nichž přežití pacienta závisí z velké části na správně zvoleném diagnostickém algoritmu. Zde má ultrasonografie nezastupitelnou roli. Vyšetření též pomáhá před provedením perkutánní dilatační tracheostomie, podobně lze zaměřit centrální žílu před kanylací u rizikového pacienta a ušetřit ho transfuze destiček. Již zavedenou roli má ultrasonografie ve vyšetřování cévního systému při poruchách perfuze a suspektní žilní trombóze. Transkraniální dopplerovská sonografie je významnou pomůckou v diagnostice průtoku krve mozkem, zvláště u cévních mozkových příhod a intrakraniální hypertenze. Pořizovací cena multimodálního ultrasonografického přístroje je značná. Tento přístroj však v rukou erudovaného intenzivisty může zachránit život pacienta a ušetřit čas, komplikace a finanční náklady celému oddělení.
Klíčová slova:
hrudní ultrasonografie – transkraniální dopplerovská sonografie – trauma
Úvod
Tento článek má za úkol nastínit možnosti využití multimodálního ultrasonografického přístroje (obr. 1) v prostředí akutní medicíny. Cílem je stimulovat zájem o ultrasonografii a poukázat na již navržené postupy a algoritmy, které by mohly intenzivistům a internistům v přípravě k atestaci z intenzivní medicíny pomoci v jejich každodenní praxi.
Image 1. Příklad multimodálního ultrasonografického přístroje vybaveného transtorakální, abdominální a lineární sondou (GE Vivid S6) 
Echokardiografie
Rutinní aplikace echokardiografie v intenzivní medicíně významně rozšiřuje diagnostické a následně terapeutické možnosti poruch hemodynamiky. Vyšetření může diagnostikovat ventrikulární systolickou a diastolickou funkci, přítomnost, nebo absenci myokardiální ischemie, preload, afterload, pravé srdce a plicní hypertenzi, poruchu chlopenního aparátu (obr. 2), přítomnost vegetací, patologie aorty (obr. 3), interakci s ventilací, onemocnění perikardu, septální defekty, pleurální výpotky a nemoci mediastina. Echokardiografie může být prováděna u každého hemodynamicky nestabilního pacienta, dále v případě respiračního selhání nebo v diferenciální diagnostice srdečního selhání, bolestí na hrudi, arytmií, šelestů, kardiomegalie nebo u podezření na centrální či periferní embolizace. Echokardiografie má zásadní význam pro diagnostiku preload a plnicích tlaků u respiračně selhaných pacientů, podobně nelze bez echokardiografie správně indikovat různé formy podpor cirkulace a respiračního aparátu ve formě extrakorporální membránové oxygenace (ECMO). Vyšetření je rychlé, neinvazivní a může být libovolně opakováno u lůžka pacienta. V praxi obvykle zahajujeme transtorakální echokardiografií (TTE). Vedle primárních indikací k TEE v průměru 6 % pacientů s podporou umělou plicní ventilací vyžaduje rozšíření vyšetření o transezofageální echokardiografii (TEE), vlastní data autora. TEE je prováděno primárně pro diagnostiku endokarditidy, vyšetření aorty, zdroje embolie, vyloučení intrakardiálního zkratu, při vyšetřování chlopenních protéz a někdy u dárcovského srdce před transplantací.
Image 2. Vyšetření TEE pacientky resuscitované pro arytmii, příjmové vyšetření odhalilo těsnou aortální stenózu (AVAi 0,4 cm2). Vyšetření TEE ze středního jícnu – nahoře levá síň, v centru těžce degenerovaná aortální chlopeň, která byla 2. den po příjmu nahrazena protézou 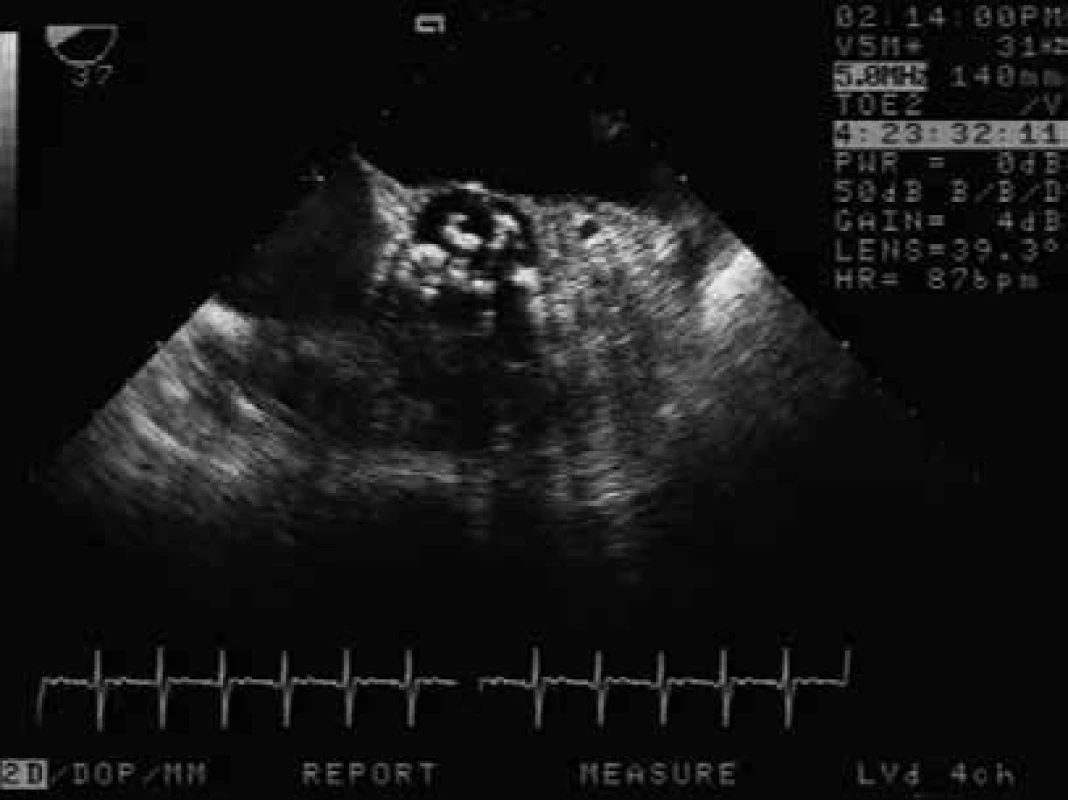
Image 3. Vyšetření TEE: příjem pacienta s polytraumatem – v mediastinu nejasný stín a na CT rozšíření aorty. Na TEE je patrna v levé dolní části (z pohledu pacienta) sektoru barevného dopplerovské sonografie traumatická disekce sestupné aorty s pravým lumen, turbulence v horní části je vstup do falešného lumen. Pacient podstoupil urgentní stenting 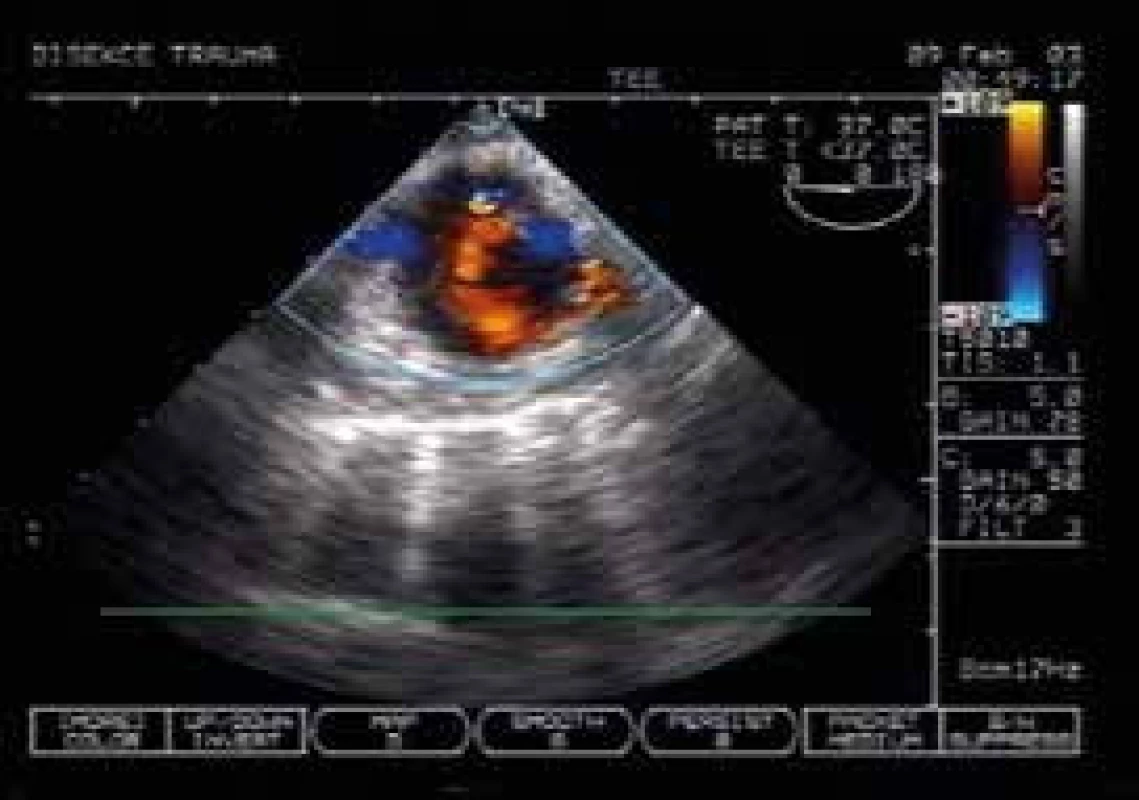
S ohledem na možnosti, které metodika nabízí, považuje autor tohoto článku za vhodné provádění komplexního vyšetření tak, jak je známe z echokardiografických laboratoří s přihlédnutím k hemodynamickým specifikům kriticky nemocných pacientů [1]. Kompletní echokardiografické vyšetření kriticky nemocných by mělo zahrnout následující položky: preload, globální a segmentální kontraktilitu, diastolickou funkci, afterload, poruchy chlopenního aparátu, srdeční výdej, pravé srdce, plicnici a plicnicový tlak, patologie aorty, perikardu a vyšetření pleurální dutiny (tab). Rutinně vyšetřujeme minimálně 10–11 zobrazení transtorakálně a 12–20 zobrazení u transezofageálního vyšetření [1]. Transtorakální vyšetření nemá kontraindikací, u jícnového jsou relativní kontraindikací krvácení z úst a horního gastrointestinálního traktu, stavy po jícnové a žaludeční chirurgii, jícnové varixy, cervikální spinální trauma, dále je vyšetření třeba zvážit u endoskopicky zavedené nazojejunální sondy.
Tab. Základní echokardiografické vyšetření u kriticky nemocného 
LK – levá komora srdeční PK – pravá komora srdeční UPV – umělá plicní ventilace V rámci rutinního hemodynamického monitorování je echokardiografie nejpřínosnější pro diagnostiku a terapii u nejasné hemodynamické nestability. Aplikace echokardiografie objasnila 70 % příčin a vedla k okamžitému chirurgickému výkonu u 22 %. Frekvence následné katetrizace plicnice byla 35 % u všech hypotenzních pacientů [2]. Příspěvek echokardiografie pro diagnostiku byl popsán nejen pro změny terapie u 40 % pacientů bez plicnicového katétru (Pulmonary Artery Catheter – PAC), ale i u 40–50 % pacientů s již zavedeným PAC bez ohledu na základní diagnózu [3,4]. Zdá se, že provozování echokardiografie u všech hemodynamicky nestabilních pacientů redukuje potřebu zavádět PAC, která může být přibližně na polovině průměrné frekvence zavádění PAC v evropských jednotkách intenzivní péče [5,6]. Potřeba zavádění PAC a kontinuálního monitoringu tlaků v plicnici může být limitována pro stavy hemodynamické nestability kardiálního původu, jiné příčiny mohou být zvládány jen s pomocí echokardiografie. Tento postup může na druhou stranu přinést zvýšení morbidity a mortality ve skupině monitorované s pomocí PAC, protože méně závažně nemocní pacienti budou zvládáni jen s pomocí intermitentní echokardiografie. Pokud pomineme vysoké pořizovací náklady, echokardiografie je jako rutinní postup lacinější než PAC. Multimodální ultrasonografický přístroj vybavený TEE sondou by měl být součástí všech větších jednotek intenzivní péče. Jeho pořízení bude následně snadno odůvodněno vysokým počtem diagnostikovaných a léčených pacientů a s tím souvisejícími úsporami na plicnicových katétrech, RTG materiálu a krevních destičkách bez ohledu na okamžitou a téměř kompletní diagnostiku kardiovaskulárního systému.
V akutních situacích může být kardiolog nebo sonografista obtížně dosažitelný po 24 hod denně. Přibývající množství publikací potvrzuje fakt, že kvalifikovaní intenzivisté mohou zajistit přesnou, bezpečnou a obsažnou diagnostiku hemodynamiky s pomocí TEE a TTE. Intenzivisté zapojení do managementu kriticky nemocných si jsou vědomi všech klinických a laboratorních parametrů a měli by být schopni interpretovat echokardiografické vyšetření komplexním způsobem a s okamžitou aplikací pro další terapii. Provozování echokardiografie však vyžaduje dokonalou znalost instrumentária a principů srdeční ultrasonografie. Spojeným úsilím European Society of Cardiology a European Society of Cardiothoracic Anaesthetists vznikla v roce 2004 kurikula pro trénink v transtorakální a transezofageální echokardiografii. Podmínkou získání akreditace je v obou případech splnění předepsaného log book a echo praxe po dobu 1 roku, dále multiple choice test a video test. Evropská společnost intenzivní medicíny (European Society of Intensive Medicine – ESICM) zahájila v roce 2016 zkoušení European Diploma in Critical Care Echocardiography (EDEC), který je první akreditační zkouškou kombinující TTE (100 vyšetření) a TEE (35 vyšetření) v log book. Teoretická zkouška sestávající z MCQ testu a video testu je doplněna praktickou zkouškou na trenažeru. Všechny tyto snahy umožnit nejen kardiologům kvalifikační zkoušku z echokardiografie by měly stimulovat trénink intenzivistů v aplikaci srdeční ultrasonografie [7,8].
Hrudní ultrasonografie
Vyšetření hrudníku by nemělo být limitováno pouze na echokardiografii. Odhad stupně a rozsahu alveolární konsolidace je možný s pomocí TEE [9]. Vyšetření pleurální dutiny, kvantifikace pleurální tekutiny a případné vyloučení ventrálního pneumotoraxu s pomocí TTE by mělo být integrální součástí transtorakálního echokardiografického vyšetření. Adekvátní drenáž pleurální dutiny lze považovat za součást „open lung concept“ a může být velmi efektivně iniciována a provedena na podkladě ultrasonografického (USG) vyšetření [10,11]. Podobně patologie bránice lze nejlépe ověřit s pomocí bedside USG vyšetření.
Prevalence výpotků na intenzivní péči je vysoká a u interních pacientů se pohybuje mezi 15–62 % [12]. Hrudní sonografie vykazuje lepší senzitivitu a specificitu pro diagnostiku pleurální tekutiny než RTG vyšetření hrudníku, které má senzitivitu 80–83 %. Je známo, že RTG může „opominout“ 300–500 ml tekutiny [13]. USG navíc vylučuje atelektázu, konsolidaci a zvýšený stav bránice, a tím potencionálně iatrogenizující „torakocentézu“. Je rychlejší než RTG vyšetření, může být libovolně opakována u lůžka pacienta a má významně nižší frekvence komplikací než u punkcí bez USG asistence [14–16]. Pacienti s úspěšně provedenou torakocentézou mají trend ke kratšímu pobytu na jednotce intenzivní péče (JIP/Intensive Care Unit – ICU) a nižší mortalitu. V případě malých výpotků je na zvážení benefit punkce oproti riziku komplikací jako pneumotorax nebo krvácení, a to zvláště u pacientů na umělé plicní ventilaci (UPV) nebo u trombopenických [17–19]. Z patofyziologie pacientů na umělé plicní ventilaci je zřejmé, že adekvátní drenáž významných pleurálních výpotků udržuje nízký pleurální tlak, udržuje dostatečný transpulmonální tlak a funkční reziduální kapacitu za cenu nižšího peak a plateau airway pressure [20–22].
Kromě studií pokoušející se kvantifikovat pleurální tekutinu pomocí USG na spontánně ventilujících ambulantních pacientech [14] byly publikovány studie kvantifikující pleurální tekutinu i u kriticky nemocných pacientů [23] a u pacientů na umělé plicní ventilaci [24,25]. Zkušený intenzivista by neměl mít problém určit i kvalitu výpotku, tedy zda se jedná o transudát/exsudát, pyotorax, krev s koaguly nebo zda jsou přítomna septa. Přes tekutinu jako vhodné USG medium lze i určit rozsah konsolidace plicního parenchymu komprimovaného výpotkem. Zobrazení bránice, jater a sleziny před punkcí a určení tloušťky hrudní stěny má význam pro výběr kanyly či interkostálního drénu a bezpečnost punkce. Při tomto postupu se procento úspěšnosti blíží 100 % a frekvence komplikací je 0 % [15,17,19].
Pneumotorax (PNO) je na UPV závažná komplikace vyžadující okamžitou diagnózu. Problémem RTG vyšetření u lůžka pacienta je nízká senzitivita, neboť nezachytí až 30 % pneumotoraxů u pacientů v supinní poloze, z nichž polovina přechází do tenzního pneumotoraxu [26,27]. Celá diagnóza je postavena na vyšetření pleurálních listů pod úrovní žeber jako rozhraní echolucentních měkkých tkání a echokontrastní vzdušné plíce. Tzv. „pleural sliding“ je navozen posunem listů pleury po sobě v rámci dech cyklu. „Fenomén komety“ vede z pleurální linie vertikálně přes celý sektor a má dynamickou synchronizaci s lung sliding v podobě kyvadlového pohybu. „Lung point“ je rozhraní normálního „sliding“ a jeho absence (zóna separace pleurálních listů plynem svědčí pro pneumotorax), obr. 4. Pro interpretaci je třeba vědět, že amplituda lung sliding se zvyšuje od apexu k bázi a lze obtížně nalézt u HF-IPPV (High-Frequency-Intermittent Positive-Pressure Ventilation), v apnoi, po pleuritidě, talkáži, těžkého emfyzému, fibróz, kompletní atelektázy, bazálně až u třetiny těžkých případů akutního respiračního distress syndromu (ARDS) a pneumonií (měl by být přítomen ventrálně). Přenos srdeční pulzace „plicní pulz“ je obvykle markantní u atelektáz a nemožnosti vybavit „lung sliding“, oba fenomény mohou být samozřejmě vidět najednou u normálního nálezu.
Image 4. Pneumotorax: lung point detekovaný lineární sondou v přední axilární čáře. M-mode je normální (sea-shore sign) v inspiriu, během nějž se pod sondu nasouvá viscerální pleura. V exspiriu je zde pneumotorax (bar-code sign) 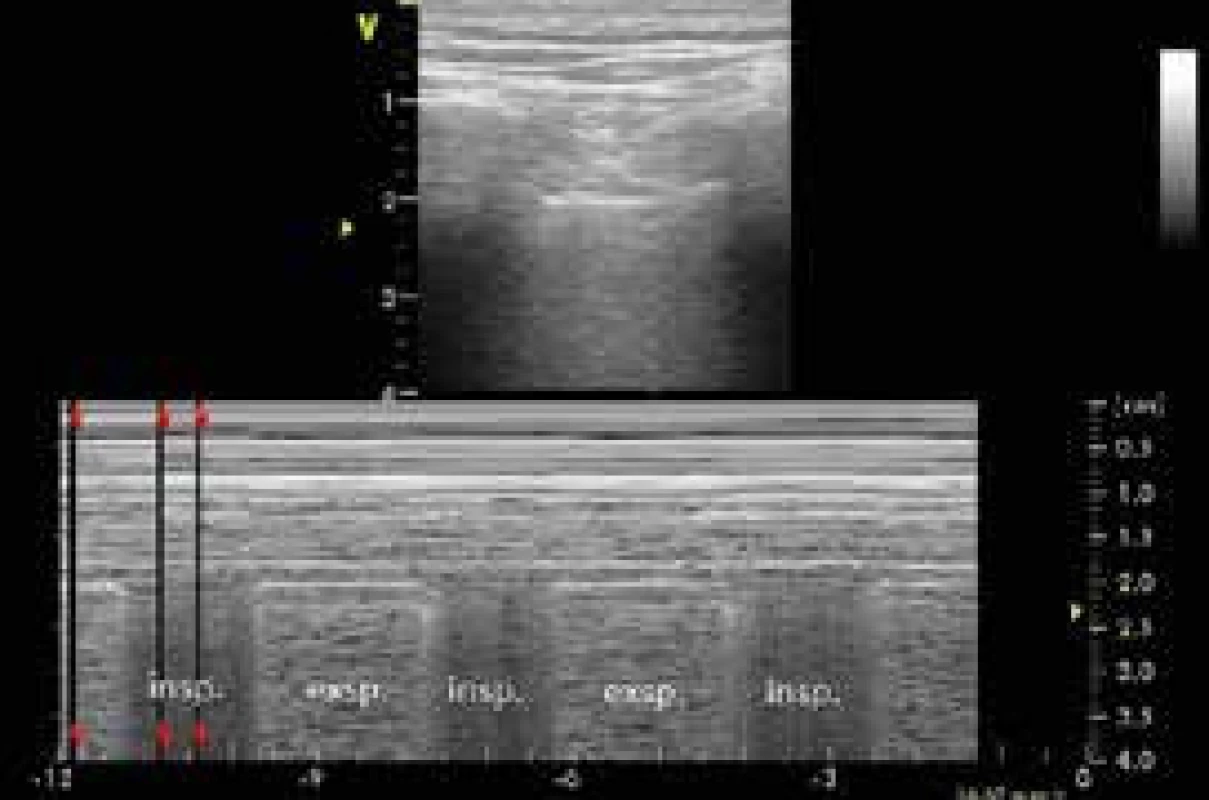
USG má senzitivitu 95% pro diagnostiku PNO, posun pleurálních listů (sliding) má negativní predikční hodnotu 100 % pro diagnostiku PNO [10]. Při nenalezení „lung sliding“ ventrálně nelze PNO vyloučit, ale ani s jistotou potvrdit. Pokud je přítomen klinický nález, je možno jistě rozhodnout o drenáži, nicméně jistotu přinese až nález „lung point“. Při posunu sondy laterálně a dorzálně obvykle nalezneme oblast přechodu „absence sliding s reverberacemi pleurální linie“ ventrálně do obrazu „sliding a fenoménu komety“ dorzálně (typicky v oblasti přední a střední axilární linie u ventrálního pneumotoraxu), obr. 4. Tento nález má sice 66% senzitivitu, ale 100% specificitu pro diagnózu PNO [28]. Až 80 % ventrálních radiookultních PNO je diagnostikováno pomocí „lung point“, který určuje i rozsah PNO. Při nepřítomnosti „lung point“ je třeba ověřit přítomnost komet (B linií, viz níže) a/nebo plicního pulzu. Pokud nenalezneme žádný z těchto fenoménů, jedná se s největší pravděpodobností o PNO [29]. Při možnosti hrudního USG vyšetření by tak měla zcela vymizet z praxe pleurální drenáž naslepo v urgentní situaci. Podobně u uzavřeného drénu před vytažením lze vyloučit potřebu pokračující drenáže s pomocí pleurálního nálezu.
Atelektázy a konsolidace plicní tkáně jsou detekovatelné při kontaktu s pleurou (periferní segmenty bazálně) nebo v levé plíci paravertebrálně a bazálně s pomocí TEE [30]. Plicní tkáň je hepatizovaná, ohraničená ostrou hranicí (pleura) a neostrou v hloubce (přechod do vzdušné tkáně). Někdy lze sledovat i dynamický bronchogram jako průnik vzduchu do hepatizované tkáně v inspiriu – typicky (60 %) u infekční alveolární konsolidace (pneumonie). Absence dynamiky bronchogramu je k vidění u atelektáz [9].
Intersticiální syndrom reprezentuje zmnožení tekutiny v interlobulárních septech. Reprezentuje akutní poškození plic (Acute Lung Injury – ALI), ARDS, kardiální plicní edém, pneumonii, exacerbaci chronických intersticiálních procesů. Kromě normálního pleurálního nálezu jsou k vidění difuzní „plicní komety“, typicky pod anterolaterální hrudní stěnou jako B linie. Jejich senzitivita je 93%, specificita 94% pro alveolární intersticiální syndrom [31]. Klinický význam je v časných fázích akutní dušnosti, během nichž je RTG metoda negativní [32]. Jejich zmnožení a zahušťování přes tzv. B4–7 line (II. stupeň) do B3–4 linií (III. stupeň) až k úplnému splynutí do konsolidace parenchymu (IV. stupeň) lze využít k odhadu plicní recruitability na IPPV. Platí, že prakticky nikdy nelze očekávat recruitment na IPPV u IV. stupně dorzálně a dorzobazálně a zvláště při nehomogenitě plicního postižení [33]. Tato metoda má oproti monitoringu plicní mechaniky na ventilátoru výhodu monitoringu lokálních změn v příslušných zónách hrudníku a v absenci potřeby pacienta sledovat, nebo dokonce relaxovat. Nevýhodou oproti plicní mechanice je nemožnost někdy odlišit hyperinflaci od recruitmentu.
Vyšetření bránice se provádí na úrovni jater (pravá bránice) a sleziny (levá). Spontánně ventilující pacient nebo na UPV má normální amplitudu pohybu mezi 10–40 mm (bez vlivu výpotků), amplituda < 10 mm, resp. < 5 mm je patologická. Ztluštění bráničního svalu o alespoň 25 % v oblasti kostofrenického úhlu je indikátor normální svalové funkce bráničního svalu [34]. Důležité je zohlednit pleurální fibrotizace, atelektázy, nízké dechové objemy a vzestup intraabdominálního tlaku. Největší význam má vyšetření v péči o pacienty po kardiotorakální chirurgii (n. phrenicus).
Sonografie peritoneální dutiny a retroperitonea pro intenzivisty
Vyšetření abdominální oblasti lze rozdělit na vyšetření peritoneální dutiny a retroperitonea s uropoetickým systémem. Detekce tekutiny v peritoneální dutině je snadná a zahrnuje vyšetření ve všech abdominálních kvadrantech s důrazem na vyšetření Morrisonova prostoru mezi játry a pravou ledvinou, perisplenického prostoru pod levou bránicí, obou parakolických prostorů, obou kyčelních jam a prostorů před a za močovým měchýřem (ideálně při uzavřené močové cévce nebo před vycévkováním). Toto vyšetření je důležitou součástí vyšetření u nejasných šokových stavů, příjmového vyšetření traumat, je velmi přínosné při podezření na náhlou příhodu břišní nebo při sekvestraci volné tekutiny v břiše u portální hypertenze či pravostranného selhání. Detekce volné tekutiny usnadňuje její nekomplikovanou punkci, což může zásadně změnit další diagnosticko-terapeutický algoritmus, např. diagnostikovat peritonitidu či střevní perforaci. Podobně nám USG cílená punkce umožňuje vyloučit spontánní bakteriální peritonitidu u cirhotiků a při zavedení katétru drenáž peritonea a přímé měření intraabdominálního tlaku u extrémních ascitů. Ideální místo pro punkci je obvykle v dolních kvadrantech, ale je nejspíše dáno aktuálním sonografickým obrazem při vědomí průběhu epigastrických cév v břišní stěně.
USG vyšetření peritoneální dutiny nám umožňuje nejen detekci tekutiny, ale usnadňuje i časnou diagnostiku pneumoperitonea. Pneumoperitoneum je klasicky diagnostikováno jako vzduch pod pravou či levou bránicí. Přesnost RTG se pohybuje mezi 55 % až 85 % v závislosti na poloze pacienta [35,36]. USG vyšetření je založeno na podobném principu jako vyšetření pro pneumotorax. Volný plyn je obvykle na vertexu peritoneální dutiny, tj. typicky supraumbilikálně a okolo jater. Diagnózu může usnadnit pohyb jater s ventilací navozující dynamický obraz intraabdominálních orgánů. Senzitivita tohoto vyšetření dosahuje 93 % a specificita 64 % [35,36].
Samotné vyšetření střevních kliček umožňuje vidět jejich tekutý obsah (při plynném není vyšetření střeva možné), peristaltiku a tloušťku střevní stěny. Pokud není střevo zaplynováno, je možné diagnostikovat ileus nebo třeba megakolon. Vyšetření sleziny umožňuje s určitou přesností monitorovat např. trauma nebo splenické infarkty. Játra jsou rutinní součástí USG vyšetření břicha, při pátrání po zdroji sepse často vyšetřujeme žlučník a žlučový strom. Akutní cholecystitida je diagnostikována při stěně žlučníku > 4 mm (v závislosti na enterálním příjmu), žlučníku distendovaném > 5 cm, pericholecystickém infiltrátu/tekutině a sludge/kamenech u kalkulózního zánětu [37]. Žlučník se někdy vyklenuje z pod jaterního laloku a lze ho punktovat pod kontrolou USG jak transperitoneálně, tak i transhepaticky [38] (obr. 5). Výhody transhepatálního postupu zahrnují nižší riziko perforace kolon, riziko vypadnutí katétru a úniku žluči do peritonea. Barevná dopplerovská sonografie vylučuje poškození cév při punkci přes jaterní parenchym.
Image 5. Hydropický žlučník u akutní pankreatitidy těsně před zavedením pig tail katétru přes okraj pravého jaterní laloku 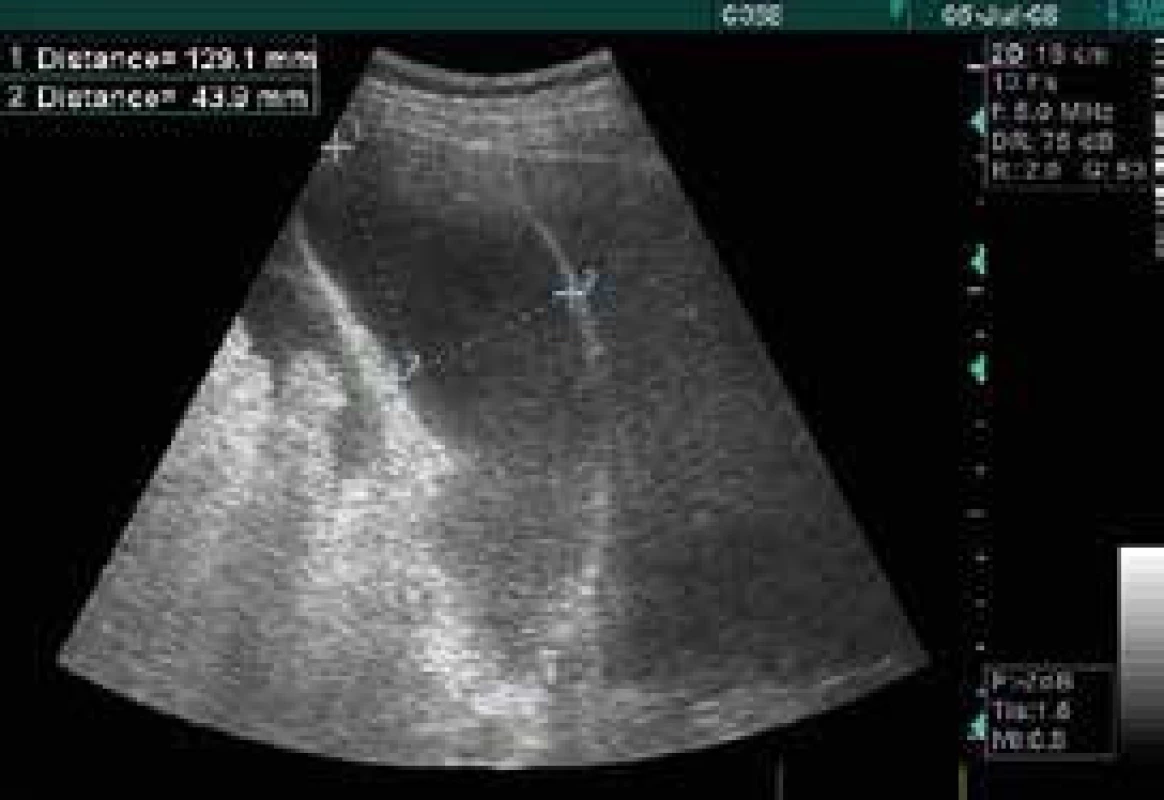
Vyšetření pankreatu je u kriticky nemocných velmi obtížné pro interferenci s plynem v střevních kličkách. Význam ultrasonografie je v možnosti perkutánní drenáže v případě rozsáhlých pseudocyst (obvykle > 5–6 cm v průměru) u pankreatitid, pokud jsou USG vyšetřením dosažitelné a není riziko punkce solidních nekróz, které by implikovaly spíše chirurgickou intervenci [39].
Renální ultrasonografie je často indikována mezi prvními vyšetřeními u renálního selhání pro vyloučení subrenální blokády. Podélný rozměr ledviny a velikost centrálního echokomplexu je nejjednodušeji dosažitelný parametr. V závislosti na věku a pohlaví měří ledvina 9–12 cm, centrální echokomplex 6–7 cm. Komplexní vyšetření s pulzní a barevnou dopplerovskou sonografií v renálních tepnách lze však indikovat i jako možný monitor splanchnické perfuze. Akutní tubulární nekróza asociuje se vzestupem rezistivního indexu (RI) [40]. Normální nález pulzní dopplerovskou sonografií na renálních tepnách má významnou diastolickou komponentu charakteristickou pro nízkorezistentní cirkulaci. Nejdůležitější semikvantitativní parametry jsou RI (systolický peak – diastolický peak/systolický peak, normálně 0,5–0,1) a akcelerační čas (Acceleration Time – AcT) systolické fáze. RI nad 0,8 jsou abnormální, ACT by neměl překročit 100 ms. Vyšší hodnoty je třeba interpretovat s ohledem na možnou přítomnost aortální vady, aneuryzmata hrudní aorty, stenózu nebo arteriosklerózu renální tepny. Renální hypoperfuze je charakterizována poklesem absolutní výšky systolického průtoku, daleko více však redukcí průtoku v diastole. To má za následek vzestup RI až k maximu 1,0. Někdy lze pozorovat inverzi průtoku v diastole díky vysoké intravaskulární rezistenci při vazokonstrikci v malých periferních cévách.
Toto vyšetření renálních cév nabývá na významu u náhlých příhod břišních, cirhóz a pankreatitid neboť stupeň zhoršení renálního průtoku krve souvisí exponenciálně se vzestupem intraabdominálního tlaku (Intra-Abdominal Pressure – IAP; pokles na polovinu při vzestupu IAP z 18 na 25 mm Hg) [41,42].
Cílené USG vyšetření u šokových stavů a těžkých traumat
I když je koncept „zlaté hodiny“ již 20 let starý, k většině úmrtí na rozsáhlá traumata dochází během prvních desítek minut až hodin po příjmu do nemocnice (až 48 %) [43]. Nejčastěji souvisí se zajištěním dýchacích cest, traumatem hrudníku a hemoragickým šokem [43–45]. Podíl rozsáhlých fatálních traumat mozku je sice významný, jejich primární terapie a reverzibilita je však omezená. Rychlá schopnost ultrasonografie detekovat volnou tekutinu a tuto tekutinu pod kontrolou USG drénovat z něj dělá ideální nástroj pro primární vyšetření šokových stavů. Jedná se především o rychlé cílené vyšetření perikardu, obou pleurálních dutin pro hemotorax a pneumotorax a diagnostiku hemoperitonea. Toto vyšetření nezabere více než několik desítek sekund při současném zajišťování pacienta invazivními kanylacemi. V závislosti na objemu krve v drénech a dynamice krvácení je bez dalšího prodlení indikována torakotomie, v případě hemoperitonea laparotomie. Je třeba si uvědomit, že transport i na blízké CT a postupná diagnostika hrudníku, břicha a hlavy může v závislosti na kvalitě spirální mechaniky a RTG vyšetření vést ke ztrátě času a zhoršení šance na přežití. Toto CT vyšetření je lépe provést až po iniciálním USG vyšetření, které souhrnně tvoří cílené ultrasonografické vyšetření při traumatu (Focused Assessment with Sonography for Trauma – FAST) [46]. Tento koncept během posledních let vytěsnil z použití diagnostickou peritoneální laváž jako iniciální diagnostiku abdominálního traumatu [47] a lze ho použít v diferenciální diagnostice jakéhokoli hemodynamického kolapsu. Masivní hemoperitoneum lze rychle diagnostikovat vyšetřením Morrisonova prostoru v 82–90 % případů, vyšetření je nutné doplnit o perisplenickou oblast, pánev (retrovezikálně a paravezikálně) a parakolické prostory. Negativní FAST obvykle znamená, že pacient má jiný zdroj krvácení než výše uvedené dutiny – nelze vyloučit retroperitoneum, intraparenchymové krvácení či traumatické krvácení do trávicího traktu. Vyšetření je omezeno u obézních a u podkožního emfyzému. Indikace k torakotomii na podkladě množství hemotoraxu jsou známy (> 800 ml jednorázově, nebo pokračující krvácení > 200 ml/hod). Indikace k laparotomii na podkladě sonografické kvantifikace krve v peritoneální dutině je obtížněji definovatelná. Má význam nejvíce v subakutní fázi konzervativně řešených parenchymových traumat primárně diagnostikovaných s pomocí CT (subkapsulární ruptury jater a sleziny). Lze shrnout, že čím těžší je trauma, tím je výtěžnost USG větší. Echokardiografie u traumatu vylučuje kromě hemoperikardu především trauma aorty, v tomto případě při podezření provádíme transezofageální vyšetření (obr. 3).
Zobrazení horních dýchacích cest a trachey
Význam ultrasonografie spočívá v diagnostice polohy ET (endotracheální) kanyly, zvláště při použití biluminální rourky a vyšetření spodiny dutiny ústní a krku před provedením perkutánní dilatační tracheostomie (PDTS). Jestliže je endotracheální kanyla dobře zavedena, vidíme bilaterální pohyb bránice a oboustrannou expanzi plic s posunem pleurálních listů. V případě vyřazení plíce z ventilace je patrný „plicní pulz“ přenesením srdečních pulzací a absenci posunu pleurálních listů. Toto vyšetření nahrazuje auskultační nález a bronchoskopii, která je obtížná při použití úzkých biluminálních rourek. Vyšetření krku před PDTS pomáhá rozhodnout o supraistmické vs infraistmické preparaci kanálu na tracheu a změřit hloubku kanálu, což pomáhá s výběrem vhodného typu tracheostomické kanyly. Přínosná je vizualizace vaskulárních struktur před tracheou. Před výkonem lze pod kontrolou USG povytáhnout ET kanylu mimo místo punkce a měřit průměr trachey pro volbu správné kanyly [48].
Transkraniální dopplerovská sonografie
Význam transkraniálního dopplerovského sonografického vyšetření (Transcranial Doppler – TCD) je v diagnóze a monitoringu vazospazmu u pacientů se subarachnoidálním krvácením (SAH), detekci elevací intrakraniálního tlaku (Intracranial Pressure – ICP), reaktivity na změny ventilace a v diagnóze mozkové smrti.
Vazospazmus se vyskytuje až u 40 % pacientů s aneuryzmatickým subarachnoidálním krvácením (SubArachoideal Hemorrhage – SAH) a asociuje s 15–20 % rizikem mozkové ischemie a smrti [49]. Diagnóza spazmu s pomocí TCD je založena na principu inverzního vztahu průtoku krve v arterii k ploše průtokového ústí (lumen arterie) [50]. Se zužováním cévy při spazmu dochází ke zrychlení průtokových rychlostí. Vyšetření z temporálního okna umožnuje vyšetřit a. cerebri media (ACM), a. cerebri anterior (ACA), podobně lze z orbitálního okna vyšetřit intrakraniální část vnitřní karotidy (arteria carotis interna – ACI) a z foraminálního okna suboccipitálně a. cerebri posterior (ACP), vertebrální (AV) a bazilární (AB) tepnu. Submandibulárně lze vyšetřit extrakraniální část ACI. TCD obvykle vyšetřujeme 2. den po SAH pro získání referenčních parametrů. Kontrolní TCD měření pokračuje po prvních 14 dní. Vazospastická ACM má obvykle rychlosti nad 120 cm/s [12], rychlosti nad 200 cm/s asociují s průměrem ACM < 1 mm (normální průměr ACM je 3 mm). Nižších rychlostí pro diagnózu je třeba pro ACA, pro AV a AB již > 80–95 cm/s. TCD má senzitivitu 38–91 % a specificitu 94–100 % pro detekci vazospazmu na ACM. Extrakraniální vyšetření cervikální ACI je důležité pro stanovení Lindegaardova indexu zohledňujícího průtok mozkovými tepnami vůči průtoku extrakraniálně. Nejvyšší rychlost intrakraniálně je v čitateli indexu a nejvyšší rychlost na stejnostranné extrakraniální ACI je ve jmenovateli indexu. Lindegaardův index [51] je normálně 1,7 ± 0,4 [52] a s ohledem na anatomické odchylky v populaci je důležité stanovení individuální výše tohoto indexu před obdobím vazospazmů. ACM/cervikální ACI index > 3 implikuje středně významný proximální ACM vazospazmus, index > 6 se asociuje s těžkým vazospazmem. U AB je těžký vazospazmus již při indexu (vůči extrakraniální části AV) > 3. Kompletní vyšetření ACM, ACI a ACA je výtěžnější než izolované vyšetření ACM.
U mozkového edému v rámci kraniocerebrálního poranění byl při hodnotách CPP < 70 mm Hg nalezen vzestup v TCD indexu pulsatility (pulsatility index = [peak systolic velocity – end-diastolic velocity]/timed mean velocity). Podobně byl nacházen vztah umožňující odvodit CPP z TCD vyšetření [53], jehož přesnost závisí na korelaci ACM průtoků a celkových průtoků mozkem. Zhoršení reaktivity na změny pCO2 a ztráta tlakové autoregulace asociuje se špatným neurologickým výsledkem po kraniocerebrálním poranění [54]. TCD lze použít k měření reaktivity na změny CO2 reaktivity a tlakové autoregulace, což může intenzivistům umožnit upravit CPP a UPV pro individuálního pacienta.
Diagnóza mozkové smrti zahrnuje krátké systolické průtoky s obráceným nebo žádným průtokem v diastole nebo průtok není TCD detekovatelný vůbec (obr. 6). TCD má pro diagnózu mozkové smrti 98% specificitu a 75% senzitivitu [55]. Význam vyšetření v našich podmínkách je od roku 2013 pro diagnostiku mozkové smrti pomocí USG jako metody doplňující klinické vyšetření. Odpadá tím na invazivitu, kontrast, transport a náklady náročnější angiografie či scintigrafie.
Table 1. Transkraniální dopplerovská sonografie u pacientky s klinickým nálezem mozkové smrti, který byl vzápětí verifikován angiograficky. V diastole patrný reverzní průtok na pravé a. cerebri media 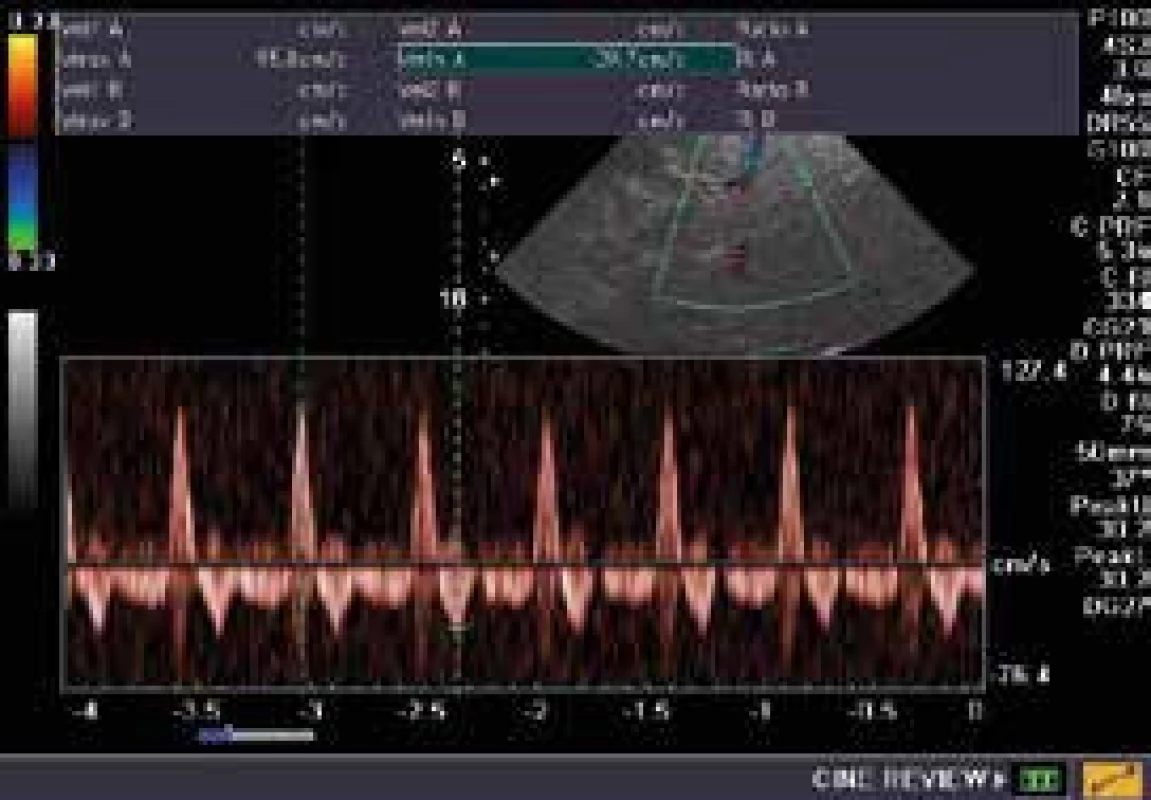
Vyšetření cévního systému
USG vyšetření pro suspektní žilní trombózu spočívá ve verifikaci zachovaného lumen žíly a jeho kolapsibility při přímém tlaku sondou. V případě trombu lumen nekolabuje. Vyšetření pokračuje aplikací „duplexní sonografie“ neboli kombinací 2 modalit: barevné a pulzní dopplerovské sonografie. Po zaměření základních hodnot vyšetřující zvedne končetinu nebo zmáčkne periferii (lýtko) a sleduje odpověď v dopplerovském vyšetření. Chronický trombus je více echogenní, může být i centrálně rekanalizován. Tromby obvykle hledáme v oblasti dolních končetin, dolní duté žíly, jater a zkušený sonografista v oblasti pánve. V prostředí intenzivní péče však nacházíme významné procento trombóz i v oblasti horní hrudní apertury související s kanylacemi centrálního žilního systému. Práce uvádějí, že až 18 % všech hlubokých žilních trombóz pochází z oblasti horních končetin [56].
Kanylace a jiné invazivní cévní postupy pod kontrolou USG
U pacientů s rizikem krvácení je na místě před rizikovou kanylací využít možnosti zaměření centrální žíly nebo arterie např. s pomocí lineární sondy. V ideálním případě takový postup ušetří pacienta transfuze destiček. Kanylaci lze provést pod přímou kontrolou USG s pomocí speciálního sterilního nástavce na sondu do kterého se vkládá punkční jehla nebo s nepřímou kontrolou, kdy kanylujeme po označení průběhu žíly (obr. 7). Problém při přímé kontrole je v transverzálním zaměření cévy, kdy kontrastní bod v žíle lze považovat za hrot, ale stejně dobře se může jednat o část jehly za hrotem.
Image 6. Levá vnitřní jugulární žíla přibližně na úrovni vrcholu větvení sternálního a klavikulárního úponu m. sternocleidomastoideus, okrouhlé lumen pod ní a mediálně (z pohledu pacienta) je levá společná karotida 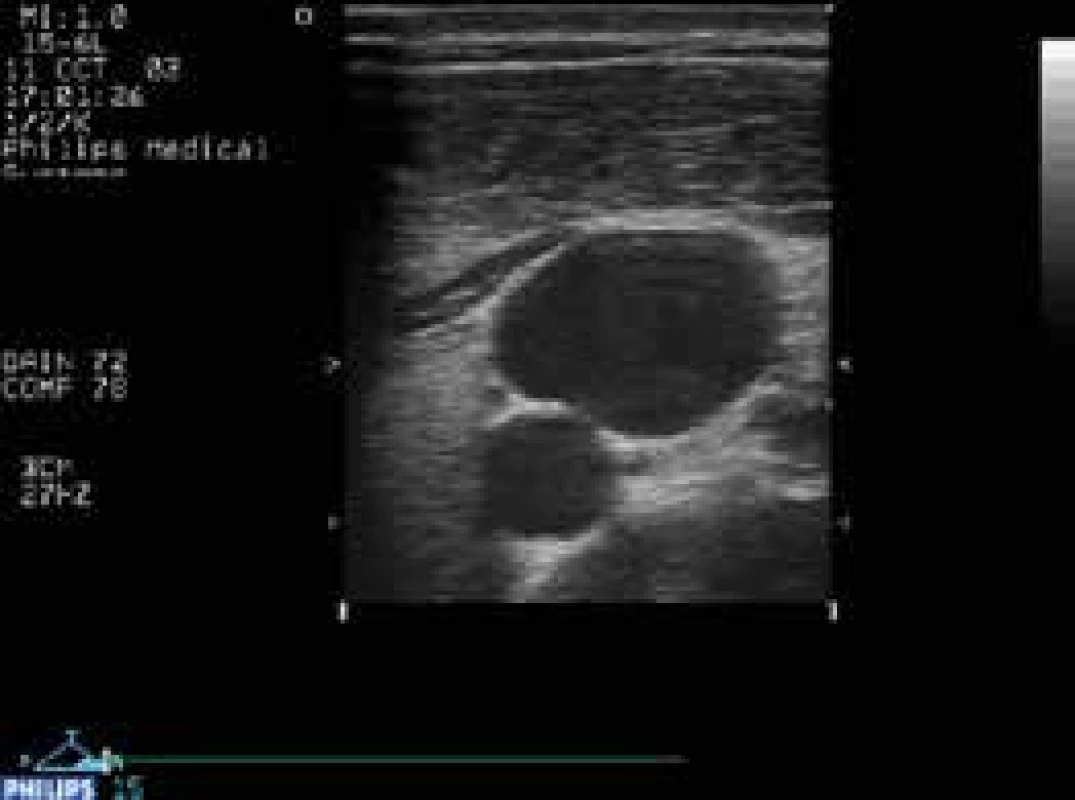
Důležitost zaměření např. vnitřní jugulární žíly u rizikových pacientů dokumentují anatomické práce nacházející tuto cévu na úrovni vrcholu větvení sternálního a klavikulárního úponu m. sternocleidomastoideus přibližně v 5 % mediálně od společné karotidy, v 15 % před společnou karotidou, v 80 % laterálně od ní a s četností 0–9 % za ní [57]. Déle trvající kanylace s pomocí USG se tedy může vyplatit v podobě nižšího počtu komplikací [58]. Vedle pacientů s trombocytopenií, koagulopatií, či anamnézou obtížné kanylace jsou v tomto případě absolutní indikace k USG navigované kanylaci. Těmi jsou kanylace arteriálního systému u pacienta bez pulzatilního srdečního výdeje na veno-arteriální extrakorporální membránové oxygenaci (Veno-Arterial-Extracorporeal Membrane Oxygenation – VA-ECMO a prográdní kanylace a. femoralis superficialis k zajištění periferní perfuze u pacientů s femorální inzercí VA-ECMO.
Zavedení externí stimulace patří mezi základní dovednosti intenzivisty, na které někdy závisí přežití pacienta. Nasměrování bipolární elektrody přes trikuspidální chlopeň do hrotu pravé komory usnadňuje transtorakální echokardiografie, zvláště v apikální 4 komorové projekci nebo v parasternální projekci na vtokový trakt pravé komory.
Intraaortální balonkovou kontrapulzaci lze velmi dobře zavádět pod kontrolou echokardiografie, při níž supraklavikulárně či transezofageálně můžeme optimálně umístit konec balonu pod odstup levé a. subclavia.
Podobně verifikace polohy ECMO kanyl je ideálně prováděna s pomocí TTE (VV-ECMO s kanylací ze dvou míst, VA-ECMO), nebo s asistencí TEE (VV-ECMO s kanylací dual lumen kanylou z v. jugularis interna).
Závěr
Pořizovací cena multimodálního ultrasonografického přístroje je značná. Tento přístroj však v rukou erudovaného intenzivisty může zachránit život pacienta a ušetřit čas, komplikace a náklady celému oddělení. Výstupy rozsáhlého spektra vyšetření jsou okamžitě aplikovány lékařem, který vyšetření provádí, pacient je ušetřen často komplikovaného transportu na CT, radiační a kontrastní zátěže. Současný rozvoj ultrasonografických metod v intenzivní péči slibuje další aplikace v dosud neprobádaných oblastech. Tento článek nabízí přehled ultrasonografických aplikací, které budou vyžadovat další výzkum a zavádění protokolů které dnes nelze odvodit z běžných postupů v kardiologii či radiologii.
Práce využívá data z ultrazvukovcýh přístrojů pořízených s grantovou podporou EU – projekt reg. No. CZ.2.16/3.1.00/21565 OP Prague Competitiveness.
doc. MUDr. Martin Balík, Ph.D., EDIC
Klinika anesteziologie, resuscitace a intenzivní medicíny 1. LF UK a VFN v Praze
Doručeno do redakce 31. 5. 2018
Přijato po recenzi: 28. 1. 2019
Sources
-
Balík M. Echokardiografie u kriticky nemocného. Anesteziologie a intenzivní medicína 2006; 17(2): 116–122.
-
Colreavy FB, Donovan K, Lee KY et al. Transesophageal echocardiography in critically ill patients. Crit Care Med 2002; 30(5): 989–996.
-
Poelaert J, Trouerbach J, De Buyzere M et al. Evaluation of Transesophageal Echocardiography as a Diagnostic and Therapeutic Aid in a Critical Care Setting. Chest 1995; 107(3): 774–779.
-
Benjamin E, Griffin K, Leibowitz AB et al. Goal-directed Transesophageal echocardiography performed by intensivists to assess left ventricular function: comparison with pulmonary artery catheterization. J Cardiothorac Vasc Anesth 1998; 12(1): 10–15.
-
Balík M, Pažout J, Fric M et al. Echokardiografie jako součást managementu hemodynamiky v intenzivní péči. Anesteziologie a neodkladná péče 2001; 12(3): 120–124.
-
Vincent JL, Dhainaut JF, Petrret C et al. Is the pulmonary artery catheter misused? A European view. Crit Care Med 1998; 26(7): 1283–1287.
-
Cholley B, Mayo P, Poelaert J et al. [Expert Round Table on Ultrasound in ICU]. International expert statement on training standards for critical care ultrasonography. Intensive Care Med 2011; 37(7): 1077–1083. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–011–2246–9>.
-
Vieillard-Baron A, Mayo PH, Vignon P et al. International consensus statement on training standards for advanced critical care echocardiography. Intensive Care Med 2014; 40(5): 654–666. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–014–3228–5>.
-
Lichtenstein D, Lascols N, Meziere G et al. Ultrasound diagnosis of alveolar consolidation in critically ill. Intensive Care Med 2004; 30(2): 276–281. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–003–2075–6>.
-
Lichtenstein D, Menu Y. A bedside ultrasound sign ruling out pneumothorax in the critically ill: lung sliding. Chest 1995; 108(5): 1345–1348.
-
Balik M, Plasil P, Waldauf P et al. Ultrasound estimation of volume of pleural fluid in mechanically ventilated patients. Intensive Care Med 2006; 32(2): 318. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–005–0024–2>.
-
Sahn SA. Pleural disease in critically Ill patient. In: Irwin RS, Cerra FB, Rippe JM (eds). Intensive Care Medicine. Lippincott Raven: Philadelphia 1999 : 710–727.
-
Coppage L, Jolles H, Henry DA. Imaging of the chest in the intensive care setting. In: Shoemaker WC, Ayres SM, Grenvik A et al (eds). Textbook of critical care. Saunders: Philadelphia 1995 : 332–347.
-
Eibenberger KL, Dock WI, Ammann ME et al. Quantification of pleural effusions: sonography versus radiography. Radiology 1994; 191(3): 681–684. Dostupné z DOI: <http://dx.doi.org/10.1148/radiology.191.3.8184046>.
-
Mayo PH, Goltz HR, Tafreshi M et al. Safety of Ultrasound-Guided Thoracentesis in Patients Receiving Mechanical Ventilation. Chest 2004; 125(3): 1059–1062.
-
Jones PW, Moyers JP, Rogers JT et al. Ultrasound-Guided Thoracentesis 2003. Is It a Safer Method? Chest 2003; 123(2): 418–423.
-
Fartoukh M, Azoulay E, Galliot R et al. Clinically Documented Pleural Effusions in Medical ICU Patients. How Useful Is Routine Thoracentesis? Chest 2002; 121(1): 178–184.
-
Barterr T. The Evaluation of Pleural Effusion. Chest 1994; 106(4): 1209–1214. Erratum in Chest 1995; 107(2): 592.
-
Lichtenstein D, Hulot JS, Rabiller A et al. Feasibility and safety of ultrasound-aided thoracentesis in mechanically ventilated patients. Intensive Care Med 1999; 25(9): 955–958.
-
Gattinoni L, Vagginelli F, Chiumello D et al. Physiologic rationale for ventilator setting in acute lung injury/acute respiratory distress syndrome patients. Crit Care Med 2003; 31(4 Suppl): S300-S304. Dostupné z DOI: <http://dx.doi.org/10.1097/01.CCM.0000057907.46502.7B>.
-
Ahmed SH, Ouzounian SP, Dirusso S et al. Hemodynamic and Pulmonary Changes after Drainage of Significant Pleural Effusions in Critically Ill, Mechanically Ventilated Surgical Patients. J Trauma 2004; 57(6): 1184–1188.
-
Talmor M, Hydo L, Gershenwald JG et al. Beneficial effects of chest tube drainage of pleural effusion in acute respiratory failure refractory to PEEP ventilation. Surgery 1998; 123(2): 137–143.
-
Vignon P, Chastagner C, Berkane V et al. Quantitative assessment of pleural effusion in critically ill patients by means of ultrasonography. Crit Care Med 2005; 33(8): 1757–1763.
-
Roch A, Bojan M, Michelet P et al. Usefulness of Ultrasonography in Predicting Pleural Effusions > 500 ml in Patients Receiving Mechanical Ventilation. Chest 2005; 127(1): 224–232. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.127.1.224>.
-
Peris A, Tutino L, Balik M et al. The use of point-of-care bedside lung ultrasound significantly reduces the number of radiographs and computed tomography scans in critically ill patients. Anesth Analg 2010; 111(3): 687–692. Dostupné z DOI: <http://dx.doi.org/10.1213/ANE.0b013e3181e7cc42>.
-
Tocino IM, Miller MH, Fairfax WR. Distribution of pneumothorax in the supine and semirecumbent critically ill adult. Am J Roentgenol 1985; 144(5): 901–905. Dostupné z DOI: <http://dx.doi.org/10.2214/ajr.144.5.901>.
-
McGonigal MD, Schwab CW, Kauder DR et al. Supplemented emergent chest CT in the management of blunt torso trauma. J Trauma 1990; 30(12): 1431–1435.
-
Lichtenstein D, Meziere G, Biderman R et al. The „lung point“: an ultrasound sign specific to pneumothorax. Intensive Care Med 2000; 26(10): 1434–1440.
-
Volpicelli G, Elbarbary M, Blaivas M et al. International Liaison Committee on Lung Ultrasound for International Consensus Conference on Lung Ultrasound (2012) International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med 2012; 38(4): 577–591. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–012–2513–4>.
-
Tsubo T, Yatsu Y, Suzuki A et al. Daily changes of the area of density in the dependent lung region – evaluation using transesophageal echocardiography. Intensive Care Med 2001; 27(12): 1881–1886. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–001–1115–3>.
-
Lichtenstein D, Meziere G, Biderman R et al. The comet-tail artifact: an ultrasound sign of alveolar-intersticial syndrome. Am J Respir Crit Care Med 1997; 156(5): 1640–1646. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm.156.5.96–07096>.
-
Lichtenstein D, Meziere G. Ultrasound diagnosis of an acute dyspnea. Crit Care 2003; 7(Suppl 2): P189. Dostupné z DOI: <http://dx.doi.org/10.1186/cc2078>.
-
Bouhemad B, Brisson H, Le-Guen M et al. Bedside ultrasound assessment of positive end-expiratory pressure-induced lung recruitment. Am J Respir Crit Care Med 2011; 183(3): 341–347. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201003–0369OC>.
-
Matamis D, Soilemezi E, Tsagourias M et al. Sonographic evaluation of the diaphragm in critically ill patients. Technique and clinical applications. Intensive Care Med 2013; 39(5): 801–810. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–013–2823–1>.
-
Chen SC, Yen ZS, Wang HP et al. Ultrasonography is superior to plain radiography in the diagnosis of pneumoperitoneum. Br J Surg 2002; 89(3): 351–354. Dostupné z DOI: <http://dx.doi.org/10.1046/j.0007–1323.2001.02013.x>.
-
Chen SC, Wang HP, Chen WJ et al. Selective use of ultrasonography for the detection of pneumoperitoneum. Acad Emerg Med 2002; 9(6): 643–645.
-
Ralls PW, Colletti PM, Lapin SA et al. Realtime sonography in suspected acute cholecystitis: Prospective evaluation of primary and secondary signs. Radiology 1985; 155(3): 767–771. Dostupné z DOI: <http://dx.doi.org/10.1148/radiology.155.3.3890007>.
-
Kadir S. Teaching Atlas of Interventional Radiology: Non-Vascular Interventional Procedures. Thieme: New York 2006. ISBN 978–1588900562.
-
Malecka-Panas E, Juszynski A, Chrzastek J et al. Pancreatic fluid collections: Diagnostic and therapeutic implications of percutaneous drainage guided by ultrasound. Hepatogastroenterology 1998; 45(21): 873–878.
-
Platt JF. Doppler ultrasound of the kidney. Semin Ultrasound CT MR 1997; 18(1): 22–26.
-
Sugrue M, Jones F, Deane SA et al. Intraabdominal hypertension is an independent cause of postoperative renal impairment. Arch Surg 1999; 134(10): 1082–1085.
-
Kirkpatrick AW, Colistro R, Fox DL et al. Renal arterial resistive index response to intra-abdominal hypertension in a porcine model. Crit Care Med 2007; 35(1): 207–2013.
-
Maio RF, Burney RE, Gregor MA et al. A study of preventable trauma mortality in rural Michigan. J Trauma 1996; 41(1): 83–90.
-
Papadopoulous IN, Bukis D, Karalas E et al. Preventable prehospital trauma deaths in a Hellenic urban health region: An audit of prehospital trauma care. J Trauma 1996; 41(5): 864–869.
-
Esposito TJ, Sanddal ND, Hansen JD et al. Analysis of preventable trauma deaths and inappropriate trauma care in a rural state. J Trauma 1995; 39(5): 955–962.
-
Scalea TM, Rodriguez A, Chiu WC et al. Focused assessment with sonography for trauma (FAST): Results from an international consensus conference. J Trauma 1999; 46(3): 466–472.
-
Wherrett LJ, Boulanger BR, McLellan BA et al. Hypotension after blunt abdominal trauma: The role of emergent abdominal sonography in surgical triage. J Trauma 1996; 41(5): 815–820.
-
Sustic A, Zupan Z, Esskinja N et al. Ultrasonography guided percutaneous tracheostomy with dilatation forceps after anterior cervical spine fixation. Acta Anaesthesiol Scand 1999; 43(10): 1078–1080.
-
Bleck TP. Rebleeding and vasospasm after SAH: New strategies for improving outcome. J Crit Illn 1997; 12 : 572–582.
-
Seiler R, Grolimund P, Huber P. Transcranial Doppler sonography: An alternative to angiography in the evaluation of vasospasm after subarachnoid hemorrhage. Acta Radiol Suppl 1986; 369 : 99–102.
-
Lindegaard KF, Nornes H, Bakke SJ et al. Cerebral vasospasm diagnosis by means of angiography and blood velocity measurements. Acta Neurochir (Wien) 1989; 100(1–2): 12–24.
-
Aaslid R, Markwalder TM, Nornes H. Noninvasive transcranial Doppler ultrasound recording of flow velocity in basal cerebral arteries. J Neurosurg 1982; 57(6): 769–774. Dostupné z DOI: <http://dx.doi.org/10.3171/jns.1982.57.6.0769>.
-
Steiner LA, Balestreri M, Johnston AJ et al. Sustained moderate reductions in arterial CO2 after brain trauma time-course of cerebral blood flow velocity and intracranial pressure. Intensive Care Med 2004; 30(12): 2180–2187. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–004–2463–6>.
-
Lee JH, Kelly DF, Oertel M et al. Carbon dioxide reactivity, pressure autoregulation, and metabolic suppression reactivity after head injury: A transcranial Doppler study. J Neurosurg 2001; 95(2): 222–232. Dostupné z DOI: <http://dx.doi.org/10.3171/jns.2001.95.2.0222>.
-
Dosemeci L, Dora B, Yilmaz M et al. Utility of transcranial Doppler ultrasonography for confirmatory diagnosis of brain death: Two sides of the coin. Transplantation 2004; 77(1): 71–75. Dostupné z DOI: <http://dx.doi.org/10.1097/01.TP.0000092305.00155.72>.
-
Blaivas M. Ultrasound in the detection of venous thromboembolism. Crit Care Med 2007; 35(5 Suppl): S224–S234.
-
Maecken T, Grau T. Ultrasound imaging in vascular access. Crit Care Med 2007; 35(5 Suppl): S178-S185.
-
Randolph A, Cook D, Gonzales C et al. Ultrasound guidance for placement of central venous catheters: A meta-analysis of the literature. Crit Care Med 1996; 24(12): 2053–2058.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2019 Issue 3-
All articles in this issue
- Nestabilní nemocný při prvním kontaktu s lékařem v nemocnici: jak rozpoznat riziko?
- Diagnostika hypovolemie a hypervolemie: od klinického vyšetření po moderní metody
- Význam ultrasonografického vyšetření v diagnostice akutních stavů
- Tekutinová léčba u akutních stavů pro neintenzivisty
- Syndrom akutní dechové tísně
- Úvodní antibiotická léčba závažných bakteriálních infekcí
- Hemoragický šok a léčba masivního krvácení
- Výživa v akutní fázi nemoci
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hemoragický šok a léčba masivního krvácení
- Tekutinová léčba u akutních stavů pro neintenzivisty
- Syndrom akutní dechové tísně
- Diagnostika hypovolemie a hypervolemie: od klinického vyšetření po moderní metody
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

