-
Medical journals
- Career
Novinky ve farmakologické léčbě srdečního selhání
: Jiří Vítovec 1; Jindřich Špinar 2; Lenka Špinarová 1
: I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně 1; LF MU, Brno 2
: Vnitř Lék 2019; 65(10): 611-619
:
Cílem léčby srdečního selhání je snížení mortality i snížení morbidity, především zlepšení kvality života a snížení hospitalizací. Základem léčby jsou inhibitory ACE (ACEI), ke kterým přidáváme blokátory mineralokortikoidních receptorů (MRA). V případě intolerance ACE jsou indikovány sartany – blokátory receptoru AT1 pro angiotenzin 2 (ARB). K blokátorům renin-angiotenzinového systému přidáváme betablokátory opět v maximálně tolerované dávce. K odstranění symptomů – otoků či dušnosti – jsou doporučena diuretika. U vybraných nemocných je vhodné přidat digoxin. Objevují se 3 nové lékové skupiny se slibnou budoucností: (1) Na základě výsledků studie PARADIGM-HF mohou být ACEI u symptomatických nemocných nahrazeny inhibitorem receptoru AT1 pro angiotenzin 2 a inhibitorem neprilyzinu – ARNI, genericky sakubitril/valsartan. (2) U diabetes mellitus jsou současně vhodnými léky na srdeční selhání skupina inhibitorů receptorů pro sodíko-glukózový kotransportér 2 (SGLT2). (3) Rozsáhlý výzkum je prováděn s látkou omecamtiv mecarbil u akutního srdečního selhání a dalšími perspektivními léky.
Klíčová slova:
inhibitory SGLT2 – srdeční selhání – ACE inhibitory – farmakoterapie – nové léky – omecamtiv mecarbil – sakubitril/valsartan
Cíle léčby srdečního selhání
Cílem léčby pacientů se srdečním selháním je zlepšit jejich klinický stav, funkční kapacitu i kvalitu života, zabránit jejich hospitalizaci a snížit mortalitu. Evropská doporučení 2016 poprvé staví kvalitu života na rovnocennou úroveň mortalitě, a tedy léky, které zlepšují kvalitu života, resp. snižují počet hospitalizací, jsou stejně důležité jako léky s prokázaným efektem na mortalitu. Strategii farmakologické i nefarmakologické léčby ukazuje schéma 1.
Schéma 1. Algoritmus léčby pacienta se symptomatickým srdečním selháním se sníženou ejekční frakcí 
ACEI – ACE inhibitory ARB – angiotenzin 2 blokátory receptoru AT1/sartany ARNI – inhibitor receptoru AT1 pro angiotenzin 2 a inhibitor neprilyzinu CRT – resynchronizační terapie EF – ejekční frakce H-ISD – hydralazin-izosorbiddinitrát LVAD – levokomorová srdeční podpora MRA – blokátory mineralkortikoidních receptorů Je prokázáno, že neurohumorální antagonisté (ACEI, ARB, MRA a betablokátory) prodlužují přežití pacientů se srdečním selháním a sníženou ejekční frakcí (Heart Failure with reduction of Ejection Fraction – HFrEF), a jsou proto doporučovány pro léčbu každého pacienta, pokud nejsou kontraindikovány nebo netolerovány. Zatím nebylo prokázáno, že by sartany (ARB) snižovaly úmrtnost nemocných s HFrEF více než ACEI, proto by se jejich podávání mělo omezit na intoleranci ACEI, nebo ty kteří užívají ACEI, ale nesnášejí MRA. Při intoleranci MRA je tedy někdy doporučena kombinace inhibitorů ACE + ARB, ale za kontrol u kardiologa či internisty. Ivabradin, lék blokující If kanál v sinusovém uzlu, snižuje zvýšenou srdeční frekvenci u nemocných se sinusovým rytmem, s níž se lze často u HFrEF setkat; rovněž bylo prokázáno, že zlepšuje výsledek léčby, a jeho použití je tedy třeba ve vhodných případech zvážit [1–3].
Výše uvedené léky je u pacientů se symptomy anebo se známkami městnání nutno užívat spolu s diuretiky. Podávání diuretik je nutno upravit podle klinického stavu pacienta.
Léčba doporučená u symptomatických pacientů se srdečním selháním se sníženou ejekční frakcí (HFrEF)
Inhibitory angiotenzin-konvertujícího enzymu
Je prokázáno, že ACEI snižují mortalitu a morbiditu pacientů s HFrEF a jejich užívání se doporučuje, pokud nejsou kontraindikovány nebo netolerovány, u všech nemocných se sníženou ejekční frakcí. Tyto důkazy byly nejdříve popsány ve studii CONSENSUS u nemocných s těžkým symptomatickým srdečním selháním, později i u nemocných s lehčím srdečním selháním, např. ve studiích SAVE a SOLVD. ACEI je nutno postupně titrovat až na maximální tolerovanou dávku. Ve studii ATLAS bylo prokázáno, že vysoká dávka lisinoprilu snižuje mortalitu a hospitalizace více než malá dávka. Existují důkazy, že v klinické praxi užívá většina pacientů suboptimální dávky ACEI. Inhibitory ACE jsou rovněž doporučovány u pacientů s asymptomatickou systolickou dysfunkcí levé komory (LK). Evropská doporučení uvádějí ACEI ramipril, trandolapril a lisinopril a jako historické enalapril a kaptopril [1–3].
Blokátory receptoru AT1 pro angiotenzin 2
Sartany (ARB) měly např. ve studiích ELITE II, OPTIMAL či VAL-HEFT srovnatelný efekt s ACEI, proto jsou doporučeny jako náhrada za ACEI při intoleranci (suchý kašel, angioedém). ESC Guidelines 2016 doporučují i kombinaci ACEI + sartanů v případě intolerance MRA. Doporučeny jsou losartan, kandesartan a valsartan [1,2].
V programu CHARM bylo sledováno 7 601 pacientů, kteří byli vybráni ze 3 rozdílných skupin:
- pacienti s ejekční frakcí < 40 %, kteří neužívali ACEI pro jeho nesnášenlivost
- pacienti, kteří souběžně užívali ACEI
- pacienti s ejekční frakcí > 40 %
Souhrn všech 3 studií prokázal účinnost kandesartanu na morbiditu a mortalitu u nemocných netolerujících ACEI, avšak minimální účinnost, pokud byl kandesartan přidán k ACEI, nebo podáván u nemocných se zachovanou ejekční frakcí [4].
Antagonisté mineralokortikoidních receptorů (MRA)
Podávat MRA (spironolakton a eplerenon) se doporučuje všem symptomatickým pacientům (i přes léčbu ACEI a betablokátorem) se srdečním selháním a ejekční frakcí ≤ 35 % s cílem snížit mortalitu a hospitalizace. Příznivý vliv byl prokázán např. ve studii EPHESUS [1]. MRA tedy přidáváme k ACEI či sartanům všem symptomatickým nemocným.
Opatrnosti je třeba, pokud se MRA podává pacientům s poškozením renálních funkcí a nemocným s hodnotami draslíku v séru > 5,0 mmol/l. Podle klinického stavu je nutno pravidelně kontrolovat hodnoty draslíku v séru a renální funkce. Doporučeny jsou spironolakton a eplerenon [2].
Betablokátory
Betablokátory snižují mortalitu a morbiditu většiny symptomatických pacientů s HFrEF i přes užívání ACEI. Existuje shoda, že se betablokátory a ACEI navzájem doplňují a že je lze začít podávat okamžitě po stanovení diagnózy srdečního selhání. Toto bylo prokázáno např. ve studiích MERIT, COPERNICUS či CAPRICORN [1,3]. Zdá, se že u ambulantních nemocných je vhodnější začít inhibicí ACE či sartanem a poté titrovat dávku betablokátoru. Zatím nejsou k dispozici žádné důkazy podporující zahájení léčby betablokátorem před zahájením podávání ACEI či sartanem. Studie CIBIS III vyšla v tomto směru neutrálně [1,2].
Betablokátory je nutno začít podávat klinicky stabilizovaným pacientům v nízkých dávkách a dávku pozvolna titrovat až do maximální snášené dávky. U pacientů přijatých do nemocnice pro akutní srdeční selhání (ASS) je nutno betablokátory začít podávat s opatrností ihned poté, co bylo dosaženo stabilizace pacienta.
Metaanalýza údajů jednotlivých pacientů všech hlavních studií s betablokátory u HFrEF neprokázala přínos betablokátorů (BB) z hlediska hospitalizací a mortality u podskupiny pacientů s HFrEF a fibrilací síní. Protože se však jednalo o retrospektivní podskupinovou analýzu a protože betablokátory riziko nezvýšily, rozhodl výbor pro doporučené postupy nevydat samostatné doporučení na základě poruch srdečního rytmu. Doporučené BB jsou bisoprolol, karvedilol, metoprolol sukcinát (ZOK) a nebivolol [1].
V roce 2015 se na českém trhu objevila výhodná fixní kombinace betablokátoru a ACEI pod názvem Cosyrel, ve kterém je obsažen bisoprolol fumarát a perindopril arginin.
Inhibitor kanálu If
Ivabradin zpomaluje srdeční frekvenci inhibicí kanálu If v sinusovém uzlu, a je tedy nutno jej podávat pouze pacientům se sinusovým rytmem. U pacientů se symptomatickým HFrEF a s EFLK ≤ 35 %, sinusovým rytmem a srdeční frekvencí ≥ 70 tepů/min snížil ivabradin ve studii SHIFT incidenci souhrnného sledovaného parametru mortality a hospitalizací pro srdeční selhání. Evropská léková agentura (European Medicines Agency – EMA) schválila ivabradin k použití v Evropě u pacientů s HFrEF a s EFLK ≤ 35 %, sinusovým rytmem při klidové srdeční frekvenci ≥ 75 tepů/min [1,2].
Diuretika
Diuretika se doporučují ke zmírnění známek a symptomů městnání u pacientů s HFrEF; účinky této lékové skupiny však v randomizovaných klinických studiích dosud nebyly a pravděpodobně nebudou hodnoceny. Kličková diuretika vyvolávají intenzivnější a kratší diurézu než tiazidová diuretika. Obě skupiny působí synergicky a jejich kombinaci lze použít k léčbě rezistentních otoků. Dávku diuretik je nutno v průběhu času upravovat podle individuálních potřeb. U vybraných asymptomatických euvolemických/hypovolemických pacientů je možno diuretika (dočasně) vysadit. Pacienty lze vyškolit, aby si sami mohli upravovat dávku diuretika podle symptomů/známek městnání a každodenní kontroly tělesné hmotnosti. Z kličkových diuretik se požívá furosemid a torasemid, z tiazidových hydrochlorotiazid, chlortalidon a indapamid a z kalium šetřících verospiron a spironolakton a existuje taktéž amilorid a triamteren [1,2].
Kombinace hydralazinu a izosorbiddinitrátu
Tato kombinace byla testována ve studii A-HEFT u afro-americké populace a ukázala příznivý účinek na mortalitu u srdečního selhání. Vzhledem k tomu, že hydralazin v perorální formě v ČR není k dispozici, pro naše nemocné jej nelze používat [5].
Digoxin
Použití digoxinu lze zvážit u pacientů se sinusovým rytmem a symptomatickým HFrEF s cílem snížit riziko hospitalizací. Účinky digoxinu u pacientů s HFrEF a fibrilací síní nebyly v randomizovaných klinických studiích hodnoceny a studie z nedávné doby naznačily potenciálně vyšší riziko příhod (mortality a hospitalizací pro srdeční selhání) u pacientů s fibrilací síní užívajících digoxin. Toto zjištění je však sporné. U pacientů se symptomatickým srdečním selháním a fibrilací síní se digoxin osvědčil při zpomalování rychlé komorové frekvence. Doporučuje se klidová komorová frekvence v rozmezí 70–90 tepů/min. Také je nutno kontrolovat a dodržovat plazmatickou koncentraci v rozmezí 0,5–0,9 ng/ml (0,64–1,2 nmol/l). Použití digoxinu ve studii DIG nesnížilo mortalitu, ale snížilo počet hospitalizací, tedy vedl ke zlepšení kvality života [1,2].
Nové lékové skupiny u chronického srdečního selhání
Inhibitor angiotenzinových receptorů a neprilyzinu
Byla vyvinuta nová léková skupina inhibující současně RAAS a neutrální endopeptidázu (Angiotenzin Receptor – Neprilyzin Inhibitor – ARNI). Prvním představitelem této skupiny je molekula slučující vlastnosti valsartanu a sakubitrilu (inhibitoru neprilyzinu).
V publikované studii PARADIGM-HF byly hodnoceny dlouhodobé účinky kombinace sakubitril/valsartanu ve srovnání s ACEI (enalapril) na morbiditu a mortalitu ambulantních pacientů s HFrEF a EFLK ≤ 40 % (tato hodnota se v průběhu studie změnila na ≤ 35 %), zvýšenými plazmatickými hodnotami NP (BNP ≥ 150 pg/ml nebo NT-proBNP ≥ 600 pg/ml, případně, pokud byli nemocní hospitalizováni pro srdeční selhání v předchozích 12 měsících, BNP ≥ 100 pg/ml, nebo NT-proBNP ≥ 400 pg/ml) a vypočítanou/odhadovanou glomerulární filtrací (GFR, eGFR) ≥ 30 ml/min/1,73 m2 povrchu těla, kteří ve vstupním období snášeli užívání enalaprilu (2krát 10 mg) i kombinace sakubitril/valsartanu (2krát 97/103 mg). Primární cíle vyzněly vysoce statisticky významně ve prospěch LCZ696, a to jak pro složený cíl kardiovaskulární úmrtí a první hospitalizace pro srdeční selhání (p < 0,001), tak pro oba jednotlivé podcíle, tedy pro kardiovaskulární mortalitu (p < 0,001), tak pro první hospitalizace pro srdeční selhání (p < 0,001). Statisticky významně byla nižší i celková mortalita (p < 0,001), graf 1, graf 2. Naopak pokles renálních funkcí a nový výskyt fibrilace síní byl v obou skupinách podobný [6–8].
1. Primární cíl ve studii PARADIGM-HF 
2. Úmrtí z kardiovaskulární příčiny ve studii PARADIGM-HF 
Z podskupinových analýz nebyl zásadní rozdíl pro kardiovaskulární úmrtí podle věku, pohlaví nebo rasy. Nebyl ani rozdíl podle klasifikace NYHA či renálních funkcí. Lehce významnější efekt byl pozorován u nediabetiků než diabetiků (p = 0,05). Rozdíl byl podobný u nemocných s i bez fibrilace síní a nebyl rozdíl podle ejekční frakce. Proto se kombinace sakubitril/valsartan doporučuje u pacientů s HFrEF, kteří splňují výše uvedený profil jako náhrada za ACEI či sartany [18]. V současnosti probíhá studie PARAGON-HF u srdečního selhání se zachovalou ejekční frakcí. Sakubitril/valsartan je registrován pod názvem Entresto.
Glifloziny – selektivní inhibitory transportéru pro sodík a glukózu 2 (sodium-glucose co-transporter 2)
Inhibitory SGLT2 – glifloziny byly do klinické praxe uvedeny jako perorální antidiabetika, která působí mechanizmem zvýšeného vylučování glukózy močí pomocí blokády kotransportéru SGLT2, čímž je zabráněno zpětnému vstřebání glukózy v ledvinách. Glifloziny (kanagliflozin, dapagliflozin, empagliflozin) přinesly do léčby diabetes mellitus převratný mechanizmus účinku, dlouho se totiž vůbec nevěřilo, že by bylo možné snižovat hladinu cukru v krvi cestou vylučování cukru močí.
Studie EMPA-REG OUTCOME byla prezentována na podzim roku 2015 a okamžitě vyvolala nadšení, ale i řadu diskusí [9–12]. Dlouhodobé multicentrické randomizované dvojitě zaslepené placebem kontrolované studie se zúčastnilo více než 7 000 pacientů ze 42 zemí světa s diabetes mellitus 2. typu s vysokým kardiovaskulárním rizikem. Medián doby sledování činil 3,1 roku. Pacienti užívali v kombinaci se standardní terapií 1krát denně perorálně buď 10 mg, nebo 25 mg empagliflozinu, nebo placebo. Standardní terapie zahrnovala kromě léčiv snižujících glykemii i antihypertenziva a hypolipidemika. Primárním sledovaným cílem byl výskyt úmrtí v důsledku kardiovaskulárních onemocnění a dále výskyt nefatálního infarktu myokardu nebo nefatální cévní mozkové příhody. Z celkového počtu zúčastněných dokončilo studii více než 97 % pacientů.
Empagliflozin v kombinaci se standardní terapií snížil výskyt úmrtí v důsledku kardiovaskulárních onemocnění a výskyt nefatálního infarktu myokardu nebo nefatální cévní mozkové příhody o 14 %. Během terapie došlo ke snížení mortality na kardiovaskulární choroby o 38 %. Užívání empagliflozinu také vedlo ke snížení celkové mortality o 32 % a k redukci hospitalizací pro srdeční selhání o 35 % (graf 3). Celkový bezpečnostní profil léku byl v souladu s předchozími studiemi. Nebyl pozorován rozdíl mezi placebem a empagliflozinem v incidenci diabetické ketoacidózy a zlomenin. Empagliflozin prokázal signifikantní snížení kardiovaskulárního rizika a mortality u diabetiků 2. typu s vysokým kardiovaskulárním rizikem.
3. Hospitalizace pro srdeční selhání ve studii EMPA-REG 
V roce 2017 prezentovaná studie CANVAS tyto informace potvrdila ve snížení počtu hospitalizací u srdečního selhání po kanagliflozinu (graf 4) [13].
4. Hospitalizace pro srdeční selhání ve studii CANVAS 
Rozsáhlý program probíhá s dapagliflozinem. Metaanalýza 21 studií potvrdila pozitivní trend na kardiovaskulární příhody. Studie DECLARE-TIMI 58 je velkou klinickou studií zahrnující velké počty nemocných jak s potvrzeným kardiovaskulárním onemocněním, tak rizikovými faktory. Studie ukázala významný pokles kombinovaného cíle ve výskytu srdečního selhání a kardiovaskulárního úmrtí (graf 5) [14].
5. Primární cíl: srdeční selhání a KV-úmrtí ve studii DECLARE-TIMI 58. Upraveno podle [14] ![Primární cíl: srdeční selhání a KV-úmrtí ve studii DECLARE-TIMI 58. Upraveno podle [14]](https://pl-master.mdcdn.cz/media/image_pdf/c24d60f291e699db00454eade334f24c.png?version=1578154896)
Data z reálného života – tzv. CVD REAL průzkum na více než 300 000 nemocných z celého světa potvrzují pozitivní výsledky z klinických studií v rámci kardiovaskulární bezpečnosti a prevence srdečního selhání [15].
Protože se objevují stále nová pozitivní data u srdečního selhání, byla zahájena studie DAPA HF – Study to Evaluate the Effect of Dapagliflozin on the Incidence of Worsening Heart Failure or Cardiovascular Death in Patients with Chronic Heart Failure with Reduced Ejection Fraction. Cílem studie DAPA HF je určit, zda je dapagliflozin výhodnější oproti placebu u nemocných se srdečním selháním se sníženou ejekční frakcí a se zvýšenými natriuretickými peptidy léčených základní – maximální – léčbou srdečního selhání na snížení kardiovaskulárních úmrtí a hospitalizací pro srdeční selhání. Předpokládá se zařazení asi 4 500 nemocných a doba sledování 2–3 roky [16]. V roce 2017 byly zahájeny i studie EMPEROR s empagliflozinem u systolického i diastolického srdečního selhání [21].
Omecamtiv mecarbil
Omecamtiv mecarbil je specifický srdeční aktivátor myozinu. U srdečního selhání je snížená kontraktilita v důsledku ztráty aktino-myozinových můstků. Snížený srdeční výdej způsobuje hypotenzi a aktivaci sympatického nervového systému. Současné pozitivně inotropní léky jako dobutamin mají paliativní, ale ne léčebný efekt, navíc mohou způsobovat arytmie a zvýšenou spotřebu kyslíku (schéma 2).
Schéma 2. Mechanizmus účinku omecamtiv mecarbilu 
CI – konfidenční interval/Confidence Interval HHF – hospitalizace pro srdeční selhání/Hospitalization for Heart Failure oGLD – jiné léky snižující hladinu glukózy/other Glucose-Lowering Drug SGLT2(i) – Sodium–GLucose co-Transporter 2 (inhibitor) Srdeční myocyty se kontrahují pomocí mostů mezi myofilamenty aktinem a myozinem. Chemická energie z ATP je přeměněna na mechanickou, což umožňuje myozinu se pevně navázat na aktin a způsobit kontrakci. Omecamtiv specificky aktivuje ATPázu a zlepšuje využití energie. Celkový efekt omecamtiv mecarbilu je prodloužení systolického ejekčního času a zvýšení srdečního výdeje. Toto způsobuje snížení tepové frekvence, zatímco spotřeba kyslíku myokardem není ovlivněna. Zvýšení srdečního výdeje je nezávislé na hladině intracelulárního vápníku a nezpůsobuje zvýšenou spotřebu energie či kyslíku. Celkovým výsledkem je efektivnější kontrakce [19].
Studie COSMIC-HF (Chronic Oral Study of Myosin Activation to Increse Contractility in Heart Failure) sledovala perorální podávání omecamtiv mecarbilu u pacientů s chronickým srdečním systolickým selháním a ejekční frakcí < 40 % ve funkční třídě NYHA II-III.
Ejekční frakce LK se statisticky významně zlepšila ve skupině fixní dávky (p = 0,025), zatímco ve skupině titrační byl patrný trend (p = 0,063) [18].
Omecamtiv mecarbil byl také testován v klinické studii ATOMIC AHF, což byla studie fáze 2 u akutního srdečního selhání. V této studii primární cíl – změna dušnosti – nedosáhl statistického významu, i když při nejvyšší dávce 310 ng/ml byl trend zlepšení dušnosti nejvýznamnější [19].
Léčba omecamtiv mecarbilem zlepšila strukturální a funkční parametry levé komory a rovněž vedla ke snížení tepové frekvence a humorální aktivace hodnocené pomocí NT-proBNP. Bezpečnost a tolerabilita byla srovnatelná s placebem. Je předpoklad, že by se tyto pozitivní výsledky mohly také promítnout do klinických výstupů [17–20].
Ve výzkumu nových léků pro srdeční selhání s nízkou ejekční frakcí je řada kandidátů a uvidíme, které z nich se uplatní v klinické praxi (tab) [20].
1. Nové léky pro léčbu srdečního selhání s nízkou ejekční frakcí v klinickém výzkumu 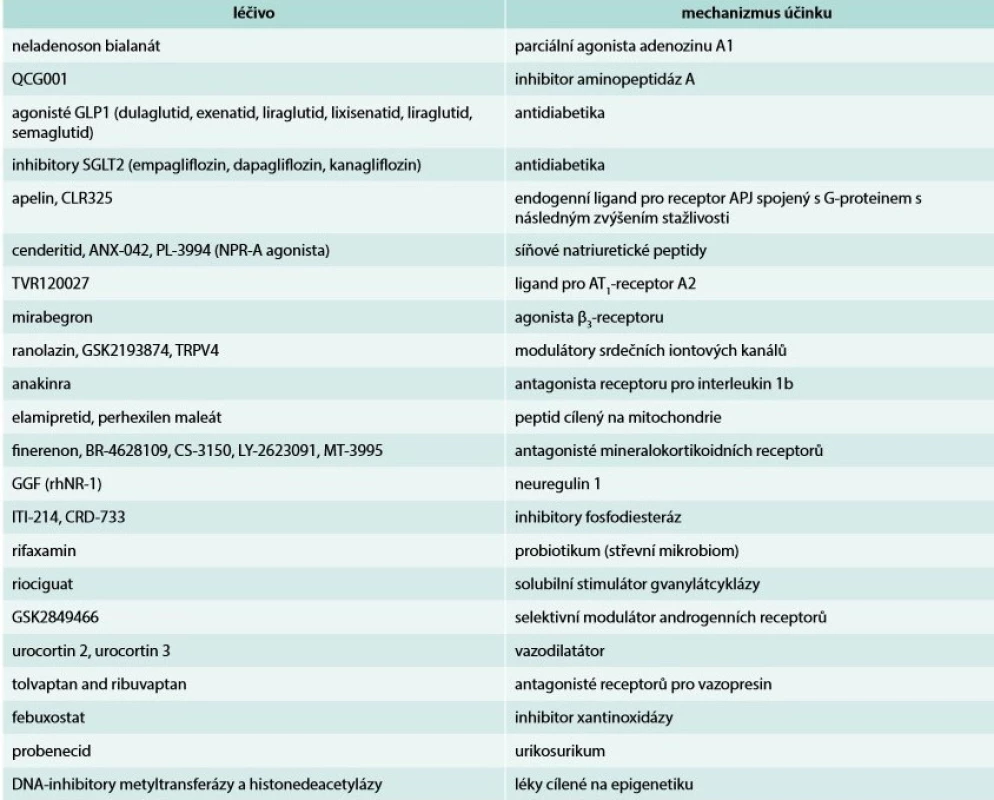
Závěr
Mnoho let byla základem léčby srdečního selhání diuretika a digoxin. Léky objevené pro léčbu toto onemocnění na konci 20. století jako inhibitory ACE, sartany, betablokátory či blokátory mineralokortikoidních receptorů se dlouhodobě zdály být nenahraditelné. V posledních 3 letech se však objevily zcela nové lékové skupiny, které se zdají být velmi slibné. Především sakubitril/valsartan, který by mohl nahradit blokátory renin-angiotenzinových receptorů (inhibitory ACE a ARB) a zcela nová perorální antidiabetika, glifloziny, která by mohla velmi účinným a metabolicky pozitivním diuretikem. Specifický srdeční aktivátor myozinu omecamtiv mecarbil na svou velkou studii stále čeká. Výzkum v této oblasti stále pokračuje a uvidíme, co přinese budoucnost.
Doručeno do redakce 13. 3. 2019
Přijato po recenzi 23. 9. 2019
prof. MUDr. Jiří Vítovec, CSc., FESC
I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
Sources
- Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129–2200. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehw128>. Erratum in Erratum [Eur Heart J 2018].
- Špinar J, Hradec J, Špinarová L et al. Summary of the 2016 ESC Guidelines on the diagnosis and treatment of acute and chronic heart failure. Prepared by the Czech Society of Cardiology. Cor Vasa 2016; 58(5): e530-e568. Dostupné z DOI: <http://dx.doi.org/10.1016/j.crvasa.2016.09.004>.
- Souček F, Novák J. Novinky v léčbě srdečního selhání. Vnitř Lék 2017; 63(4): 255–264.
- Pfeffer MA, Swedberger K, Granger CB et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM – Overall programme. Lancet 2003; 362(9386): 759–766. Dostupné z DOI: <http://dx.doi.org/10.1016/s0140–6736(03)14282–1>.
- Vítovec J. Vazodilatační léčba aneb 20 let klinických studií srdečního selhání. Cor Vasa 2006; 48(11): 373–375. Dostupné z DOI: <http://dx.doi.org/10.33678/cor.2006.121>.
- McMurray JJV, Packer M, Desai AS et al. Angiotensin-Neprilysin Inhibition versus Enalapril in Heart Failure. N Engl J Med 2014; 371(11): 993–1004. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1409077>.
- Špinar J, Špinarová L, Vítovec J. Studie PARADIGM-HF možná změní léčbu srdečního selhání? Hypertenze a KV prevence 2014; 3(2): 25–26.
- Špinarová L, Špinar J, Vítovec L. Co nám přináší studie PARADIGM-HF. Kardiol Rev Int Med 2014; 16(5): 395–397.
- Kvapil M. EMPA REG OUTCOME. Důkaz, že populace pacientů s diabetem se mění. Remedia 2016; 26(1): 67–72.
- McGill JB. The SGLT2 Inhibitor Empagliflozin for the Treatment of Type 2 Diabetes Mellitus: a Bench to Bedside Review. Diabetes Ther 2014; 5(1): 43–63. Dostupné z DOI: <http://dx.doi.org/10.1007/s13300–014–0063–1>.
- Vítovec J, Špinar J, Špinarová L. Empagliflozin a srdeční selhání. Hypertenze a KV prevence 2016; 5(2): 19–23.
- Zinman B, Wanner CH, Lachin JM et al. [EMPA-REG OUTCOME Investigators]. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373(22): 2117–2128. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1504720>.
- Neal B, Perkovic V, Mahaffey KV et al. [CANVAS Program Collaborative Group]. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med 2017; 377(7): 644–657. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1611925>.
- Wiviott SD, Raz I, Bonaca MP et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2019; 380(4): 347–357. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1812389>.
- Kosiborod M, Lam CSP, Kohsaka S et al. Cardiovascular events associated with SGLT-2 inhibitors versus other glucose-lowering drugs: the CVD-REAL 2 study. J Am Coll Cardiol 2018; 71(23): 2628–2639. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2018.03.009>.
- Špinar J, Vítovec J, Špinarová L. Diabetes mellitus a srdeční selhání: úloha inhibitorů SGLT2. AtheroRev 2018; 3(1): 40–45.
- Malik FI, Hertman JJ, Elias KA et al. Cardiac Myosin Activation: A Potential Therapeutic Approach For Systolic Heart Failure. Science 2011; 331(6023): 1439–1443. Dostupné z DOI: <http://dx.doi.org/10.1126/science.1200113>.
- Teerling JR, Felker GM, MsMurray JV et al. Chronic Oral Study of Myosin Activation to Increase Contractility in Heart Failure (COSMIC-HF): a phase 2, pharmacokinetic, randomised, placebo-controlled trial. Lancet 2016; 388(10062): 2895–2903. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(16)32049–9>.
- Teerlink JR, Felker GM, McMurray JJV et al. [ATOMIC-AHF Investigators]. Acute treatment with omecamtiv mecarbil to increase contractility in acute heart failure: the ATOMIC-AHF study. J Am Coll Cardiol 2016; 67(12): 1444–1455. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2016.01.031>.
- Vítovec J, Špinar J, Špinarová L et al. Léčba kardiovaskulárních onemocnění. Grada Praha: 2018. ISBN 978–80–271–0624–0.
- Rossignol P, Hernandez AF, Solomon SD et al. Heart failure drug treatment. Lancet 2019; 393(10175): 1034–1044. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(18)31808–7>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2019 Issue 10-
All articles in this issue
- Interdisciplinary cooperation for a maximum acceleration of availability of modern therapy for ischemic stroke for all patients in need of endovascular thrombectomy
- Innovations in pharmacological treatment of heart failure
- New european guidelines for the diagnosis and treatment of hypertension, issued in 2018 – brief comments
- Acute and recurrent pericarditis
- Prophylaxis for infective endocarditis – an endless story with a colorful past, an uncertain presence and unclear future
- Inflammatory myocardial disease
- Current and future trends in the treatment of dyslipidemias
- Genetic testing in patients with hypertrophic cardiomyopathy
- Takotsubo syndrome
- Úvodník
- Odešel profesor Marek, velký internista, endokrinolog, ale především velký člověk
- Z odborné literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Acute and recurrent pericarditis
- Innovations in pharmacological treatment of heart failure
- Takotsubo syndrome
- Prophylaxis for infective endocarditis – an endless story with a colorful past, an uncertain presence and unclear future
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

