-
Medical journals
- Career
Trimeresurus albolabris (štrkáčovec bieloústy) – hlásenie uhryznutia: kazuistika
Authors: František Nehaj 1; Marianna Kubašková 2; Michal Mokáň 1; Juraj Krivuš 1; Ivana Gomolová 1; František Kovář 1; Martin Jozef Péč 3; Marián Mokáň 1
Authors‘ workplace: I. Interná klinika JLF UK a UN Martin, Slovenská republika 1; Rádiologická klinika JLF UK a UN Martin, Slovenská republika 2; JLF UK Martin, Slovenská republika 3
Published in: Vnitř Lék 2018; 64(7-8): 802-806
Category: Case Reports
Overview
Toxikológia je špecializovaná vedná disciplína, ktorá sa zaoberá mikrobiologickými, rastlinnými a zvieracími jedmi, otravami a toxínmi. Táto disciplína nezahŕňa iba pôsobenie účinku a chemické zloženie toxínov, ale aj biologickú povahu organizmov produkujúcich jedovaté látky, štruktúru a funkciu aparátu syntetizujúceho tieto látky a ich možnosti použitia. Z medicínskeho hľadiska k dôležitým funkciám toxikológie patrí skúmanie vplyvu jedu na organizmus a terapia intoxikácie. Rod Trimeresurus, do ktorého patrí štrkáčovec bieloústy, je rozsiahly a zahŕňa približne 36 druhov štrkáčovcov. Hadie jedy majú rôzne zloženie, podľa ktorého môžu ovplyvňovať kardiovaskulárny a nervový systém, obličky, hemokoaguláciu, cievnu stenu a svalové bunky. V tejto práci prezentujeme ojedinelú kazuistiku uhryznutia hadom druhu štrkáčovec bieloústy a liečebný postup pri intoxikácii hadím jedom. Rýchle posúdenie, pozorovanie a včasný špecifický manažment sú kľúčom liečby intoxikácie hadím jedom.
Kľúčové slová:
hadí jed – hemotoxín – intoxikácia – jedom indukovaná konzumpčná koagulopatia – liečba – štrkáčovec bieloústy – Trimeresurus albolabris
Úvod
Štrkáčovce sú malé až stredne veľké hady so štíhlym a svalnatým telom v dĺžke od 40 do 120 cm. Hlava má charakteristický trojuholníkový tvar, farba tela je prevažne zelená, zelenožltá alebo zelenomodrá, ale môžu byť aj hnedej farby. Sú to nočné tvory a väčšina žije stromovým životom. Sú to rýchle hady s nervóznym charakterom a agresívnymi prvkami. Štrkáčovce sa vyskytujú v južnej a východnej Ázii – Indický polostrov, Nepál, Srí Lanka, Taiwan, Malajzia, Indonézia, južná časť Číny, Filipíny, Pakistan a Japonsko. Obývajú biotopy ako plantáže, bambusové a mangrovové porasty, lesy a pralesy v kopcovitých krajinách [1–9].
Jed štrkáčovcov je zložený prevažne z enzymatických komponentov, ako kininogenázy, enzýmy podobné kalikreínu uvoľňujúce bradykinín z kininogénu i priamo účinné enzýmy potencujúce funkciu bradykinínu a látky priamo ovplyvňujúce myokard. Medzi prodrómy systémovej intoxikácie patrí nauzea, vomitus, abdominalgie, hnačky a zvýšená telesná teplota. Letargia a mdloby sú prítomné pri závažnejších intoxikáciách. V prípade závažného zníženia krvného tlaku (v dôsledku systémovej vazodilatácie) môže stav progredovať do cirkulačného kolapsu až šoku s tachypnoe, cyanózou a kómou [9].
Lokálne a celkové prejavy intoxikácie jedu štrkáčovcov sú individuálne [7]. Miesto uhryznutia býva bolestivé, začervenané s krvácaním a opuchom, ktorý sa postupne rozširuje. Môžu sa tvoriť pľuzgiere, neskôr až nekrózy. Vzhľadom na prítomnosť cytotoxických enzýmov, ktorých cytotoxicita je nízka, vznikajú nekrózy prevažne následkom kompartment syndrómu v oblasti malých kĺbov prstov. Incidencia nekróz sa pohybuje okolo 2–3 %. Nekrózy často podliehajú sekundárnej infekcii. Približne u polovice prípadov sa pozoruje lymfadenopatia a bolestivosť regionálnych lymfatických uzlín, niekedy je dokonca nutné pristúpiť k amputácii nekrotických častí. V súbore 80 pacientov uhryznutých hadom Trimeresurus albolabris z Thajska bolo nutné amputovať nekrotické časti (v tomto prípade prsty) u 2 z 9 postihnutých pacientov [8]. Pri ťažkom lokálnom postihnutí trvá rekonvalescencia niekoľko mesiacov s možnými trvalými následkami v podobe deformácií a ankylózy kĺbov.
Podľa rozsahu lokálnych príznakov sa nedá posúdiť závažnosť intoxikácie. Existujú prípady s ťažkým lokálnym postihnutím s minimálnymi systémovými prejavmi a opačne. Najčastejšie prípady sú zväčša lokálnou reakciou so slabšou systémovou reakciou, čo je pravdepodobne spôsobené pomaly sa uvoľňujúcim jedom z miesta uhryznutia v tesných kompartmentoch. Tým sa zvyšuje lokálna devastácia tkaniva. Na druhej strane však jed preniká do systémovej cirkulácie veľmi pomaly.
Hadie jedy obsahujú veľké a rozličné množstvo biologicky aktívnych proteínov a peptidov, z ktorých niektoré ovplyvňujú hemostázu. Jed obsahuje zložky zvyšujúce permeabilitu ciev a hemoragíny [2]. Ďalšími komponentami jedu sú látky enzýmového charakteru ovplyvňujúce hemokoaguláciu. Ich pôsobením vznikajú poruchy hemostázy s prejavmi krvácania, ale aj trombotické komplikácie [3–6]. Tieto zložky ovplyvňujú koagulačný systém, endoteliálne bunky a krvné doštičky. Zložky jedu môžu byť rozdelené podľa účinku na hemostázu:
- enzýmy, ktoré zrážajú fibrinogén
- enzýmy, ktoré degradujú fibrin(ogén)
- aktivátory plazminogénu
- aktivátory protrombínu
- aktivátory faktoru V
- aktivátory faktoru X
- inhibítory protrombinázového komplexu, trombínu, fosfolipázy a aktivátoru proteínu C
- enzýmy s hemoragickou aktivitou
- enzýmy, ktoré degradujú inhibítory serínovej proteázy
- induktory doštičkovej agregácie
- inhibítory doštičkovej agregácie [10–14]
Na patofyziológii koagulačnej poruchy sa podielajú:
- primárna fibri(geno)lýza
- stimulácia plazmatického koagulačného systému aktiváciou koagulačných faktorov, alebo priamou aktiváciou protrombínu za vzniku koagulopatie konzumpčného typu
- konverzia fibrinogénu na fibrín (thrombin-like fibrinogen) vrátane vzniku stabilizovaného, ktorý je vo zvýšenej miere degradovaný a spôsobuje nárast D-dimérov.
V ťažších štádiách sa poruchy hemokoagulácie prejavia krvácaním, napr. z ďasien, nosa, do gastrointestinálneho traktu, vzácne aj do mozgu. K spontánnemu krvácaniu dochádza až u 20 % pacientov uhryznutých štrkáčovcom bieloústym. Pôsobením enzýmov podobných trombínu dochádza ku konzumpčnej koagulopatii typu podobnej diseminovanej intravaskulárnej koagulácie (DIK). Výsledkom je komplexná necharakteristická porucha koagulácie, ktorá sa udáva ako Venom-Induced Consumption Coagulopathy (VICC) [15,16]. K vzácnejším prejavom patrí oligúria, inkontinencia stolice, ako aj zmeny na elektrokardiograme (EKG) [10].
Podanie antiséra musí byť dôkladne zvážené. Riadime sa tzv. Štokholmskými kritériami (tab. 1) [17,18]. Indikáciou k podaniu antiséra sú poruchy hemokoagulácie, najmä s prejavmi krvácania. Avšak dochádza aj k situáciám, v ktorých je treba individualizovať podanie antiséra. Pri pretrvávaní celkových príznakov intoxikácie a rekurencii symptómov, je indikované opakované podanie antiséra. Absolútnou kontraindikáciou podania antiséra je alergia na použité zvieracie sérum alebo ťažká reakcia v alergickej anamnéze po podaní antitetanického séra. Pri alergii na konské sérum nie je možné podať ovčie, ktoré je produkované iba pre severoamerické štrkáčovce (CroFab) a európske vretenice (ViperaTab). Antisérum môže byť podané z vitálnej indikácie po antialergickej príprave.
Table 1. Štockholmské kritériá – indikácie na podanie antiséra 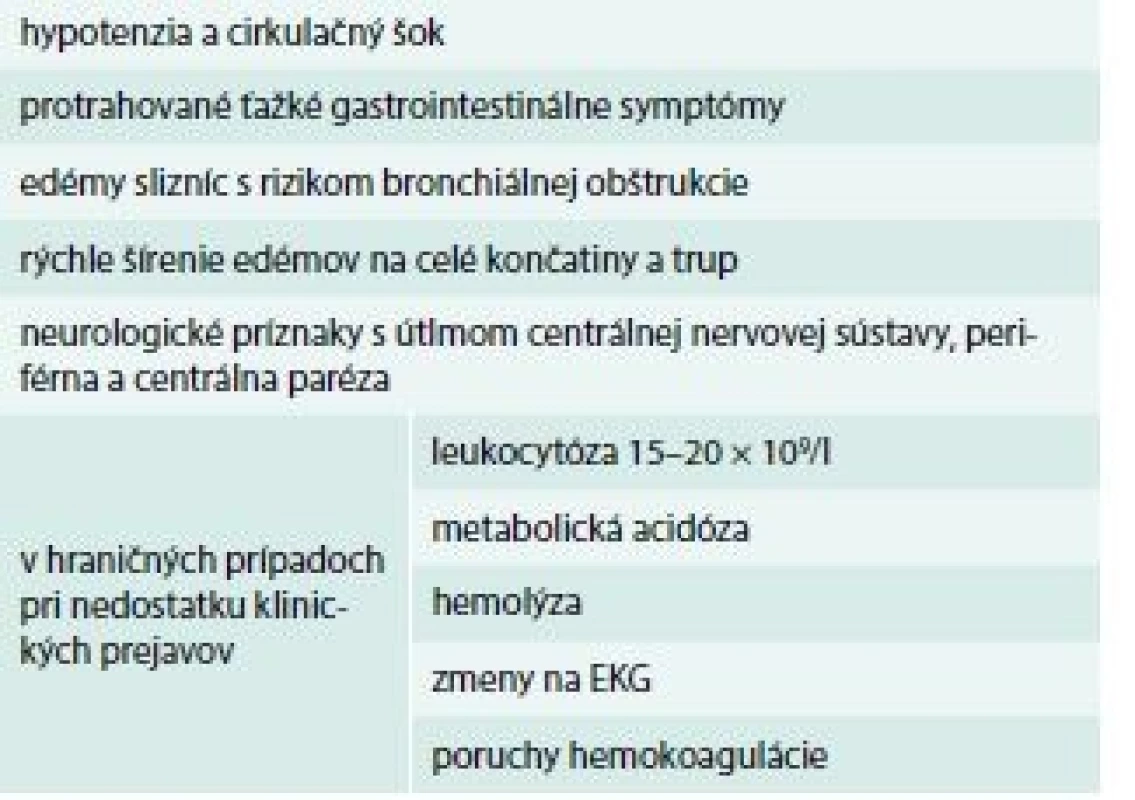
Kazuistika
22-ročný pacient bez závažného predchorobia bol prijatý na metabolickú jednotku intenzívnej starostlivosti po 1 hod a 30 min od uhryznutia ako suspektná intoxikácia hadím jedom. Anamnéza: Pacient sa vo voľnom čase venoval chovu exotických hadov. O 20 : 30 hod pri kŕmení štrkáčovca bieloústeho (Trimeresurus albolabris), ktorý neprijímal potravu 2 mesiace, vyberal laboratórnu myš pinzetou z terária. Počas tohto úkonu had uhryzol pacienta do palca ľavej hornej končatiny, na ktorom zostal visieť niekoľko sekúnd a pravdepodobne vypustil do pacienta značnú časť jedu nahromadeného počas 2 mesiacov.
Pri prijatí sa pacient sťažoval na sucho v ústach a bolesti celej ľavej hornej končatiny. V objektívnom náleze bol prítomný edém ľavej hornej končatiny od prstov až po ľavé rameno (obr. 1), pacient bol obnubilovaný, odpovedal s latenciou, opakovane mal riedke stolice bez prímesi krvi, sklony k hypotenzii (105–110/50–60 mm Hg) a sínusovú tachykardiu (110–120/min). Výsledky laboratórnych parametrov s časovým odstupom sú uvedené v tab. 2. Prvé výsledky odobraté po uhryznutí boli bez koagulopatie, bez patologických odchýlok v základnom biochemickom súbore a krvnom obraze. Službukonajúci lekár urgentného príjmu telefonicky konzultoval Národné toxikologické informačné centrum v Bratislave, ktoré nemalo antisérum k dispozícii, odporučili symptomatickú a podpornú liečbu s doporučením kontaktovať ďalšie toxikologické centrá v Prahe a v Mníchove.
Image 1. Uhryznutie hadom Trimeresurus albolabris 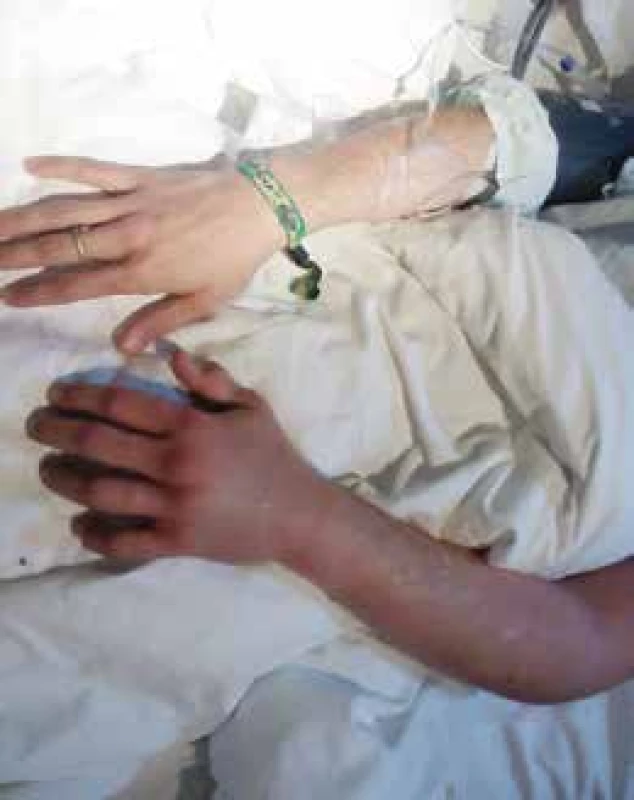
Table 2. Laboratórne parametre pacienta uhryznutého štrkáčovcom bieloústym 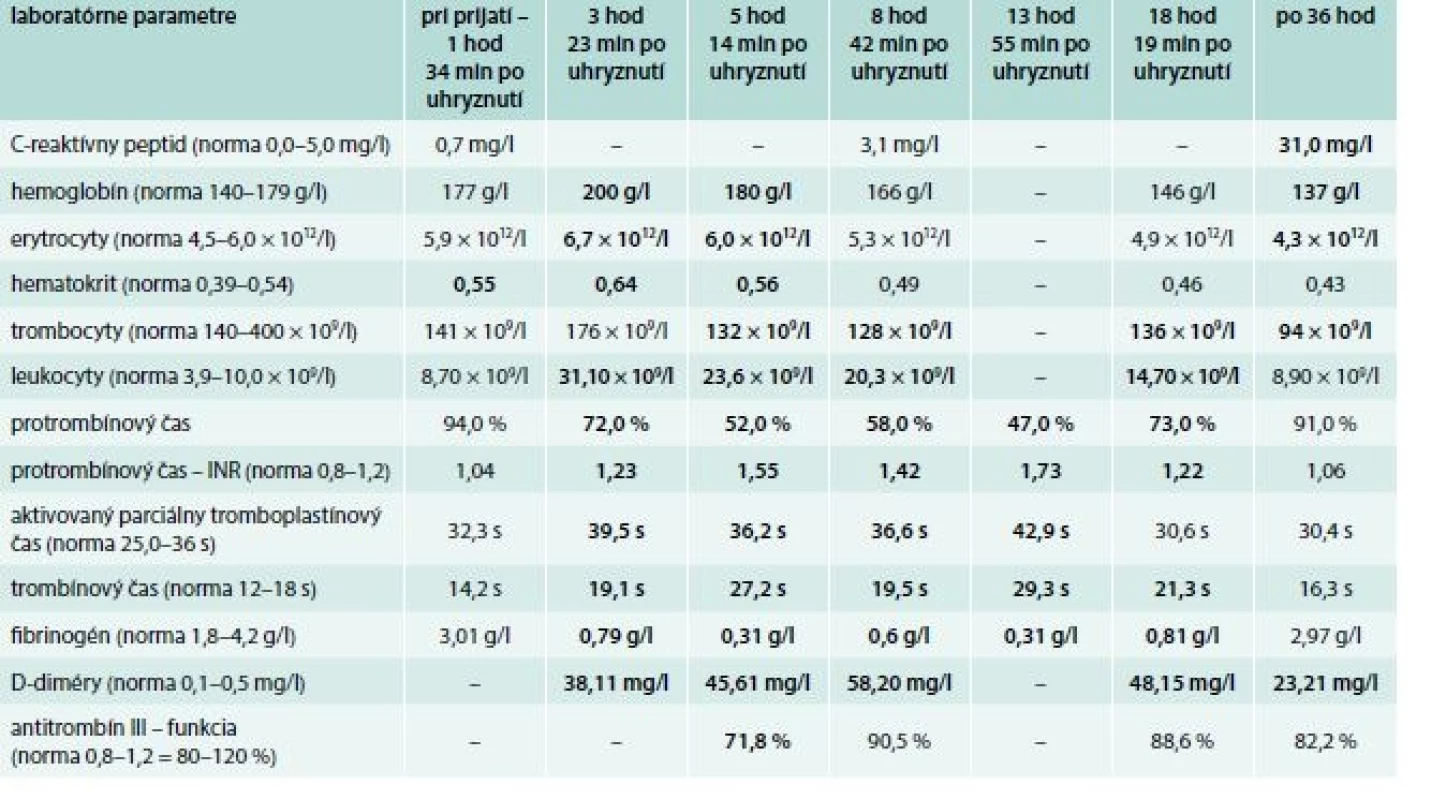
Vzhľadom na klinický stav pacienta, u ktorého boli prítomné lokálne aj systémové prejavy intoxikácie, bolo konzultované Toxikologické informačné stredisko (TIS) v Prahe, cez ktoré sa podarilo kontaktovať Toxikologické centrum Kliniky anestéziológie, resuscitácie a intenzívnej medicíny (KARIM) 1. lekárskej fakulty Karlovej Univerzity a Všeobecnej fakultnej nemocnice v Prahe. Na území Českej republiky nebolo antisérum taktiež dostupné. Kontrolné odbery s dostupnými výsledkami o 4 hod a 57 min po uhryznutí boli už s rozvíjajúcou sa VICC, polyglobúliou, leukocytózou s reaktívnou neutrofíliou, s ľahkou trombocytopéniou (konzumpčná). Bola zahájená substitúcia čerstvou mrazenou plazmou, fibrinogénom, antitrombínom a vitamínom K. Opakovane bolo konzultované Toxikologické centrum KARIM v Prahe s doporučením ďalšej konzultácie Toxikologického centra v Mníchove (Klinikum rechts der Isar, Technische Universität München), ktoré disponovalo týmto antisérom. Približne o 7 hod po uhryznutí po dohovore a vybavení potrebných administratívnych úkonov s lekárom z toxikologického centra v Mníchove bol zabezpečený transport antiséra osobným motorovým vozidlom nemeckej záchrannej služby do Bratislavy. Po 11 hod a 40 min od uhryznutia bolo antisérum dopravené do Bratislavy, odkiaľ bolo letecky prepravené na metabolickú jednotku v Martine.
Po 12 hod a 30 min od uhryznutia bolo pacientovi aplikované antisérum Green Pit Viper Antivenin (Thai Red Cross, Science Division, Thailand, obr. 2) po antialergickej príprave, konktrétne 3 ampulky v 250 ml izotonickom fyziologickom roztoku počas 40 min. Po 14 hod po uhryznutí pre systémové prejavy boli podané ďalšie 3 ampulky antiséra. Počas prvých 24 hod sa ešte pokračovalo v substitúcii čerstvou mrazenou plazmou, fibrinogénom, antitrombínom a vitamínom K. Počas hospitalizácie boli renálne a hepatálne parametre vo fyziologickom rozmedzí. Pacient bol po 5 dňoch prepustený do domácej ambulantnej starostlivosti bez zdravotných následkov s úpravou hematologických parametrov ad integrum s ústupom edému ľavej hornej končatiny (obr. 3).
Image 2. Antisérum Green Pit Viper antivenin (Thai Red Cross) 
Image 3. Štyri dni po uhryznutí 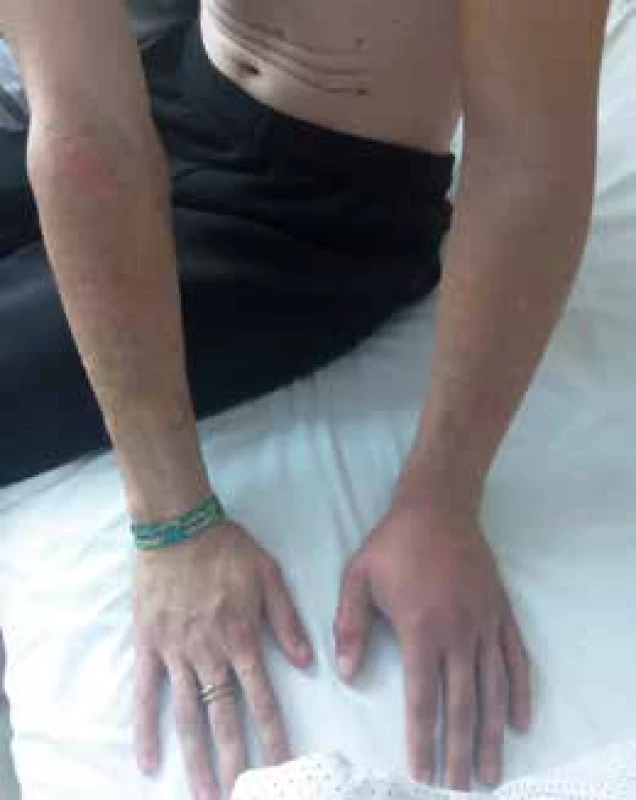
Diskusia
Pri hemotoxínoch je dôležitá pravidelná kontrola hemokoagulačných testov [10]. Tieto testy je nutné kontrolovať v pravidelných časových intervaloch (minimálne každé 4 hod), keďže sa môže predlžovať protrombínový čas (PT), aktivovaný parciálny tromboplastínový čas (APTT) a trombínový čas (TT). V tomto prípade je hladina fibrinogénu primárnym a najdôležitejším ukazovateľom laboratórneho sledovania koagulopatie. Substitúcia fibrinogénu je problematická a neodporúča sa až do podania antiséra, pretože dochádza k jeho deštrukcii a konzumpcii za vzniku degradačných produktov fibrínu vrátane D-dimérov. Vzhľadom na tento fakt je z klinického hľadiska substitúcia indikovaná na hranici afibrinogenémie. Vysoká hladina D-dimérov znamená generalizáciu trombínovej alebo trombínu podobnej aktivity s intravaskulárnou tvorbou stabilizovaných fibrín polymérových komplexov a komplexnej necharakteristickej poruche koagulácie typu VICC. Môže dôjsť aj k zmenám vo funkcii krvných doštičiek [14]. Substitúcia fibrinogénu by mala byť teda zahájená, ak sa jeho hladina blíži k nule a pacient má prejavy krvácania. Dôvodom substitúcie je prevencia pred následnou totálnou defibrináciou do finálneho riešenia, to znamená terapia antisérom. Podobne sa môže podať aj čerstvá mrazená plazma, ktorá obsahuje aj koagulačné faktory. Ak dôjde k zníženej aktivite antitrombínu konzumpciou alebo degradáciou proteázami nachádzajúcimi sa v jedoch, je doporučené zváženie jeho substitúcie. Táto liečba znižuje výskyt vzniku trombocytopénie, rozvoju hypotenzie a akútneho obličkového zlyhania. Pri prejavoch krvácania a ťažkom priebehu VICC treba zvážiť liečbu heparínom, ktorá nemá signifikantne pozitívne výsledky [11,17–20].
Záver
Pred zavedením možnosti podania antiséra bola v Japonsku do roku 1905 úmrtnosť na uhryznutie štrkáčovcom 11–24 % [11]. V 80. rokoch 20. storočia pri dostupnosti antiséra sa fatalita v Indonézii pohybovala okolo 2,4 % [13]. V minulosti sa exotické zvieratá vyskytovali len v zoologických záhradách, avšak v súčasnej modernej a multikulturálnej spoločnosti po splnení určitých podmienok je možné legálne chovať jedovaté hady, ktoré by v habitate a biotope strednej Európy neprežili. Vzhľadom na fakt, že každé antidotum má svoju exspiráciu a pri veľkom množstve jedovatých živočíchov, nie je možné uchovávať tieto špeciálne pripravené látky na jednom mieste. V tomto prípade treba zdôrazniť, že pacient choval exotické hady nelegálne. Existuje sieť odborníkov a špecializovaných toxikologických centier, vďaka ktorým sa dostane antidotum k pacientovi včas aj zo zahraničia, a tým sa zabráni najhoršiemu scenáru.
Táto práca bola podporená grantami VEGA 1/0187/17 a APVV-17-0054.
MUDr. František Nehaj
I. interná klinika JLF UK a UN, Martin, Slovenská republika
Doručeno do redakce 3. 1. 2018
Přijato po recenzi 11. 3. 2018
Sources
- Mattison C. Hadi. Ottovo nakladatelství: Praha 2001. ISBN 80–7181–478–4.
- Warrell DA. Bites of venomous snakes. N Engl J Med 2002; 347(22): 1804–1805. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM200211283472217>.
- Pochanugool C, Wildde H, Bhanganada K et al. Venomous snakebite in Thailand. II: Clinical experience. Mil Med 1998; 163(5): 318–323.
- Sokol J, Skerenova M, Jedinakova Z et al. Progress in the Understanding of Sticky Platelet Syndrome. Semin Thromb Hemost 2017; 43(1): 8–13. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0036–1584352>.
- Sokol J, Biringer K, Skerenova M et al. Activity of coagulation factor XI in patients with spontaneous miscarriage: the presence of risk alleles. J Obstet Gynaecol 2015; 35(6): 621–624. Dostupné z DOI: <http://dx.doi.org/10.3109/01443615.2014.991284>.
- Simonova R, Bartosová L, Chudy P et al. Nine kindreds of familial sticky platelet syndrome phenotype. Clin Appl Thromb Hemost 2013; 19(4): 395–401. Dostupné z DOI: <http://dx.doi.org/10.1177/1076029612439340>.
- Lalloo DG, Theakston RD. Snake antivenoms. J Toxicol Clin Toxicol 2003; 41(3): 277–90; 317–27.
- Dumavibhat B, Visudhisphan S, Malasit P. Severe cases of Green Pit Viper snake venom poisoning. J Med Assoc Thai 1989; 72(10): 593–596.
- Cowles RA, Colleti LM. Presentation and treatment of venomous snakebites at a Nothern Academic Medical Center. Am Surg 2003; 69(5): 445–449.
- Nasu K, Ueda T, Miyakawa I. Intrauterine fetal death cause by Pit Viper venom poisoning in early pregnancy. Gynecol Obstet Incest 2004; 57(2): 114–116. Dostupné z DOI: <http://dx.doi.org/10.1159/000075676>.
- Barkagan ZS, Mamot AP, Glazunova GA et al. Effect of heparin on fibrinogern formation during experimental toxic syndrome of disseminated intravascular coagulation. Ukr Biokhim Zh (1978) 1988; 60(1): 23–29.
- Rojnuckarin P, Mahasandana S, Intragumthornchai T et al. Prognostic factors of Green Pit Vipers bites. Am J Trop Med Hyg 1998; 58(1): 22–25.
- Hutton RA, Looareesuwan S, Ho M et al. Arboreal Green Pit Vipers (genus Trimeresurus) of Southeast Asia: bites by T. albolabris and T. macrops in Thailand and review of the literature. Trans R Soc Trop Med Hyg 1990; 84(6): 866–874.
- Markland FS. Snake venoms and the hemostatic system. Toxicon 1998; 36(12): 1749–1800.
- Isbister GK, Williams V, Brown SG et al. [Australian Snakebite Project Investigators]. Clinically applicable laboratory end-points for treating snakebite coagulopathy. Pathology 2006; 38(6): 568–572.
- Tanos PP, Isbister GK, Lalloo DG et al. A model for venom-induced consumptive coagulopathy in snake bite. Toxicon 2008; 52(7): 769–780. Dostupné z DOI: <http://dx.doi.org/10.1016/j.toxicon.2008.08.013>.
- Paul V, Prahlad KA, Earali J et al. Trial of heparin in viper bites. J Assoc Physicians India 2003; 51 : 163–166.
- Sokol J, Biringer K, Skerenova M et al. Different models of inheritance in selected genes in patients with sticky platelet syndrome and fetal loss. Semin Thromb Hemost 2015; 41(3): 330–335. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0034–1395351>.
- White J. Snake venoms and coagulopathy. Toxicon 2005; 45(8): 951–967. Dostupné z DOI: <http://dx.doi.org/10.1016/j.toxicon.2005.02.030>.
- Valenta J. Jedovatí hadi. Galén: Praha 2008. ISBN 9788072624737.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 7-8-
All articles in this issue
- Skotský model dávkování vankomycinu a monitorování jeho hladin zlepšuje účinnost i bezpečnost léčby vankomycinem
- Mezenchymální kmenové buňky a léčba diabetu 1. typu
- Jak diagnostikovat sarkoidózu srdce?
- Budúcnosť farmakologickej liečby nealkoholovej steatoheptitídy z pohľadu kľúčových patofyziologických mechanizmov
- Nízkosacharidová strava v léčbě diabetes mellitus
- Kontroverze v léčbě dny
- Funkce endotelu, její vztah k arteriální hypertenzi a možnosti její modulace
- Srdeční postižení u suicidální intoxikace oxidem uhelnatým s rysy toxické i stresové kardiomyopatie: kazuistika
- Spironolakton v léčbě hypertenze: opomíjená molekula
- Trimeresurus albolabris (štrkáčovec bieloústy) – hlásenie uhryznutia: kazuistika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nízkosacharidová strava v léčbě diabetes mellitus
- Spironolakton v léčbě hypertenze: opomíjená molekula
- Mezenchymální kmenové buňky a léčba diabetu 1. typu
- Kontroverze v léčbě dny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

