-
Medical journals
- Career
Idiopatické zánětlivé myopatie
Authors: Jiří Vencovský
Authors‘ workplace: Revmatologický ústav, Praha
Published in: Vnitř Lék 2018; 64(2): 155-163
Category: Reviews
Overview
Idiopatické zánětlivé myopatie jsou heterogenní skupinou získaných zánětlivých onemocnění příčně pruhovaného svalstva, často doprovázené systémovými a orgánovými příznaky. Mezi nejčastější typy patří dermatomyozitida, polymyozitida, imunitně zprostředkovaná nekrotizující myopatie, s nádorem asociovaná myozitida, myozitida v rámci překryvných syndromů, juvenilní myozitida a myozitida s inkluzními tělísky. Základním klinickým projevem je většinou nebolestivá svalová slabost podmíněná zánětem a imunitními změnami v postiženém svalstvu. Z něho se do cirkulace uvolňují svalové enzymy a myoglobin. Mění se elektrické vlastnosti svalových vláken, které jsou pozorovatelné při elektromyografickém vyšetření. Převážná část nemocných má v séru přítomné autoprotilátky proti jaderným nebo cytoplazmatickým antigenům. Jejich přítomnost je většinou pro tato onemocnění velmi specifická a častá je asociace individuálních autoprotilátek s určitými klinickými projevy onemocnění. Pro některé pacienty, zejména s dermatomyozitidou, je zvýšená asociace s nádorovými chorobami, a u těchto nemocných je patrná významná souvislost s přítomností anti-TIF1γ a anti-NXP2 autoprotilátek. Diferenciální diagnostika zánětlivých myopatií bývá často složitá, záměna za jiné nezánětlivé onemocnění není výjimkou, a pečlivý diagnostický proces je nutností. Terapie směřuje k potlačení autoimunitní odpovědi pomocí glukokortikoidů a imunosupresiv. U větší části nemocných je odpověď na standardní léčbu nedostatečná a je nutné použít méně běžné či biologické léky nebo intravenózní imunoglobuliny. Nemocní s myozitidou s inkluzními tělísky neodpovídají na léčbu většinou vůbec nebo jen minimálně.
Klíčová slova:
autoimunita – autoprotilátky – myopatie – myozitida – systémové onemocnění – zánětÚvod
Idiopatické zánětlivé myopatie (IZM) jsou heterogenní skupinou získaných zánětlivých onemocnění příčně pruhovaného svalstva (tab. 1) [1,2]. Značná část nemocných má navíc i systémové příznaky a orgánová postižení, nejčastěji kůže, plic, horní části trávicí trubice, kloubů a srdce. Pro většinu z těchto onemocnění je charakteristická přítomnost nebolestivé, symetrické a převážně proximální svalové slabosti. Vyšetření svalové biopsie prokáže různé známky imunitně podmíněných změn ve svalu a poškození svalových vláken. Hladiny enzymů svalového původu jsou v cirkulaci zvýšené. Elektromyografie (EMG) ukazuje přítomnost multifokálních myopatických příznaků. U dermatomyozitidy se objevují charakteristické kožní změny. Pro některé pacienty, zejména s dermatomyozitidou (DM), je zvýšená asociace s nádorovými chorobami.
Table 1. Získaná zánětlivá onemocnění příčně pruhovaného svalstva 
Epidemiologie
IZM jsou poměrně řídce se vyskytující onemocnění, jejichž frekvence ale zřejmě stoupá. Roční incidence je pravděpodobně kolem 11 na milion obyvatel a nejnovější přehledy prevalence ukazují počty kolem 25/100 000 [3,4]. V ČR je tedy odhadem asi 2 500 nemocných. Ženy jsou postiženy asi 3krát častěji než muži. Vrchol výskytu je mezi 50.–60. rokem věku, ale onemocnění se může vyskytnout kdykoliv. DM je častější v oblastech s nižší zeměpisnou šířkou, což se přisuzuje intenzitě a délce expozice ultrafialového (UV – ultraviolet) záření a podle posledních poznatků i rozložení genetické predispozice. Polymyozitida (PM) je zase častější v severských zemích. Incidence myozitidy s inkluzními tělísky (IBM – inclusion body myositis) je asi 1–2 případy na milion obyvatel, metaanalýza prevalence ukazuje počet až 45/1 milion. Je častější u mužů a začíná ve vyšším věku ve srovnání s ostatními IZM. Zřídka se vyskytuje před 50. rokem života.
Etiologie a patogeneze
IZM jsou považovány za autoimunitní onemocnění. Pro tento vztah svědčí několik okolností – většina nemocných má v séru prokazatelné autoprotilátky [5], existuje predispozice v oblasti HLA molekul [6], poměrně často se IZM vyskytují v rámci překryvných syndromů s jinými systémovými chorobami pojiva a konečně většinou odpovídají na imunosupresivní terapii [7]. Vazba na HLA molekuly je spjata s typem choroby a s přítomností některých specifických autoprotilátek. Hodně se podezřívá možný vztah k virovým onemocněním – např. byl popsán možný vztah k infekcím viry coxsakie. PM se vyskytuje častěji v souvislosti s infekcí retroviry. Existují důkazy o zvýšené aktivitě interferonů typu I u IZM a spekuluje se o jejich možné indukci virovým onemocněním [8]. Žádný definitivní průkaz virové etiologie pro IZM však podán nebyl. O některých lécích víme, že mohou vyvolat zánětlivé svalové onemocnění – např. D-penicilamin či statiny [9]. Významná asociace s maligními chorobami a zvýšená exprese některých autoantigenů na nádorových buňkách, které bývají cílem pro autoprotilátky asociované s myozitidami, naznačuje také možnou indukci imunitního systému neoplastickým procesem. Poměrně velké procento nemocných s IZM má v séru přítomné autoprotilátky [5]. Cílem jsou významné nitrobuněčné antigeny, které hrají roli v řadě pochodů navázaných na opravy DNA, transkripci či translaci. Řada z těchto protilátek se najde pouze u IZM. Vzhledem k významné asociaci jednotlivých autoprotilátek s klinickými projevy se předpokládá jejich patogenní působení.
Imunopatologické mechanizmy poškození se liší u jednotlivých typů IZM. U DM dochází především k postižení cév a sekundárně k poškození svalových vláken, kdežto u PM a IBM je pravděpodobné přímé cytotoxické působení T-lymfocytů. U IBM je navíc přítomná degenerativní komponenta ve formě depozit amyloidu, trochu podobně jako u Alzheimerovy choroby. Pravděpodobně významný přímý patogenní podíl hrají autoprotilátky u IMNM.
Klinický obraz
PM a DM začínají většinou subakutně, IBM pomalu a chronicky. Svalová slabost je dominantním rysem [10]. U PM, DM a IMNM je lokalizována symetricky do proximálních svalových skupin končetin, trupu a krku. V nejzávažnějších případech mohou být nemocní téměř nehybní, zcela odkázáni na lůžko a pomoc druhé osoby. Často nedokáží zvednout hlavu od podložky, vždy bývá výraznější slabost flexorů krku než jeho extenzorů. Při mírnějších projevech mají obtíže při stoupání do schodů a při vstávání z nízké židle. Chůze se stává kolébavou. Komplikuje se zvedání předmětů, oblékání a česání. Postupně se vyvíjejí svalové atrofie. Ze svalů bývají nejvíce a nejčastěji postiženy m. deltoideus, mm. gluteus medius a maximus, m. iliopsoas, flexory krku a případně paraspinální svaly. U IBM bývá svalová slabost asymetrická a častěji zasahuje distální svalstvo. Nejčastěji jsou postiženy flexory na předloktí a distální flexory prstů rukou, m. triceps brachii, m. quadriceps femoris a dorsiflexory nohy. Svalová slabost není u IZM většinou doprovázena myalgiemi; v akutním stavu např. při nekrotizující myopatii se bolest svalů může vyskytnout, ale pokud je hlavním symptomem, měli bychom vždy zvažovat jinou diagnózu, např. fibromyalgii, revmatickou polymyalgii, neuropatie nebo jiné zánětlivé onemocnění. U pacientů s myozitidou a antisyntetázovým syndromem může být bolest způsobená současně probíhající artritidou.
Svalovou sílu hodnotíme většinou pomocí svalového testu a skórujeme sílu podle Kendallové na škále 0–10. Někdy se používá také 6minutový test chůze nebo funkční testy s pomocí opakovaných pohybů, případně s použitím závaží, v tomto případě se však testuje spíše svalová výdrž než okamžitá síla [11].
V průběhu onemocnění je zásadní rozlišit, čím jsou svalové symptomy způsobeny, tedy zda jde stále o pokračující aktivní zánět nebo o již indukované poškození a atrofie. Zatímco zánět je možné ovlivnit imunosupresivní léčbou a zlepšit tak svalovou sílu, poškození svalů lze vylepšit pouze cvičením a cílenou rehabilitací. Odlišení aktivity a poškození je někdy obtížné – může pomoci hodnocení pomocí magnetické rezonance/MRI – magnetic resonance imaging (obr. 1) nebo absence aktivních změn na EMG, případně normální hladiny kreatinkinázy (CK). Výjimečně je nutné opakovat svalovou biopsii k objasnění původu slabosti a vhodnosti imunosupresivní terapie. Je potřebné také myslet na možnou indukci glukokortikoidní myopatie, která může vest k výrazné svalové slabosti. Odlišit ji může pomoci zhodnocení CK, EMG, MRI či případně biopsie, ale v praxi se nejlépe osvědčuje manipulace s dávkou glukokortikoidů. Při podezření na indukovanou myopatii snížíme dávku < 20–15 mg denně a v případě glukokortikoidní myopatie vidíme zlepšení již po několika málo týdnech. Pokud se provede biopsie, je pro glukokortikoidy indukovanou myopatii typická atrofie vláken typu II.
Image 1. STIR (short tau inversion recovery) MRI (A–C) a T1 vážený obraz (D) stehenních svalů. (A) zánětlivý edém extenzorů a tekutina ve fasciálních prostorech u pacientky s aktivní dermatomyozitidou, bez známek svalové atrofie (B) lokalizovaný edém svalů v oblasti extenzorů kolene u pacientky s dlouho trvajícím aktivním onemocněním a těžkou svalovou atrofií (C) bez známek edému (zánětu) na MRI u pacientky s polymyozitidou a přetrvávající svalovou slabostí kvůli svalové atrofii (D) tuková infiltrace a atrofie u pacienta s myozitidou s inkluzními tělísky 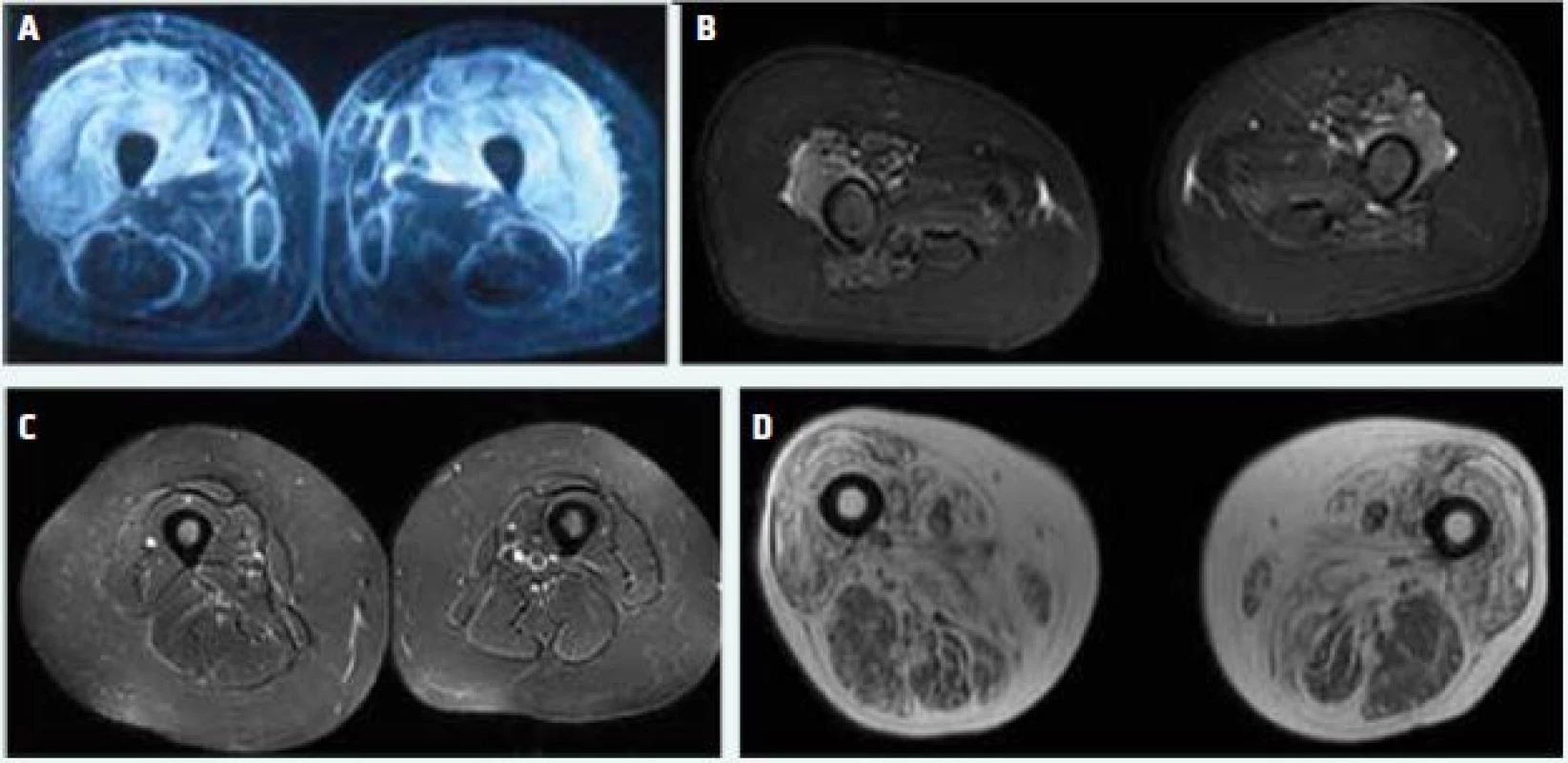
Mezi nejčastější orgánové postižení patří dysfagie, která je způsobena slabostí svalstva v horní části jícnu a její výskyt se udává u 12–54 % nemocných. Je obvykle asociovaná se závažnějším onemocněním a znamená celkově horší prognózu vývoje. Většinou je symptomem akutní fáze nemoci, i když může přetrvávat do pozdějších stadií. U IBM je dysfagie velmi častá, až v 60 %. Symptomy dysfagie u IZM mohou být jen mírné od ztíženého polykání suché potravy a nutnosti zapíjet sousta až k těžkým projevům nedovolujícím ani polykání tekutin a vyžadujícím nazogastrickou sondu nebo parenterální výživu. Následkem dysfagie může být malnutrice. Nejobávanější komplikací je však aspirace obsahu z jícnu do plic přinášející nebezpečí vzniku pneumonie nebo vytvoření abscesu. Tento mechanizmus je jedním nejčastějších příčin úmrtí pacientů s IZM. V průběhu nemoci může dojít k fibrotizaci krikofaryngeálního svalu, který se při polykání normálně uvolňuje a dovolí průchod sousta do jícnu. Při jeho špatné funkci je polykání ztíženo. Jsou popsána úspěšná vyřešení takovéto chronické situace myotomií krikofaryngeálního svalu [12].
Plicní postižení je poměrně časté, nejvíce se vyskytuje intersticiální plicní fibróza, méně aspirační pneumonie a ventilační insuficience z důvodů slabosti dýchacích svalů. Časné formy intersticiálního onemocnění odhalí HRCT (high-resolution computed tomography/CT s vysokým prostorovým rozlišením) a měření difuzní plicní kapacity. Postižení svalstva hrtanu a měkkého patra se projeví chrapotem a nosním hlasem. Mohou se objevit i kardiální příznaky ve formě poruch vedení či arytmií. Perikarditida není častá, ale může být přítomna u nemocných s anti-PL-7 protilátkami. Řada pacientů má artralgie a artritidy, které jsou většinou neerozivní, ale mohou vést k tvorbě deformit a kontraktur. Asi nejčastější je symetrická polyartritida postihující drobné klouby ruky, někdy velmi připomíná revmatoidní artritidu. Artritidy po úplném odeznění opět recidivují, někdy jako samostatný klinický symptom, bez recidivy myozitidy. Až u 22 % může onemocnění začít artritidou ještě před tím, než jsou identifikovatelné svalové symptomy [13].
Pro DM jsou charakteristické kožní změny, jako jsou otok a červenofialové zbarvení kolem očí (obr. 2); tmavě červená, až fialová vyrážka na extenzorové straně ruky, především nad drobnými klouby ruky (Gottronovy známky, obr. 3); hyperemie a teleangiektazie kolem nehtových lůžek; tmavě červená až fialová vyrážka se objevuje i na čele, tvářích, krku, hrudníku, většinou ve tvaru písmene V (obr. 4), na zádech, loktech, zevní straně stehen (obr. 5) a vnitřních kotnících. Distribuce na zadní straně krku, ramenou a na hrudníku se nazývá šálový příznak. U dětského typu dermatomyozitidy mohou být známky kožní vaskulitidy. U dětí jsou také časté podkožní kalcifikace, které však řidčeji můžeme identifikovat i u dospělých, především u těch s anti-NXP-2 autoprotilátkami (obr. 6). Kožní manifestace někdy přetrvávají i po zlepšení svalového onemocnění.
Image 2. Výrazný edém kolem očí s heliotrop zbarvením u pacientky s dermatomyozitidou 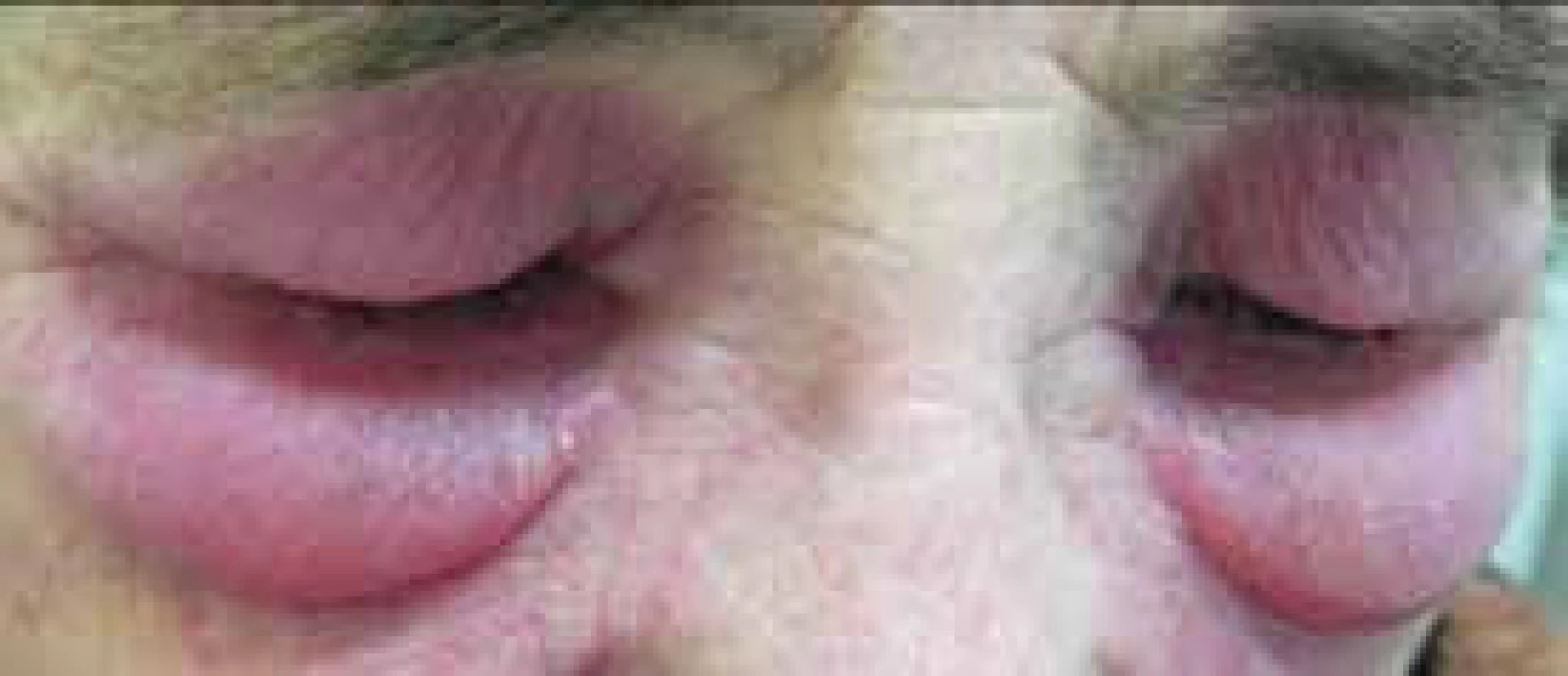
Image 3. Tzv. prsty mechanika a zároveň Gottronovy skvrny na dorzální straně zejména metakarpofalangeálních kloubů rukou 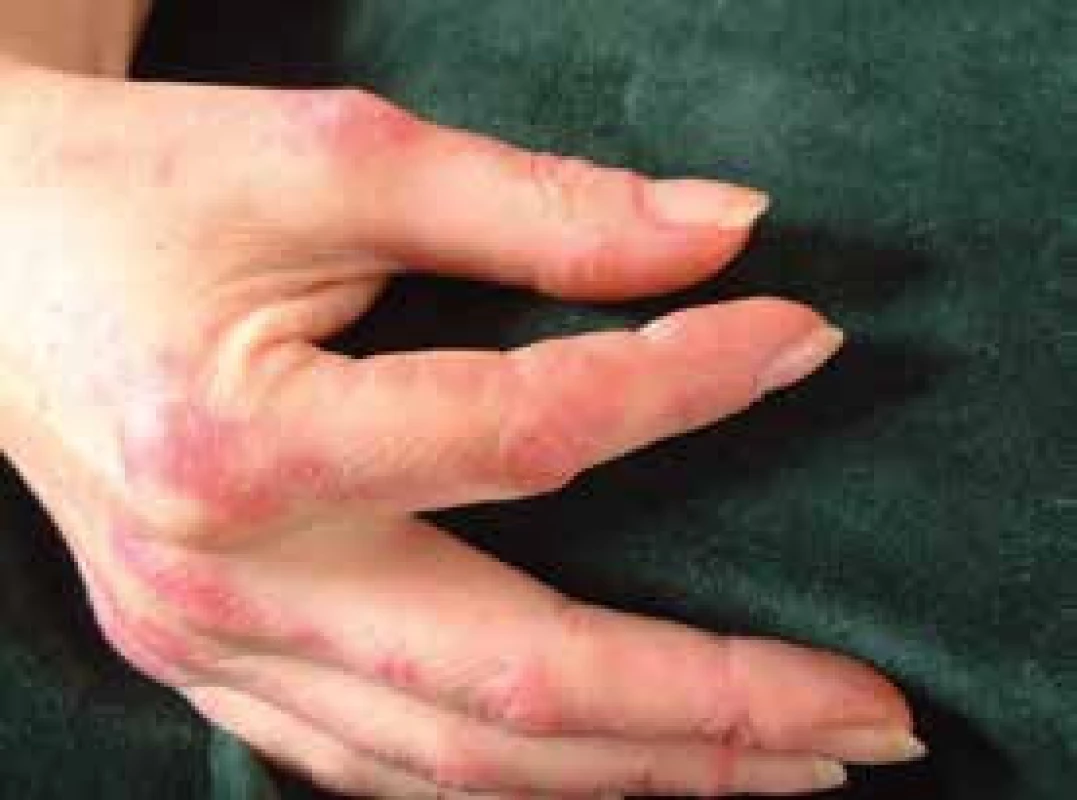
Image 4. Červenofialová vyrážka na hrudníku se známkami aktivity, ale také se staršími změnami ve formě pigmentací kůže u nemocné s dermatomyozitidou 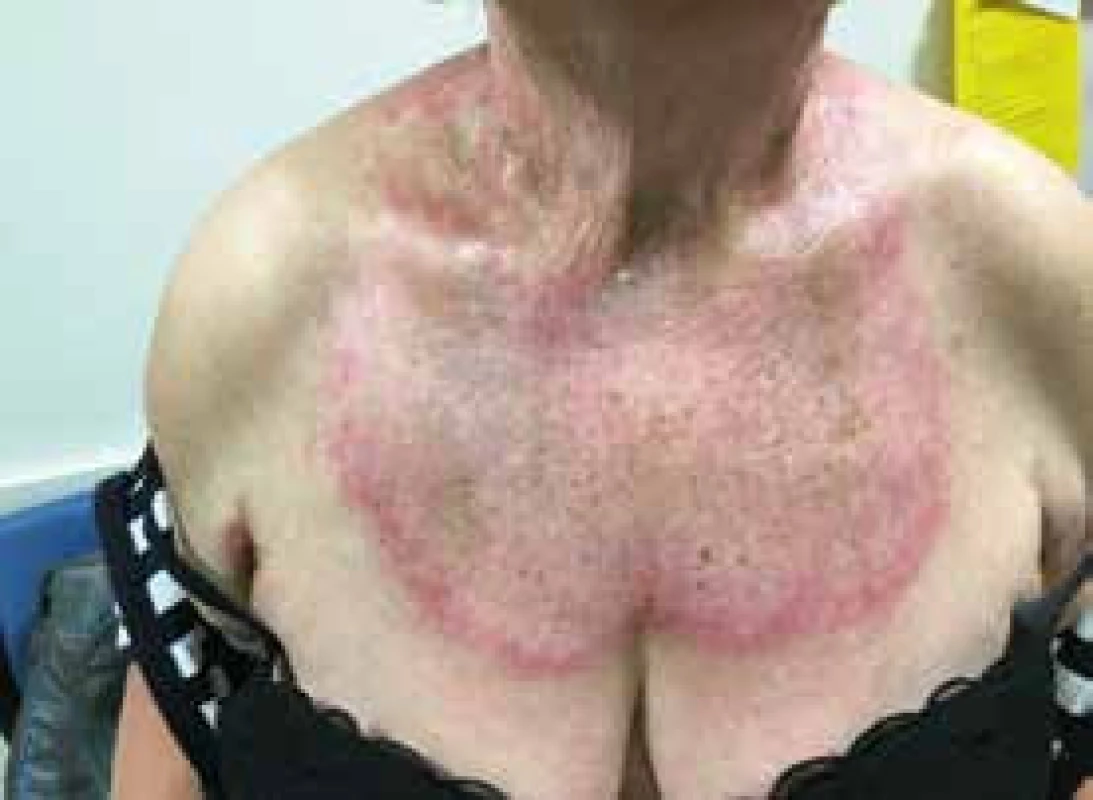
Image 5. Vyrážka na zevní straně stehna, zde s náznakem ulcerací 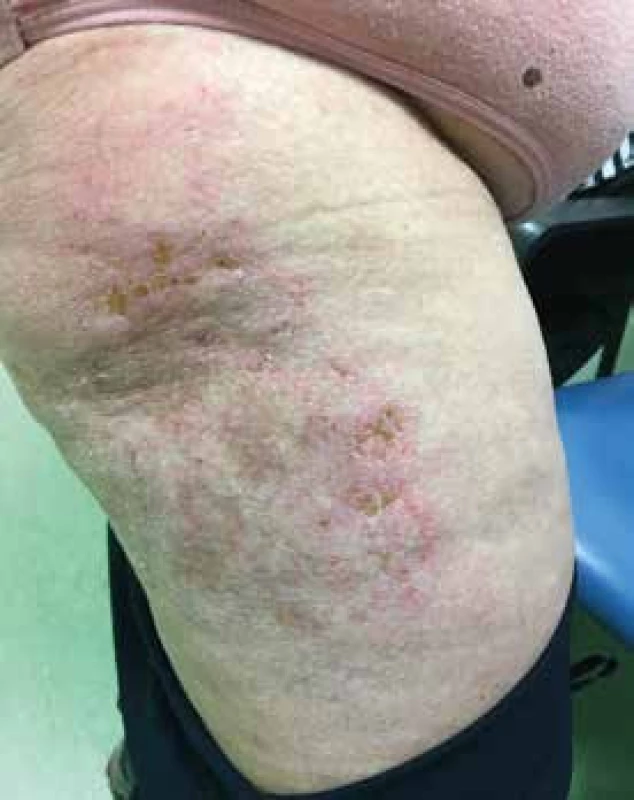
Image 6. Podkožní kalcifikace kolem lokte a na předloktí (A) a v RTG obraze (B) 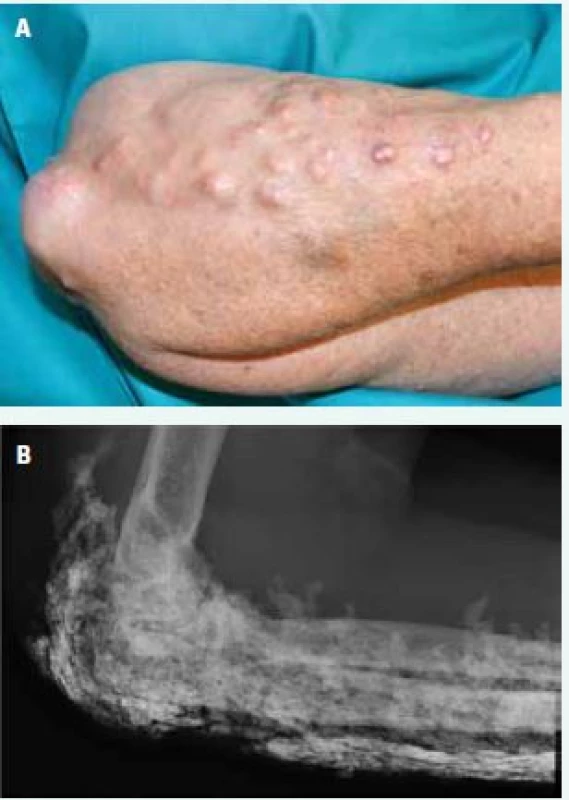
Podtypy IZM
Antisyntetázový syndrom (ASS) je soubor příznaků u PM či DM, který vedle myozitidy zahrnuje intersticiální plicní onemocnění, Raynaudův fenomén, artritidu, horečnaté stavy, zejména na začátku choroby, a tzv. prsty mechanika (obr. 3). Někdy převažuje plicní postižení. Je přítomná některá z antisyntetázových protilátek (tab. 2).
Table 2. Přehled autoprotilátek u myozitid 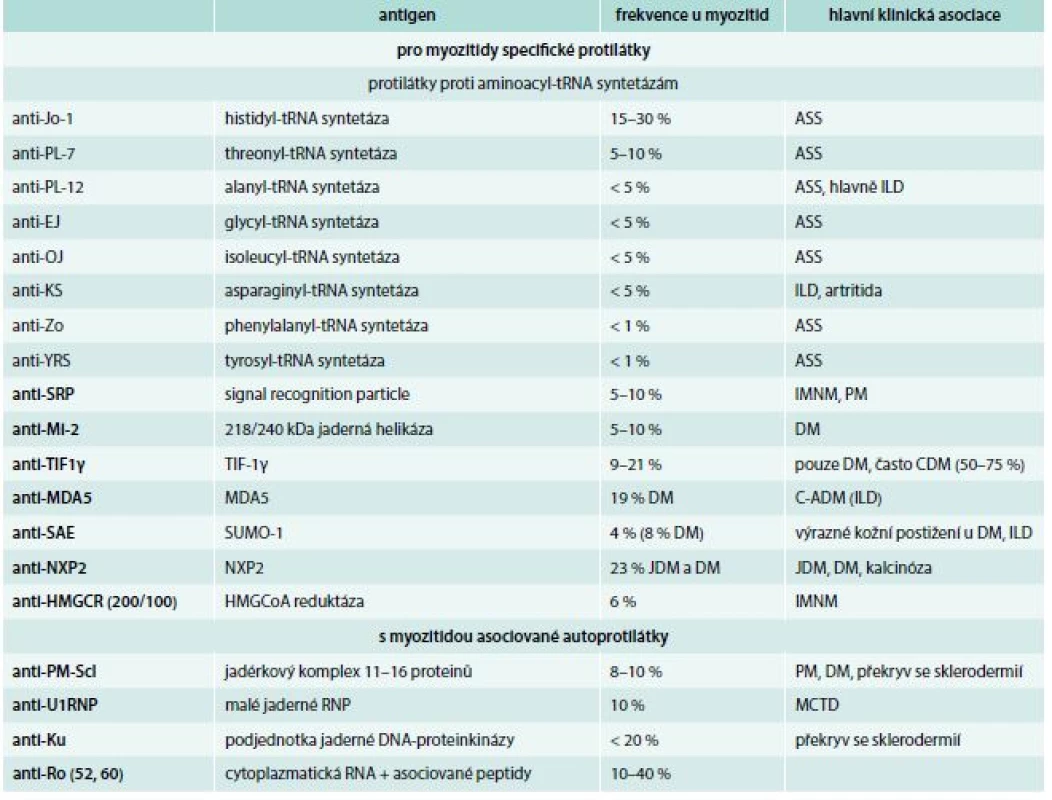
ASS – antisyntetázový syndrom C-ADM – klinicky amyopatická DM CDM – s nádorem asociovaná DM DM – dermatomyozitida HMGCR – hydroxymetylglutaryl koenzym A reduktáza ILD– intersticiální plicní onemocnění MCTD – mixed connective tissue disease/smíšené onemocnění pojiva MDA5 – melanoma differentiation associated antigen NXP– jaderný matrixový protein PM – polymyozitida RNP – ribonukleoprotein SUMO – small ubiquitin-like activating enzyme TIF– transkripční intermediární faktor Myozitida asociovaná s nádorem (CAM) se popisuje asi v 5–25 %. Lokalizace nádorů jsou různé. Nejčastější jsou karcinom ovarií a prsu u žen a karcinom plic u mužů. Jsou popsány i hematologické malignity. Tumor a myozitida se objevují nejčastěji přibližně ve stejnou dobu, ale zvýšené riziko perzistuje pro některé nádory i po několik let od počátku myozitidy [14]. Nejčastější CAM je u DM (CDM), ale zvýšené riziko je i u polymyozitidy (CPM) nebo nekrotizující myopatie. Většina nemocných s CDM má v séru přítomné autoprotilátky proti TIF1γ nebo NXP2. Podle věku a typu myozitidy se doporučuje různě intenzivní vyhledávání nádoru, případně i opakovaně (schéma) [14–16].
Schéma. Algoritmus diagnostiky skryté malignity u myozitid. Upraveno podle [14–16] ![Schéma. Algoritmus diagnostiky skryté malignity u myozitid. Upraveno podle [14–16]](https://pl-master.mdcdn.cz/media/image/04fa88262b59083d288c9ad16e432934.jpg?version=1537792034)
DM – dermatomyozitida IBM – myozitida s inkluzními tělísky IMNM – imunitně zprostředkovaná nekrotizující myopatie IZM – idiopatické zánětlivé myopatie MAA – s myozitidou asociované protilátky MSA – pro myozitidu specifické autoprotilátky PM – polymyozitida Myozitida s inkluzními tělísky je nejčastější u mužů nad 50 let věku [18]. Slabost a atrofie postihují proximální i distální svaly, především extenzory nohy a hluboké flexory ruky. Časté postižení m. quadriceps femoris se projevuje pády. Onemocnění pomalu progreduje a může skončit až úplnou imobilitou.
Imunitně zprostředkovaná nekrotizující myopatie je nověji rozeznávaná jednotka, která se většinou projevuje výraznější svalovou slabostí, častěji i myalgiemi a akutnějším začátkem [19]. Nejvíce nemocných s touto chorobou má v anamnéze léčbu statiny, které indukují autoimunitní onemocnění charakterizované přítomností anti-HMGCR protilátek [9]. Je to nemoc, která se vyskytuje velmi vzácně; incidence se odhaduje na 2–3 případy/100 000 léčených statiny. Frekvence onemocnění ale pravděpodobně stoupá, tak jak se rozšiřuje používání statinů. Nemocní většinou odpovídají na podávání imunosupresivní léčby. Menší část nemocných s nekrotizující myopatií je spjatá s přítomností anti-SRP protilátek. Tato forma má většinou nepříliš dobrý průběh, remise jsou vzácné. Nekrotizující myopatii můžeme také vidět jako paraneoplastický projev.
Termín amyopatická dermatomyozitida je vyhrazen pro ty stavy, při kterých nelze identifikovat svalové postižení, ale kožní příznaky odpovídají DM. Hypomyopatická DM má jasnou převahu kožních manifestací, můžou se však objevit subklinické známky svalového postižení ve formě mírně zvýšené CK nebo mírné projevy svalové slabosti při provedení svalového testu. Někdy může být tato choroba spjata s těžkým a akutně probíhajícím intersticiálním plicním onemocněním, v takovém případě bývají přítomny anti-MDA-5 protilátky.
Laboratorní a další vyšetření
Bývají zvýšeny sérové hladiny CK, laktátdehydrogenázy (LDH), AST, ALT, aldolázy a myoglobinu. K jejich elevaci dochází během aktivního onemocnění, v remisi se většinou normalizují. Bývá zvýšena především hladina CK-MM izoenzymu, ale často je vyšší i CK-MB frakce, která většinou pochází ze znovu poškozeného regenerujícího svalstva bohatého na CK-MB. Nelze tak hodnotit případné kardiální poškození pomocí CK-MB. Obecně není hodnota CK dobrým ukazatelem aktivity onemocnění. CK se může přechodně zvýšit po provedení EMG či v souvislosti s intramuskulární injekcí nebo po svalové biopsii.
V séru 70–80 % nemocných se vyskytují autoprotilátky (tab. 2), které mají úzké asociace s podtypy choroby a s přítomností klinických symptomů. Ty, které jsou vázány pouze na IZM, označujeme jako pro myozitidu specifické autoprotilátky, zatímco autoprotilátky, které se vyskytují i u jiných systémových onemocnění pojiva, jsou označovány jako s myozitidou asociované. Sedimentace erytrocytů a proteiny akutní fáze jsou často normální, ale mohou být zvýšené. Může být velmi mírná anémie.
Elektromyografie (EMG) je poměrně senzitivní, ale nepříliš specifické vyšetření. Pro myozitidu svědčí:
- polyfázické, úzké a nízké potenciály motorických jednotek
- zvýšená inzerční aktivita, fibrilační potenciály a pozitivní ostré vlny
- bizarní vysokofrekvenční opakované výboje
EMG může sloužit k hodnocení aktivity a výběru místa biopsie.
Biopsie svalové tkáně by měla být provedena vždy při podezření na IZM. Zánětlivý proces je často nerovnoměrně rozložený a je tedy možné se setkat s falešně negativními nálezy. Typickým projevem je zánětlivá infiltrace, která se skládá z lymfocytů, makrofágů, dendritických buněk a plazmatických buněk. Často se najde degenerace a nekróza myofibril, fagocytóza nekrotických buněk a zároveň známky regenerace. V pokročilejších fázích jsou známky fibrózy, tukové náhrady a atrofie. Existují rozdíly v bioptických nález mezi jednotlivými IZM [19]. U DM dochází k poklesu množství nitrosvalových kapilár z důvodů imunitního poškození. Zánětlivé infiltráty se objevují především intermyziálně, nikoliv přímo mezi svalovými vlákny. Sestávají hlavně z CD4+ T-lymfocytů, makrofágů, dendritických buněk a B-lymfocytů. Ve stěně cév se najdou depozita útočného komplexu komplementu C5b–C9 (MAC). Vlákna atrofují především na povrchu fasciklů – dochází k typické perifascikulární atrofii. Na povrchu vláken, především v perifascikulární oblasti, je indukována abnormální exprese molekul HLA I. třídy. Pro PM je charakteristická invaze CD8+ T-lymfocytů do svalových vláken, které nevykazují známky nekrózy nebo se tyto lymfocyty hromadí kolem jednotlivých svalových vláken uvnitř fasciklu. CD8+ T-lymfocyty obsahují perforin a granzym, enzymy, které jsou schopné přímo poškodit přiléhající svalové buňky. Difuzní hyperexprese HLA molekul I. třídy na svalových buňkách naznačuje jejich aktivaci a aberantní zpracování proteinových molekul vedoucí k poruše fyziologické činnosti svalových buněk. U IBM jsou nálezy ve svalu podobné jako u PM, ale navíc jsou přítomné charakteristické orámované vakuoly, které obsahují β-amyloid. Je nutné myslet na to, že vzorky ze svalové biopsie, které jsou zality do parafinu, neumožňují diagnózu IBM, protože parafin rozpouští bazofilní inkluze typické pro toto onemocnění. Tento problém není naneštěstí vzácný. U IMNM je typická převaha nekrotických svalových vláken, nadpoloviční část nemocných má přítomnou aberantní expresi molekul HLA I na jejich povrchu [9,18,20]. Ve stěně cév a na povrchu nekrózou nepostižených svalových vláken se najdou depozita MAC. Většina pacientů nemá lymfocytární zánětlivou infiltraci, ale bývají detekovatelné makrofágy.
Magnetická rezonance (MRI) umožňuje zjistit rozsah a závažnost postižení [21]. Edém způsobený zánětem se projeví v obrazech s potlačením tuku; atrofie a tuková přeměna se nejlépe hodnotí v T1 váženém obraze. Výhodou MRI je možnost zacílení biopsie a také možnost sledování aktivity (obr. 1). Nejsou však standardizovány způsoby hodnocení [22].
Diagnostika
K diagnostice se používá několik různých souborů kritérií, i když ani jeden způsob není optimální. Dosud nejčastější jsou minimálně upravená kritéria Bohana a Petera (tab. 3) [23,24]. Je nutné vyloučit jiné onemocnění způsobující podobné symptomy. Tato kritéria však vůbec neobsahují jednotky, jako jsou IBM nebo IMNM, které v době tvorby kritérií nebyly vůbec známy. V klinické praxi se osvědčují i kritéria podle ENMC [20] kladoucí důraz na nálezy v biopsii ze svalu. Recentně byla vytvořena nová kritéria, která budou však asi vhodnější pro epidemiologické přehledy nebo klinická hodnocení léčby než každodenní diagnostickou praxi [25].
Table 3. Klasifikační kritéria pro polymyozitidu a dermatomyozitidu. Upraveno podle [23,24] ![Klasifikační kritéria pro polymyozitidu a dermatomyozitidu. Upraveno podle [23,24]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d7e2ebac399330c141bdb2d4f0c476f8.jpg)
Diferenciální diagnostika
Diferenciální diagnostika IZM může být velmi široká (tab. 4) [26]. Klasický obraz DM s vyrážkou, nebo obraz PM či DM s přítomností specifických autoprotilátek v séru, typickým nálezem v biopsii a jasným zánětem na MRI nečiní většinou zvláštní diagnostické obtíže. Pokud však nejsou všechny tyto příznaky plně vyjádřeny a nemocný neodpovídá na imunosupresivní terapii, je to pokyn k revizi diagnózy. V případech na léčbu rezistentních PM je potřeba myslet především na IBM. Na tu by nás měla upozornit existence svalové slabosti především v extenzorech kolena, ve flexorech prstů rukou a také častá asymetrie změn. Nesprávná diagnóza není však vzácností a někdy se odhalí až po několika letech. Některé skutečnosti by nás měly upozornit na možnost nesprávné diagnózy a navést nás správným směrem (tab. 5) [10].
Table 4. Onemocnění, která mohou způsobit nebo napodobovat myopatické syndromy. Upraveno podle [26] ![Onemocnění, která mohou způsobit nebo napodobovat myopatické syndromy. Upraveno podle [26]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6986d82e3e4f1dc5e6b1f848756c388a.jpg)
Table 5. Stavy vyžadující pozornost z hlediska možné diferenciální diagnostiky polymyozitidy a dermatomyozitidy. Upraveno podle [10] ![Stavy vyžadující pozornost z hlediska možné diferenciální diagnostiky polymyozitidy a dermatomyozitidy. Upraveno podle [10]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ef0695b5034af1cf2b57a8b78996d450.jpg)
Terapie
Hlavním cílem léčby IZM je zlepšit svalovou sílu, potlačit extramuskulární aktivitu onemocnění a zároveň minimalizovat riziko komplikací spojených s léčbou [7]. Tradičně jsou v léčbě PM a DM používány vysoké dávky glukokortikoidů. Většinou se doporučuje podávat 1–1,5 mg/kg/den prednisonu. Tyto dávky jsou spojené s nežádoucími účinky – např. osteonekróza kosti či rychlý vývoj osteoporózy, proto se v poslední době kloníme spíše k nižším dávkám kolem 0,5 mg/kg/den, i když vysoce akutní případy mohou stále vyšší dávky vyžadovat. Dosáhneme-li efektu, zhruba po 6 týdnech začneme snižovat dávku glukokortikoidů, vždy asi o 15–20 % podávané dávky každý měsíc, do udržovací dávky 5–10 mg. Jen u malé části nemocných je možné podávání glukokortikoidů zcela ukončit. Klinická zkušenost ukazuje, že přidání imunosupresivních léků je zapotřebí u většiny pacientů s IZM. Prognóza je horší, pokud je podání účinné léčby opožděno. Nejčastěji podávaným lékem je metotrexát. Dávkování je 7,5–30 mg týdně. Nedávná klinická hodnocení však nepotvrdila efekt metotrexátu u dospělých nemocných proti samotným glukokortikoidům. Zde je ovšem nutné poznamenat, že provádění klinického hodnocení u IZM je velmi obtížné z mnoha důvodů, které zahrnují hlavně heterogenitu onemocnění, malé počty nemocných, nedostatečné nástroje ke zhodnocení efektu a obtížné odlišení pokračující aktivity či již způsobeného poškození. Jednotliví nemocní pravděpodobně mohou z léčby metotrexátem profitovat. U juvenilní DM byl nedávno efekt cyklosporinu a zejména metotrexátu prokázán ve srovnání se samostatným podáním prednisonu [27]. Azatioprin se doporučuje dávkovat 2–3 mg/kg/den a cyklosporin kolem 3,5 mg/kg/den, případně více.
Takrolimus se zdá efektivní u některých pacientů, zejména s intersticiálním plicním onemocněním v rámci ASS. Sami v těchto situacích používáme poměrně často cyklofosfamid, s klinicky slušnými výsledky, i když formální zhodnocení chybí. V poslední době je využíván mykofenolát mofetil, zejména při komplikující IPF. U jednotlivých rezistentních nemocných byl použit i leflunomid s efektem, zejména u DM, ale počty léčených nemocných jsou velmi malé.
Randomizované, zaslepené, zkřížené klinické hodnocení u 15 nemocných s DM ukázalo ke konci 3měsíčního léčení významné zlepšení ve svalové síle a v dalších neuromuskulárních symptomech u těch nemocných, kteří dostávali intravenózní imunoglobuliny (IVIg), ve srovnání s těmi, kteří dostávali placebo. Léčba však musí pokračovat v intervalech 4–8 týdnů, jinak může dojít ke vzplanutí. Ne všechny výsledky s IVIg jsou takto pozitivní a vzhledem k vysoké ceně je léčba pomocí IVIg omezena na stavy, u nichž zcela selhávají ostatní možnosti. Nová pozorování ukazují, že IVIg jsou pravděpodobně velmi účinné ke zvládání rezistentních případů IMNM i bez nutnosti použití glukokortikoidů.
Někteří nemocní reagují dobře na podání rituximabu, ale větší klinické hodnocení provedené současně u dospělých i dětských nemocných s PM/DM/JDM formálně efekt neprokázalo, i když stav většiny nemocných se zlepšil [28]. IBM většinou nereaguje na žádnou terapii. Doporučuje se krátkodobé podání prednisonu, pokud není efekt, je vhodné tuto léčbu ukončit.
Farmakologická léčba pomůže asi u 75 % pacientů. Ne u všech se však obnoví plná svalová síla, protože vlivem onemocnění dojde k poškození svalů, jejich atrofii a případně tukové náhradě či fibrotizaci. Ukazuje se, že časná a dávkovaná rehabilitace má prospěšný efekt a zvyšuje šanci na lepší svalové možnosti po potlačení zánětlivého procesu.
Průběh a prognóza
Onemocnění probíhá chronicky, většinou s relapsy, často při snaze o snížení imunosupresivní léčby. Nemoc postupně vede k atrofii svalů a permanentnímu snížení svalové síly. Kožní projevy mohou zanechat pigmentace a jizvy. Artritida vede k deformitám. Intersticiální plicní postižení může progredovat do plicní fibrózy a vzácněji se může objevit plicní hypertenze. Asi v 10 % může být onemocnění poměrně rychle fatální z důvodů aktivity choroby a nastupujících komplikací. Při kombinaci s nádorem je mortalita nemoci vyšší. Výsledky léčby u dětské formy dermatomyozitidy jsou lepší, až u poloviny případů dochází ke kompletní remisi. Obecně je s klinickým průběhem hodně spojena přítomnost specifické autoprotilátky.
Práce v oblasti idiopatických zánětlivých myopatií je podporována projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Doručeno do redakce 8. 10. 2017
Přijato po recenzi 19. 11. 2017
prof. MUDr. Jiří Vencovský, DrSc.
Revmatologický ústav, Praha
Sources
1. Vencovský J. Idiopatické zánětlivé myopatie. In: Pavelka K, Vencovský J, Horák P et al (eds). Revmatologie. Maxdorf: Praha 2012 : 382–392. ISBN 978–80–7345–295–7.
2. Dalakas MC. Inflammatory muscle diseases. N Engl J Med 2015; 372(18): 1734–1747. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1402225>.
3. Svensson J, Arkema EV, Lundberg IE et al. Incidence and prevalence of idiopathic inflammatory myopathies in Sweden: a nationwide population-based study. Rheumatology (Oxford) 2017; 56(5): 802–810. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/kew503>.
4. Barnabe C, Joseph L, Bélisle P et al. Prevalence of autoimmune inflammatory myopathy in the first nations population of Alberta, Canada. Arthritis Care Res (Hoboken) 2012; 64(11): 1715–1719. Dostupné z DOI: <http://dx.doi.org/10.1002/acr.21743>.
5. Tansley S, Gunawardena H. The evolving spectrum of polymyositis and dermatomyositis-moving towards clinicoserological syndromes: a critical review. Clin Rev Allergy Immunol 2014; 47(3): 264–273. Dostupné z DOI: <http://dx.doi.org/10.1007/s12016–013–8387–6>.
6. Miller FW, Cooper RG, Vencovský J et al. Genome-wide association study of dermatomyositis reveals genetic overlap with other autoimmune disorders. Arthritis Rheum 2013; 65(12): 3239–3247. Dostupné z DOI: <http://dx.doi.org/10.1002/art.38137>.
7. Mann H, Vencovský J. Terapie idiopatických zánětlivých myopatií. In: Pavelka K, Vencovský J, Šenolt L et al (eds). Farmakoterapie revmatických onemocnění. Maxdorf: Praha 2017. ISBN 978–80–7345–537–8.
8. Ekholm L, Vosslamber S, Tjärnlund A et al. Autoantibody Specificities and Type I Interferon Pathway Activation in Idiopathic Inflammatory Myopathies. Scand J Immunol 2016; 84(2): 100–109. Dostupné z DOI: <http://dx.doi.org/10.1111/sji.12449>.
9. Mammen AL. Statin-associated autoimmune myopathy. N Engl J Med 2016; 374(7): 664–669. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1515161>.
10. Vencovský J. Muscular manifestations. In: Aggarwal R, Oddis C (eds). Managing myositis: a practical guide. Springer 2017. V tisku.
11. Alexanderson H, Broman L, Tollbäck A et al. Functional index-2: Validity and reliability of a disease-specific measure of impairment in patients with polymyositis and dermatomyositis. Arthritis Rheum 2006; 55(1): 114–122. Dostupné z DOI: <http://dx.doi.org/10.1002/art.21715>.
12. Vencovský J, Řehák F, Pafko P et al. Acute cricopharyngeal obstruction in dermatomyositis. J Rheumatol 1988; 15(6): 1016–1018.
13. Klein M, Mann H, Pleštilová L et al. Arthritis in idiopathic inflammatory myopathy: clinical features and autoantibody associations. J Rheumatol 2014; 41(6): 1133–1139. Dostupné z DOI: <http://dx.doi.org/10.3899/jrheum.131223>.
14. Tiniakou E, Mammen AL. Idiopathic Inflammatory Myopathies and Malignancy: a Comprehensive Review. Clin Rev Allergy Immunol 2017; 52(1): 20–33. Dostupné z DOI: <http://dx.doi.org/10.1007/s12016–015–8511-x>.
15. Selva-O‘Callaghan A, Trallero-Araguás E, Grau-Junyent JM et al. Malignancy and myositis: novel autoantibodies and new insights. Curr Opin Rheumatol 2010; 22(6): 627–632. Dostupné z DOI: <http://dx.doi.org/10.1097/BOR.0b013e32833f1075>.
16. Madan V, Chinoy H, Griffiths CE et al. Defining cancer risk in dermatomyositis. Part I. Clin Exp Dermatol 2009; 34(4): 451–455. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2230.2009.03216.x>.
17. Rose MR. [ENMC IBM Working Group]. 188th ENMC International Workshop: Inclusion Body Myositis, 2–4 December 2011, Naarden, The Netherlands. Neuromuscul Disord 2013; 23(12): 1044–1055. Dostupné z DOI: <http://dx.doi.org/10.1016/j.nmd.2013.08.007.
18. Vencovský J. Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny. Čas Lék Čes 2016; 155(6): 319–323.
19. Dalakas MC. Muscle biopsy findings in inflammatory myopathies. Rheum Dis Clin North Am 2002; 28(4): 779–798.
20. Hoogendijk JE, Amato AA, Lecky BR et al. 119th ENMC international workshop: trial design in adult idiopathic inflammatory myopathies, with the exception of inclusion body myositis, 10–12 October 2003, Naarden, The Netherlands. Neuromuscul Disord 2004; 14(5): 337–345. Dostupné z DOI:
21. Tomasová Studýnková J, Charvát F, Jarosová K et al. The role of MRI in the assessment of polymyositis and dermatomyositis. Rheumatology (Oxford) 2007; 46(7): 1174–1179. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/kem088>.
22. Kubínová K, Mann H, Vencovský J. MRI scoring methods used in evaluation of muscle involvement in patients with idiopathic inflammatory myopathies. Curr Opin Rheumatol 2017; 29(6): 623–631. Dostupné z DOI: <http://dx.doi.org/10.1097/BOR.0000000000000435>.
23. Bohan A, Peter JB. Polymyositis and dermatomyositis (first of two parts). N Engl J Med 1975; 292(7): 344–347. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM197502132920706>.
24. Bohan A, Peter JB. Polymyositis and dermatomyositis (second of two parts). N Engl J Med 1975; 292(8): 403–407. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM197502202920807>.
25. Lundberg IE, Tjärnlund A, Bottai M et al. 2017 European League Against Rheumatism/American College of Rheumatology classification criteria for adult and juvenile idiopathic inflammatory myopathies and their major subgroups. Ann Rheum Dis 2017;76(12):1955–1964.
26. Mann HF, Vencovsky J, Lundberg IE. Treatment-resistant inflammatory myopathy. Best Pract Res Clin Rheumatol 2010; 24(3): 427–440. Dostupné z DOI: <http://dx.doi.org/10.1016/j.berh.2009.12.008>.
27. Ruperto N, Pistorio A, Oliveira S et al. Prednisone versus prednisone plus ciclosporin versus prednisone plus methotrexate in new-onset juvenile dermatomyositis: a randomised trial. Lancet 2016; 387(10019): 671–678. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(15)01021–1>.
28. Oddis CV, Reed AM, Aggarwal R et al. Rituximab in the treatment of refractory adult and juvenile dermatomyositis and adult polymyositis: a randomized, placebo-phase trial. Arthritis Rheum 2013; 65(2): 314–324. Dostupné z DOI: <http://dx.doi.org/10.1002/art.37754>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 2-
All articles in this issue
- Revmatoidní artritida
- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Biologická léčba psoriatické artritidy
- Život ohrožující projevy systémového lupusu a antifosfolipidového syndromu ve vnitřním lékařství
- Systémová sklerodermie v roce 2017
- Idiopatické zánětlivé myopatie
- Nové trendy v monitorování a léčbě ANCA asociovaných vaskulitid
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
- Polymyalgia rheumatica
- Léčba k cíli u dnavé artritidy
- Nutraceutika v terapii gonartrózy: pohled ortopeda
- Osteoporóza a kvalita kostní hmoty
- Léčba chronické bolesti u zánětlivých revmatických onemocnění
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Idiopatické zánětlivé myopatie
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

