-
Medical journals
- Career
Rizika hospitalizace seniorů
Authors: Hana Matějovská Kubešová; Ondřej Výška; Jiří Nakládal; Emmanuela Fernandová; Petra Vacková
Authors‘ workplace: Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno, pracoviště Bohunice
Published in: Vnitř Lék 2018; 64(11): 1070-1075
Category:
Overview
Hospitalizace nemocného seniorského věku s sebou nese kromě léčby akutního onemocnění nebo akutního zhoršení chronického onemocnění riziko řady komplikací specifických pro danou věkovou kategorii. Mezi nejčastější komplikace počátku hospitalizace patří delirantní stavy, na jejichž etiologii se kromě dehydratace a dalších změn vnitřního prostředí způsobených základní chorobou podílí také zhoršená adaptabilita nemocného vyššího věku na změnu prostředí. Další obávanou komplikací je vznik syndromu imobilizace, který svou tendencí k řetězení širokého spektra komplikací může navodit nezvratný nepříznivý vývoj stavu seniora. Infekční komplikace s vysokou tendencí k rozvoji sepse jsou častou prvotní příčinou hospitalizace, ale také častou komplikací hospitalizace z původně jiné indikace. Nástup infekční komplikace je obvykle v seniorském věku doprovázen pomalejším vzestupem zánětlivých parametrů, který ale neznamená pomalejší progresi stavu. Základním problémem je volba vhodné antibiotické terapie s ohledem na vyšší riziko selekce Clostridium difficile. Další rizika, jako je malnutrice, dehydratace, tromboembolické komplikace, se u hospitalizovaných nemocných seniorského věku vyskytují s vyšší četností a je vhodné co nejčasněji započít s preventivními opatřeními proti jejich vzniku.
Klíčová slova:
dehydratace – delirium – imobilizační syndrom – instabilita – malnutrice – respirační infekce – uroinfekce
Úvod
Hospitalizace seniora znamená na jedné straně mnohdy jedinou šanci na zvládnutí akutní nemoci, na druhé straně však hrozí mnoha komplikacemi. Zátěží je už prostá změna prostředí, ke které se přidává skokové snížení fyzické aktivity. Jednou z nejčastěji řešených komplikací hospitalizace seniorů jsou delirantní stavy jako důsledek psychické zátěže ve spojení se změnami vnitřního prostředí způsobenými samotnou zdravotní dekompenzací. Neméně častým jevem je syndrom imobilizace, který může nastartovat kaskádu řetězících se patologií až s možným fatálním zakončením. Vzhledem k tomu, že velmi častou příčinou zhoršení zdravotního stavu seniora vedoucího k hospitalizaci jsou infekty, přibývá hrozba dysmikrobie s rizikem klostridiové kolitidy. Prakticky všech hospitalizovaných seniorů s krátkodobě či dlouhodobě omezenou soběstačností se týká riziko pádů, vzniku malnutrice, dehydratace a dekubitů.
Vzhledem k opakovaně prokázané efektivitě existujících preventivních opatření je žádoucí zhodnotit celkový stav seniora prostřednictvím škál hodnotících míru rizika jednotlivých druhů komplikací a podle zjištěné míry rizika individuálně nastavit příslušná preventivní opatření.
Existuje řada škál pro odhalení míry křehkosti seniora a jeho rizikovosti z hlediska výskytu komplikací jak během hospitalizace, tak v období po propuštění z hospitalizace. Míra senzitivity různých skórovacích systémů se samozřejmě liší, jako dva nejcitlivější nástroje jsou citovány ISAR (Identification Seniors At Risk Hospitalized Patients) a MPI (Multidimensional Prognostic Index) [1]. Využívání těchto nástrojů v běžné praxi vyžaduje poměrně značnou časovou dotaci, v našich zařízeních poskytujících péči seniorské populaci není dosud běžně zavedeno. Na druhé straně je nepochybně výhodné mít možnost porovnání vývoje celkového stavu seniora jako oporu pro některá závažná diagnostická i terapeutická rozhodnutí ve smyslu rizika vs profit nemocného [2–5]. Nepominutelnou oblastí je i hledisko ekonomické: využití škál exaktně popisuje konkrétního nemocného i pro nezdravotníka a dokládá náročnost poskytované péče [6,7].
Základními a již dlouhou dobu využívanými hodnotícími škálami jsou Activities of Daily Living (ADL) [8] k ohodnocení míry soběstačnosti při základních úkonech sebepéče, při propuštění nemocného je vhodné provést test instrumentálních denních činností, jehož neuspokojivý výsledek by měl sloužit jako podklad k angažování rodiny, případně terénních služeb v době propuštění nemocného [9].
Ke zjištění kognitivního výkonu je nejšíře využíván Mini Mental state Examination [10], i když v současné době nárůstu počtu seniorů s kognitivním deficitem Alzheimerova typu je zdůrazňován i význam testů charakteru kreslení hodin – clock test, Montrealský kognitivní test [11].
Na mnoha pracovištích zajišťujících péči o seniory jsou běžně zavedeny do rutinní praxe také škály hodnotící stav nutrice pacienta, nejčastěji Mini Nutritional Assessment (MNA) [12], dále škály hodnotící riziko vzniku dekubitů, nejčastěji podle Nortonové [13], a riziko pádů [14].
Na druhé straně doposud nejsou rutinně využívány metody k vyšetření míry depresivity hospitalizovaných nemocných jako faktoru významně snižujícího komplianci nemocného. K dispozici je geriatrická škála deprese (Geriatric Depression Scale – GDS) [15], která je schopna odhalit nemocného s mírnou až závažnou depresí.
Delirantní stavy
Delirantní stavy nastupují jako reverzibilní komplexní mozková dysfunkce, jako nespecifická reakce na různé typy nox. Objevení se deliria znamená zhoršení prognózy nemocného ve smyslu pomalejší rekonvalescence s potenciálním nebezpečím rozvoje komplikací, dlouhodobějšího přetrvávání mentální deteriorace asi u třetiny delirujících nemocných a přechod do demence u 5–10 % nemocných. Obecně je delirantní stav považován za projev celkové křehkosti organizmu a u téhož nemocného má tendenci se při dalších zhoršeních zdravotního stavu opakovat. Za rizikové je možno považovat nemocné ve věku nad 70 let, s akutním somatickým onemocněním, nemocné s demencí, nemocné léčené psychofarmaky, ev. závislé na alkoholu či jiných látkách, a nemocné psychicky labilní [16].
Delirantní stavy se mohou vyskytnout u poměrně vysokého procenta seniorů zvláště ve spojení s akutní změnou jejich zdravotního stavu – např. u seniorů po operativním řešení zlomeniny femoru je delirantní stav pravděpodobný až v 50 % případů, po operacích všeobecně chirurgických u 10 % nemocných. Přechodná zmatenost se však může vyskytnout i v domácím prostředí u 65letých v 1–2 %, ve věku ≥ 85 let u 10–13 %. Z hlediska etiologického je u seniorů nejčastější extrakraniální příčinou deliria dehydratace, přehled dalších možných příčin ukazuje tab. 1.
Table 1. Příčiny delirantních stavů 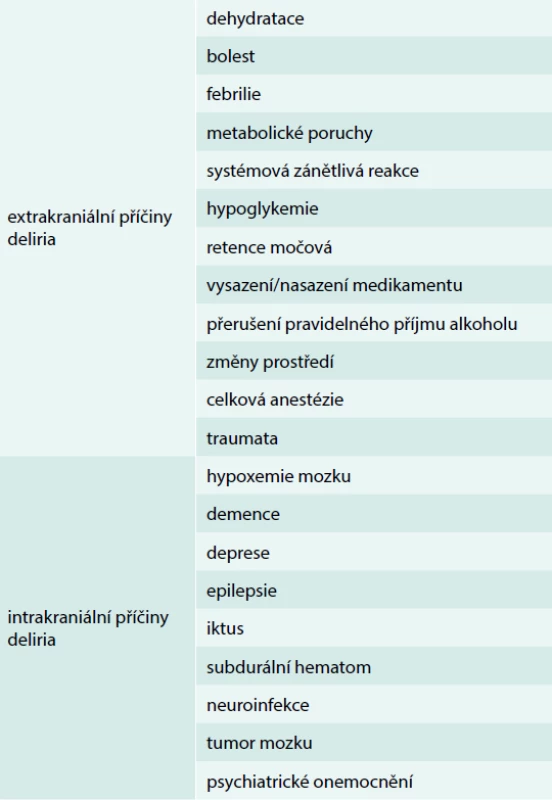
Všeobecně známé jsou příznaky hyperaktivního deliria – náhle vzniklý přechodný stav zmatenosti s neklidem, úzkostí, s poruchou paměti, orientace, chování, spánku, bdělosti a pozornosti, většinou s retrográdní amnezií. Stav bývá doprovázen halucinacemi a bludy, obranným a únikovým jednáním. Opomíjené však mnohdy zůstávají příznaky hypoaktivní formy deliria, při které je nemocný naopak apatický a nevyžaduje pozornosti. Tím ovšem zůstává neřešena i vlastní příčina delirantního stavu [17].
Ke zpřesnění diagnostiky deliria slouží jednoduchá a časově nenáročná škála CAM (Confusion Assessment Method) využívaná zejména na jednotkách intenzivní péče v rámci sledování pooperačních stavů. Právě pro odhalení hypoaktivních forem deliria by však bylo její využití vhodné i u rizikových nemocných na standardních odděleních [18].
Instabilita
Instabilita je definována jako porucha koordinace způsobující nejistotu při chůzi, závratě a pády. Výskyt tohoto syndromu je v seniorské populaci velmi vysoký – udává se až 40 % seniorů s občasnými pocity instability či závratí a asi 25 % populace nad 65 let trpí opakovanými pády. Pády dělíme podle etiologie na mechanické a symptomatické. Příčinou mechanických pádů mohou být poruchy koordinace pohybu, snížení reakční rychlosti, zhoršení zraku, oslabení přímivých svalů. Symptomatické pády mohou být důsledkem poruch mozečku, poruch periferního rovnovážného ústrojí nebo jeho centrálního analyzátoru. Mezi nejčastější příčiny pádů seniorů patří poruchy prokrvení mozku z důvodu stenózy magistrálních mozkových tepen, srdečních arytmií či anémie, útlaku vertebrálních arterií při spondylóze krční páteře [17,19,20]. Samotná hospitalizace navýší riziko pádu ztíženou orientací nemocného v cizím prostředí potencovanou senzorickými deficity.
Pád staršího nemocného znamená ve 20–30 % případů úraz, nemocní s pády mají 4–6krát vyšší mortalitu. Z nemocných zemřelých na následky pádu bylo 67 % mužů a 92 % žen starších 60 let [16]. Jako nejčastější příčiny úmrtí po pádu byly diagnostikovány pneumonie, dekubitální sepse a nitrolební krvácení. Ze zlomenin se po pádech nejčastěji vyskytuje zlomenina krčku femoru, Collesova zlomenina, zlomeniny obratlů, zlomeniny lebky a nitrolební poranění. Dále může dojít ke zhmoždění měkkých tkání s rozvojem imobilizačního syndromu a přechodnou či trvalou ztrátou soběstačnosti, k rozvoji tzv. crush syndromu při zaklínění po pádu, případně k prochladnutí při nemožnosti vstát (tab. 2).
Table 2. Příčiny pádů u seniorů 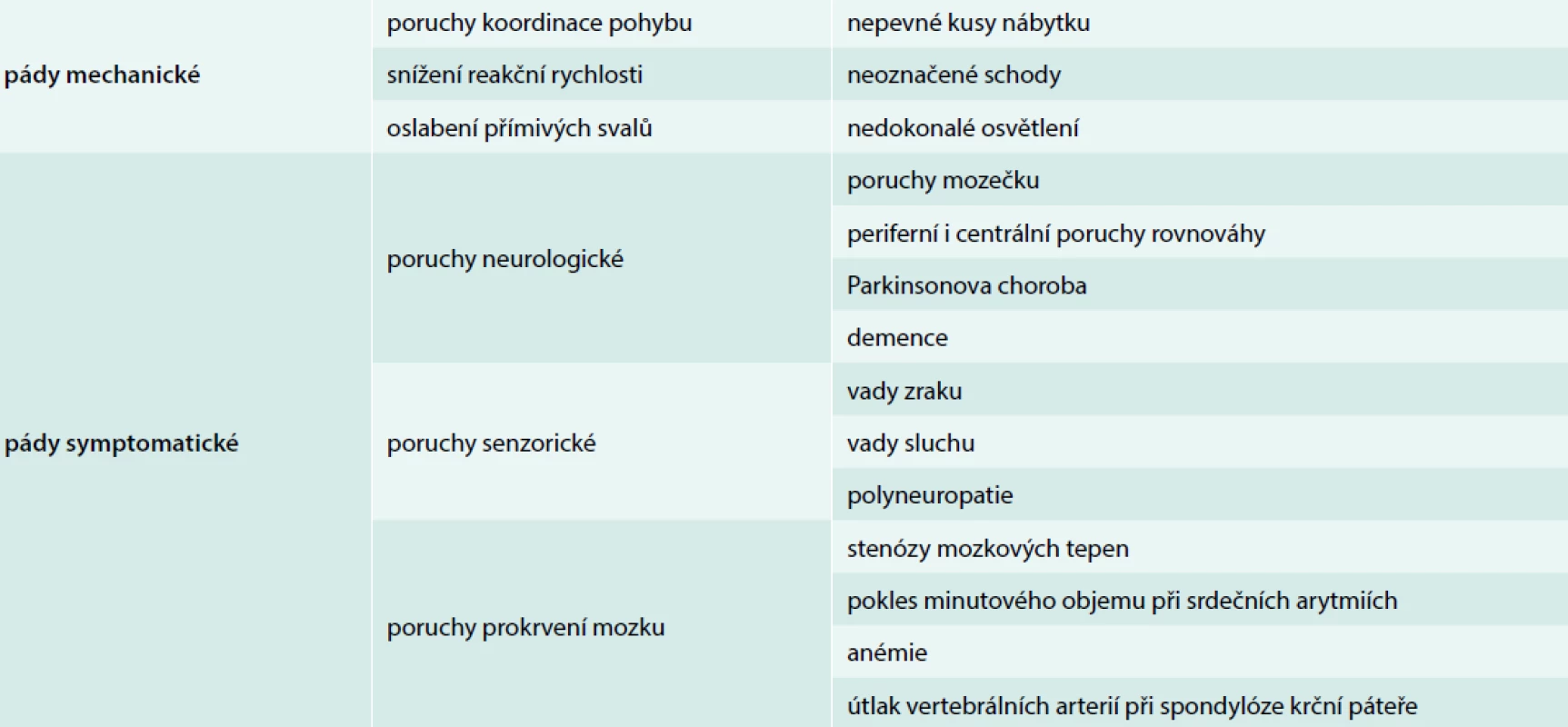
Pády jsou v současné době pojímány jako jedno z nejvyšších rizik hospitalizovaného seniora a opatření ke snižování výskytů pádů jako parametr kvality poskytované péče. V rámci prevence pádů je již při přijetí seniora k hospitalizaci stanovováno v ošetřovatelské dokumentaci riziko pádu a jeho závažnosti je přizpůsobován systém péče.
Imobilizační syndrom
Imobilizační syndrom je definován jako souhrn negativních projevů nedostatečné pohybové aktivity. Méně závažný stupeň je nazýván seniorskou dekondicí a bývá přirovnáván k projevům detréningu u sportovců, tedy poklesu maximální spotřeby kyslíku (VO2max), poklesu krevního objemu, méně účinnému vzestupu srdeční frekvence při maximální zátěži. Tyto projevy jsou doprovázeny poklesem aktivity lipázy, poklesem hladiny glykogenu i citlivosti k inzulinu, poklesem aktivity oxidativních enzymů ve svalech. Vzestup hladin katecholaminů má za následek rozkolísání krevního tlaku i pocity palpitací. Seniorská dekondice může být umocněná projevy přidružených chorob, poruchou pohybové koordinace, dysregulací krevního oběhu – ortostatické hypotenze či chronotropní insuficience myokardu. Vznik dekondice urychlují také léky s negativně chronotropním účinkem, jako je digitalis nebo betablokátory, psychofarmaka, dále malnutrice či sklon k depresivitě.
Nechtěně se na vzniku dekondice mohou podílet i zdravotníci při neadekvátní interpretaci stesků nemocného – např. prodloužením klidu na lůžku, pokud si nemocný stěžuje na slabost – „zatím se šetřete“, „počkejte, až zesílíte“. Únava a dušnost mohou být považovány za projevy choroby, nikoli za dekondici, svalová slabost může být považována za závrať.
Při dalším trvání pohybové inaktivity se dekondice prohlubuje do plně vyjádřeného imobilizačního syndromu. Rychlost jeho vývoje závisí na celkovém zdravotním stavu, přítomnosti komorbidit, stavu výživy apod. Např. při septických komplikacích se první známky imobilizačního syndromu mohou u nemocného vyššího věku projevit již po několika hodinách pobytu na lůžku. Obecně postihuje imobilizační syndrom zvláště často seniory s omezenou adaptační kapacitou, s poruchou regulačních mechanizmů, např. ortostatických a seniory s významnou multimorbiditou (tab. 3).
Table 3. Projevy imobilizačního syndromu 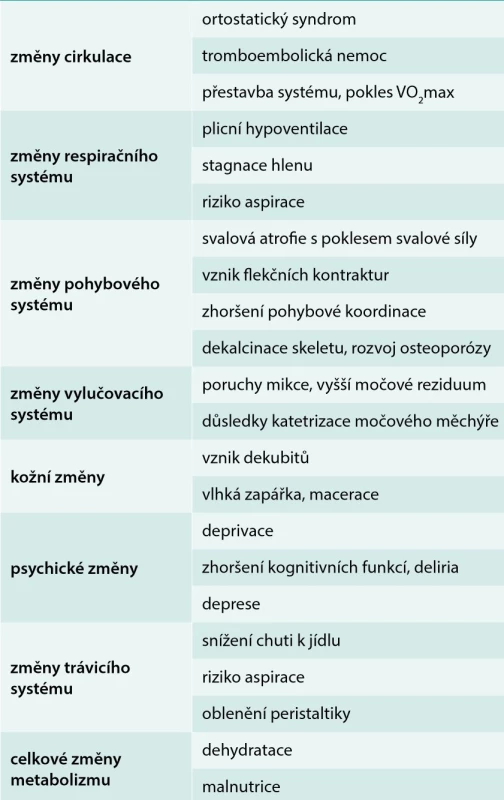
Zcela zásadní v řešení imobilizačního syndromu je prevence jeho vzniku a prevence jeho komplikací. Z obecného pohledu to znamená časnou a důslednou fyzioterapii včetně protahování rizikových partií flekčních kontraktur a posilování svalů končetin, péče o kůži, podporu expektorace, zajištění adekvátní bilance tekutin a náležitého přísunu energie, péče o psychiku seniora. Časná rehabilitace a vertikalizace zahájená ihned, jakmile to zdravotní stav seniora dovolí, významně zvyšuje šanci nemocného na návrat soběstačnosti a schopnost navrátit se do svého původního prostředí. Pohybová aktivita má podle nejnovějších poznatků komplexní příznivý vliv na většinu patofyziologických součástí imobilizačního syndromu včetně psychických [21]. Za současné napjaté personální situace na jednotkách poskytujících akutní péči může nedostatek času vést k nechtěným prohřeškům vůči této tendenci – ve snaze o úsporu času vykoná ošetřující personál určitý úkon raději sám, než by čekal, až jej svede senior. Tím ovšem prodlužujeme obnovení soběstačnosti seniora, prodlužujeme jeho hospitalizaci a navyšujeme riziko vzniku hospitalizačních komplikací.
Dokonce i na odděleních následné péče, která by měla být zaměřena převážně na mobilizaci veškerého rehabilitačního potenciálu s cílem obnovení soběstačnosti a bezpečného návratu do vlastního prostředí, není situace uspokojivá. Personální a ekonomické podmínky, byť naplňují současnou legislativu, dovolují podle nedávno zveřejněných výsledků porovnání jednotlivých zařízení délku cvičení konkrétního nemocného v rozsahu 15 až 45 min za den [22].
Septické komplikace u starších nemocných
Vlivem involučních změn imunitního systému jsou starší nemocní do určité míry imunokompromitovaní. Opakované infekty urotraktu, respirační a gastrointestinální patří mezi nejčastější příčiny hospitalizace seniorů obecně, tytéž druhy infektů v různém pořadí a kombinacích komplikují průběh hospitalizace. Infekčními agens se mohou stát mikroorganizmy běžně sídlící na kožních a slizničních površích (oportunní infekce), či jsou součástí flóry gastrointestinálního traktu (endogenní původci). Asi třetina infekcí je způsobena původcem exogenním – nejčastěji z rukou ošetřujícího personálu. Jednotlivé úkony diagnostiky a terapie vytváří řadu vstupních rizikových míst – punkce venózního systému, močové katétry. Velmi rizikovou oblastí u nesoběstačných nemocných je orofarynx jako místo často obtížně dostupné péči s možností pomnožení patologické flóry často aspirované při polykacích obtížích [23].
Infekce probíhá u staršího křehkého nemocného mnohdy s méně intenzivními klinickými a laboratorními projevy, zato však velmi fulminantně s uvolněním bakteriálních endotoxinů a oligonukleotidů – s následnou masivní vazodilatací a nebezpečím vzniku septického šoku s vývojem multiorgánového selhání – selhávání více než 2 orgánů znamená u starších nemocných prakticky 100% mortalitu. Vznikající septickou komplikaci může v jejím počátku navíc překrýt delirantní stav, jehož význam může být u seniora podhodnocen. Aktuálně využívané schéma hodnotící schéma SOFA zahrnuje právě poruchu vědomí jako známku nastupujícího orgánového selhání [24].
V rámci léčby septických stavů u seniorů je jednoznačně indikována empirická antibiotická terapie intravenózně aplikovanými antibiotiky. Je nutno opakovaně odebírat biologický materiál k záchytu původce a zjištění jeho citlivosti na antibiotika, optimálně i se stanovením minimálních inhibičních koncentrací testovaných antibiotik. Výtěžnost záchytu agens bývá nízká, ve snaze o maximálně cílenou léčbu je vhodné zvážit PCR metody (polymerázové řetězové reakce/Polymerase Chain Reaction) [25]. Výběr antibiotik je také nutno přizpůsobit faktu zvýšeného rizika superinfekce Clostridium difficile, aktuálně jsou jako nejrizikovější vyhodnocovány aminopeniciliny a fluorochinolony. Klostridiová kolitida mnohdy uniká pozornosti zejména při mírnějším průběhu nebo při její manifestaci až po propuštění nemocného z hospitalizace – tím rizikovějším se nemocný stává při případné další hospitalizaci s nutností antibiotické léčby [26,27].
Dehydratace, malnutrice, hyperkoagulace
Tyto komplikace hrozí v průběhu hospitalizace nemocného kterékoli věkové kategorie, u nemocných vyššího věku je však jejich rychlý vznik a negativní dopad potencován již proběhlými involučními změnami. Prakticky každého seniora je nutno považovat za dlouhodobě subklinicky dehydratovaného jednak z důvodu postupně se snižující produkce ADH, a tím klesajícího pocitu žízně, jednak z důvodu záměrné redukce příjmu tekutin z obav z častějšího močení a případných nehod při inkontinenci. Další zátěž v podobě febrilního stavu, zvracení či průjmu vede velmi rychle k rozvoji prerenálního selhání. Obrat tekutin je nutno balancovat na základě průběžného sledování bilance, v závažnějších situacích optimálně měřením CVT. Optimální výdej tekutin by měl být 1 200–1 500 ml/24 hod, při septickém stavu až 3 000 ml/24 hod vzhledem k osmotické zátěži ledvinného parenchymu. U starších nemocných je ovšem tento postup limitován stavem kardiopulmonální kompenzace [17].
Riziko malnutrice také stoupá s věkem zejména u osaměle žijících seniorů, kteří mají dlouhodobě tendenci preferovat převážně sacharidovou a proteinově deficitní stravu. Kromě nemocných, na kterých je patrná vyhublost z prvního pohledu, není výjimkou, že se senior splňující kritéria nadváhy či dokonce obezity, nachází z hlediska laboratorního v hypoproteinemii a hypalbuminemii. Dekompenzace zdravotního stavu za těchto podmínek vede k rychlé ztrátě svalové hmoty, progresi slabosti a imobilizace se všemi riziky a s omezenými možnostmi zvratu tohoto nepříznivého vývoje [28].
Pro podporu nutrice vždy preferujeme enterální cestu, současná nabídka různých modalit enterální výživy dává šanci individuálního přístupu. V případě nutnosti parenterální podpory volíme roztoky podle požadovaného obratu tekutin.
Riziko tromboembolických komplikací stoupá v populaci obecně od 40. roku věku, u hospitalizovaného nemocného ve věku nad 65 roků věku dosahuje několikanásobku kumulací prakticky všech výše jmenovaných nepříznivých faktorů – dehydratace, imobilizace, zánětlivé aktivity, katabolizmus, intervence žilního systému. Porovnání výskytu plicní embolizace u hospitalizovaných seniorů na základě klinických údajů a ze sekčních nálezů ukazuje až polovinu plicních embolizací, které nebyly za života seniorů diagnostikovány. Jedná se velmi pravděpodobně o silentní formy, které však neléčeny výrazně zhoršují prognózu nemocného [29]. Vzhledem k vysokému výskytu tromboembolických komplikací jsou profylaktické režimy běžně uplatňovány u ortopedických a chirurgických zákroků u seniorů, ale i v zařízeních interního charakteru se při aplikaci různých skórovacích systémů stává kandidátem profylaxe tromboembolické nemocni prakticky každý hospitalizovaný senior nad 65 let věku [30,31].
Z klinického pohledu je pro diagnostiku tromboembolických příhod možno stále využít schéma Wellsovo (tab. 4), pokud není aktuálně k dispozici výsledek hemokoagulačního vyšetření či výsledek angio-CT vyšetření [32].
Table 4. Klinické rozhodovací pravidlo dle Wellse 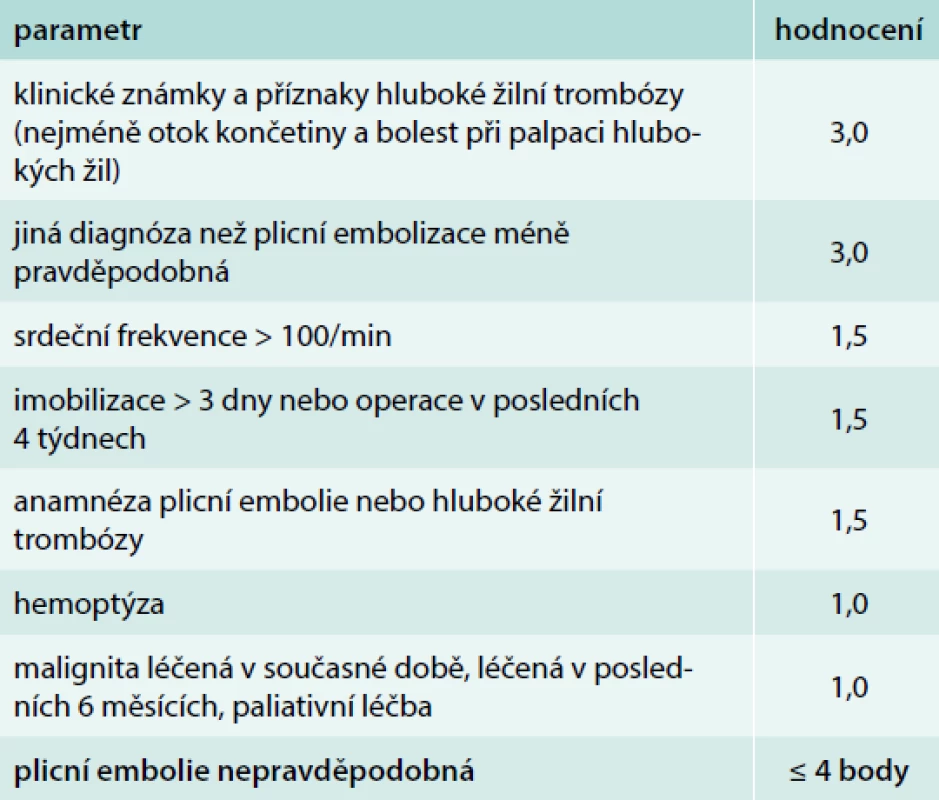
Závěr
U nemocných seniorského věku je nutno zejména v počátku hospitalizace, ale i v jejím dalším průběhu očekávat komplikace specifické pro daný věk – delirantní stavy, dehydrataci, rozvoj imobilizačního syndromu, malnutrici, pády a jejich nepříznivé důsledky.
Tyto stavy jsou do určité míry preventabilní a aktivity směrované k předcházení specifickým komplikacím je nutno zahájit bezprostředně po přijetí seniora k hospitalizaci.
Míru rizika konkrétního nemocného je vhodné stanovovat pomocí validizovaných škál.
Nástup septické komplikace hospitalizace seniora je obvykle doprovázen pomalejším vzestupem aktivity zánětlivých parametrů, který však neznamená pomalejší progresi stavu.
Antibiotická terapie nemocných vyššího věku má být volena s ohledem na zvýšené riziko onemocnění Clostridium difficile.
prof. MUDr. Hana Matějovská Kubešová, CSc.
Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno, pracoviště Bohunice
Doručeno do redakce 3. 6. 2018
Přijato po recenzi 14. 9. 2018
Sources
- Warnier RM, van Rossum, Velthuijsen E et al. Validity, Reliability and Feasibility of Tools to Identify Frail Older Patients in Inpatient Hospital Care: A Systematic Review. J Nutr Health Aging 2016; 20(2): 218–230. Dostupné z DOI: <http://dx.doi.org/10.1007/s12603–015–0567-z>.
- Pilotto A, Ferrucci L, Franceschi M et al. Development and validation of a multidimensional prognostic index for one-year mortality from comprehensive geriatric assessment in hospitalized older patients. Rejuvenation Res 2008; 11(1): 151–161. Dostupné z DOI: <http://dx.doi.org/10.1089/rej.2007.0569>.
- Heim N, van Fenema EM, Weverling-Rijnsburger A et al. Optimal screening for increased risk for adverse outcomes in hospitalised older adults. Age Ageing 2015; 44(2): 239–244. Dostupné z DOI: <http://dx.doi.org/10.1093/ageing/afu187>.
- Buurman BM, Hoogerduijn JG, van Gemert EA et al. Clinical Characteristics and Outcomes of Hospitalized Older Patients with Distinct Risk Profiles for Functional Decline: A Prospective Cohort Study. PLoS One 2012; 7(1): 1–8. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0029621>.
- Berková M, Topinková E, Mádlová P et al. Krátká baterie pro testování fyzické zdatnosti seniorů – pilotní studie a validizace textu u starších osob v České republice. Vnitř Lék 2013; 59(4): 256–263.
- Franklin M, Berdunov V, Edmans J et al. Identifying patient-level health and social care costs for older adults discharged from acute medical units in England. Age Ageing 2014; 43(5): 703–707. Dostupné z DOI: <http://dx.doi.org/10.1093/ageing/afu073>.
- Asmus-Szepesi KJ, Koopmanschap MA, Flinterman LE et al. Formal and informal care costs of hospitalized older people at risk of poor functioning: A prospective cohort study. Arch Gerontol Geriatr 2014; 59(2): 382–392. Dostupné z DOI: <http://dx.doi.org/10.1016/j.archger.2014.04.014>.
- Katz S, Downs TD, Cash HR et al. Progress in development of the index of ADL. Gerontologist 1970; 10(1): 20–30.
- Lawton MP, Brody EM. Assessment of older people: self maintening and interumetanl activities of daily living. Gerontologist 1969; 9(3): 179–186.
- Folstein MF, Folstein SE, McHugh PR. “Mini-mental state”: a practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12(3): 189–198.
- Nasreddine ZS, Phillips NA, Bédirian V et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc 2005; 53(4): 695–699. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1532–5415.2005.53221.x>.
- Rubenstein LZ, Harker JO, Salvà A et al. Screening for undernutrition in geriatric practice: developing the short-form mini-nutritional assessment (MNA SF). J Gerontol A Biol Sci Med Sci 2001; 56(6): M366-M372.
- Norton D. Norton scale for decubitus prevention. Krankenpflege (Frankf) 1980; 34(1): 16.
- Schmid NA. 1989 Federal Nursing Service Award Winner. Reducing patient falls: a research-based comprehensive fall prevention program. Mil Med 1990; 155(5): 202–207.
- Sheikh JI, Yesavage JA. Geriatric Depression Scale (GDS): Recent evidence and development of a shorter version. Clin Gerontol 1986; 5(1–2): 165–172. Dostupné z DOI: <http://dx.doi.org/http://dx.doi.org/10.1300/J018v05n01_09>.
- Kalvach Z, Zadák Z, Jirák R et al. Geriatrie a gerontologie. Grada: Praha 2004. ISBN 80–247–0548–6.
- Topinková E. Geriatrie pro praxi. 1. ed. Galén: Praha 2005. ISBN 80–7262–365–6.
- Inouye SK. Delirium in hospitalized older patients: recognition and risk factors. J Geriatr Psychiatry Neurol 1998; 11(3): 118–125. Dostupné z DOI: <http://dx.doi.org/10.1177/089198879801100302>.
- Jaffee EG, Arora VM, Matthiesen MI et al. Postdischarge Falls and Readmissions: Associations with Insufficient Vision and Low Health Literacy among Hospitalized Seniors. J Health Commun 2016; 21(Supl 2): 135–140. Dostupné z DOI: <http://dx.doi.org/10.1080/10810730.2016.1179371>.
- Bielaková K, Matějovská Kubešová H. Závratě a pády jako častá symptomatologie kardiovaskulárního postižení ve vyšším věku. Kardiol Rev Int Med 2018; 20(1): 44–46.
- Tuka V, Daňková M, Riegel K et al. Pohybová aktivita – svatý grál moderní medicíny? Vnitř Lék 2017; 63(10): 729–736.
- Gorušová J. Rehabilitace starších nemocných v zařízeních následné péče. Geri a Gero 2018; 7 : 72–75.
- Matějovská Kubešová H, Matějovský J. Věnujeme dost pozornosti orální hygieně seniorů? Geri a Gero 2015; 4(1): 31–33.
- Beneš J. Vývoj názorů na patofyziologii sepse. Vnitř Lék 2017; 63(7–8): 481–487.
- Freiberger T. PCR diagnostika infekcí. Vnitř Lék 2017; 63(7–8): 472–474.
- Bielakova K, Fernandova E, Matějovská Kubešová H. Can we improve the therapy of Clostridium difficile infection in elderly patients? Wien Klin Wochenschr 2016; 128(15–16): 592–598. Dostupné z DOI: <http://dx.doi.org/10.1007/s00508–016–1056-z>.
- Singh H, Nugent Z, Yu BN Hospital discharge abstracts have limited accuracy in identifying occurrence of Clostridium difficile infections among hospitalized individuals with inflammatory bowel disease: A population-based study. PLoS One. 2017; 12(2): e0171266. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0171266>.
- Zadák Z. Prevence a terapie sarkopenie ve stáří. Vnitř Lék 2016; 62(7–8): 671–677.
- Prudius D, Weber P, Meluzínová H et al. Deceased elderly in-patients with pulmonary embolism. Bratisl Lek Listy 2014; 115(12): 786–790.
- Schleyer AM, Robinson E, Dumitru R Preventing hospital-acquired venous thromboembolism: Improving patient safety with interdisciplinary teamwork, quality improvement analytics, and data transparency. J Hosp Med 2016; 11(Suppl 2): S38-S43. Dostupné z DOI: <http://dx.doi.org/10.1002/jhm.2664>.
- Yassin M, Mitchell C, Diab M et al. The necessity of pharmacological prophylaxis against venous thromboembolism in major joint arthroplasty. Int Orthop 2014; 38(5): 1073–1075. Dostupné z DOI: <http://dx.doi.org/10.1007/s00264–013–2233–6>.
- Angriman F, Ferreyro BL, Posadas-Martinez ML. Wells Score and Poor Outcomes Among Adult Patients With Subsegmental Pulmonary Embolism: A Cohort Study. Clin Appl Thromb Hemost 2015; 21(6): 539–545. Dostupné z DOI: <http://dx.doi.org/10.1177/1076029614559772>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 11-
All articles in this issue
- Arteriální hypertenze ve stáří
- Onemocnění štítné žlázy v seniorském věku
- Diabetes mellitus u staršího komplikovaného pacienta
- Antikoagulační léčba u seniorů
- Léčba statiny u osob vyššího věku
- Specifické rysy racionální geriatrické farmakoterapie: role klinických farmaceutů v individualizované léčbě ve stáří
- Sarkopenie jako závažné orgánové selhání, její diagnostika a současné možnosti léčby
- Nutriční podpora u geriatrických nemocných: nové doporučené postupy ESPEN
- Poruchy vodní a iontové rovnováhy ve stáří
- Geriatrický pacient a chirurgický výkon
- Rizika hospitalizace seniorů
- Pády: významná příčina morbidity a mortality seniorů
- Hyperaktivní močový měchýř u starších pacientek: zvláštnosti léčby a lékové interakce
- Poruchy termoregulace a jejich význam ve vyšším věku
- Chronické nehojící se rány v geriatrii
- Souvisí stav zásobení organizmu vitaminem D s výsledky testování kognitivních funkcí a aktivit denního života u seniorů?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poruchy termoregulace a jejich význam ve vyšším věku
- Sarkopenie jako závažné orgánové selhání, její diagnostika a současné možnosti léčby
- Poruchy vodní a iontové rovnováhy ve stáří
- Pády: významná příčina morbidity a mortality seniorů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

