-
Medical journals
- Career
Sarkopenie jako závažné orgánové selhání, její diagnostika a současné možnosti léčby
: Eva Topinková
: Geriatrická klinika 1. LF UK a VFN v Praze
: Vnitř Lék 2018; 64(11): 1038-1052
:
Sarkopenie je definována jako generalizovaná a progredující ztráta svalové hmoty, svalové síly a fyzického výkonu ovlivněná věkem, která klesne pod definovanou hranici. Kosterní svalová hmota, největší tělesný orgán, selhává ve své funkci a byl navržen termín svalové selhání – muscle failure. Sarkopenie je nahlížena jako závažný klinický problém, který narušuje koncept zdravého stárnutí a kvalitu života postižených seniorů. V patogenezi sarkopenie se uplatňují komplexní multifaktoriální procesy, které zahrnují nejen věkem podmíněné změny neuromuskulární funkce, obrat proteinu ve svalech a hormonální změny, ale i chronický prozánětlivý stav, oxidativní stres a behaviorální faktory – výživu a stupeň fyzické aktivity. V článku je podán podrobný přehled screeningových a diagnostických metod včetně konsenzuálně doporučených diagnostických hodnot (cut offs) jednotlivých vyšetření a potenciálních biomarkerů signalizujících patofyziologické mechanizmy uplatňující se v rozvoji sarkopenie u konkrétního jedince. Podrobně jsou popsány současné strategie pro prevenci a léčbu sarkopenie. Zahrnují strukturovanou fyzickou aktivitu – progresivní odporový tréning a aerobní aktivity, které působí preventivně proti úbytku svalové hmoty a zlepšují svalovou výkonnost. Efekt cvičení je potencován nutriční suplementací, především proteinoanabolickým efektem bílkovin a některých aminokyselin. V současnosti nejsou registrována léčiva s indikací sarkopenie, ale ve vyšších fázích klinického hodnocení jsou látky (monoklonální protilátky s antimyostatinovým efektem, selektivní modulátory androgenních receptorů a další), u kterých se předpokládá brzké zavedení do praxe. Závěry Sarkopenie je nová klinická diagnóza orgánového selhání funkce kosterní svaloviny s negativními zdravotními dopady. Je třeba, aby byli lékaři obeznámeni s klinickými projevy a diagnostickými postupy a léčbu sarkopenie zaměřili individuálně s ohledem na vedoucí příčiny.
Klíčová slova:
klinická diagnóza a léčba – sarkopenie – svalová hmota, síla a funkce – svalové selhání
Úvod
Koncem 90. let minulého století přinesla geriatrie do medicíny nový koncept křehkosti (v anglické terminologii frailty), označovaný vzhledem ke komplexní etiologii a výskytu ve vyšším věku také jako geriatrický syndrom křehkosti, zkráceně geriatrická křehkost. Tento koncept umožnil popsat a definovat obtížně uchopitelnou narůstající vulnerabilitu seniora způsobenou multisystémovou dysfunkcí a akumulací deficitů v průběhu života [1–3]. I když má křehkost nepochybně velmi významnou psychosociální a kognitivní dimenzi, v posledních 2 dekádách se výzkum soustředil především na koncept fyzické křehkosti definované Friedovou jako unavitelnost, vyčerpanost, slabost, nízká fyzická aktivita s pomalou chůzí a pokles tělesné hmotnosti [1].
Rozhodující podíl na fyzické křehkosti má sarkopenie, nová nozologická jednotka generalizované a progredující svalové atrofie manifestující se selhávající funkcí kosterní svalové hmoty. Protože geriatrické křehkosti bylo v naší literatuře věnováno několik samostatných publikací, je cílem tohoto sdělení upozornit na problematiku sarkopenie a její význam v současné praxi.
Diagnóza sarkopenie je většině praktikujících lékařů dosud neznámá a s touto tematikou se zatím nesetkávají v pregraduálním ani v předatestačním studiu. Diagnózu sarkopenie nenacházíme ani v lékařských zprávách. Při tom jde o stav, kdy sval – největší tělesný orgán – selhává ve své funkci a zcela zásadně ovlivňuje další osud pacienta. Většina laiků ale ani lékařů nemá vysvětlení pro náhlý propad fyzické zdatnosti během akutní hospitalizace pacienta: na lůžko je přijat akutně nemocný, ale soběstačný pacient a po několika dnech vyléčena jeho primární k hospitalizaci vedoucí diagnóza, ale pacient se stává obtížně mobilním, schopným chůze v lepším případě jen s chodítkem. V minulosti jsme říkali, že se pacient „rozležel“. Dnes víme, že za zhoršením funkční zdatnosti je třeba hledat právě akcelerovanou ztrátu svalové hmoty během hospitalizace, na níž se podílí kromě omezení mobility i stres, akutní zánět a nedostatečná výživa během hospitalizace. Sarkopenie postihuje však i značnou část především starších nemocných, s nimiž se setkáváme v ambulancích. I když je ztráta svalové hmoty patrná již při pohledu na nemocného a pomalá chůze a obtížné postavování z nabídnuté židle by pro lékaře měly být signálem pro další otázky a vyšetření, na diagnózu sarkopenie nemyslíme. Proto sarkopenie zůstává dosud nediagnostikována a neléčena.
Sarkopenie
Terminologie a definice
Termín sarkopenie (z řeckého sarx – maso, penia – ztráta) byl použit poprvé 1989 Irwinem Rosenbergem pro popis úbytku svalové hmoty provázející stárnutí. Sarkopenie je charakterizována úbytkem svalové hmoty a poklesem svalové funkce (vyjádřena jako pokles svalové síly a celkové fyzické výkonnosti). Dochází ke svalové atrofii, ale i celkovému zhoršení „kvality“ svalové hmoty projevující se větším poklesem svalové síly, než by odpovídalo stupni svalové atrofie. Podobně jako u osteoporózy je pro sarkopenii diagnostický pokles svalové hmoty a výkonu pod stanovenou hranici.
Sarkopenie představuje novou nozologickou jednotku a diagnóza sarkopenie byla v roce 2017 zařazena do mezinárodní klasifikace nemocí ICD-10-CM pod číslem M 62.84 [4,5]. Přesto existuje stále řada terminologických nejasností a někteří autoři navrhují užívat termín myopenie (analogicky s osteopenií) nebo dynapenie (zdůrazňující svalovou slabost/nízký výkon svalu) nebo řadit sarkopenii mezi onemocnění doprovázená kachektizací, tzv. (muscle) wasting disorders [6]. Žádný z těchto termínů se nevžil a i nadále je nejfrekventnější termín sarkopenie, který bude užíván v dalším textu.
Prevalence sarkopenie, zdravotní dopady a náklady na zdravotní péči
Podle recentních epidemiologických studií stoupá výskyt sarkopenie s věkem, častěji jsou postiženy ženy. Závažná sarkopenie s poklesem svalové hmoty přesahující 2 směrodatné odchylky (SD) mladých dospělých osob postihuje po 60. roce věku 9–11 % žen a 5–7 % mužů. Lehčí formy sarkopenie (pokles svalové hmoty < 1–2 SD označovaná jako presarkopenie) postihují až polovinu žen a > 40 % starších mužů (graf 1) [7]. V České republice byl výskyt sarkopenie (definované jako nízká svalová síla) zaznamenán u 6 % osob mezi 70–79 lety, ale již u 21 % mezi 80–84 lety a u osob nad 85 let postihoval třetinu vyšetřených. Jednalo se o seniory bez závažné nemocnosti schopné žít samostatně [8].
1. Prevalence sarkopenie v evropské populaci podle věku. Upraveno podle [7] ![Prevalence sarkopenie v evropské populaci
podle věku. Upraveno podle [7]](https://pl-master.mdcdn.cz/media/image/8e9f26ae264ef96c414b189212f436a6.png?version=1545910965)
sarkopenie 1. stupně – SMI muži 8,51–10,75 kg/m2; ženy 5,76–6,75 kg/m2
sarkopenie 2. stupně – SMI muži ≤ 8,50 kg/m2; ženy ≤ 5,75 kg/m2
Svalová hmota hodnocena bioimpedanční metodou vyjádřená jako SMI. SMI – index kosterních svalů/skeletal muscle indexSarkopenie se vyskytuje častěji u pacientů se závažným onemocněním srdce, plic a pacientů s demencí, v malnutrici a u stavů omezujících mobilitu [9,10].
Sarkopenie má závažné nepříznivé zdravotní důsledky [11–13]:
- zhoršuje mobilitu pacienta a v pokročilých fázích limituje jeho soběstačnost
- zvyšuje riziko pádů a fraktur
- zvyšuje celkovou mortalitu
Pacienti se sarkopenií mají zvýšené náklady na zdravotní péči i sociální služby: častější a delší hospitalizace, vyšší potřebu následné a ošetřovatelské ústavní péče, domácí ošetřovatelské služby (home care) a pečovatelské služby [14]. U akutně hospitalizovaných zvyšuje přítomnost sarkopenie náklady na nemocniční péči 5násobně oproti pacientům bez sarkopenie [15]. V ČR provedl ekonomickou analýzu dopadů sarkopenie Šteffl et al s využitím dat projektu SHARE. U seniorů starších 70 let bez závažné chronické nemocnosti zvyšovala sarkopenie přímé náklady na zdravotní péči 2násobně, a to především z důvodu hospitalizace. Spotřeba primární péče byla srovnatelná [8].
Patofyziologie vzniku sarkopenie
Hmota kosterních svalů tvoří 40–50 % celkové tělesné hmotnosti a kromě zajištění pohybu těla se podílí významně na celkové spotřebě kyslíku, celotělovém metabolizmu, celkovém obratu a ukládání energetických substrátů. Dostatečně robustní svalová hmota je tak nezbytná pro udržení homeostázy.
Příčinné faktory a procesy podílející se na rozvoji sarkopenie jsou multifaktoriální. K úbytku svalové hmoty dochází při poruše rovnováhy mezi anabolickými a katabolickými procesy ve svalu [15,16]. Mezi nejvýznamnější anabolické mechanizmy se řadí účinek anabolicky působících hormonů (inzulin, IGF1, růstový hormon a pohlavní hormony testosteron a dehydroepiandrosteron), svalové kontrakce/svalová aktivita a dostatek esenciálních aminokyselin zejména s rozvětveným řetězcem (leucin, izoleucin, valin). Proteoanabolická cesta zahrnuje proteosyntézu dependentní na serin/treonin kináze Act/protein kináze B (PKB), která následně aktivuje kinázu mTOR (mammalian target of rapamycin). mTOR cesta aktivovaná IGF1 a inzulinem prostřednictvím Act/PKB nebo přímo aminokyselinami a cvičením po vytvoření komplexu mTORC1 indukuje svalovou proteosyntézu. Studie sledující anabolickou odpověď svalu potvrzují, že stárnutí je doprovázeno sníženou proteosyntézou ve svalu a sníženou odpovědí na anabolické stimuly ve srovnání s mladšími jedinci. Tato situace je označována jako anabolická rezistence svalu [17]. Vysvětluje se klesající účinností Act/PKB-mTOR proteosyntetické cesty, ale i věkem narůstající inzulinovou rezistencí, změnou tělesného složení s věkem (zmnožení viscerálního tuku, klesající podíl netukové tělesné hmoty/lean body mass – LBM, aktivace prozánětlivých cytokinů, obezita) a kvalitativními změnami ve svalu. Pro praxi to znamená to, že k dosažení anabolické odpovědi srovnatelné s mladšími osobami je potřeba podnětu vyšší intenzity, např. vyšší dávka proteinu/esenciálních aminokyselin [18].
Katabolické procesy ve svalu urychluje zvýšená zánětlivá aktivita mediovaná především cytokiny (interleukiny, tumor-nekrotizující faktor α – TNFα a další regulační molekuly např. atrogin 1), poškození způsobená reaktivními kyslíkovými produkty (oxidativní stres) a mitochondriální dysfunkce. Proteokatabolizmus ve svalu probíhá cestou aktivace ubikvitin proteasomové cesty s aktivací myostatinu a TGFβ (transforming growth factor β), které jsou za klidových okolností přítomny ve svalové extracelulární matrix v neaktivní formě. Jejich aktivací jsou stimulovány transkripční faktory, které přímou vazbou na nukleární DNA indukují syntézu atroginu 1 a MuRF1. Dochází k ubikvitinaci svalových proteinů, což je předurčuje k proteolýze proteasomem S26 [19].
Kromě poklesu celkového množství svalové hmoty dochází i ke zhoršování kvality (morfologie a vnitřní architektury) svalu. Významnější ztráta postihuje zejména rychlá svalová vlákna typu II, je patrná dezorganizace sarkomerických prostor, snižuje se počet satelitních buněk (zhoršená regenerace svalu), dochází k akumulaci tuku mezi svalovými vlákny i uvnitř myocytů (myosteatóza) a k mikroskopické denervaci se sníženým počtem motorických jednotek (úbytek spinálních motoneuronů) a zhoršuje se funkce nervosvalové junkce [15,16].
V posledních letech byla věnována pozornost také zánětlivým procesům v souvislosti s akcelerací změn provázejících stárnutí včetně vlivu na svalovou tkáň. Chronické zánětlivé změny nízké intenzity (low-grade inflammation) aktivují nuclear factor-κβ (NF-κB) signální cestu a produkci mediátorů zánětu, především interleukinu 6 (IL6), interleukinu 1 (IL1) a TNFα, které kromě dalších negativních vlivů akcelerují i pokles svalové hmoty a síly [20]. Na buněčné úrovni dochází k aktivaci již zmíněné proteinokatabolické ubikvitin proteasomové cesty, snižuje se anabolický efekt mediovaný IGF1 a zvyšuje se anabolická rezistence svalu. Všechny prozánětlivé mechanizmy podílející se na rozvoji sarkopenie nejsou dostatečně prozkoumány. Je však známo, že perzistující zvýšení TNFα je spojeno s „wasting“ syndromem – kachexií a sarkopenií a buněčnou apoptózou. Tyto změny jsou více vyjádřeny ve svalech s nízkou anabolickou aktivitou a ve svalech starších jedinců. Fyzický trénink – především posilovací (odporová) cvičení – významně snížil plazmatické hladiny TNFα a solubilního TNF receptoru 1, a proto by mohl být účinnou intervencí, jak zvrátit proapoptotické nastavení [21]. Také zvýšení prozánětlivých cytokinů IL6 a IL1 je spojeno se ztrátou svalové síly, zhoršením chůze a fyzickou disabilitou [22]. Experimentální intervence snižující IL1 zahrnují ketogenní diety, zvýšený příjem polynenasycených tuků a kalorickou restrikci [23].
Mitochondriální dysfunkce v důsledku buněčného poškození mitochondriální mtDNA reaktivními kyslíkovými a dusíkovými produkty (RONS) během života je procesem, který se podílí na stárnutí buněk a orgánové dysfunkci během stárnutí. Porucha oxidativní fosforylace, snížená produkce ATP a snížená schopnost myocytu opravit poškození mtDNA a eliminovat poškozené mitochondrie autofagocytózou jsou uvažovány jako možné mechanizmy spolupodílející se na atrofii stárnoucího svalu [24]. Je však třeba dalšího výzkumu uvedených mechanizmů a zejména cest, které by umožnily tyto procesy ovlivnit.
Klinický obraz sarkopenie, klasifikace, sarkopenie a křehkost
Se stoupajícím věkem dochází k fyziologickým změnám muskuloskeletálního aparátu, které postihují kostní hmotu a architekturu kosti, kloubní chrupavku, pojivovou tkáň, ale také svalovou tkáň a nervosvalový přenos.
Svalová hmota i svalová síla narůstají v průběhu života až do časné dospělosti a dosahují maxima kolem 35–40 let věku. Po 50. roce života dochází k postupující ztrátě svalové hmoty, která v dolních končetinách dosahuje 1–2 % ročně. Svalová síla klesá ještě rychleji o 1,5–5 % za rok [25,26]. Proto je důležité dosáhnout v mladším věku maxima svalové hmoty, udržet ji ve středním věku a ve stáří minimalizovat ztrátu.
U sarkopenie jsou s věkem spojené změny svalové tkáně generalizované a progredující a projevují se zhoršováním svalové funkce. Klinickým korelátem je subjektivně vnímaná a postupně narůstající unavitelnost nejprve při náročnějších fyzických činnostech, později již při běžných denních činnostech, zhoršující se celková síla, slábnutí a u závažnějších forem sarkopenie dochází k poklesu celkové fyzické zdatnosti a výkonnosti. Jde tedy (analogicky např. srdečnímu selhání) o selhání svalové funkce, jinými slovy o selhání hmotnostně největšího tělesného orgánu (muscle failure).
Pacienti se sarkopenií mají obtíže při chůzi do schodů a po nerovném povrchu, při delším stání, obtížně se postavují ze sedu, v případě pádu se nedokáží zvednout. Snížena je i síla rukou a paží, mají potíže při otevírání sklenic a lahví, nošení a zdvihání břemen již o váze 3–5 kg. To vše negativně ovlivňuje kvalitu života nemocných, jejich celkový pocit zdraví a zapojení do běžného života. Těžké formy sarkopenie omezují samostatný život a soběstačnost a pacienti vyžadují dopomoc druhé osoby.
Primární sarkopenie
Sarkopenii klasifikujeme jako primární věkově podmíněnou, pokud nejsou přítomny jiné příčiny a orgánová onemocnění, která způsobují úbytek svalové hmoty, svalové síly a kvalitativní změny svalové tkáně [27].
Sekundární sarkopenie
Sarkopenie se rozvíjí nejčastěji v důsledku fyzické inaktivity (sedavý způsob života, omezená mobilita při onemocněních pohybového aparátu, dlouhodobém upoutání na lůžko nebo vozík) [28], u některých neurologických onemocnění, u onemocnění doprovázených chronickou systémovou zánětlivou reakcí (nádorová onemocnění, orgánové selhání – srdce, plic, ledvin). V těchto případech dochází k úbytku nejen svalové tkáně, ale i celkové beztukové i tukové hmoty a hovoříme o kachexii [29–31]. Dalším významným kauzálním faktorem rozvoje sekundární sarkopenie je malnutrice, a to jak při nedostatečném příjmu proteinu, tak protein-kalorická.
Samostatnou jednotku tvoří sarkopenická obezita s nízkou beztukovou svalovou hmotou v přítomnosti obezity [32]. Obezita zvyšuje riziko rozvoje sarkopenie a limituje fyzickou aktivitu. Infiltrace svalu tukovou tkání, tzv. myosteatóza, způsobuje mitochondriální dysfunkci zhoršující β-oxidaci se zvýšenou tvorbou reaktivních kyslíkových produktů. To vytváří lipotoxické prostředí, vede k inzulinové rezistenci a zvýšené produkci prozánětlivých cytokinů a způsobuje svalovou dysfunkci – viz část patofyziologie sarkopenie [33,34]. Stupeň myosteatózy koreluje s celkovou mortalitou [35].
Podle časového trvání klasifikujeme sarkopenii jako akutní, s níž se často setkáváme u geriatrických pacientů při delší hospitalizaci a upoutání na lůžko. Sarkopenie trvající 6 měsíců a déle je sarkopenie chronická. Toto rozlišení vychází z potřeby opakovaného vyšetření pacientů v riziku sarkopenie při sledování vývoje a závažnosti sarkopenie a odpovědi na léčbu [27].
Primární sarkopenie je onemocněním vyššího věku („senilní sarkopenie“ analogicky se senilní osteoporózou). Se sekundární sarkopenií se můžeme setkat i u nemocných mladšího a středního věku. U většiny starších pacientů je však příčina sarkopenie multifaktoriální – stárnutí pohybového, resp. nervosvalového aparátu, diskrétní nutriční poruchy (deficit vitaminu D, nízký příjem proteinu nedostatečný pro svalový anabolizmus), omezená fyzická aktivita, nízkoprahový zánět a další komorbidity. Proto se v geriatrické literatuře řadí sarkopenie mezi tzv. geriatrické syndromy s multikauzální etiologií [36], u kterých musíme uplatňovat komplexní intervenci – viz dále léčba sarkopenie.
Klinická diagnostika
Screening sarkopenie
Vzhledem ke zdravotním i ekonomickým dopadům sarkopenie je žádoucí rozpoznat pacienty s rizikem rozvoje či již s přítomnou sarkopenií. Podezření na sarkopenii zvyšuje přítomnost varovných signálů (tzv. red flags), tab. 1. Klinické pozorování a dotaz na subjektivní stesky pacienta doplníme orientačními otázkami na stav výživy a stravování (např. zda má pacient dietní omezení, dostatečný kalorický příjem a příjem proteinu, úbytek hmotnosti) a na úroveň fyzické aktivity pacienta. Nutriční deficit, minimální fyzická aktivita a převážně sedavý způsob života jsou varovnými signály.
1. Varovné signály sarkopenie. Upraveno podle [11] ![Varovné signály sarkopenie. Upraveno podle
[11]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/73def5f1a2f0259b9c600c74055a9ab1.png)
Zcela recentně byl vypracován i krátký dotazník SARC-F určený pro screening [37]. Doporučujeme ho použít k vyhledávání pacientů v riziku (tab. 2). SARC-F má velmi dobrou specifitu, ale nízkou senzitivitu [38]. Dobře tak identifikuje osoby, které sarkopenii nemají, u kterých není třeba dále vyšetřovat. Vzhledem k nízké senzitivitě však zatím nelze SARC-F doporučit pro celoplošný populační screening.
2. Dotazník SARC-F pro screening sarkopenie, česká verze. Upraveno podle [37] ![Dotazník SARC-F pro screening sarkopenie, česká verze. Upraveno podle [37]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8e8ab1d41fe407160af3e59fe230c232.png)
Pro screening lze využít i hodnocení rychlosti chůze na vzdálenost 4 m. Rizikový je čas delší než 4 s (tedy rychlost chůze nižší než 1 m/s – viz dále).
Diagnostický postup
Diagnóza sarkopenie se je založena na:
- měření svalové síly, nejčastěji síla stisku ruky ručním dynamometrem
- zhodnocení fyzické zdatnosti za použití standardizovaných výkonnostních testů
- měření množství svalové hmoty
Diagnostický algoritmus navržený Evropskou pracovní skupinou pro sarkopenii (European Working Group on Sarcopenia in Older People – EWSOP) z roku 2010 zachycuje schéma [27]. Doporučuje se zahájit vyšetření měřením rychlosti chůze a svalové síly ručním dynamometrem. V případě patologických hodnot doplníme vyšetřením k přesnému stanovení množství svalové hmoty.
Schéma. Algoritmus pro diagnózu sarkopenie, konsenzus Evropské pracovní skupiny [27,101] ![Schéma. Algoritmus pro diagnózu sarkopenie, konsenzus Evropské pracovní skupiny [27,101]](https://pl-master.mdcdn.cz/media/image/26cc484e97a0bed8eb2ac35e036bfe76.png?version=1545911147)
Následně (2011–2014) byly publikovány konsenzy pro americkou [39–41] a asijskou [42] populaci, jejichž diagnostická kritéria a hranice jednotlivých vyšetření specifických pro sarkopenii se mírně odlišují (např. absolutní množství svalové hmoty je vztaženo k body mass indexu, pro asijskou populaci je kritická hodnota svalové hmoty nižší než pro kavkazoidní rasu), v zásadě však všechny hodnotí svalovou sílu, fyzickou výkonnost a svalovou hmotu. V dalším textu se podrobněji zaměříme na tyto oblasti, podrobnosti zachycuje tab. 3.
3. Nástroje používané pro diagnostiku a závažnost sarkopenie 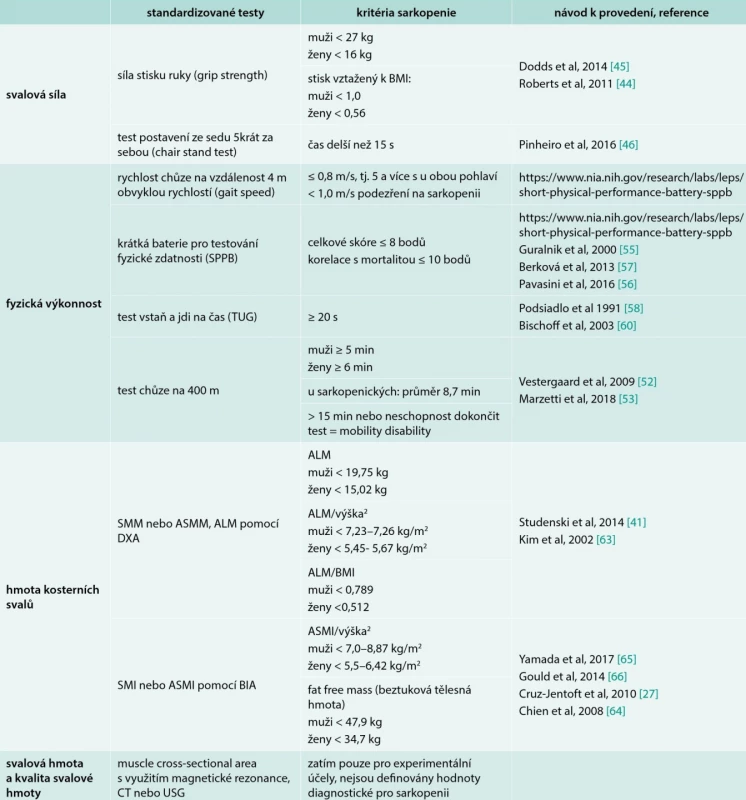
ALM – apendikulární svalová hmota/Appendicular Lean Mass ASMI – apendikulární SMI ASMM – apendikulární SMM BIA – bioimpedanční analýza SMI – index kosterních svalů/skeletal muscle index SMM hmota kosterních svalů/skeletal muscle mass SPPB – krátká baterie pro testování fyzické zdatnosti/Short Physical Performance Battery TUG – test vstaň a jdi na čas/Timed-Up-and-Go test Hodnocení svalové síly
Snížení svalové síly je hlavní klinickou manifestací sarkopenie. Nízká síla stisku ruky je velmi dobrým prediktorem zdravotních komplikací, delší hospitalizace, funkčních omezení, zhoršené kvality života a úmrtí [43]. Proto nově připravovaný aktualizovaný konsenzus Evropské pracovní skupiny navrhuje svalovou sílu jako hlavní kritérium pro diagnózu sarkopenie. Doporučenou metodou je stanovení maximální síly stisku ruky. Měření vyžaduje použití ručního dynamometru a standardizované provedení. Hodnotíme nejlepší ze 3 pokusů na každé ruce, hodnoty vztahujeme k odpovídající standardizované populaci [44]. U starších osob může být vyhodnocení limitováno komorbiditami (artróza ruky, neurologický deficit, st. p. fraktuře předloktí apod). Absolutní hodnoty jsou ovlivněny rasou i životním stylem. Graf 2 zachycuje normativní data pro britskou populaci založená na údajích 12 epidemiologických studií. Hodnoty < 2 standardní odchylky (SD) jsou považovány za patologické, tj. diagnostická pro sarkopenii je síla stisku u žen < 16 kg, u mužů < 27 kg [45]. Hodnotu je též možné vztáhnout k BMI. Pak jsou patologické hodnoty pro muže < 1,0 a pro ženy < 0,56. Síla stisku ruky koreluje se svalovou silou paží a dolních končetin a je jednoduchým, levným a dostupným vyšetřením doporučovaným pro nemocniční i ambulantní praxi.
2. Maximální síla stisku ruky měřená ručním dynamometrem v průběhu života, normativní data populace Spojeného království. Upraveno podle [45] ![Maximální síla stisku ruky měřená ručním dynamometrem v průběhu života, normativní data populace
Spojeného království. Upraveno podle [45]](https://pl-master.mdcdn.cz/media/image/054f6ea1e287c0d32a3e2e3921f19c78.png?version=1545911236)
Studie designovaná v 1. linii podle věku v posloupnosti od nejmladších. Pokud není možné provést/hodnotit sílu stisku ruky, doporučuje se zhodnotit svalovou sílu dolních končetin. Využívá se „chair stand“ test, tj. test postavení ze sedu na židli bez pomoci paží 5krát za sebou maximální rychlostí. Pro sarkopenii svědčí neschopnost se postavit bez opory, popřípadě čas delší než 15 s pro obě pohlaví [46]. Alternativně je možné hodnotit svalovou sílu vybraných svalových skupin dolních končetin (extenze nebo flexe kolena, stlačení plošiny oběma nohama se změřením maximální síly jednoho provedení Rmax) [47].
Hodnocení fyzické výkonnosti
Fyzická výkonnost je definována jako objektivně měřitelná tělesná funkce ve vztahu k pohybové aktivitě. Jde o komplexní aktivity vyžadující funkčnost celého muskuloskeletálního aparátu, nervového a kardiorespiračního systému.
V diagnostice sarkopenie se doporučují měření rychlosti chůze nebo testové baterie, např. „Krátká baterie pro testování fyzické zdatnosti“, Test „vstaň a jdi“ nebo hodnocení instrumentálních všedních činností (Instrumental Activities of Daily Living – IADL) [27].
Rychlost chůze je rychlá, bezpečná a spolehlivá metoda pro hodnocení svalové síly a svalového výkonu. Rychlost chůze také velmi dobře predikuje negativní dopady sarkopenie – pády, disabilitu, institucionalizaci a mortalitu [48,49]. Nejčastěji doporučovanou variantou je rychlost chůze obvyklou rychlostí na vzdálenost 4 m za definovaných podmínek s manuálním měřením času nebo za použití akcelerometru [50]. Za předpokladu, že výkon pacienta není ovlivněn jinou komorbiditou (porucha rovnováhy, stereotypu chůze při ortopedických nebo neurologických onemocněních, demencí apod), je suspektní pro sarkopenii čas delší než 4 s (rychlost menší než 1 m/s). U závažnější sarkopenie je rychlost chůze menší než 0,8 m/s, tedy čas delší než 5 s. Peelová et al v systematickém přehledu 48 studií zaznamenali průměrnou rychlost chůze u geriatrických pacientů starších 70 let v nemocnici 0,45 m/s, v následné péči 0,52 m/s a v ambulantní péči 0,74 m/s a vyšetření chůze doporučuje jako součást komplexního geriatrického posouzení [48]. Kognitivní poruchy (mírná kognitivní porucha a demence) negativně ovlivňují rychlost chůze a urychlují pokles fyzické zdatnosti v průměru o jednu dekádu [51].
Test chůze na 400 m hodnotí schopnost chůze a vytrvalost. Standardizované podmínky vyžadují vnitřní chodbu s rovným povrchem o délce nejméně 25 m. Vyšetřovaný prochází 20 × 20 m co nejrychleji, povolena jsou nejvýše 2 zastavení. Schopnost ujít tuto vzdálenost koreluje se schopností vykonávat nezávislé činnosti (IADL). Senioři bez sarkopenie zvládnou tuto vzdálenost obvykle do 5–6 min [52]. Průměrná doba u sarkopenických jedinců nad 70 let ve studii SPRINTT byla podle Marzettiho et al 8,70 ± 2,46 min [53]. Čas delší než 15 min nebo neschopnost test dokončit svědčí o tzv. „mobility disability“, tedy těžké sarkopenii vedoucí ke zdravotnímu postižení (disabilitě) a limitující nezávislý život pacienta [54].
Komplexní posouzení fyzické výkonnosti umožňuje krátká baterie pro testování fyzické zdatnosti (seniorů) – Short Physical Performance Battery/SPPB. SPPB je testová baterie zahrnující hodnocení rovnováhy, chůze na 4 m a postavování ze židle [55]. Maximální bodové skóre je 12 bodů (za každou část maximálně 4 body), hodnoty 10–12 bodů značí dobrou fyzickou zdatnost, nižší hodnoty jsou typické pro pacienty s rizikem křehkosti. Typické pro sarkopenii jsou hodnoty ≤ 8 bodů, mortalita se zvyšuje již pod hranicí 10 bodů [56]. SPPB byl popsán a validován i v ČR [57].
Test vstaň a jdi na čas (Timed Get Up and Go) patří mezi výkonnostní testy, v ČR je využíván v rámci ošetřovatelské praxe [58,59]. Zahrnuje postavení ze židle, chůzi na 3 m, otočení, chůzi zpět a posazení. Pro sarkopenii svědčí čas delší než 20 s [60].
Všechny uvedené testy predikují nežádoucí dopady sarkopenie a jsou používány v klinické i výzkumné praxi pro diagnózu i progresi sarkopenie a hodnocení efektu léčby.
Hodnocení svalové hmoty
Pro hodnocení množství kosterní svalové hmoty lze využít několik metod, které se liší přesností, cenou i dostupností. Nejpřesnější metodou využívanou ve výzkumu jsou magnetická rezonance a výpočetní tomografie. Jejich použití v klinické praxi limituje dostupnost a cena. Proto v praxi využíváme dvoufotonovou absorpciometrii (DXA) nebo bioimpedanční analýzu (BIA). Hodnotu svalové hmoty vyjadřujeme v kg jako celkovou kosterní svalovou hmotu (Skeletal Muscle Mass – SMM) nebo svalovou hmotu všech 4 končetin (Appendicular Skeletal Muscle Mass – ASMM nebo též Appendicular Lean Mass – ALM). Vzhledem k odlišnostem ve výšce a hmotnosti vyšetřovaných jsou celkové hodnoty svalové hmoty vztahovány k výšce nebo BMI [61,62]. Hodnoty diagnostické pro sarkopenii jsou uvedeny v tab. 3 [63].
BIA poskytuje méně přesné informace a svalová hmota se odhaduje s pomocí rovnic kalibrovaných pro určitou populaci s využitím DXA údajů [64–66]. Proto se hodnoty mohou lišit s ohledem na jednotlivé přístroje a populace. Doporučuje se vycházet z absolutně naměřené hodnoty a pro výpočet využít rovnici podle Janssena [7]:
skeletal muscle mass (kg) = výška2 BIA odpor × 0,401 + [pohlaví × 3,825] + [věk × (-0,71)] + 5,102,
kdy výška je udávána v cm; BIA odpor v ohmech; pohlaví muži = 1 a ženy = 0; věk v letech; Skeletal Muscle Index SMI = (skeletal muscle mass/hmotnost) × 100.
Nízká svalová hmota vyjádřená SMI je ≤ 8,87 kg/m2 pro muže a ≤ 6,42 kg/m2 pro ženy. BIA výsledky mohou být ovlivněny hydratací a přítomností edémů (nadhodnocení svalové hmoty).
Orientačním vyšetřením, které nepříliš přesně koreluje se svalovou hmotou a nutričním stavem, je antropometrické měření obvodu paže a obvodu lýtka. Pro sarkopenii svědčí obvod paže nad tricepsem < 21,1 cm u mužů a < 19,2 cm u žen. Obvod lýtka u sarkopenických osob je menší než 31 cm. V současnosti se toto vyšetření doporučuje pro screening jako doplnění SARC-F a pokud není dostupné ekonomicky náročnější vyšetření.
Kvalita svalové hmoty
Kvalita svalové hmoty je termín, který je v současnosti nejednoznačně definován a zahrnuje mikroskopické a makroskopické změny svalové architektury, biochemické změny a složení svalové tkáně [67]. V současnosti však pro klinickou praxi není stanovena vhodná metoda k hodnocení kvality svalové hmoty. Ve výzkumu jsou ověřovány magnetická rezonance a CT (hodnotí plochu mm. psoas na úrovni 3/4 lumbálního obratle nebo plochu mm. kvadriceps a homogenitu svalu a stupeň myosteatózy) a svalová biopsie. Jako perspektivní je zdá být ultrasonografické (USG) vyšetření [68], v tisku je připraven standardizovaný protokol pracovní skupiny SARCUS Evropské geriatrické společnosti pro jeho provádění. Obr. zachycuje schematicky USG vyšetření m. gastrocnemius. USG by se mohla stát rutinní levnou a dostupnou diagnostickou metodou.
Obr. Ultrasonografické vyšetření architektury m. gastrocnemius 
Diagnostické biomarkery
Biomarkery se zdají být slibnou oblastí pro zpřesnění diagnostiky sarkopenie a umožňují upřesnit i mechanizmy podílející se na rozvoji sarkopenie [11,15,69]. Je možné sledovat biomarkery následujících patogenetických mechanizmů:
- degenerativní procesy neuromuskulární junkce, např. C terminální agrinový fragment (CAF) – protein syntetizovaný motoneurony destabilizující receptor pro acetylcholin, u sarkopenie je zvýšen a koreluje s neuromuskulární únavností a nízkou ALM
- endokrinní dysfunkci, tj. hormony ovlivňující proteoanabolizmus – testosteron, DHEA, a osu GH-IGF-1,
- růstové faktory regulující růst svalu, např. myostatin (MYO), activin A a B, růstový diferenciační faktor 15 (GDF-15), kostní morfogenetické proteiny, TGFβ, folistatin (FST – hlavní inhibitor myostatinu) a brain-derived neurotrophic factor (BDNF),
- obrat svalových proteinů. Do této skupiny patří sarkomerické proteiny (aktin, myosin, troponin a tropomyosin) a proteiny extracelulární matrix (N-terminal globular domain epitop kolagenu 6, IC6), MMP-generated degradation fragment of collagen 6 (C6M), N-terminal peptide (P3NP, 3-methylhistidin – 3MH), X izoforma troponinu T specifická pro kosterní sval (sTnT) a kreatinin,
- markery fyzické inaktivity, např. komplement protein C1q, hemoglobin, albumin, selen, leptin, kyselina močová, magnesium a vitamin D,
- markery zánětu a oxidativního stresu: IL6, IL1, TNFα, butyryl-cholinesterase (b-CHE), oxidovaný low density lipoprotein (OxLDL) a vitamin C.
Uvedené biomarkery zachycují pouze možné patogenetické mechanizmy sarkopenie a jejich korelace s klinicky významnými aspekty je slabá. Mohou však napomoci v identifikaci procesů podílejících se na rozvoji multifaktoriálně podmíněné sarkopenie. V současnosti probíhá intenzivní výzkum, který by umožnil jejich rozšíření v klinické praxi.
Současné terapeutické přístupy u sarkopenie
Ovlivnění komorbidit
U sekundární sarkopenie, např. u chronické obstrukční plicní nemoci (CHOPN), srdečního selhání, chronických systémových zánětlivých onemocnění, osteoporózy, diabetu nebo obezity je důležitá léčba primární choroby.
Fyzická aktivita a cvičební programy
Z klinické praxe je znám negativní vliv krátkodobé inaktivity během hospitalizace, poranění nebo rekonvalescence, během níž dochází k akcelerované ztrátě svalové hmoty. Během inaktivity klesá u starších osob proteosyntéza ve svalu o 30 % a za každý den inaktivity/imobility se ztrácí 0,5–1 % svalové hmoty [70]. Proteokatabolizmus není zásadněji postižen. Vzhledem k již popsané anabolické rezistenci starších osob, tj. snížené odpovědi na anabolické stimuly, je velmi obtížné tento proces zvrátit.
Jako nejefektivnější se ukazují fyzická aktivita, konkrétně posilovací cvičení formou progresivního odporového tréninku (progressive resistence training – PRT). Při tomto typu cvičení pacient procvičuje jednotlivé svalové skupiny proti zevnímu odporu, a zátěž a počet opakování pohybu se postupně zvyšuje podle individuálních schopností. Doporučuje se zahajovat cvičení s frekvencí 2krát týdně a postupně navyšovat na 3krát týdně, prodlužuje se postupně i délka lekcí. Minimální délka trvání cvičebního programu je 8–12 týdnů. V klinických studiích byla využívána tradiční posilovací cvičení se závažím, cvičení s gumou, cvičení proti gravitaci vlastní vahou atd. Vhodné je kombinovat PRT i se cvičením aerobním, vytrvalostním a cvičením rovnováhy a kloubní pružnosti [71].
V Cochrane databázi 121 studií potvrdili Liu a Latham výrazný efekt PRT na zvýšení svalové síly a VO2max [72]. PRT má pozitivní i když méně vyjádřený efekt na fyzickou výkonnost, rychlost chůze a postavování ze sedu [73]. Metaanalýza zahrnující 1 328 starších osob s PRT programem potvrdila efekt PRT na zvýšení svalové hmoty (1,1 kg; 0,9–1,2 kg), vyšší intenzita cvičení vedla k většímu nárůstu [74].
U starších křehkých osob se sarkopenií a funkčním omezením je obtížné zahájit intenzivní program fyzické aktivity. Při tom právě u křehkých seniorů může cvičení zabránit rozvoji disability. Je třeba program přizpůsobit jejich funkčním omezením a velmi postupně intenzitu cvičení zvyšovat. U fyzicky zdatnějších nezávislých seniorů se doporučuje jakákoli fyzická aktivita, a to jak aerobní (optimálně 90–150 min týdně nejméně střední intenzity) plus posilovací cvičení (PRT) 2krát týdně. Vhodnější jsou skupinové aktivity a u PRT se doporučuje zaškolení fyzioterapeutem a alespoň periodicky dohled nad správným prováděním. Osvědčuje se začleňovat fyzickou aktivitu do běžné denní rutiny [11,15].
Nutriční intervence
Malnutrice zcela nepochybně zasahuje do patogeneze sarkopenie a je jedním ze známých faktorů zhoršujících svalovou funkci především u křehkých pacientů. Se stoupajícím věkem klesá celkový kalorický příjem, mění se stravovací návyky a energeticky a proteinem bohatá strava je nahrazována potravinami s nízkou kalorickou i biologickou hodnotou. Zvyšuje se počet seniorů v malnutrici a zvláště po 70. roce věku dochází k postupnému poklesu hmotnosti. V tomto věku tvoří 75 % ze ztracené hmotnosti tuk a 25 % jde na vrub ztráty svalové a kostní hmoty. I když se podaří dosáhnout zvýšení hmotnosti, dojde jen k velmi malému doplnění původně ztracené svalové hmoty. Narůstá pouze množství tukové tkáně a dochází k rozvoji sarkopenické obezity. Základní prevencí rozvoje sarkopenie ve vyšším věku je proto dostatečný a vyvážený proteinokalorický příjem [75].
Mezinárodní odborné společnosti (Society for Sarcopenia, Cachexia, and Wasting Diseases [76] a European Society for Clinical and Economic Aspects of Osteoporosis/ESCEO [75]) vypracovaly doporučení pro nutriční intervenci pro prevenci a management sarkopenie. V obou doporučeních se zdůrazňuje synergický efekt nutriční intervence s fyzickou aktivitou.
Hlavní nutriční strategie doporučované pro léčbu sarkopenie zahrnují [11,75–77]:
Zvýšený příjem proteinu
Dostatečný příjem proteinu napomáhá udržet svalovou hmotu a sílu u dospělých i starých osob. Vzhledem k anabolické rezistenci starších osob je třeba pro dosažení optimální proteosyntézy vyššího množství proteinu, než jsou doporučované denní dávky (DDD) 0,8 g proteinu/kg hmotnosti/den. Na základě výsledků studie PROT-AGE bylo navrženo zvýšení DDD proteinu pro starší osoby na 1,2 g/kg/den (tj. 90 g proteinu denně při hmotnosti 75 kg). Jde o příjem kvalitního proteinu s vysokým obsahem leucinu a dalších esenciálních aminokyselin v dietě nebo formou proteinové suplementace [78]. U seniorů se syndromem křehkosti nebo s chronickým onemocněním s vysokým rizikem progrese sarkopenie je doporučená dávka proteinu ještě vyšší 1,2–1,5 g/kg/den.
Je dostatek vědeckých důkazů, že proteinová suplementace zpomaluje úbytek svalové hmoty, větší efekt se popisuje u pacientů s původně nízkým příjmem proteinu. Efekt na zlepšení svalové funkce však je méně výrazný a popisují ho pouze některé studie. Proteoanabolická odpověď svalu je závislá na aminokyselinovém složení proteinu. Primárním stimulem proteosyntézy jsou esenciální aminokyseliny (viz dále), které jsou obsaženy ve vysoce kvalitních bílkovinách především živočišného původu.
Ke stimulaci maximální proteosyntézy je u starších osob třeba asi 30 g proteinu. Doporučuje se proto rozdělit doporučenou denní dávku do 3denních porcí (tj. 3 × 30 g) k dosažení optimální stimulace během celého dne [79]. V případě fyzické aktivity PRT se doporučuje příjem rychle stravitelného proteinu (syrovátkový protein, mléko) krátce po skončení cvičení.
Esenciální aminokyseliny, jejich metabolity a prekurzory
Suplementace aminokyselinami s rozvětveným řetězcem – leucin, izoleucin a valin byla v minulosti užívána atlety ke zlepšení výkonosti. Systematický přehled a metaanalýza publikovaných studií potvrzují, že leucin zvyšuje proteosyntézu ve svalu a také LBM a může rozšiřovat intervenční spektrum u sarkopenie [80,81].
β-hydroxy β-methylbutyrát (HMB) je metabolitem leucinu s vyšší účinností na stimulaci proteosyntézy. Také HMB byl historicky užíván sportovci. Denní dávka 3 g HMB působí preventivně proti svalové atrofii, ale jsou třeba další studie, které by zhodnotily jeho efekt na zlepšení svalové síly a výkonu [82].
Ornitin α-ketoglutarát (OKG) je prekurzorem několika aminokyselin (glutamátu, glutaminu, argininu a prolinu) a dalších biologicky aktivních látek (polyaminů, citrulinu, α-ketoisokaproátu a NO), které jsou významnými modulátory proteinového metabolizmu a hemodynamiky ve svalu [77]. Jejich zavedení do praxe však vyžaduje další klinické studie.
Suplementace vitaminem D
Sérové hladiny vitaminu D klesají s věkem a deficit vitaminu D je u starších osob častý. Vitamin D ovlivňuje svalový metabolizmus a trofiku a nízké hladiny jsou asociovány se sarkopenií. V holandské studii Longitudinal Aging Study Amsterdam měli senioři s nízkou hladinou 25(OH) vitaminu D < 25 nmol/l 2krát větší pravděpodobnost trpět sarkopenií [75]. Metaanalýza 29 studií se suplementací vitaminem D potvrdila malé, ale statisticky významné zvýšení svalové hmoty i síly [83]. Snížil se o 19 % i výskyt pádů [84]. Další výsledky studie PROVIDE naznačily i výhodnost kombinované nutriční suplementace vitaminem D a syrovátkovým proteinem obohaceným leucinem u sarkopenických pacientů, která zlepšila svalovou hmotu a sílu dolních končetin více než prostá suplementace vitaminem D [85]. V současnosti probíhající studie DO-HEALTH (http://dohealth.eu/wordpress/) ověřuje kombinovaný efekt cvičebního programu, vitaminu D a ω-3 mastných kyselin. Na základě těchto výsledků se doporučuje stanovit u všech sarkopenických pacientů hladinu vitamin D a v případě nízkých sérových hodnot podat terapeutickou dávku vitaminu D do normalizace, dlouhodobě pak podávat udržovací dávku 800 IU denně.
Kreatin monohydrát
Kreatin monohydrát v dávce 5–20 g denně podávaný během PRT zlepšoval svalovou hmotu i výkonnost a doporučuje se podávat po dobu 12 týdnů při současně probíhajícím PRT programu a při pokračujícím cvičení i déle [15,76].
Antioxidanty
Antioxidanty (tj. selen, vitaminy A, C, E, a β karoten) snižují úroveň oxidačního stresu a předpokládá se, že by mohly zmírňovat oxidační stres, a tak zasáhnout do patofyziologie sarkopenie. V epidemiologických studiích byla vyšší plazmatická hladina antioxidantů spojena s nižším rizikem disability a lepší svalovou silou. Intervenční studie až dosud nepotvrdily benefit suplementace antioxidanty a jejich podávání u sarkopenie tak nemá oporu v klinických studiích a může představovat zdravotní riziko [15].
ω-3 mastné kyseliny (MK)
Polynenasycené mastné kyseliny (PUFAs) mohou zlepšovat proteosyntézu ve svalu a sílu stisku ruky [86]. Eikosanoidy mají protizánětlivý potenciál, především n-3 PUFA s dlouhým řetězcem (kyselina eikosapentaenová a dokosahexaenová). Metaanalýza 68 studií, které sledovaly efekt těchto MK získaných z mořských živočichů, potvrdily protizánětlivý účinek a snížení cytokinů a TNFα. Efekt na proteosyntézu ve svalu a na svalovou hmotu nebo funkci nebyl konzistentní. Zatím tedy ani ω-3 MK nemohou být využity pro léčbu sarkopenie.
Kalorická restrikce
Diskutovanou intervencí je kalorická restrikce s pravidelným fyzickým cvičením, které zlepšují celkové zdraví i homeostázu proteinového obratu [87]. Riziko váhového úbytku v důsledku kalorické restrikce u neobézních seniorů s akcelerací svalové atrofie i nedostatečně prozkoumané mechanizmy kalorické restricke neumožňují tyto postupy zatím uplatňovat v praxi [88].
V praxi nejsou v ČR dostupné nutriční produkty pro lékařské účely s indikací sarkopenie. Lze však využít nutriční doplňky s navýšeným obsahem proteinu (např. Nutridrink protein, Fresubin protein energy), HMB, vitaminem D (Ensure plus Advance), ω-3 MK (některé onkologické produkty). Mají však současně vysoký energetický obsah, a proto nejsou vhodné např. u sarkopenické obezity. Ostatní produkty lze najít spíše v doplňcích pro sportovní výživu nabízejících široké spektrum aminokyselinových, proteinových a dalších doplňků.
Kombinované intervence – fyzická aktivita + nutriční suplementace
Stále více klinických studií potvrzuje, že lepšího efektu dosahují kombinované léčebné režimy [89,90]. Metaanalýza 22 studií kombinující PRT s proteinovou suplementací potvrdila statisticky významně vyšší nárůst beztukové hmoty, objemu svalu a síly dolních končetin u kombinovaných režimů v porovnání pouze s PRT [91]. Fyzická aktivita zvyšuje citlivost kosterních svalů k proteinoanabolickému efektu aminokyselin, a proto jsou kombinace cvičebních programů s vhodnou nutriční podporou doporučenou strategií k udržení svalové hmoty a síly ve vyšším věku [75].
Farmakologická léčba
V současnosti není registrován žádný lék pro léčbu sarkopenie. Ve vývoji je však několik substancí, které zasahují na různých úrovních do několika patofyziologických cest. Tab. 4 zachycuje nové látky k ovlivnění sarkopenie a probíhající klinické studie.
4. Farmakologické látky ověřované pro léčbu svalové atrofie, sarkopenie a kachexie v klinických studiích (upraveno podle [15]) ![Farmakologické látky ověřované pro léčbu svalové atrofie, sarkopenie a kachexie v klinických studiích
(upraveno podle [15])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b73bc41c515fca7d5f38f09ee90db7ab.png)
Vzhledem ke klesající proteosyntéze byly v léčbě sarkopenie ověřovány protenoanabolické hormony. Bohužel, pro jejich nežádoucí účinky nemohou být doporučeny v této indikaci. V klinických studiích byly ověřovány:
- Testosteron v terapeutických dávkách zvyšuje svalovou hmotu a méně i svalovou sílu a celkovou svalovou výkonnost a vede k poklesu množství tukové hmoty. Vyšší dávky stimulují myogenezu aktivací satelitních buněk a potlačují adipogenezu [92]. Podávání testosteronu zejména u non-hypogonadálních mužů je spojeno s rizikem nežádoucích účinů (zvýšené kardiovaskulární riziko, retence tekutin, polycytemie, akcelerace benigních i maligních postižení prostaty, horšení spánkové apnoe). Nežádoucí účinky (NÚ) jsou však závislé na dávce a vyskytují se obvykle až při podávání vysokých dávek 300–600 mg/týden [15]. V červenci roku 2018 byly publikovány první výsledky dosud probíhající velké klinické studie The Testosterone Trials in Older Men [93,94]. Testosteron zvýšil množství svalové hmoty, které však nebylo doprovázeno zlepšením fyzické výkonnosti hodnocené jako vzdálenost ušlá za 6 min. Další rozsáhlá studie The T4DM trial sleduje efekt léčby testosteronem u diabetiků a bylo zahájeno zařazování pacientů.
- Selektivní modulátory androgenních receptorů (SARM) mají zachovaný anabolický efekt na kost a sval, ostatní účinky zodpovědné za NÚ jsou potlačeny. V současnosti je ověřováno několik nesteroidních SARM (tab. 4). Enobosarm ověřovaný ve fázi 2 klinického hodnocení zvýšil po 3 měsících LBM i fyzický výkon u mužů i postmenopauzálních žen a byl dobře snášen [95]. Přestože je stále v klinickém hodnocení, lze jej v současnosti již zakoupit jako anabolikum pod názvem Ostarine v internetovém prodeji. Další SARM, MK-773, u sarkopenických křehkých seniorů statisticky významně zvýšil LBM, ale bez pozitivního účinku na sílu a funkci [96]. Přes větší bezpečnost je efekt SARM na LBD menší ve srovnání s vyššími dávkami testosteronu. Zatím chybějí data o efektivitě, perzistenci účinku a bezpečnosti při dlouhodobém podávání.
- GH/IGF1. Podávání růstového hormonu a jím indukovaného IGF1 je zatíženo řadou NÚ (ortostatická hypotenze, gynekomastie, myozitida, hyperglykemie, edémy, syndrom karpálního tunelu, zvýšené kardiovaskulární riziko) a přes zvýšení LBM nezlepšilo svalové funkce [15]. Proto jsou pro léčbu sarkopenie nevhodné.
- Grelin a agonisté grelinových receptorů. Grelin potencuje chuť k jídlu, zvyšuje příjem potravy a stimuluje sekreci růstového hormonu. Zatím jen několik malých studií s grelinovými agonisty (anamorelin a kapromorelin) demonstrovalo pozitivní efekt na svalovou hmotu a funkci (tandemová chůze, chůze do schodů). Vzhledem k malému efektu na LBM se neočekává jejich využití v léčbě sarkopenie.
- ACE inhibitory. Funkční zvýšení výkonnosti (6minutová chůze) bylo popsáno již v roce 2007 ve studii s perindoprilem u srdečního selhání Smukadasem et al [97]. Došlo i ke snížení výskytu fraktur stehenní kosti. Následně proběhlo několik menších studií s nekonzistentními výsledky. Nově zahájená klinická studie The LACE study (Leucine and ACE inhibitors in sarcopenia) bude ověřovat efekt kombinované léčby v trvání 12 měsíců na celkovou zdatnost (hodnocenou SPPB) a svalovou hmotu (DXA) i nákladovou efektivitu [98].
Nové farmakologické přístupy
Vzhledem k předpokládané roli prozánětlivých cytokinů a myokinů v patogenezi sarkopenie se nabízejí v léčbě i monoklonální protilátky [99]. Do klinického hodnocení postoupily antimyostatinové monoklonální protilátky trevogrumab, landogrozumab a bimagrumab [100]. Probíhající studie v indikacích nádorové kachexie, po operacích na horní části stehenní kosti, v prevenci pádů i primární sarkopenie jsou slibné především v zabránění ztráty svalové hmoty, efekt na výkonnostní testy však je omezený. Zatím je vývoj ve fázi 2–3 klinických hodnocení, lze však reálně očekávat uvedení některé z těchto anabolicky působících látek do registračního řízení během několika let.
prof. MUDr. Topinková Eva, CSc.
Geriatrická klinika 1. LF UK a VFN v Praze
Doručeno do redakce 27. 8. 2018
Přijato po recenzi 14. 9. 2018
Sources
- Fried LP, Tangen CM, Walston J et al. Frailty in older adults: Evidence for a phenotype. J Gerontol A Biol Sci Med Sci 2001; 56(3): M146–156.
- Drey M, Pfeifer K, Sieber C et al. The Fried frailty criteria as inclusion criteria for a randomized controlled trial: Personal experience and literature review. Gerontology 2011; 57(1): 11–18. Dostupné z DOI: <http://dx.doi.org/10.1159/000313433>.
- Rockwood K, Song X, Mac Knight C et al. A global clinical measure of fitness and frailty in elderly people. CMAJ 2005; 173(5): 489–495. Dostupné z DOI: <http://dx.doi.org/10.1503/cmaj.050051>.
- 2018 ICD-10-CM Diagnosis Code M62.84. Dostupné z WWW: <http://www.icd10data.com/ICD10CM/Codes/M00-M99/M60-M63/M62-/M62.84>.
- Vellas B, Fielding RA, Bens C et al. Implications of ICD-10 for sarcopenia clinical practice and clinical trials: report by the International Conference on Frailty and Sarcopenia Research Task Force. J Frailty Aging 2018; 7(1): 2–9. Dostupné z DOI: <http://dx.doi.org/10.14283/jfa.2017.30>.
- Anker SD, Coats AJS, Morely JE et al. Muscle wasting disease: A proposal for a new disease classification. J Cachexia Sarcopenia Muscle 2014; 5(1): 1–3. Dostupné z DOI: <http://dx.doi.org/10.1007/s13539–014–0135–0>.
- Janssen I, Heymsfield SB, Ross R. Low relative skeletal muscle mass (sarcopenia) in older persons is associated with functional impairment and physical disability. J Am Geriatr Soc 2002; 50(5): 889–896.
- Steffl M, Sima J, Shiells K et al. The increase in health care costs associated with muscle weakness in older people without long-term illnesses in the Czech Republic: results from the Survey of Health, Ageing and Retirement in Europe (SHARE). Clin Interv Aging 2017; 12 : 2003–2007. Dostupné z DOI: <http://dx.doi.org/10.2147/CIA.S150826>.
- Shafiee G, Keshtkar A, Soltani A et al. Prevalence of sarcopenia in the world: a systematic review and metaanalysis of general population studies. J Diabetes Metab Disord 2017; 16 : 21. Dostupné z DOI: <http://dx.doi.org/10.1186/s40200–017–0302-x>.
- Ethgen O, Beaudart C, Buckinx F et al. The future prevalence of sarcopenia in Europe: a claim for public health action. Calcif Tissue Int 2017; 100(3): 229–234. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–016–0220–9>.
- Beaudart Ch, McCloskey E, Bruyere O et al. Sarcopenia in daily practice: assessment and management. BMC Geriatrics 2016; 16(1): 170. Dostupné z DOI: <http://dx.doi.org/10.1186/s12877–016–0349–4>.
- Landi F, Cruz-Jentoft AJ, Liperoti R et al. Sarcopenia and mortality risk in frail older persons aged 80 years and older: results from ilSIRENTE study. Age Ageing 2013; 42(2): 203–209. Dostupné z DOI: <http://dx.doi.org/10.1093/ageing/afs194>.
- Morais JA. Sarcopenia – definitions and epidemiology. In: Evans JG, Williams TF, Beattie BL (eds) et al. Oxford Textbook of Geriatric Medicine. 2nd ed. Oxford University Press 2018. Chapter 54 : 409–414. ISBN 978–0192628305.
- Cawthon PM, Lui LY, Taylor BC et al. Clinical definitions of sarcopenia and risk of hospitalization in community-dwelling older men: The Osteoporotic Fractures in Men Study. J Gerontol A Biol Sci Med Sci 2017; 72(10): 1383–1389. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/glw327>.
- Liguori I, Russo G Aran L et al. Sarcopenia: assessment of disease burden and strategies to improve outcomes. Clin Interv Aging 2018; 13 :913–927. Dostupné z DOI: <http://dx.doi.org/10.2147/CIA.S149232>.
- Bernard T, Fielding RA. Pathophysiology of sarcopenia. In: Evans JG, Williams TF, Beattie BL (eds) et al. Oxford Textbook of Geriatric Medicine. 2nd ed. Oxford University Press 2018: Chapter 55. 415–420. ISBN 978–0192628305.
- Cuthbertson D, Smith K, Babraj J et al. Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle. Faseb J 2005; 19(3): 422–424. Dostupné z DOI: <http://dx.doi.org/10.1096/fj.04–2640fje>.
- Paddon-Jones J, Rasmussen BB. Dietary protein recommendations and the prevention of sarcopenia. Curr Opin Clin Nutr Metab Care 2009; 12(1): 86–90. Dostupné z DOI: <http://dx.doi.org/10.1097/MCO.0b013e32831cef8b>.
- Gumucio JP, Mendias CL. Atrogin-1, MuRF-1, and sarcopenia. Endocrine 2013; 43(1): 12–21. Dostupné z DOI: <http://dx.doi.org/10.1007/s12020–012–9751–7>.
- Schaap LA, Pluijm SM, Deeg DJ et al. Higher inflammatory marker levels in older persons: associations with 5-year change in muscle mass and muscle strength. J Gerontol A Biol Sci Med Sci 2009; 64(11): 1183–1189. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/glp097>.
- Lambert CP, Wright NR, Finck BN et al. Exercise but not diet-induced weight loss decreases skeletal muscle inflammatory gene expression in frail obese elderly persons. J Appl Physiol 2008; 105(2): 473–478. Dostupné z DOI: <http://dx.doi.org/10.1152/japplphysiol.00006.2008>.
- Ferrucci L, Penninx BW, Volpato S et al. Change in muscle strength explains accelerated decline of physical function in older women with high interleukin-6 serum levels. J Am Geriatr Soc 2002; 50(12): 1947–1954.
- Goldberg EL, Dixit VD. Drivers of age-related inflammation and strategies for healthspan extension. Immunol Rev 2015; 265(1): 63–74. Dostupné z DOI: <http://dx.doi.org/10.1111/imr.12295>.
- Calvani R, Joseph AM, Adhihetty PJ et al. Mitochondrial pathways in sarcopenia of aging and disuse muscle atrophy. Biol Chem 2013; 394(3): 393–414. Dostupné z DOI: <http://dx.doi.org/10.1515/hsz-2012–0247>.
- Sayer AA, Syddall H, Martin H et al. The developmental origins of sarcopenia. J Nutr Health Aging 2008; 12(7): 427–432.
- Keller K, Engelhardt M. Strength and muscle mass loss with aging process. Age and strength loss. Muscles Ligaments Tendons J 2013; 3(4): 346–350.
- Cruz-Jentoft AJ, Baeyens JP, Bauer JM et al. Sarcopenia: European consensus on definition and diagnosis: report of the European working group on sarcopenia in older people. Age Ageing 2010; 39(4): 412–423. Dostupné z DOI: <http://dx.doi.org/10.1093/ageing/afq034>.
- Steffl M, Bohannon RW, Sontakova L et al. Relationship between sarcopenia and physical activity in older people: a systematic review and meta-analysis. Clin Interv Aging 2017; 12 : 835–845. Dostupné z DOI: <http://dx.doi.org/10.2147/CIA.S132940>.
- Bahat G, Ilhan B. Sarcopenia and the cardiometabolic syndrome: a narrative review. Eur Geriatr Med 2016; 7(3): 220–223. Dostupné z DOI: <http://dx.doi.org/10.1016/j.eurger.2015.12.012>.
- Bone AE, Hepgul N, Kon S et al. Sarcopenia and frailty in chronic respiratory disease. Chron Respir Dis 2017; 14(1): 85–99. Dostupné z DOI: <http://dx.doi.org/10.1177/1479972316679664>.
- Muscaritoli M, Anker SD, Argiles J et al. Consensus definition of sarcopenia, cachexia and pre-cachexia: joint document elaborated by Special Interest Groups (SIG) “cachexia-anorexia in chronic wasting diseases” and “nutrition in geriatrics”. Clin Nutr 2010; 29(2): 154–159. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clnu.2009.12.004>.
- Prado CM, Wells JC, Smith SR et al. Sarcopenic obesity: a critical appraisal of the current evidence. Clin Nutr 2012; 31(5): 583–601. <http://dx.doi.org/10.1016/j.clnu.2012.06.010>.
- Kalinkovich A, Livshits G. Sarcopenic obesity or obese sarcopenia: A cross talk between age-associated adipose tissue and skeletal muscle inflammation as a main mechanism of the pathogenesis. Ageing Res Rev 2017; 35 : 200–221. Dostupné z DOI: <http://dx.doi.org/10.1016/j.arr.2016.09.008>.
- Kob R, Bollheimer LC, Bertsch T et al. Sarcopenic obesity: molecular clues to a better understanding of its pathogenesis? Biogerontology 2015; 16(1): 15–29. Dostupné z DOI: <http://dx.doi.org/10.1007/s10522–014–9539–7>.
- Reinders I, Murphy RA, Brouwer IA et al. Muscle quality and myosteatosis: novel associations with mortality risk: the Age, Gene/Environment Susceptibility (AGES)-Reykjavik Study. Am J Epidemiol 2016; 183(1): 53–60. Dostupné z DOI: <http://dx.doi.org/10.1093/aje/kwv153>.
- Cruz-Jentoft AJ, Landi F, Topinková E et al. Understanding sarcopenia as a geriatric syndrome. Curr Opin Clin Nutr Metab Care 2010; 13(1): 1–7. Dostupné z DOI: <http://dx.doi.org/10.1097/MCO.0b013e328333c1c1>.
- Malmstrom TK, Miller DK, Simonsick EM et al. SARC-F: a symptom score to predict persons with sarcopenia at risk for poor functional outcomes. J Cachexia Sarcopenia Muscle 2016; 7(1): 28–36. Dostupné z DOI: <http://dx.doi.org/10.1002/jcsm.12048>.
- Ida S, Kaneko R, Murata K. SARC-F for screening of sarcopenia among alder adults: A meta-analysis of screening test accuracy. J Am Med Dir Assoc 2018; 19(8): 685–689. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jamda.2018.04.001>.
- Fielding RA, Vellas B, Evans WJ et al. Sarcopenia: an undiagnosed condition in older adults current consensus definition: prevalence, etiology, and consequences. International Working Group on Sarcopenia. J Am Med Dir Assoc 2011; 12(4): 249–256. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jamda.2011.01.003>.
- Morley JE, Abbatecola AM, Argiles JM et al. Sarcopenia with limited mobility: an International Consensus. J Am Med Dir Assoc 2011; 12(6): 403–409. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jamda.2011.04.014>.
- Studenski SA, Peters KW, Alley DE et al. The FNIH Sarcopenia Project: rationale, study description, conference recommendations, and final estimates. J Gerontol A Biol Sci Med Sci 2014; 69(5): 547–558. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/glu010>.
- Chen LK, Liu LK, Woo J et al. Sarcopenia in Asia: consensus Report of the Asian Working Group for Sarcopenia. J Am Med Dir Assoc 2014; 15(2): 95–101. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jamda.2013.11.025>.
- Leong DP, Teo KK, Rangarajan S et al. Prognostic value of grip strength: findings from the Prospective Urban Rural Epidemiology (PURE) study. Lancet 2015; 386(9990): 266–273. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(14)62000–6>.
- Roberts HC, Denison HJ, Martin HJ et al. A review of the measurement of grip strength in clinical and epidemiological studies: towards a standardised approach. Age Ageing 2011; 40(4): 423–429. Dostupné z DOI: <http://dx.doi.org/10.1093/ageing/afr051>.
- Dodds RM, Syddall HE, Cooper R et al. Grip strength across the life course: normative data from twelve British studies. PLoS One 2014; 9(12): e113637. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0113637>.
- Pinheiro PA, Carneiro JAO, Coqueiro RS et al. “Chair Stand Test” as simple tool for sarcopenia screening in elderly women. J Nutr Health Aging 2016; 20(1): 56–59. Dostupné z DOI: <http://dx.doi.org/10.1007/s12603–015–0621-x>.
- Francis P, Toomey C, Mc Cormack W et al. Measurement of maximal isometric torque and muscle quality of the knee extensors and flexors in healthy 50 - to 70-year-old women. Clin Physiol Funct Imaging 2017; 37(4): 448–455. Dostupné z DOI: <http://dx.doi.org/10.1111/cpf.12332>.
- Peel NM, Kuys SS, Klein K. Gait speed as a measure in geriatric assessment in clinical settings: a systematic review. J Gerontol A Biol Sci Med Sci 2013; 68(1): 39–46. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/gls174>.
- Studenski S, Perera S, Patel K et al. Gait speed and survival in older adults. JAMA 2011; 305(1): 50–58. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2010.1923>.
- Rydwik E, Bergland A, Forsen L et al. Investigation into the reliability and validity of the measurement of elderly people’s clinical walking speed: a systematic review. Physiother Theory Pract 2012; 28(3): 238–256. Dostupné z DOI: <http://dx.doi.org/10.3109/09593985.2011.601804>.
- Verghese J, Annweiler C, Avers E et al. Motoric cognitive risk syndrome: multicountry prevalence dementia risk. Neurology 2014; 83(8): 718–726. Dostupné z DOI: <http://dx.doi.org/10.1212/WNL.0000000000000717>.
- Vestergaard S, Patel KV, Bandinelli S et al. Characteristics of 400-meter walk test performance and subsequent mortality in older adults. Rejuvenation Res 2009; 12(3): 177–184. Dostupné z DOI: <http://dx.doi.org/10.1089/rej.2009.0853>.
- Marzetti E, Cesari M, Calvani R et al. The “Sarcopenia and Physical fRailty IN older people: multi-componenT Treatment strategies” (SPRINTT) randomized controlled trial: case finding, screening and characteristics of eligible participants. Exp Gerontol 2018; 113 : 48–57. Dostupné z DOI: <http://dx.doi.org/10.1016/j.exger.2018.09.017>.
- Rolland YM, Cesari M, Miller ME et al. Reliability of the 400-m usual-pace walk test as an assessment of mobility limitation in older adults. J Am Geriatr Soc 2004; 52(6): 972–976. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1532–5415.2004.52267.x>.
- Guralnik JM, Ferrucci L, Pieper CF et al. Lower extremity function and subsequent disability: consistency across studies, predictive models, and value of gait speed alone compared with the short physical performance battery. J Gerontol A Biol Sci Med Sci 2000; 55(4): M221-M231.
- Pavasini R, Guralnik J, Brown JC et al. Short Physical Performance Battery and all-cause mortality: systematic review and meta-analysis. BMC Med 2016; 14(1): 215. Dostupné z DOI: <http://dx.doi.org/10.1186/s12916–016–0763–7>.
- Berková M, Topinková E, Mádlová P et al. Krátká baterie pro testování fyzické zdatnosti seniorů – pilotní studie a validizace testu u starších osob v České republice. Vnitř Lék 2013; 59(4): 256–263.
- Podsiadlo D, Richardson S. The timed “Up & Go”: a test of basic functional mobility for frail elderly persons. J Am Geriatr Soc 1991; 39(2): 142–148.
- Kalvach Z, Čeledová L, Holmerová I et al. Křehký pacient a primární péče. 1. elektronické vyd. Grada: Praha 2012. ISBN 978–80–247–7628–6 (online; pdf). ISBN 978–80–247–7629–3 (online; epub).
- Bischoff HA, Stahelin HB, Monsch AU et al. Identifying a cut-off point for normal mobility: a comparison of the timed ‘up and go’ test in community-dwelling and institutionalised elderly women. Age Ageing 2003; 32(3): 315–320.
- Cooper C, Fielding R, Visser M et al. Tools in the assessment of sarcopenia. Calcif Tissue Int 2013; 93(3): 201–210. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–013–9757-z>.
- Cawthon PM, Peters KW, Shardell MD et al. Cutpoints for low appendicular lean mass that identify older adults with clinically significant weakness. J Gerontol A Biol Sci Med Sci 2014; 69(5): 567–575. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/glu023>.
- Kim J, Wang Z, Heymsfield SB et al. Total-body skeletal muscle mass: estimation by a new dual-energy X-ray absorptiometry method. Am J Clin Nutr 2002; 76(2): 378–383. Dostupné z DOI: <http://dx.doi.org/10.1093/ajcn/76.2.378>.
- Chien MY, Huang TY, Wu YT. Prevalence of sarcopenia estimated using a bioelectrical impedance analysis prediction equation in community-dwelling elderly people in Taiwan. J Am Geriatr Soc 2008; 56(9): 1710–1715. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1532–5415.2008.01854.x>.
- Yamada Y, Nishizawa M, Uchiyama T et al. Developing and validating an age-independent equation using multi-frequency bioelectrical impedance analysis for estimation of appendicular skeletal muscle mass and establishing a cutoff for sarcopenia. Int J Environ Res Public Health 2017; 14(7). pii: E809. Dostupné z DOI: <http://dx.doi.org/10.3390/ijerph14070809>.
- Gould H, Brennan SL, Kotowicz MA et al. Total and appendicular lean mass reference ranges for Australian men and women: the Geelong osteoporosis study. Calcif Tissue Int 2014; 94(4): 363–372. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–013–9830–7>.
- McGregor RA, Cameron-Smith D, Poppitt SD. It is not just muscle mass: a review of muscle quality, composition and metabolism during ageing as determinants of muscle function and mobility in later life. Longev Healthspan 2014; 3(1): 9. Dostupné z DOI: <http://dx.doi.org/10.1186/2046–2395–3-9>.
- Nijholt W, Scafoglieri A, Jager-Wittenaar H et al. The reliability and validity of ultrasound to quantify muscles in older adults: a systematic review. J Cachexia Sarcopenia Muscle 2017; 8(5): 702–712. Dostupné z DOI: <http://dx.doi.org/10.1002/jcsm.12210>.
- Calvani R, Marini F, Cesari M et al. Biomarkers for physical frailty and sarcopenia. Aging Clin Exp Res 2017; 29(1): 29–34. Dostupné z DOI: <http://dx.doi.org/10.1007/s40520–016–0708–1>.
- Wall BT, Dirks ML, Van Loon LJ. Skeletal muscle atrophy during short-term disuse: implications for age-related sarcopenia. Ageing Res Rev 2013; 12(4): 898–906. Dostupné z DOI: <http://dx.doi.org/10.1016/j.arr.2013.07.003>.
- Yamada M, Arai H, Sonoda T et al. Community-based exercise program is cost-effective by preventing care and disability in Japanese frail older adults. J Am Med Dir Assoc 2012; 13(6): 507–511. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jamda.2012.04.001>.
- Liu CJ, Latham NK Progressive resistance strength training for improving physical function in older adults. Cochrane Database Syst Rev 2009; (3): CD002759. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD002759.pub2>.
- Fragala MS, Dam TT, Barber V et al. Strength and function response to clinical interventions of older women categorized by weakness and low lean mass using classifications from the Foundation for the National Institute of Health sarcopenia project. J Gerontol A Biol Sci Med Sci 2015; 70(2): 202–209. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/glu110>.
- Peterson MD, Sen A, Gordon PM. Influence of resistance exercise on lean body mass in aging adults: a meta-analysis. Med Sci Sports Exerc 2011; 43(2): 249–258. Dostupné z DOI: <http://dx.doi.org/10.1249/MSS.0b013e3181eb6265>.
- Robinson SM, Reginster JY, Rizzoli R et al. Does nutrition play a role in the prevention and management of sarcopenia? Clin Nutr 2018; 37(4): 1121–1132. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clnu.2017.08.016>.
- Morley JE, Argiles JM, Evans WJ et al. Society for Sarcopenia, Cachexia, and Wasting Disease. Nutritional recommendations for the management of sarcopenia. J Am Med Dir Assoc 2010; 11(6): 391–396. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jamda.2010.04.014>.
- Calvani R, Miccheli A, Landi F et al. Current nutritional recommendations and novel dietary strategies to manage sarcopenia. J Frailty Aging 2013; 2(1): 38–53.
- Bauer J, Biolo G, Cederholm T et al. Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from the PROT-AGE Study Group. J Am Med Dir Assoc 2013; 14(8): 542–559. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jamda.2013.05.021>.
- Paddon-Jones J, Rasmussen BB. Dietary protein recommendations and the prevention of sarcopenia. Curr Opin Clin Nutr Metab Care 2009; 12(1): 86–90. Dostupné z DOI: <http://dx.doi.org/10.1097/MCO.0b013e32831cef8b>.
- Xu Z, Tan Z, Zhang Q et al. The effectiveness of leucine on muscle protein synthesis, lean body mass and leg lean mass accretion in older people: a systematic review and meta-analysis. Br J Nutr 2015; 113(1): 25–34. Dostupné z DOI: <http://dx.doi.org/10.1017/S0007114514002475>.
- McDonald CK, Ankarfeldt MZ, Capra S et al. Lean body mass change over 6 years is associated with dietary leucine intake in an older Danish population. Br J Nutr 2016; 115(9): 1556–1562. Dostupné z DOI: <http://dx.doi.org/10.1017/S0007114516000611>.
- Wu H, Xia Y, Jiang J et al. Effect of beta-hydroxy-betamethylbutyrate supplementation on muscle loss in older adults: a systematic review and meta-analysis. Arch Gerontol Geriatr 2015; 61(2): 168–175. Dostupné z DOI: <http://dx.doi.org/10.1016/j.archger.2015.06.020>.
- Beaudart C, Buckinx F, Rabenda V et al. The effects of vitamin D on skeletal muscle strength, muscle mass, and muscle power: a systematic review and meta-analysis of randomized controlled trials. J Clin Endocrinol Metab 2014; 99(11): 4336–4345. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2014–1742>.
- Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. BMJ 2009; 169(6): 551–561. Dostupné z DOI: <http://dx.doi.org/10.1001/archinternmed.2008.600>.
- Bauer JM, Verlaan S, Bautmans I et al. Effects of a vitamin D and leucine-enriched whey protein nutritional supplement on measures of sarcopenia in older adults, the PROVIDE study: a randomized, double-blind, placebo-controlled trial. J Am Med Dir Assoc 2015; 16(9): 740–747. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jamda.2015.05.021>.
- Smith GI, Atherton P, Reeds DN et al. Omega-3 polyunsaturated fatty acids augment the muscle protein anabolic response to hyperinsulinaemia-hyperaminoacidaemia in healthy young and middle-aged men and women. Clin Sci (Lond) 2011; 121(6): 267–278. Dostupné z DOI: <http://dx.doi.org/10.1042/CS20100597>.
- Marzetti E, Lawler JM, Hiona A et al. Modulation of age-induced apoptotic signaling and cellular remodeling by exercise and calorie restriction in skeletal muscle. Free Radic Biol Med 2008; 44(2): 160–168. Dostupné z DOI: <http://dx.doi.org/10.1016/j.freeradbiomed.2007.05.028>.
- Mercken EM, Carboneau BA, Krzysik-Walker SM et al. Of mice and men: the benefits of caloric restriction, exercise, and mimetics. Ageing Res Rev 2012; 11(3): 390–398. Dostupné z DOI: <http://dx.doi.org/10.1016/j.arr.2011.11.005>.
- Denison HJ, Cooper C, Sayer AA et al. Prevention and optimal management of sarcopenia: a review of combined exercise and nutrition interventions to improve muscle outcomes in older people. Clin Interv Aging 2015; 10 : 859–869. Dostupné z DOI: <http://dx.doi.org/10.2147/CIA.S55842>.
- Naseeb MA, Volpe SL. Protein and exercise in the prevention of sarcopenia and aging. Nutr Res 2017; 40 : 1–20. Dostupné z DOI: <http://dx.doi.org/10.1016/j.nutres.2017.01.001>.
- Cermak NM, Res PT, De Groot LC et al. Protein supplementation augments the adaptive response of skeletal muscle to resistance-type exercise training: a meta-analysis. Am J Clin Nutr 2012; 96(6): 1454–1464. Dostupné z DOI: <http://dx.doi.org/10.3945/ajcn.112.037556>.
- Ferrando AA, Sheffield-Moore M, Paddon-Jones D et al. Differential anabolic effects of testosterone and amino acid feeding in older men. J Clin Endocrinol Metab 2003; 88(1): 358–362. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2002–021041>.
- Yeap BB, Page ST, Grossmann M. Testosterone treatment in older men: clinical implications and unresolved questions from the Testosterone Trials. Lancet Diabetes Endocrinol 2018; 6(8): 659–672. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–8587(17)30416–3>.
- Snyder PJ, Bhasin S, Cunningham GR et al. Lessons From the Testosterone Trials. Endocr Rev 2018; 39(3): 369–386. Dostupné z DOI: <http://dx.doi.org/10.1210/er.2017–00234>.
- Basaria S, Collins L, Dillon EL et al. The safety, pharmacokinetics, and effects of LGD-4033, a novel nonsteroidal oral, selective androgen receptor modulator, in healthy young men. J Gerontol A Biol Sci Med Sci 2013; 68(1): 87–95. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/gls078>.
- Cesari M, Fielding R, Bénichou O et al. Pharmacological interventions in frailty and sarcopenia: report by the International Conference on Frailty and Sarcopenia Research Task Force. J Frailty Aging 2015; 4(3): 114–120. Dostupné z DOI: <http://dx.doi.org/10.14283/jfa.2015.64>.
- Sumukadas D, Witham MD, Struthers AD et al. Effect of perindopril on physical function in elderly people with functional impairment: a randomized controlled trial. CMAJ 2007; 177(8): 867–874. Dostupné z DOI: <http://dx.doi.org/10.1503/cmaj.061339>.
- Band MM, Sumukadas D, Struthers AD et al. Leucine and ACE inhibitors as therapies for sarcopenia (LACE trial): study protocol for a randomised controlled trial. Trials 2018; 19(1): 6. Dostupné z DOI: <http://dx.doi.org/10.1186/s13063–017–2390–9>.
- Boutari C, Mantzoros CS. Decreasing Lean Body Mass with Age: Challenges and Opportunities for Novel Therapies. Endocrinol Metab (Seoul) 2017; 32(4): 422–425. Dostupné z DOI: <http://dx.doi.org/10.3803/EnM.2017.32.4.422>.
- Pirruccello-Straub M, Jackson J, Wawersik S et al. Blocking extracellular activation of myostatin as a strategy for treating muscle wasting. Sci Rep 2018; 8(1): 2292. Dostupné z DOI: <http://dx.doi.org/10.1038/s41598–018–20524–9>.
- Landi F, Liperoti R, Fusco D. Prevalence and risk factors of sarcopenia among nursing home older residents. J Gerontol A Biol Sci Med Sci 2012; 67(1): 48–55. Dostupné z DOI: <http://doi: 10.1093/gerona/glr035>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 11-
All articles in this issue
- Arterial hypertension in the elderly
- Thyroid disease in the elderly
- Diabetes mellitus in complex older patients
- Anticoagulant therapy in the elderly
- Statin therapy in elderly patients
- Specific features of rational geriatric pharmacotherapy: the role of clinical pharmacists in individualized drug treatment in older age
- Sarcopenia as a severe organ failure, its diagnosing and present therapeutic possibilities
- Nutritional support in geriatric patients: the ESPEN new recommended guidelines
- Electrolyte and water disorders in old age
- The geriatric patient and surgery
- Risk factors for hospitalization among older persons
- Falls: a significant cause of morbidity and mortality in elderly people
- Overactive urinary bladder in elderly female patients: treatment specificities and drug interactions
- Thermoregulatory disorders and their significance in the elderly
- Chronic non-healing wounds in geriatrics
- Do the test results of cognitive function and activities of daily life of seniors correlate with the state of vitamin D supply to the organism?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Thermoregulatory disorders and their significance in the elderly
- Sarcopenia as a severe organ failure, its diagnosing and present therapeutic possibilities
- Electrolyte and water disorders in old age
- Falls: a significant cause of morbidity and mortality in elderly people
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

