-
Medical journals
- Career
Hypotyreóza u pacientů se srdečním onemocněním
Authors: Jan Jiskra
Authors‘ workplace: III. interní klinika 1. LF UK a VFN v Praze
Published in: Vnitř Lék 2017; 63(9): 566-571
Category: Reviews
Overview
Hypotyreóza je u pacientů se srdečním onemocněním častým nálezem. Je rizikovým faktorem aterosklerózy a ischemické choroby srdeční a má přímý negativní vliv na funkci levé i pravé srdeční komory (hypotyreózní kardiomyopatie). Potvrzená manifestní hypotyreóza je vždy důvodem k substituční léčbě levotyroxinem; u pacientů se srdečním onemocněním vždy začínáme léčbu malou dávku a zvyšujeme postupně. Léčba subklinické hypotyreózy je u pacientů se srdečním onemocněním kontroverzní a její benefity pravděpodobně závisí na věku. Ve vyšším věku často rizika léčby převáží, a proto se raději spokojíme s cílovými hodnotami tyreoidálního stimulačního hormonu v horním pásmu normálního rozmezí, nebo i lehce nad ním, než abychom pacienta předávkovali. Velmi zjednodušeně lze říci, že léčba subklinické hypotyreózy u pacientů se srdečním onemocněním je nejefektivnější u mladších osob, zejména < 65 let, zatímco ve vyšším věku > 80 let již riziko obvykle převyšuje benefit.
Klíčová slova:
dysfunkce levé komory srdeční – dysfunkce pravé komory srdeční – hypotyreóza – ischemická choroba srdeční – kardiovaskulární riziko – protilátky proti tyreoidální peroxidáze – subklinická hypotyreózaÚvod
Hypotyreóza patří mezi onemocnění vyskytující se v masovém měřítku. Prevalence manifestní hypotyreózy, tedy zvýšený tyreoidální stimulační hormon (TSH) a snížený tyroxin v séru, je 3–5 % a asi stejně častá je subklinická hypotyreóza (zvýšený TSH a normální tyroxin v séru). Je zřejmé, že potenciální kardiovaskulární zdravotní rizika s nimi spojená ohrožují významnou část populace. Zatímco u manifestní hypotyreózy není o negativním vlivu na kardiovaskulární systém pochyb, u subklinické jsou význam kardiovaskulárního rizika a možnosti jeho ovlivnění předmětem pokračujících diskusí.
Patofyziologie
Existují 2 hlavní mechanizmy negativního vlivu hypotyreózy na srdce:
- hypotyreóza jako potenciální rizikový faktor aterosklerózy a ischemické choroby srdeční (ICHS)
- přímý negativní vliv hypotyreózy na srdeční funkci (hypotyreózní kardiomyopatie)
Hypotyreóza jako rizikový faktor aterosklerózy a ICHS
Hypotyreóza je příčinou proaterogenní dyslipidemie a snižuje vylučování vody ledvinami, čímž přispívá k diastolické arteriální hypertenzi. Zda je hypotyreóza i nezávislým rizikovým faktorem aterosklerózy, zůstává otevřenou otázkou. Zdá se, že to platí především pro manifestní hypotyreózu a pro subklinickou hypotyreózu u mladších osob (< 65 let). Patofyziologický mechanizmus zůstává neznámý (spekuluje se mimo jiné o roli cytoadhezivních molekul, vlivu na agregaci destiček apod). Naopak subklinická hypotyreóza u starších osob (> 80 let) se zdá být spojena s nižší kardiovaskulární i celkovou mortalitou.
Hypotyreózní kardiomyopatie
Změny srdce u manifestní hypotyreózy jsou dobře známé. Patří k nim perikardiální výpotek a porucha relaxace a kontraktility srdečního svalu s diastolickou a systolickou dysfunkcí. Průvodním jevem jsou nespecifické změny na EKG (negativní vlna T a snížená voltáž v hrudních svodech) a elevace kreatinkinázy v séru. Ty jsou nejednou mylně interpretovány jako ischemické změny (obr. 1). Perikardiální výpotek je způsoben sníženou glomerulární filtrací a sníženou schopností ledvin vylučovat vodu. Při tom dochází k hromadění tekutiny v třetích prostorech a k hyponatremii. To je pro hypotyreózu celkem typický jev. Porucha srdečního svalu se nejprve projeví poruchou relaxace (diastolická dysfunkce). Příčinou je zřejmě změna složení proteoglykanů mezibuněčného prostoru myokardu a vazba vody na ně – podobně jako při změnách kůže. Postupně dochází i ke změně složení bílkovin myokardu a k poruše kontraktility (ke stejným změnám dochází i v příčně pruhovaných svalech – důsledkem je hypotyreózní myopatie). Tyto změny jsou reverzibilní a funkce srdečních komor se po substituční léčbě levotyroxinem normalizuje, i když to může trvat řadu měsíců.
Image 1. EKG u hypotyreózy. 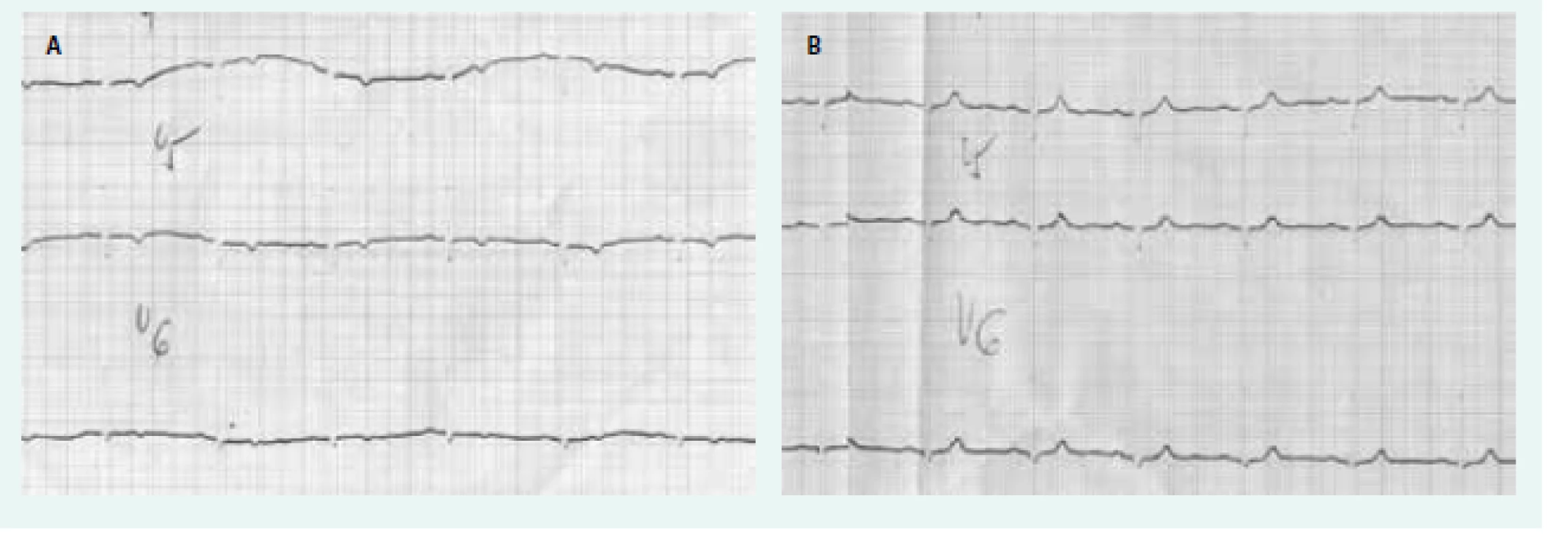
A – negativní vlny T u neléčené hypotyreózy B – normalizace po léčbě levotyroxinem Klinické studie
V posledních 30 letech byla realizována řada studií a metaanalýz, z nichž většina potvrdila manifestní hypotyreózu jako významný rizikový faktor kardiovaskulární morbidity a mortality. Subklinickou hypotyreózu jako rizikový faktor potvrdily jen některé studie a metaanalýzy, a jiné toto spojení naopak zpochybnily. Jednou z hypotéz je, že kardiovaskulární riziko je u subklinické hypotyreózy závislé na věku (graf 1), [12]. Metaanalýzy z posledních let totiž ukázaly, že kardiovaskulární riziko je u subklinické hypotyreózy významně zvýšeno jen u osob mladších 65 let, a to především u postmenopauzálních žen, které jsou ohroženy nejvíce [15]. Naopak ve vyšším věku se subklinická hypotyreóza zdá být naopak protektivním faktorem – příkladem je 2krát nižší mortalita u osob starších 85 let s mírně vyšším TSH (> 4,8 mIU/l) [19].
Graph 1. Hypotetická závislost kardiovaskulárního rizika subklinické hypotyreózy na věku. 
Upraveno podle [12] Dosud nemáme žádné důkazy, že má léčba levotyroxinem u subklinické hypotyreózy pozitivní vliv na kardiovaskulární morbiditu a mortalitu. K dispozici jsou pouze intervenční studie, které ukázaly, že léčba příznivě ovlivňuje rizikové faktory aterosklerózy [2,11], klesala rychlost pulzové vlny jako nezávislého prediktoru koronární aterosklerózy [1], zlepšila se průtokem prostředkovaná vazodilatace [16], došlo k poklesu systolického i diastolického krevního tlaku, zlepšila se glomerulární filtrace, snížila se intimomediální tloušťka a zvětšil se průměr a. carotis a byl pozorován vzestup endoteliálních progenitorových buněk jako nepřímá známka zlepšení endoteliální dysfunkce [18]. Terapie levotyroxinem u subklinické hypotyreózy vedla také ke zlepšení funkční tělesné kapacity (měřené 6minutovým „walk“ testem na běhátku) [7] a ke zlepšení dysfunkce levé [13] i pravé [21] srdeční komory. Na druhou stranu byla kardiovaskulární morbidita zvýšená i u pacientů, kteří měli subklinickou hypotyreózu levotyroxinem léčenou [14]. Řada prací také ukázala, že zejména u starších osob je relativní kardiovaskulární riziko u subklinické hypertyreózy (a tedy i riziko plynoucí z předávkování levotyroxinem!) vyšší než u subklinické hypotyreózy (graf 2) [15]. Recentní retrospektivní kohortová studie neprokázala žádný (ani pozitivní, ani negativní) vliv léčby levotyroxinem u pacientů se subklinickou hypotyreózou na riziko infarktu myokardu a celkovou mortalitu (n = 12 212) [3] ani na další kardiovaskulární příhody či frekvenci hospitalizací (n = 1 192) [4].
Graph 2. Relativní riziko kardiovaskulární morbidity u subklinické hypotyreózy a hypertyreózy u osob starších 80 let. 
RR – relativní riziko Upraveno podle [15] Diagnostika hypotyreózy
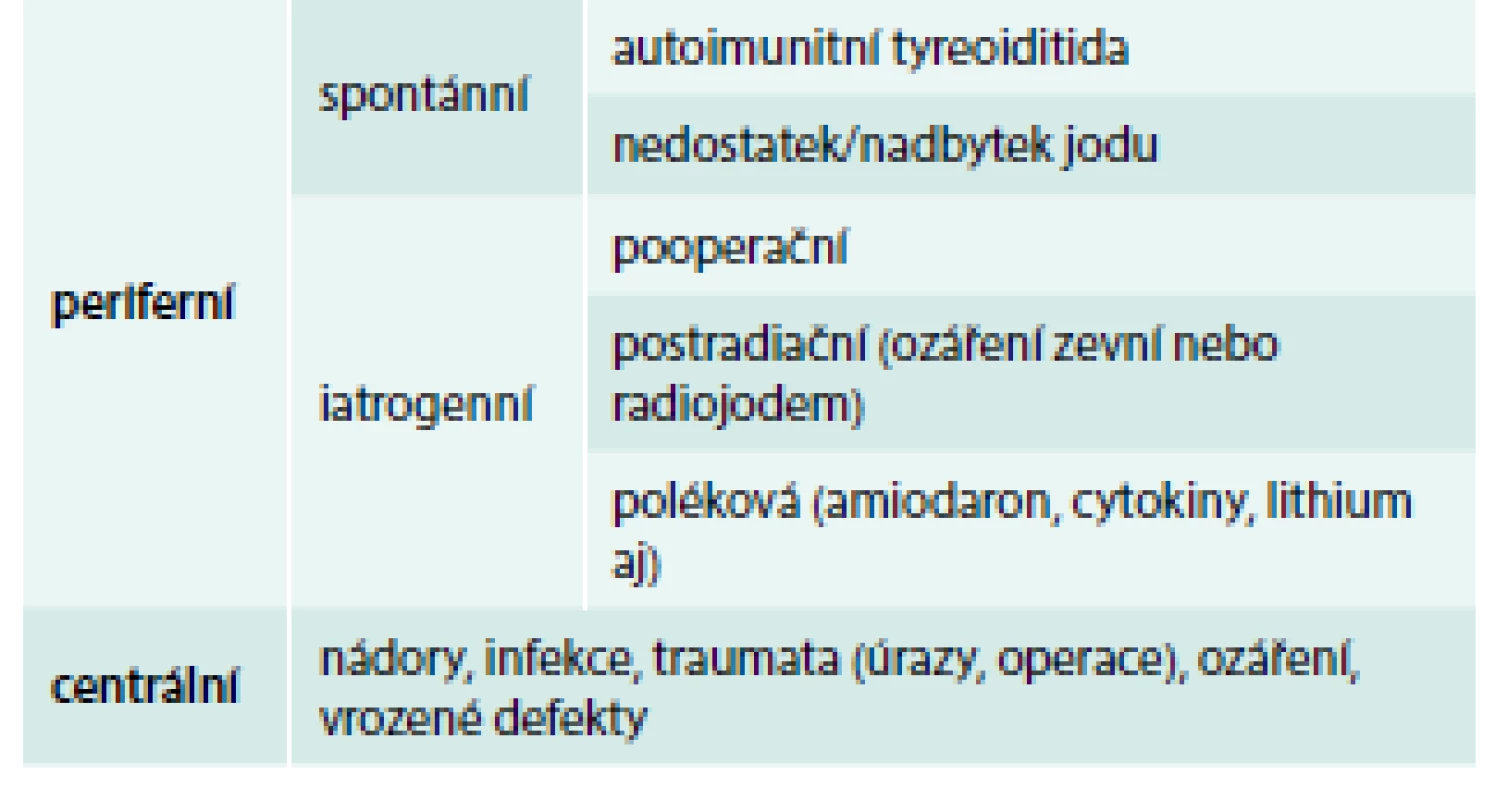
Základem diagnostiky periferní hypotyreózy je vyšetření hladiny TSH v séru. Pokud je normální, lze periferní tyreoidální dysfunkci vyloučit. Pokud jsou hodnoty TSH zvýšené, doplníme volný tyroxin (free thyroxine 4 – fT4) a protilátky proti tyreoidální peroxidáze (TPOAb – anti-thyroid autoantibodies) v séru, ev. zopakujeme vyšetření TSH. Bude-li fT4 snížený, jde o manifestní hypotyreózu, bude-li normální, jde o subklinickou hypotyreózu. Pozitivní TPOAb svědčí pro nejčastější příčinu hypotyreózy – autoimunitní tyreoiditidu. Ostatní příčiny jsou relativně vzácné (tab. 1). Je-li podezření na centrální hypotyreózu (operace nebo onemocnění hypofýzy v anamnéze, úraz hlavy, ozáření CNS, krvácení do CNS apod), je diagnóza naopak založena na vyšetření fT4.
Existují i „netyreoidální“ příčiny mírné elevace TSH (tab. 2), při nichž jsou negativní protilátky a normální nález při ultrasonografickém vyšetření. Tyto stavy nevyžadují léčbu levotyroxinem. Se zvýšeným TSH a sníženým fT4 se setkáme i u iatrogenní hypotyreózy vyvolané podáváním tyreostatik.
Table 2. Příčiny netyreoidální elevace TSH v séru 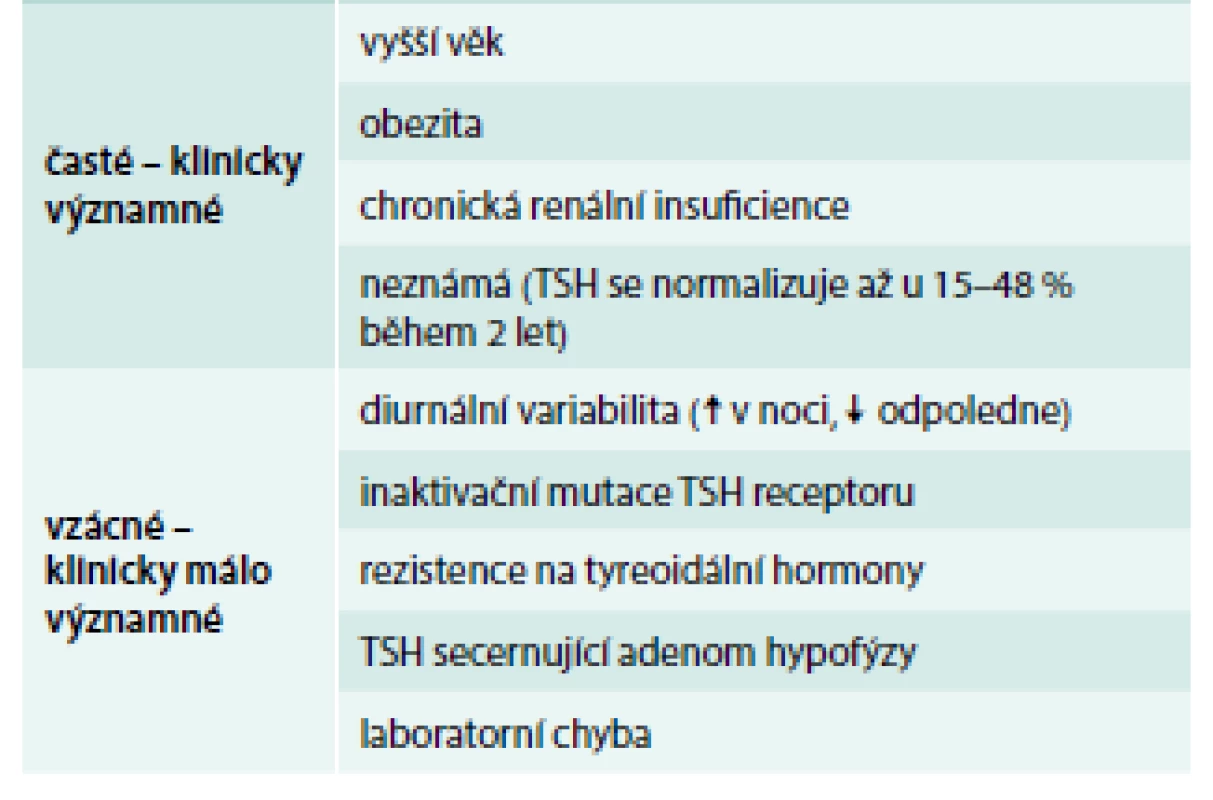
TSH – tyreoidální stimulační hormon Diagnóza subklinické hypotyreózy by měla být potvrzena nejméně 2 patologickými výsledky TSH v odstupu 3–6 měsíců a měly by se doplnit TPOAb v séru nebo ultrasonografické (USG) vyšetření štítné žlázy, aby byla dokumentovaná příčina. Normalizace TSH je totiž častá, zejména ve vyšším věku. Podle studie Somwaru et al z roku 2013 [20] došlo u osob ve věku > 65 let po 2 letech ke spontánní normalizaci TSH u 46 % osob se vstupní hodnotou TSH 4,5–6,9 mIU/l a 10 % osob se vstupní hodnotou TSH 7–9,9 mIU/l; a u 48 % osob se vstupně negativními TPOAb a 15 % osob se vstupně pozitivními TPOAb. Je třeba také mít na paměti, že většina velkých observačních studií ukázala, že hladina TSH v krvi stoupá s věkem [6,10]. Ve studii NHANES u pacientů nad 30–39 let stoupal 97,5 percentil normy pro TSH každých 10 let o 0,3 mIU/l, což nebylo ovlivněno hmotností, tyreoidálními protilátkami ani jodurií [5].
Nejen vyšetření celkového tyroxinu (TT4 – total thyroxine 4) v séru, ale i fT4 může ovlivněno řadou okolností (tab. 3). Proto se jako screeningový test doporučuje TSH a fT4 (eventuálně TT4) se doplňuje pouze, pokud je TSH mimo normu. Celkový či volný trijodtyronin (TT3 či fT3) se vyšetřuje jen v nejasných případech a v běžné praxi jsou tato vyšetření nadbytečná. Jednou z indikací je snížení TSH při normálním fT4 a klinickém podezření na hypertyreózu. Při „syndromu nízkého T3“ je fT3 snížený z důvodu porušené dejodace tyroxinu na trijodtyronin (T3) a preferenční syntézy tzv. reverzního T3, což obvykle provází závažné celkové nemoci (sepse, trauma, multiorgánové selhání, chronická malnutrice, chronické srdeční selhání apod). TSH je při tom obvykle snížený, může však být i normální či zvýšený, stejně jako fT4.
Table 3. Faktory, které mohou ovlivnit imunoanalytické stanovení volného tyroxinu v séru 
Platí, že diagnostika hypotyreózy je spolehlivější v ambulantním režimu. Důvodem je to, že TSH je velmi citlivý parametr, který je ovlivněn řadou přidružených akutních i chronických chorob. Uvádí se například, že až třetina hospitalizovaných pacientů má nespecificky suprimovaný (snížený) TSH z netyreoidálních příčin (tab. 4). Pokud je však důvodné klinické podezření na hypotyreózu, provádíme laboratorní testy samozřejmě i za hospitalizace.
Table 4. Příčiny netyreoidální suprese TSH 
Terapie hypotyreózy u pacienta se srdečním onemocněním
Podstatou léčby hypotyreózy je hormonální substituce levotyroxinem (LT4). Orientační denní dávka je 1,5 μg LT4 na 1 kg tělesné hmotnosti, závisí však na řadě faktorů. U mladých a jinak zdravých jedinců můžeme ihned podat téměř plnou dávku. U pacientů s ICHS nebo s chronickým srdečním selháním se doporučuje začít léčbu malou dávkou (12,5–25 μg denně), která se zvyšuje postupně (o 50–100 % po 4–6 týdnech). Podobně postupujeme i u starších jinak zdravých osob, i když důkazy pro tento postup chybějí a jsou práce, které ukázaly, že i ve vyšším věku je zahájení substituce plnou dávkou bezpečné [17]. Dávka LT4 se upravuje podle hodnoty TSH v séru – cílové hodnoty jsou rovny pásmu normy příslušné laboratorní metody (obvykle od 0,4–0,5 mIU/l do 4,0–5,0 mIU/l). Při léčbě pacienta se srdečním onemocněním se často raději spokojíme s hodnotami TSH v horní polovině normálního rozmezí (2–4 mIU/l), nebo i lehce nad ni, než abychom pacienta předávkovali. Subklinická hypertyreóza vzniklá předávkováním má totiž prokazatelně větší zdravotní rizika (kardiovaskulární, kostní, depresivní syndrom) než neléčená subklinická hypotyreóza [8,15]. U pacientů se srdečním onemocněním vedou neodůvodněně vysoké dávky LT4 spojené s poklesem TSH pod dolní mez normálního rozmezí (0,4–0,5 mIU/l) prokazatelně ke komplikacím (fibrilace síní, tachykardie, manifestace anginy pectoris, manifestace srdečního selhání, osteoporóza) a jsou spojeny se zvýšenou morbiditou a mortalitou (graf 3). Výjimkou je tzv. supresní léčba po odstranění štítné žlázy pro zhoubný nádor. Jejím cílem je zabránit potlačením produkce TSH růstu případné zbytkové tyreoidální tkáně nebo metastáz. I ta však musí být u pacientů se srdečním onemocněním indikována s rozvahou a s přihlédnutím k poměru rizika a benefitu. U pacientů s karcinomem štítné žlázy s nízkým rizikem se spokojíme se supresí TSH do dolního pásma normálních hodnot (0,5–1,0 mIU/l). Pouze u pacientů s karcinomem štítné žlázy s vysokým rizikem je suprese agresivnější s cílovým TSH pod dolní hranici normálních hodnot, vždy však v závislosti na toleranci pacienta. Po 5 letech se v závislosti na stupni rizika tyreoidálního karcinomu suprese uvolňuje a přechází se na substituční dávku.
Graph 3. Mortalita z kardiovaskulárních příčin v závislosti na TSH. 
TSH – tyreoidální stimulační hormon Upraveno podle [8] Manifestní hypotyreóza by měla být léčena vždy a o příznivém efektu léčby nemůže být pochyb. Indikace k léčbě subklinické hypotyreózy u pacientů se srdečním onemocněním však zůstávají nejasné a kontroverzní. Jak bylo uvedeno výše, léčba sice redukuje rizikové faktory aterosklerózy, zlepšuje srdeční funkci a možná zlepšuje tělesnou zdatnost nemocných, nemá však významný vliv na mortalitu ani morbiditu nemocných. Naopak, při předávkování levotyroxinem může být pacient léčbou i poškozen. U subklinické hypotyreózy u pacienta se srdečním onemocněním by se o léčbě mělo rozhodnout individuálně s přihlédnutím k věku, přidruženým chorobám, komplianci pacienta a laboratorním nálezům (tab. 5).
Table 5. Rámcové doporučení pro léčbu hypotyreózy u pacientů s onemocněním srdce 
TSH – tyreoidální stimulační hormon fT4 – volný tyroxin LT4 by se měl užívat nalačno alespoň 30 min před požitím potravy a jiných léků, jinak se snižuje resorpce. Tu snižují nejvíce preparáty železa, léky snižující žaludeční aciditu (omeprazol, antacida) a iontoměniče (pryskyřice při hypolipidemické léčbě). Resorpce se také snižuje u pacientů s chronickým městnavým srdečním selháním. K monitoraci léčby periferní hypotyreózy LT4 se používá výhradně TSH. Vyšetřování fT4 nebo dokonce TPOAb za tímto účelem je zbytečné a imunoanalytické vyšetření fT4 je navíc u polymorbidních pacientů užívajících řadu léků značně nespolehlivé. Než dojde ke stabilizaci stavu a optimalizaci dávky, kontroluje se TSH po 4–6 týdnech od poslední úpravy. Častější kontroly nemají velký význam, změna dávky se v hodnotě sérového TSH dříve neprojeví. U stabilizovaného pacienta stačí kontroly TSH a klinického stavu 1krát ročně.
Závěr
Hypotyreóza je u pacientů se srdečním onemocněním častým nálezem. Potvrzená manifestní hypotyreóza je vždy důvodem k substituční léčbě levotyroxinem, u pacientů se srdečním onemocněním vždy začínáme léčbu malou dávku a zvyšujeme postupně. Často se raději spokojíme s cílovými hodnotami TSH v horním pásmu normálního rozmezí, nebo i lehce nad ni, než abychom pacienta předávkovali. Benefit z léčby subklinické hypotyreózy by měl být u pacientů se srdečním onemocněním zvážen vždy individuálně.
doc. MUDr. Jan Jiskra, Ph.D.
jan.jiskra@vfn.cz
III. interní klinika 1. LF UK a
VFN v Praze
www.vfn.cz
Doručeno do redakce 27. 6. 2017
Přijato po recenzi 4. 9. 2017
Sources
1. Biondi B, Galderisi M, Pagano L et al. Endothelial-mediated coronary flow reserve in patients with mild thyroid hormone deficiency. Eur J Endocrinol 2009; 161(2): 323–329. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-09–0196>.
2. Abreu IM, Lau E, de Sousa Pinto B et al. Subclinical hypothyroidism: to treat or not to treat, that is the question! A systematic review with meta-analysis on lipid profile. Endocr Connect 2017; 6(3): 188–199. Dostupné z DOI: <http://dx.doi.org/10.1530/EC-17–0028>.
3. Andersen MN, Olsen AM, Madsen JC et al. Levothyroxine Substitution in Patients with Subclinical Hypothyroidism and the Risk of Myocardial Infarction and Mortality. PLoS One 2015; 10(6): e0129793. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0129793>.
4. Andersen MN, Olsen AS, Madsen JC et al. Long-Term Outcome in Levothyroxine Treated Patients With Subclinical Hypothyroidism and Concomitant Heart Disease. J Clin Endocrinol Metab 2016; 101(11): 4170–4177.
5. Boucai L, Hollowell JG, Surks MI. An approach for development of age-, gender-, and ethnicity-specific thyrotropin reference limits. Thyroid 2011; 21(1): 5–11. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2010.0092>.
6. Bremner AP, Feddema P, Leedman PJ et al. Age-related changes in thyroid function: a longitudinal study of a community-based cohort. J Clin Endocrinol Metab 2012; 97(5): 1554–1562. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2011–3020>.
7. Curotto Grasiosi J, Peressotti B, Machado RA et al. Improvement in functional capacity after levothyroxine treatment in patients with chronic heart failure and subclinical hypothyroidism. Endocrinol Nutr 2013; 60(8): 427–432. Dostupné z DOI: <http://dx.doi.org/10.1016/j.endonu.2013.01.013>.
8. Franklyn JA. The thyroid – too much and too little across the ages. The consequences of subclinical thyroid dysfunction. Clin Endocrinol (Oxf) 2013; 78(1): 1–8. Dostupné z DOI: <http://dx.doi.org/10.1111/cen.12011>.
9. Garber JR, Cobin RH, Gharib H et al. [American Association Of Clinical Endocrinologists And American Thyroid Association Taskforce On Hypothyroidism In Adults]. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Thyroid 2012; 22(12): 1200–1235. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2012.0205>. Erratum in Thyroid 2013; 23(2): 251. Thyroid 2013; 23(1): 129.
10. Hollowell JG, Staehling NW et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab 2002; 87(2): 489–499.
11. Iqbal A, Jorde R, Figenschau Y. Serum lipid levels in relation to serum thyroidstimulating hormone and the effect of thyroxine treatment on serum lipid levels in subjects with subclinical hypothyroidism: the tromso Study. J Intern Med 2006; 260(1): 53–61.
12. Mariotti S. Mild hypothyroidism and ischemic heart disease: Is age the answer? J Clin Endocrinol Metab 2008; 93(8): 2969–2971. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2008–1237>.
13. Monzani F, Di Bello V, Caraccio N et al. Effect of levothyroxine on cardiac function and structure in subclinical hypothyroidism: a double blind, placebo-controlled study. J Clin Endocrinol Metab 2001; 86(3): 1110–1115.
14. Nyirenda MJ, Clark DN, Finlayson AR et al. Thyroid disease and increased cardiovascular risk. Thyroid 2005; 15(7): 718–724.
15. Ochs N, Auer R, Bauer DC et al. Meta-analysis: subclinical thyroid dysfunction and the risk for coronary heart disease and mortality. Ann Intern Med 2008; 148(11): 832–845.
16. Razvi S, Ingoe L, Keeka G et al. The beneficial effect of lthyroxine on cardiovascular risk factors, endothelial function and quality of life in subclinical hypothyroidism: randomised, crossover trial. J Clin Endocrinol Metab 2007; 92(5): 1715–1723.
17. Roos A, Linn-Rasker SP, van Domburg R et al. The starting dose of levothyroxine in primary hypothyroidism treatment: a prospective, randomized, bouble-blind trial. Arch Intern Med 2005; 165(15): 1714–1720.
18. Shakoor SK, Aldibbiat A, Ingoe LE et al. Endothelial progenitor cells in subclinical hypothyroidism: the effect of thyroid hormone replacement therapy. J Clin Endocrinol Metab 2010; 95(1): 319–322. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2009–1421>.
19. Singer RB. Mortality in a complete 4year follow up of 85yearold residents of leiden, classified by serum level of thyrotropin and thyroxine. J Insur Med 2006; 38(1): 14–19.
20. Somwaru LL, Rariy CM, Arnold AM et al. The natural history of subclinical hypothyroidism in the elderly: the cardiovascular health study. J Clin Endocrinol Metab 2012; 97(6): 1962–1969. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2011–3047>.
21. Turhan S, Tulunay C, Ozduman Cin M et al. Effects of thyroxine therapy on right ventricular systolic and diastolic function in patients with subclinical hypothyroidism: a study by pulsed wave tissue Doppler imaging. J Clin Endocrinol Metab 2006; 91(9): 3490–3493.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 9-
All articles in this issue
- Onemocnění štítné žlázy v České republice: projekt EUthyroid a vyhodnocení epidemiologických dat VZP za období let 2012–2015
- Skríning tyreopatií v gravidite – odborné usmernenie v praxi
- Chlopenní vady při léčbě hyperprolaktinemie dopaminovými agonisty
- Hypotyreóza u pacientů se srdečním onemocněním
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Diagnostika a manažment metastatického feochromocytómu a paragangliómu
- Kvalita kosti u akromegalikov
- Syndróm neprimeranej antidiurézy (SIAD) a súčasný manažment hyponatriémie
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Primární hyperparatyreóza – nové klinické formy onemocnění
- Efekt antidiabetickej liečby na kosť
- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Primární hyperparatyreóza – nové klinické formy onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career