-
Medical journals
- Career
Diferenciální diagnostika pleurálních výpotků
Authors: Miloslav Marel; Libor Fila; Michaela Červená
Authors‘ workplace: Pneumologická klinika 2. LF UK a FN v Motole, Praha
Published in: Vnitř Lék 2016; 62(7-8): 598-604
Category: Reviews
Overview
Problematika pleurálních výpotků zasahuje do mnoha oblastí medicíny. Ročně postihne asi 0,5 % populace. V článku jsou sumarizovány patofyziologické podklady vzniku výpotků, jejich epidemiologie, popis jednotlivých typů výpotků a možnosti léčby. Větší pozornost je věnována diferenciální diagnostice a léčbě maligních pleurálních výpotků.
Klíčová slova:
diagnostika – exsudát – léčba – pleura – transsudátÚvod
S pleurálními výpotky se setkávají lékaři mnohých odborností. Vedle pneumologů jsou to často internisté (kardiologové, nefrologové, gastroenterologové) a lékaři dalších specializací – chirurgové, gynekologové, radiologové, onkologové aj. Výpotkem v pohrudniční dutině se mohou komplikovat jak nemoci orgánů hrudních, tak i nemoci celkové.
Patofyziologické poznámky
Pasáž tekutiny přes pleurální štěrbinu je závislá na rovnováze hydrostatického a onkotického tlaku tekutiny v kapilárách obou listů pohrudnice a v pleurální dutině (transsudáty) a dále na permeabilitě cévního řečiště (záněty, nádory – exsudáty). Fluidotorax se tvoří, je-li resorpční kapacita pleury překročena (max. 700 ml/den), patologicky snížena (tumorózní postižení lymfatik) nebo patologický proces resorpci nedovoluje (koagulovaný hemotorax).
Při transsudátech jsou porušeny systémové faktory, je zvýšený hydrostatický tlak (srdeční selhání), snížený onkotický tlak (hypalbuminemie), vyšší negativní intrapleurální tlak (atelektáza), transdiafragmatický přesun tekutiny (ascites) nebo patologická komunikace (urinotorax).
Exsudáty vznikají při poruše pleury samotné. Přispívá k tomu zvýšená permeabilita cév (pneumonie), porušená kontinuita lymfatických cév (chylotorax), snížená lymfatická drenáž (nádor), patologická komunikace (pseudocysta pankreatu).
I u zdravých osob je v pleurální dutině přítomno asi 10–20 ml tekutiny potřebné k lubrikaci povrchů pleurálních listů. Obsahuje asi 4 500 leukocytů na µl, z nich je 53,6 % monocytů, 10,2 % lymfocytů, 3 % mezoteliálních buněk, 3,6 % granulocytů a 29,5 % blíže neurčených poškozených buněk [1].
Tekutina proudí do pleurální štěrbiny z parietální pleury a vstřebává se do viscerální pleury, dále je odstraňována přes lymfatická stomata v dolní části parietální pleury a rovněž je odstraňována tzv. celulárním mechanizmem pomocí mezoteliálních buněk.
Epidemiologie
Podle odhadů prof. R. W. Lighta pro USA má fluidotorax během roku asi 0,5 % populace [2]. Z výsledků epidemiologické studie na neselektovaném souboru nemocných v jednom okrese ve Středočeském kraji vyplynulo, že pleurální výpotek byl prokázán během jednoho roku u 0,32 % populace. Při přepočtu na 10 000 000 obyvatel České republiky lze odhadovat, že výpotek během 1 roku vznikne u 32 000 obyvatel ČR. Nejčastěji se jednalo o kardiální transsudát (46 %), na 2. místě byl v terénu výpotek maligní (22 %), dále výpotek při nespecifických zánětlivých onemocněních (17 %) a na 4. místě, stejně jako v odhadech prof. Lighta pro USA, byl výpotek při plicní embolizaci [3].
O frekvenci jednotlivých typů výpotků na klinických pracovištích u nás informují např. výsledky 4leté prospektivní klinické studie provedené na Pneumologické klinice 1. LF UK Praha-Veleslavín v letech 1986–1990, retrospektivní studie z let 1998–2001 na oddělení TRN FN v Motole (Praha) a z nedávno ukončené (2015) observační studie na Pneumologické klinice 2. LF UK a FN v Motole (Praha). V prvé klinické studii jsme nejčastěji diagnostikovali výpotek nádorový (63 %), dále pak výpotky parapneumonické včetně hrudních empyémů (18 %), výpotky tuberkulózní (6 %) a kardiální transsudáty (3,5 %) [4].
V první motolské studii z let 1998–2001 jsme posuzovali typy výpotků u 320 nemocných. Nejčastější diagnózou bylo nádorové onemocnění u 170 pacientů (53 %). 90 z nich mělo plicní karcinom. Ostatní nádory mělo 80 nemocných, nejčastějším byl karcinom prsu u (28 pacientů). Výpotek u těchto nemocných byl maligní u 104 osob, paramaligní u 66.
Pleurální výpotek doprovázel nenádorové onemocnění u 150 nemocných (47 %). Nejčastěji se jednalo o pleuropneumonii u 45 osob (14 %), v souvislosti s ICHS mělo fluidotorax 30 osob, diagnózu hrudního empyému jsme stanovili u 21 nemocných. Traumatický původ jsme určili jako hlavní příčinu u 10 nemocných, 7 mělo tuberkulózní pleuritidu, 17 výpotků souviselo s dalšími nemocemi (embolie, cirhóza jater, podbrániční proces aj). U 20 nemocných, což bylo 6,2 % celého souboru, jsme nebyli schopni přesnou příčinu výpotku určit.
Ve skupině nenádorových onemocnění obvykle odpovídal výpotek typu základního onemocnění, tedy nejčastějšími byly parapneumonické výpotky (45), kardiální transsudáty (30) a empyém (21) [5].
Celkem byl na oddělení TRN FN v Motole v letech 1998–2001 průběh nemoci komplikován výpotkem u 8,4 % všech nemocných přijatých k hospitalizaci, oproti 5,1 % v letech 1986–1990 na obdobném typu pracoviště.
Nejrecentnější údaje o současném výskytu typů výpotků na Pneumologické klinice 2. LF UK a FN v Motole máme z klinické observační studie z Pneumologické kliniky 2. LF UK a FN v Motole, kde bylo během roku 2014 a 2015 vyšetřováno 261 nemocných s pleurálním výpotkem (dosud nepublikováno).
168 případů (64 %) vzniklo v souvislosti s maligním onemocnění. 71krát se jednalo o bronchogenní karcinom, 2krát o mezoteliom a 95krát o jinou malignitu (tab. 1). Druhým nejčastěji diagnostikovaným typem byl parapneumonický výpotek (včetně 5 empyémů) u 46 (18 %) nemocných. Kardiální původ byl prokázán u 24 (9 %) nemocných, 5krát byl výpotek posttraumatický, 3krát se jednalo o tuberkulózní exsudát, ostatních typů bylo 7, typ výpotku jsme neurčili u 8 nemocných, to je u 3 %.
Table 1. Příčiny fluidotoraxu na Pneumologické klinice 2. LF UK a FN v Motole v letech 2014 a 2015 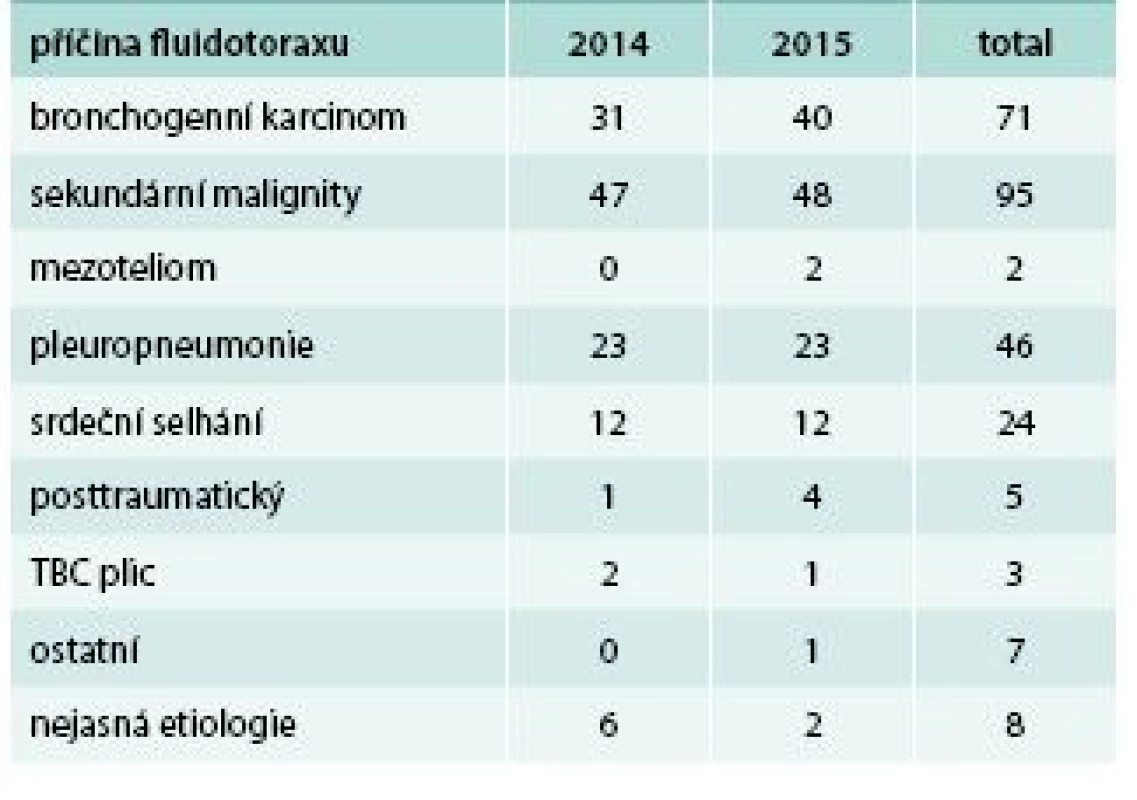
Je zřejmé, že v posledních 15 letech na pneumologických pracovištích přibývá nádorových výpotků a výpotků parapneumonických.
Pokud srovnáme tyto nedávné údaje s výsledky studie provedené Touškem na Interním oddělení v Novém Bydžově v letech 1956–1960, vidíme zásadní změnu. Oproti dřívějšímu nejčastějšímu zastoupení tuberkulózních výpotků, které v Touškově souboru byly zastoupeny v 36,5 %, v současnosti převažují na klinických pracovištích výpotky nádorové a výpotky při nespecifických zánětech [6].
Diagnostika
Při diagnostice nemocných s pleurálním výpotkem nejasné etiologie využíváme tradičních i novějších postupů. Pro zlepšení komunikace mezi lékaři různých specializací je třeba znát charakteristiky (definice) nejčastějších typů výpotků.
Maligní je výpotek, který provází maligní onemocnění a jsou v něm prokázány maligní buňky, nebo je maligní tkáň nalezena v biopsii parietální pleury, ev. je malignita na pleuře prokázána při torakoskopii či pitvě.
Paramaligní výpotek doprovází maligní nitrohrudní onemocnění, avšak cytologicky ani histologicky není ani při opakovaném vyšetření prokázána maligní tkáň, pleurální dutina není přímo postižena nádorem. K nahromadění tekutiny vedou různé patofyziologické mechanizmy, nejčastěji obstrukce lymfatik nádorem nebo průvodní poststenotická pneumonie.
Parapneumonický výpotek je exsudát provázející pneumonii, plicní absces či bronchiektazie. V jeho obraze dominují leukocyty, je pro něj typická nízká hladina glukózy, vysoká laktátdehydrogenáza (LDH). Pokud se počíná měnit v empyém, klesá jeho pH. Hodnoty pod 7,2 by měly vždy vést k úvaze o vhodnosti drenáže.
Hrudní empyém je nahromadění hnisu v pleurální dutině. V cytologickém obraze dominují částečně nebo zcela rozpadlé leukocyty. Je v něm velmi nízká glukóza, vysoké LDH a pH pod 7,0.
Tuberkulózní výpotek (definitivní diagnóza) by měl splňovat alespoň jedno z následujících kritérií:
- pozitivní kultivace bacillus Kochi (BK) z pleurální tekutiny nebo z biopsie parietální pleury
- prokázání specifického granulomu v biopsii pleury
- pozitivní vyšetření sputa na BK při současném exsudátu
Tuberkulózní výpotek (pravděpodobná diagnóza) lze určit po vyloučení jiných příčin u nemocných, kteří nesplnili výše uvedené podmínky, pokud je ve výpotku dominujícím buněčným elementem lymfocyt (nejčastěji se jedná o Th1 lymfocty, poměr CD4/CD8 je 4,3), obsahuje méně než 10 % eozinofilů a méně než 5 % mezotelií, Mantoux je pozitivní, ve výpotku charakteristicky chybí eozinofily a mezotelie, ev. je vysoká hodnota adenozindeaminázy, může být pozitivní PCR a byly vyloučeny jiné příčiny.
Kardiální hydrotorax je transsudát (CAVE! – po intenzivní diuretické terapii se může změnit na exsudát) u nemocného se známkami srdečního, nejčastěji levostranného selhávání (dilatované srdce, srdeční gallop). Byl prokázán pomocí ultrasonografie až u 1/2 nemocných přijatých na JIP pro kardiální selhání [7]. Cytologicky prokazujeme lymfocyty a mezotelie, buněk je méně než 1 000/mm3. Po nasazené diuretické terapii dochází ke zmenšování hydrotoraxu, jeho změně na exsudát a zlepšení stavu kardiální kompensace.
Hemotorax je hemoragický výpotek ev. krev v pleurální dutině. Hematokrit ve výpotku je vyšší než 50 % hematokritu v krvi, může se jednat buď o traumatický hemotorax ev. netraumatický hemotorax (nádory, plicní embolie). Hemotorax může být iatrogenní, při hemoragické diatéze či při hrudní endometrióze.
Pankreatický výpotek provází akutní i chronické onemocnění slinivky břišní. Prokazujeme v něm vysokou hladinu pankreatické amylázy a pestrý cytologický obraz. Výpotek může obsahovat vyšší hladinu amylázy (salivární izoenzym) i u nemocných s rupturou jícnu a asi u 10 % nemocných s plicní rakovinou.
Paraembolický výpotek diagnostikujeme, pokud jsou na ventilačně-perfúzním scanu známky pravděpodobné plicní embolizace, nebo je plicní embolie prokázána jinak (dnes častěji angio-CT). Výpotek má charakter exsudátu, typicky nepřesahuje 1/3 hemitoraxu a v 75 % je provázen pleurální bolestí. V cytologickém obraze se často nacházejí eozinofily. Je potřebné aktivně vyloučit jiné příčiny pleurálního výpotku.
Benigní azbestový výpotek je diagnostikován rovněž po vyloučení jiných příčin u nemocných s expozicí azbestu a po dlouhodobém sledování (2 roky).
Revmatoidní výpotek se vyskytuje asi u 5 % nemocných s revmatoidní artritidou, častěji u mužů. Je pro něj charakteristická nízká hladina glukózy, nízké pH, snížení frakcí C3, C4 komplementu, vysoká LDH a negativní mikrobiologické vyšetření.
Chylotorax je přítomnost chylu v pleurální dutině. Typické mléčné zabarvení zůstává i po centrifugaci (na rozdíl od empyému, který se po centrifugaci vyčeří). Při biochemickém vyšetření prokazujeme vysokou hladinu triglyceridů na rozdíl od pseudochylotoraxu, ve kterém jsou vysoké hladiny cholesterolu nebo lecitin-globulinových komplexů. Nejčastěji je v současnosti chylotorax asociován s lymfomy.
Z dalších možných typů výpotků uvedeme pouze názvy, neboť jejich frekvence je nízká, nicméně je třeba na tyto možné příčiny výpotků myslet. Jedná se o transsudáty při uremii, myxedému, cirhóze, glomerulonefritidě a syndromu horní duté žíly. Exsudátem mohou být provázena mnohá onemocnění gastrointestinálního traktu (subfrenický absces aj), systémové onemocnění (lupus erythematodes, Churgův-Straussův syndrom aj). Výpotek se může objevit v závislosti na užívání léků (nitrofurantoin, amiodaron, praktolol, metotrexát, rekombinantní lidský interferon α, granulocyte colony stimulating growth factor – G-CSF, prokarbazin, mitomycin, simvastatin aj), dále může doprovázet benigní nádory ovarií (Meigsův syndrom), sarkoidózu a ozařování. Stále častěji se setkáváme s výpotkem u osob po operaci srdce (by-pass), tzv. postcardiac injury syndrom.
Vyšetřování
Při vyšetřování nemocných s pleurálním výpotkem věnujeme samozřejmě velkou pozornost anamnéze. Vedle údajů o dušnosti a kašli, které obvykle v klinickém obraze dominují, vždy posuzujeme nemocného jako celek (kouření, váhový úbytek, bolesti na hrudi, flebitidy, gastrointestinální obtíže aj). Při fyzikálním vyšetření se vedle poslechu a poklepu opakovaně dobře osvědčuje fremitus pectoralis, který je nad výpotkem vymizelý. Po obdržení skiagramu hrudníku ve dvou projekcích lékař již zpravidla ví, že před ním stojí nemocný s pleurálním výpotkem. Na skiagramu hrudníku je poznatelných 200 ml výpotku, otupení zadního kostofrenického úhlu způsobí 50 ml výpotku (obr. 1). Mnohdy jsou příznaky pleurálního výpotku minimální, podle literárních údajů je až 25 % nemocných s výpotkem asymptomatických. V rozpoznání i malých výpotků a k určení optimálního místa k provedení hrudní punkce napomůže sonografické vyšetření hrudníku. K bližšímu posouzení situace uvnitř plíce (skrytý tumor) a v celém hrudníku (lokulovaný empyém) se stále častěji využívá CT ev. PET/CT (výpočetní tomografie/pozitronová emisní tomografie).
Image 1. Skiagram hrudníku s typickým nálezem pleurálního výpotku vlevo 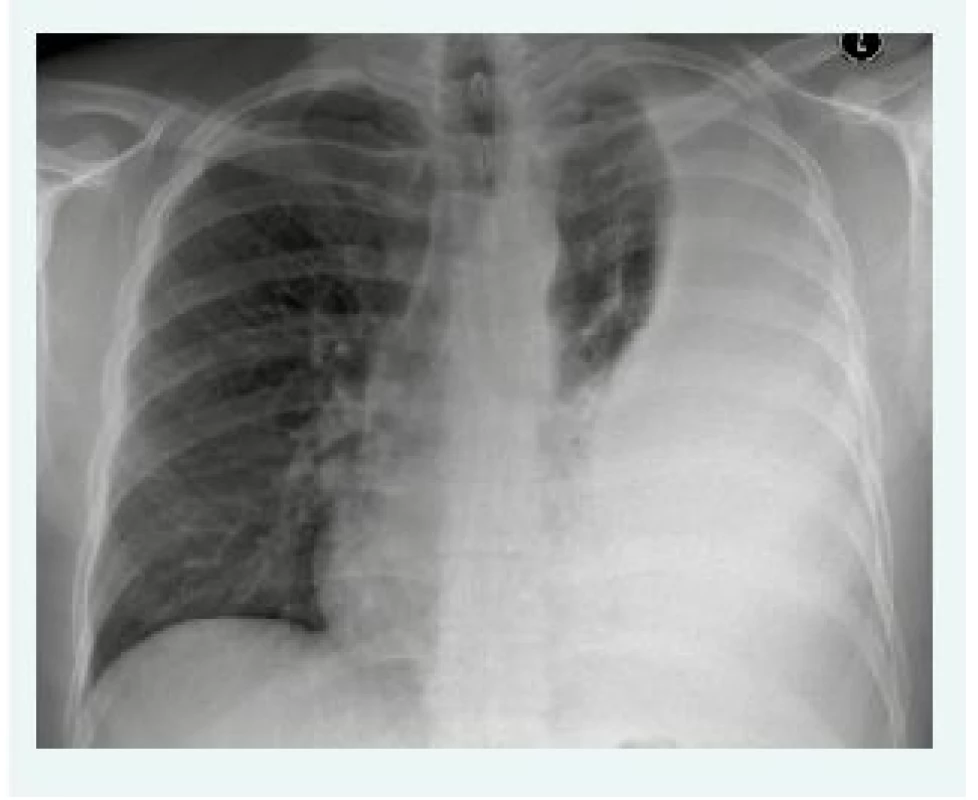
Dalším úkolem je rozhodnutí, zda se jedná o exsudát či transsudát. Již více než 40 let jsou ve světě známa a přijata tzv. Lightova kritéria (1972) rozlišující transsudát od exsudátu pomocí LDH a celkové bílkoviny současně stanovené ve výpotku a v séru. I v současnosti jsou tato kritéria hodnocena pozitivně a jsou považována za zlatý standard rozlišování mezi exsudátem a transsudátem [8]. Pokud je splněno alespoň jedno z níže uvedených kritérií, jedná se o exsudát:
- celková bílkovina ve výpotku dělená hodnotou v séru více než 0,5
- laktátdehydrogenáza ve výpotku dělená hodnotou v séru více než 0,6
- laktádehydrogenáza ve výpotku je vyšší než 2/3 horní hranice normy v séru
Lightova kritéria mají senzitivitu 98 % a specificitu 74 % v rozpoznání exsudátu. Sám autor těchto kritérií připouští, že jeho kritéria jsou „tvrdá“ pro transsudáty, a proto doporučuje ve sporných případech posuzovat i další kritéria, tzv. „gradienty“: pokud je celková bílkovina v séru minus celková bílkovina ve výpotku více než 31 g/l, pak tento nález svědčí pro transsudát. Podobně je typické pro transsudát, že albumin v séru minus albumin ve výpotku je více než 12 g/l [7].
V případě, že se jedná o transsudát, klinik pomýšlí především na levostranné kardiální selhání, cirhózu jater nebo onemocnění ledvin. Pokud se jedná o exsudát, dalším krokem vyšetřovacího algoritmu (schéma) je posouzení vzhledu výpotku a biochemické vyšetření. Vedle LDH a celkové bílkoviny stanovujeme ve výpotku amylázu (zvýšená u pankreatických výpotků), glukózu (nízká u revmatoidního výpotku a v empyému) ev. pH [9] a opakovaně vyšetřujeme cytologii výpotku. Ve výpotku lze rovněž vyšetřovat nádorové markery. Další vyšetření jsou indikována individuálně podle potřeb diferenciální diagnostiky, tedy bronchologické, radiologické (CT, angio-CT), bakteriologické a mykobakteriologické (pokud možno alespoň 100 ml výpotku odesíláme na vyšetření Mycobacterium tuberculosis), hematologické ev. imunologické či lipidologické [10]. Při podezření na tuberkulózní pleuritidu se doporučuje vyšetřit ve výpotku adenozindeaminázu (ADA), která je v případě TBC zvýšená (zvýšená je rovněž u empyému a revmatoidního výpotku).
Schéma. Algoritmus vyšetření nemocných s pleurálním výpotkem 
Nověji se zkouší vyšetřovat N-terminal pro-brain natriuretic peptid (NT-proBNP), jehož hladina v pleurálním výpotku koreluje s hladinou v séru s cílem odlišit kardiální transsudát od exsudátů. Hraniční hodnota odlišující tyto 2 typy fluidotoraxů v dosavadních studiích dosti kolísala, avšak nejčastěji byla určena na 1 500 pg/ml. NT-proBNP se nejvíce osvědčil v případě, v němž klinické vyšetření svědčilo pro transsudát, avšak Lightova kritéria svědčila pro exsudát [10].
Ve studii s 405 nemocnými s výpotkem [11], ze kterých bylo 91 tuberkulózních, byla pro ADA prokázána senzitivita 100 % a specificita 95 % s použitím hraniční hodnoty 47 IU/l. Počet falešně pozitivních nálezů byl 16 (3,5 %). Z nich bylo maligních výpotků 10, parapneumonický 1krát a 5krát empyém. Podobně by mohla k této diagnóze přispět i zvýšená hodnota interferonu γ [12] a polymerázová řetězová reakce (PCR) ve výpotku. Posledně jmenovaná metoda byla zkoušena v několika studiích s rozdílnými výsledky. Specificita kolísala od 78 % do 100 % a senzitivita od 61 % do 94 %, autoři ale soudí, že ji nelze doporučit pro rutinní klinickou praxi [13].
Výjimečné postavení mezi vyšetřovacími metodami výpotků zaujímá cytologie. Tradičně se u nás používá dělení do tzv. cytologických obrazů výpotků. Podle Touška lze vyčlenit obraz lymfocytární, asociovaný s tuberkulózou, lymfocytárně–mezoteliální spojovaný s kardiálním hydrotoraxem ev. s nádorovými výpotky, polynukleární svědčící nejčastěji pro nespecifický zánět, mezoteliální obraz nalézaný nejvíce u nádorových výpotků, a eozinofilní (více než 10 % buněk jsou eozinofily), který může souviset s alergií, pneumotorax, erytrocyty v pleurální dutině či embolizací a cytologický obraz pestrý. Ve světové literatuře není tento způsob popisu cytologických nálezů obvyklý, spíše se procentuálně vyjadřuje zastoupení jednotlivých buněčných elementů ev. zastoupení jejich subpopulací. V hodnocení cytologických známek malignity se stále užívá dělení podle Pappanicolaua od I do V, přičemž za pozitivní pro malignitu lze považovat Pap IV a V. Tradice, jednoduchost a rychlost tohoto způsobu vyšetření přispěla k velmi dobré úrovni dosažených výsledků. Cytologická verifikace maligních výpotků kolísá mezi 40–90 %, nejčastěji 60 %.
V posledních letech se v diagnostice nádorových buněk uplatňují i monoklonální protilátky proti epiteliálním membránovým antigenům (EMA) přítomným v epiteliálních nádorech, protilátky proti membránovému glykoproteidu MOC-31, které pomohou odlišit adenokarcinom od reaktivních mezotelií ve výpotku, protilátky proti karcinoembryonálnímu antigenu (CEA) jsou pozitivní u žlázových karcinomů a negativní u mezoteliomu aj. U posledně jmenovaného typu se i v praxi osvědčilo vyšetřování mezotelinu (glykoproteinový nádorový marker) – viz níže.
Na některých pracovištích se dosud provádějí jehlové biopsie parietální pleury. Jejich výtěžnost v případě maligních pleurálních výpotků kolísá od 39 do 75 %, v diagnostice tuberkulózní pleuritidy je biopsie úspěšná v 50–80 %. Nejčastěji se ve světě užívá jehla Abramsova, Copeho a jehla RAJA. V posledních letech, pravděpodobně v souvislosti s lepší dostupností videotorakoskopie, se biopsií parietální pleury provádí stále méně.
O významu bronchoskopického vyšetření pro diferenciální diagnostiku existují rozporné údaje. V minulosti byly publikovány závěry, že pokud na skiagramu hrudníku nejsou kromě obrazu výpotku jiné patologické nálezy, není nutné bronchoskopii indikovat. Soudíme, že vzhledem k četnosti nádorových výpotků, jak na lůžkových zařízeních (klinika 64 %), tak i v terénu (22 %), je bronchoskopie indikována vždy, pokud není typ výpotku zcela jednoznačně určen.
Pokud zůstává příčina výpotku nejasná i po výše uvedených vyšetřeních, nebo je třeba většího vzorku k histologickému vyšetření (mezoteliom), pak stále častěji indikujeme torakoskopii.
I po zevrubném vyšetření nemocných s fluidotoraxem se daří určit příčinu jen asi v 85–95 %. U zbylých 5–15 % nemocných nezbývá než postupovat k více invazivním způsobům vyšetřování ev. podle celkového posouzení nemocné sledovat a symptomaticky léčit.
Maligní pleurální výpotek
Maligní pleurální výpotek představuje v současnosti největší klinický problém. Nejčastěji doprovází rakovinu plic, prsu, lymfomy a rakovinu ovarií. Je i typickým projevem primárního maligního nádoru pleury – mezoteliomu. Maligní pleurální výpotek doprovází plicní rakovinu v době diagnózy asi v 10–15 %, během celého průběhu nemoci se objeví asi u 50 % nemocných. Obdobný údaj pro nemocné s rakovinou prsu je 46–48 %. Častější výskyt výpotku se popisuje při lymfangiitickém šíření, od diagnózy rakoviny prsu do vzniku výpotku uplynou nejčastěji 2 roky. Lymfomy, včetně Hodgkinovy nemoci, jsou komplikovány výpotkem asi v 16 %, vždy jsou postiženy mediastinální uzliny, asi ve 2/3 se jedná o chylotorax. Ne vždy, když je pleurální prostor postižen nádorem, musí být přítomen i výpotek. Ve studii provedené na 191 zemřelých s malignitou, u nichž byla provedena pitva, bylo prokázáno postižení pleury maligním procesem u 55, přičemž výpotek byl nalezen jen u poloviny z nich [14].
Patofyziologicky se jedná buď o přímé či nepřímé postižení pleurálního prostoru. Podle prof. Sahna (1987) lze pro nepřímé postižení používat výše popsaný termín paramaligních výpotků. V tom případě k nahromadění výpotku vede zvýšení permeability pohrudničního povrchu se zvýšeným únikem proteinů. Zdá se, že významnějším faktorem je snížená clearence proteinů z pleurálního prostoru, která je v případě maligních nemocí významně nižší než u výpotků tuberkulózních či kardiálních. Dochází ke snížení lymfatické drenáže obstrukcí stomat v parietální pleuře ev. obstrukcí lymfatických cév při nádorovém postižení mediastinálních uzlin. K nahromadění tekutiny může dojít i při obstrukci a ruptuře ductus thoracicus mající za následek chylotorax. Jiným mechanizmem vzniká výpotek při porušení hydrostatických poměrů (větší negativní tlak) v pleurální dutině při vzniku atelektázy po obturaci bronchu nádorem ev. při současné malnutrici a hypoproteinemii, která může způsobovat vznik transsudátu. Přímé postižení obvykle začíná jako nádorové mikroemboly ve viscerální pleuře s následným postižením pleury parietální.
Klinická manifestace maligních pleurálních výpotků (obvykle masivní se zastřením více než 50 % hemitoraxu) je ovlivněna jednak nádorem samotným a jednak obvykle masivní pohrudniční expanzí výpotku. Hlavním příznakem je dušnost, kterou udává více než 50 % nemocných, dále se vyskytuje nevýrazná tupá bolest, kterou má na hrudníku pouze 25 % pacientů. Často mají nemocní kašel, který zvětšuje riziko pneumotoraxu během hrudní punkce. Lze proto doporučit ukončení torakocentézy, pokud u nemocného vznikne nezvladatelný kašel. Další příznaky jsou spojené s malignitou – hubnutí, únava, nechutenství.
Na skiagramu hrudníku a ještě lépe na CT lze pozorovat jak známky typické pro výpotek, tak mnohdy výpotkem skrytý nádor (obr. 2). Je nutné věnovat pozornost jak změnám na pleuře, na níž můžeme někdy pozorovat nádorové masy, tak i změnám v mediastinu, v němž může být patrné zvětšení uzlin ev. rozšíření srdečního stínu (perikardiální výpotek). Výpotek je často masivní a zastínění je patrné v celém rozsahu hemitoraxu. K přesnému zhodnocení šíře výpotku a určení místa punkce lze doporučit ultrasonografické vyšetření.
Image 2. CT snímek pravého hemitoraxu s výpotkem a plicním karcinomem 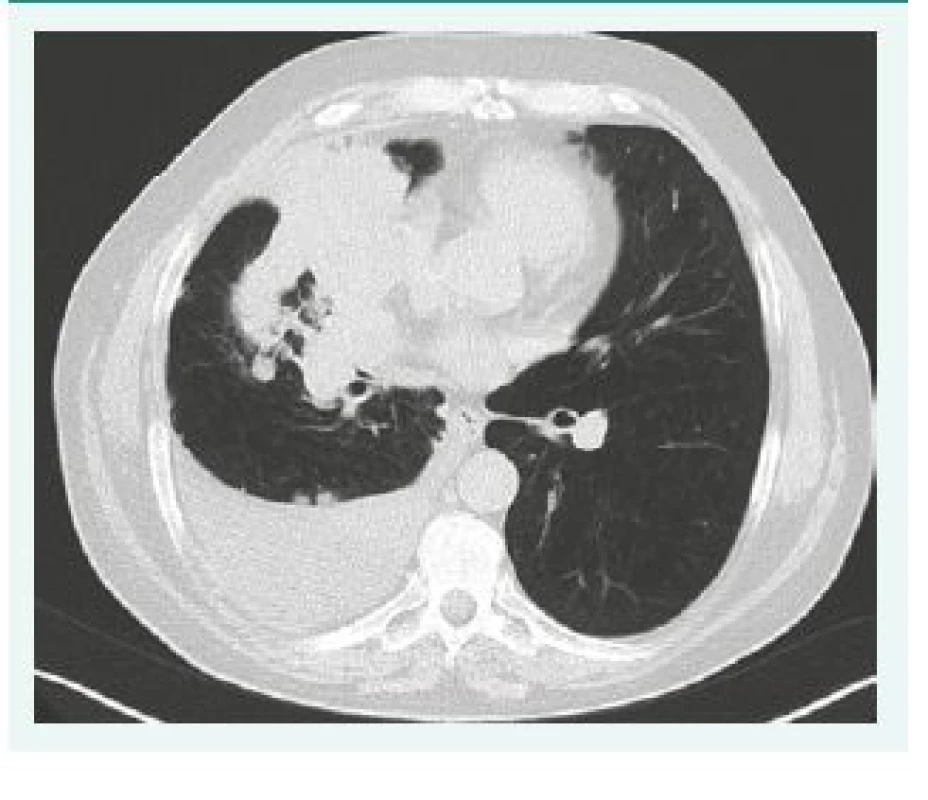
Výpotek má obvykle charakter exsudátu, kritéria jsou vždy splněna pro LDH, někdy nemusí být splněn požadavek poměru bílkovin ve výpotku k bílkovinám v séru. Nejčastěji se jedná o hemoragický výpotek s počtem erytrocytů nad 100 000/mm3. V některých studiích bylo zjištěno, že 55 % hemoragických výpotků je maligních. Počet bílých krvinek kolísá, nejčastěji jsou přítomny lymfocyty ev. mononukleáry, charakteristická je absence eozinofilů. Je nižší hladina glukózy, pod 60 mg/dl, což je zdůvodňováno masivním postižením pleury maligním bujením. Spolu s nižším pH je považována nízká glukóza za nepříznivý prognostický faktor nemocných s maligním pleurálním výpotkem. Asi 10 % těchto nemocných má ve výpotku vyšší amylázu.
Diagnóza je stanovena buď na základě cytologického průkazu maligních buněk (Pappanicolau IV a V), nebo po histologickém průkazu maligní tkáně získané buď slepou biopsií pleury, biopsií pleury pod CT kontrolou, torakoskopií či při otevřené biopsii. Pozitivita cytologického vyšetření stoupá s množstvím vyšetřené tekutiny i s počtem odběrů. Při diferenciálně diagnostických pochybnostech je na místě indikovat torakoskopii, kterou většina autorů považuje za suverénní diagnostickou a v mnohých případech i léčebnou metodu.
Z dalších metod průkazu maligních elementů se zkouší imunohistochemický průkaz maligních elementů monoklonálními protilátkami, jako např. anti CEA, anti HMFG2 (human milk fat globuli) aj. Přibývá informací o přínosu vyšetření tumor markerů, zejména CEA, CYFRA 21–1, NSE. Dále se mohou uplatnit i chromozomální analýza a speciální barvení PAS (periodic acid Schiff – Schiffovo reagens) s diastázovou digescí odlišující adenokarcinom od mezoteliomů. U posledně jmenovaného nádoru může k diagnóze přispět i vysoká hladina hyalouronové kyseliny, hodnoty nad 75 mg/l byly pro mezoteliom 100% specifické, při nižší senzitivitě 56 %. V poslední době se k diagnostice využívá nový sérový marker. Jedná se o solubilní mesothelin-related protein (SMRP), což je cirkulující produkt mezotelinu, povrchového proteinu, který má vliv na adhezivitu mezotelií. 55 % nemocných s maligním mezoteliomem má zvýšenou hladinu SMRP v době diagnózy a 84 % v pokročilých stadiích. Specificita tohoto vyšetření je vyšší než 80 %, zkouší se i při vyhledávání časných forem mezoteliomu [7,15]. Při suspekci na postižení pleury lymfomem se doporučuje vyšetřit výpotek flow-cytometrií.
Léčba některých typů pleurálních výpotků
Pleurální výpotek je obvykle komplikací jiného onemocnění. Pouhými evakuačními punkcemi nelze tyto nemocné vyléčit, snad jen s výjimkou pomalu se doplňujících výpotků u nemocných s maligním onemocněním v terminálních stadiích. Léčbu je potřeba zaměřit především na základní nemoc.
Nemocným s tuberkulózní pleuritidou indikujeme antituberkulotika, obvykle v čtyřkombinaci rifampicin, izoniazid, pyrazinamid a etambutol v intermitentním či denním režimu. Za dostatečnou dobu léčení považujeme 6 měsíců, v úvodu se někdy přidávají kortikoidy. V metaanalýze 10 prací (pouze 3 byly randomizované a kontrolované placebem) hodnotící význam kortikoidů přidaných k léčbě tuberkulózní pleuritidy [16] nebyl prokázán benefit jejich podání. Na léčení tohoto typu výpotku nejsou shodné názory. V některých publikacích jsou uvedeny i jiné způsoby podávání antituberkulotik, např. je doporučováno i denní podávání kombinace 300 mg izoniazidu s 600 mg rifampicinu po dobu 6–9 měsíců [2].
Pozornost našich i zahraničních autorů v posledních letech zaslouženě přitahuje léčení maligních pleurálních výpotků. V případě malých výpotků (výpotek v rozsahu menším než 1/3 hemitoraxu) doprovázející chemosenzitivní nádorová onemocnění (malobuněčný plicní karcinom, karcinom prsu, karcinom ovarií či lymfomy) se doporučuje nejprve vyzkoušet efekt chemoterapie. Častěji se však jedná o nádory více či méně chemorezistentní, jako je nemalobuněčná plicní rakovina (75 % ze všech plicních nádorů) nebo mezoteliom. V takových případech přichází v úvahu často jen léčba symptomatická. Významným faktorem zhoršujícím život nemocných je doplňující se maligní výpotek a obtíže z něho plynoucí – dušnost, nutnost opakovaných evakuačních punkcí a ztráta bílkovin. Jedna z možností jak zamezit doplňování tekutiny v pleurální dutině je spojení obou pleurálních listů, vytvoření pleurodézy. Indikuje se u osob s rekurentním symptomatickým výpotkem po průkazu schopnosti reexpanze plíce a snížení dušnosti po evakuaci výpotku. V literatuře je popsáno mnoho způsobů jak tohoto cíle dosáhnout a množství preparátů, které se k tomuto druhu léčby používají [7]. V minulosti se používal dusičnan stříbrný, terpentýn, krev, jodizovaný olej. První literární zprávy o tomto typu léčení jsou z roku 1948. V současnosti je nejčastěji užíván bezazbestový talek, jodpovidon, platina či mechanická abraze pleury při torakoskopii. Principem léčby je přiblížení obou listů pohrudnice k sobě (po kompletní evakuaci) a následná instilace některého z uvedených přípravků buď při torakoskopii nebo pomocí drénu nebo při torakocentéze. Výsledkem je iritace povrchu pleury a vytvoření pevného srůstu obou listů, tedy pleurodéza. Efekt léčby, tedy zamezení akumulace tekutiny v pleurální dutině, se podle různých autorů pohybuje kolem 60–90 %. Nejčastěji je používán talek (při torakoskopii či drénem v roztoku), v nedávné minulosti jsme používali doxycyklin. U nemocných starších nebo nádorovým onemocněním oslabených se doporučuje intrapleurálně 2% jodovidon 100 ml [17]. Závažnou komplikací po instilaci většiny těchto preparátů jsou teploty, bolest v místě podání, nauzea a někdy i závažné celkové reakce na podanou látku (syndrom akutní dechové tísně po instilaci talku / ARDS – acute respiratory distress syndrome). Dle nedávno zveřejněných výsledků o výskytu reakce podobné ARDS rozhoduje velikost částic talku. Ve skupině 558 nemocných, kterým byl instilován do pleurálního prostoru talek, jehož částice byly tzv. větší (medián nad 25,6 μm), nebyla podobná reakce pozorována ani jednou [18].
V mnoha případech nám zůstává jako jediná možnost symptomatické pomoci nemocným výpotek opakovaně evakuovat. Vedle zmíněných opakovaných punkcí u pomalu se doplňujících se výpotků je další možností trvale zavést do pleurální dutiny katétr a výpotek řízeně vypouštět (indwelling pleural catheter). Metoda se rychle rozšířila, avšak nejednotnost v názorech na ní trvají. Hlavním důvodem jsou časté komplikace, jako je dislokace katétru, nutriční ztráty, infekce, metastázy v drenážním kanále, souhrnně popsané v nedávno publikovaném sdělení [19].
Z dalších typů léčení nemocných s pleurálními výpotky bychom rádi vyzdvihli význam komplexního interního i chirurgického přístupu k nemocným s hrudními empyémy (drenáž při klesajícím pH pod 7,2, užití streptokinázy u septovaných výpoků) [20], význam adekvátní antibiotické terapie nemocných s parapneumonickými výpotky, dobře vedené kardiologické léčby u nemocných s kardiálními transsudáty a potřebu spolupráce s gastroenterology při léčení výpotků komplikujících onemocnění GIT (akutní či chronická pankreatitida, subfrenický absces), s internisty při léčení nemocných s výpotky při plicní embolizaci a imunology při léčení výpotků při systémových onemocněních.
Výsledky léčení závisí na úrovni znalostí ošetřujícího lékaře i na základní diagnóze.
Závěr
Závěrem tohoto přehledu současných názorů na problematiku pleurálního syndromu bychom rádi ještě jednou upozornili na nezbytnost komplexního pohledu na tyto nemocné a na potřebu zapojit do vyšetřovacího algoritmu jak tradiční osvědčené metody, tak i novější, třeba i invazivnější způsoby vyšetření.
I tak diferenciální diagnostika pleurálních výpotků pravděpodobně zůstane tvrdým oříškem pro lékaře v terénu i na lůžkových zařízeních.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL)
prof. MUDr. Miloslav Marel, CSc.
miloslav.marel@fnmotol.cz
Pneumologická klinika 2. LF UK a FN v Motole,
Praha
www.fnmotol.cz
Doručeno do redakce 1. 6. 2016
Přijato po recenzi 10. 7. 2016
Sources
1. Yamada S. Über die seröse Flüssigkeit in der Pleurahöhle der gesunden Menschen. Z Ges Exp Med 1933; 90(1): 342–348.
2. Light RW. Pleural Disease. 2nd ed. Lea and Febiger: Philadelphia 1990.
3. Marel M, Zrůstová M, Stasný B et al. Incidence of Pleural Effusions in Well-defined region: Epidemiological Study in Central Bohemia. Chest 1993; 104(5): 1486–1489.
4. Marel M, Stastny B, Melínová L et al. Diagnosis of Pleural Effusions – Experience with Clinical Studies 1986–1990. Chest 1995; 107(6): 1598–1603.
5. Marel M. Novinky v diferenciální diagnostice pleurálních výpotků. Zdrav Nov – příloha Lékařské listy – 2007; 56(2): 23–26.
6. Toušek M. Diferenciální diagnostika pleuritického syndromu. Státní zdravotnické nakladatelství: Praha 1962.
7. Light RW, Gary Lee YC. Textbook of Pleural Diseases. 2nd ed. Hodder: London 2008. ISBN 978–0340940174.
8. Porcel JM. Pearls and myths in pleural fluid analysis. Respirology 2011; 16(1): 44–52.
9. Rahman NM, Mishra EK, Davies HE et al. Clinically important factors influencing the diagnostic measurement of pleural fluid pH and glucose. Am J Respir Crit Care Med 2008; 178(5): 483–490.
10. Hooper C, Gary Lee YC, Maskell N. [BTS Pleural Guideline Group]. Investigation of a unilateral pleural effusion in adults: British Thoracic Society pleural disease guideline 2010. Thorax 2010; 65(Suppl 2): ii4-ii17.
11. Valdes L, San José E, Alvarez D et al. Diagnosis of tuberculous pleurisy using the biologic parameters adenosine deaminase, lysozyme and interferon gamma. Chest 1993; 103(2): 458–465.
12. Dheda K, van Zyl-Smit RN, Sechi LA et al. Utility of quantitative T-cell responses versus unstimulated interferon-g for the diagnosis of pleural tuberculosis. Eur Respir J 2009; 34(5): 1118–1126.
13. Bennedsen J, Thomsen VO, Pfyffer GE et al. Utility of PCR in diagnosing pulmonary tuberculosis. J Clin Microbiol 1996; 34(6): 1407–1411.
14. Rodriguez-Panadero F, Borderas Naranjo F, López Mejîas J. Pleural metastatic tumours and effusions. Frequency and pathogenic mechanisms in a post-mortem series. Eur Resp J 1989; 2(4): 366–369.
15. Davies HE, Sadler RS, Bielsa S et al. Clinical impact and reliability of pleural fluid mesothelin in undiagnosed pleural effusions. Am J Respir Crit Care Med 2009; 180(5): 437–444.
16. Matchaba PT, Volmink J. Steroids for treating tuberculous pleurisy. Cochrane Database Syst Rev 2000; 2: CD001876.
17. Roberts ME, Neville E, Berrisford RG et al. [BTS Pleural Disease Guideline Group]. Management of a malignant pleural effusion: British Thoracic Society pleural disease guideline 2010. Thorax 2010; 65(Suppl 2): ii32-ii40.
18. Jannsen JP, Collier G, Astoul P et al. Safety of talc poudrage in malignant pleural effusion. Lancet 2007; 369(9572): 1535–1539.
19. Lui MM, Thomas R, Lee YC. Complications of indwelling pleural catheter use and their management. BMJ Open Resp Res 2016; 3(1): e000123. Dostupné z DOI: <http://dx.doi.org/10.1136/bmjresp-2015–000123>.
20. Davies EH, Davies RJ, Davies CW. [BTS Pleural Disease Guideline Group]. Management of pleural infection in adults: British Thoracic Society pleural disease guideline 2010. Thorax 2010; 65(Suppl 2): ii41-ii53.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 7-8-
All articles in this issue
- Určení prevalence potenciálních lékových interakcí u pacientů léčených 5 a více léčivými přípravky v České a Slovenské republice
-
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov. - Klinický přínos nových bazálních analog inzulinu
- Posuny v nutričních doporučeních pro zdravé obyvatelstvo a jejich dopad pro diabetickou dietu
- Syndrom porušeného vnímání hypoglykemie u diabetes mellitus
- Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
- Přínos urgentně provedené endoskopické retrográdní cholangiopankreatografie pro terapii akutní pankreatitidy
- Diabetes mellitus 2. typu a srdeční selhání
- Diferenciální diagnostika pleurálních výpotků
- Nežádoucí účinky biologické léčby v revmatologii
-
Možnosti ovlivnění kardiovaskulárního rizika u diabetes mellitus 2. typu antidiabetickou léčbou
Snížení kardiovaskulárního rizika při léčbě liraglutidem – výsledky studie LEADER - Metanol: hrozba intoxikace je stále aktuální
- Diabetická retinopatie: patogeneze a terapeutické implikace
- Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií
- Cílové hodnoty systolického krevního tlaku
- Klinický význam natriuretických peptidů v diferenciální diagnostice dušnosti
- Srdeční selhání se zachovanou ejekční frakcí
- Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
- Antagonisté glukagonu otevírají novou cestu v léčbě diabetu 2. typu
- Breviár edukácie diabetika pre internistu
- Prevence a terapie sarkopenie ve stáří
- Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Prevence a terapie sarkopenie ve stáří
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

