-
Medical journals
- Career
Těžká osteoporóza aneb Příběh chronické polékové hyponatremie
Authors: Pavel Polák 1,2,3; Petr Husa 1; Hana Matějovská Kubešová 2
Authors‘ workplace: Klinika infekčních chorob LF MU a FN Brno 1; Klinika interní, geriatrická, ošetřovatelství a praktického lékařství LF MU a FN Brno 2; Oddělení klinické hematologie FN Brno 3
Published in: Vnitř Lék 2016; 62(2): 152-156
Category: Case Reports
Overview
Autoři prezentují případ 73leté ženy léčené v posledních 15 letech pro arteriální hypertenzi diuretiky (tiazidy, amiloridem a indapamidem) a současně antidepresivem trazodonem. Po 6 letech této léčby začala pacientka trpět manifestní osteoporózou s vícečetnými frakturami i po banálním traumatu a současně byla po celou tuto dobu dokumentována těžká hyponatremie bez adekvátní suplementace. Osteoporóza a hyponatremie u této pacientky spolu s největší pravděpodobností těsně souvisely – autoři diskutují možné patofyziologické mechanizmy na úrovni renálních tubulů, osteoblastů a osteoklastů, hypofyzárně-skeletální osy, syndrom neadekvátní sekrece adiuretinu (SIADH) a možný vliv porušené acidobazické rovnováhy.
Klíčová slova:
alkalóza – antidepresiva – diuretika – hyponatremie – osteoporózaÚvod
Osteoporóza je komplexní heterogenní onemocnění, jehož důsledkem je pokles kostní minerálové denzity (bone mineral density – BMD), porušená mikroarchitektura kostní tkáně a zvýšené riziko fraktury. Pokles BMD je generalizovaný s největším vyjádřením v oblasti bederní páteře a kyčelních kloubů. Uplatňují se faktory genetické, dietetické, hormonální a lokální (cytokiny) [1].
Hyponatremie představuje nejčastější poruchu mineralogramu u hospitalizovaných pacientů s prevalencí 2–4 % při přijetí. Mezi hlavní rizika hyponatremie patří edém mozku v důsledku přesunu volné vody do intracelulárního hypertonického prostředí, dále edém plic (Ayusův-Arieffův syndrom) a syndrom pontinní demyelinizace. Zanedbatelné nejsou ani mírnější příznaky, jako jsou nestabilita chůze, nechutenství, chátrání a osteoporóza. Mezi léky, které mohou vyvolat hyponatremii, patří především tiazidová diuretika, inhibitory zpětného vychytávání serotoninu (SSRI) a antiepileptika. Z chorobných stavů doprovázených hyponatremií je třeba zmínit hypokortikalizmus, hypotyreózu, městnavé srdeční selhávání, jaterní cirhózu a renální nedostatečnost. Asi v 50 % je hyponatremie způsobena syndromem neadekvátní sekrece antidiuretického hormonu (syndrome of inappropriate antidiuretic hormone secretion – SIADH). Tiazidy indukovaná hyponatremie (TIH) byla v retrospektivní studii prokázána u 1/3 takto léčených pacientů. Mezi rizikové faktory patří vyšší věk, ženské pohlaví a nižší tělesná hmotnost [2].
Autoři popisují případ ženy s klinicky závažnou formou osteoporózy (fraktury po malém traumatu), u které byla minimálně po dobu 9 let léčby diuretiky (tiazidy, amilorid, indapamid) sice dokumentována, ale neadekvátně léčena těžká chronická hyponatremie.
Popis případu
Bývalá zdravotní sestra ve věku 73 let byla v březnu 2015 přijata na Kliniku infekčních chorob (KICH) FN Brno pro subakutní horní i dolní dyspeptický syndrom. V anamnéze figurovala léčba arteriální hypertenze v posledních 15 letech a dále četné fraktury: stav po fraktuře levého humeru před 8 lety, po fraktuře pravého zápěstí před 5 lety a po fraktuře dolního raménka stydké kosti vpravo vzniklé pouze po prudkém dosednutí měsíc před hospitalizací. V posledních několika letech byla sledována pro osteoporózu a pravidelně užívala ibandronát. Pacientka uváděla 2 porody a od svých 58 let věku byla v menopauze. Při fyzikálním vyšetření byl nápadný mírný divergentní strabizmus pravého očního bulbu, mírná dysmetrie pravé horní končetiny, generalizovaná sarkopenie a celková slabost. Pacientka vážila 47 kg při tělesné výšce 158 cm (body mass index 18,8 kg/m2). Laboratorně byla při přijetí zjištěna těžká hyponatremie (115,0 mmol/l) s hypochloremií (78,0 mmol/l), mírná respirační alkalóza (pH 7,49, pCO2 4,3 kPa, pO2 9,0 kPa, HCO3- 24,1 mmol/l, deficit bází 1,5). Hodnoty dusíkatých katabolitů v séru byly v referenčním rozmezí (urea 2,5 mmol/l, kreatinin 55,0 μmol/l); byla zjištěna hypoproteinemie (52,9 g/l) s hypoalbuminemií (29,1 g/l) a hyperglykemií (9,4 mmol/l) a laboratorní známky hemokoncentrace (hemoglobin 160,0 g/l, hematokrit 44,0 %). Celková kalcemie byla 2,0 mmol/l; fosfatemie 0,7 mmol/l; kalciurie nebyla stanovena. Ostatní laboratorní parametry včetně aminotransferáz, amylázy, laktátdehydrogenázy byly v referenčním rozmezí. Dlouhodobá medikace sestávala z kyseliny acetylsalicylové (100 mg/den), perindoprilu s indapamidem (4/1,25 mg denně), acebutololu (400 mg 2krát denně), lacidipinu (4 mg ráno a 2 mg večer) a antidepresiva se zdvojeným serotoninovým působením trazodonu (150 mg/den). Kombinovaný preparát perindoprilu s indapamidem užívala pacientka asi 5 let, předtím byla několik let léčena amiloridem s hydrochlorotiazidem. V nemocničním informačním systému byl prakticky totožný rozvrat vnitřního prostředí dokumentován průběžně již od roku 2006, kdy byla zahájena léčba amiloridem s hydrochlorotiazidem. Na tuto poruchu mineralogramu bylo pacientce doporučeno užívat více kuchyňské soli. Na základě těchto údajů byla okamžitě ukončena terapie diuretiky, minerálová dysbalance a porucha acidobazické rovnováhy byly plně korigovány pozvolna během 7 dnů (výpis použité terapie a vývoj laboratorních parametrů v čase je uveden v tab 1). Současně odezněly i dyspeptické potíže (infekční etiologie nebyla prokázána). Pomocí vyšetření zobrazením magnetickou rezonancí byla vyloučena patologie v oblasti hypotalamu a hypofýzy, ultrasonografické vyšetření dutiny břišní neprokázalo klinicky relevantní patologii a RTG vyšetření hrudníku bylo v mezích normy. Pacientka byla propuštěna do domácího ošetřování s doporučením další léčby osteoporózy. Případná další terapie diuretiky byla relativně kontraindikována – pokud by se k ní přistoupilo, pak pouze za podmínky pravidelné kontroly mineralogramu a pečlivé péče o stabilní vnitřní prostředí.
Table 1. Vývoj laboratorních parametrů v čase a použitá léčba 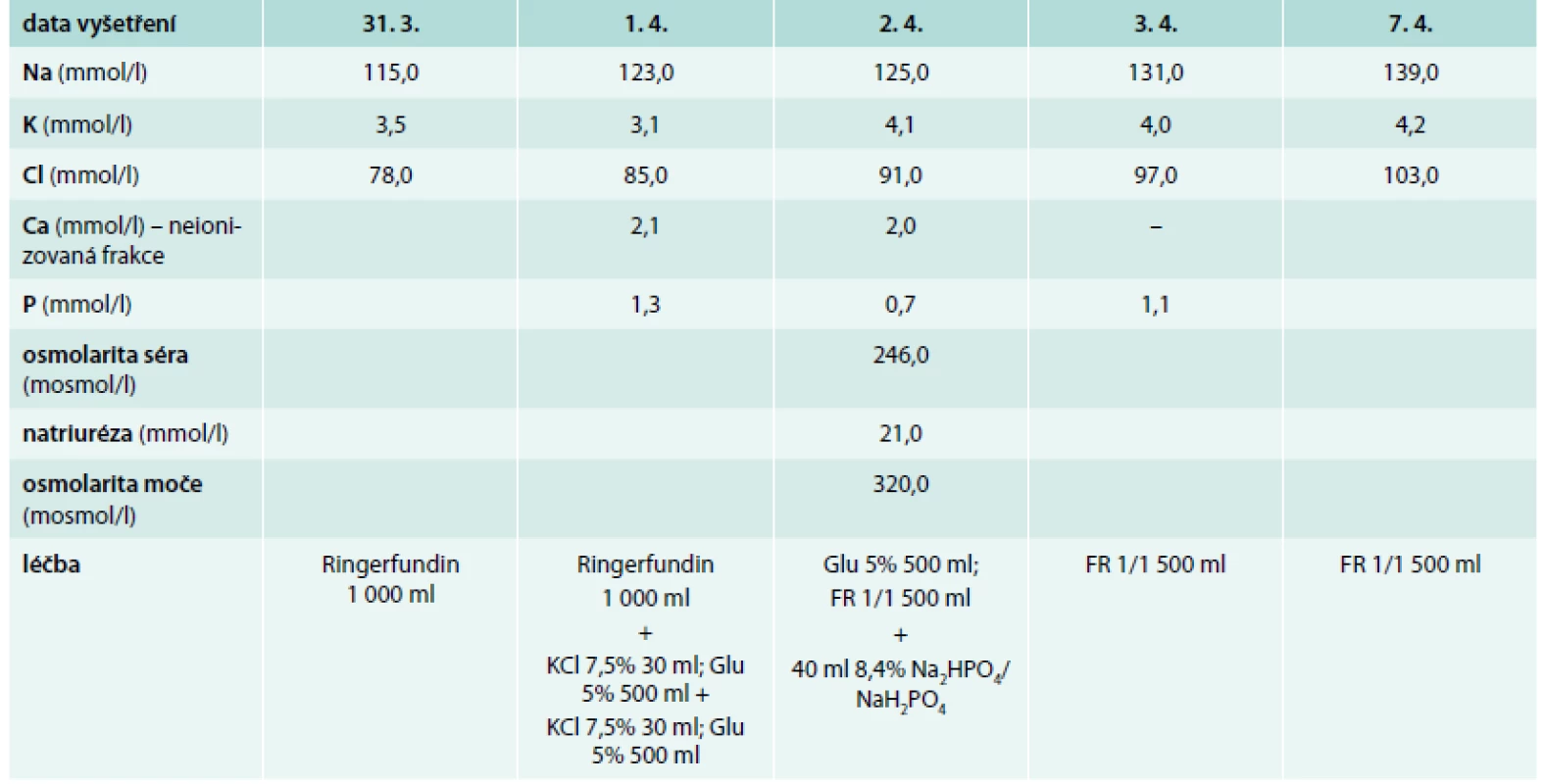
FR – fyziologický roztok Glu – roztok glukózy Poznámka: bilance tekutin nebyly měřeny. Diskuse
V odborném písemnictví v posledních 5 letech přibývá mnoho prací zabývajících se problematikou BMD u pacientů s kardiovaskulárním onemocněním a s rozličnou medikací včetně diuretik, antipsychotik a antidepresiv. Z různých, většinou retrospektivních, prací vyplývají nekonzistentní a někdy i protichůdné závěry. V české literatuře se tomuto tématu blíže věnovala Žofková [3]. U popsané pacientky se na rozvoji těžké osteoporózy s největší pravděpodobností podílela chronická těžká hyponatremie, jejíž vývoj byl léta dokumentován v časové souvislosti s medikací diuretiky. Případný vliv antidepresiv byl vzhledem k výrazně kratší době užívání zřejmě minoritní, nicméně v disponovaném terénu nezanedbatelný. Závažnost stavu umocňovala progredující proteino-energetická malnutrice a disabilita.
Osteoporóza a kardiovaskulární onemocnění
Kardiovaskulární onemocnění sama o sobě mohou být rizikovým faktorem fraktur. Toto riziko je dáno zčásti vyšší četností pádů při zhoršeném posturálním tonu a zčásti sníženou mechanickou pevností kosti. Spekuluje se o možném vlivu endoteliální dysfunkce a sníženého krevního zásobení kostní tkáně u pokročilé aterosklerózy. U hypertoniků je pozorováno zvýšené vylučování Ca2+ do moče. V rozsáhlé celonárodní kontrolované studii provedené Vestergaardem (n = 124 655) bylo u hypertoniků a u pacientů po cévní mozkové příhodě pozorováno zvýšené riziko kostních fraktur. V krátkodobém horizontu bylo toto riziko pozorováno i u pacientů po myokardiálním infarktu, po flebotrombóze a u jedinců s fibrilací síní. V této studii bylo riziko fraktury kyčelního kloubu u hypertoniků léčených méně než 3 roky zvýšené 1,6krát a u hypertoniků léčených déle než 6 let 1,4krát (95% interval spolehlivosti 1,41–1,80 a 1,13–1,76), a to po adjustaci na prodělané fraktury v minulosti, alkoholizmus, léčbu glukokortikoidy, antiepileptiky, nesteroidními antirevmatiky, diuretiky a amiodaronem. Riziko fraktury obratle ve stejných podskupinách bylo zvýšené 1,6krát (95% interval spolehlivosti [CI] 1,21–2,03) a 1,1krát (95% CI 0,64–1,80). Zvýšené riziko osteoporózy bylo pozorováno u žen s hypoestrogenizmem a při přítomnosti rizikových faktorů ischemické choroby srdeční [4].
Javed provedl 10letou retrospektivní průřezovou studii BMD v souboru 631 žen. Z tohoto souboru trpělo 65,3 % žen hypertenzí a nebyl pozorován rozdíl v BMD mezi ženami s hypoestrogenizmem a bez něj. Současně nebyl pozorován statisticky významný vliv hypertenze na rozvoj osteopenie či osteoporózy, a to ani v multivariační analýze. Obdobně nebyl prokázán žádný vliv užívání tiazidů. Adjustované riziko osteopenie u hypertoniků dosahovalo 1,0 (95% CI 0,76–1,40, p = 0,837) a 0,98 pro osteoporózu (95% CI 0,66–1,46; p = 0,931). Do studie bylo zařazeno celkem 458 jedinců užívajících tiazidové diuretikum, z nichž 50,2 % mělo prokázanou osteopenii a 8,4 % osteoporózu. V podskupině bez této léčby mělo osteopenii 50,0 % a osteoporózu 17,3 % jedinců. V podskupině léčené tiazidy dosahovalo T-skóre pro frakturu bederního obratle -0,23 a -1,13 pro pravý kyčelní kloub (standardní odchylka [SD] 1,90 a 1,15) a v podskupině bez této medikace -0,39 a -0,97 (SD 1,65 a 1,10). U jedinců léčených tiazidy dosahovalo Z-skóre pro bederní obratle 0,31 (SD 1,79) a -0,42 pro pravý kyčelní kloub (SD 1,03) a 0,28 (SD 1,51) a -0,34 (SD 0,95) v podskupině bez této léčby. Tato nerandomizovaná studie však byla založena pouze na dotazníkovém šetření a na jednorázovém měření krevního tlaku [5].
Ve studiích na myších bylo prokázáno, že kalcifikace cévní stěny a aortální chlopně přímo souvisí s poklesem BMD. U srdečního selhávání dochází k rychlejšímu poklesu BMD. Ve studii provedené Aluochem bylo prokázáno zvýšené riziko fraktur kyčelního kloubu u pacientů s chronickým srdečním selháváním po adjustaci na pohlaví a věk [6].
V randomizované dvojitě zaslepené studii byl prokázán přímý vliv tiazidů na BMD v oblasti páteře a kyčelních kloubů. Tiazidy inhibují kotransportér Na+ a Cl- (SCCT) v nefronu i kostech. Tento transportér je zodpovědný za reabsorpci Na+ a Cl- v distálním tubulu. Zvýšená exkrece Na+ při blokádě SCCT tiazidovým diuretikem je doprovázena ztrátami Cl- s následným zvýšením reabsorpce bikarbonátu, což vede k mírné metabolické alkalóze a ke snížení pufrovací aktivity kosti. Konečným důsledkem těchto jevů může být ztráta kostní hmoty. Tato data nejsou v souladu s pozorovanou zvýšenou reabsorbcí Ca2+ při léčbě tiazidy, což by mělo mít naopak příznivý efekt na BMD [1]. Oproti tomu kličková diuretika zvyšují odpad Ca2+ do moče a současně indukují vzestup sérových koncentrací parathormonu a 1,25-dihydroxyvitaminu D [7]. Kostní remodelace v důsledku ztrát Ca2+ močí při léčbě kličkovými diuretiky je zřejmě efektem dávky diuretika [8].
Osteoporóza, hyponatremie a vliv medikace
Hyponatremie byla recentně identifikována jako nezávislý rizikový faktor osteoporózy a fraktur [8].
Ve studii na myších bylo prokázáno, že osteoblasty i osteoklasty exprimují receptory pro hormony hypofýzy (tyreostimulační hormon – TSH, folikulostimulační hormon – FSH, adrenokortikotropní hormon – ACTH a oxytocin). Z tohoto poznatku byla postulována teorie existence hypofyzárně-skeletální osy, jejíž existence zapříčiňuje, že hormony hypofýzy vykazují přímý vliv na funkci kostních buněk (mimo jiné je takto lépe vysvětlen rozvoj osteoporózy při hypertyreóze). Hyponatremie je vždy doprovázena zvýšenou sérovou koncentrací dalšího z hormonů secernovaných pars posterior hypofýzy – adiuretinu (ADH) v séru, který je klíčovým regulátorem kostní resorpce a formace. Receptory pro ADH (Avpr1α a Avpr2) jsou exprimovány osteoblasty i osteoklasty. Jejich stimulace aktivuje kinázu Erk s následným snížením kostní formace a zvýšením kostní resorpce. Genetická mutace v genech pro receptory pro ADH anebo farmakologická inhibice V2-receptorů v distálním tubulu pomocí vaptanů vede ke zvýšené osteoblastogenezi při současném snížení formace i aktivity osteoklastů. K demineralizaci kostí přispívá i hyperaldosteronizmus [9].
Hyponatremie má vliv na trabekulární i kortikální kostní tkáň. Velká studie prokázala lineární vztah mezi sérovou koncentrací natria a BMD v oblasti kyčelního kloubu. U hyponatremie bylo riziko rozvoje osteoporózy 2,9krát vyšší. Mezi další možné patofyziologické faktory ztráty kostní mineralizace patří snížené vstřebávání kyseliny askorbové při hyponatremii s následným oxidativním stresem osteoklastů a se zvýšením jejich aktivity. Uvažuje se též o možnosti porušených reparačních procesů mikrofraktur osteoblasty. V pokusech na myších byla při chronické hyponatremii prokázána deplece Ca2+ z endoplazmatického retikula. Deplece sérového natria je hrazena uvolněním natria z kostních struktur – mechanizmus dosud není objasněn. Z observačních studií vyplývá, že chronická hyponatremie souvisí s poruchou stability chůze, s pády, osteoporózou a frakturami u starších jedinců. Je možné, že hyponatremie vede ke změně kvality kosti, která není zachycena pomocí měření BMD a současně je pravděpodobné, že se na těchto jevech negativně podílí již mírná hyponatremie (přibližně 133 mmol/l) [2,10].
Průřezová studie provedená u více než 400 anorektiček prokázala jako rizikový faktor hyponatremie vyšší věk, déle trvající anorexii, léčbu inhibitory zpětného vychytávání serotoninu (SSRI) a antipsychotiky, a to bez závislosti na indexu tělesné hmoty (BMI), věku při stanovení diagnózy anorexie, užívání estrogenů či věku menarché. U žen s hyponatremií pak byl pozorován vyšší pokles BMD: T-skóre v oblasti bederní páteře dosahovalo hodnoty -1,8 ± 0,1, zatímco u žen s normonatremií -1,4 ± 0,1 (p = 0,004). U žen s hyponatremií dosahovalo Z-skóre v oblasti páteře -1,6 ± 0,1 a u žen s normonatremií -1,3 ± 0,1 (p = 0,004). Obdobné hodnoty byly získány pro oblast kyčelního kloubu: T-skóre i Z-skóre u žen s hyponatremií bylo -1,2 ± 0,1 (u normonatremických žen -0,9 ± 0,1; p = 0,009) [11].
Největší prospektivní studie týkající se osteoporózy a fraktur při hyponatremii byla provedena Rotterdamskou skupinou. Jedinci s hyponatremií byli starší, častěji trpěli pády a častěji užívali diuretika. Při logistické regresi bylo u chronické hyponatremie pozorováno 4krát zvýšené riziko osteoporózy. Čím těžší je hyponatremie, tím vyšší je riziko osteoporózy (uplatňuje se tíže hyponatremie i délka jejího trvání). Při zahájení studie představovala hyponatremie 1,4krát zvýšené riziko fraktur mimo osový skelet, pro frakturu obratle bylo toto riziko ještě vyšší. Nebyl však pozorován vliv hyponatremie na BMD. U jedinců s hyponatremií byla rovněž zaznamenána zvýšená mortalita z jakýchkoli příčin [12].
Terapie tiazidy signifikantně snižuje riziko fraktury kyčelního kloubu u mužů ve vysokém věku a u žen všech věkových kategorií. Možným efektem tiazidů je stimulace osteoblastů k novotvorbě kostní tkáně. In vitro byla pozorována stimulace produkce osteokalcinu v lidských osteoblastech a zvýšená exprese Na+/Cl- kontransportéru senzitivního na tiazidy v buňkách podobným osteoblastům; současně byla pozorována snížená diferenciace osteoklastů [1].
V nedávno publikované studii prokázal Usala et al statisticky signifikantní souvislost hyponatremie s osteoporózou a rizikem fraktury a to po adjustaci na věk, pohlaví a rasu: odds ratio (OR) pro rozvoj osteoporózy u chronické hyponatremie bylo 3,97 (95% CI 3,59–4,39); pro fraktury pak OR 4,61 (95% CI 4,15–5,11). Podobný trend byl pozorován i u krátkodobě trvající hyponatremie: OR pro rozvoj osteoporózy bylo 3,06 (95% CI 2,81–3,33) a pro fraktury OR 3,05 (95% CI 2,83–3,29). Jedním ze závěrů této studie bylo konstatování, že hyponatremie (akutní i chronická) zvyšuje morbiditu i mortalitu [13].
V dánské retrospektivní studii byla prokázána souvislost hyponatremie s frakturami kyčelních kloubů i obratlů. Riziko rozvoje osteoporózy v oblasti kyčelních kloubů u hyponatremických jedinců bylo zvýšené 2,2krát (95% CI 1,40–3,34) a v oblasti bederní páteře zvýšené 1,8krát (95% CI 1,20–2,80) [14].
Další recentní retrospektivní studie prokázala signifikantně nižší hodnoty natremie a albuminemie u jedinců po osteosyntéze fraktury v porovnání s kontrolní skupinou [15].
V nedávno publikované rozsáhlé monocentrické observační longitudinální studii (n = 24 784) pozorovali američtí autoři hyponatremii u 2,8 % souboru a s ní související 2,5krát vyšší riziko osteoporózy kyčelního kloubu (95% CI 1,36–4,46) ve věkové kategorii do 55 let a překvapivě pouze 1,6krát vyšší riziko u pacientů ve věku nad 67 let (95% CI 1,13–2,12; p = 0,002) [16].
Diuretika mohou rovněž indukovat poruchu acidobazické rovnováhy, syndrom nepřiměřené sekrece adiuretinu a sekundární hyperaldosteronizmus – rozbor možných patofyziologických mechanizmů přesahuje rámec tohoto sdělení, pro úplnost jsou uvedeny referenční literární zdroje [17–21].
Závěr
Mechanizmy léky indukovaného rozvoje osteopenie/osteoporózy jsou velmi komplexní a dosud ne zcela pochopené. V klinické praxi se jistě značně uplatňují různé individuální faktory. Hyponatremie (i mírná) byla v posledních letech identifikována jako nezávislý rizikový faktor poklesu kostní minerálové denzity s následným rizikem fraktur. Mezi léky, které mohou svým přímým i nepřímým působením hyponatremii způsobit, patří i diuretika (především tiazidová) a antidepresiva. Z prezentovaného případu vyplývá nutnost pravidelné kontroly mineralogramu a případně časná adekvátní úprava léčby, aby se předešlo životně závažným komplikacím i v dlouhodobém horizontu.
Podpořeno MZ ČR – RVO (FNBr, 65269705)
Doručeno do redakce 29. 7. 2015
Přijato po recenzi 30. 10. 2015
MUDr. Pavel Polák, Ph.D.
pavel.polak@fnbrno.cz
Oddělení klinické hematologie FN Brno
www.fnbrno.cz
Sources
1. Sakhaee K, Maalouf NM, Kumar R et al. Nephrolithiasis-associated bone disease: pathogenesis and treatment options. Kidney Int 2011; 79(4): 393–403.
2. Ayus JC, Negri AL, Kalantar-Zadeh K et al. Is chronic hyponatremia a novel risk factor for hip fracture in the elderly? Nephrol Dial Transplant 2012; 27(10): 3725–3731.
3. Žofková I. Léky indukovaná osteoporóza. Vnitř Lék 2013; 59(1): 59–63.
4. Vestergaard P, Rejnmark L, Mosekilde L. Hypertension is a risk factor for fractures. Calcif Tissue Int 2009; 84(2): 103–111.
5. Javed F, Khan SA, Ayers EW et al. Association of hypertension and bone mineral density in an elderly African American female population. J Natl Med Assoc 2012; 104(3–4): 172–178.
6. Aluoch AO, Jessee R, Habal H et al. Heart failure as a risk factor for osteoporosis and fractures. Curr Osteoporos Rep 2012; 10(4): 258–269.
7. Ilić K, Obradović N, Vujasinović-Stupar N. The relationship among hypertension, antihypertensive medications, and osteoporosis: a narrative review. Calcif Tissue Int 2013; 92(3): 217–227.
8. Kann PH, Hadji P, Bergmann RS. Osteoporose jenseits von Kortison. Z Rheumatol 2014; 73(4): 323–328.
9. Tamma R, Sun L, Cuscito C et al. Regulation of bone remodeling by vasopressin explains the bone loss in hyponatremia. Proc Natl Acad Sci USA 2013; 110(46): 18644–18649. Dostupné z DOI: http://dx.doi.org/10.1073/pnas.1318257110.
10. Hannon MJ, Verbalis JG. Sodium homeostasis and bone. Curr Opin Nephrol Hypertens 2014; 23(4): 370–376.
11. Lawson EA, Fazeli PK, Calder G et al. Plasma sodium level is associated with bone loss severity in women with anorexia nervosa: a cross-sectional study. J Clin Psychiatry 2012; 73: e1379-e1383. Dostupné z DOI: http://dx.doi.org/10.4088/JCP.12m07919.
12. Hoorn EJ, Rivadeneira F, van Meurs JBJ et al. Mild hyponatremia as a risk factor for fractures: The Rotterdam Study. J Bone Miner Res 2011; 26(8): 1822–1828.
13. Miriam Rachel Usala G, Fernandez SJ, Mete M et al. Hyponatremia is associated with increased osteoporosis and bone fractures in a large U. S. health system population. J Clin Endocrinol Metab 2015; 100(8):3021–3031. Dostupné z DOI: http://dx.doi.org/10.1210/jc.2015–1261.
14. Kruse C, Eiken P, Vestergaard P. Hyponatremia and osteoporosis: insights from the Danish National Patient Registry. Osteoporos Int 2015; 26(3): 1005–1016.
15. Kwak MK, Choi D, Lee JH et al. Relationship between decrease in serum sodium level and bone mineral density in osteoporotic fracture patients. J Bone Metab 2015; 22(1): 9–15.
16. Afshinnia F, Sundaram B, Ackermann RJ et al. Hyponatremia and osteoporosis: reappraisal of a novel association. Osteoporos Int 2015; 26(9): 2291–2298.
17. Li WG, Yu Y, Huang C et al. Nonproton ligand sensing domain is required for paradoxical stimulation of acid-sensing ion channel 3 (ASIC3) channels by amiloride. J Biol Chem 2011; 286(49): 42635–42646. Dostupné z DOI: http://dx.doi.org/10.1074/jbc.M111.289058.
18. Weinstein AM. A mathematical model of distal nephron acidification: diuretic effects. Am J Physiol Renal Physiol 2008; 295(5): F1353-F1364.
19. Kopp KF. Das Bikarbonat-Mangel-Syndrom, Bicarbonate-Deficiency-Syndrome (BDS). Der Bikarbonat-Alkalisch-Plus-BONUS (BBAPB). Tägliche Bikarbonat-Substitution, Wirkung und Nutzen für Wohlbefinden und Gesundheit im Allgemeinen und in der Medizin. Dostupné z WWW: http://www.kf-kopp.de/wissenschaftliche-arbeiten/das-bikarbonat-mangel-syndrom-bicarbonate-deficiencysyndrome-bds/.
20. Bhuvaneswar CG, Baldessarini RJ, Harsh VL et al. Adverse endocrine and metabolic effects of psychotropic drugs: selective clinical review. CNS Drugs 2009; 23(12): 1003–1021.
21. Bonny O, Edwards A. Calcium reabsorption in the distal tubule: regulation by sodium, pH, and flow. Am J Physiol Renal Physiol 2013; 304(5): F585-F600.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 2-
All articles in this issue
- Použití systémových glukokortikoidů v terapii infekčních nemocí
- Inhibitory protonové pumpy a jejich účinek na kosti
- Fekálna mikrobiálna terapia
- Těžká osteoporóza aneb Příběh chronické polékové hyponatremie
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Racionální diagnostika cholangiokarcinomu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
- Inhibitory protonové pumpy a jejich účinek na kosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

