-
Medical journals
- Career
Myopatie při Waldenströmově makroglobulinemii.
Popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů typu IgM
Authors: Zdeněk Adam 1; Jarmila Kissová 1; Luděk Pour 1; Marta Krejčí 1; Eva Ševčíková 1; Renata Koukalová 2; Zdeňka Čermáková 3; Marta Černá 4; Zdeněk Král 1; Jiří Mayer 1
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Oddělení nukleární medicíny, pracoviště pozitronové emisní tomografie, Masarykův onkologický ústav, Brno prim. MUDr. Zdeněk Řehák, Ph. D. 2; Oddělení klinické biochemie FN Brno, pracoviště Bohunice, a Katedra laboratorních metod LF MU, Brno, přednosta doc. MUDr. Milan Dastych, CSc., MBA 3; Hematologicko transfuzní oddělení Uherskohradišťské nemocnice, a. s., Uherské Hradiště, prim. MUDr. Marta Černá 4
Published in: Vnitř Lék 2015; 61(9): 821-828
Category: Case Reports
Overview
Monoklonální imunoglobuliny se v ojedinělých případech váží na tělu vlastní antigeny a způsobují tak autoimunitní poškození organizmu. V textu popisujeme Waldenströmovu makroglobulinemii, která se manifestovala bolestmi ve svalech a anémií. Pacientka pociťovala bolesti zad asi 3 roky před příchodem na naši ambulanci. V posledním roce se k bolestem zádových svalů přidaly i bolesti ve svalech horních a dolních končetin. Vzniklo tak podezření na polymyozitidu. Ta ale nebyla odborným vyšetřením potvrzena. Pacientka měla v kostní dřeni jasnou infiltraci lymfoplazmocytárním lymfomem a 10,8 g/l monoklonálního imunoglobulinu typu IgM. Koncentrace myoglobinu v séru a aktivita kreatinkinázy (CK) v séru byly opakovaně signifikantně zvýšené. Proto byla zahájena léčba monoklonální protilátkou antiCD20 (Mabthera) 375 mg/m2 i. v. 1krát měsíčně, cyklofosfamidem 500 mg/m2 i. v. den 1 a den 15 v 28denním cyklu a dexametazonem 20 mg 1.–4. den a 15.–18. den léčebného cyklu. Plánováno bylo celkem 8 cyklů. Již po 5. cyklu bylo dosaženo vymizení monoklonálního imunoglobulinu (negativní imunofixace), normalizace hodnot myoglobinu a CK a výrazný ústup bolestí svalů. Koncentrace hemoglobinu před léčbou byla výrazně snížená, po léčbě se normalizovala. Po 5 cyklech bylo tedy dosaženo kompletní remise Waldenströmovy nemoci dle biochemických parametrů a normalizace hodnot myoglobinu a CK v séru.
Klíčová slova:
Mabthera – monoklonální imunoglobulin typu IgM – myopatie – Waldenströmova makroglobulinemieÚvod
Monoklonální imunoglobulin představuje ve většině případů jen marker, který charakterizuje masu klonálních plazmocytů či lymfoplazmocytů, takže změny jeho koncentrace vypovídají o progresi či regresi případné nemoci. U malé části osob s přítomnou monoklonální protilátkou se můžeme setkat s vazbou této protilátky na některé tělu vlastní antigeny, a tedy s projevy autoimunity zprostředkovanými právě touto monoklonální protilátkou. Monoklonální imunoglobuliny typu IgM způsobují autoimunitní projevy častěji než monoklonální imunoglobuliny typu IgG anebo typu IgA [1–3].
Cílem následujícího popisu je poukázat na možnost myopatie související s monoklonálním imunoglobulinem typu IgM. V diskusi je uveden přehled možných autoimunitních poškození způsobených monoklonálními imunoglobuliny. V české literatuře není poškození svalové tkáně vlivem monoklonálního imunoglobulinu popsáno. Ve světovém písemnictví (Medline-Pubmed) bylo podobných případů popsáno jen velmi málo.
Popis případu
Pacientka, narozená roku 1955, měla ve 23 letech zjištěno bronchiální astma a hypofunkci štítné žlázy, pravděpodobně autoimunitního původu. V roce 2010 byl sonograficky zjištěn tumor ledviny, následovala nefrektomie. Histologicky byl prokázán angiomyolipom ledviny. Pacientka udávala, že od mládí trpěla snadnou tvorbou hematomů při nepatrném úrazu. Bolesti ve svalech zad si uvědomovala již od roku 2010. Bolesti svalů se v roce 2013 rozšířily i na končetiny. Zintenzivnění bolestí svalů přivedlo pacientku k revmatologovi. Ten zjistil mírnou anémii, ale překvapivé bylo zvýšení koncentrace myoglobinu v séru a zvýšení aktivity kreatinkinázy (CK) a laktátdehydrogenázy (LD). Zvýšená byla také hodnota sedimentace erytrocytů. K došetření patologických hodnot myoglobinu a kreatinkinázy v séru byla odeslána do Revmatologického ústavu v Praze. Ve zprávě z Revmatologického ústavu v Praze je uvedeno, že polymyozitita při absenci významnější svalové slabosti, normálním výsledku EMG a negativním výsledku imunologického vyšetření je nepravděpodobná. Podrobný rozsah imunologického vyšetření nebyl v předložené dokumentaci specifikován. Revmatologové doporučili vyšetření na odborném hematologickém pracovišti pro možnost postižení svalstva při monoklonální gamapatii.
Při prvním vyšetření na ambulanci Interní hematologické a onkologické kliniky v Brně v listopadu roku 2013 udávala pacientka difuzní bolesti ve svalech zad, dále bolesti svalů nohou i rukou. Při klinickém vyšetření však nebyla u pacientky prokázána jednoznačná patologie. Při vstupním vyšetření (14. 11. 2013) byla zjištěna anémie s koncentrací hemoglobinu 107 g/l, počtem trombocytů 324 × 109/l a leukocytů 6,9 × 109/l. Při vyšetření základních koagulačních parametrů byla nalezena prodloužená hodnota APTT na 46,1 s (1,38 R).
Koncentrace polyklonálních imunoglobulinů: IgG 16,56 g/l (norma 7–16 g/l), IgM 10,16 g/l (norma 0,40–2,30 g/l), IgA 3,77 g/l (norma 0,7–4,0 g/l). Ke kvantitativnímu stanovení koncentrace polyklonálních imunoglobulinů byla použita metoda nefelometrie.
Byl přítomný monoklonální imunoglobulin typu IgM λ v koncentraci 14,7 g/l. Jeho koncentrace byla stanovena metodou elektroforézy a denzitometrie. Vzhledem k rozdílnosti metod stanovení polyklonálního imunoglobulinu IgM a monoklonálního imunoglobulinu IgM nejsou tyto číselné hodnoty porovnatelné. Volné lehké řetězce byly jen nepatrně zvýšené, κ 34,68 a λ 40,60 mg/l a jejich poměr byl v normě 0,85. Hodnota myoglobinu byla 250 µg/l (norma 25–58 µg/l), hodnota kreatinkinázy byla 12 µkat/l (norma 0,43–2,34 µkat).
Pro diferenciální diagnózu IgM gamapatie je vždy třeba histologické vyšetření kostní dřeně. Cytologické hodnocení aspirované kostní dřeně neumožní jednoznačně stanovit diagnózu lymfoplazmocytárního lymfomu. První pokus o provedení trepanobiopsie byl neúspěšný a byl provázen projevy zvýšené krvácivosti již při lokální anestezii. Odebraný vzorek nebyl reprezentativní.
Prodloužená hodnota APTT, údaje o zvýšené náchylnosti ke krvácení v anamnéze a zvýšené krvácení při první trepanobiopsii byly důvodem pro podrobnější došetření hemokoagulace.
Komplexní vyšetření nepotvrdilo deficit koagulačních faktorů, včetně faktorů fáze kontaktu (prekalikreinu a vysokomolekulárního kininogenu) či poruchu fibrinolýzy nebo primární hemostázy. Testy k vyloučení nespecifického inhibitoru vykazovaly nejednoznačné výsledky, přítomnost antifosfolipidových protilátek potvrzena jednoznačně nebyla. Na základě provedených testů se jako nejpravděpodobnější příčina prodlouženého APTT jevila přítomnost nespecifického inhibitoru způsobeného monoklonálním imunoglobulinem. V přítomnosti monoklonálního imunoglobulinu (paraproteinu) je tento typ inhibitoru popisován [4,5], specifické testy k jeho identifikaci však dostupné nejsou. Vzhledem k anamnéze krvácivých projevů a průkazu snížení generace trombinu dle trombin-generačního testu byla pacientka připravená k zákroku podáním čerstvé mražené plazmy a 2 ampulí Dicynonu.
Po této přípravě byla provedena trepanobiopsie s odebráním reprezentativního vzorku kostní dřeně bez jakýchkoliv komplikací. Histologicky byla v kostní dřeni detekována 10–30% lymfoplazmocytární infiltrace v nodulárních non-paratrabekulárních agregátech. Imunohistochemicky se jednalo o CD 20+, CD5-, CD23- cyklinD1-plazmocytoidní buňky IgM λ. V pozadí byly reaktivní mastocyty. Patolog nález hodnotil jako obraz infiltrace kostní dřeně lymfoplazmocytárním lymfomem. V rámci základního vyšetření bylo provedeno také PET-CT, které vyjma hraniční lymfadenopatie tříselných uzlin neodhalilo nic patologického. Výše uvedené nálezy naplnily kritéria symptomatické Waldenströmovy makroglobulinemie. Symptomem nemoci byla v tomto případě anémie, protože vyjma patologické infiltrace kostní dřeně nebyla odhalena jiná příčina anémie, a samozřejmě také myopatie.
Pacientku jsme léčili monoklonální protilátkou antiCD20 (Mabthera), cyklofosfamidem a dexametazonem (R-CD). Mabthera (rituximab) byla podávána v dávce 375 mg/m2 1krát měsíčně. Dexametazon byl podáván v dávce 20 mg/den 1.–4. den a 15.–18. den v 28denním cyklu. Cyklofosfamid byl podáván v dávce 500 mg/m2 infuze 1. a 15. den 28denního cyklu. Tato léčba byla plánována na 8 cyklů.
V průběhu léčby byly sledovány laboratorní parametry charakterizující aktivitu nemoci: koncentrace hemoglobinu, koncentrace monoklonálního imunoglobulinu, aktivita kreatinkinázy a koagulační parametry. V průběhu léčby byl zřetelný signifikantní pokles myoglobinu a hodnot kreatinkinázy (CK). Vývoj hodnot v průběhu léčby zobrazuje tab. 1.
Table 1. Vývoj laboratorních parametrů před léčbou a v průběhu 8 aplikací chemoterapie v režimu rituximab, cyklofosfamid a dexametazon 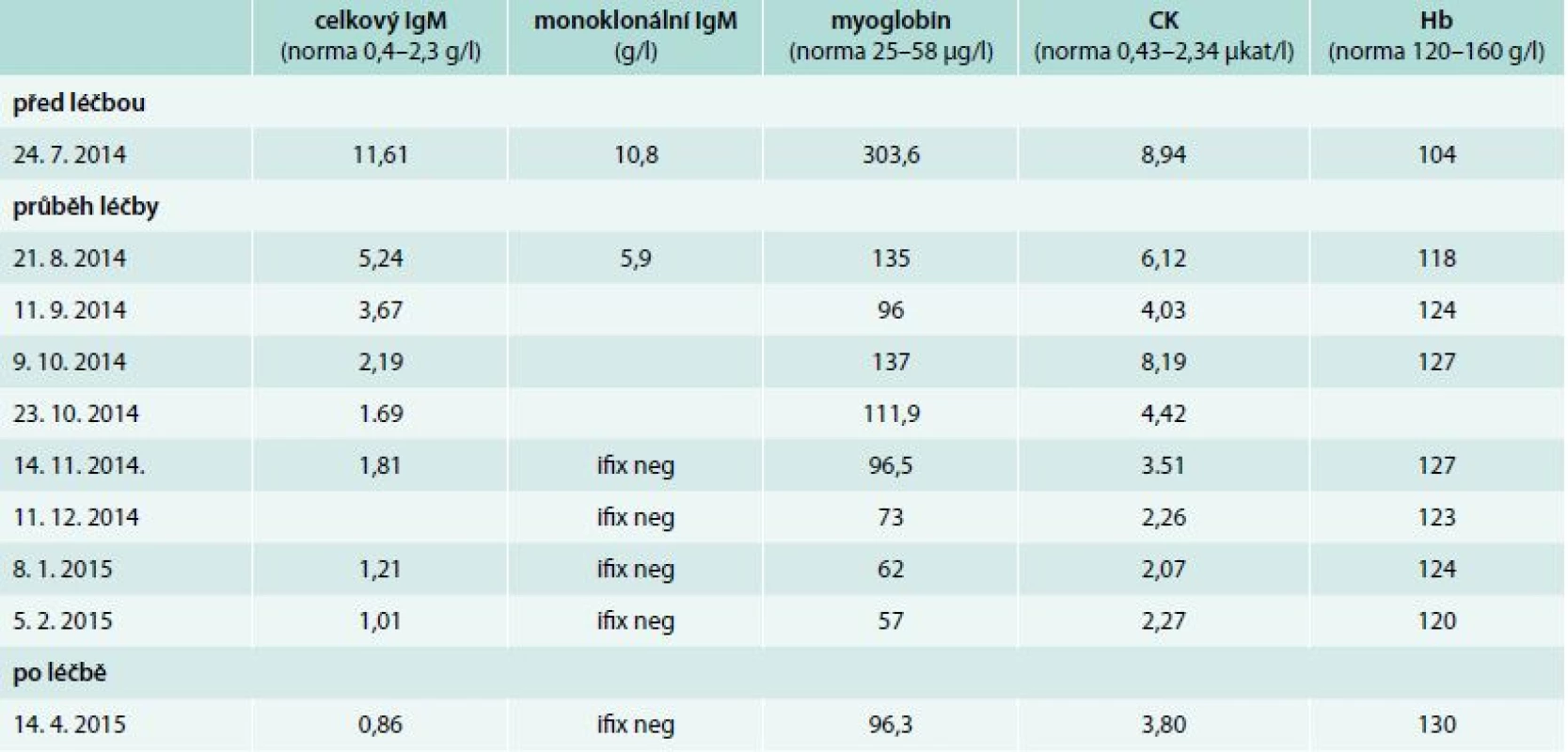
Ifix neg – negativní výsledek průkazu přítomnosti monoklonálního imunoglobulinu metodou imunofixace Po aplikaci 5 cyklů této léčby byla negativní imunofixace, takže koncentrace monoklonálního imunoglobulinu typu IgM klesla pod detekovatelné hodnoty a koncentrace myoglobinu i CK se dostala do fyziologického rozmezí. Rovněž dochází k normalizaci APTT, což potvrzuje hypotézu přítomnosti nespecifického inhibitoru vyvolaného přítomností monoklonálního imunoglobulinu. Subjektivní příznaky nemoci se také po 5 cyklech léčby minimalizovaly.
Při kontrole v dubnu roku 2015 zůstává negativní imunofixace, ale zvýšila se opět koncentrace myoglobinu a kreatinfosfokinázy. Nyní bude nemocná sledována zpočátku v měsíčních intervalech, později v delších. Vzhledem k mladému věku nemocné je naplánován v intervalu 3 měsíců od poslední chemoterapie sběr kmenových buněk krvetvorby z periferní krve. Sběr bude proveden po stimulaci leukocytárními růstovými faktory. V případě recidivy Waldenströmovy makroglobulinemie zvažujeme v rámci léčby druhé linie podání vysokodávkované chemoterapie s podporou transplantace autologních kmenových buněk krvetvorby.
Diskuse
Monoklonální imunoglobuliny jsou produkovány jedním klonem plazmocytů (monoklonální imunoglobuliny typu IgG, IgA, a vzácně pak ostatní) anebo lymfoplazmocytů (monoklonální imunoglobulin typu IgM). Ve většině případů se tyto monoklonální imunoglobuliny neváží na žádné tělu vlastní antigeny. U menšiny nemocných se monoklonální imunoglobuliny váží na některé tělu vlastní antigeny a mohou způsobovat klinické projevy autoimunity.
Je zjištěno, že podstatně častěji se na autoantigeny váží monoklonální imunoglobuliny typu IgM než monoklonální imunoglobulin typu IgG anebo IgA. Proto také monoklonální gamapatie nejistého významu typu IgM a Waldenströmova makroglobulinemie jsou častěji provázeny autoimunitními projevy, než je tomu v případě MGUS a mnohočetného myelomu non-IgM typu. Příčina vyšší frekvence autoimunitních projevů monoklonálních gamapatií typu IgM, než je u ostatních gamapatií, zatím čeká na vysvětlení.
Průkaz vazby monoklonálního imunoglobulinu na autoantigeny však ještě nemusí vždy znamenat klinicky zřetelné symptomy. Proto je četnost klinicky zřetelných autoimunitních chorob způsobených monoklonálním imunoglobulinem nižší než četnost průkazu přítomnosti monoklonálního imunoglobulinu, vázajícího se na autoautigeny. Bylo to prokázáno cílenou analýzou přítomnosti monoklonálních IgM autoprotilátek.
Jak častá je vazba monoklonální IgM protilátky na autoantigeny?
Carlizzi v roce 2007 uvádí, že vazbu monoklonálního imunoglobulinu typu IgM na nukleární antigeny detekoval u 1/3 vyšetřených osob. Pokud analyzovali pouze podskupinu osob starších 60 let, tak monoklonální protilátky typu IgM, vázající se na nukleární antigeny, prokázal u 40 % případů [6]. Klinické symptomy odpovídající přítomnosti antinukleárních protilátek však detekoval pouze u 1 osoby. Pozitivita průkazu antinukleárních protilátek byla závislá na volbě testu pro jejich průkaz [6].
Vazba monoklonálního imunoglobulinu typu IgM na jeden či více autoantigenů byla prokázána u 71 % ze 172 osob s IgM monoklonální gamapatií. Jednalo se o analýzu velmi širokého spektra autoprotilátkové aktivity. Vazbu monoklonálního imunoglobulinu na jaderné antigeny (antinukleárním protilátky) mělo 11 % vyšetřených [7]. V této práci ale není uvedeno, jak časté byly klinické projevy těchto autoprotilátek. Uvedené práce tedy signalizují, že u pacientů s monoklonálním imunoglobulinem, zvláště jedná-li se o imunoglobulin typu IgM, musíme vždy myslet na možnost jeho autoimunitní aktivity. Stone v roce 2005 uvádí přehled antigenů, na které byla prokázána vazba monoklonálního imunoglobulinu [8]. Jsou to sumarizované informace z různých publikací, které popisovaly vazbu monoklonálního imunoglobulinu u osob s Waldenströmovou makroglobulinemií a s mnohočetným myelomem. Tab. 2 ilustruje, že vyjma relativně známých projevů vazby monoklonálního imunoglobulinu na autoantigeny, jako je nemoc chladových aglutininů, smíšená kryoglobulinemie a neuropatie, se můžeme setkat s klinickými důsledky vazby na kterýkoliv antigenů uvedených v tabulce včetně antigenů svalových vláken.
Table 2. Přehled všech možných vazeb monoklonálního imunoglobulinu na autoantigeny 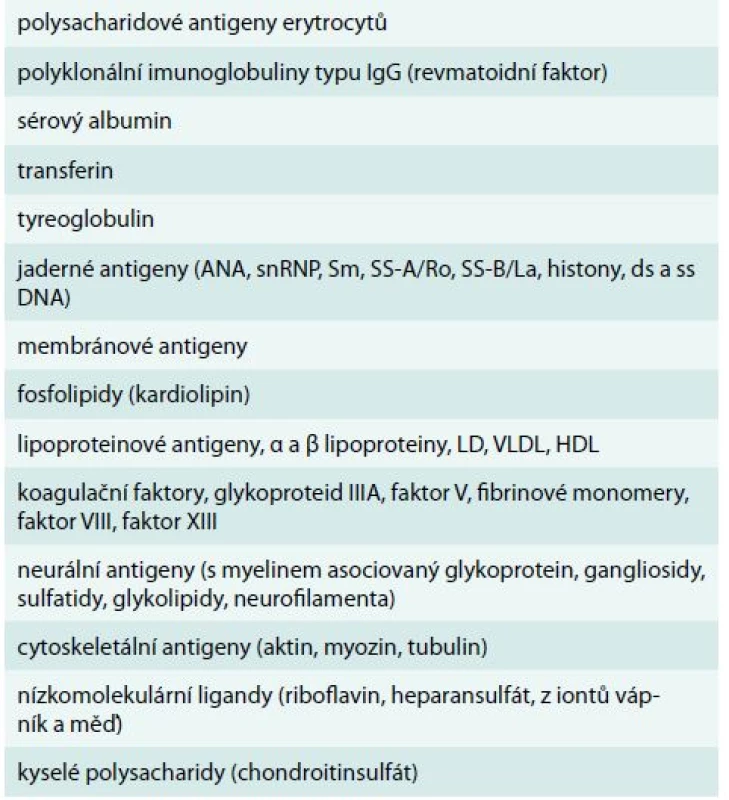
Jak častá je klinická manifestace autoimunitní aktivity monoklonálního imunoglobulinu?
V recentní literatuře lze nalézt 2 práce hodnotící výskyt autoimunitních poruch u pacientů s Waldenströmovou makroglobulinemií. V malém souboru 12 pacientů s Waldenströmovou makroglobulinemií byly autoimunitní projevy prokázány u více než u 1/2 pacientů (57 %). Jednalo se o Hashimotovu tyreoiditidu, perniciózní anémii, imunitní trombocytopenii, nemoc chladových aglutininů, chronickou demyelinizační neuropatii, polymyalgia rheumatica a temporální artritidu [9,10].
Podobné údaje, ale na větším souboru, zjistili dánští autoři, kteří provedli analýzu celkem 57 pacientů s Waldenströmovou makroglobulinemií. Jejich výsledky jsou natolik zajímavé, že je uvádíme v tab. 3. V jejich souboru byla nejčastější na Coombsův test pozitivní autoimunitní hemolytická anémie (AIHA) – 16 %, séropozitivní revmatoidní artritida (16 %) a žaludeční vřed spojený s přítomností protilátky proti parietálním buňkám bez přítomnosti perniciózní anémie [11]. Manifestace autoimunity byla prokázána u 29 z 57 vyšetřovaných, z toho ve 20 případech se současně vyskytly nejméně 2 autoimunitní projevy a v 9 případech jen jeden autoimunitní projev. Jedna manifestace byla častější u mužů, více než jedna manifestace byla častější u žen [11]. Z pohledu četnosti autoimunitních projevů monoklonálního imunoglobulinu je můžeme rozdělit na vzácné a velmi vzácné. Mezi časté a tedy nejznámější autoimunitní vazby monoklonálního imunoglobulinu patří 3 klinické jednotky, které uvádíme dle historického vývoje jejich poznání.
Table 3. Frekvence autoimunitního poškození orgánů a tkání monoklonálním imunoglobulinem typu IgM v souboru 57 pacientů s Waldenströmovou chorobou. Upraveno podle [11] ![Frekvence autoimunitního poškození orgánů a tkání monoklonálním imunoglobulinem typu IgM v souboru 57 pacientů s Waldenströmovou chorobou. Upraveno podle [11]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/331d7a7beae4666d64e78dbdf02cfd34.jpg)
Nemoc chladových aglutininů
První popis této nemoci je z 50. let minulého století [12]. K vazbě monoklonálního imunoglobulinu dojde až při poklesu teploty cirkulující krve pod určitou kritickou hodnotu. Navázání monoklonálního imunoglobulinu na erytrocyty nastartuje hemolyzující aktivitu komplementu. Komplement tuto svoji destrukční aktivitu dokončí, i když se při zvýšení teploty z erytrocytu uvolní navázaný monoklonální imunoglobulin. Intenzita hemolýzy v případě nemoci chladových aglutininů je podstatně vyšší, než u případů přechodného výskytu polyklonálních chladových aglutininů po infekci mycoplasma pneumoniae [13].
Kryoglobulinemie
V 60. letech 20. století byla poprvé popsána smíšená kryoglobulinemie s vysokými titry revmatoidního faktoru (RF) u pacientů s Waldenströmovou makroglobulinemií [14]. Podstatou je vazba monoklonálního imunoglobulinu typu IgM (monoklonálního RF) na Fc fragment polyklonálních imunoglobulinů typu IgG. Ke kryoprecipitaci dochází i pro limitovanou rozpustnost komplexu IgM-IgG. Později, až v roce 1990, byla prokázána výrazná asociace nemoci smíšené kryoglobulinemie s hepatitidou C.
Za kryoglobulinemii typu I je označována klinická porucha, při níž je kryoglobulin tvořen pouze IgM imunoglobulinem, tzv. monokomponentní kryoglobulin. Kryoglobulin IgM typu I se neváže na polyklonální imunoglobuliny typu IgG, a tedy netvoří revmatoidní faktor. Vyšetřením revmatoidního faktoru lze tyto 2 typy kryoglobulinemie od sebe odlišit. Kryoglobulinemie byla v české literatuře popsána opakovaně [15,16].
Neuropatie
Neuropatie často provázejí přítomnost monoklonálního imunoglobulinu jak u osob s MGUS, tak u osob s Waldenströmovou makroglobulinemií. Souvislost neuropatie s monoklonálním imunoglobulinem byla popsána poprvé v roce 1979 [17]. V současnosti je známo nejméně 5 antigenů, na něž se může vázat monoklonální IgM (s myelinem asociovaný glykoproteid – demyelinizační senzomotorická neuropatie, sulfamid – demyelinizační, převážně senzorická neuropatie, CD1b gangliosid – demyelinizační senzorická neuropatie, GM1 gangliosid – progresivní motorická neuropatie, trisulfát heparin disacharid – bolestivá převážně senzorická neuropatie).
Velmi vzácně se vyskytující autoimunitní projevy monoklonálních imunoglobulinů
V tab. 4 uvádíme výčet autoimunitních projevů monoklonálních imunoglobulinů, převážně ty, s nimiž jsme se již setkali na našem pracovišti v průběhu poslední 24 let [18–24]. V literární databázi Medline lze nalézt podstatně více různých typů vzácných autoimunitních projevů monoklonálního imunoglobulinu, než zde uvádíme. Jedině současným vyšetřením ionizovaného kalcia a celkového kalcia můžeme dojít k podezření na pseudohyperkalcemii způsobenou vazbou kalcia monoklonálním imunoglobulinem od opravdové hyperkalcemie [25–27]. Tab. 2 se spektrem popsaných antigenů, na něž byla prokázána vazba monoklonálního imunoglobulinu, dává tušit, že spektrum velmi vzácných projevů autoimunitní aktivity monoklonálního imunoglobulinu je nezměrně pestré.
Table 4. Přehled nemocí, které mohou způsobit molekuly monoklonálního imunoglobulinu 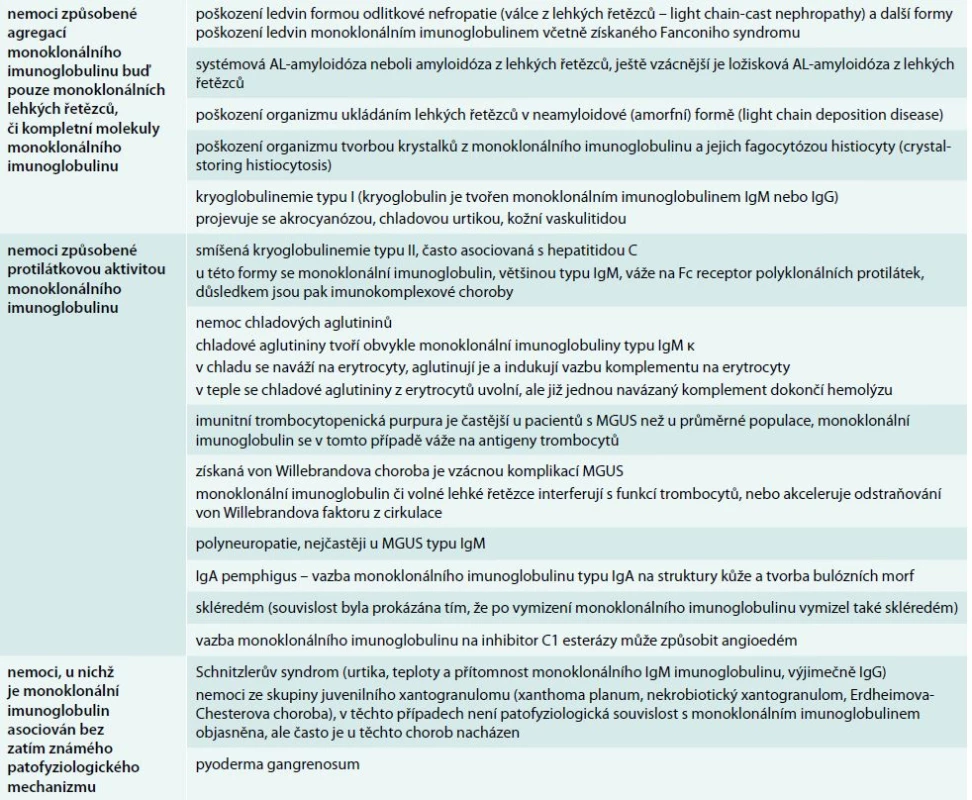
Myopatie při monoklonální gamapatii
S postižením svalové tkáně při monoklonální gamapatii jsme se na našem pracovišti setkali v průběhu 25 let práce naší myelomové ambulanci poprvé.
Při pohledu do literatury je zřejmé, že tento typ poškození organizmu monoklonálním imunoglobulinem je popisován i ve světové literatuře relativně vzácně, ale jak dokladuje náš případ i citovaná literatura, monoklonální imunoglobulin může ve velmi vzácných případech poškozovat příčně pruhovanou svalovinu [28–33].
Vazbu monoklonálního imunoglobulinu na svalová vlákna nemáme laboratorně prokázanou. Nicméně z faktu, že při poklesu koncentrace monoklonálního imunoglobulinu při léčbě došlo jak ke zvýšení koncentrací hemoglobinu (vymizení anémie), tak k poklesu koncentrace kreatinkinázy (CK) a myoglobinu, usuzujeme na kauzální souvislost mezi monoklonálním imunoglobulinem a myopatií.
Jakou léčbu zvolit?
Léčba Waldenströmovy choroby a chorob způsobených monoklonálním imunoglobulinem typu IgM je podrobně popsána v doporučení České myelomové skupiny z roku 2014 [34] a v mezinárodních doporučeních [35]. Morbus Waldenström má relativně příznivou prognózu (tab. 5) a tomu musí odpovídat i míra agresivity léčby [36]. Je z ní patrné, že u mladších pacientů je prognóza podstatně příznivější než u pacientů starších a že zásadní vliv na celkový medián přežití mají úmrtí z jiné příčiny než je Waldenströmova makroglobulinemie. Při použité chemoterapii v režimu cyklofosfamid, dexametazon a rituximab neměla nemocná žádnou nauzeu, vlasy nebyly touto léčbou poškozené a pacientka zvládla tuto léčbu bez přerušení zaměstnání, takže tato léčba neměla zásadní negativní vliv na kvalitu jejího života.
Table 5. Analýza skupiny 5 784 pacientů s Waldenströmovou makroglobulinemií. 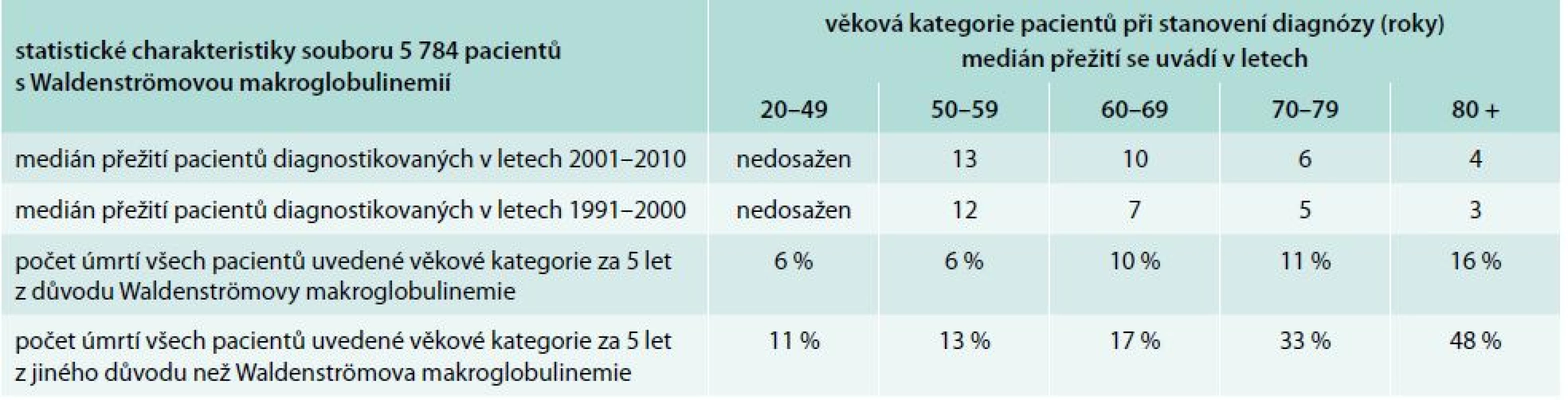
Medián sledování skupiny pacientů z let 1991–2000 byl 13 let. Medián sledování pacientů ve skupině 2001–2010 byl 5 let. Medián přežití všech pacientů v letech 1991–2000 byl 6 let. Medián přežití všech pacientů v letech 2001–2010 byl vypočítán na 8,2 roku (p < 0,001). Dále jsou uvedeny mediány přežití v jednotlivých věkových kategoriích a kumulativní incidence úmrtí z důvodu Waldenströmovy nemoci anebo z důvodů jiných v průběhu 5 let [36]. Závěry pro praxi
Monoklonální imunoglobulin typu IgM může mít velmi pestré autoimunitní projevy. Poškození příčně pruhovaných svalů je jednou z vzácných projevů přítomnosti monoklonálního imunoglobulinu.
Diferenciální diagnostika nejasného poškození orgánů a tkání by vždy měla obsahovat vyšetření přítomnosti monoklonálního imunoglobulinu (imunofixační elektroforézu) a při prokázání monoklonálního imunoglobulinu by se měla hledat souvislost.
Při potlačení tvorby monoklonálního imunoglobulinu dojde i k vymizení jeho případných autoimunitních projevů.
Text byl vytvořen na podporu následujících aktivit: MZ ČR – RVO (FNBr, 65269705), MUNI/A/0830/2014, NT12130 a NT 14575.
Doručeno do redakce 3. 12. 2014
Přijato po recenzi 20. 4. 2015
prof. MUDr. Zdeněk Adam, CSc.
z.adam@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice
www.fnbrno.cz
Sources
1. Dighiero G, Guilbert B, Fermand JP et al. Thirty-six human monoclonal immunoglobulins with antibody activity against cytoskeleton proteins, thyroglobulin, and native DNA: immunologic studies and clinical correlations. Blood 1983; 62(2): 264–270.
2. Avrameas S, Guilbert B, Dighiero G. Natural antibodies against tubulin, actin myoglobin, thyroglobulin, fetuin, albumin and transferrin are present in normal human sera, and monoclonal immunoglobulins from multiple myeloma and Waldenström’s macroglobulinemia may express similar antibody specificities. Ann Immunol (Paris) 1981; 132C(2): 231–236.
3. Al-Lozi M, Pestronk A. Organ-specific autoantibodies with muscle weakness. Curr Opin Rheumatol 1999; 11(6): 483–488.
4. Bulikova A, Smejkal P, Zavřelová J at al. Získané inhibitory krevního srážení. Interní medicína pro praxi 2008; 10(7): 336–339.
5. Triplett DA. Use of the dilute Russell viper venom time (dRVVT): its importance and pitfalls. J Autoimmun 2000; 15(2): 173–178.
6. Carlizzi G, Ciarla MV, Diluzio A et al. Autoantibodies in patients with monoclonal gammopathies. Ann N.Y. Acad Sci 2007; 1107 : 206–211.
7. Stone MJ, McElroy A, Pestronk P et al. Human monoclonal macroglobulins with anbody activity. Semin Oncol 2003; 30(2): 318–324.
8. Stone MJ, Marlini V, Pascual P. Autoantibody activity in Waldenström´s macroglobulinaemia. Clin Lymphoma 2005; 5(4): 225–229.
9. Antienza J, Bockorn B, Dadla A et al. Inflammatory and immune-releated condition associated with Waldenström´s macroglobulinemia. A single center experience. Leukemia and Lymphoma 2015; 56(4): 1179–1180.
10. Ansell SM. Waldenström Macroglobulinemia and autoimmunity: what´s the connection? Leukemia Lymphoma 2015; 56(4): 845–846.
11. Jonsson V, Kierkegaard A, Salling S et al. Autoimmunity in Waldenström´s macroglobulinemia. Leukemia Lymphoma 1999; 34(3–4): 373–379.
12. Christenson W, Dacie J. Serum proteins in acquired hemolytic anemia (autoantibody type). Brit J Haematol 1957; 3(2): 153–164.
13. Adam Z, Pejchalová A, Chlupová G. Nemoc chladových aglutininů nereagující na léčbu glukokortikoidy a na léčbu rituximabem. Jaký postup zvolit pro třetí linii léčby? Popis případu a přehled literatury. Vnitř Lék 2013; 59(9): 828–840.
14. Kritzman J, Kunkel H, McCarthy J et al. Studie of a Waldenström-type macroglobulinemia with revmatoid factor properties. J Lab Clin Med 1961; 57 : 905–917.
15. Adam Z, Králová E. Kryoglobulinémie – první příznak mnohočetného myelomu. Klin Onkol 1992; 5(5): 147–148.
16. Husa P, Adam Z, Husová E et al. Léčba chronické infekce virem hepatitidy C pegylovaným interferonem a ribavirinem u pacienta se smíšenou kryoglobulinémií. Vnitř Lék 2005; 51(2): 238–243.
17. Dellagi K, Brouet J Danon F. Gross idiotype antigens among monoclonal imunoglobulin M from patients with Waldenström´s macroglobulinemia and polyneuropathy. J Clin Incest 1979; 64(5): 1530–1534.
18. Adam Z, Šmardová J, Ščudla. V Waldenströmova makroglobulinemie – klinické projevy, diferenciální diagnostika a prognóza nemoci. Vnitř Lék 2007; 53(12): 1325–1337.
19. Adam Z, Pour L, Krejčí M et al. Poškození ledvin při mnohočetném myelomu a dalších monoklonálních gamapatiích. Vnitř Lék 2008; 54(9): 847–861.
20. Adam Z, Krejčí M, Pour L et al. Schnitzlerův syndrom – popis čtrnáctiletého průběhu nemoci a přehled informací o této nemoci. Vnitř Lék 2008; 54(12): 1140–1153.
21. Adam Z, Feit J, Krejčí M et al. IgA pemphigus provázející mnohočetný myelom vymizel při léčbě bortezomibem (Velcade), cyklofosfamidem a dexametazonem. Popis případu a přehled literatury. Vnitř Lék 2009; 55(10): 981–991.
22. Adam Z, Zahradová L, Krejčí M et al. Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET-CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případ a přehled literatury. Vnitř Lék 2010; 56(11): 1159–1168.
23. Adam Z, Szturz P, Pour L et al. Kožní projevy monoklonálních gamapatií, zkušenosti jednoho pracoviště. Čes Dermatoven 2011; 1(2): 30–37.
24. Szturz P, Adam Z, Vašků V et al. Complete remission of multiple myeloma associated sclerodema after bortezomib-based treatment. Leuk Lymphoma 2013; 54(6): 1324–1326.
25. Mak WM, Chen PL, Lee K. Misleading hypercalcaemia in a patient with Waldenstrom’s macroglobulinaemia. Br J Biomed Sci 2011; 68(4): 210–212.
26. Elfatih A, Anderson NR, Fahie-Wilson MN et al. Pseudo-pseudohypercalcaemia, apparent primary hyperparathyroidism and Waldenström’s macroglobulinaemia. J Clin Pathol 2007; 60(4): 436–437.
27. Side L, Fahie-Wilson MN, Mills MJ. Hypercalcaemia due to calcium binding IgM paraprotein in Waldenström’s macroglobulinaemia. J Clin Pathol 1995; 48(10): 961–962.
28. al-Lozi MT, Pestronk A, Yee WC et al. Myopathy and paraproteinemia with serum IgM binding to a high-molecular-weight muscle fiber surface protein. Ann Neurol 1995; 37(1):41–46.
29. Bakri K, Haydar AA, Davis J et al. Waldenström’s macroglobulinaemia presenting as isolated epistaxis: a common complaint but a rare cause. Int J Clin Pract 2004; 58(1): 81–82.
30. Deconinck N, Laterre EC, Van den Bergh PY. Adult-onset nemaline myopathy and monoclonal gammopathy: a case report. Acta Neurol Belg 2000; 100(1): 34–40.
31. Eymard B, Brouet JC, Collin H et al. Late-onset rod myopathy associated with monoclonal gammopathy. Neuromuscul Disord 1993; 3(5–6): 557–560.
32. Islam A, Myers K, Cassidy DM et al. Muscle Involvement in Multiple Myeloma: Report of a Patient Presenting Clinically as Polymyositis. Hematology 1999; 4(2):123–125.
33. Keller CE, Hays AP, Rowland LP et al. Adult-onset nemaline myopathy and monoclonal gammopathy. Arch Neurol 2006; 63(1): 132–134.
34. Bockorny B, Atienza J, Dasanu CA. Autoimmune manifestation in patients with Waldenström macroglobulinemia. Clin Lymphoma Myeloma Leuk 2014; 14(6): 456–549.
35. Adam Z, Hájek R, Krejčí M et al. Diagnostika a léčba Waldenströmovy makroglobulinémie. Transfuze a hematologie dnes 2014; 20(Suppl): 7–22.
36. Dimopoulos MA, Gastritis E, Owen RG et al. Treatment recommendation for patients with Waldenström macroglobulinemia and releated disorders. Blood 2014; 124(9): 1404–1411.
37. Castillo JJ, Olszewski AJ, Kanan S et al. Overall survival and competing risks of death in patients with Waldenström macroglobulinaemia: an analysis of the Surveillance, Epidemiology and End Results database. Br J Haematol 2015; 169(1): 81–89.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 9-
All articles in this issue
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Sekundární humorální imunodeficience u nemocných se systémovým lupus erythematodes
- Má věk nemocných s chronickou myeloidní leukemií při léčbě imatinibem vliv na dosaženou léčebnou odpověď?
- Role metabolického syndromu v gastroenterologii
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Změny stravovacích návyků ve vztahu k rizikovým faktorům a kardiovaskulární mortalitě
-
Myopatie při Waldenströmově makroglobulinemii.
Popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů typu IgM
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Sekundární humorální imunodeficience u nemocných se systémovým lupus erythematodes
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

