-
Medical journals
- Career
Hepatorenální syndrom – patofyziologie, diagnostika a léčba
Authors: Vladimír Hrabovský; Alice Mendlová; Terezie Vavříčková
Authors‘ workplace: Interní klinika LF OU a FN Ostrava, přednosta doc. MUDr. Arnošt Martínek, CSc.
Published in: Vnitř Lék 2015; 61(7-8): 649-654
Category: Reviews
Overview
Hepatorenální syndrom je život ohrožující komplikace jaterních chorob. Jedná se o funkční postižení ledvin, které se vyskytuje jak u akutních (typ I), tak i chronických (typ II) onemocnění jater a je spojeno s vysokou mortalitou. Léčba má omezené možnosti, ale podávání vazopresorů (terlipresin), albuminu a portosystémový shunt dokážou prognózu zlepšit. Transplantace jater je léčbou nejefektivnější. Autoři prezentují aktuální data o této problematice včetně doporučení pro léčebnou praxi.
Klíčová slova:
albumin – hepatorenální syndrom – jaterní cirhóza – terlipresinÚvod
Hepatorenální syndrom (HRS) je život ohrožující stav charakterizovaný funkčním poškozením ledvin u pacientů s akutním nebo chronickým jaterním poškozením. Jeho základním rysem je přítomnost jaterní léze spolu s dalšími atributy, kterými jsou portální hypertenze, (refrakterní) ascites a zejména nepřítomnost jiného patologického stavu, který by vysvětloval alteraci ledvinných funkcí. Prognóza onemocnění je velmi špatná a zatížená vysokou mortalitou [1]. Rozlišujeme 2 typy HRS: akutní typ I a chronický typ II. Stručná charakteristika je uvedena v tab. 1.
Table 1. Základní rozdělení a charakteristika hepatorenálního syndromu 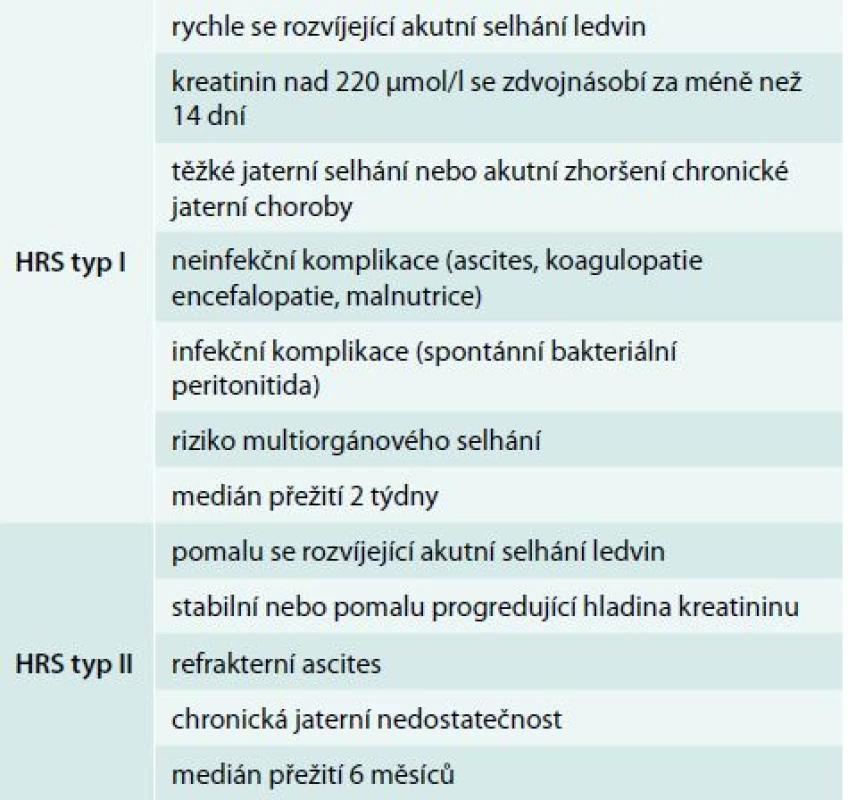
Incidence onemocnění se v případě chronického jaterního onemocnění uvádí v rozmezí 10–40 %. Přibližně u 8–20 % cirhotiků s ascitem se rozvine HRS během 1. roku od stanovení diagnózy a u 40 % z nich pak do 5 let [2]. Hodnocení incidence v případě akutní formy HRS je ale obtížné. U pacientů s cirhózou může dojít zejména při infekčních komplikacích nebo příliš razantní diuretické léčbě k rozvoji HRS, který má charakter typu I. Během fulminantního selhání jater je pak celkový stav pacienta ovlivněn mnoha dalšími faktory: hypoxie, toxické vlivy terapie, kontrastní látky, SIRS (systemic inflammatory response syndrome)/sepse, takže zařadit nemocného do HRS je velmi obtížné. Není tedy překvapivé, že incidence akutního HRS není přesně známá.
Historie HRS sahá do 19. století, kdy se objevují první zmínky o hemodynamických změnách a poruchách diurézy bez přítomnosti proteinurie u nemocných s chronickým jaterním onemocněním (Frerichs v roce 1877). Přibližně od poloviny minulého století se přestal termín hepatorenální syndrom používat pro označení simultánního poškození jater a ledvin. Jednou z nejvýznamnějších prací té doby, ve které se podařilo poprvé systematicky popsat cirkulační a metabolické změny u HRS, publikovali Hecker a Sherlock v roce 1956 [3]. Na retrospektivně studovaném souboru pouhých 9 pacientů odvodili souvislosti, které byly potvrzeny o půl století později. Právem byla tato práce zařazena mezi Milestones in liver disease, tedy nejvýznamnější milníky v hepatologii [4]. Funkční povaha onemocnění byla v průběhu dalších let potvrzena tím, že ledviny těchto pacientů nevykazují anatomické odchylky v sekčních nálezech [5], jsou transplantabilní [6] a porucha jejich funkce odezní po úspěšné ortotopické transplantaci jater (orthotopic liver transplantation – OLT) [7].
Patogeneze
Patogeneze hepatorenálního syndromu není stále jednoznačně objasněna. Je samozřejmě bezprostředně spjata s projevy základního jaterního onemocnění, zejména s průvodními změnami hemodynamiky a narušenou rovnováhou vodně-minerálního hospodářství [8]. Typickým projevem jaterní insuficience je hyperkinetická cirkulace (nízký krevní tlak a vysoká tepová frekvence) se zvýšením minutového srdečního výdeje. Je to důsledek snížené periferní cévní rezistence, kterou způsobuje nadprodukce některých vazodilatačních látek (oxid dusnatý, prostacykliny, kininy). Jejich zvýšená hladina byla u těchto nemocných opakovaně prokázána [9–11]. Nerovnováha mezi kapacitou cévního řečiště a jeho náplní vede k poklesu efektivního plazmatického objemu (EPV) a aktivaci regulačních mechanizmů [12]. Jejich cílem je udržet normální hodnoty systémového tlaku a perfuzi orgánů a tkání. Organizmus k regulaci EPV využívá několik mechanizmů. Jsou to zejména systém renin-angiotenzin-aldosteron (RAAS), sympatický nervový systém (SNS), antidiuretický hormon (ADH) a atriální natriuretický peptid (ANP). Z podstaty účinku výše uvedených regulátorů vyplývá, že v regulaci stability vnitřního prostředí mají u HRS zásadní postavení také ledviny. V souhrnu lze konstatovat, že důsledkem popsaných změn je renální vazokonstrikce, pokles glomerulární filtrace (GF), rozvoj oligoanurického selhání ledvin a zvýšená retence sodíku a vody. Vzniká hyperhydratace, otoky a pro HRS typický ascites.
Regulační mechanizmy vstupující do patogeneze HRS jsou shrnuty v tab. 2. Zvýšená aktivita sympatiku, spouštěná cévními baroreceptory, způsobuje mimo jiné zvýšený tonus renálních arterií s následným poklesem GF a vylučování sodíku. Současně zvyšuje sekreci reninu z juxtaglomerulárního aparátu ledvin, a tím aktivuje RAAS. Systém renin-angiotenzin-aldosteron je nejvýznamnějším regulátorem krevního tlaku a vodně-minerálního hospodářství a kromě SNS ho aktivují také impulzy z ledvin (juxtaglomerulární aparát a macula densa). Účinek angiotenzinu, respektive angiotenzinu II (AT-II) na jeho receptor AT1 vede k systémové vazokonstrikci za účelem udržení normálního krevního tlaku a ke zvýšení srdeční kontraktility. Vazokonstrikce v ledvinách však snižuje GF a v kombinaci s účinkem AT-II na ledvinné transportní funkce vede ke zvýšené reabsorpci natria. Tento metabolický efekt potencuje navíc jeho aktivační vliv na syntézu aldosteronu a ADH. Antidiuretický hormon je za normálních podmínek uvolňován z neurohypofýzy v reakci na změny osmolality krevní plazmy. Jeho hlavním působením je zpětná absorpce vody a také sodíku v ledvinách. Stimulace cestou RAAS je tedy neosmotická.
Table 2. Hlavní regulační mechanizmy v patofyziologii HRS 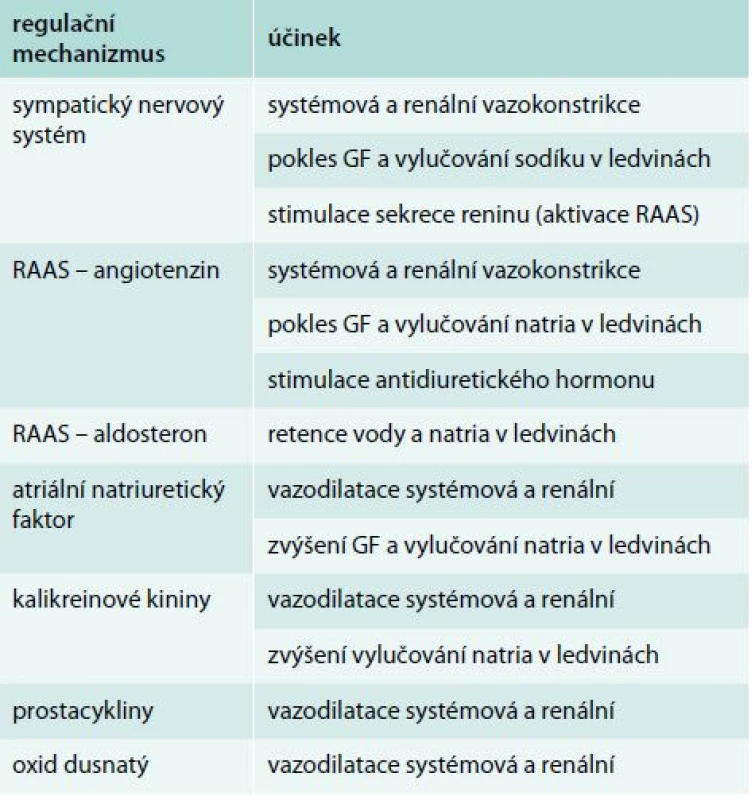
GF – glomerulární filtrace RAAS – systém renin-angiotenzin-aldosteron V protikladu s uvedenými vazokonstrikčními a antidiuretickými faktory působí látky opačného účinku, tedy vazodilatační nebo podporující diurézu. Natriuretické peptidy představují asi nejvýznamnější představitele. V současné době známe atriální natriuretický peptid (ANP), mozkový natriuretický peptid (brain natriuretic peptid – BNP), natriuretický peptid C (CNP) a urodilatin. Z pohledu tohoto sdělení je vhodné zmínit účinky ANP, který je syntetizován a následně uvolňován z myocytů srdečních síní v reakci na jejich dilataci s cílem podpořit diurézu a vylučování sodíku. Má významný vazodilatační efekt. Zjednodušeně se dá také říct, že co v ledvinách AT-II stimuluje, to ANP inhibuje. Významnou roli hraje také skupina proteinů, peptidů a enzymů kalikrein-kininového systému. Stimulace bradykininových receptorů B1 aktivními kininy (bradykinin, kalidin) způsobuje vazodilataci, aktivaci monocytů a makrofágů a stimuluje pocit bolesti. Účinek na B2 receptory stimuluje nejen vazodilataci, ale také natriurézu. Prostaglandiny představují skupinu látek lipofilní povahy s autokrinními a parakrinními účinky téměř ve všech lidských tkáních. Podskupina tak zvaných prostacyklinů je syntetizována v cévní stěně a má významné vazodilatační účinky, včetně ledvin. U pacientů s cirhózou jater byly zjištěny zvýšené hladiny cirkulujícího prostacyklinu I2 (PGI2), což je dáváno do patofyziologických souvislostí s dilatací cév u jaterních chorob a následnou hyperkinetickou cirkulací [9]. Oxid dusnatý (NO), též někdy zvaný endoteliální relaxační faktor (EDRF) je další významnou substancí, která hraje roli v problematice HRS. NO je uvolňován z endotelu a tato reakce je zprostředkovaná enzymem endoteliální NO-syntetázou (eNOs). Stejně jako u prostaglandinů podporuje nadprodukce NO rozvoj nepřiměřené arteriální vazodilatace a také hyperkinetické cirkulace [10,11]. Současně se zdá, že zvýšená produkce NO je také zodpovědná za sníženou odpověď organizmu na podávání vazopresorů [13].
Hlavním patofyziologickým rysem HRS je tedy snížená periferní cévní rezistence, renální vazokonstrikce s poklesem GF a zvýšená retence natria a vody. V minulosti se objevilo několik hypotéz, které se snažily tyto změny vysvětlit. Bohužel ani v současnosti neexistuje jediná ucelená, která by shrnula všechna aktuálně známá data. V 50. a 60. letech 20. století se objevily první snahy. Tzv. underfill a overflow hypotézy vycházely z předpokladu, že základním problémem je buď portální hypertenze a ascites stimulující kompenzační mechanizmy v prvním případě [14] anebo v případě druhém hypervolemie z důvodu primárně zvýšené retence sodíku a vody, která indukuje otoky a oběhové změny ve splanchnickém řečišti [15]. Pro dnešní znalosti jsou však již nedostatečné. Třetí, tzv. vazodilatační teorie z 80. let minulého století spojila obě předchozí a je stále akceptovaná [12]. Poukazuje na typickou periferní cévní dilataci a pokles efektivního plazmatického objemu. Tím vzniká underfill a po zapojení kompenzačních mechanizmů s retencí vody overflow. Otoky a renální vazokonstrikce jsou pak další důsledky výše uvedeného.
Nicméně patofyziologie HRS je stále otevřenou otázkou. Je nutno brát v úvahu další vlivy, které mohou hrát v této problematice roli. Stále není jasné, proč se v závislosti na přítomnosti ascitu liší u cirhotiků reakce na změnu polohy těla. Zatímco bez ascitu dochází k reakci fyziologické, u pacientů s ascitem přetrvává aktivace kompenzačních mechanizmů i vleže [16]. Současně je snížená odpověď ledvin na zvýšeně vylučovaný ANP [17].
Tzv. hepatorenální reflex, zprostředkovávaný sympatickým nervovým systémem, je dalším faktorem, který je akceptován v procesu rozvoje HRS [18]. V souvislosti se zavedením transjugulárního intrahepatalního portosystémového shuntu (TIPS) do praxe se totiž prokázalo, že úprava portální hypertenze (musí být sinusoidální) může mít příznivý vliv na renální průtok. Výsledky nejsou jednoznačné, často je však hepatorenální reflex stavěn do pozice hlavního patofyziologického mechanizmu HRS [19,20].
V neposlední řadě nelze u pacientů s jaterním onemocněním zapomenout na vliv cirhotické kardiomyopatie. Poškození myokardu a rozvoj diastolické nebo systolické dysfunkce s následnou aktivací regulačních mechanizmů byl u těchto nemocných rovněž opakovaně zdokumentován [21].
Diagnostika a diferenciální diagnostika
Diagnostický proces u HRS se opírá o komplexní zhodnocení anamnézy a laboratorní analýzu jaterních a ledvinných funkcí. Anamnesticky pátráme po příčinách vzniku akutního či chronického jaterního onemocnění. Informace z oblasti farmakologické, toxikologické i z osobní anamnézy mohou významně pomoci při hodnocení aktuální situace a stratifikaci dalších rizik. Nedílnou součástí je samozřejmě kvalitní zhodnocení stavu, ve kterém se nemocný nachází ve chvíli vyšetření/přijetí, včetně fyzikálního vyšetření (stav vědomí, hydratace, kožní změny, poruchy orgánových systémů). Z důvodu špatné prognózy HRS je nutno mít na paměti, že včasná diagnostika příčiny stavu je zcela zásadní pro osud nemocného.
Laboratorní testy a provedení zobrazovacích vyšetření jsou zaměřeny jednak na zhodnocení status quo a současně směřují k již zmiňované snaze o rychlé zjištění etiologie. Je třeba se ale vyvarovat (pokud lze) použití kontrastních látek z důvodu rizika postkontrastního poškození ledvin. V obecné rovině lze říct, že u pacientů s HRS budou dominovat známky poškození syntetických, exkrečních a detoxikačních funkcí jater různého stupně. Z hlediska ledvin je typický obraz oligoanurického selhání se zvýšenou hladinou kreatininu a moč bude koncentrovaná, bez proteinurie či erytrocyturie. Pro diagnózu HRS je pak zásadní nepřítomnost jiného onemocnění, které by vysvětlovalo ledvinnou dysfunkci. Platná diagnostická kritéria HRS podle International Ascites Club shrnuje [22], tab. 3
Table 3. Diagnostická kritéria hepatorenálního syndromu dle International Ascites Club (2007) 
Diferenciální diagnostika je zaměřena na vyloučení takových nozologických jednotek a stavů, u kterých dochází k paralelnímu poškození jater a ledvin (infekční, metabolická, toxická, imunologická a gestační onemocnění). V případě jejich přítomnosti je diagnóza HRS vyloučena.
Léčba
Nejefektivnějším léčebným opatřením u HRS je transplantace jater. Tato metoda, která by možná měla být na vrcholu pomyslné léčebné pyramidy, je totiž ve světle špatné prognózy onemocnění nejúčinnější [23]. Problémem však zůstává obecná dostupnost vhodných dárců. Péče o nemocné s HRS proto musí být vždy komplexní a v konečném důsledku maximální tak, aby umožnila se výkonu dožít, pokud je samozřejmě indikován. To platí bez výjimky zejména pro HRS typu I. V tomto případě je nezbytná intenzivní spolupráce s transplantačním centrem.
Pomineme-li komplexní intenzivní péči u pacientů s HRS typu I, pak obecná režimová opatření u typu II zahrnují jaterní dietu se zákazem alkoholu a podpůrnou či symptomatickou léčbu. U rizikových pacientů je rovněž důležitá prevence. Sem patří maximální snaha vyvarovat se léků, které mohou HRS indukovat. Z těch běžně užívaných jsou to především nesteroidní antiflogistika, kontrastní látky a blokátory angiotenzin konvertujícího enzymu [24–26]. Riziková jsou také diuretika a jejich používání musí být velmi obezřetné. V případě léčby ascitu je doporučována spíše vysoko objemová paracentéza s albuminem v dávce 8 g/l ascitu [25–27]. Významnou pozornost je také nutno věnovat infekčním komplikacím. Zejména spontánní bakteriální peritonitida je závažnou komplikací, která je spojena s rozvojem HRS a její prevence i léčba je velmi důležitá [28,30].
Farmakologická terapie HRS je omezená a velká část zkoušených léků selhala. Nízká dávka dopaminu má známý nefroprotektivní účinek. Vliv na HRS ale nebyl pozorován. Několik studií na malém souboru pacientů neprokázalo efekt ani u misoprostolu (syntetický analog prostaglandinu PGE1) [31] a antagonisty endotelin-A-receptoru (BQ123) [32]. Použití antagonisty ATII receptoru (saralazin) se jeví jako možné, ale z důvodu navozené hypotenze jen u pacientů po TIPS (transjugulární intrahepatální portosystémová spojka) [33].
Slibnou oblastí se stala až léčiva se systémovou vazokonstrikcí, zejména analoga vazopresinu, působící přes vazopresinové V1 receptory. První dva z nich, oktapresin a ornipresin, pozitivně ovlivnily průběh HRS [34–36], ale byly zatíženy vysokým procentem závažných komplikací (ischemické a krvácivé). Od jejich použití bylo proto nutno ustoupit. Teprve až terlipresin se během klinického zkoušení ukázal jako bezpečný a efektivní. Jeho podávání v monoterapii či v kombinaci s albuminem se stalo základní součástí léčby HRS [37–39]. V současné době je známo, že u typu I v kombinaci s albuminem snižuje mortalitu [40,41]. Doporučená dávka se pohybuje v rozmezí 0,5–2 mg po 4–6 hodinách, tedy do maximální dávky 12 mg/den, nejlépe v kombinaci s albuminem [27,28,40]. Aplikace terlipresinu však může být i kontinuální [28,42]. Cílovou hodnotou je hladina kreatininu pod 133 µmol/l (1,5 mg/dl). Přestože je považován za relativně bezpečný lék, během jeho podávání je nutno věnovat zvýšenou pozornost riziku ischemie, srdečních dysrytmií a iontových dysbalancí.
Další vazokonstrikční látky, jejichž použití bylo efektivní u HRS, jsou noradrenalin, oktreotid (analog somatostatinu) a midodrin (α-adrenergní agonista) [40,42–45]. Data o jejich účinnosti jsou významná zejména pro země, kde není terlipresin volně dostupný. Na druhé straně jejich účinek je srovnatelný a z našeho pohledu mohou být považovány za vhodnou alternativu [46]. Určitě zajímavá může být i jejich cena. Léčba terlipresinem je totiž drahá.
Z výše uvedeného tedy vyplývá, že podání vazokonstrikčně působících látek má pozitivní efekt na průběh HRS a snižuje mortalitu. Jejich účinek je potencován aplikací albuminu. Ten je podáván jako expandér plazmatického objemu. Albumin je doporučován v dávce iniciálně 1 g/kg tělesné hmotnosti a dále v dávce 20–40 g/den [27,40]. Podávání jiných roztoků k doplnění EPV nelze doporučit. Krystaloidy jsou u pacientů se zvýšením celkového tělesného natria nevhodné a koloidy mají svá striktní kritéria použití.
Zvýšení EPV lze dosáhnout také provedením transjugulárního intrahepatálního portosystémového stent-shuntu (TIPS). Propojení portálního a systémového řečiště vede nejenom k redukci portální hypertenze, ale také zlepšení systémové hemodynamiky a prokrvení ledvin [47,48]. Klesá aktivita RAAS, SNS, aldosteronu a zlepšuje se vylučování sodíku [19,20,47,48]. Jedná se ale o invazivní metodu, která má svá rizika. Krvácivé komplikace, stenóza či trombóza shuntu a rovněž zhoršení encefalopatie jsou ty nejčastější. Není také jasné, proč v některých případech implantace TIPS prodlužuje přežívání a zlepšuje naděje na transplantaci a jindy je nástup reparačních změn opožděný nebo dokonce žádný [49]. Přesto je TIPS doporučován zejména u HRS typu I se sníženou odpovědí na léčbu vazopresory. Testino et al prezentovali výsledky léčby akutního HRS s užitím TIPS u 9 pacientů s akutní alkoholickou hepatitidou. Svá pozorování shrnují v konstatování, že se jedná o cennou metodu pro zvládnutí období čekání na transplantaci [50]. TIPS tedy dokáže zlepšit prognózu u pacientů v prakticky již beznadějném stavu.
Extrakorporální eliminační metody (renal replacement therapy – RRT) jsou zaměřeny buď na izolovanou náhradu funkce ledvin, nebo kombinovanou, ledvinnou s jaterní. Z hlediska ledvinné dialýzy jsou názory na její využití u HRS sporné. Zkušenosti ukazují, že akutní typ I je u pacientů bez indikace k transplantaci zatížen vysokou morbiditou, mortalitou, krátkým přežitím a současně dalšími riziky vyplývajícími z dialyzačních technik (krvácení, hypotenze). V případě typu II je riziko obdobné. Gonwa et al ale uvádějí, že u těch nemocných, kteří jsou adepty transplantace a jsou rezistentní na farmakoterapii, se může dialýza stát efektivním řešením [51]. Odpověď na otázku, zda použít intermitentní či kontinuální RRT, odpověď neznáme. S ohledem na křehkou hemodynamiku pacientů s jaterním onemocněním lze doporučit techniku kontinuální, která je lépe tolerována [52,53]. U metod, které jsou schopny nahrazovat také funkce jater, je hodnocení složité v důsledku nedostatku klinických studií. V České republice jsou nejvíce známé metody MARS (molecular adsorbent recirculating system) a Prometheus FPSA (fractionated plasma separation and adsorption system). První ze jmenovaných byla použita v několika málo studiích a výsledky byly kontroverzní [54]. Lavayssiere et al ve své recentní studii uvádějí, že z 32 pacientů s HRS typu I byl MARS efektivní jen u 13 a pouze 9 pacientů dosáhlo kompletní remise ledvinného selhání [55].
Jak již bylo nastíněno v úvodu, transplantace jater je ideálním způsobem léčby HRS. Není přitom významnější rozdíl, zda se jedná o transplantaci od živých nebo zemřelých dárců [56]. Přežívání pacientů s HRS je ale ve srovnání s těmi, kteří HRS neměli, podle Ruize et al statisticky významně horší [57]. 4leté přežití prezentované Distantem et al se jeví naopak jako příznivé: 70 % (bez HRS) vs 60 % (s HRS) [58]. Pacienti s ledvinným postižením mají rovněž vyšší předoperační i pooperační morbiditu, stráví delší dobu na JIP a v konečném důsledku i vyšší mortalitu [23,58]. Gonwa ve svých pozorováních uvádí, že asi třetina pacientů po transplantaci potřebuje dialyzační léčbu a přibližně 5–10 % z nich skončí s nezvratným selháním ledvin [23]. Svou roli zde hraje také nefrotoxická imunosuprese. Přesto je v globálním měřítku transplantace jediná, která dokáže zvrátit špatnou prognózu HRS, a právě proto je kladen takový důraz na období tzv. „bridging to transplantation“, tedy úsek mezi stanovením diagnózy a provedením operace. Základem úspěchu se pak stávají úspěšně aplikovaná a zvládnutá výše uvedená opatření.
Závěr
Hepatorenální syndrom je potencionálně fatální komplikace jaterního selhání. Jedná se o funkční poškození ledvin, které má sice jasně definovaná diagnostická kritéria, ale omezené léčebné možnosti a špatnou prognózu. Léčba HRS v souladu s platnými doporučeními v sobě zahrnuje následující aspekty.
U pacientů s HRS typ I:
- komplexní, intenzivní léčba jaterní insuficience
- rychlá diagnostika se stratifikací rizik a stanovení indikace k event. OLT
- konzultace s transplantačním centrem ke zhodnocení indikace OLT, ke které je nutno pacienta primárně směřovat
- podání vazopresorů (v našich podmínkách terlipresinu) a albuminu nitrožilně
- provedení TIPS u pacientů před OLT, kteří jsou refrakterní na vazopresorickou léčbu
- dialyzační léčbu zahájit v souladu s platnými kritérii pro RRT
U pacientů s HRS typ II:
- stanovit přesnou diagnózu jaterního onemocnění a stanovit možnosti OLT
- symptomatická léčba a režimová opatření
- prevence rozvoje HRS zaměřená zejména na infekční a polékové komplikace
- v léčbě refrakterního ascitu preferovat vysokoobjemovou paracentézu s aplikací albuminu nitrožilně
- v případě selhání výše uvedených opatření provést TIPS
- dialyzační léčbu zahájit v souladu s platnými kritérii pro RRT
MUDr. Vladimír Hrabovský, Ph.D.
vladimir.hrabovsky@fno.cz
Interní klinika LF OU a FN Ostrava
www.fno.cz
Doručeno do redakce 13. 2. 2015
Přijato po recenzi 1. 4. 2015
Sources
1. Salerno F, Cazzaniga M, Merli M et al. Diagnosis, treatment and survival of patients with hepatorenal syndrome: a survey on daily medical practice. J Hepatol 2011; 55(6): 1241–1248.
2. Devuni D, Anand BS, Ouyang A et al. Hepatorenal Syndrome. 2014. Dostupné z WWW: <http://emedicine.medscape.com/article/178208-overview>.
3. Hecker R, Sherlock S. Electrolyte and circulatory changes in terminal liver failure. The Lancet 1956; 268(6953): 1121–1125.
4. Arroyo V. Hecker R, Sherlock S. Electrolyte and circulatory changes in terminal liver failure [Lancet 1956;2 : 1221–1225]. J Hepatol 2002; 36(3): 315–320.
5. Shear L, Kleinerman J, Gabuzda GJ. Renal failure in patients with cirrhosis of the liver. I. Clinical and pathologic characteristics. Am J Med 1965; 39 : 184–198.
6. Koppel MH, Coburn JW, Mims MM et al. Transplantation of cadaveric kidneys from patients with hepatorenal syndrome. Evidence for the functional nature of renal failure in advanced liver disease. N Engl J Med 1969; 280(25): 1367–1371.
7. Iwatsuki S, Popovtzer MM, Corman JL et al. Recovery from “hepatorenal syndrome” after orthotopic liver transplantation. N Engl J Med 1973; 289(22): 1155–1159.
8. Barbano B, Sardo L, Gigante A et al. Pathophysiology, diagnosis and clinical management of hepatorenal syndrome: from classic to new drugs. Curr Vasc Pharmacol 2014; 12(1): 125–135.
9. Guarner C, Soriano G, Such J et al. Systemic prostacyclin in cirrhotic patients. Relationship with portal hypertension and changes after intestinal decontamination. Gastroenterology 1992; 102(1): 303–309.
10. Wiest R, Shah V, Sessa WC et al. NO overproduction by eNOS precedes hyperdynamic splanchnic circulation in portal hypertensive rats. Am J Physiol 1999; 276(4 Pt 1): G1043-G1051.
11. García-Pagán JC, Fernández M, Bernadich C et al. Effects of continued NO inhibition on portal hypertensive syndrome after portal vein stenosis in rat. Am J Physiol 1994; 267(6 Pt 1): G984-G990.
12. Schrier RW, Arroyo V, Bernardi M et al. Peripheral arterial vasodilatation hypothesis: a proposal for the initiation of renal sodium and water retention in cirrhosis. Hepatology 1988; 8(5): 1151–1157.
13. Hori N, Wiest R, Groszmann RJ. Enhanced release of nitric oxide in response to changes in flow and shear stress in the superior mesenteric arteries of portal hypertensive rats. Hepatology 1998; 28(6): 1467–1473.
14. Paper S. The role of the kidney in Laennec´s cirrhosis of the liver. Medicine (Baltimore) 1958; 37(4): 299–316.
15. Lieberman FL, Ito S, Reynolds TB. Effective plasma volume in cirrhosis with ascites. Evidence that a decreased value does not account for renal sodium retention, a spontaneous reduction in glomerular filtration rate (GFR), and a fall in GFR during drug-induced diuresis. J Clin Invest 1969; 48(6): 975–981.
16. Bernardi M, Fornale L, DiMarco C et al. Hyperdynamic circulation of advanced cirrhosis: a re-appraisal based on posture-induced changes in hemodynamics. J Hepatol 1995; 22(3): 309–318.
17. Bernardi M, Trevisani F, Fornale L et al. Renal sodium handling in cirrhosis with ascites: mechanisms of impaired natriuretic response to reclining. J Hepatol 1994; 21(6): 1116–1122.
18. Jalan R, Hayes PC. Sodium handling in patients with well compensated cirrhosis is dependent on the severity of liver disease and portal pressure. Gut 2000; 46(4): 527–533.
19. Jalan R, Forrest EH, Redhead DN et al. Reduction in renal blood flow following acute increase in the portal pressure: evidence for the existence of a hepatorenal reflex in man? Gut 1997; 40(5): 664–670.
20. Stanley AJ, Redhead DN, Bouchier IA et al. Acute effects of trans-jugular intrahepatis portosystemic stentshunt (TIPSS) procedure on renal blood flow and cardiopulmonary hemodynamics in cirrhosis. Amer J GE 1998; 93(12): 2463–2468.
21. Wong F. Cirrhotic cardiomyopathy. Hepatol Int 2009; 3(1): 294–304.
22. Salerno F, Gerbes A, Gines P et al. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut 2007; 56(9): 1310–1318.
23. Gonwa TA, Morris CA, Goldstein RM et al. Long-term survival and renal function following liver transplantation in patients with and without hepatorenal syndrome – experience in 300 patients. Transplantation 1991; 51(2): 428–430.
24. Moore KP, Wong F, Gines P et al. The management of ascites in cirrhosis: report on the consensus conference of the International Ascites Club. Hepatology 2003; 38(1): 258–266.
25. Claria J, Kent JD, Lopez-Parra M et al. Effects of celocoxib and naproxen on renal function in nonazotemic patients with cirrhosis and ascites. Hepatology 2005; 41(3): 579–587.
26. Guevara M, Fernandez-Esparrach G, Alessandria C et al. Effects of contrast media on renal function in patient with cirrhosis: a prospective study. Hepatology 2004; 40(3): 646–651.
27. Brůha R, Drastich P, Hůlek P et al. Doporučený postup pro diagnostiku a léčbu hepatorenálního syndromu. Vnitř Lék 2006; 52(6): 649–650.
28. European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis and hepatorenal syndrome in cirrhosis. European Association for the Study of the Liver. J Hepatol 2010; 53(3): 397–417.
29. Arroyo V, Colmenero J. Ascites and hepatorenal syndrome in cirrhosis: pathophysiological basis of therapy and current management. J Hepatol 2003; 38(suppl 1): S69-S89.
30. Fernández J, Navasa M, Planas R et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Gastroenterology 2007; 133(3): 818–824.
31. Gines A, Salmeron JM, Gines P et al. Oral misoprostol or intravenous prostaglandin E2 do not improve renal function in patients with cirrhosis and ascites with hyponatremia or renal failure. J Hepatol 1993; 17(2): 220–226.
32. Soper CP, Latif AB, Bending MR. Amelioration of hepatorenal syndrome with selective endothelin-A antagonist. Lancet 1996; 347 (9018): 1842–1843.
33. Schroeder ET, Anderson GH Jr, Smulyan H. Effects of a portacaval or peritoneovenous shunt on renin in the hepatorenal syndrome. Kidney Int 1979; 15(1): 54–61.
34. Lenz K, Hortnagl H, Druml W et al. Ornipressin in the treatment of functional renal failure in decompensated liver cirrhosis. Effects on renal hemodynamics and atrial natriuretic factor. Gastroenterology 1991; 101(4): 1060–1067.
35. Guevara M, Ginès P. Hepatorenal syndrome. Dig Dis 2005; 23(1):47–55.
36. Guevara M, Rodés J. Hepatorenal syndrome. Int J Biochem Cell Biol 2005; 37(1): 22–26.
37. Fabrizi F, Dixit V, Messa P et al. Terlipressin for hepatorenal syndrome: A meta-analysis of randomized trials. Int J Artif Organs 2009; 32(3): 133–140.
38. Narahara Y, Kanazawa H, Sakamoto C et al. The efficacy and safety of terlipressin and albumin in patients with type 1 hepatorenal syndrome: a multicenter, open-label, explorative study. J Gastroenterol 2011; 47(3): 313–320.
39. Gluud LL, Christensen K, Christensen E et al. Terlipresin for hepatorenal syndrome. Cochrane Database Syst Rev 2012; 9: CD005162. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD005162.pub3>.
40. Gluud LL, Christensen K, Christensen E et al. Systematic review of randomized trials on vasoconstrictor drugs for hepatorenal syndrome. Hepatology 2010; 518ě9 : 576–584.
41. Fabrizi F, Aghemo A, Messa P. Hepatorenal syndrome and novel advances in its management. Kidney Blood Press Res 2013; 37(6): 588–601.
42. Arroyo V, Fernandez J. Management of hepatorenal syndrome in patients with cirrhosis. Nat Rev Nephrol 2011; 7(9): 517–526.
43. Angeli P, Volpin R, Gerunda G et al. Reversal of type 1 hepatorenal syndrome with the administration of midodrine and octreotide. Hepatology 1999; 29(6): 1690–1697.
44. Wong F, Pantea L, Sniderman K. Midodrine, octreotide, albumin, and TIPS in selected patients with cirrhosis and type 1 hepatorenal syndrome. Hepatology 2004; 40(1): 55–64.
45. Tavakkoli H, Yazdenpanah K, Mansourian M. Noradrenalin versus the combination of midodrine and octreotide in patients with hepatorenal syndrome: Randomized clinical trial. Int J Prev Med 2012; 3(11): 764–749.
46. Ghosh S, Choudhary N, Sharma K et al. Noradrenaline vs. terlipressin in the treatment of type 2 hepatorenal syndrome: a randomized pilot study. Liver Intern 2013; 33(8): 1187–1193.
47. Brensing KA, Textor J, Strunk H et al. Transjugular intrahepatic portosystemic stent-shunt for hepatorenal syndrome. Lancet 1997; 349(9053): 697.
48. Brensing KA, Textor J, Perz J et al. Long term outcome after transjugular intrahepatic portosystemic stent-shunt in bon-transplant cirrhotics with hepatorenal syndrome: a phase II study. Gut 2000; 47(2): 288–295.
49. Flora KD. Hepatorenal syndrome is reversible with medical therapy plus TIPS. J Watch Gastroenterol 2004. Dostupné z DOI: <http://dx.doi.org/10.1056/JG200410130000007>.
50. Testino G, Leone S, Ferro C et al. Severe acute alcoholic hepatitis and hepatorenal syndrome: role of transjugular intrahepatic portosystemic stent shunt. J Med Life 2012; 5(2): 203–205.
51. Gonwa T, Wadei H. The challenges of providing renal replacement therapy in decompensated liver cirrhosis. Blood Purif 2012; 33(1–3): 144–148.
52. Gonwa TA, Mai M, Melton L et al. Renal replacement therapy and orthotopic liver transplantation. The role of continuous veno-venous haemodialysis. Transplantation 2001; 71(10): 1424–1428.
53. Witzke O, Baumann M, Patschan D et al. Which patients benefit from haemodialysis therapy in hepatorenal syndrome? Gastroenterol Hepatol 2004; 19(12): 1369–1373.
54. Wong F, Raina N, Richardson R. Molecular adsorbent recirculating system is ineffective in the management of type 1 hepatorenal syndrome in patients with cirrhosis with ascites who have failed vasoconstrictor treatment. Gut 2010, 59(3): 381–386.
55. Lavayssière L, Kallab S, Cardeau-Desangles I et al. Impact of molecular adsorbent recirculating system on renal recovery in type-1 hepatorenal syndrome patients with chronic liver failure. J Gastroenterol Hepatol 2013; 28(6): 1019–1024.
56. Goldaracena N, Marquez M, Selzner N et al. Living vs. deceased donor liver transplantation provides comparable recovery of renal function in patients with hepatorenal syndrome: a matched case-control study. Am J Transplant 2014; 14(12): 2788–2795.
57. Ruiz R, Barri Y, Jennings L et al. Hepatorenal syndrome: a proposal for kidney after liver transplantation. Liver Transpl 2007; 13(6): 838–843.
58. Distant D, Gonwa TA. The kidney in liver transplantation. J Am Soc Nephrol 1993; 4(2): 129–136.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 7-8-
All articles in this issue
- Transplantace pankreatu: současný stav a výhledy do budoucna
- Tumory a transplantace jater
- Transplantace solidních orgánů v České republice
- Konopí – léčba budoucnosti?
- Novinky v léčbě akutního nevarikózního krvácení do horní části gastrointestinálního traktu
- Domácí nutriční péče v České republice
- Vitamin D – stará látka s novými perspektivami
- Možnosti endoskopického řešení polypoidních a nepolypoidních lézí v kolon
- Obyčejná nemoc – apendicitida
- Platí „LDL-hypotéza“ i pro pacienty s diabetem?
- Snížení krevního tlaku – léčbou dalších rizikových faktorů
- Jak na dyslipidemii u pacientů s metabolickým syndromem
- Transplantace ledviny při inkompatibilitě krevní skupiny – úvodní zkušenosti programu
- Takotsubo (stresová) kardiomyopatie – co se změnilo? – editorial
- Rizikové faktory vzniku karcinomu štítné žlázy – editorial
- Takotsubo kardiomyopatie, klinické zkušenosti s onemocněním a jednoletá prognóza pacientů
- Infuzní toxicita rituximabu u nemocných s chronickou lymfocytární leukemií
- Kardiovaskulární účinky léčby GLP-1 agonisty se zaměřením na liraglutid
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
- Rizikové faktory vzniku karcinomu štítné žlázy
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Obyčejná nemoc – apendicitida
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

