-
Medical journals
- Career
Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilátem, apixabanem a rivaroxabanem
Authors: Jan Kvasnička 1; Miroslav Penka 2; Tomáš Kvasnička 1; Jana Michalcová 2; Zuzana Kudrnová 1; Ivana Malíková 1
Authors‘ workplace: Trombotické centrum Ústavu klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN Praha, přednosta prof. MUDr. Tomáš Zima, DrSc., MBA 1; Oddělení klinické hematologie FN Brno, primář prof. MUDr. Miroslav Penka, CSc. 2
Published in: Vnitř Lék 2015; 61(6): 537-546
Category: Guidelines
Overview
V současné době jsou pro prevenci a léčbu tromboembolické nemoci k dispozici nová perorální antikoagulancia (NOAC), která jsou registrována pro vybrané indikace i v ČR. Jedná se o přímé perorální inhibitory trombinu (dabigatran etexilát) a přímé inhibitory faktoru Xa (apixaban a rivaroxaban), jejichž výhodou jsou některé vlastnosti, které nevykazují dosavadní „klasická“ antikoagulancia. I v souvislosti s novými antikoagulancii však řešíme některé problémy, jako jsou laboratorní monitoring v urgentních situacích účinné léčby a u krvácivých komplikací dosavadní absenci specifického antidota. Níže přiložený text předkládá indikace, dávkování, způsob eliminace, sledování účinnosti léčby či rizika krvácení a léčbu krvácivých komplikací.
Klíčová slova:
apixaban – dabigatran etexilát – NOAC – rivaroxabanÚvod
V České republice jsou v současnosti k dispozici tato nová perorální antikoagulancia (NOAC – new oral anticoagulants):
- přímý inhibitor trombinu
- dabigatran etexilát (PRADAXA®, výrobce Boehringer Ingelheim Pharma GmbH & Co. KG, Německo)
- přímé inhibitory aktivovaného faktoru Xa
- apixaban (ELIQUIS®, výrobce Bristol-Myers Squibb/Pfizer, Velká Británie)
- rivaroxaban (XARELTO®, výrobce Bayer Pharma AG, Německo).
Tato NOAC jsou indikována:
- k prevenci pooperačních tromboembolických komplikací po ortopedických operacích, elektivní náhradě kolenního, nebo kyčelního kloubu
- v prevenci ischemického iktu nebo systémové embolizace u nemocných s nevalvulární fibrilací síní
- k léčbě hluboké žilní trombózy (HŽT) a hemodynamicky stabilní plicní embolie (PE) a k prevenci rekurentní HŽT a PE u dospělých
Poznámka: rivaroxaban podávaný společně s kyselinou acetylsalicylovou (ASA) samotnou, nebo s kombinací ASA + klopidogrel nebo tiklopidin je dále ještě schválen k prevenci aterotrombotických příhod u dospělých pacientů po akutním koronárním syndromu (AKS) se zvýšenými hladinami srdečních biomarkerů.
Dávkování NOAC v jednotlivých indikacích je v přehledu uvedeno v tab. 1.
Table 1. Doporučené dávkování NOAC s uvedením úpravy v některých situacích 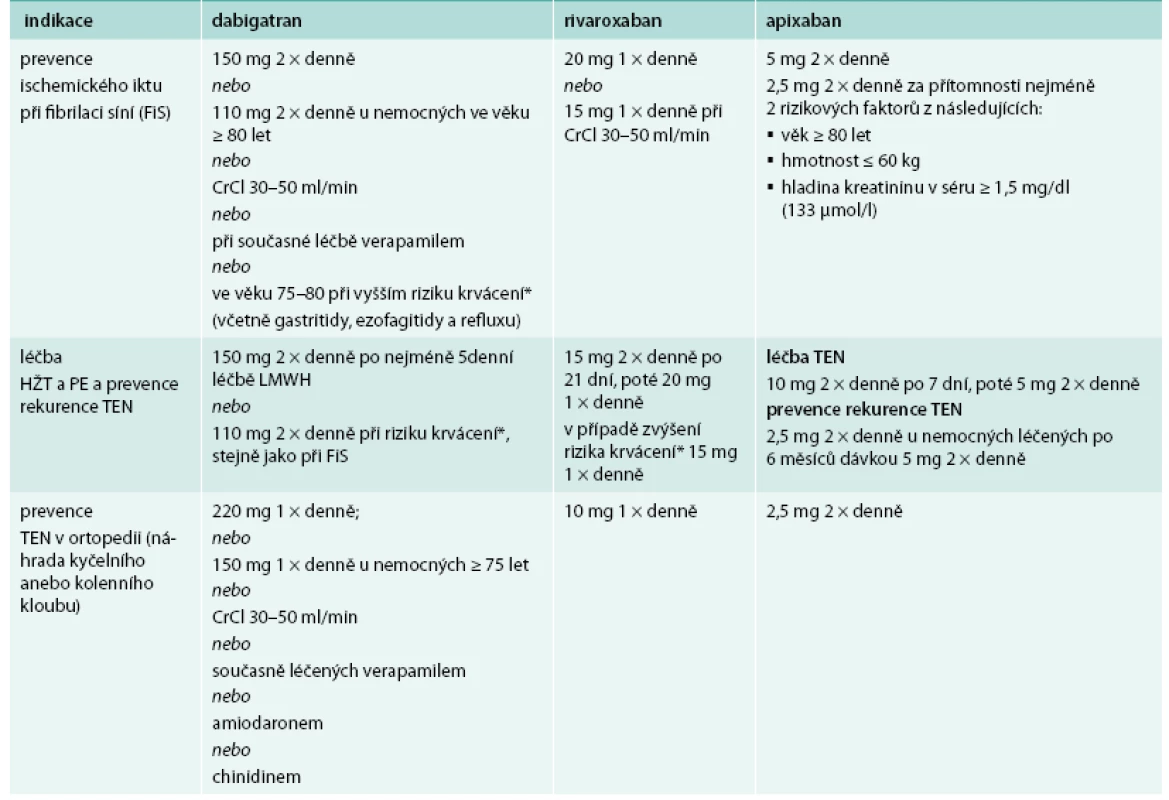
* individuální zhodnocení rizika krvácení vs trombotizace Nespornou výhodou NOAC je, že pokud se podávají v doporučených indikacích a v jednotném dávkování, nemusí být tato léčba kontrolována laboratorními testy tak, jako je tomu v případě léčby warfarinem.
Detailní popis indikací a kontraindikací NOAC, farmakodynamických a farmakokinetických údajů, ovlivnění účinku jinými léky, návody na změnu léčby pomocí NOAC, postup při předávkování, krvácení nebo používání koagulačních testů a jejich interpretace v případě potřeby a informace o populacích s potencionálně vyšším rizikem krvácení jsou uvedeny v Souhrnech údajů o uvedených přípravcích [1–3] a v Doporučeních pro předepisující lékaře, kterými vybavuje lékaře držitel rozhodnutí o registraci. Dokumenty jsou volně dostupné na webových stránkách Státního ústavu pro kontrolu léčiv v Praze v databázi léků: www.sukl.cz /modules/medication/search.php.
Součástí kontroly bezpečného užívání NOAC je také poučení pacienta lékařem a jeho vybavení informační kartou o přípravku, se kterou se má léčený pacient prokazovat i při návštěvě jiného lékaře, nebo před ošetřením u stomatologa.
V textu dále uvádíme základní pravidla a doporučení pro rychlou orientaci lékaře jak postupovat při krvácení a při prevenci výskytu této nežádoucí příhody.
Postup při krvácení u nemocného léčeného NOAC [4–7]
Přestože z výsledků registračních klinických studií vyplývá, že je po NOAC méně závažných krvácení než při použití warfarinu, je s tímto obecným rizikem antikoagulační léčby nutné počítat i při použití NOAC. Krvácení však bývá při léčbě pomocí NOAC spojeno s další okolností – např. s poraněním pacienta léčeného pomocí NOAC, s krvácením do GIT po ruptuře žaludečního vředu u nemocného léčeného pomocí NOAC apod. Při zjišťování anamnézy krvácejícího pacienta je vždy nutné se dotazovat cíleně i na užívání NOAC.
V úvodu je nutné vyhodnotit závažnost krvácení podle klinických projevů. Krvácení pak klasifikujeme jako:
- klinicky lehké, klinicky málo rizikové krvácení (většinou do podkoží, na sliznicích a jinde, bez klinické odezvy a poklesu hemogramu)
- klinicky středně rizikové krvácení, neohrožující bezprostředně život pacienta (pokles hemoglobinu o 20 g/l, krvácení z poranění, do GIT, krvácení do močových cest, nebo krvácení do jiné oblasti, hemodynamicky je však nemocný stabilizován)
- klinicky vysoce rizikové, život ohrožující, krvácení (pokles hemoglobinu o > 50 g/l, ztráta > 50 % objemu krve během 3 hod, známky hemoragického šoku, krvácení do CNS)
Dále provádíme odběr krve na laboratorní vyšetření – hemogramu, kreatinu v séru, koagulační testy (při život ohrožujícím krvácení i stanovení fibrinogenu) a podle výše krevních ztrát provádíme odběry pro objednávku transfuzních přípravků.
Volba koagulačních testů a interpretace výsledků pak závisí na použitém NOAC [4,5,8,9] (přehled doporučených testů je uveden v tab. 2).
Table 2. Interpretace a výsledky koagulačních testů u pacientů léčených různými NOAC. Upraveno dle [4] ![Interpretace a výsledky koagulačních testů u pacientů léčených různými NOAC. Upraveno dle [4]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/77db81b69329fe678372190baccdd39d.png)
aPTT – aktivovaný parciální tromboplastinový čas (activated partial thromboplastin time) dTT – (kalibrovaný) dilutovaný trombinový čas (diluted thrombin time) INR – mezinárodní normalizovaný poměr (international normalized ratio) PT – protrombinový čas (prothrombin time) TT – trombinový čas (thrombin time) *ULN – horní limit normálu laboratoře (upper limit of normal) Dabigatran etexilát
Pro rychlé vyhodnocení antikoagulační aktivity dabigatranu je vhodné vyšetření aPTT (aktivovaného parciálního tromboplastinového času), který je prodloužen. Nález dvojnásobku maxima referenčních hodnot aPTT v době očekávaného minima účinku dabigatranu při dávkování 2krát150 mg denně před další dávkou NOAC odpovídá vysokému riziku krvácení a značné poruše koagulace. Hodnota aPTT > 1,3násobek normy, měřená za stejných podmínek při dávkování 220 mg 1krát denně (indikace TEP v ortopedii) může být rovněž spojena se zvýšeným rizikem krvácení. Spolu s aPTT je také doporučováno provedení kalibrovaného dilutovaného trombinového času (např. test Hemoclot®, Hyphen BioMed, Neuville, France), který poskytne údaje o koncentraci dabigatranu ve vyšetřované plazmě. Hodnoty koncentrace dabigatranu ze SPC v době maximálního antikoagulačního účinku a v době minimálního účinku v závislosti na podané dávce jsou uvedeny v tab. 3. Koncentrace dabigatranu vyšší než 67 µg/l při dávkování 220 mg 1krát denně, nebo 200 µg/l při dávkování 2krát 150 mg v době minima účinku vypovídá opět o zvýšeném riziku krvácení.
Table 3. Terapeutické koncentrace dabigatranu 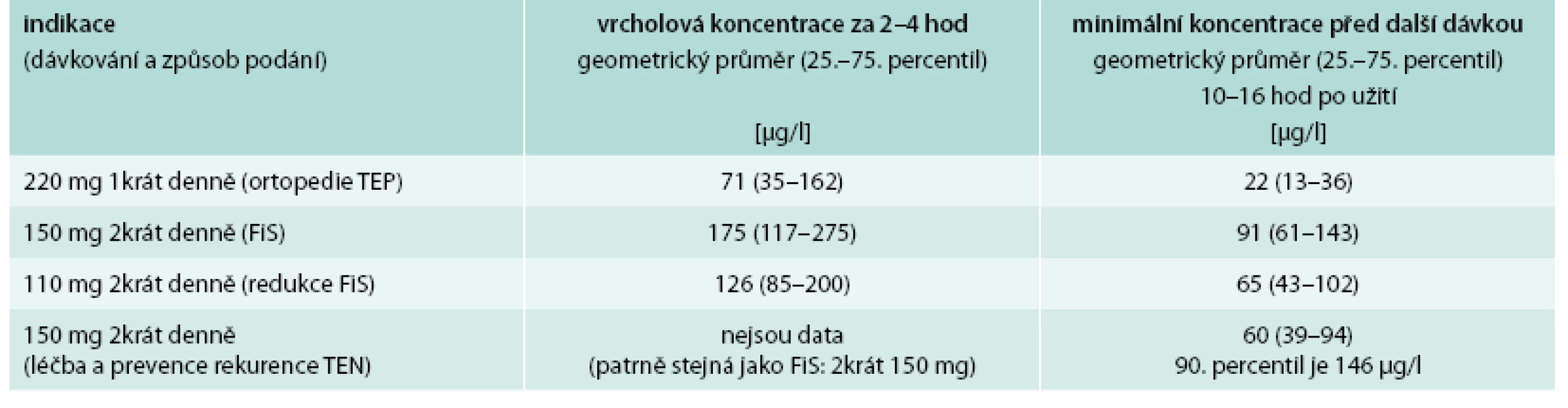
Potřebnou informaci o ovlivnění koagulace dabigatranem podá i trombinový čas (TT). Je sice prodloužen i při nízkých koncentracích dabigatranu, ale pokud se nachází v referenčních mezích laboratoře (většinou do 16 s), je antikoagulační aktivita dabigatranu již nulová.
Rivaroxaban
Pro rychlé orientační vyšetření antikoagulační aktivity rivaroxabanu je vhodné použít protrombinový čas (PT). Výsledek je zde udáván v sekundách, resp. poměru času normálního k vyšetřovanému vzorku plazmy. Běžně (a chybně) užívané vyjádření hodnoty PT v INR jsou určené jen k monitoraci warfarinu. PT je v případě účinné koncentrace rivaroxabanu prodloužen. Některé reagenční soupravy PT se však k monitorování účinku rivaroxabanu nehodí, a proto je třeba, aby laboratoř jejich účinnost ověřila s kontrolní plazmou se známými koncentracemi rivaroxabanu. Spolehlivým testem k určení aktivity rivaroxabanu je však test inhibice faktoru Xa. Při použití spolu s kontrolní plazmou se známými koncentracemi rivaroxabanu podává informaci o koncentraci rivaroxabanu v krvi pacienta. V tab. 4 jsou uvedeny údaje ze SPC o koncentraci rivaroxabanu v době maxima a minima účinku v závislosti na použitém dávkování.
Table 4. Terapeutické koncentrace rivaroxabanu 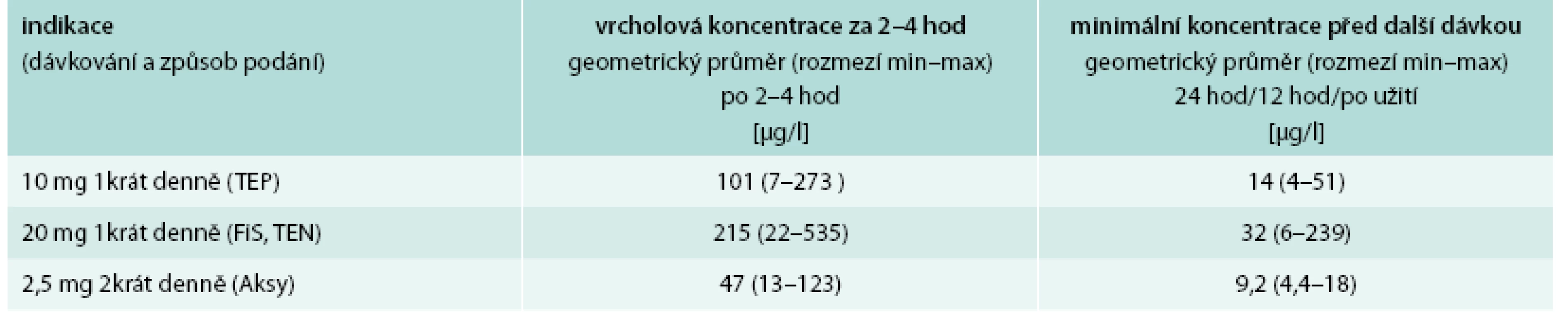
Potíže s laboratorním vyšetřením koagulace mohou ale nastat při převodu z warfarinu na rivaroxaban, a naopak, protože hladiny INR používaného k ověření souběžného účinku warfarinu mohou být uměle zvýšeny. U léčených pacientů by měl být warfarin vysazen a léčba rivaroxabanem zahájena při hladině INR ≤ 2,5 nebo INR ≤ 3,0 podle toho, zda je pacient léčen pro žilní trombózu nebo pro fibrilaci síní. U pacientů, kteří jsou převáděni z rivaroxabanu na warfarin, by měl být rivaroxaban a warfarin podáván současně, dokud není hladina INR ≥ 2,0. Během doby, během níž pacienti užívají jak rivaroxaban, tak warfarin, má být proto INR stanoveno v době nejnižší aktivity rivaroxabanu.
Pro hrubou informaci o zvýšeném vlivu rivaroxabanu v dávce 20 mg v období vrcholu jeho účinku dle švýcarské skupiny expertů podá i tromboelastografické vyšetření přístrojem Rotem® [10]. Zatím však nejde o mezinárodně uznávaný způsob monitorování účinku rivaroxabanu.
Apixaban
Použití protrombinového času (PT) v tomto případě většinou selhává. K určení aktivity apixabanu se proto hodí jen test inhibice faktoru Xa. Při použití spolu s kontrolní plazmou se známými koncentracemi apixabanu se získají informace o koncentraci apixabanu v krvi pacienta. V tab. 5 jsou uvedeny údaje z SPC o koncentraci apixabanu v době maxima a minima účinku v závislosti na použitém dávkování. Další testy, jako aPTT nebo TT, se k ověření antikoagulačního účinku apixabanu nehodí.
Table 5. Terapeutické koncentrace apixabanu 
V případě krvácení je také nutné získat údaj o době, ve které pacient požil poslední tabletu NOAC. Na rozdíl od warfarinu (poločas 42 hod) mají totiž NOAC poměrně krátký poločas. Dabigatran asi 12–14 hod, apixaban 8–15 hod a rivaroxaban asi 9–13 hod. Maximální antikoagulační účinek lze proto očekávat za 2–4 hod po požití a poté již klesá. Časový údaj pak slouží k odhadu výše koagulační poruchy způsobené NOAC v době krvácení. Tento odhad ještě korigujeme podle nálezu koncentrace kreatininu v séru. Vychází se z poznatku, že zvýšení renální insuficience podmiňuje eliminaci NOAC (zejména dabigatranu, který je v 80 % vylučován ledvinami), a tedy i pomalou obnovu hemokoagulace.
Terapeutický postup je v případě krvácení při léčbě NOAC [6,11–14] volen podle závažnosti klinických projevů krvácení. V přehledu je uveden v grafické úpravě na schématu 1.
Schéma 1. NOAC – terapeutický postup při krvácení 
PCC – koncentrát protrombinového komplexu rFVIIa – rekombinantní aktivovaný faktor VII Doporučení je založeno na omezených klinických zkušenostech. Uvádíme i mezioborové konsenzuální stanovisko Doporučený postup při život ohrožujícím krvácení. K zástavě krvácení se zatím volí nespecificky účinkující hemostyptika, protože specificky účinkující antidota [14] nejsou v současné době ještě povolena k použití. Z tohoto hlediska je tedy toto doporučení dočasné.
Okamžitá, úplná a trvalá eliminace antikoagulačního účinku dabigatran etexilátu jeho antidotem idarucizumabem, humanizovaným FAB fragmentem monoklonální protilátky proti dabigatranu, v dávce 5 g i.v. je již úspěšně ověřena ve studii RE-VERSE AD® u krvácejících pacientů, nebo při potřebě urgentní operace u léčených pacientů. K používání již bude také brzy uvolněno specificky účinkující intravenózní antidotum anti-Xa inhibitorů – andexanet α (Annexa® – A, Portorola Pharmaceuticals, USA), což je modifikovaný faktor Xa zbavený prokoagulační aktivity. Inhibuje antikoagulační účinek přímých inhibitorů faktoru Xa rivaroxabanu a apixabanu.
Perioperační management u nemocných léčených NOAC [1–3,6]
NOAC před plánovanou operací vysazujeme. Potřebná doba je uvedena v tab. 6. Závisí na výši zjištěné globální clearance kreatininu (CrCl), typu NOAC a rizika krvácení, které je spojeno s plánovanou operací. Pokud se však má nemocný podrobit jen malému operativnímu zákroku – drobná kožní incize, nekomplikovaná extrakce zubu, endoskopie bez biopsie, zákroky pro kataraktu či glaukom apod, pak NOAC, podobně jako warfarin, v této situaci nevysazujeme. I při léčbě s NOAC však můžeme na přechodnou dobu použít k přemostění nízkomolekulární hepariny (LMWH). LMWH je možno podat v době, kdy by měla být užita další dávka NOAC.
Table 6. Přerušení léčby s NOAC před plánovanou operací v závislosti na CrCl a riziku krvácení při operaci 
V případě urgentní operace zvažujeme možnost odložení operace (zejména v době maxima účinku NOAC, to je během 2–4 hod po požití) v porovnání s výší rizika odkladu operace (algoritmus rozhodování je uveden na schématu 2). I v tomto případě se opět můžeme přesvědčit o poklesu antikoagulační aktivity NOAC příslušnými antikoagulačními testy (aPTT, TT, PT a kalibrované testy), které opakujeme po 1 hod. Vhodné je také získat údaj o koncentraci sérového kreatininu. Toto dilema však samozřejmě odpadne, pokud bude k dispozici příslušné antidotum.
Schéma. 2. Příklad postupu při neodkladné operaci u pacientů léčených NOAC 
K rozhodování o snížení dávky NOAC nebo o častější kontrole rizikového pacienta napomůže také stanovení individuálního rizika krvácení pacienta léčeného NOAC
Mimo údajů v SPC upozorňujících na možné zvýšené riziko krvácení při léčbě s NOAC (stáří pacienta, kritické hodnoty CrCl, souběžná medikace aj) lze použít k vyhodnocení individuální rizika krvácení při antikoagulační léčbě i některé skórovací systémy, jako je HAS-BLED [5] <http://www.mdcalc.com/has-bled-score-for-major-bleeding-risk/> nebo validovaný skórovací systém pro výpočet vyššího individuálního rizika krvácení do GIT nebo do CNS u osob léčených antikoagulancii, který se nazývá Q-Bleed [16]. Ten je také dostupný na webových stránkách <http://www.qbleed.org/>.
Při častější kontrole léčeného pacienta s vyšším rizikem krvácení je pak mimo objektivní vyšetření a anamnézy s cíleným dotazem na možné krvácení třeba provést i kontrolu laboratorní, zejména stanovení kreatininu v séru, hemogramu a koagulačních testů. Vyšetření koagulace je v tomto případě vhodné jak v době maxima účinku, tak i v době minima antikoagulační aktivity NOAC, tj. před další dávkou léku. Dále se při prevenci krvácení během léčby s NOAC zaměřujeme i na obecná preventivní opatření [17], jako je prevence pádů u osob ve vysokém věku, užívání inhibitorů protonových pump při anamnéze vředové choroby, zákaz alkoholu, úprava hypertenze aj.
Pro zhodnocení funkce ledvin (CrCl v ml/min) je po získání údaje o výši sérového kreatininu doporučena k výpočtu clearance kreatininu (CrCl) metoda dle Cockcrofta-Gaulta.
Vzorec pro výpočet CrCl v ml/min je následující:
Vyšetření koncentrace sérového kreatinu a výpočet CrCl jsou také doporučena před zahájením léčby pomocí NOAC. U apixabanu je navíc doporučeno vyšetřit i jaterní testy (bilirubin, AST, ALT). Výsledky vyšetření poté slouží k výběru NOAC, jeho dávky, popřípadě ke kontraindikování léčby s NOAC. Vyšetření CrCl je také nutné při volbě délky přestávky léčby s NOAC před plánovanou operací, jak již bylo uvedeno.
Pozor: Pro pacienty nevalvulární fibrilací síní je podle doporučení České kardiologické společnosti [4] nevhodné nasazení jakéhokoli z NOAC již při hodnotě CrCl ≤ 30 ml/min, i když rivaroxaban a apixaban je dle SPC možné použít ještě do hodnoty CrCl 15 ml/min.
Závěrečné poznámky
Je prosazováno, aby Doporučení pro bezpečnou léčbu s NOAC v úpravě dle místních podmínek nebo speciálního zaměření (anesteziologie) byla k disposici pro lékaře a jiný zdravotnický personál ve všech zdravotnických zařízeních, v kterých je podávána léčba pomocí NOAC nebo jsou zde ošetřování nemocní, kteří užívají NOAC. Prezentovaná „Doporučení“ budou také k dispozici na webových stránkách České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně: <http://www.CSTH.cz>, na kterých mohou sloužit jako podklad pro přípravu celoústavně platného nařízení k bezpečné léčbě s NOAC.
Uvedené NOAC podléhají dalšímu sledování z pohledu nežádoucích účinků. To umožní rychlé získání nových informací o bezpečnosti. Zdravotničtí pracovníci jsou žádáni, aby hlásili jakákoli podezření na nežádoucí účinky Státnímu ústavu pro kontrolu léčiv, oddělení farmakovigilance, nejlépe na e-mailovou adresu: farmakovigilance@sukl.cz.
V případě nejasností se může lékař ordinující NOAC obrátit s žádostí o telefonickou, nebo jinou konzultaci na lékaře Trombotických center v místě.
Podpořeno grantem MZ RVO-VFN64165.
Poznámka: Doporučení bylo předneseno a odsouhlaseno po diskusi na XXII. česko-slovenské konferenci o hemostáze a trombóze v Hradci Králové dne 21. 5. 2015.
prof. MUDr. Jan Kvasnička, DrSc.
kvasnicka.jan@vfn.cz
Trombotické centrum Ústavu klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN
www.vfn.cz
Doručeno do redakce: 3. 6. 2015
Sources
1. The European Medicines Agency. Souhrn údajů o přípravku Pradaxa. [online]. Dostupné z WWW: <http://www.emea.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000829/WC500041059.pdf>.
2. The European Medicines Agency. Souhrn údajů o přípravku Xarelto. [online]. Dostupné z WWW: <http://www.emea.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000944/WC500057108.pdf>.
3. The European Medicines Agency. Souhrn údajů o přípravku Eliquis. [online]. Dostupné z WWW: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002148/WC500107728.pdf>.
4. Čihák R, Haman L, Táborský M. European Heart Rhythm Association practical guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Summary of the document prepared by the Czech Society of Cardiology. Cor et Vasa 56(2014) e42–e56. Dostupné z WWW: <http://www.sciencedirect.com/science/article/pii/S001086501300129X>.
5. Čihák R, Haman L, Heinc P. Souhrn Aktualizace doporučených postupů ESC pro léčbu fibrilace síní z roku 2012. Cor Vasa 2012; 54: e341-e351. Dostupné z WWW: <http://www.sciencedirect.com/science/article/pii/S0010865012001257?v=s5>.
6. Heidbuchel H, Verhamme P, Alings M et al. European Heart Rhythm Association Practical Guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Europace 2013; 15 : 625–651. Dostupné z DOI: <http://doi: 10.1093/europace/eut083>.
7. Penka M, Penka I, Gumulec J et al. Krvácení. Grada Publishing: Praha 2014. ISBN 978–80–247–0689–4.
8. Baglin T, Hillarp A, Tripodi A et al. Measuring Oral Direct Inhibitors (ODIs) of thrombin and factor Xa: A recommendation from the Subcommittee on Control of Anticoagulation of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost 2013; 11(Suppl 2): 765–760.
9. Kvasnička J, Malíková I. Nová perorální přímá antikoagulancia (NOAC) – jak řešit možné problémy s vyšetřením koagulace. Anest Intenziv Med 2014; 25(5): 367–372.
10. Tsakiris DA, Alberio LA et al. Quantifizierung von Rivaroxaban und Beeinflussung von Gerinnungstests bei Patienten mit Rivaroxaban (Xarelto®) [online]. 2012. Dostupné z WWW: <http://www.sgh-ssh.ch/upload/File/2012_11.10._Rivaroxaban_D.pdf>.
11. Kozek-Langenecker SA, Afshari A, Albaladejo P et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology. Eur J Anaesthesiol 2013; 30(6): 270–382.
12. Siegal DM, Crowther MA. Acute management of bleeding in patients on novel oral anticoagulants. Eur Heart J 2013; 34(7): 489–498b.
13. Khadyzhynov D, Wagner F, Formella S et al. Effective elimination of dabigatran by haemodialysis. A phase I single-centre study in patients with end-stage renal disease. Thromb Haemost 2013; 109(4): 596–605.
14. Yeh CH, Hogg K, Weitz JI. Overview of the new oral anticoagulants: opportunities and challenges. Arterioscler Thromb Vasc Biol 2015; 35(5): 1056–1065.
15. Greinacher A, Thiele T, Selleng K. Reversal of anticoagulants: an overview of current developments. Thromb Haemost 2015; 113(5): 931–942.
16. Hippisley-Cox J, Coupland C. Predicting risk of upper gastrointestinal bleed and intracranial bleed with anticoagulants: cohort study to derive and validate the QBleed scores. BMJ 2014; 349: g4606. Dostupné z DOI: <http://doi: 10.1136/bmj.g4606>.
17. Ageno W, Crowther M, Baglin T et al. Selection and assessment of patients treated with the novel oral anticoagulant drugs: a recommendation from the Subcommittee on Control of Anticoagulation of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost 2013; 11(1): 177–179.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 6-
All articles in this issue
- Diagnostika a terapie dny – editorial
- Echinokokové infekce – vzácná postižení jater – editorial
- Zobrazení muskuloskeletálních projevů a komplikací diabetes mellitus
- Pokračující periferní nervové blokády – přínos pro ortopedické pacienty s diabetes mellitus?
- Perioperační péče a diabetes
- Komplikace endoprotéz u diabetiků
- Obezita a ortopedické operace aneb existují mechanické komplikace obezity?
- Akutní a chronická antikoagulační léčba u kloubních náhrad
- Diabetická neuropatie
- Infekce v rámci syndromu diabetické nohy
- Vybrané kožní změny typu necrosis lipoidica a kožní a slizniční mykotické afekce u diabetes mellitus
- Uplatnění kmenových buněk v ortopedii
- Ortopedická operační léčba syndromu diabetické nohy
- Základní principy a úskalí rehabilitace u diabetiků po amputaci
- Pegasus – Tikagrelor v sekundární prevenci u nemocných po infarktu myokardu
- Diagnostika a terapie dny
- Neobvyklý případ cystického postižení jater – alveolární echinokokóza jater
- „Stresová dovolená“ aneb takotsubo kardiomyopatie
- Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilátem, apixabanem a rivaroxabanem
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika a terapie dny
- „Stresová dovolená“ aneb takotsubo kardiomyopatie
- Echinokokové infekce – vzácná postižení jater – editorial
- Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilátem, apixabanem a rivaroxabanem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



