-
Medical journals
- Career
Nakolik jsme schopni dosáhnout současně platných cílových hodnot LDL-cholesterolu v sekundární prevenci ischemické choroby srdeční
Authors: Otto Mayer Jr; Jan Bruthans V Zastoupení Řešitelů Projektu Euroaspire
Authors‘ workplace: Centrum preventivní kardiologie II. interní kliniky LF UK a FN Plzeň, přednosta prof. MUDr. Jan Filipovský, CSc.
Published in: Vnitř Lék 2015; 61(5): 439-446
Category: Original Contributions
Overview
Východisko:
Množství intervenčních studií prokázalo, že pacienti s manifestní vaskulární chorobou profitují z agresivnějšího dávkování statinů. Položili jsme si otázku, jaké dávkování statinů je v praxi obvyklé a nakolik je v praxi splňována doporučená cílová hodnota LDL-cholesterolu.Metodika a výsledky:
Analyzováno bylo celkem 948 pacientů o průměrném věku 64,5 let (SD ± 9,0) po akutním koronárním syndromu nebo koronární revaskularizaci (české soubory studií EUROASPIRE III a IV). Přestože statinem bylo v letech 2012/2013 léčeno více než 93 % pacientů, maximální dávku (atorvastatin 80 mg nebo ekvivalent) užívala pouze 2,4 % pacientů a oproti období 2006/2007 se zvýšila pouze preskripce středně dávkovaného statinu (atorvastatin 40 mg). Od let 2006/2007 sice došlo k mírnému zlepšení adherence k cílové hodnotě < 2,5 mmol/l (z 54 % na 65 %), nicméně aktuálně platnou cílovou hodnotu < 1,8 mmol/l dosahovalo stále jen < 25 % pacientů. Na základě individuálních hodnot LDL-cholesterolu lze odhadnout, že při maximální možné up-titraci dávky statinu by adherence k aktuální cílové hodnotě stoupla na asi 43 %.Závěr:
Přestože převážná většina pacientů s manifestní ICHS je léčena statinem, užívané dávkování a zejména adherence k cílové hodnotě LDL-cholesterolu v praxi neodpovídá současným doporučeným terapeutickým standardům pro sekundární prevenci.Klíčová slova:
cílová hodnota – dávkování – EUROASPIRE – sekundární prevence – statinÚvod
Léčba statinem představuje jedno z nosných standardních opatření v sekundární prevenci ischemické choroby srdeční (ICHS) i dalších aterovaskulárních chorob, a to v podstatě nezávisle na individuálním lipidovém profilu pacienta. Metaanalýza 14 intervenčních statinových [1] studií zahrnující celkem 90 056 subjektů prokázala, že každý pokles LDL-cholesterolu o 1 mmol/l, spojený s léčbou statinem, je provázen 19% poklesem rizika úmrtí z kardiovaskulární příčiny či 26% poklesem rizika nefatálního infarktu myokardu. Přestože klíčový význam statinu byl prokázán již v první polovině 90. Let minulého století, s postupem času druhá generace statinových studií (PROVE-IT, TNT, IDEAL, AtoZ a i další) [2–5] zaměřila pozornost také na význam náležitého dávkování. Tyto studie, srovnávající efekt standardní a vysoké dávky statinu v souhrnu celkem jednoznačně prokázaly, že čím vyšší je dávka statinu (a tedy i čím nižší je hladina LDL-cholesterolu léčbou dosažená), tím větší je přínos léčby z hlediska kardiovaskulární mortality a morbidity [6]. Asociace mezi cílovou hodnotou LDL-cholesterolu dosaženou léčbou a kardiovaskulárním rizikem je alespoň prozatím kontinuálně lineární. Dosud realizované studie prozatím nenalezli dolní hranici účinku, tj. koncentraci LDL-cholesterolu, při které již nebude docházet ke snižování kardiovaskulárního rizika (tedy tzv. J křivku vztahu cílového LDL-cholesterolu a kardiovaskulárního rizika). Výsledky výše zmíněných studií vedly k tomu, že již 4. doporučení pro kardiovaskulární prevenci (Guidelines) z roku 2007 [7] „volitelně“ navrhovala cílovou hodnotu LDL-cholesterolu pro pacienty s manifestní kardiovaskulární chorobou „…pokud to bude klinicky uskutečnitelné a únosné z finančního hlediska“. V současné době platná 5. doporučení z roku 2012 již stanovují cílovou hodnotu LDL-cholesterolu pro osoby s manifestní aterovaskulární chorobou jednoznačně na méně než 1,8 mmol/l [8].
Cílem této studie bylo analyzovat preskripční zvyklosti z hlediska dávkovaní statinu v sekundární prevenci, jaká byla četnost dosažení cílové hodnoty LDL-cholesterolu a nakolik by se teoreticky zlepšila adherence k doporučené cílové hodnotě po maximalizaci (up-titraci) dávky statinu v souboru českých pacientů s chronickou ICHS (po akutní koronární příhodě či koronární revaskularizaci).
Metodika
Studovaný soubor
Analyzovaný soubor zahrnuje spojená data dvou nezávislých souborů, EUROASPIRE III (EAIII) a EUROASPIRE IV (EAIV), realizovaných v letech 2006–2007 a 2012–2013, resp. (v této studii jsou analyzována pouze česká data). Obě studie byly realizovány ve 2 centrech, na II. interní klinice FN Plzeň a Centru kardiovaskulární prevence Thomayerovy nemocnice Praha (dříve IKEM Praha). Výběr vzorku je detailně popsán jinde [9]. Ve zkratce, v obou jednotlivých studiích byli vždy retrospektivně identifikováni pacienti mladší 80 let (v době přijetí k hospitalizaci) spadající alespoň do jedné z následujících diagnostických kategorií podle závěrečné diagnózy v propouštěcí zprávě: urgentní nebo elektivní koronární bypass či perkutánní koronární angioplastika, akutní infarkt myokardu nebo prokázaná koronární ischemie (dle závěru ošetřujícího lékaře). Identifikace pacientů byla zahájena u nejrecentnějších případů, ale ne dříve než 6 měsíců po příslušné hospitalizaci, a pokračovala zpětně v čase, dokud nebylo vždy dosaženo počtu 600 pacientů a žijící pacienti byli vyzváni dostavit se k vyšetření.
Design předkládané analýzy představuje deskriptivní survey. Všechny procedury byly realizovány v souladu se zásadami „správné klinické praxe“, projekt byl schválen etickou komisí a všichni vyšetření probandi byli zařazeni na základě dobrovolnosti a podepsali Informovaný souhlas. Všechna získaná data byla skladována a zpracovávána v souladu se Zákonem na ochranu osobních údajů.
Realizované studijní procedury
Celkem 979 respondentů (487 a 492 pacientů ve studiích EAIII a EAIV, resp., tj. 81,2 % a 82,0 % souboru identifikovaných jedinců) absolvovalo vyšetření podle standardního protokolu, jehož detaily jsou opět popsány jinde [9]. Vyšetření obsahovalo základní demografické charakteristiky, individuální rodinou a osobní anamnézu kardiovaskulárních chorob, detailní informace o životním stylu a užívané farmakoterapii (včetně aktuálního dávkování).
Dále proběhly následující vyšetřovací procedury: měření tělesné výšky a hmotnosti v lehkém spodním prádle pomocí automatických vah SECA 701 s připojeným měřidlem (váhy byly náležitě kalibrovány vždy před zahájením každé ze studií). Obvod pasu byl měřen ocelovou krejčovskou mírou v místě největšího objemu trupu. Krevní tlak (TK) byl zprůměrován ze 2 měření vsedě pomocí standardního rtuťového sfygmomanometru s přesností 2 mm Hg na pravé ruce a pomocí příslušně široké manžety. Počet vydechovaných částic oxidu uhelnatého byl měřen pomocí přístroje Smokerlyser (Bedfont Scientific, Maidstone, UK) k verifikaci udávaného kuřáckého habitu. Odběr krve byl realizován z venepunkce po přinejmenším 12hodinovém lačnění. Laboratorní vyšetření zahrnovalo stanovení celkového (TCHOL) a HDL-cholesterolu (HDL), triglyceridů (TG) a glukózy (GLU) a bylo realizováno v centrální laboratoři studie EAIII a IV (Disease Risk Unit, National Institute for Health and Welfare, Helsinki, Finsnko). LDL-cholesterol byl kalkulován pomocí Friedewaldovy rovnice, tj. LDL = TCHOL – HDL – (TG/2,22). Koncentrace kreatinkinázy (CK) byla stanovena komerčně dostupnou metodikou na platformě ACCESS 2 (BECKMAN-COULTER, Brea, CA, USA v Oddělení klinické biochemie a hematologie FN Plzeň.
Zpracování dat
Z 979 respondentů bylo 31 subjektů z této analýzy vyřazeno, převážně z důvodů chybějící informace ohledně dávky užívaného statinu. Dosažené individuální hodnoty LDL-cholesterolu byly kategorizovány s ohledem na doporučenou cílovou hodnotu tohoto parametru podle 4. a 5. společného evropského doporučení [7,8], tj. < 2,5 mmol/l a < 1,8 mmol/l. Udávaná dávka příslušného statinu byla standardizována podle svého očekávatelného hypolipidemického účinku do následujících kategorií:
- atorvastatin 10 mg nebo ekvivalent (kategorie zahrnovala také ještě pacienty léčené 20 mg simvastatinu, 40 mg fluvastatinu nebo 5 mg rosuvastatinu)
- atorvastatin 20 mg nebo ekvivalent (40 mg simvastatinu, 80 mg fluvastatinu nebo 10 mg rosuvastatinu)
- atorvastatin 40 mg nebo ekvivalent (80 mg simvastatinu nebo 20 mg rosuvastatinu)
- atorvastatin 80 mg nebo ekvivalent (40 mg rosuvastatinu)
Pro modelování efektu up-titrace dávky statinu jsme použili tzv. „pravidlo 6“ [10], tj. při zdvojnásobení dávky užívaného statinu jsme předpokládali 6% pokles individuální hodnoty LDL-cholesterolu a počítáno bylo pouze s takovým množstvím titračních kroků, kolik umožňovalo současné dávkování (např. u pacientů léčených 40 mg atorvastatinu je teoreticky možno up-titrovat dávku pouze jednou, zatímco u léčených 20 mg jsou titrační kroky možné dva). Pro výpočet nákladů na léčbu jsme použili skutečnou prodejní cenu užívaných statinů v říjnu roku 2007 a listopadu roku 2013 ve Fakultní lékárně FN Plzeň (pokud se lišila cena jednotlivých generických zástupců téhož statinu, byla použita ta nejnižší cena; pokud po teoretické up-titraci již neexistoval užívaný statin ve vyšší dávce, byla použita cena atorvastatinu v ekvipotentní dávce).
Data byla statisticky analyzována pomocí software STATISTICA 8. Použita byla převážně deskriptivní statistika a pouze standardní metodiky (Mannův-Whitneyův U test a χ2 test).
Výsledky
Realizovaná analýza zahrnuje celkem 948 pacientů o průměrném věku 64,5 let (SD ± 9,0) po akutním koronárním syndromu nebo koronární revaskularizaci. Medián (25.-75. percentil) času mezi zařazovací příhodou a vyšetřením činil 1,11 (0,8–1,54) roků. Statinem bylo léčeno 89,0 % pacientů, zatímco 95,6 % prodělalo koronární revaskularizaci (koronární angioplastiku nebo aortokoronární bypass). Základní údaje souboru udává tab. 1.
Table 1. Základní charakteristiky souboru respondentů, profil rizikových faktorů v době interview [průměr (± SD) či proporce faktoru] a charakteristiky hypolipodemické terapie ve studiích EUROASPIRE III a IV a u jejich sloučených dat ![Základní charakteristiky souboru respondentů, profil rizikových faktorů v době interview [průměr (± SD) či proporce faktoru] a charakteristiky hypolipodemické terapie ve studiích EUROASPIRE III a IV a u jejich sloučených dat](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d9b5ff9a88951fe525904327aa794ecc.jpg)
Mannův-Whitneyův U test či *χ2test; **změny dávkování statinů v průběhu od dimise po zařazovací koronární příhodě či revaskularizace (založeno na údaji v propouštěcí zprávě) do vyšetření v rámci studie EUROASPIRE Dávkování statinů a adherence k cílové hodnotě LDL-cholesterolu
Pouze asi 20 % pacientů v celém souboru užívalo dávky statinu o ekvivalentu atorvastatinu ≥ 40 mg (tab. 1). Dávkování statinů se v průběhu sledovaného období signifikantně zvýšilo, jmenovitě preskripce dávky odpovídající 40 mg atorvastatinu stoupla ze 4,6 % na 34,5 %. Na druhé straně, nejvýše dávkovaný statin (80 mg) nebyl v letech 2006/2007 předepisován vůbec a i v letech 2012/2013 zcela minimálně (pouze u 2,4 % pacientů).
Proporce dosažení cílové hodnoty LDL-cholesterolu < 2,5 mmol/l (tj. podle 3. a 4. doporučení) se v průběhu sledovaného období (2006–2013) významně zlepšila z 53,7 % na 64,7 %. Pokud bychom ovšem použili novou cílovou hodnotu < 1,8 mmol/ (podle 5. doporučení), byla by pozorovaná změna zcela minimální (z 19,3 na 23,8 %).
Proporce dosažení cílové hodnoty signifikantně stoupala s dávkou užívaného statinu při současně klesající průměrné hodnotě LDL-cholesterolu (nejvyšší dávkování se z tohoto trendu však již zase vymykalo). Průměrné hodnoty kreatinkinázy se naopak prakticky neměnily (tab. 2).
Table 2. Průměrné hladiny (SD) LDL-cholesterolu, kreatinkinázy (CK) a proporce dosažení cílové hodnoty podle použité dávky statinu 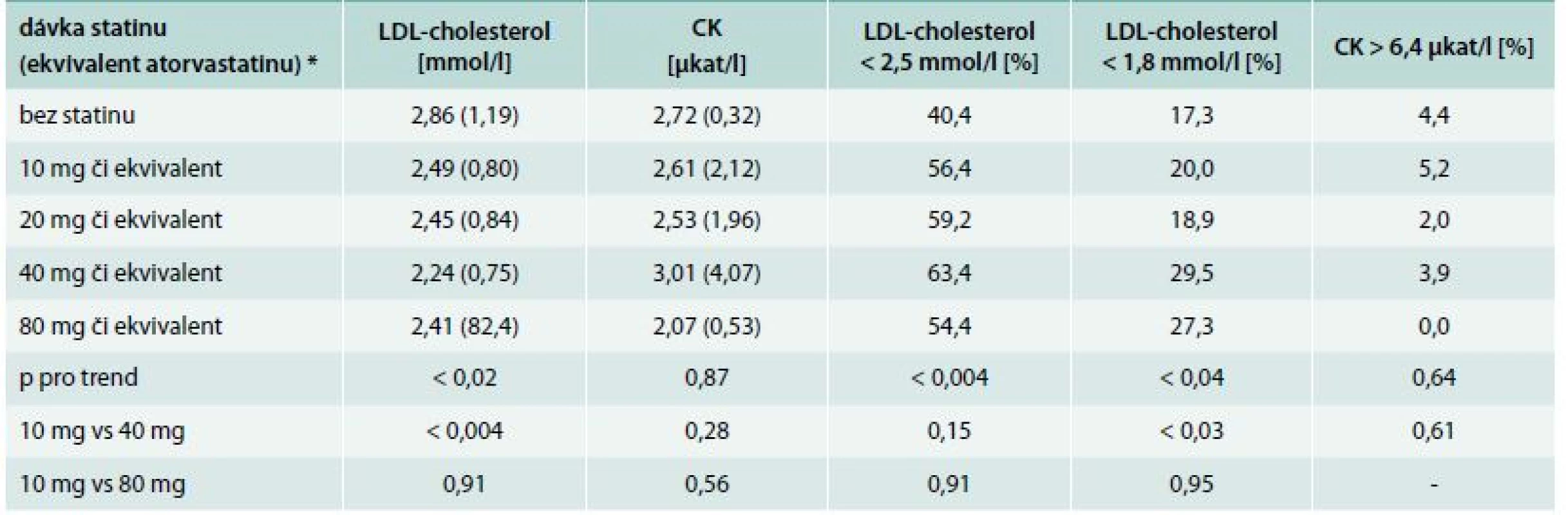
Mannův-Whitneyův U test či χ2 test; *viz Metodika Teoreticky dosažitelná kontrola po maximální možné up-titraci statinu
Očekávatelné zlepšení adherence k cílové hodnotě po maximální možné up-titraci statinu udává tab. 3. Při použití cílové hodnoty LDL-cholesterolu < 2,5 mmol/l by po maximální možné up-titraci statinu mohlo teoreticky dosáhnout až 80 % pacientů. Pokud bychom ovšem použily v současné době platné cílové hodnoty LDL-cholesterolu < 1,8 mmol/l, klesne teoretická dosažitelnost po up-titraci na pouze 43,0 %. Skladba dávkování by ovšem z více než 72 % musela zahrnovat maximálně dávkovaný statin (tj. 80 mg atorvastatinu či jeho ekvivalent) a z dalších více než 16 % středně dávkovaný statin (40 mg atorvastatinu).
Table 3. Očekávatelné zlepšení adherence k cílovým hodnotám LDL-cholesterolu po maximální možné up-titraci, její náklady v době studie a předpokládaná nutná skladba dávek (pouze u pacientů aktuálně užívajících statin, n = 843) 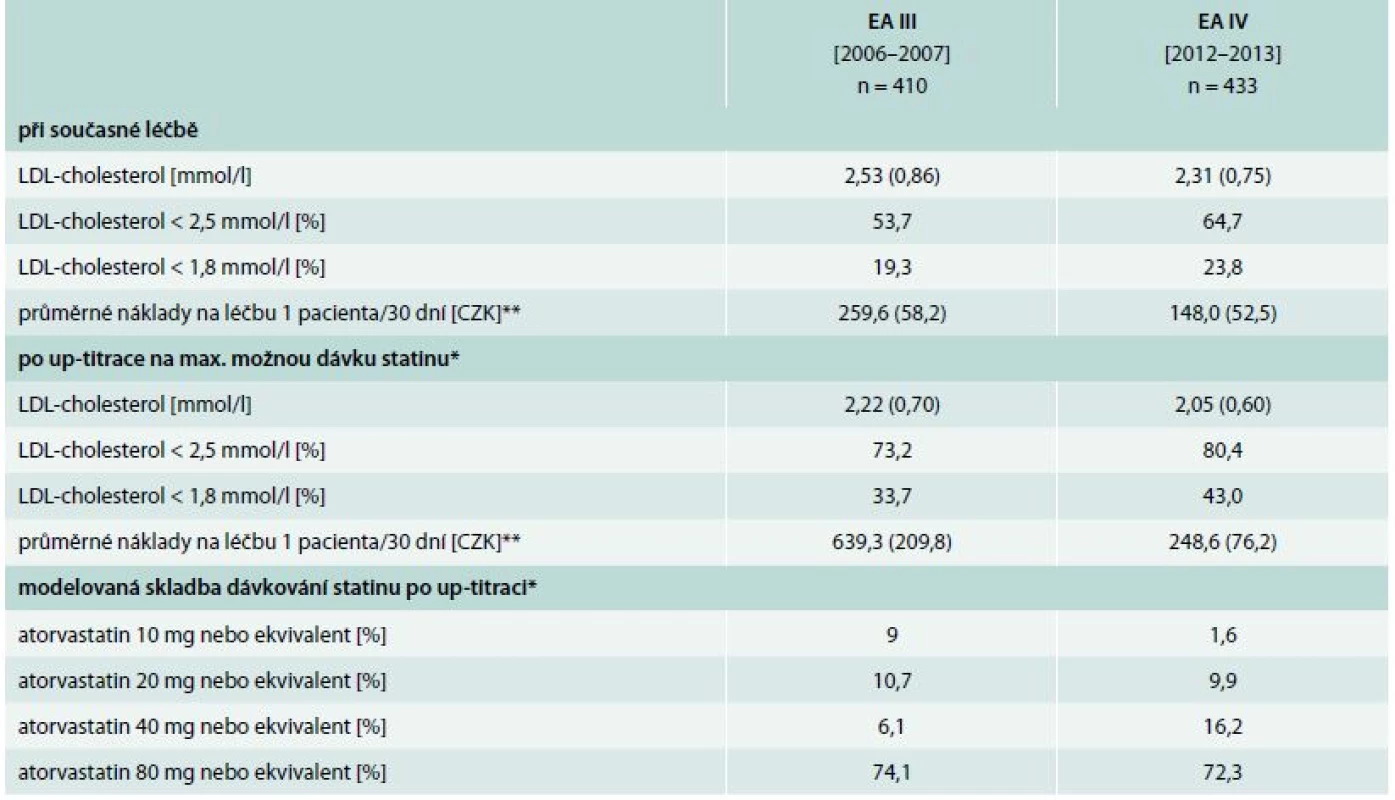
* blíže popsáno v oddíle Metodika ** kalkulováno podle skutečných nákupních cen pro příslušné léčivo ve Fakultní lékárně FN Plzeň v říjnu roku 2007 a listopadu roku 2013 Pokusili jsme se rovněž odhadnout finanční náklady maximální možné up-titrace. V letech 2006/2007 by takto náklady na 30 dní léčby statinem u jednoho pacienta stouply vice než dvojnásobně, ze skutečných asi 260 Kč na teoretických 640 Kč po up-titraci. Na druhé straně, v letech 2012/2013 by očekávatelný vzestup byl již méně než 70 % a i celkově jsou náklady před i po up-titraci výrazně nižší než v předcházejícím období.
Úpravy dávkování v ambulantní péči
Analyzovali jsme také, nakolik byla dávka statinu dále upravována v ambulantní péči (tab. 4). U asi 48 % byla zachována dávka doporučená v době propuštění z hospitalizace pro zařazovací příhodu (akutní koronární syndrom či elektivní revaskularizaci), zvýšena byla u 24,3 %, zatímco naopak snížení dávky či úplné vysazení statinu bylo pozorováno u 24,7 % pacientů. Statin nebyl při propuštění vůbec doporučen pouze u 3,5 % pacientů. Rozdíly v dosažení doporučené cílové hodnoty LDL-cholesterolu byly mezi těmito skupinami v podstatě minimální, pouze pacienti, u nichž byla dávka v ambulantní péči zvýšena, vykazovali signifikantně vyšší adherenci k cílové hodnotě LDL-cholesterolu < 1,8 mmol/l.
Table 4. Změna dávkování statinu v ambulantní péči po propuštění z hospitalizace pro zařazovací příhodu 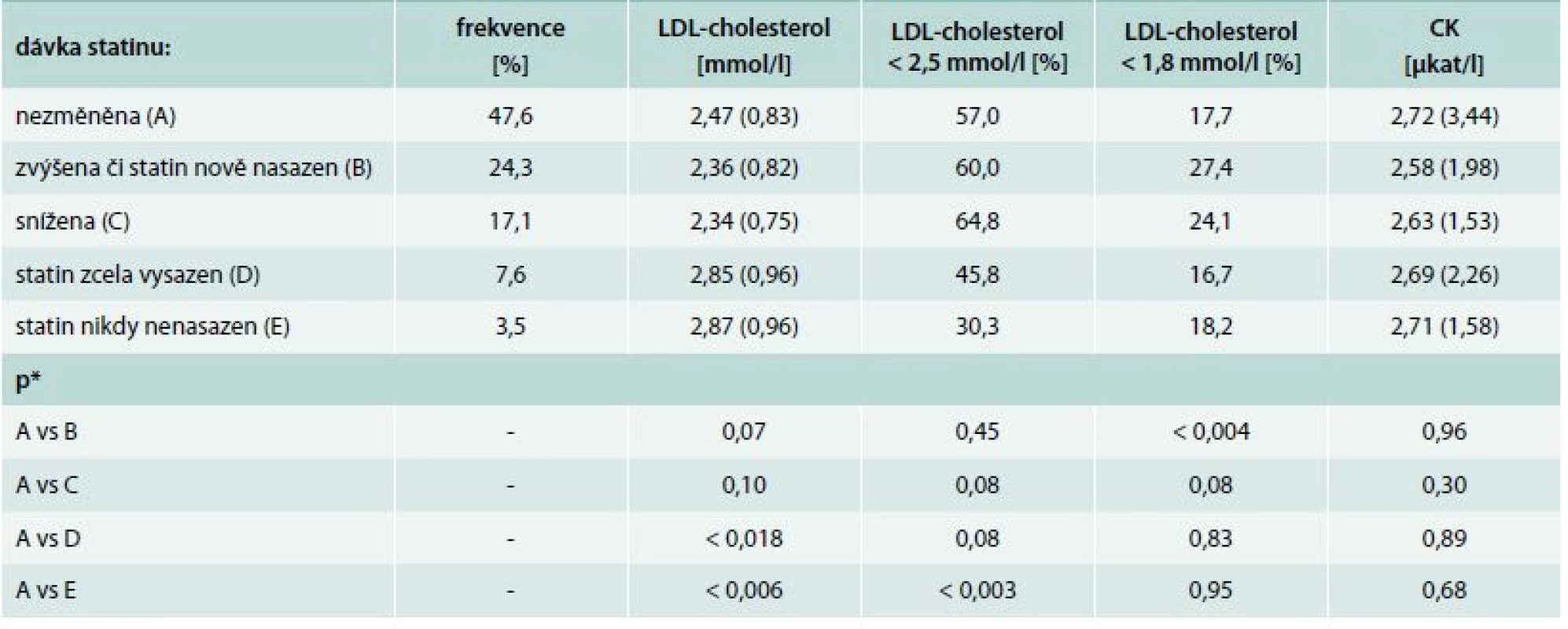
*Mannův-Whitneyův U test či χ2 test Diskuse
V naší studii jsme objektivizovali, že statiny jsou u českých pacientů s chronickou ICHS výrazně poddávkovány. Přestože důkazy přínosu intenzivní léčby statinem oproti standardně dávkované jsou přesvědčivé [2–6] (a poměrně dlouho známé), nejvyšší dávkování statinem (80 mg atorvastatinu či ekvivalent) bylo užíváno pouze 2,4 % pacientů vyšetřených v letech 2012/2013 (zatímco u žádných v letech 2006/2007). Lze pozorovat pouze jednoznačný vzestup v preskripci středně dávkovaného statinu (40 mg atorvastatinu nebo ekvivalent) mezi lety 2006/2007 a 2012/2013 z asi 5 % na takřka 35 %, s čímž pravděpodobně souvisí i signifikantní pokles průměrné hladiny LDL-cholesterolu v tomto období a rámcové zlepšení adherence k tehdy akceptované cílové hodnotě LDL-cholesterolu < 2,5 mmol/l. Na druhé straně, i této původní cílové hodnoty dosáhly jen asi 2/3 pacientů, natožpak nového, daleko striktnějšího cíle < 1,8 mmol/l (adherence k tomuto cíli byla méně než čtvrtinová). Je tedy zcela evidentní, že v současné klinické praxi není dosažitelný potenciál statinu k redukci fatálních a nefatálních příhod v sekundární prevenci ICHS plně využit.
Jakou máme reálnou šanci dosáhnout nové cílové hodnoty LDL-cholesterolu?
V naší studii jsme se pokusili modelovat, nakolik by se zlepšila adherence k původní i nové cílové hodnotě LDL-cholesterolu při maximální možné up-titraci statinu. Vycházeli jsme při tom z celkem akceptovaného tzv. „pravidla 6“ předpokládajícího, že zdvojnásobení dávky libovolného statinu povede k asi 6% poklesu původní hodnoty LDL-cholesterolu [10]. Při použití toho pravidla jsme odhadli, že po maximální možné up-titraci by starší cílové hodnoty LDL-cholesterolu < 2,5 mmol/l dosáhlo až 80 % pacientů, zatímco nového striktnějšího cíle < 1,8 mmol/l pouze maximálně asi 43 % pacientů. Nutno zdůraznit, že k dosažení toho cíle by 72–74 % pacientů muselo užívat statin v nejvyšší možné dávce (či jinak řečeno, pouze asi jen 1/4 pacientů s ICHS vystačí se středně dávkovaným či nízko dávkovaným statinem, což je současná klinická realita).
Naskýtá se tedy otázka, jak dále v případě, že ani po maximální up-titraci statinu nedosáhneme cílové hodnoty, postupovat. Jednou z možností je samozřejmě stav akceptovat a poslední Doporučení na pro tuto situaci nabízejí jako náhradní cíl „…dosáhnout poklesu LDL-cholesterolu alespoň o 50 %“ [8]. Pokud se však budeme dále snažit o dosažení cílové hodnoty, nutno zvážit možnost kombinační léčby.
Fibráty se pro tuto roli nejeví jako nejvhodnější alternativa, a to především proto, že hrubě postrádáme jasné důkazy přínosu kombinace fibrát + statin v sekundární prevenci. Jediná data, která máme pro tuto kombinaci v sekundární prevenci k dispozici, jsou ze studie ACCORD [11], v níž byla randomizována asi třetina subjektů s manifestní ischemickou chorobu srdeční. Kombinace fenofibrátu se simvastatinem byla spojena pouze s asi 8% nesignifikantní redukcí velkých kardiovaskulárních příhod a navíc se v tomto případě jednalo o kombinaci s pouze nízkou dávkou statinu (20–40 mg simvastatinu). Další námitka, kterou je možno vznést proti kombinaci fibrát + statin v sekundární prevenci, je ohledně bezpečnosti této kombinace. Její riziko je sice v klinické praxi možná vnímáno mnohdy nadneseně, na druhé straně je si však nutno uvědomit, že v sekundární prevenci bychom byli nuceni podávat do kombinace s fibrátem tu nejvyšší dávku statinu (80 mg atorvastatinu), o jejíž bezpečnosti máme zřejmě naprosto nedostatečné údaje. V tomto kontextu je nutno vzpomenout „lékovou katastrofu“ koncem 90. let 20. století, kdy právě kombinace vysokodávkovaného cerivastatinu s gemfibrozilem vedla k řadě nežádoucích účinků (včetně fatálních), přestože se zřejmě jednalo o kombinaci dvou preparátů s relativně vyšší toxicitou oproti ostatním zástupcům stejných farmakologických tříd [12]. Poslední námitku, kterou je možno proti této kombinaci vznést, je její relativně chabá účinnost z hlediska potenciálu k dalšímu snížení LDL-cholesterolu (necelých 6 %) [13], v jiné studii dokonce jen asi 1 % [14].
Dalšího kandidáta pro kombinační léčbu v sekundární prevenci představuje ezetimib. Z hlediska hypolipidemické účinnosti můžeme od tohoto preparátu očekávat po přidání k libovolnému statinu další asi 20–25% pokles LDL-cholesterolu [15,16]. Pokud bychom tedy tento očekávatelný účinek aplikovali na náš soubor, lze teoreticky dosáhnou zlepšení adherence k cílové hodnotě LDL-cholesterolu < 1,8 mmol/l u zhruba 57 % pacientů. Ezetimib jakožto vhodný preparát do kombinace se statinem vzbuzoval dlouhou dobu řadu kontroverzí, zejména po té, co jeho efektivitu na snížení rozsahu aterosklerotického postižení zpochybnila studie ENHANCE [17]. Nicméně nedávno prezentované (na konferenci AHA v listopadu roku 2014) výsledky studie IMPROVE-IT [18] efektivitu kombinace ezetimib + statin v sekundární prevenci potvrdily. Do této studie bylo randomizováno 18 144 pacientů bezprostředně (do 10 dnů) po akutním koronárním syndromu. Kombinace ezetimib + simvastatin byla během 7 let sledování (jedná se pravděpodobně o dosud nejdelší realizovaný intervenční trial) spojená se signifikantním 6,4% poklesem incidence primárního endpointu (velká kardiovaskulární příhoda, úmrtí z kardiovaskulární příčiny, revaskularizace myokardu nebo nestabilní angina pectoris) oproti monoterapii simvastatinem. Přes nesporný úspěch, který tato studie představuje (jedná se v podstatě o první důkaz účinku jiného hypolipidemika než statinu v sekundární prevenci , a tím i potvrzení „cholesterolové teorie“), zůstávají přesto nezodpovězené otázky. Jedním z cílů této studie bylo prokázat, že i standardně dávkovaným statinem lze dosáhnout náležité adherence k cílové hodnotě LDL-cholesterolu, pokud bude kombinován s ezetimibem, což se i podařilo – větev s kombinační léčbou zahrnovala až 94 % pacientů léčených pouze 40 mg simvastatinu, zatímco jen 6 % s 80 mg. Toho však bylo docíleno také asi tím, že do studie byli zařazováni pacienti s poměrně příznivými vstupními hodnotami LDL-cholesterolu (> 2,6 mmol/l u již dříve léčených či > 3,24 mmo/l bez hypolidemické léčby). Daleko důležitější však je, že nelze pominout velmi robustní důkazy toho, že intenzivní léčba statinem je z hlediska redukce rizika kardiovaskulárních příhod účinnější (v podstatě nezávisle na vstupní hodnotě LDL-cholesterolu) než léčba standardní [2–6]. S ohledem na tyto důkazy je tedy správnější přístup v sekundární prevenci ICHS léčit pacienta maximální tolerovanou dávku statinu, a teprve pokud poté nebude dosaženo cílové hodnoty, přidat do kombinace ezetimib.
Nového nadějného kandidáta pro kombinační hypolipidemickou léčbu představují inhibitory PCSK-9 (proprotein convertase subtilisin-kexin type 9) – ve fázi klinického testování jsou nyní přinejmenším 3 zástupci této farmakologické třídy (evolokumab, alirokumab, bokocizumab). Tato nová hypolipidecká třída zatím vykazuje poměrně impresivní hypolipidemický potenciál. Ve studii DESCARTES [19] byla jednoroční léčba evolokumabem provázena dalším asi 57% poklesem LDL-cholesterolu po přidání k atorvastatinu 80 mg či dalším asi 49% poklesem, pokud byla přidána ke kombinaci 80 mg atorvastatinu + 10 mg ezetimibu. Potvrzení přínosu z hlediska redukce rizika fatálních a nefatálních příhod pro tuto novou skupinu hypolipidemik v sekundární prevenci nám však mohou přinést až výsledky studie FOURIER nejdříve v letech 2016/2017.
Brání nám něco v maximalizaci dávky statinů?
Podávání maximální dostupné dávky libovolného léku není v klinické praxi obvykle příliš populární, v převážné většině případů tomu však brání spíše důvody psychologické. Z důvodů racionálních je samozřejmě nejčastější obava lékaře či pacienta z nežádoucího účinku. Je však nutno zdůraznit, že statiny mají excelentní bezpečnostní profil. Nejvíce obávaný nežádoucí účinek pozorovaný u statinů, tj. rabdomyolýza, je extrémně vzácný (vyskytuje se asi u 1 pacienta z 23 727 léčených po dobu 1 roku [12]), naopak pouze mírné poškození příčně pruhovaného svalu probíhá v naprosté většině případů subklinicky a navíc na dávce statinu spíše nezávisle. V našem souboru vykazovalo asi 21 % nadnormální hodnotu CK, nicméně 4násobné zvýšení normální hodnoty (bez průvodních myalgii) vykazovalo pouze 7 pacientů (0,8 % souboru). Studie Newmana et al z roku 2006 na celkovém souboru více než 14 000 pacientů nenašla žádný rozdíl ve výskytu myalgií mezi léčenými 10 mg a 80 mg atorvastatinu; výskyt myalgií byl navíc pouze zhruba 2násobný než u placeba a pouze u 2 pacientů užívajících 80 mg atorvastatinu (0,06 %) bylo pozorováno 10násobné (klinicky jinak asymptomatické) zvýšení [20].
Z dalších možných nežádoucích účinků bylo sice prokázáno mírné prodiabetogenní působení statinu [21], závislé tentokrát na dávce [22]. Na druhé straně přínos z hlediska redukce kardiovaskulárního rizika několikanásobně převyšuje potenciální negativní impakt tohoto nežádoucího účinku [22].
Preskripci vysokodávkovaného statinu v sekundární prevenci ICHS by také již neměly bránit ekonomické důvody. Díky masivnímu zlevnění statinu na podzim roku 2013 by skutečné náklady na léčbu statinem u pacientů v našem souboru činily méně než 60 % nákladů v letech 2006/2007. Maximální teoretická up-titrace by tyto náklady zvedla pouze jen o asi 67 % (v průměru 100 Kč na 1 pacienta/30 dní), přičemž finální průměrné náklady by i tak zůstávaly nižší než skutečná průměrná cena léčby v letech 2006/2007.
Jak prakticky při léčbě statinem v sekundární prevenci postupovat?
Statin má být nasazen ihned v době primomanifestace či primodiagnózy ICHS, lze však postupovat dvěma způsoby. Buď budeme dávku statinu postupně ambulantně navyšovat, dokud nebude dosaženo předepsané cílové hodnoty LDL-cholesterolu, nebo pacientovi ihned zpočátku (nejčastěji v době infarktu) předepíšeme dávku nejvyšší. Pro druhý přístup hovoří několik argumentů. Jak je evidentní i v našem souboru, „ochota“ up-titrovat již jednou předepsanou dávku statinu byla poměrně nízká (u méně než 25 % pacientů). Pokud tedy bude zahájena léčba rovnou nejvyšší dávkou již v době hospitalizace pro akutní koronární příhodu či elektivní revaskularizaci (a bude to náležitě zdůrazněno v propouštěcí zprávě), je větší šance, že to bude respektováno i v ambulantní péči. Podle našich výsledků pouze asi čtvrtina pacientů bude takto léčena „zbytečně vysokou“ dávkou statinu. Existují však již poměrně přesvědčivé důkazy (např. v podobně zmíněné studie IMPROVE-IT), že pacienti s ICHS mohou profitovat i z nižší cílové hodnoty než současných < 1,8 mmol/l (čili i pro tyto „zbytečně intenzivně léčené“ pacientů je agresivní dávkování statinu nejspíše přínosné). Samozřejmě je nutno mít stále na paměti (byť minimální) riziko nežádoucího účinku a pacienty náležitě poučit také o možnosti event. lékových interakcí (např. s verapamilem, makrolidovými antibiotiky, fibráty či další méně často předepisovaným léčivy).
Limitace studie
Naše studie zahrnuje pouze pacienty iniciálně ošetřené a dále akumulované kolem velkých nemocnic univerzitního typu. Nemůžeme tedy vyloučit, že mimo větší aglomerace může být situace v preskripci statinů a jejich dávkování odlišná (horší?) Na druhé straně speciálně problematika významu statinů v sekundární prevenci je u nás široce implementována do klinického povědomí a narážíme zde tedy již spíše na limity ochoty pacientů léčbu náležitě užívat než na neinformovanost lékaře. Přestože jsme vycházeli z reálných individuálních hodnot LDL-cholesterolu u pacientů s ICHS, analýza efektu maximalizace dávky představuje pouze teoretický model, nikoliv efekt skutečně realizované intervence. Je tedy pravděpodobné, že skutečný impakt maximalizace individuálních dávek statinu na zlepšení adherence k cílové hodnotě LDL-cholesterolu by byl v reálné situaci menší.
Závěry
V naší studii jsme prokázali, že v klinické praxi je dávkování statinu v sekundární prevenci ICHS nedostačující a v souhrnu neodpovídá plně současným poznatkům a doporučením. Na druhé straně však maximalizace dávky statinu představuje poměrně snadné a i ekonomicky dostupné opatření, jak se dále přiblížit plnému potenciálu sekundární prevence k zabránění fatálním i nefatálním recidivám kardiovaskulárních chorob. Nadějný koncept představuje také kombinační hypolipidemická léčba.
Předkládaná analýza byla realizována za grantové podpory Interní grantové agentury Ministerstva zdravotnictví ČR (NT 13186) a v rámci Programu rozvoje vědních oborů Karlovy univerzity (projekt P36). Projekt EUROASPIRE byl do České republiky přinesen z iniciativy prof. MUDr. Jaroslava Šimona (zemřel v roce 2010), tehdy jako člena Pracovní skupiny preventivní kardiologie ESC, která tento projekt spustila. Jmenovitě bychom chtěli poděkovat všem dalším spolupracovníkům, kteří studie EUROASPIRE III a IV s námi realizovali (podle abecedního pořádku): V. Adámková3, J. Bělohoubek3, R. Cífková2, J. Filipovský1, J. Jeschke1, M. Galovcová3, A. Krajčoviechová2, M. Patraulea1, H. Rosolová1, J. Seidlerová1, K. Timoracká1, P. Vagovičová1, J. Vaněk1 a P. Wohlfahrt2 (1II. interní klinika LF UK a FN Plzeň; 2Centrum kardiovaskulární prevence 1. LF UK a Thomayerovy nemocnice Praha; 3Pracoviště preventivní kardiologie IKEM Praha).
doc. MUDr. Otto Mayer jr, CSc.
mayero@fnplzen.cz
Centrum preventivní kardiologie II. interní kliniky LF UK a FN Plzeň
www.fnplzen.cz
Doručeno do redakce 1. 3. 2015
Přijato po recenzi 8. 4. 2015
Sources
1. Baigent C, Keech A, Kearney PM et al. Cholesterol Treatment Trialists‘ (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective metaanalysis of data from 90,056 participants in 14 randomised trials of statins. Lancet 2005; 366(9493): 1267–1278.
2. Cannon CP, Braunwald E, McCabe CH et al. Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 Investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med 2004; 350(15): 1495–1502. Erratum in N Engl J Med 2006; 354(7): 778.
3. LaRosa JC, Grundy SM, Waters DD et al. Treating to New Targets Investigators, Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352(14): 1425–1435.
4. de Lemos JA, Blazing MA, Wiviott SD et al. A-to-Z Investigators. Early intensive vs. a delayed conservative simvastatin strategy in patients with acute coronary syndromes phase Z of the A-to-Z trial. JAMA 2004; 292(11): 1307–1316.
5. Pedersen TR, Faergeman O, Kastelein JJ et al. Incremental Decrease in End Points Through Aggressive Lipid-Lowering Study Group. High-dose atorvastatin versus usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA 2005; 294(19): 2437–2445. Erratum in JAMA 2005 28; 294(24): 3092.
6. Cannon CP, Steinberg BA, Murphy SA et al. Meta-analysis of cardiovascular outcomes trials comparing intensive versus moderate statin therapy. J Am Coll Cardiol 2006; 48(3): 438–445.
7. Graham I, Atar D, Borch-Johnsen K et al. European guidelines on cardiovascular disease prevention in clinical practice: executive summary. Fourth Joint Task Force of the European Society of Cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of nine societies and by invited experts). Eur J Cardiovasc Prev Rehabil 2007; 14(Suppl 2): E1-E40.
8. Perk J, De Backer G, Gohlke H et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012; 33(13): 1635–1701.
9. Kotseva K, Wood D, De Backer G et al. EUROASPIRE Study Group. EUROASPIRE III: a survey on the lifestyle, risk factors and use of cardioprotective drug therapies in coronary patients from 22 European countries. Eur J Cardiovasc Prev Rehabil 2009; 16(2): 121–137.
10. Knopp RH. Drug treatment of lipid disorders. N Engl J Med 1999; 341(7): 498–511.
11. Ginsberg HN, Elam MB, Lovato LC et al. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362(17): 1563–1574. Erratum in N Engl J Med 2010; 362(18): 1748.
12. Antons KA, Williams CD, Baker SK et al. Clinical perspectives of statin-induced rhabdomyolysis. Am J Med 2006; 119(5): 400–409.
13. Grundy SM, Vega GL, Yuan Z et al. Effectiveness and tolerability of simvastatin plus fenofibrate for combined hyperlipidemia (the SAFARI trial). Am J Cardiol 2005; 95(4): 462–468.
14. Durrington PN, Tuomilehto J, Hamann A et al. Rosuvastatin and fenofibrate alone and in combination in type 2 diabetes patients with combined hyperlipidemia. Diabetes Res Clin Pract 2004; 64(2): 137–151.
15. Cruz-Fernandez J, Bedarida G, Adgey J et al. Efficacy and safety of ezetimibe co-administered with ongoing atorvastatin therapy in achieving low-density lipoprotein goal in patients with hypercholesterolemia and coronary heart disease. Int J Clin Pract 2005; 59(6): 619–627.
16. Ballantyne C, Abate N, Yuan Z et al. Dose-comparison study of the combination of ezetimibe and simvastatin (Vytorin) versus atorvastatin in patients with hypercholesterolemia: the Vytorin Versus Atorvastatin (VYVA) study. Am Heart J 2005; 149(3): 464–473.
17. Kastelein JJ, Akdim F, Stroes ES et al. ENHANCE Investigators. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med 2008; 358(14): 1431–1443.
18. Blazing MA, Giugliano RP, Cannon CP et al. Evaluating cardiovascular event reduction with ezetimibe as an adjunct to simvastatin in 18,144 patients after acute coronary syndromes: final baseline characteristics of the IMPROVE-IT study population. Am Heart J 2014; 168(2): 205–212.
19. Blom DJ, Hala T, Bolognese M et al. DESCARTES Investigators. A 52-week placebo-controlled trial of evolocumab in hyperlipidemia. N Engl J Med 2014; 370(19): 1809–1819.
20. Newman C, Tsai J, Szarek M et al. Comparative safety of atorvastatin 80 mg versus 10 mg derived from analysis of 49 completed trials in 14,236 patients. Am J Cardiol 2006; 97(1): 61–67.
21. Sattar N, Preiss D, Murray HM et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet 2010; 375(9716): 735–742.
22. Preiss D, Seshasai SR, Welsh P et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA 2011; 305(24): 2556–2564.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 5-
All articles in this issue
- Vliv spironolaktonu u pacientů se srdečním selháním a zachovalou funkcí levé komory – studie TOPCAT
- Nová verze klasifikace plicní hypertenze
- Hypertenze u žen
- Vplyv pridania fytosterolu ku hypolipidemickej liečbe statínom na veľkosť lipoproteínových partikúl u pacientov s veľmi vysokým kardiovaskulárnym rizikom
- Hypertenze bílého pláště a maskovaná hypertenze
- Personalizovaná farmakoterapie digoxinem
- Kontroverze kolem betablokátorů
- Je potřeba léčit agresivně fibrilaci síní?
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Ambulantní léčba žilní plicní embolie
- Současný stav a budoucnost péče o nemocné s vrozeným srdečními vadami
- Inhibice systému renin-angiotenzin-aldosteron u srdečního selhání aneb od obecného souhlasu (CONSENSUS) po vzorec myšlení (PARADIGM-HF)
- Hemokoagulace – nové pohledy na starou kaskádu
- Primární hyperaldosteronizmus: problémy diagnostických přístupů
- Neurokardiologie nebo kardioneurologie – nová specializace budoucnosti?
- Feochromocytom – proč je jeho časná diagnóza pro pacienta důležitá?
- Nakolik jsme schopni dosáhnout současně platných cílových hodnot LDL-cholesterolu v sekundární prevenci ischemické choroby srdeční
- Čo môže zapríčiniť diabetes
- Hyperosmolární hyperglykemický stav
- Kombinační léčba hypertenze 2015
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyperosmolární hyperglykemický stav
- Hemokoagulace – nové pohledy na starou kaskádu
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Hypertenze u žen
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

