-
Medical journals
- Career
Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti
Authors: M. Kršek 1; J. Čáp 2; V. Hána 1; J. Marek Za Výbor České Endokrinologické Společnosti České Lékařské Společnosti J. E. Purkyně 1
Authors‘ workplace: III. interní klinika – klinika endokrinologie a metabolizmu 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Štěpán Svačina, DrSc., MBA 1; IV. interní hematologická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta doc. MU Dr. Pavel Žák, Ph. D. 2
Published in: Vnitř Lék 2013; 59(9): 819-827
Category: Guidelines
Overview
Cushingův syndrom je vzácné onemocnění s variabilní etiologií spojené s významně zvýšenou morbiditou a mortalitou postižených pacientů. Z tohoto důvodu je nezbytné včasné stanovení etiologicky správné diagnózy a časná léčba vedoucí ke zmírnění postižení pacientů a snížení jejich morbidity a mortality. Článek představuje shrnutí současných doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu.
Klíčová slova:
Cushingův syndrom – léčba – doporučeníÚvod
Cushingův syndrom (CS) je charakterizován nadměrnou autonomní produkcí kortizolu a jeho klinické příznaky jsou vyvolány působením zvýšených koncentrací kortizolu v cirkulaci na tkáně organizmu. Poprvé byl popsán Harvey Cushingem. Jedná se o vzácné onemocnění s odhadovanou incidencí 2 – 4 případy na 1 000 000 obyvatel a 1 rok [1,2].
CS je klinicky charakterizován komplexním postižením organizmu zahrnujícím centripetální obezitu s disproporčně tenkými končetinami, akumu-laci tuku na obličeji (měsícovitý obličej), krku (buffalo hump) a v některých dalších atypických místech, purpurovými striemi na kůži břicha, ale někdy i hýždích, axilách apod., steroidní atrofií kůže, tvorbou hematomů, kožních infekcí, zvláště u žen je časté akné a hirsutizmus. Dochází k poruše metabolizmu všech základních živin, katabolizmu proteinů, ukládání tuků, inzulinorezistenci či poruše glukózového metabolizmu, dyslipidemii. Komplexním mechanizmem dochází též k úbytku kostní hmoty (osteopenie, osteoporóza). Hyperkortizolemie vede k hyperkoagulačnímu stavu, který je společně s uvedenými metabolickými odchylkami příčinou zvýšeného kardiovaskulárního rizika pacientů s CS. Působení kortizolu vede dále k psychickým poruchám (zejména afektivní poruchy, deprese), imunosupresivní účinky vedou ke zvýšenému sklonu k infekcím, zejména bakteriálním, dochází ze zvýšení nitroočního tlaku, je zvýšené riziko glaukomu a vzniku katarakty. CS je spojen s významně zvýšenou celkovou morbiditou a mortalitou, zejména díky morbiditě a mortalitě kardiovaskulární [3,4]. Typický vzhled pacientky s CS je uveden na obr. 1.
Image 1. Typický vzhled pacientky s Cushingovým syndromem (z archivu prof. Michala Krška). 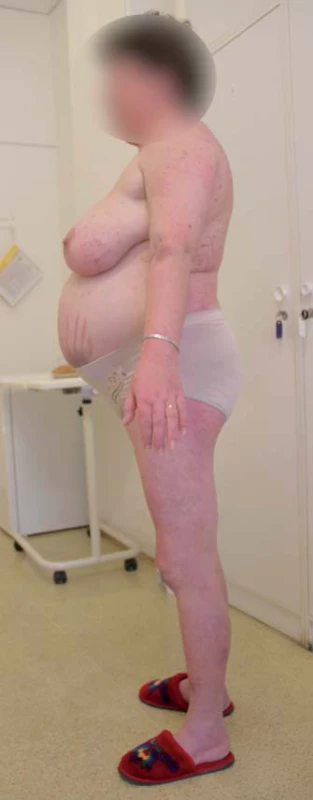
Vzhledem k závažnosti postižení pacientů s CS je nezbytné včasné a správné stanovení diagnózy a diferenciální diagnózy a včasná volba správného terapeutického postupu. Předmětem tohoto článku je doporučení terapeutických postupů u jednotlivých forem CS.
Etiologie a diferenciální diagnostika Cushingova syndromu
CS má multifaktoriální etiologii. Endogenní CS dělíme na častější (asi 75 – 80 %) CS způsobený primárně nadprodukcí ACTH, tzv. ACTH ‑ dependentní Cushingův syndrom, a méně častý (asi 20 – 25 %) CS způsobený primárně nadprodukcí kortizolu v kůře nadledvin. Rozdělení CS podle etiologie je uvedeno v tab. 1. Podobný klinický obraz jako endogenní CS může mít CS při exogenním přívodu glukokortikoidů, nejčastěji v důsledku systémové léčby glukokortikoidy (iatrogenní CS).
Table 1. Přehled etiologie endogenního Cushingova syndromu [36]. ![Přehled etiologie endogenního Cushingova syndromu [36].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b5adfe156a22290f2aaf7136a1bd7eda.png)
Pro stanovení správného terapeutického postupu je nezbytné správné stanovení diagnózy a diferenciální diagnózy Cushingova syndromu. Diagnostický a diferenciálně diagnostický terapeutický postup patří mezi nejobtížnější v klinické endokrinologii. Základní přehled diagnostiky a diferenciální diagnostiky Cushingova syndromu je uveden podrobně v řadě publikací [5 – 7]. Stručné schéma diferenciální diagnostiky CS a její výstupy pro terapii jsou uvedeny na obr. 2.
Image 2. Zjednodušené schéma diagnostiky, diferenciální diagnostiky a terapeutických výstupů u Cushingova syndromu [37]. ![Zjednodušené schéma diagnostiky, diferenciální diagnostiky a terapeutických výstupů u Cushingova syndromu [37].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/10f17ada28afbe0a1454e67ff80d7148.jpg)
Cíle léčby Cushingova syndromu
Obecné cíle léčby CS jsou následující:
- Normalizace hormonální aktivity, resp. produkce kortizolu.
- Snížení morbidity a mortality.
- Odstranění etiologické příčiny CS.
- Normalizace funkce osy hypotalamus ‑ hypofýza ‑ nadledviny (HPA).
- Zabránění či minimalizace rizika recidivy CS.
Léčba ACTH ‑ dependentního Cushingova syndromu
ACTH‑ dependentní Cushingův syndrom rozdělujeme podle zdroje nadprodukce ACTH, který je nejčastěji v hypofýze (Cushingova choroba), méně často ACTH produkují jiné tumory (ektopický ACTH syndrom, paraneoplastický CS).
Léčba Cushingovy choroby (centrálního Cushingova syndromu)
Příčinou Cushingovy choroby (CD) je v naprosté většině případů ACTH produkující adenom hypofýzy, jiné příčiny jsou raritní (tab. 1).
Neurochirurgické odstranění tumoru hypofýzy je metodou první volby v léčbě CD. Dnes se provádí v naprosté většině případů transsfenoidálním přístupem. Výsledky léčby jsou závislé na zkušenosti centra, operatéra, velikosti a lokalizaci adenomu hypofýzy. Za minimální doporučený roční počet transsfenoidálních výkonů na 1 operatéra je považováno 50 operací. U prvního transsfenoidálního výkonu provedeného ve zkušeném centru je pro mikroadenomy udávaná úspěšnost (cure rate) 80 – 90 %, pro makroadenomy pak přibližně 50% [8]. Opakované operace mají úspěšnost výrazně nižší. Ideálním výsledkem operace je selektivní odstranění adenomu a normalizace hormonální sekrece při zachování normálních funkcí hypofýzy.
Pro časné posouzení úspěšnosti operace je doporučováno více postupů. Nejvíce používaným je stanovení ranní (8.00 – 9.00 hod) koncentrace sérového kortizolu po 24hodinovém vynechání substituce hydrokortizonem, prováděné obvykle 5. pooperační den. Pro úspěšnost výkonu svědčí suprimované koncentrace kortizolu, obvykle pod 30 nmol/ l [9]. Rozhodující je však další sledování nemocného a laboratorních výsledků a jejich vývoj.
Pooperačně je nutné počítat s funkčním útlumem osy HPA, viz „Perioperační zajištění chirurgické léčby pacientů s Cushingovým syndromem“.
Radiační terapie je doporučena jako metoda 2. volby při neúspěchu primooperace, kdy volíme mezi 2. operací, radiační terapií nebo medikamentózní léčbou. V současné době používáme stereotaktické metody radiační terapie. V ČR nejčastěji radiochirurgickou léčbu Leksellovým gama nožem (LGN). Zřídka můžeme radiační terapii použít i jako léčbu 1. volby, především u pacientů s vysokým rizikem neurochirurgického výkonu nebo u pacientů, kteří chirurgickou léčbu odmítnou.
Pro léčbu LGN musejí být splněny některé podmínky týkající se velikosti a lokalizace tumoru hypofýzy, především vzdálenost od n. opticus minimálně 2 mm. Pokud není možno použít LGN, alternativně může být indikována konformní frakcionovaná radioterapie.
Pro provedení radioterapie je nutno počítat s postupným uplatňováním efektu ozáření. Medián normalizace hormonální aktivity se pohybuje přibližně mezi 2,5 a 3 lety. Po tuto dobu musíme hormonální aktivitu monitorovat a k její normalizaci používat medikamentózní léčbu (viz „Medikamentózní léčba Cushingova syndromu“) [10].
Medikamentózní terapie
V případě potřeby snížení hormonální aktivity onemocnění používáme medikamentózní terapii (viz „Medikamentózní léčba Cushingova syndromu“).
V případě raritního ACTH produkujícího karcinomu hypofýzy máme kromě níže uvedené medikamentózní léčby dnes navíc k dispozici protinádorové chemoterapeutikum temozolamid. Jedná se o derivát imidotetrazinu a patří ke 2. generaci alkylačních cytostatik. Podává se perorálně a existuje několik schémat podávání:
- a) 200 mg/ m2 po dobu 5 dnů, opakovat každých 28 dnů,
- b) 50 mg/ m2 1. – 7. den a 14. – 21. den 28denního cyklu,
- c) 50 – 70 mg/ m2 denně.
Podle publikovaných údajů je popisováno signifikantní zmenšení tumoru hypofýzy až v 60 % případů. Je dobře tolerovaný, nejvýznamnějším vedlejším účinkem je myelosuprese, která je závažná u 17 % léčených pacientů.
Bilaterální adrenalektomie
U pacientů s CD s trvající hormonální aktivitou neřešitelnou výše uvedenými způsoby máme k dispozici provedení bilaterální adrenalektomie jako definitivního řešení hyperkortizolizmu. Bilaterální adrenalektomii jsme dnes nuceni indikovat jen výjimečně. Její výhodou je rychlé a definitivní řešení hyperkortizolizmu (ne však etiologické), nevýhodami jsou nutnost doživotní substituce hypokortikalizmu a nebezpečí rozvoje Nelsonova syndromu. Jako Nelsonův syndrom označujeme rychlý a často agresivní růst ACTH produkujícího tumoru hypofýzy po provedení bilaterální adrenalektomie.
Léčba ektopického ACTH syndromu (paraneoplastického Cushingova syndromu)
Strategie a taktika léčby ektopického ACTH syndromu závisí na konkrétním ACTH produkujícím tumoru, jichž byly popsány řádově desítky, jak benigních, tak maligních. Přibližně v 80 % případů se zdroj ektopické nadprodukce ACTH vyskytuje v oblasti hrudníku a mediastina a jedná se většinou o plicní karcinoid nebo malobuněčný plicní karcinom.
Chirurgická terapie je metodou 1. volby při léčbě ektopického ACTH produkujícího tumoru a může být kurativní (např. u bronchiálního karcinoidu nebo karcinoidu thymu).
Specifická protinádorová chemoterapie je indikována u maligních tumorů nevyřešených nebo neřešitelných pouze chirurgicky.
Terapie analogy somatostatinu může být indikována u neuroendokrinních tumorů ektopicky produkujících ACTH a exprimujících somatostatinové receptory. K systémové terapii neuroendokrinních tumorů produkujících ACTH používáme superaktivní analoga somatostatinu (lanreotid, octreotid, pasireotid) [11] nebo máme k dispozici cílenou terapii radioaktivně značenými analogy somatostatinu [12].
Medikamentózní terapie
V případě potřeby snížení hormonální aktivity onemocnění používáme medikamentózní terapii (viz „Medikamentózní léčba Cushingova syndromu“).
Bilaterální adrenalektomie
U pacientů s trvající hormonální aktivitou neřešitelnou výše uvedenými způsoby máme k dispozici rovněž provedení bilaterální adrenalektomie jako definitivního řešení hyperkortizolizmu. Její výhodou je rychlé a definitivní řešení hyperkortizolizmu (ne však etiologické), nevýhodou je nutnost doživotní substituce hypokortikalizmu.
Léčba ACTH ‑ independentního Cushingova syndromu
Léčba adenomu nadledviny
Chirurgická terapie je metodou 1. volby v léčbě kortizol produkujících adenomů. Je kurativním výkonem prakticky ve 100 % [13]. V současné době se až na výjimky, týkající se především gigantických tumorů, provádí laparoskopicky. Laparoskopická technika výrazně snížila perioperační morbiditu a mortalitu a urychlila rekonvalescenci [14].
Jiné formy terapie kortizol produkujících adenomů nadledvin nepřicházejí prakticky do úvahy. Pouze u řídkých případů pacientů neschopných podstoupit léčbu chirurgickou by přicházela do úvahy medikamentózní terapie. V případě použití inhibitorů steroidogeneze je vyšší nebezpečí vzniku hypokortikalizmu vzhledem k funkční blokádě osy HPA. Je proto potřeba opatrného dávkování a častého sledování efektu léčby.
Léčba karcinomu kůry nadledviny
Chirurgická terapie je metodou 1. volby při léčbě karcinomu kůry nadledviny v I. a II. stadiu. Odstranění primárního tumoru či debulking, případně odstranění resekabilních metastáz, je doporučováno i v případě generalizace. Přístup (laparoskopický či otevřený) je volen individuálně dle nálezu.
Medikamentózní terapie protinádorová je předmětem onkologie, na tomto místě je uveden pouze orientační přehled. Používá se u generalizovaného či reziduálního karcinomu kůry nadledvin. Vede rovněž k poklesu sekrece kortizolu. V indikovaných případech je indikována i neoadjuvantní či adjuvantní terapie. Základním lékem v léčbě karcinomu kůry nadledviny je mitotan (o, p-DDD), který se používá v monoterapii, nebo je součástí kombinační protinádorové terapie. Nejčastěji používané kombinace jsou: mitotan + streptozotocin, mitotan + cisplatina + etoposid + doxorubicin, gemcitabin + capecitabin. Mezi další zkoušená chemoterapeutika patří irinonectan a paclitaxel. Perspektivní by mohlo být použití inhibitorů angiogeneze (anti‑VEGF, bevacizumab), blokátorů EGF receptoru (cetuximab), inhibitorů tyrozinkinázové aktivity EGF receptoru (erlotinib) [15,16].
Medikamentózní terapie hyperkortizolizmu viz medikamentózní terapie. Lékem volby k potlačení sekrece kortikosteroidů karcinomem nadledviny je mitotan (viz výše). Pokud nestačí, můžeme v kombinaci s mitotanem použít další inhibitory steroidogeneze (ketokonazol, metyrapon).
Radiační terapie se používá buďto jako adjuvantní, nebo jako paliativní léčba [16].
Lokální terapie: V indikovaných případech, zejména při léčbě metastatického postižení, mohou být indikovány metody lokální léčby, radiofrekvenční ablace [17] nebo transarteriální chemo-embolizace [18].
Léčba ACTH ‑ independentní makronodulární adrenální hyperplazie (AIMAH)
Medikamentózní terapie AIMAH. V léčbě hyperkortizolizmu při AIMAH lze v případech, u nichž jsme identifikovali přítomnost aberantních receptorů, použít specifické medikamentózní léčby (tab. 2) [19]. Pokud nebyly aberantní receptory identifikovány, je indikována medikamentózní terapie inhibitory steroidogeneze (viz medikamentózní terapie).
Table 2. Aberantní receptory jako možná příčina ACTH-independentní makronodulární adrenální hyperplazie a potenciální medikamentózní léčba [19]. ![Aberantní receptory jako možná příčina ACTH-independentní makronodulární adrenální hyperplazie a potenciální medikamentózní léčba [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a985610e9e5bcd552f61c8fd056235cf.png)
Chirurgická léčba je indikována v případech, kdy není z jakéhokoliv důvodu proveditelná nebo účinná léčba medikamentózní. V tom případě je indikováno provedení bilaterální adrenalektomie, většinou laparoskopické. V praxi přistupujeme k provedení bilaterální adrenalektomie v naprosté většině případů. Nevýhodou bilaterální adrenalektomie je nutnost doživotní substituce hypokortikalizmu.
Léčba primární pigmentované nodulární adrenální nemoci (PPNAD)
Chirurgická terapie je metodou volby při léčbě PPNAD, provádíme bilaterální adrenalektomii, dnes prakticky výhradně laparoskopickou. Nevýhodou bilaterální adrenalektomie je nutnost doživotní substituce hypokortikalizmu.
Medikamentózní léčba Cushingova syndromu
Indikace medikamentózní léčby
Indikace medikamentózní léčby CS jsou následující:
- Při trvající hormonální aktivitě po neúspěšném chirurgickém řešení a u pacientů, kteří prodělali neurochirurgickou operaci s reziduem adenomu hypofýzy, byla u nich provedena radioterapie a čekáme na nástup jejího účinku.
- K normalizaci nebo snížení hormonální aktivity v případech, kdy se nám nedaří identifikovat zdroj nadprodukce ACTH, jako dočasné řešení mezi vyšetřovacími procedurami nebo kontrolními vyšetřeními.
- Jako paliativní léčbu u inoperabilních stavů a u metastazujících tumorů produkujících kortizol či ACTH.
- Zvláštní indikací je léčba před chirurgickým řešením. Medikamentózní snížení hormonální aktivity předoperačně vede ke korekci metabolických odchylek, ke zlepšení klinického stavu pacientů a pravděpodobně i ke snížení frekvence perioperační a pooperační morbidity a mortality.
Medikamentózní léčbu Cushingova syndromu dělíme podle místa, na kterém zasahuje, na léčbu neuromodulační, adrenolytickou a léčbu antagonisty glukokortikoidních receptorů (tab. 3) [20].
Table 3. Přehled medikamentózní léčby Cushingova syndromu [36]. ![Přehled medikamentózní léčby Cushingova syndromu [36].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/350d6638dbb2e1130e2b290b6f0fbafe.png)
Neuromodulační léčba
Pomocí neuromodulační léčby ovlivňujeme různými mechanizmy na neuroendokrinologické (hypotalamo ‑ hypofyzární) úrovni sekreci ACTH. Je tedy indikována především u CD, analoga somatostatinu mohou být účinná i u některých případů ektopického ACTH syndromu.
Agonisté dopaminu
Agonisty dopaminu primárně využíváme v léčbě prolaktinomů a hyperprolaktinemie, jsou však v některých případech schopné snižovat i sekreci ACTH. V minulosti nečastěji používaný bromocryptin vedl k významnému snížení sekrece kortizolu a ke zlepšení klinického stavu jen u variabilního malého množství pacientů. V současnosti v indikaci léčby Cushingovy nemoci preferenčně používáme cabergolin, který je účinnější a je provázen menším výskytem nežádoucích účinků. Podle některých recentních studií je cabergolin schopen normalizovat vylučování volného močového kortizolu (UFC) až u 36 % pacientů s Cushingovou nemocí, snížit až u 75 % pacientů [21]. Rozmezí používaných dávek je 1 – 7 mg týdně. Dobrý účinek na snížení sekrece ACTH byl popsán i u pacientů s ACTH produkujícím neuroendokrinním tumorem a u pacientů s Nelsonovým syndromem [22,23]. K nežádoucím účinkům patří: nauzea, ortostatická hypotenze, bolesti hlavy, kongesce nosní sliznice, halucinace. Je nutno zmínit teoretickou možnost poškození chlopenního aparátu při dlouhodobém použití vysokých dávek cabergolinu. Proto je doporučováno u léčených pacientů každoroční provedení echokardiografického vyšetření [24].
Analoga somatostatinu
Mezi superaktivní analoga somatostatinu řadíme lanreotid, octreotid a pasireotid. Lanreotid a octreotid se váží preferenčně na 2. podtyp somatostatinových receptorů a s menší afinitou na 5. podtyp somatostatinových receptorů. ACTH produkující adenomy hypofýzy však exprimují preferenčně 5. podtyp. Kortizol navíc vede k potlačení exprese především 2. podtypu somatostatinových receptorů, proto léčba lanreotidem a octreotidem u většiny pacientů s CD selhává, částečné úspěchy byly zaznamenány u pacientů s Nelsonovým syndromem [25]. Nově máme v léčbě CD k dispozici multiligandový analog somatostatinu pasireotid (SOM 230). Pasireotid se váže na všechny podtypy somatostatinových receptorů, nejvíce pak právě na 5. podtyp, ke kterému má 40krát vyšší afinitu než octreotid [26]. Multicentrická studie III. fáze s dlouhodobou léčbou CD pasireotidem u 162 pacientů v dávkách 600, resp. 900 μg s.c. 2krát denně prokázala po 12 měsících u 19,1 % pacientů (13,4 % při dávce 600 μg 2krát denně; 25 % při dávce 900 μg 2krát denně) normalizaci UFC a u 9,3 % (15,9 %, resp. 2,5 %) došlo k významnému poklesu UFC (≥ 50 %). Při léčbě se vyskytovaly nežádoucí účinky společné pro somatostatinová analoga (cholecystolitiáza, bolesti břicha, průjem, nauzea, zvracení, slabost, únavnost, hypotenze, vertigo, bolesti hlavy, elevace jaterních testů) přibližně ve stejné frekvenci jako u lanreotidu a octreotidu. Oproti nim však navíc při léčbě pasireotidem dochází k poměrně vysokému výskytu hyperglykemie, poruchy glukózové tolerance a ke vzniku nebo zhoršení diabetes mellitus (dohromady až v 73 %). Důvodem je pravděpodobně inhibice sekrece inzulinu a hormonů stimulujících sekreci inzulinu. Takto vzniklou poruchu glukózového metabolizmu lze nejlépe ovlivnit podáním analog GLP‑1 nebo inhibitorů DPP ‑ 4 [27].
Další neuromodulačně působící léky
Řada dalších látek byla zkoušena, ale nedostala se do rutinního používání v praxi především pro nízkou účinnost. Patří mezi ně: agonisté PPAR ‑ g, antagonisté receptoru pro 5 - hydroxytryptamin, valproát sodný, deriváty kyseliny retinové [28,29].
Adrenolytická léčba
Adrenolytická léčba je primárně zaměřena na buňky kůry nadledvin a inhibici adrenální steroidogeneze. I přes některé pokroky v poslední době stále zůstává základem medikamentózní léčby CS různé etiologie.
Ketokonazol
Ketokonazol je antimykotikum, které rovněž inhibuje v kůře nadledvin syntézu sexuálních steroidů a kortizolu mechanizmem inhibice 17a ‑ hydroxylázy, C17 – 20 lyázy a syntézy cholesterolu. Při léčbě CS se podává ve vysokých dávkách. Začínáme dávkou 400 mg denně, účinné dávky se pohybují v rozmezí 600 – 1 200 mg denně, rozděleně ve 3 – 4 denních dávkách. V takto vysokých dávkách má řadu nežádoucích účinků, zejména gastrointestinálních (nauzea, zvracení), kožních (raš, alopecie). Nejzávažnější je hepatotoxicita, vzácně může docházek i k závažnému postižení jater charakteru hepatodystrofie s akutním jaterním selháním [30]. Jsou nutné laboratorní kontroly jaterních parametrů. Inhibici syntézy androgenů lze využít u žen, naopak u mužů může podávání ketokonazolu vést k poklesu libida a ke vzniku gynekomastie. Pro optimální vstřebávání je nutná přítomnost kyselého prostředí v žaludku, účinnost ketokonazolu je proto významně snížena u pacientů s achlorhydrií. Nástup účinku ketokonazolu trvá několik týdnů.
Metyrapon
Metyrapon je inhibitor 11b ‑ hydroxylázy a je nejúčinnějším inhibitorem steroidogeneze s rychlým nástupem účinku v prvních 3 dnech podávání. Léčbu zahajujeme dávkou 750 mg denně, rozdělenou do 3 denních dávek a podle účinnosti ji titrujeme, v některých případech až do dávky 3 – 8 g denně rozděleně do 4 denních dávek [31]. Nežádoucí účinky nejsou časté, nicméně zejména při podávání vysokých dávek se může objevit nechutenství, nauzea, zvracení, bolesti břicha, elevace jaterních enzymů, u žen se v důsledku vzestupu koncentrací androgenů může objevit hirsutizmus a akné.
Mitotan
Mitotan (o,p ‑ DDD; orto, para, dichloro, difenyl, dichloroetan) snižuje syntézu kortizolu mechanizmem blokády SCC (side‑chain cleavage), 3β ‑ hydroxysteroidní dehydrogenázy, 11β ‑ hydroxylázy a aldosteronu mechanizmem blokády aldosteronsyntázy. Nástup účinku je pomalý, ale působení je protrahované se supresí funkce kůry nadledvin až několik měsíců po vysazení léčby. Léčbu v případě karcinomu kůry nadledvin obvykle začínáme dávkami 1 – 1,5 g denně a dávku postupně zvyšujeme podle efektu na steroidogenezi a nežádoucích účinků, resp. tolerance až do dávky 6 – 10 g denně. Vhodné je monitorovat koncentraci mitotanu v séru, za terapeutické rozmezí jsou považovány koncentrace 14 – 20 mg/ l. Při léčbě mitotanem je třeba počítat s četnými nežádoucími účinky, především s nechutenstvím, nauzeou, zvracením, rašem, vertigem, apatií, ataxií, poruchami artikulace, koncentrace [32]. Laboratorně může docházet k elevaci jaterních enzymů, hypercholesterolemii, prodloužení krvácivosti. V indikaci inhibice steroidogeneze mitotan používáme zřídka, a pokud jsme nuceni ho použít, pak podáváme obvykle nižší dávky než při léčbě adenokortikálního karcinomu.
Etomidat
Etomidat je celkové anestetikum, chemicky derivát imidazolu, který inhibuje steroidogenezi mechanizmem inhibice 11β ‑ hydroxylázy, 17-hydroxylázy a v menší míře C 17 – 20 lyázy a SCC. V indikaci inhibice steroidogeneze je podáván v „neanestetických“ dávkách 1,6 – 4,2 mg/ hod i.v. V těchto dávkách je účinným inhibitorem steroidogeneze, s rychlým nástupem účinku, jehož nevýhodou je nutnost parenterální aplikace. Vhodné je jeho použití u těžkých případů v podmínkách jednotky intenzivní péče [33,34].
Další adrenolyticky působící léky, které nejsou běžně používány pro nízkou účinnost, jsou např. aminoglutethimid a trilostan.
Blokátory glukokortikoidního receptoru
V klinické praxi byl zkoušen a v některých zemích je k léčbě CS registrován antagonista glukokortikoidních a progesteronových receptorů mifepriston (RU486) [6]. Jeho podání vede k zablokování glukokortikoidního receptoru a zvýšení produkce CRH, ACTH a kortizolu. Nevýhodou léčby mifepristonem je nemožnost jejího spolehlivého laboratorního monitorování.
Kombinační léčba
V medikamentózní léčbě často používáme kombinaci několika látek. Kombinační léčba nám v řadě případů umožní snížení dávek jednotlivých látek, a tím snížení frekvence nežádoucích účinků za současného zvýšení účinnosti léčby. Z adrenolyticky působících látek nejčastěji kombinujeme ketokonazol s metyraponem, v léčbě Cushingovy nemoci se jako perspektivní jeví kombinace pasireotidu s cabergolinem a ketokonazolem, kterou je pravděpodobně možno dosáhnout normalizace hormonální aktivity u většiny pacientů s Cushingovou nemocí [35].
Monitorování medikamentózní terapie
Monitorování medikamentózní léčby CS je nutné, abychom na jedné straně dosáhli dostatečného snížení hormonální aktivity, ale na druhé straně abychom nevyvolali hypokortikalizmus. V současné době neexistuje zcela spolehlivý laboratorní test, který bychom mohli k monitorování léčby použít. Některými autory je doporučováno stanovení vylučování UFC, které částečně ukazuje na dostatečnost suprese hormonální aktivity CS, jinými autory je však vyšetření UFC považováno za nepříliš vhodné a spolehlivé. Přesto ho považujeme za vyšetření nejdůležitější k posouzení dostatečné suprese sekrece kortizolu a doporučujeme ho v této indikaci používat. Někteří doporučují stanovení denního profilu kortizolemie (alespoň 5 stanovení) a zjištění průměru těchto hodnot, přičemž jeho doporučované rozmezí je mezi 150 a 300 nmol/ l. Stanovení ranní kortizolemie slouží i k odhalení vzniku hypokortikalizmu při medikamentózní léčbě. Jak bylo uvedeno, terapii mifepristonem spolehlivě monitorovat nelze [36 – 38].
Souhrn medikamentózní léčby Cushingova syndromu je uveden v tab. 3.
Doporučení taktiky medikamentózní terapie Cushingova syndromu
- Základním lékem v léčbě CS v našich podmínkách je ketokonazol. Používáme ho sice tzv. off ‑ label, ale je běžně dostupný a finančně méně nákladný než ostatní léky.
- Pokud není účinek ketokonazolu dostatečný, v léčbě CD postupujeme takto:
- a) Přidáváme cabergolin, který sice používáme rovněž tzv. off ‑ label, ale je běžně dostupný.
- b) Pokud není dostatečně účinná ani kombinace ketokonazol + cabergolin, je indikováno přidání pasireotidu k této kombinaci. Pasireotid je u nás registrován pro použití u CD, ale nemá t.č. stanovenou úhradu. V přechodném období je možno zažádat o povolení dovozu a hrazení revizního lékaře příslušné zdravotní pojišťovny.
- c) V případě intolerance ketokonazolu nebo jako alternativu k podání pasireotidu je možno do kombinace přidat místo nich metyrapon. O povolení jeho dovozu a hrazení je možno zažádat revizního lékaře příslušné zdravotní pojišťovny.
- 3. U benigního ACTH ‑ independentního CS při nedostatečném účinku přidáváme do kombinace ke ketokonazolu metyrapon.
Zvláštní situace
Perioperační zajištění chirurgické léčby pacientů s Cushingovým syndromem
U pacientů s Cushingovým syndromem nezávisle na etiologii musíme počítat s tím, že pokud chirurgicky odstraníme příčinu Cushingova syndromu, zůstává celý zbytek osy HPA nebo její část funkčně utlumena. Po úspěšné kurativní operaci máme před sebou pacienta s funkčním hypokortikalizmem. Chirurgický výkon je proto nezbytné zajistit podáváním hydrokortizonu. Doporučujeme podávat 50 mg i.v. při premedikaci asi 2 hod před výkonem, dalších 100 mg i.v. infuzně v průběhu výkonu. V den operace a 1. pooperační den podáváme 200 mg i.v. denně ve 4 dílčích dávkách, od 2. pooperačního dne dávky snižujeme a po obnovení perorálního příjmu přecházíme na perorální podávání ve 3 denních dávkách, přičemž nejvyšší je ranní dávka (přibližně 1/ 2 denní dávky). Postupně klesáme na běžnou substituční dávku asi 15 – 25 mg hydrokortizonu denně. Rychlost poklesu dávky je individuální, při příliš rychlém poklesu může docházet k tzv. detrakčnímu syndromu (cortisol withdrawal syndrome). V tom případě se vracíme na nejbližší vyšší tolerovanou dávku. Při pravidelných kontrolách zjišťujeme podle příslušných zásad restituci funkce HPA osy, při její normalizaci je možno hydrokortizon vysadit.
Léčba Cushingova syndromu v graviditě
CS v průběhu gravidity je závažným onemocněním s výrazně zvýšeným rizikem komplikací na straně plodu i matky. Je proto nutné ho včas léčit i za gravidity. U CD je metodou volby provedení transsfenoidální operace tumoru hypofýzy. Z hlediska načasování operace je za nejvhodnější považováno její provedení koncem 1. nebo ve 2. trimestru. U tumorů nadledvin je opět metodou volby chirurgické odstranění tumoru, optimálně ve 2. trimestru. Pokud je nutné podání medikamentózní léčby, lékem první volby u CS v graviditě je metyrapon, při jeho nedostatečném účinku ho můžeme v případě CD kombinovat s cabergolinem. Ketokonazol a mitotan jsou kontraindikovány pro teratogenní účinky [39].
Závěr
Léčba CS může být komplikovaná a často dlouhodobá. Domníváme se proto, že patří do center, která se léčbou CS zabývají. Komplikovanost a složitost může spočívat nejen ve variabilní etiologii, ale i v tom, že např. v medikamentózní léčbě CS je nutno buď použít léky v indikacích, které nejsou uvedené v SPC (summary of product characteristics), tedy tzv. off ‑ label, jako např. ketokonazol a kabergolin, nebo léky u nás neregistrované, tzv. na individuální dovoz, jako je metyrapon. Jediným lékem, který je u nás registrovaný a má schválenou indikaci léčby CD, je t.č. pasireotid, který je v ČR registrovaný, dostupný a hrazený je po schválení revizním lékařem příslušné zdravotní pojišťovny.
prof. MU Dr. Michal Kršek, CSc.
www.vfn.cz
e‑mail: michal.krsek@lf1.cuni.cz
Sources
1. Cushing HW. The basophil adenomas of the pituitary body and their clinical manifestations (pituitary basophilism). Bull Johns Hopkins Hosp 1932; 50 : 137 – 195.
2. Lahera Vargas M, da Costa CV. Prevalence, etiology and clinical findings of Cushing’s syndrome. Endocrinol Nutr 2009; 56 : 32 – 39.
3. Bertagna X, Guignat L, Groussin L et al. Cushing’s disease. Best Pract Res Clin Endocrinol Metab 2009; 23 : 607 – 623.
4. Ross EJ, Linch DC. Cushing’s syndrome ‑ Killing disease: Discriminatory value of signs and symptoms aiding early diagnosis. Lancet 1982; 2 : 646 – 649.
5. Newell‑Price J, Trainer P, Bessser M et al. The diagnosis and differential diagnosis of Cushing’s syndrome and pseudo ‑ Cushing’s states. Endocr Rev 1998; 19 : 647 – 672.
6. Nieman LK, Chrousos GP, Kellner C et al. Successful treatment of Cushing’s syndrome with the glucocorticoid antagonist RU 486. J Clin Endocrinol Metab 1985; 61 : 536 – 540.
7. Nieman LK, Biller BM, Findling JW et al. The Diagnosis of Cushing’s Syndrome: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008; 93 : 1526 – 1540.
8. Utz AL, Swearingen B, Biller BM. Pituitary surgery and postoperative management in Cushing’s disease. Endocrinol Metab Clin North Am 2005; 34 : 459 – 478.
9. McCance DR, Besser M, Atkinson AB. Assessment of cure after transsphenoidal surgery for Cushing’s disease. Clin Endocrinol 1996; 44 : 1 – 6.
10. Vladyka V, Liščák R, Šimonová G et al. Radiosurgical treatment of hypophyseal adenomas with the gamma knife: results in a group of 163 patients during a 5‑year period. Čas Lék Česk 2000; 139 : 757 – 766.
11. de Bruin C, Feelders RA, Lamberts SW et al. Somatostatin and dopamine receptors as targets for medical treatment of Cushing’s syndrome. Rev Endocr Metab Disord 2009; 10 : 91 – 102.
12. Kam BL, Teunissen JJ, Krenning EP et al. Lutetium ‑ labelled peptides for therapy of neuroendocrine tumours. Eur J Nucl Med Mol Imaging 2012; 39 (Suppl 1): 103 – 112.
13. Valimaki M, Pelkonen R, Porkka L et al. Long‑term results of adrenal surgery in patients with Cushing’s syndrome due to adrenocortical adenoma. Clin Endocrinol (Oxf) 1984; 20 : 229 – 236.
14. Young WF Jr, Thompson GB. Laparoscopic adrenalectomy for patients who have Cushing’s syndrome. Endocrinol Metab Clin North Am 2005; 34 : 489 – 499.
15. Berruti A, Terzolo M, Sperone P et al. Etoposide, doxorubicin and cisplatin plus mitotane in the treatment of advanced adrenocortical carcinoma: a large prospective phase II trial. Endocr Relat Cancer 2005; 12 : 657 – 666.
16. Fassnacht M, Libé R, Kroiss M et al. Adrenocortical carcinoma: a clinician’s update. Nature Rev Endocrinol 2011; 7 : 323 – 335.
17. McGahan J, Browning P, Brock J et al. Hepatic ablation using radiofrequency electrocautery. Invest Radiol 1990; 25 : 267 – 270.
18. de Baere T, Dufaux J, Roche A et al. Circulatory alterations induced by intra ‑ arterial injection of iodized oil and emulsions of iodized oil and doxorubicin: experimental study. Radiology 1995; 194 : 165 – 170.
19. Bourdeau I, Lacroix A. Aberrant hormone receptors in adrenal Cushing’s syndrome. Curr Opin Endocrinol Diab 2002; 9 : 230 – 236.
20. Morris D, Grossman A. The medical management of Cushing’s syndrome. Ann NY Acad Sci 2002; 970 : 119 – 133.
21. Godboud A, Manavela M, Danilowicz K et al.Cabergoline monotherapy in the long‑term treatment of Cushing’s disease. Eur J Endocrinol 2010; 165 : 709 – 716.
22. Casulari LA, Naves LA, Mello PA et al. Nelson’s syndrome: complete remission with cabergoline but not with bromocriptine or cyproheptadine treatment. Horm Res 2004; 62 : 300 – 305.
23. Pivonello R, Ferrone D, de Herder WW et al. Dopamine receptor expression and function in corticotroph ectopic tumors. J Clin Endocrinol Metab 2007; 92 : 65 – 69.
24. Valassi E, Klibanski A, Biller BM. Clinical review: Potential cardiac valve effects of dopamine agonists in hyperprolactinemia. J Clin Endocrinol Metab 2010; 95 : 1025 – 1033.
25. Lamberts SW, Uitterlinden P, Klijn JM. The effect of the long‑acting somatostatin analogue SMS 201 – 995 on ACTH secretion in Nelson’s syndrome and Cushing’s disease. Acta Endocrinol (Copenh) 1989; 120 : 760 – 766.
26. Hofland LJ, van der Hoek J, Feelders R et al.The multiligand somatostatin analogue SOM230 inhibits ACTH secretion by cultured human corticotroph adenomas via somatostatin receptor type 5. Eur J Endocrinol 2005; 152 : 645 – 654.
27. Colao A, Petersenn S, Newell‑Price J et al. Pasireotide B2305 Study Group. A 12-month phase 3 study of pasireotide in Cushing’s disease. N Engl J Med 2012; 366 : 914 – 924.
28. Castillo V, Giacomini D, Paez ‑ Pereda M et al.Retinoic acid as a novel medical therapy for Cushing’s disease in dogs. Endocrinology 2006; 147 : 4438 – 4444.
29. Dang CN, Trainer P. Pharmacological management of Cushing’s syndrome: an update. Arq Bras Endocrinol Metabol 2007; 51 : 1339 – 1348.
30. Knight TE, Shikuma CY, Knight J. Ketoconazole‑induced fulminant hepatitis necessitating liver transplantation. J Am Acad Dermatol 1991; 25 : 398 – 400.
31. Verhelst JA, Trainer PJ, Howlett TA et al. Short and long‑term responses to metyrapone in the medical management of 91 patients with Cushing’s syndrome. Clin Endocrinol (Oxf) 1991; 35 : 169 – 178.
32. Haak HR, Hermans J, van de Velde CJ et al. Optimal treatment of adrenocortical carcinoma with mitotane: results in consecutive series of 96 patients. Br J Cancer 1994; 69 : 947 – 951.
33. Allolio B, Schulte HM, Kaulen D et al. Nonhypnotic low‑dose etomidate for rapid correction of hypercortisolaemia in Cushing’s syndrome. Klin Wochenschr 1988; 66 : 361 – 364.
34. Drake WM, Perry LA, Hinds CJ et al. Emergency and prolonged use of intravenous etomidate to control hypercortisolaemia in a patient with Cushing’s syndrome and peritonitis. J Clin Endocrinol Metab 1998; 83 : 3542 – 3544.
35. Feelders RA, de Bruin C, Pereira AM et al. Pasireotide alone or with cabergoline and ketoconazole in Cushing’s disease. N Engl J Med 2010; 362 : 1846 – 1848.
36. Kršek M, Hána V et al. Cushingův syndrom. Praha: Galén 2006.
37. Kršek M. Cushingův syndrom a možnosti jeho řešení v roce 2012. Remedia 2012; 22 : 386 – 392.
38. Trainer PJ, Eastment C, Grossman A et al. The relationship between cortisol production rate and serial serum cortisol estimation in patients on medical therapy for Cushing’s syndrome. Clin Endocrinol 1993; 39 : 441 – 443.
39. Lindsay JR, Jonklaas J, Oldfield EH et al. Cushing’s syndrome during pregnancy: personal experience and review of the literature. J Clin Endocrinol Metab 2005; 90 : 3077 – 3083.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 9-
All articles in this issue
- Vede fyzická aktivita při přerušení dodávky inzulinu inzulinovou pumpou u pacientů s diabetem 1. typu ke klinicky významným změnám?
- Využití natriuretických peptidů v diagnostice hypertrofie levé komory srdeční u obézních hypertoniků s metabolickým syndromem
- Význam stanovení kardiálních biomarkerů ve stratifikaci a sledování nemocných s AL‑ amyloidózou – zkušenosti jednoho centra
- Hodnocení vybraných ukazatelů apoptózy a angiogeneze u chronické lymfocytární leukemie
- Compliance starších nemocných s kognitivní poruchou
- Studie RESOLUTE v České republice: inzulin glargin zlepšuje kompenzaci diabetu 2. typu u pacientů s dosud neuspokojivým výsledkem terapie kombinací inzulin detemir a perorální antidiabetika. Výsledky neintervenčního projektu RESOLUTE v České republice
- Food intake regulation – 1st part
- Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti
- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Regionální migrující osteoporóza – diferenciálně diagnostický problém
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Food intake regulation – 1st part
- Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti
- Regionální migrující osteoporóza – diferenciálně diagnostický problém
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

