-
Medical journals
- Career
Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
: Z. Adam 1; A. Pejchalová 2; G. Chlupová 3; L. Říhová 3; L. Pour 1; M. Krejčí 1; L. Červinek 1; Z. Král 1; J. Mayer 1
: Interní hematologická a onkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Mayer, CSc. 1; Transfuzní oddělení FN Brno, pracoviště Bohunice, přednostka prim. MU Dr. Eva Tesařová, CSc. 2; Oddělení klinické hematologie FN Brno, přednosta prof. MU Dr. Miroslav Penka, CSc. 3
: Vnitř Lék 2013; 59(9): 828-840
: Case Report
Získané autoimunitní hemolytické anémie se dělí dle vlastností imunoglobulinů, které hemolýzu vyvolávají. Nejčastější jsou hemolytické anémie s tepelnými protilátkami. Ty se váží na erytrocyty a nastartují jejich destrukci v buňkách retikuloendotelového systému. Jde tedy o extravaskulární hemolýzu. Nemoc chladových aglutininů se od klasické autoimunitní anémie s tepelnými protilátkami zásadně liší. Aglutinaci způsobují monoklonální protilátky, ve většině případů třídy IgM, zcela výjimečně IgG. Ty se v chladu váží na erytrocyty a způsobují jejich aglutinaci, a tím poruchu prokrvení částí těla s nižší teplotou. Vazba aglutininů iniciuje vazbu komplementu na erytrocyty. V teple se aglutininy uvolní, ale navázané části komplementu již způsobí hemolýzu, která je převážně intravaskulární. Uvolněný hemoglobin způsobuje hemoglobinurii. Popisujeme pacienta s touto nemocí. První příznaky nemoci, anémie + poruchy prokrvení akrálních částí těla, které v teple mizely, následované hemoglobinurií, vedly ke stanovení diagnózy nemoci chladových aglutininů. Léčba I. linie, prednison, byla bez léčebné odpovědi. V rámci léčby II. linie byly použity rituximab a dexametazon. Rituximab byl aplikován v dávce 500 mg/ m2 4krát po sobě v týdenních intervalech. Dexametazon byl podán v dávce 40 mg 1. – 4. den a 15. – 18. den cyklu. Tato léčba však také nevedla k léčebné odpovědi. Proto v textu přinášíme přehled všech publikací o léčbě této nemoci, abychom z nich vybrali nejúčinnější léčebné možnosti při selhání monoterapie rituximabem. Léčbou první volby pro nemoc chladových aglutininů je rituximab v monoterapii, obvykle aplikovaný 1krát týdně nejméně po dobu 4 týdnů. Tato léčba dosahuje léčebné odpovědi asi u 1/ 2 léčených a medián trvání remise po rituximabu je 11 měsíců. Účinnější, i když toxičtější, je kombinace rituximabu s fludarabinem. Kombinace rituximabu s fludarabinem vedla v klinické studii k 75 % léčebných odpovědí včetně 20 % kompletních remisí. Medián léčebné odpovědi byl delší než 66 měsíců. V malé studii (10 pacientů) vedlo navýšení počtu aplikací rituximabu ze 4 na 8 k léčebné odpovědi u 6 nemocných, u nichž po 4 aplikacích rituximabu nebyla dosažena léčebná odpověď. Při léčbě Waldenströmovy makroglobulinemie byla prokázána účinnost následujících léků a jejich kombinací: rituximab, chlorambucil, cyklofosfamid, fludarabin, bortezomib, lenalidomid, bendamustin a alemtuzumab. Pro léčbu nemoci chladových aglutininů se používají stejné léky a léčebné postupy jako pro Waldenströmovu makroglobulinemii. Formou popisů případů byly u nemoci chladových aglutininů popsány úspěchy léčby bortezomibem, kombinací rituximabu + bendamustinu, rituximabu + cyklofosfamidu, případně trojkombinací rituximabu + fludarabinu + cyklofosfamidu. Zásadním přínosem je také léčba monoklonální protilátkou anti‑C5, eculizumabem, která se jinak používá pro léčbu paroxyzmální noční hemoglobinurie. Tím, že eculizumab zablokuje C5 část komplementu, zastaví se hemolýza u pacienta s nemocí chladových aglutininů. Pro vzácnost nemoci chladových aglutininů je klinických studií velmi málo, a tak nezbývá nic jiného, než při volbě léčby u této vzácné nemoci přihlížet k informacím z popisů jednotlivých případů nemocí chladových aglutininů i ke zkušenostem s léčbou Waldenströmovy makroglobulinemie. Otázkou řešenou v diskuzi je, kterou z možností použít u popsaného pacienta v rámci léčby III. linie.
Klíčová slova:
nemoc chladových aglutininů – autoimunitní hemolytická anémie – Waldenströmova makroglobulinemie – rituximab – fludarabin – bortezomib – bendamustin – cyklofosfamid – eculizumabÚvod
Autoimunitní hemolytické anémie se dále rozdělují dle vlastností protilátek na hemolytické anémie s tepelnými anebo s chladovými protilátkami [1].
Léčba hemolytické anémie s chladovými protilátkami, zvané též nemoc chladových aglutininů (cold agglutinin disease) se podstatně liší od léčby hemolytické anémie s tepelnými protilátkami. Při zadání hesla „cold agglutinin disease“ do literární databáze Pubmed ‑ Medline s omezením na české publikace jsme našli jen 3 publikace [2 – 4], které se tomuto tématu věnují. Proto považujeme za přínosné uvést přehled informací o této vzácné nemoci a její léčbě a na popsaném případu analyzovat otázku, jakou léčbu podat pacientovi v případě neúspěchu glukokortikoidů a 4 aplikací rituximabu.
Kritéria pro nemoc chladových aglutininů dle Berentsena
- chronická hemolýza,
- hladina chladových aglutininů vyšší než titr 64,
- typický nález při přímém antiglobulinovém testu (PAT). Tento nález znamená pozitivní polyspecifický test s monospecifickým testem pro komplement, protein C3d a negativní (někdy slabě pozitivní) test na IgG [5,6].
Nemoc chladových aglutininů se nazývá primární, pokud se nenalezne žádná maligní choroba. Klasicky se provádějí klinická a zobrazovací vyšetření a dále základní laboratorní vyšetření včetně stanovení kvantity polyklonálních imunoglobulinů, elektroforézy a imunofixace a také histologické, imunohistochemické a flowcytometrické vyšetření kostní dřeně a flowcytometrické vyšetření periferní krve. Imunofixace by měla být provedena vždy, i když není na běžné elektroforéze typický pás monoklonálního imunoglobulinu [5,6].
Důležité je, aby byl vzorek krve pacienta s chladovými aglutininy transportován a udržován při teplotě 37 – 38 °C tak dlouho, dokud není sérum odděleno od krevního koagula.
V opačném případně se nemusí správně stanovit titr protilátek, ani stanovit koncentrace polyklonálních a monoklonálních imunoglobulinů. Případná hemolýza zásadně zkreslí biochemická vyšetření (vzestup aktivity LD a hodnot draslíku a změny dalších iontů).
Epidemiologické údaje
Hemolytické anémie s chladovými protilátkami jsou poměrně vzácné. V populační studii, provedené ve Skandinávii, zjistili, že autoimunitní hemolytické anémie způsobené chladovými aglutininy tvoří 13 – 15 % všech autoimunitních hemolytických anémií. Prevalence nemoci chladových aglutininů ve Skandinávii činí 16 případů na 1 milion obyvatel. Medián výskytu nemoci je 67 (30 – 92) let a medián přežití 12,5 roku. Medián přežití byl stejný jako u průměrné skandinávské populace [5].
Nemoc chladových aglutininů se výjimečně objeví jako komplikace agresivních lymfomů či jiných typů maligních chorob.
Hemolytická anémie s chladovými protilátkami se výjimečně také objeví jako komplikace infekce Mycoplasma pneumoniae a některých virových infekcí.
Chladové aglutininy jsou protilátky, které se váží na erytrocyty pouze při nižší tělesné teplotě, než je teplota fyziologická [7]. Po navázání způsobují shlukování (aglutinaci) erytrocytů. Tento jev je znám již od roku 1903, kdy jej popsal Landsteiner [8].
Chladové aglutininy jsou někdy přítomny i v séru zdravých dárců, v těchto případech jsou ale obvykle polyklonální a v podstatně nižších titrech, než je tomu u pacientů s nemocí chladových aglutininů.
U nemocných s klinicky zjevnou nemocí chladových aglutininů jsou tyto protilátky (chladové aglutininy) monoklonální, jsou přítomny ve vysokých titrech a mají výše položenou tepelnou amplitudu než v případě náhodně nalezených polyklonálních chladových aglutininů. Optimální teplota pro aglutinaci za přítomnosti monoklonálních aglutininů se blíží 37 °C [7].
Klinický průběh
Klinický průběh je obvykle dlouhodobý, nemoc nemá tendenci k postupnému zhoršování, i když jsou jistě výjimky s nepříznivým průběhem. Berentsen et al popisují 86 případů, z nichž jen u 50 % byla anémie tak závažná, že bylo nutné podávat transfuze erytrocytů [5].
Typickým příznakem nemoci jsou oběhové poruchy způsobené chladem, provázejí až 90 % pacientů s touto nemocí. Jejich intenzita kolísá od střední akrocyanózy až po mutilující Raynaudovy příznaky, způsobené nepatrným ochlazením [5].
Charakteristický pro tuto nemoc je sezónní výskyt klinických potíží a prohlubování anémie v průběhu chladných měsíců, i když někteří pacienti mohou mít laboratorní známky hemolýzy a problémy i při normální pokojové teplotě [9].
Asi 2/ 3 pacientů mají paradoxní zhoršení hemolytické anémie způsobené febrilním onemocněním nebo větším traumatem [5,10,11].
Imunologická podstata
Chladové aglutininy jsou často specifické pro I antigen a některé makromolekuly na povrchu erytrocytů.
Ochlazení krve při průtoku akrálními částmi těla umožní chladovým aglutininům navázat se na erytrocyty. To způsobí aglutinaci (naruší mikrocirkulaci) a zároveň vede k navázání C1 komplexu komplementu a aktivaci komplementového systému. Po následujícím ohřátí se chladové aglutininy uvolní, a tím se uvolní i vazba mezi erytrocyty (vymizí aglutinace), zatímco komplex komplementu C3b zůstane na erytrocytu navázaný. C3b část komplementu aktivuje C5, to vede k narušení membrány erytrocytu a k intravaskulární hemolýze [12,13]. Aktivace terminální komponenty komplementu a intravaskulární hemolýza způsobuje hemoglobinurii.
V rovnovážném stavu je destrukce erytrocytů s navázaným C3b mediovaná retikuloendoteliálními buňkami, hlavně v játrech. Komplementová součást C3b je zčásti konvertována na C3d, což znamená, že tyto krvinky nepodlehnou hemolýze a jsou uvolněny do oběhu.
Díky tomu, že je trvalá konzumpce komplementu, jsou koncentrace C3 a C4 komponent komplementu u většiny nemocných s nemocí chladových aglutininů nízké. Trvalá deplece komplementu limituje rychlost extravaskulární hemolýzy a pravděpodobně brání fulminantnímu průběhu hemolýzy.
V průběhu reakce akutní fáze se zvyšuje tvorba i plazmatické koncentrace komplementu, a tedy i koncentrace C3 a C4 částí komplementu. To vysvětluje paradoxní zhoršení anémie při horečnatých stavech, kdy nemocný leží s horečkou v teple v posteli. Proto jsou infekční komplikace s teplotami důvodem k okamžité léčbě bakteriálních infekcí. Podání plazmy, obsahující komplement, se považuje za rizikové [10,11]. Blokáda komplementu by však mohla být i terapeutická cesta.
Klonalita chladových aglutininů
Přítomnost monoklonálního imunoglobulinu u nemoci chladových aglutininů byla popsána již v roce 1957 [14] a od té doby byl monoklonální imunoglobulin opakovaně u této nemoci prokazován. Ve velké skupině 86 pacientů byl monoklonální imunoglobulin typu IgM k detekován u více než 90 % z nich, zatímco monoklonální imunoglobuliny typu IgA a IgG byly detekovány zcela výjimečně [5].
Přítomnost monoklonálního imunoglobulinu typu IgM tak upozornila na souvislost nemoci chladových aglutininů s Waldenströmovou makroglobulinemií. Berentsen et al popisují nálezy v kostní dřeni odpovídající nízké infiltraci kostní dřeně buňkami lymfoplazmocytárního lymfomu i u pacientů, kteří byli zaklasifikováni jako primární nemoc chladových aglutininů. Ve flowcytometrické a histopatologické studii kostní dřeně od pacientů s nemocí chladových aglutininů bez klinického nebo radiologického průkazu lymfomu byly detekovány CD19+, CD20+, κ+ klonální lymfocytární populace u 10 z 11 pacientů [15]. A stejně je tomu i v námi popsaném případě.
V roce 2006 provedli v rámci populační skandinávské studie opětovné hodnocení vzorků kostní dřeně od 86 pacientů, kteří byli zprvu klasifikováni jako primární nemoc chladových aglutininů. Monoklonální CD20+ κ+ lymfocyty byly detekovány v aspirátu u 90 % pacientů, u nichž byla provedena flowcytometrie [5,15]. Morfologické a imunohistochemické známky klonální B lymfoproliferace byly popsány u 50 (76 %) z 66 pacientů, od nichž byly dostupné vzorky. Výsledky této největší analýzy uvádí tab. 1. Nejčastěji byl detekován lymfoplazmocytární lymfom a lymfom marginální zóny.
1. Výsledky imunohistochemického fl owcytometrického a histologického vyšetření kostní dřeně u 66 pacientů, kteří byli původně klasifi kováni jako primární choroba chladových aglutininů [5,15]. ![Výsledky imunohistochemického fl owcytometrického a histologického vyšetření kostní dřeně u 66 pacientů, kteří byli původně klasifi kováni jako primární choroba chladových aglutininů [5,15].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6f5cfe78e2fe9e2da5d99afb9fe16232.png)
Vzhledem k tomu, že na buňkách kostní dřeně byly nalezeny imunofenotypické znaky lymfoplazmocytárního lymfomu u 50 % vyšetřených a že monoklonální imunoglobulin typu IgM byl nalezen téměř u všech případů, došli autoři k závěru, že u 50 % pacientů s primární nemocí chladových aglutininů splňuje nález v kostní dřeni imunofenotypová kritéria Waldenströmovy makroglobulinemie [16,17], i když tito pacienti nemají klinické symptomy této nemoci.
Choroby asociované s monoklonálním imunoglobulinem (monoclonal immunoglobuline associated diseases) jsou jednotky, charakterizované specifickými vlastnostmi monoklonálního imunoglobulinu bez průkazu lymfomu či myelomu. A tak pacienty s chladovými aglutininy a s monoklonálním imunoglobulinem typu IgM, kteří nemají histologicky potvrzenou maligní B lymfocytární chorobu, je možné zařadit do této kategorie chorob souvisejících s monoklonálním imunogobulinem. Choroby asociované s monoklonálním imunoglobulinem typu IgM a Waldenströmova makroglobulinemie nepředstavují 2 zásadně odlišné entity, jde spíše o kontinuální spektrum [18,19].
Přítomnost klonální B lymfoproliferace v kostní dřeni u většiny, ne‑li u všech pacientů s nemocí chladových aglutininů a příbuznost s morbus Waldenström je základem pro volbu léčebných postupů.
Popis případu
Muž, narozený 1944 (185 cm, 88 kg), byl v posledních 8 letech léčen pro hypertenzi, v posledním roce užíval Prestarium Combi. Před 5 lety byl léčen pro kožní formu boreliózy. Jinak byl zdráv.
První příznaky nemoci chladových aglutininů začal pozorovat na podzim roku 2012, kdy jej okolí začalo upozorňovat na nápadně fialový nos a uši (obr. 1). V prosinci roku 2012 při dalším poklesu venkovní teploty již měl značně intenzivní projevy nemoci, při chůzi venku měl fialové uši a nos, dále mu bledly, fialověly a bolely konečky prstů na rukou i nohou. Zřejmě díky krátké expozici chladu tyto změny naštěstí byly vratné a po návratu do tepla se obnovil průtok krve, takže neměl žádné trvalé následky – trofické defekty a ulcerace. Po návratu z chladu se vzápětí moč zbarvila do červena (hemoglobinurie). Typické známky přítomnosti chladových aglutininů uvádějí obr. 2 – 4.
1. Cyanotický ušní boltec našeho pacienta vystaveného únorovému počasí. Aglutinované erytrocyty zablokují průtok krve, dochází k nedostatku kyslíku a vzniká cyanóza. Později mohou nastoupit i trofické změny. 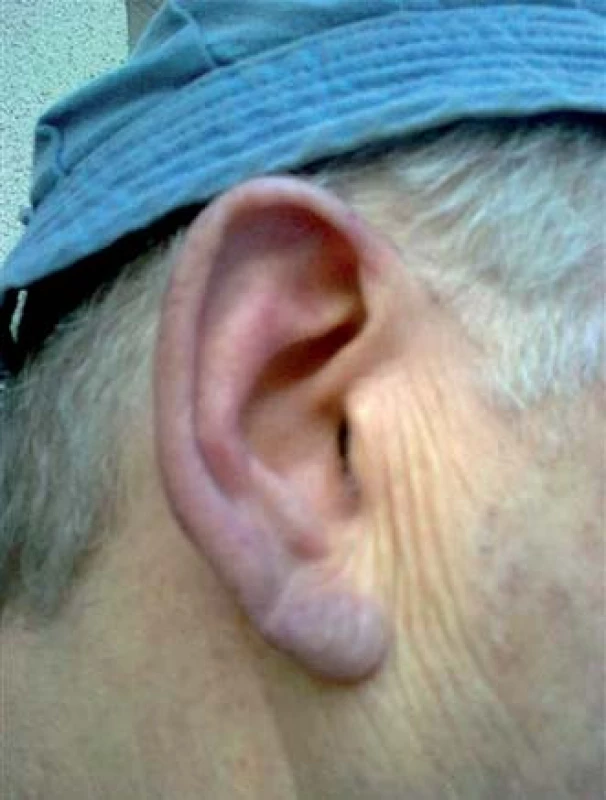
2. Krev našeho pacienta, kterou jsme nechali stát při pokojové teplotě a posléze nechali centrifugovat. Barva séra je zřetelně červená, což signalizuje hemolýzu erytrocytů proběhlou ve zkumavce. Při ochlazení krve ve zkumavce se na erytrocyty naváží aglutininy i komplement a dochází ve zkumavce k hemolýze. 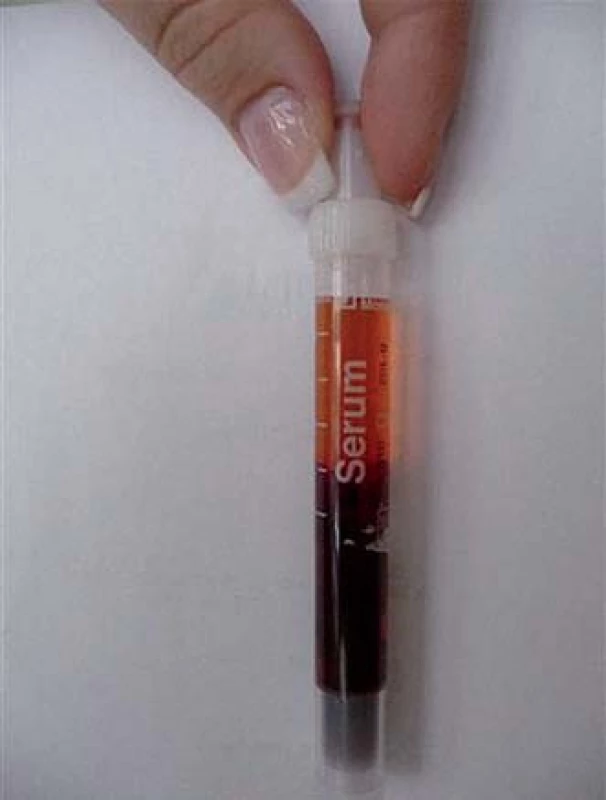
3. Krev našeho pacienta vystříknutá na Petriho misku. Po rozetření krve po misce okamžitě vzniká zřetelná aglutinace erytrocytů, podobně, jako když při křížovém pokusu přidáme k vzorku krve odpovídající diagnostické protilátky. 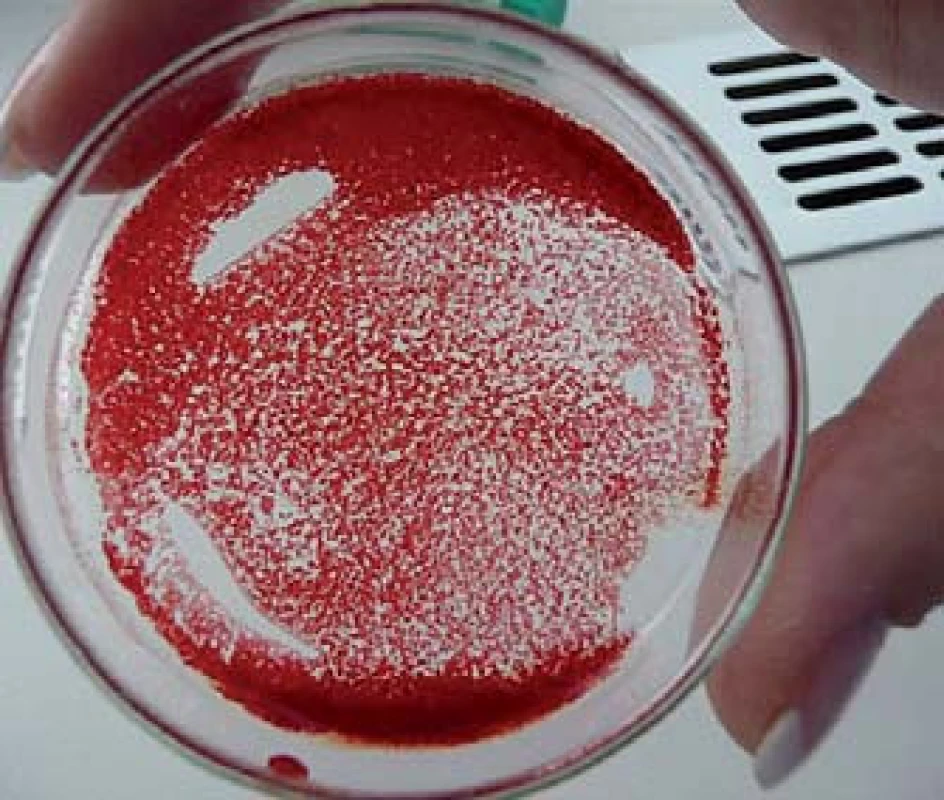
4. Krev našeho pacienta rozestřená na podložním sklíčku při mikroskopickém hodnocení. Pokud se krev rozestře bez předehřátí, je zřetelný fenomén aglutinace. Pokud se vzorek krve předehřeje v teplé lázni před provedením roztěru, dojde k uvolnění aglutininů z vazby na erytrocyty a je možné získat normální krevní nátěr. 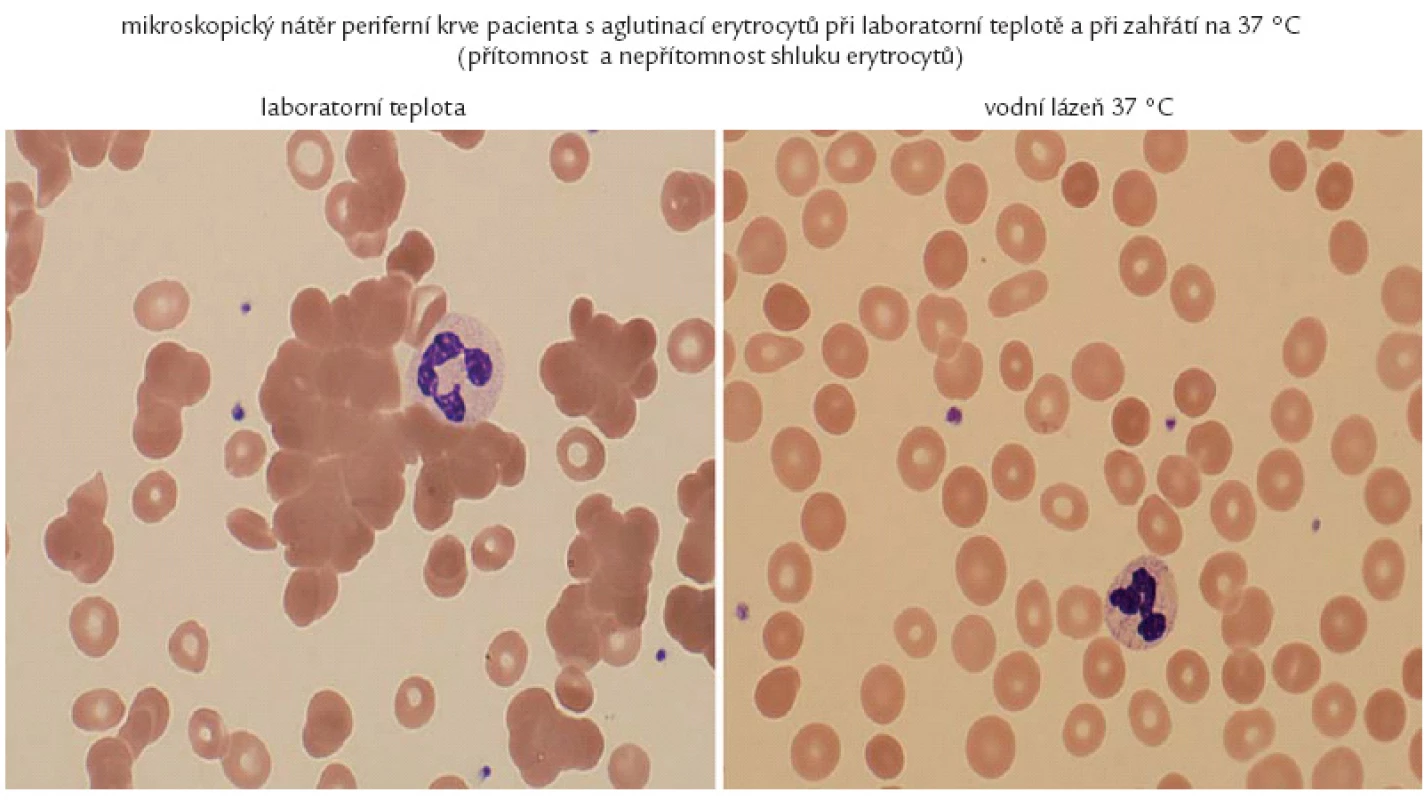
Při první návštěvě lékaře v listopadu roku 2012 byla zjištěna anémie a pacient na ni dostal preparát železa. A když tato léčba nepomáhala, anémie se nezlepšovala, byl odeslán koncem listopadu roku 2012 k dalšímu vyšetření, které prokázalo chladové protilátky, a tedy diagnózu nemoci chladových aglutininů.
V rámci I. linie léčby byly pacientovi podány glukokortikoidy (prednison) v dávce 1 mg/ kg/ den. Dávka byla postupně snižována, při návštěvě naší ambulance již užíval jen 20 mg denně. Při léčbě prednisonem nedošlo však k žádnému zlepšení krevního obrazu a hlavně, nedošlo ke zmírnění či vymizení potíží plynoucích z aglutinace erytrocytů v působení chladu. Proto byl pacient odeslán na naši ambulanci. První vyšetření a zahájení léčby proběhlo 31. prosince 2012 a dne 3. ledna 2013 byla podána první infuze rituximabu.
Krevní obraz a biochemické vyšetření
Uvedeme zásadní výsledky ze vstupního vyšetření ze dne 31. 12. 2012. Krevní obraz: leukocyty 10,30 × 109/ l, erytrocyty 3,51 × 1012/ l, hemoglobin 114 g/ l, trombocyty 233 × 109/ l.
Imunofixační elektroforéza prokázala monoklonální imunoglobulin typu IgM v koncentraci 2,9 g/ l. Volné lehké řetězce k a l byly v normě. Při stanovení imunoglobulinů byla koncentrace celkového IgG 6,94 g/ l (norma 7 – 16 g/ l), IgM 2,81 g/ l (norma 0,4 – 2,3 g/ l), IgA 3,41 g/ l (norma 0,7 – 4,0 g/ l). Volný hemoglobin byl v séru zvýšený na 214,2 mg/ l (norma 0 – 30 mg/ l) i při doručení vzorku do laboratoře ve vodní lázni 37 °C teplé.
Vyšetření kostní dřeně
Byla provedena trepanobiopsie lopaty kosti kyčelní s histologickým, cytologickým a flowcytometrickým hodnocením kostní dřeně.
Při histologickém hodnocení válečku kostní dřeně popsal patolog 10 – 15 % malých lymfocytů a 5 % plazmocytů, obojí buňky bez imunohistochemického průkazu klonality.
Hematolog při cytologickém hodnocení kostní dřeně shledal pouze kompenzatorní zmnožení erytropoézy, ale jinak bez známek prokazatelné lymfoproliferace.
Hodnocení aspirátu kostní dřeně metodou průtokové cytometrie jednoznačně prokázalo klonální B‑lymfocyty s následujícími znaky: CD5+, CD20+, CD25+, FMC7+, CD22 dim, + sκ+, cκ+, CD27- , sIgM+. Tyto lymfocyty tvořily 16 % ze všech B‑lymfocytů kostní dřeně. Popsaný lymfocytární klon odpovídal fenotypu Waldenströmovy makroglobulinemie.
Tyto výsledky hodnocení průtokovou cytometrií korespondují s popisy Berentsena (viz výše).
Vyšetření protilátek proti erytrocytům
Dále bylo provedeno vyšetření nepravidelných protilátek proti erytrocytům. V plazmě pacienta jsou přítomné chladové protilátky, které silně aglutinují erytrocyty v solném testu při 4 °C, ve kterém je lze prokázat v titru 2 000 (zkumavkový test). Teplotní amplituda těchto chladových protilátek dosahuje až do 37 °C: při této teplotě lze protilátky detekovat v solném a enzymovém testu, NAT je negativní. V testu při 20 °C i při vyšších teplotách je možné protilátku specifikovat jako protilátku anti‑I. K jejímu průkazu se použijí umbilikální erytrocyty, se kterými protilátka nereaguje (tyto erytrocyty neexprimují antigen I). Přímý antiglobulinový test provedený na opsonizovaných erytrocytech pacienta je pozitivní pro C3d složku komplementu; IgG, IgM, IgA izotyp protilátek není na erytrocytech zastoupený. Eluát z PAT‑pozitivních erytrocytů je negativní a vylučuje přítomnost tepelné autoprotilátky.
Léčba
Pacient byl koncem listopadu roku 2012 léčen prednisonem v dávce 1 mg/ kg a tato dávka se po 14 dnech postupně snižovala. Nebyla však účinná a pacient přišel s projevy nemoci chladových aglutininů na naši ambulanci. Vzhledem k neúčinnosti jsme léčbu prednisonem zcela ukončili.
Provedená vyšetření jednoznačně potvrdila primární nemoc chladových aglutininů.
V rámci II. linie léčby této autoimunitní anémie byla podána kombinovaná terapie dle protokolu, který se užívá při léčbě autoimunitní hemolytické anémie u chronické B‑lymfocytární leukemie: rituximab (rituximab 500 mg/ m2) celkem 1 000 mg. Tato dávka byla podána 4krát po sobě v týdenních intervalech + dexametazon 20 mg 1. – 4. den a 15. – 18. den cyklu. První aplikace byla podána 3. 1. 2013 a poslední, čtvrtá, 24. 1. 2013.
Aplikace rituximabu tedy proběhla ještě před zveřejněním omezení hrazení rituximabu zdravotními pojišťovnami.
Hodnocení efektu 4 aplikací rituximabu jsme provedli po měsíci, 20. února 2013. Hodnota koncentrace hemoglobinu byla 110 g/ l a pacient sděloval, že se symptomy nijak výrazně nezměnily.
Prudké zhoršení anémie při infekci
K zásadní změně došlo o několik dní později; dne 25. února 2013 se objevila horečka dosahující první den až 39 °C, další dny to bylo 38 °C. Pacient udával dráždivý kašel, slabost, došlo k poklesu hodnot krevního tlaku. Vše by odpovídalo systémové zánětlivé reakci. Při kontrole byl zřetelný vzestup hodnoty CRP z dříve fyziologických hodnot na 37 mg/ l a hemoglobin klesal z původních 110 g/ l na 97,9 g/ l a následující den na 84 g/ l. Anemizace byla provázena vzestupem aktivity LD až na 11,66 μkat/ l (norma 2,25 – 3,75 μkat/ l), což odpovídalo intravaskulárně probíhající hemolýze. Po zdánlivém ústupu infekce došlo k dalšímu zhoršení infekce se vzestupem CRP dne 8. 3. 2013 až na hodnotu 135 mg/ l, zřetelným nálezem infiltrace plicního parenchymu dle HRCT plic a poklesem koncentrace hemoglobinu až na 74 g/ l. Pacient měl velmi nízké koncentrace polyklonálních imunoglobulinů, IgG jenom 3,69 g/ l a IgA 2,28 g/ l. Proto jsme doplnili antibiotickou léčbu o podání nitrožilních imunoglobulinů. Po ústupu infekce, normalizaci CRP se zlepšil krevní obraz.
Vývoj laboratorních parametrů uvádí tab. 2.
2. Výsledky pacienta s nemocí chladových aglutininů. 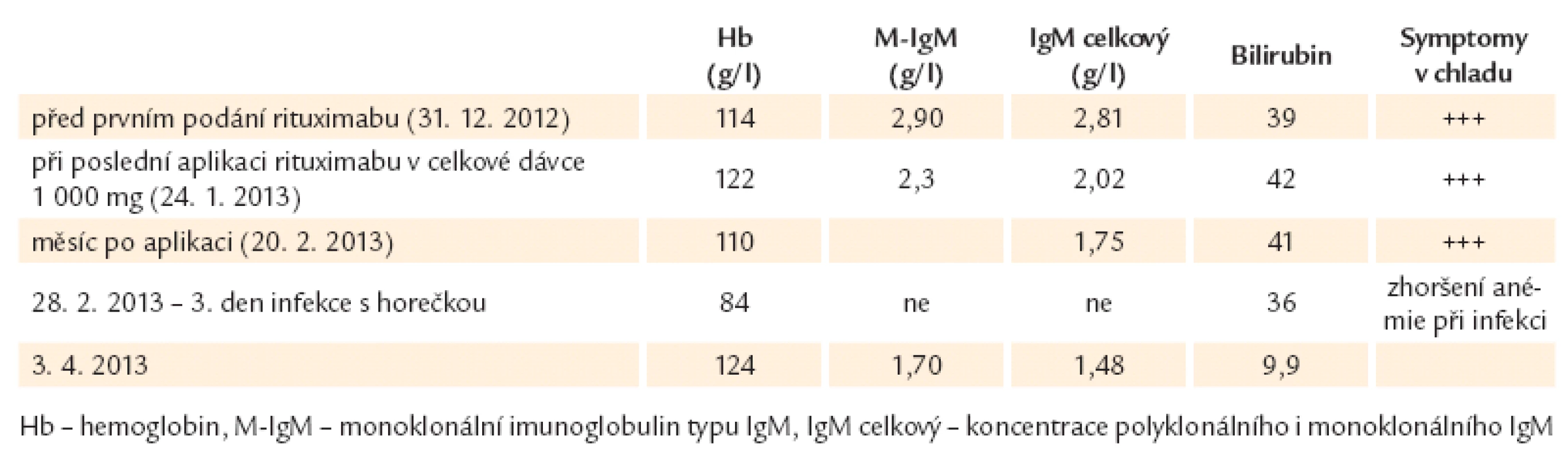
Nemoc pacienta stále obtěžuje. Znemožňuje mu pobyt mimo vytopené místnosti, při opuštění vytopené místnosti se ihned objeví výše popsané potíže, fialová akra s bolestmi v místech barevných změn a po návratu do tepla hemoglobinurie. Je pravděpodobné, že další pobyt v chladu by mohl vést i k trofickým defektům. Ale co je horší, jak je výše dokumentováno, každá infekce, která vede ke vzestupu teploty a systémové zánětlivé reakci, zásadně zvýší aktivitu hemolýzy s rychlým poklesem hodnot koncentrace hemoglobinu.
A tak stojíme před otázkou, jakou léčbu můžeme nyní pacientovi nabídnout. Proto v dalším textu shrneme dostupné údaje z literatury a z nich vyvodíme, co by nyní mohlo pomoci pacientovi s touto vzácnou chorobou.
Diskuze – přehled léčebných možností
Nefarmakologická léčba
Medikamentózní léčba byla donedávna neúspěšná, a tak se léčilo radou: „Paciente, drž se v teple!“ [20]. Neprochlazování alespoň částečně omezí závažnost klinických příznaků. Ze stejného důvodu je třeba každý nitrožilně podávaný roztok ohřát, včetně transfuzí. Operace v hypotermii jsou problémem [21]. U pacientů s chladovými aglutininy obvykle není komplikované najít vhodného dárce erytrocytů na rozdíl od pacientů s tepelnými protilátkami, pro které je problém vybrat vhodného dárce. Protilátkový screening a test kompatibility je však nutné provádět při 37 °C [22]. V případě, že je zapotřebí provést operaci v hypotermii, je nutno provést plazmaferézu, ale remise dosažené plazmaferézou jsou velmi krátké [2,23,24].
Splenektomie se v citované literatuře nedoporučuje, protože hemolýza neprobíhá ve slezině, na rozdíl od autoimunitní anémie s tepelnými protilátkami [5], a splenektomie neodstraní tvorbu monoklonálního IgM, který se tvoří v kostní dřeni. Léčebná odpověď na splenektomii byla výjimečně popsána u pacienta s nemocí chladových aglutininů, která byla způsobena monoklonální protilátkou typu IgG [25].
Indikace pro farmakologickou léčbu
Indikací pro zahájení léčby je nejen anémie, ale také klinické příznaky způsobené aglutinací, i když hodnoty krevního obrazu zůstávají kompenzovány.
Někteří pacienti však mají jen velmi mírnou aktivitu nemoci s mírnou anémií a s mírnými či žádnými cirkulačními problémy. U takových nemocných je možné s léčbou počkat. Takže diagnóza nemoci chladových aglutininů není indikací pro léčbu vždy, ale rozhodnutí léčit by mělo záviset na individuálním zvážení závažnosti nemoci, potenciálního přínosu a nežádoucích účinků léčby [5]. Hodnocení léčebných odpovědí uvádí tab. 3.
3. Hodnocení léčebných odpovědí u pacientů s nemocí chladových aglutininů dle Berentsena et al [5]. ![Hodnocení léčebných odpovědí u pacientů s nemocí chladových aglutininů dle Berentsena et al [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/48e5052ab98a99019dc6975791a4e6f2.png)
Kortikosteroidy v monoterapii
Pacienti s nemocí chladových aglutininů bývají často léčeni glukokortikoidy, ačkoliv tato praxe nebyla nikdy podporována systematickými studiemi. Lékaře k tomu vedou zkušenosti s léčbou anémie s tepelnými protilátkami a neuvědomují si rozdíl mezi oběma autoimunitními hemolytickými anémiemi.
V starším popisu 38 léčených v londýnské nemocnici pouze malá část pacientů měla léčebnou odpověď po léčbě glukokortikoidy [26]. Ke stejnému závěru – velmi malá účinnost glukokortikoidů – dospěli další autoři [23,27,28]. V retrospektivní studii uvádějí Berentsen et al a Schreiber et al léčebnou odpověď po glukokortikoidech jen u 14 %, což je velmi málo [5,29].
Cytostatika a interferon α
Monoterapie alkylačními cytostatiky měla přínos v některých laboratorních parametrech a bylo popsáno i klinické zlepšení [28,30]. Počet léčebných odpovědí je však stejně nízký jako u glukokortikoidů [5].
V malých souborech pacientů, léčených interferonem α nebo cladribinem v nízké dávce, také nebylo dosaženo léčebného úspěchu [31,32]. O efektu interferonu a existujeje několik protichůdných informací [33 – 35]. Odborná literatura obsahuje pouze několik popisů léčby azatioprinem bez léčebné odpovědi [5].
Rituximab v monoterapii
V případě Waldenströmovy makroglobulinemie je jedním z popisovaných léčebných způsobů podávání rituximabu v monoterapii 4krát po sobě v týdenních intervalech. Přehled léčby Waldenströmovy nemoci je uveden v časopise Vnitřní lékařství [36]. Zdvojnásobení celkové dávky rituximabu ze 4 na 8 infuzí (aplikace v 1. – 4. týdnu a dále ve 12. – 16. týdnu) sice nezvýšilo počet léčebných odpovědí (44 %), autoři této studie však uvádějí, že se výrazně prodloužilo trvání léčebné odpovědi u dříve léčených osob na 16 měsíců, což bylo déle než u nemocných, kteří dříve dostali pouze 4 dávky [37].
Podobné schéma aplikace rituximabu se běžně používá pro nemocné s nemocí chladových aglutininů. Od roku 1998 lze v odborné literatuře nalézt četné popisy účinnosti rituximabu u pacientů s nemocí chladových aglutininů [38 – 64] a malou prospektivní studii [65]. Tyto popisy případů v naprosté většině udávají příznivý efekt léčby rituximabem. Nicméně jsou vždy zatíženy obecnou pravdou, že autoři raději publikují pozitivní výsledky než výsledky negativní. Přesnější představu o účinnosti monoterapie rituximabem lze získat jedině z klinických studií.
Do roku 2012 byly zveřejněny zatím pouze 2 větší prospektivní studie, jejichž cílem bylo zhodnotit přínos rituximabu v monoterapii [66,67].
V obou studiích byla podána klasická dávka 375 mg/ m2 1krát týdně po dobu 4 týdnů.
Studie byly hodnoceny dle kritérií uvedených v tab. 2. Celkový počet léčebných odpovědí byl 54 % v I. [66] a 45 % v II. studii [67].
Berentsen et al léčili celkem 27 pacientů; po 4 aplikacích se celkem 14 z 27 pacientů dostalo do remise, jen u 1 pacienta se jednalo o kompletní remisi, u dalších šlo o parciální remise. U 10, kteří na první aplikaci nereagovali zlepšením, znovu po měsíci podali další 4 aplikace rituximabu a po této léčbě bylo dosaženo léčebné odpovědi u dalších 6 nemocných, kteří neměli léčebnou odpověď po prvních 4 aplikacích. Celkem bylo dosaženo 20 (54 %) léčebných odpovědí po 4 – 8 aplikacích rituximabu [66]. V Berentsenově studii byl medián vzestupu hemoglobinu 40 g/ l a medián intervalu do nástupu léčebné odpovědi byl 1,5 (0,5 – 4) měsíce, medián trvání léčebné odpovědi 11 (2 – 42) měsíců [66].
Ve studii německých autorů bylo léčeno celkem 20 nemocných, z nich 13 bylo klasifikováno jako primární nemoc chladových aglutininů a 7 mělo nemoc chladových aglutininů při maligním B lymfoproliferativním onemocnění. Rituximab byl podáván klasicky 375 mg/ m2 4krát po sobě v týdenních intervalech. Celkem u 9 pacientů došlo k léčebné odpovědi, u 1 ke kompletní remisi a u 8 pacientů k parciální remisi [67].
V největší zatím publikované skandinávské studii bylo sledováno 86 pacientů s primární nemocí chladových aglutininů. Celkem 40 z nich dostalo rituximab v monoterapii.
Celkem 23 pacientů (58 %) mělo léčebnou odpověď. Z toho 2 (5 %) dosáhli kompletní remise a 21 (53 %) dosáhlo parciální remise. Léčebné odpovědi byly pozorovány při 2. i 3. opakování léčby rituximabem [5].
Výše citované popisy případů a tyto 3 klinické studie potvrzují účinnost rituximabu v monoterapii. Nicméně dosažení kompletní remise není běžné a medián trvání léčebné odpovědi je jen v měsících. Z první Berentsenovy studie vyplývá, že když 4 aplikace v týdenních intervalech nenavodí kompletní remisi, pak navýšení počtu aplikací na 8 může u nemocných bez léčebné odpovědi po 4 aplikacích navodit dodatečnou léčebnou odpověď. Z tohoto důvodu bychom i u popisovaného pacienta chtěli zopakovat léčbu rituximabem.
Nežádoucí účinky této léčby jsou výjimečné a dobře tolerovatelné [66,67]. A jak dále s monoterapií rituximabem? Fakta o přínosu rituximabu pro udržovací léčbu folikulárních lymfomů signalizují, že prolongované a opakované podávání tohoto léku je bezpečné z hlediska rizika infekcí a prodlužuje remisi folikulárních lymfomů, takže by opakované podávání rituximabu v monoterapii vedlo s vysokou pravděpodobností k prodloužení trvání léčebné odpovědi [68]. A tak Berentsen uvádí možnost udržovací terapie i pro pacienty s nemocí chladových aglutininů [69].
Fludarabin a rituximab
Fludarabin je účinným lékem pro četné lymfoproliferativní choroby. Kombinace fludarabinu s rituximabem dosahuje vysoký počet léčebných odpovědí u Waldenströmovy makroglobulinemie [70] a u nízce agresivních nehodgkinských lymfomů [71]. U Waldenströmovy makroglobulinemie byla srovnávána monoterapie chlorambucilem s monoterapií fludarabinem v prospektivní randomizované studii. Počet léčebných odpovědí a interval do relapsu byl ve skupině léčené fludarabinem v monoterapii podstatně delší [72]. Proto byl fludarabin podáván pacientům s chorobou chladových aglutininů v monoterapii a vedl k dosažení remise [73].
Na základně těchto známých skutečností byla provedena prospektivní studie fáze II, v níž byli pacienti s nemocí chladových aglutininů léčeni fludarabinem a rituximabem v kombinaci [74,75]. Dvacet devět pacientů ve věku 39 – 87 let dostalo rituximab 375 mg/ m2 v den 1, 29, 57 a 85; a fludarabin perorálně 40 mg/ m2 ve dnech 1 – 5, 29 – 34, 57 – 61 a 85 – 89. Dvacet dva pacientů (76 %) dosáhlo léčebnou odpověď, z toho u 6 (21 %) bylo dosaženo kompletní remise a u 16 (55 %) bylo dosaženo parciální remise. Do této studie bylo zařazeno také 10 pacientů, kteří nedosáhli léčebné odpovědi po předchozí monoterapii rituximabem. V této podskupině byla dosažena kompletní remise u 1 a parciální remise u 6. Medián vzestupu koncentrace hemoglobinu byl 31 g/ l u pacientů, kteří dosáhli parciální remise a 40 g/ l u pacientů, kteří dosáhli kompletní remise. Medián intervalu do dosažení maximální léčebné odpovědi byl 4 měsíce. Medián dosažených léčebných odpovědí byl delší než 66 měsíců.
Závažnější (grade 3 – 4) hematologické nežádoucí účinky byly pozorovány u 12 (41 %) pacientů, nejčastější byla neutropenie.
Celkem 17 (59 %) pacientů mělo v průběhu léčby infekce o závažnosti stupně 1 – 3 dle WHO klasifikace nežádoucích účinků. Infekci (pneumonii) podlehl pouze 1 pacient. Pneumocystovou infekci nezaznamenali.
Protivirová profylaxe nebyla podávána a celkem 3 (10 %) pacienti, měli reaktivaci pásového oparu.
Přechodné zintenzivnění hemolýzy (anémie) bylo zřetelné u 3 (10 %) pacientů, souviselo zřejmě s infekcí a reakcí akutní fáze, při níž se zvyšuje koncentrace komplementu, jak bylo výše uvedeno [10,11].
Fludarabinem indukované tepelné protilátky proti erytrocytům nebyly pozorovány. Podstatné je, že u 1/ 2 pacientů musela být dávka fludarabinu redukována pro hematologickou toxicitu [75].
S určitou opatrností lze srovnat tyto 3 nerandomizované studie. Kombinovaná léčba fludarabin + rituximab dosáhla podstatně více léčebných odpovědí (76 %) o delším trvání (medián 66 měsíců), zatímco monoterapie rituximabem dosáhla pouze 45 – 58 % léčebných odpovědí s mediánem trvání 11 měsíců [66,67,75,76]. Remise nemoci chladových aglutininů byly ve všech studiích spojené s ústupem infiltrace kostní dřeně lymfoproliferativním onemocněním a s poklesem koncentrace monoklonálního imunoglobulinu třídy IgM. Míra hematologické léčebné odpovědi korespondovala s mírou poklesu koncentrace monoklonálního imunoglobulinu typu IgM [75]. Berentsen et al z toho vyvozují, že je zásadní potlačit patologický klon B buněk [74,75].
Kombinace fludarabinu s rituximabem je podstatně toxičtější než rituximab v monoterapii. Proto je nutné zvážit jak okamžité riziko, které je výrazné hlavně u lidí s dalšími chorobami, tak také mutagenní potenciál (riziko sekundárních hematologických malignit), byť ten je více vyjádřen u kombinací fludarabinu s cyklofosfamidem [75]. Pozdní výskyt akutní myeloidní leukemie a myelodysplastického syndromu byl popsán po léčbě obsahující fludarabin u pacientů s Waldenströmovou makroglobulinemií [77,78].
V 1 případě pacienta s nemocí chladových aglutininů byla s úspěchem použita kombinace fludarabinu, cyklofosfamidu a rituximabu, jinak standardně používaná pro léčbu chronické B‑lymfatické leukemie [79]. Léčba kombinací fludarabinu s cyklofosfamidem je však spojena s výraznějším mutagenním účinkem než fludarabin v monoterapii, a tak je opět na zvážení potencionální přínos a riziko.
Další zkušenosti s léčbou nemoci chladových aglutininů
Cílem léčby nemoci chladových aglutininů je potlačit klon tvořící monoklonální imunoglobulin typu IgM, tedy stejný typ monoklonálního imunoglobulinu, jaký je charakteristický pro Waldenströmovu makroglobulinemii. Proto budou léčebné postupy pro nemoc chladových aglutininů stejné či podobné jako postupy, které se používají pro léčbu Waldenströmovy makroglobulinemie. Za účinné léky pro léčbu Waldenströmovy makroglobulinemie se v roce 2013 považují rituximab, chlorambucil, cyklofosfamid, fludarabin, bortezomib, lenalidomid, bendamustin, everolimus a alemtuzumab [80 – 82]. Např. Gerz z Mayo Clinic považuje za vhodnou kombinaci pro iniciální léčbu Waldenströmovy makroglobulinemie kombinaci rituximabu, cyklofosfamidu a dexametazonu [80,81]. A kombinace rituximab s cyklofosfamidem byla s úspěchem použita i pro léčbu nemoci chladových aglutininů [83].
Rituximab a bortezomib
Z nových a vysoce účinných léčebných postupů pro Waldenströmovu makroglobulinemii je nutno na prvním místě uvést kombinaci bortezomibu (Velcade) s rituximabem.
Proběhly četné klinické studie fáze II, které prokázaly u pacientů s Waldenströmovou makroglobulinemií velmi vysoký počet léčebných odpovědí, dosahující 80 – 90 % a z toho až 20 % kompletních remisí [84 – 100]. Lze tedy předpokládat, že brzy budou tyto výsledky potvrzeny prospektivní randomizovanou studií a bortezomib bude zpřístupněn i pacientům s touto chorobou.
Výše uvedená fakta vedla k podání této léčby (rituximab a bortezomib) i pacientům s nemocí chladových aglutininů. Carson et al v roce 2010 popsali výborný léčebný efekt monoterapie bortezomibem u pacientky, u níž předcházela léčba cytostatiky i rituximabem. Aplikace bortezomibu v monoterapii vedla ke zlepšení krevního obrazu [101].
Rituximab a bendamustin
Vzhledem k tomu, že fludarabin má svá rizika, je žádoucí najít do kombinace k rituximabu další lék, který by měl dobrý efekt a menší toxicitu než fludarabin. V posledních letech se u nízce agresivních lymfoproliferací a u mnohočetného myelomu osvědčil lék s názvem bendamustin, který přináší lepší výsledky než klasická alkylační cytostatika a jeho akutní a pozdní toxicita je akceptovatelná [102].
Bendamustin byl srovnáván v rámci klinické studie fáze III s chlorambucilem u pacientů s chronickou B-lymfocytární leukemií (B ‑ CLL). Skupina s bendamustinem dosáhla kompletní remise ve 21 %, zatímco skupina s chlorambucilem jen v 10,8 %. Medián bezpříznakového intervalu byl v bendamustinové skupině 21,2 měsíce, zatímco v chlorambucilové jen 8,8 měsíce; p < 0,0001; a interval do další léčby byl 31,7 vs 10,1 měsíce [103]. Těmito daty jen ilustrujeme, že pro pacienty s B ‑ CLL je bendamustin podstatně výhodnější než klasické alkylační cytostatikum chlorambucil.
Také u mnohočetného myelomu byly výsledky léčby bendamustinem lepší z hlediska počtu léčebných odpovědí než po melfalanu a byl vyšší počet kompletních remisí, 32 % ve skupině léčené bendamustinem a 13 % ve skupině léčené melfalanem [104].
V případě Waldenströmovy makroglobulinemie není k dispozici žádná srovnávací studie bendamustin vs jiný standardní lék, ale vzhledem k tomu, že Waldenströmova makroglobulinemie (lymfoplazmocytární lymfom) je nemoc velmi podobná B ‑ CLL a myelomu, lze usuzovat, že bendamustin bude u této nemoci také účinnější než klasická starší alkylační cytostatika.
K dispozici je pouze popis souboru 30 nemocných s refrakterní či relabující Waldenströmovou makroglobulinemií, kteří byli léčeni bendamustinem v kombinaci s rituximabem (90 mg/ m2 i.v. den 1, 2) a rituximab (375 mg/ m2 i.v. den 1 nebo 2 cyklu). Celkový počet léčebných odpovědí byl 83,3 %, z toho 5 pacientů dosáhlo velmi dobré parciální remise a 20 parciální remise [105].
Uvedené studie signalizují, že bendamustin v monoterapii dosahuje lepších výsledků než standardně používaná alkylační cytostatika u chronické B-lymfocytární leukemie a i mnohočetného myelomu. A dále kombinace bendamustinu s rituximabem dosahuje vysokého počtu léčebných odpovědí i ve skupině s relabující či refrakterní Waldenströmovou chorobou [105]. Lze očekávat, že tato kombinace bude přínosná i pro pacienty s nemocí chladových aglutininů.
První popis léčby nemoci chladových aglutininů kombinací bendamustinu a rituximabu byl již publikován. Bendamustin byl použit u pacienta s nemocí chladových aglutininů, u něhož nebyla účinná předchozí léčba. Bendamustin byl podán v dávce 70 mg/ m2/ den 2 dny po sobě v 4týdenních intervalech. V dalším cyklu již bylo použito dávky 90 mg/ m2/ den. Rituximab byl podáván ve standardních dávkách 375 mg/ m2 1krát měsíčně vždy při aplikaci bendamustinu. Léčebná odpověď byla zřetelná již po 1. cyklu, kdy výrazně stoupla koncentrace hemoglobinu a pacient přestal být závislý na transfuzích [106].
Monoklonální protilátka anti‑C5 eculizumab
Monoklonální protilátka, anti‑C5, eculizumab, je zásadním pokrokem pro léčbu paroxyzmální noční hemoglobinurie [107]. Tím, že zablokuje aktivitu C5 části komplementu, zastaví hemolýzu. A ačkoli hemolýza u nemoci chladových aglutininů není dominantně způsobena částí komplementu C5, přesto infuze obsahující eculizumab vedla k zásadnímu zlepšení nemocného [108] s chorobou chladových aglutininů.
Použití tohoto léku by mohlo pomoci v situacích, kdy se zvyšuje endogenní produkce komplementu, tedy při febrilních infekcích a jiných stavech, které vyvolávající reakci akutní fáze. Eculizumab je tedy velmi užitečný lék pro ty nemocné, u nichž se nepodaří léčbou odstranit tvorbu monoklonálního imunoglobulinu. Představuje pro ně alternativu volby.
A co vysokodávkovaná chemoterapie s autologní transplantací?
V databázi Medline není zatím popsán případ pacienta s chladovými aglutininy, který by byl léčen vysokodávkovanou chemoterapií s autologní transplantací.
K dispozici jsou pouze popisy pacientů se symptomatickou Waldenströmovou makroglobulinemií, kteří byli takto léčeni. Analýza Evropského transplantačního registru publikovaná v roce 2010 [109] popisuje celkem 158 pacientů s Waldenströmovou makroglobulinemií, kteří byli léčeni vysokodávkovanou chemoterapií s autologní transplantací krvetvorných buněk. Léčba byla zatížena 3,8% mortalitou do konce 1. roku po transplantaci. Tato léčba vedla ke kompletní remisi u 22 %, velmi dobré parciální remisi u 50 % a parciální remisi u dalších 15 %. Po 5 letech došlo k relapsu u 52,1 % [109]. Pro pacienty s Waldenströmovou makroglobulinemií představuje tedy vysokodávkovaná chemoterapie možný postup v případě neúspěchu klasické chemoterapie [110 – 112]. A tak je otázka k odborné diskuzi, zda by tato léčba byla akceptovatelná i v případě pacientů s nemocí chladových aglutininů nereagující na předchozí léčebné postupy.
Co plyne z výše uvedených informací pro popsaný případ?
Dle analýzy publikovaných informací by pro našeho pacienta s nemocí chladových aglutininů, která nereagovala na prednison a dále na 4 aplikace rituximabu s dexametazonem, byla naděje na léčebnou odpověď při navýšení počtu aplikací rituximabu na 8.
Nicméně z výše uvedeného přehledu literatury je zřejmé, že další infuze rituximabu by bylo vhodné kombinovat s podáním dalšího účinného léku, a tím zvýšit pravděpodobnost léčebné odpovědi. Na základě přehledu literatury považujeme za vhodné zkombinovat další infuze rituximabu s bortezomibem nebo s bendamustinem nebo s cyklofosfamidem či případně s fludarabinem. Efekt těchto postupů byl potvrzen uvedenými případy. Pro vzácnost nemoci nejsou k dispozici žádné srovnávací studie. A tak je nutno vybírat dle popsané účinnosti a dle známých nežádoucích účinků léku.
Vzhledem k tomu, že z hlediska délky života je prognóza pacienta příznivá, je nutno vybírat léky s malou akutní, ale i pozdní toxicitou. Z popsaných léčebných postupů bychom za optimální považovali kombinaci rituximabu s bortezomibem a dexametazonem. Další alternativy jsou kombinace rituximab + bendamustin + dexametazon, případně rituximab + bendamustin + bortezomib.
Rozhodnutí o podání či nepodání další léčby bude záviset na rozhodnutí revizních lékařů zdravotní pojišťovny, protože žádný z uvedených nových léků nemá registraci pro tak výjimečnou chorobu, jakou je nemoc chladových aglutininů, a žádný ze starších léků nepomáhá. Takže pokud pojišťovna neudělá výjimku, jediné co lze, je doporučit pacientovi, ať se drží pěkně v teple a ať nemá žádné infekce, protože infekce mu zásadně zaktivizují hemolýzu!
Závěr pro praxi
- Nefarmakologická opatření (vyhýbání se chladu) jsou základním opatřením při potvrzení diagnózy nemoci chladových aglutininů.
- Infekce s reakcí akutní fáze zvyšují koncentraci komplementu, a tedy i hemolýzu, proto je nutné infekce léčit velmi intenzivně.
- Pokud je nutno podat infuzi či transfuzi pacientům s nemocí chladových aglutininů, musí být předehřátá na fyziologickou teplotu.
- Vzorky krve určené k laboratorním vyšetřením musejí být transportované a udržované při teplotě 37 – 38 °C až do doby, kdy se oddělí plazma od krevního koagula.
- Léčba, která se běžně používá u autoimunitní hemolytické anémie s tepelnými protilátkami (kortikoidy v monoterapii, monoterapie alkylačními cytostatiky, azatioprin, splenektomie), nebývá u pacientů s chladovými aglutininy úspěšná.
- Nemoc chladových aglutininů se má léčit podobnými postupy jako Waldenströmova makroglobulinemie.
- Základem léčby je rituximab.
- Vyšší počet léčebných odpovědí dosáhla kombinace rituximabu a fludarabinu, ale s počtem léčebných odpovědí se zvýšila také toxicita léčby.
- K nejnovějším léčebným postupům pro Waldenströmovu makroglobulinemii patří kombinace rituximab + bortezomib anebo rituximab + bendamustin, tyto léčebné postupy přinesly prospěch i pacientům s nemocí chladových protilátek.
- Monoklonální protilátka anti‑C5 eculizumab je možností léčby nejen pro nemocné s paroxyzmální noční hemoglobinurií, ale i pro pacienty s nemocí chladových aglutininů. Je schopna zastavit hemolýzu u těch pacientů, u nichž chemoterapie nevede k eliminaci monoklonálního imunoglobulinu, nebo je možné tento lék použít v době infekce, kdy se zvyšuje komplement a výrazně aktivuje hemolýza, a tedy i animizace nemocného.
Tato práce byla podpořena granty IGA Mini-sterstva zdravotnictví NT12215, NT12130 a NT13190 a dále MUNI/ A/ 0723/ 2012.
prof. MU Dr. Zdeněk Adam, CSc.
www.fnbrno.cz
e‑mail: z.adam@fnbrno.cz
Doručeno do redakce: 4. 3. 2013
Přijato po recenzi: 29. 4. 2013
Sources
1. Lechner K, Jäger U. How I treat autoimmune hemolytic anemias in adults. Blood 2010; 116 : 1831 – 1838.
2. Gumulec J, Brát R, Kolek M et al. Předoperační péče u pacientů před operací srdce s chladovými protiltákami, kryoglobulinémií a kryofibrinogenemií. Vnitř Lék 2009; 55 : 236 – 241.
3. Bílková L, Kubíková ‑ Kouřilová M. Chladové aglutininy komplikují určení krevní skupiny. Vnitř Lék 1955; 1 : 19 – 22.
4. Fiedmann B, Heřmanský F, Gyorgy A. Hemolytická anémie s chladovými aglutininy. Čas Lék Česk 1954; 93 : 1371 – 1274.
5. Berentsen S, Ulvestad E, Langholm R et al. Primary chronic cold agglutinin disease: a population based clinical study of 86 patients. Haematologica 2006; 91 : 460 – 466.
6. Berentsen S, Beiske K, Tjonnfjord GE. Primary chronic cold agglutinin disease: an update on pathogenesis, clinical features and therapy. Hematology 2007; 12 : 361 – 370.
7. Ulvestad E, Berentsen S, Bo K. Clinical immunology of chronic cold agglutinin disease. Eur J Haematol 1999; 63 : 259 – 266.
8. Landsteiner K. Über Beziehungen zwischen dem Blutserum und den Körperzellen. Münch Med Wochenschrift 1903; 50 : 1812 – 1814.
9. Lyckholm LJ, Edmond MB. Images in clinical medicine. Seasonal hemolysis due to cold ‑ agglutinin syndrome. N Engl J Med 1996; 334 : 437 – 438.
10. Ulvestad E. Paradoxical haemolysis in a patient with cold agglutinin disease. Eur J Haematol 1998; 60 : 93 – 100.
11. Ulvestad E, Berentsen S, Mollnes TE. Acute phase haemolysis in chronic cold agglutinin disease. Scand J Immunol 2001; 54 : 239 – 242.
12. Kirschfink M, Knoblauch K, Roelcke D. Activation of complement by cold agglutinins. Infusionsther Transfusionsmed 1994; 21 : 405 – 409.
13. Zilow G, Kirschfink M, Roelcke D. Red cell destruction in cold agglutinin disease. Infusionsther Transfusionsmed 1994; 21 : 410 – 415.
14. Christenson WN, Dacie JV, Croucher BE et al. Electrophoretic studies on sera containing high‑titre cold haemagglutinins: identification of the antibody as the cause of an abnormal gamma 1 peak. Brit J Haemat 1957; 3 : 262 – 275.
15. Berentsen S, Bo K, Shammas FV et al. Chronic cold agglutinin disease of the “idiopathic” type is a premalignant or low ‑ grade malignant lymphoproliferative disease. APMIS 1997; 105 : 354 – 362.
16. Owen RG, Treon SP, Al Katib A et al. Clinicopathological definition of Waldenstrom’s macroglobulinemia: consensus panel recommendations from the second international workshop on Waldenstrom’s macroglobulinemia. Semin Oncol 2003; 30 : 110 – 115.
17. Berentsen S. Cold agglutinin‑mediated autoimmune hemolytic anemia in Waldenstrom’s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9 : 110 – 112.
18. Cesana C, Barbarano L, Miqueleiz S et al. Clinical characteristics and outcome of immunoglobulin M related disorders. Clin Lymphoma 2005; 5 : 261 – 264.
19. Adam Z, Šmardová J, Ščudla V. Waldenströmova makroglobulinémie – klinické projevy, diferenciální diagnostika a prognóza nemoci. Vnitř Lék 2007; 53 : 1325 – 1337.
20. Gertz MA. Cold agglutinin disease. Haematologica 2006; 91 : 439 – 441.
21. Bartholomew JR, Bell WR, Shirey RS. Cold agglutinin hemolytic anemia: management with an environmental suit. Ann Intern Med 1987; 106 : 243 – 244.
22. Rosenfield RE, Jagathambal K. Transfusion therapy for autoimmune hemolytic anemia. Semin Hematol 1976; 13 : 311 – 321.
23. Nydegger UE, Kazatchkine MD, Miescher PA.Immunopathologic and clinical features of hemolytic anemia due to cold agglutinins. Semin Hematol 1991; 28 : 66 – 77.
24. Zoppi M, Oppliger R, Althaus U et al. Reduction of plasma cold agglutinin titers by means of plasmapheresis to prepare a patient for coronary bypass surgery. Infusionsther Transfusionsmed 1993; 20 : 19 – 22.
25. Silberstein LE, Berkman EM, Schreiber AD. Cold hemagglutinin disease associated with IgG cold ‑ reactive antibody. Ann Intern Med 1987; 106 : 238 – 242.
26. Dacie J. Treatment and prognosis of cold ‑ antibody AIHA. In: Dacie J (ed). The Haemolytic Anaemias. London: Churchill Livingstone 1992 : 502 – 508.
27. Schubothe H. The cold hemagglutinin disease. Semin Hematol 1966; 3 : 27 – 47.
28. Worlledge SM, Brain MC, Cooper AC et al. Immmunosuppressive drugs in the treatment of autoimmune haemolytic anaemia. Proc R Soc Med 1968; 61 : 1312 – 1315.
29. Schreiber AD, Herskovitz BS, Goldwein M. Low ‑ titer cold ‑ hemagglutinin disease. Mechanism of hemolysis and response to corticosteroids. N Engl J Med 1977; 296 : 1490 – 1494.
30. Hippe E, Jensen KB, Olesen H et al. Chlorambucil treatment of patients with cold agglutinin syndrome. Blood 1970; 35 : 68 – 72.
31. Hillen HF, Bakker SJ. Failure of interferon‑alpha ‑ 2b therapy in chronic cold agglutinin disease. Eur J Haematol 1994; 53 : 242 – 243.
32. Berentsen S, Tjonnfjord GE, Shammas FV et al. No response to cladribine in five patients with chronic cold agglutinin disease. Eur J Haematol 2000; 65 : 88 – 90.
33. O’Connor BM, Clifford JS, Lawrence WD et al. Alpha ‑ interferon for severe cold agglutinin disease. Ann Intern Med 1989; 111 : 255 – 256.
34. Fest T, de Wazieres B, Lamy B et al. Successful response to alpha ‑ interferon 2b in a refractory IgM autoaglutinin‑mediated hemolytic anemia. Ann Hematol 1994; 69 : 147 – 149.
35. Rordorf R, Barth A, Nydegger U et al. Treatment of severe idiopathic cold ‑ agglutinin diseases using interferon‑alpha 2b. Schweiz Med Wochenschr 1994; 124 : 56 – 61.
36. Adam Z, Ščudla V, Krejčí M et al. Léčba Waldenströmovy makroglobulinemie a léčba nemocí způsobených monoklonálním gamaglobulinem. Vnitř Lék 2008; 54 : 68 – 83.
37. Dimopoulos MA, Merlini G, Leblond V et al. How we treat Waldenström’s macroglobulinemia. Haematologica 2005; 90 : 117 – 125.
38. Bauduer F. Rituximab: a very efficient therapy in cold agglutinins and refractory autoimmune haemolytic anaemia associated with CD20 - positive, low ‑ grade non‑Hodgkin’s lymphoma. Br J Haematol 2001; 112 : 1085 – 1086.
39. Brauer DL, Edelman B, Rapoport AP et al. Plasma exchange and rituximab treatment for lenalidomide‑associated cold agglutinin disease. Transfusion 2012; 52 : 2432 – 2435.
40. Cohen Y, Polliack A, Zelig O et al. Monotherapy with rituximab induces a rapid remission of recurrent cold agglutinin‑mediated hemolytic anemia in a patient with indolent lympho ‑ plasmacytic lymphoma. Leuk Lymphoma 2001; 42 : 1405 – 1408.
41. Delluc A, Pasquier E, de Saint Martin L et al. Rituximab’s cost for the treatment of primary cold agglutinin disease should not limit its use. Haematologica 2006; 91: ECR05.
42. Engelhardt M, Jakob A, Ruter B et al. Severe cold hemagglutinin disease (CHD) successfully treated with rituximab. Blood 2002; 100 : 1922 – 1923.
43. Gertz MA. Cold agglutinin disease and cryoglobulinemia. Clin Lymphoma 2005; 5 : 290 – 293.
44. Gertz MA. Management of cold haemolytic syndrome. Br J Haematol 2007; 138 : 422 – 499.
45. Glaser M, Glaser A, Skalicky M. Long lasting remission by rituximab in a patient with primary cold agglutinin autoimmune haemolytic anaemia. Wien Klin Wochenschr 2011; 123 : 680 – 683.
46. Gupta S, Szerszen A, Nakhl F et al. Severe refractory autoimmune hemolytic anemia with both warm and cold autoantibodies that responded completely to a single cycle of rituximab: a case report. J Med Case Rep 2011; 5 : 156.
47. Gürcan HM, Keskin DB, Stern JN et al. Review of the current use of rituximab in autoimmune diseases. Int Immunopharmacol 2009; 9 : 10 – 25.
48. Hattori N, Ishii N, Ariizumi H et al. Improvement of the thermal amplitude after rituximab treatment for cold agglutinin disease with Waldenström’s macroglobulinemia. Ann Hematol 2010; 89 : 103 – 104.
49. Koppel A, Lim S, Osby M et al. Rituximab as successful therapy in a patient with refractory paroxysmal cold hemoglobinuria. Transfusion 2007; 47 : 1902 – 1904.
50. Kotani T, Takeuchi T, Kawasaki Y et al. Successful treatment of cold agglutinin disease with anti‑CD20 antibody (rituximab) in a patient with systemic lupus erythematosus. Lupus 2006; 15 : 683 – 685.
51. Layios N, Van Den Neste E, Jost E et al. Remission of severe cold agglutinin disease after Rituximab therapy. Leukemia 2001; 15 : 187 – 188.
52. Lee EJ, Kueck B. Rituxan in the treatment of cold agglutinin disease. Blood 1998; 92 : 3490 – 3491.
53. Malesci D, La Montagna G. Occurrence of cold agglutinin disease in RA patient during etanercept therapy successfully treated with rituximab. Rheumatology (Oxford) 2008; 47 : 734 – 735.
54. Mori A, Tamaru J, Sumi H et al. Beneficial effects of rituximab on primary cold agglutinin disease refractory to conventional therapy. Eur J Haematol 2002; 68 : 243 – 246.
55. Palombi M, Niscola P, Trawinska MM et al. Long‑lasting remission induced by rituximab in two cases of refractory autoimmune haemolytic anaemia due to cold agglutinins. Blood Transfus 2009; 7 : 235 – 236.
56. Panwar U, Mathews C, Cullis J. Cost‑effectiveness of rituximab in refractory cold agglutinin disease. Int J Lab Hematol 2008; 30 : 331 – 333.
57. Petit J, Clavo M, de Sevilla AF et al. Refractory cold agglutinin‑immunohaemolytic anaemia associated to marginal zone lymphoma responding to rituximab. Hematol J 2003; 4 : 450 – 451.
58. Pulik M, Genet P, Lionnet F et al. Treatment of primary chronic cold agglutinin disease with rituximab: maintenance therapy may improve the results. Br J Haematol 2002; 117 : 998 – 999.
59. Röth A, Dührsen U. Cold agglutinin disease. Eur J Haematol 2010; 84 : 91 – 93.
60. Ruch J, McMahon B, Ramsey G et al. Catastrophic multiple organ ischemia due to an anti‑Pr cold agglutinin developing in a patient with mixed cryoglobulinemia after treatment with rituximab. Am J Hematol 2009; 84 : 120 – 122.
61. Sailler L. Rituximab off label use for difficult ‑ to ‑ treat auto ‑ immune diseases: reappraisal of benefits and risks. Clin Rev Allergy Immunol 2008; 34 : 103 – 110.
62. Webster D, Ritchie B, Mant MJ. Prompt response to rituximab of severe hemolytic anemia with both cold and warm autoantibodies. Am J Hematol 2004; 75 : 258 – 259.
63. Yegin ZA, Yağci M, Haznedar R. Cold agglutinin disease with IgG monoclonal gammopathy in a case of chronic lymphocytic leukemia: an unusual presentation. Transfus Apher Sci 2009; 40 : 219 – 220.
64. Zaja F, Russo D, Fuga G et al. Rituximab in a case of cold agglutinin disease. Br J Haematol 2001; 115 : 232 – 233.
65. Berentsen S, Tjonnfjord GE, Brudevold R et al. Favourable response to therapy with the anti‑CD20 monoclonal antibody rituximab in primary chronic cold agglutinin disease. Brit J Haematol 2001; 115 : 79 – 83.
66. Berentsen S, Ulvestad E, Gjertsen BT et al.Rituximab for primary chronic cold agglutinin disease: a prospective study of 37 courses of therapy in 27 patients. Blood 2004; 103 : 2925 – 2928.
67. Schollkopf C, Kjeldsen L, Bjerrum OW et al. Rituximab in chronic cold agglutinin disease: a prospective study of 20 patients. Leuk Lymphoma 2006; 47 : 253 – 260.
68. Ghielmini M, Schmitz SF, Cogliatti SB et al. Prolonged treatment with rituximab in patients with follicular lymphoma significantly increases event‑free survival and response duration compared with the standard weekly × 4 schedule. Blood 2004; 103 : 4416 – 4423.
69. Berentsen S. How I manage cold agglutinin disease. Br J Haematol 2011; 153 : 309 – 317.
70. Treon SP. How I treat Waldenstrom macroglobulinemia. Blood 2009; 114 : 2375 – 2385.
71. Czuczman MS, Koryzna A, Mohr A et al. Rituximab in combination with fludarabine chemotherapy in low ‑ grade or follicular lymphoma. J Clin Oncol 2005; 23 : 694 – 704.
72. Leblond V, Johnson S, Chevret S et al. Results of a randomized trial of chlorambucil versus fludarabine for patients with untreated waldenstrom macroglobulinemia, marginal zone lymphoma, or lymphoplasmacytic lymphoma. J Clin Oncol 2013; 31 : 301 – 307.
73. Jacobs A. Cold agglutinin hemolysis responding to fludarabine therapy. Am J Hematol 1996; 53 : 279 – 280.
74. Berentsen S, Ulvestad E, Tjonnfjord GE. B‑lymphocytes as targets for therapy in chronic cold agglutinin disease. Cardiovasc Hematol Disord Drug Targets 2007; 7 : 219 – 227.
75. Berentsen S, Randen U, Vagan AM et al. High response rate and durable remissions following fludarabine and rituximab combination therapy for chronic cold agglutinin disease. Blood 2010; 116 : 3180 – 3184.
76. Stone MJ. Heating up cold agglutinins. Blood 2010; 116 : 3119 – 3120.
77. Leleu X, Tamburini J, Roccaro A et al. Balancing risk versus benefit in the treatment of Waldenstrom’s macroglobulinemia patients with nucleoside analogue‑based therapy. Clin Lymphoma Myeloma 2009; 9 : 71 – 73.
78. Treon SP, Branagan AR, Ioakimidis L et al. Long‑term outcomes to fludarabine and rituximab in Waldenstrom macroglobulinemia. Blood 2009; 113 : 3673 – 3678.
79. Bhattacharyya J, Mihara K, Takihara Y et al. Successful treatment of IgM ‑ monoclonal gammopathy of undetermined significance associated with cryoglobulinemia and cold agglutinin disease with immunochemotherapy with rituximab, fludarabine, and cyclophosphamide. Ann Hematol 2012; 91 : 797 – 799.
80. Gertz M. Waldenström macroglobulinemia: my way. Leuk Lymphoma 2013; 54 : 464 – 471.
81. Gertz MA. Waldenström macroglobulinemia: 2012 update on diagnosis, risk stratification, and management. Am J Hematol 2012; 87 : 503 – 510.
82. Ghobrial IM. Choice of therapy for patients with Waldenstrom macroglobulinemia. J Clin Oncol 2013; 31 : 291 – 293.
83. Schöllkopf C, Kjeldsen L, Bjerrum OW et al. Beneficial effect of rituximab in combination with oral cyclophosphamide in primary chronic cold agglutinin disease. Int J Hematol 2005; 81 : 421 – 423.
84. Agathocleous A, Rohatiner A, Rule S et al. Weekly versus twice weekly bortezomib given in conjunction with rituximab, in patients with recurrent follicular lymphoma, mantle cell lymphoma and Waldenström macroglobulinaemia. Br J Haematol 2010; 151 : 346 – 353.
85. Dimopoulos MA, Anagnostopoulos A, Kyrtsonis MC et al. Treatment of relapsed or refractory Waldenström’s acroglobulinemia with bortezomib. Haematologica 2005; 90 : 1655 – 1658.
86. Dimopoulos MA, Chen C, Kastritis E et al. Bortezomib as a treatment option in patients with Waldenström macroglobulinemia. Clin Lymphoma Myeloma Leuk 2010; 10 : 110 – 117.
87. Ghobrial IM, Hong F, Padmanabhan S et al. Phase II trial of weekly bortezomib in combination with rituximab in relapsed or relapsed and refractory Waldenstrom macroglobulinemia. J Clin Oncol 2010; 28 : 1422 – 1428.
88. Ghobrial IM, Xie W, Padmanabhan S et al. Phase II trial of weekly bortezomib in combination with rituximab in untreated patients with Waldenström macroglobulinemia. Am J Hematol 2010; 85 : 670 – 674.
89. Chen CI, Kouroukis CT, White D et al. Bortezomib is active in patients with untreated or relapsed Waldenstrom‘s macroglobulinemia: A phase II study of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007; 25 : 1570 – 1575.
90. Chen C, Kouroukis CT, White D et al. Bortezomib in relapsed or refractory Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9 : 74 – 76.
91. Laubach JP, Mitsiades CS, Roccaro AM et al.Clinical challenges associated with bortezomib therapy in multiple myeloma and Waldenström’s macroglobulinemia. Leuk Lymphoma 2009; 50 : 694 – 702.
92. Leblond V. Waldenström’s macroglobulinemia and bortezomib. Haematologica 2005; 90 : 1589A.
93. Leleu X, Eeckhoute J, Jia X et al. Targeting NF ‑ kappaB in Waldenstrom macroglobulinemia. Blood 2008; 111 : 5068 – 5077.
94. Pascal L, Gay J, Willekens C et al. Bortezomib and Waldenstrom’s macroglobulinemia. Expert Opin Pharmacother 2009; 10 : 909 – 916.
95. Treon SP, Ioakimidis L, Soumerai JD et al. Primary therapy of Waldenström macroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinical trial 05 – 180. J Clin Oncol 2009; 27 : 3830 – 3835.
96. Treon SP. How I treat Waldenström macroglobulinemia. Blood 2009; 114 : 2375 – 2385.
97. Treon SP, Hatjiharissi E, Leleu X et al. Novel agents in the treatment of Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2007; 7 (Suppl 5): S199 – S206.
98. Treon SP, Hunter ZR, Matous J et al. Multicenter clinical trial of bortezomib in relapsed/ refractory Waldenstrom’s macroglobulinemia: results of WMCTG Trial 03 – 248. Clin Cancer Res 2007; 13 : 3320 – 3325.
99. Treon SP, Loakimidis L, Soumerai JD et al. Primary therapy of Waldenstrom’s macroglobulinemia with bortezomib, dexamethasone and rituximab: results of the WMCTG clinical trial 05 – 180. ASCO annual meeting 2008. J Clin Oncol 2009; 27 : 3830 – 3835.
100. Wang M, Zhou Y, Zhang L et al. Use of bortezomib in B ‑ cell non‑Hodgkin’s lymphoma. Expert Rev Anticancer Ther 2006; 6 : 983 – 991.
101. Carson KR, Beckwith LG, Mehta J. Successful treatment of IgM ‑ mediated autoimmune hemolytic anemia with bortezomib. Blood 2010; 115 : 915.
102. Vidal L, Gafter ‑ Gvili A, Gurion R et al. Bendamustine for patients with indolent B cell lymphoid malignancies including chronic lymphocytic leukaemia. Cochrane Database Syst Rev 2012; 9: CD009045.
103. Knauf WU, Lissitchkov T, Aldaoud A et al. Bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukaemia: updated results of a randomized phase III trial. Br J Haematol 2012; 159 : 67 – 77.
104. Pönisch W, Mitrou PS, Merkle K et al. Treatment of bendamustine and prednisone in patients with newly diagnosed multiple myeloma results in superior complete response rate, prolonged time to treatment failure and improved quality of life compared to treatment with melphalan and prednisone – a randomized phase III study of the East German Study Group of Hematology and Oncology (OSHO). J Cancer Res Clin Oncol 2006; 132 : 205 – 212.
105. Treon SP, Hanzis C, Tripsas C et al. Bendamustine therapy in patients with relapsed or refractory Waldenström‘s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11 : 133 – 135.
106. Gueli A, Gottardi D, Hu H et al. Efficacy of rituximab ‑ bendamustine in cold agglutinin haemolytic anaemia refractory to previous chemo ‑ immunotherapy: a case report. Blood Transfus 2012; 22 : 1 – 4.
107. Hillmen P, Young NS, Schubert J et al. The complement inhibitor eculizumab in paroxysmal nocturnal hemoglobinuria. N Engl J Med 2006; 355 : 1233 – 1243.
108. Roth A, Huttmann A, Rother RP et al. Long‑term efficacy of the complement inhibitor eculizumab in cold agglutinin disease. Blood 2009; 113 : 3885 – 3886.
109. Kyriakou C, Canals C, Sibon D et al. High‑dose therapy and autologous stem ‑ cell transplantation in Waldenstrom macroglobulinemia: the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2010; 28 : 2227 – 2232.
110. Bachanova V, Burns LJ. Hematopoietic cell transplantation for Waldenström macroglobulinemia. Bone Marrow Transplant 2012; 47 : 330 – 336.
111. Usmani S, Sexton R, Crowley J et al. Autologous stem cell transplantation as a care option in Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11 : 139 – 142.
112. Kyriakou C, Canals C, Cornelissen JJ et al. Allogeneic stem ‑ cell transplantation in patients with Waldenström macroglobulinemia: report from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2010; 28 : 4926 – 4934.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 9-
All articles in this issue
- Does physical activity produce clinically significant changes during discontinuation of insulin pump in type 1 diabetic patients?
- Use of natriuretic peptides in diagnosis of left ventricular hypertrophy in obese hypertensive patients with metabolic syndrome
- The importance of cardiac biomarker assay for the stratification and monitoring of AL amyloidosis patients – single center experience
- Assessment of selected markers of apoptosis and angiogenesis in chronic lymphocytic leukemia
- Compliance of senior/ elderly patients with cognitive impairment
- RESOLUTE Study in the Czech Republic: insulin glargine improves the compensation of type 2 diabetes in patients with unsatisfactory results of therapy with a combination of insulin detemir and oral antidiabetics. Results of the non‑intervention RESOLUTE Project in the Czech Republic
- Food intake regulation – 1st part
- Recommendation of the Czech society of Endocrinology for the treatment of Cushing’s syndrome in adults
- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Regional migrating osteoporosis – a case report
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Food intake regulation – 1st part
- Recommendation of the Czech society of Endocrinology for the treatment of Cushing’s syndrome in adults
- Regional migrating osteoporosis – a case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

