-
Medical journals
- Career
Pokroky v léčbě chronické lymfocytární leukemie
Authors: P. Obrtlíková 1; M. Trněný 1,2
Authors‘ workplace: I. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Marek Trněný, CSc. 1; Ústav hematologie a krevní transfuze Praha, ředitel prof. MU Dr. Marek Trněný, CSc. 2
Published in: Vnitř Lék 2013; 59(7): 632-634
Category:
Overview
Chronická lymfocytární leukemie (CLL) je nejčastějším typem leukemie dospělých v západním světě a charakterizuje ji velmi variabilní klinický průběh. Někteří pacienti žijí po mnoho let bez nutnosti zahájení léčby, zatímco u jiných onemocnění rychle progreduje. Léčba chronické lymfocytární leukemie dosáhla v posledních letech mimořádných pokroků zejména díky zavedení monoklonálních protilátek a kombinované imunochemoterapie. Navzdory těmto léčebným úspěchům je CLL stále považována za nevyléčitelné, opakovaně relabující onemocnění. Pouze alogenní transplantace má potenciálně kurativní potenciál, ta je však proveditelná pouze u malé, selektované skupiny mladších nemocných bez významných komorbidit. Naopak starší a komorbidní pacienti, kteří tvoří většinu CLL populace, nejsou zpravidla schopni podstoupit intenzivní léčbu. Hledání nových léčebných možností je proto stále aktuálním tématem. Tento článek shrnuje současné léčebné možnosti a některé nově testované léky u CLL.
Klíčová slova:
chronická lymfocytární leukemie – léčba – nové lékyÚvod
Chronická lymfocytární leukemie (CLL) je nejčastějším typem leukemie v západním světě s incidencí v ČR 5,6 na 100 000 obyvatel a rok (data z Národního onkologického registru) [1], která však velmi výrazně stoupá s věkem. Věkový medián při diagnóze je 72 let a jen zřídka se CLL vyskytuje u osob mladších 40 let, muži jsou postiženi zhruba 2krát častěji než ženy. Etiologie a patogeneze této choroby ještě není uspokojivě objasněna. Známá je genetická predispozice, neboť přímí příbuzní pacientů s CLL mají až 8krát vyšší riziko rozvoje CLL ve srovnání s běžnou populací [2]. Na rozdíl od ostatních leukemií nebyl jednoznačně prokázán vliv nějaké profesionální expozice v etiologii CLL. V patogenezi je v poslední době stále více zdůrazňován význam mikroprostředí ve vývoji a progresi CLL [3]. Dosud jen částečně popsané komplexní buněčné a molekulární interakce CLL buněk s okolními buňkami a matrix v kostní dřeni či lymfatické tkáni se uplatňují v přežívání a proliferaci maligních buněk a v současné době jsou předmětem dalšího výzkumu s cílem využití těchto poznatků v terapii CLL.
CLL je onemocnění s velmi variabilním klinickým průběhem. U řady pacientů je klinický průběh indolentní a po mnoho let není nutné u nich zahajovat terapii, zatímco jiní pacienti mají rychle progredující onemocnění vyžadující časné zahájení léčby. K terapii jsou indikováni pacienti s pokročilým onemocněním (klinické stadium Binet C nebo stadium Rai III, IV). U nemocných se středně pokročilým onemocněním (Binet B nebo Rai I, II) by měla být léčba zahájena pouze při průkazu aktivity choroby definované podle obecně uznávaných mezinárodních kritérií NCI ‑ WG [4]. Vzhledem k mimořádné klinické variabilitě nemocných s CLL, a to i v rámci 1 klinického stadia, je užitečné u pacientů s CLL posouzení známých prognostických faktorů, které do značné míry mohou predikovat prognózu pacienta. Mezi nejvýznamnější patří vyšetření genetických aberací fluorescenční in situ hybridizací (FISH delece 13q, 11q, 17p, trisomie 12), stanovení mutačního stavu genů pro variabilní část těžkého řetězce imunoglobulinu (IgVH) a vyšetření mutace TP53.
Léčebné možnosti
V posledních letech prošel terapeutický přístup k CLL významnými změnami. Zavedení monoklonálních protilátek a kombinovaných imunochemoterapeutických režimů do léčby CLL vedlo ke značnému zlepšení léčebných výsledků, ne vždy je však možné tyto léčebné přístupy použít. Při výběru optimální léčby pro konkrétního pacienta je důležité zohlednit celou řadu faktorů, jako jsou věk pacienta, aktuální celkový stav, přidružená onemocnění, předléčenost či ledvinné funkce. Starší a komorbidní pacienti nejsou zpravidla schopni podstoupit intenzivní kombinovanou léčbu z důvodu vysokého rizika nepřijatelných nežádoucích účinků. Naším cílem je optimalizovat léčbu pro každého pacienta se snahou o minimalizaci toxicity s dosažením co nejlepšího léčebného výsledku.
Nejdéle užívaným cytostatikem v léčbě CLL je alkylační látka chlorambucil, který zůstává i v současné době základním lékem pro starší a výrazně komorbidní pacienty, kteří nemohou být léčeni intenzivnějšími režimy. Bylo prokázané, že chlorambucil u starších nemocných není méně účinný než samotný fludarabin [5], avšak jeho účinnost při srovnání s imunochemoterapeutickými kombinacemi je nízká. Zpravidla se dá dosáhnout parciální remise či pouze stabilizace onemocnění, jeho výhodou však zůstává relativně nízká hematologická toxicita. Dalším alkylačním cytostatikem je cyklofosfamid, který se současné době užívá v léčbě CLL zejména jako součást kombinovaných režimů. Od poloviny 90. let 20. století vstoupily do léčby CLL purinová analoga. Jejich nejdůležitějším zástupcem z hlediska CLL je fludarabin, který se v současné době používá u CLL prakticky jen v kombinovaných režimech, a to zejména s cyklofosfamidem, se kterým vykazuje in vitro synergizmus. Kombinace fludarabinu s cyklofosfamidem a monoklonální anti‑CD20 protilátkou rituximabem (FCR režim) se stala standardní léčbou 1. linie pro nemocné v celkově dobrém stavu bez závažných komorbidit [6]. Dle výsledků publikovaných studií je pomocí tohoto režimu v léčbě 1. linie dosahováno až 95 % léčebných odpovědí a kompletní remise byla zaznamenána v 52 %, resp. v 1 ze studií až v 72 % případů [7]. Německá randomizovaná studie CLL8 prokázala, že přidání rituximabu k chemoterapeutické kombinaci FC nejen prodloužilo dobu do progrese onemocnění, ale v rámci léčby 1. linie vedlo i k prodloužení celkového přežití [7]. Obdobných výsledků jsme dosáhli i v našem souboru nemocných [8]. Pro starší pacienty či nemocné s významnějšími komorbiditami se zdá se, že slibnou možností může být použití kombinovaných režimů se sníženými dávkami cytostatik [9]. Dalším lékem užívaným v poslední době v léčbě CLL je bendamustin. Tento lék byl vyvinut v Německu před 50 lety, ale teprve v posledních 10 letech se jeho použití začalo rychle rozšiřovat. Bendamustin je látkou s duální aktivitou, která vykazuje vlastnosti alkylační látky i purinového analoga. Bendamustin prokázal významně vyšší účinnost ve srovnání s chlorambucilem u neléčených nemocných s CLL a nyní je testován v kombinaci s monoklonálními protilátkami v rámci klinických studií. Jiné kombinované chemoterapeutické režimy užívané v terapii lymfomů, jako je CHOP (cyklofosfamid, doxorubicin, vinkristin a prednison) a COP (cyklofosfamid, vinkristin a prednison) v kombinaci s monoklonálními protilátkami se u CLL používají méně, a to zejména v dalších liniích terapie a ve specifických situacích, jako je přítomnost autoimunitních komplikací.
Významným pokrokem v léčbě CLL bylo zavedení monoklonálních protilátek. Ty mají schopnost se cíleně vázat přímo na antigeny na povrchu nádorových buněk a mechanizmy odlišnými od účinku cytostatik indukovat jejich zánik. Navíc mohou zvyšovat senzitivitu nádorových buněk ke konvenční chemoterapii. Nejrozšířenější monoklonální protilátkou užívanou v léčbě CLL je rituximab, chimérická protilátka zaměřená proti antigenu CD20, první schválená protilátka pro klinické použití již v roce 1997. Mechanizmus účinku rituximabu je komplexní, zahrnující přímý cytotoxický účinek, aktivaci komplementu a buněčnou cytotoxicitu závislou na protilátce. V monoterapii je účinnost rituximabu u CLL omezená, ale v rámci kombinovaných imunochemoterapeutických schémat přispěl významně ke zlepšení výsledků léčby a při tom nevedl k podstatnému zvýšení toxicity léčby. Další anti‑CD20 protilátkou užívanou v léčbě CLL je ofatumumab, který se váže na odlišný epitop antigenu CD20 než rituximab. Ofatumumab prokázal v preklinických testech slibný účinek i na rituximab – rezistentní leukemické buňky CLL a v klinické studii fáze I/ II byl účinný i u relabovaných či refrakterních nemocných (50 % léčebných odpovědí) s dobrou snášenlivostí [10]. Ofatumumab byl v roce 2009 schválen pro léčbu nemocných s CLL refrakterních na fludarabin i alemtuzumab. Anti‑CD20 protilátkou nové generace je obinutuzumab (GA101), protilátka s cíleně změněnou strukturou glykosylace, zaměřená proti epitopu II. typu antigenu CD20, která je nyní testována v rámci klinických studií v kombinaci s cytostatiky. Z předběžných výsledků klinických studií je zřejmé, že např. kombinace obinutuzumabu s chlorambucilem dosahuje signifikantně lepšího výsledku v období do progrese než samotný chlorambucil. Zda bude tato kombinace lepší než kombinace chlorambucilu s rituximabem, je předmětem následných analýz. Další protilátkou používanou u CLL je rekombinantní humanizovaná monoklonální protilátka anti‑CD52 alemtuzumab. Je využíván u pacientů, pro něž není vhodná léčba fludarabinovým režimem, a zejména v léčbě vysoce rizikové CLL s delecí 17p nebo mutací genu TP53, kde dosahuje lepších výsledků ve srovnání s ostatními léky užívanými u CLL. Vedle cytostatik a monoklonálních protilátek mají i kortikoidy své místo v léčbě CLL, a to zejména u sekundárních imunitních cytopenií nebo v léčbě refrakterních onemocnění.
Jedinou metodou, která v současnosti může vést k potencionálnímu vyléčení CLL, je alogenní transplantace, která je však proveditelná pouze u mladších pacientů (asi do 65 let) bez závažnějších komorbidit. Alogenní transplantace je však stále zatížená poměrně značnou morbiditou a mortalitou a v současné době je doporučována pouze pro vysoce rizikové pacienty bez odpovědi či s časným relapsem po kombinované léčbě s purinovým analogem, event. pro pacienty s nepříznivým cytogenetickým nálezem (del 17p nebo mutace genu TP53), kteří jsou indikováni k léčbě.
Nové léky testované u CLL
Díky narůstajícím poznatkům o patogenezi CLL, významu B buněčného receptoru (BCR) či interakcích CLL buňky s mikroprostředím dochází v posledních letech k vývoji nových léků (tab. 1), které se v současné době testují u CLL v rámci klinických studií. Mezi tyto léky patří např. lenalidomid, imunomodulační látka s komplexním mechanizmem účinku zahrnujícím antiproliferativní, protizánětlivý i antiangiogenní efekt. U CLL se v rámci klinických studií nyní zkouší lenalidomid jak v léčbě 1. linie, tak v léčbě relapsů i jako udržovací terapie u pacientů v remisi. Další látkou působící na mikrostředí je plerixafor, antagonista receptoru CXCR4 pro chemokin CXCL12, vedoucí k mobilizaci buněk z mikroprostředí. Plerixafor se testuje u CLL s hypotézou, že uvolnění nádorových buněk z mikroprostředí usnadní působení jiných antileukemických léků. Dalšími léky testovanými u CLL jsou inhibitory antiapoptotických Bcl ‑ 2 proteinů, jako je látka ABT ‑ 263 (navitoclax) a ABT ‑ 737, nebo kinázové inhibitory, jako je např. ibrutinib (PCI ‑ 32765), ireverzibilní inhibitor Brutonovy tyrozinkinázy, který prokázal svou účinnost v klinických studiích fáze I/ II jak samotný, tak v kombinaci s imunochemoterapií. Užívá se perorálně a vede především k rychlému zmenšení nádorové masy. V současné době probíhá klinická studie fáze IIIs ibrutinibem v kombinaci s rituximabem a bendamustinem pro relabované či refrakterní CLL. GS 1101 (CAL101) reverzibilní inhibitor fosfatidil ‑ inositol ‑ 3 - kinázy (PI3K) a dinaciclib – potentní inhibitor cyklin‑dependentních kináz, jsou také nyní testovány v rámci klinických studií u pacientů s CLL. Udržovací terapie, s cílem prodloužení období do relapsu či progrese, není dosud v běžné praxi u CLL zavedena. Aktuálně se testuje několik léků, jako např. rituximab či lenalidomid, ale definitivní závěry zatím nejsou k dispozici.
Table 1. Některé nové léky testované v léčbě chronické lymfocytární leukemie. 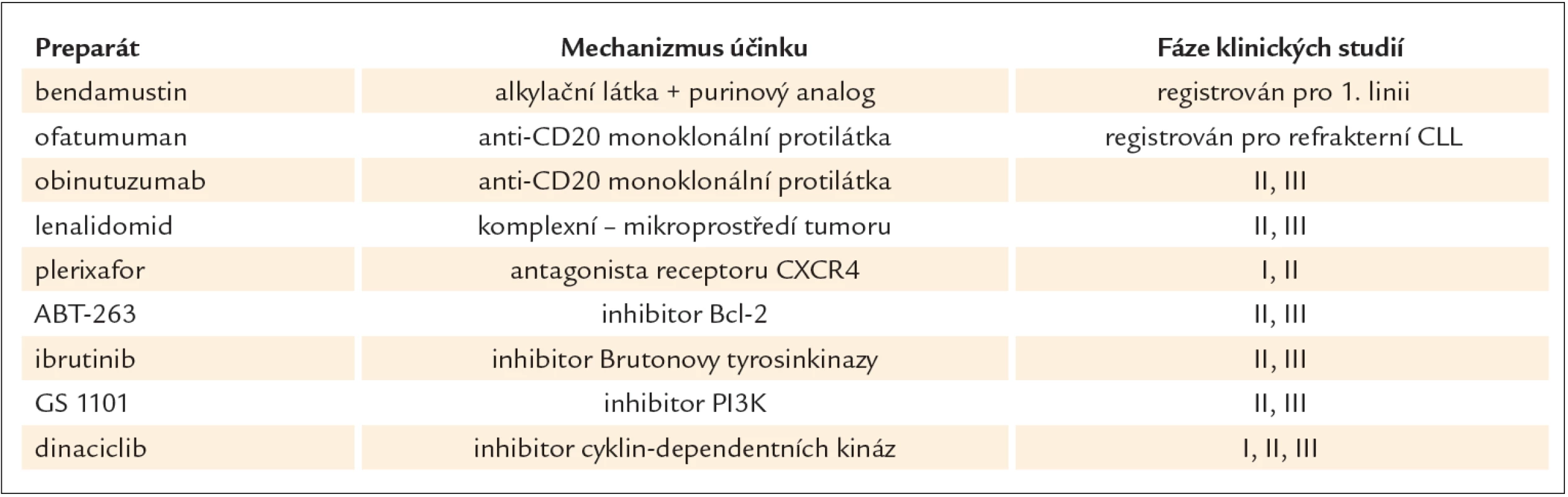
Závěr
S rozšiřujícími se poznatky o patogenezi CLL a novými léčebnými možnostmi se tato choroba z původně nevyléčitelného onemocnění stává nemocí, u níž je možné terapií navodit dlouhotrvající kompletní remisi i na molekulární úrovni. Vývoj nových léků a léčebných kombinací postupuje rychle vpřed, a poskytuje tak naději na další zlepšování prognózy pacientů s CLL.
MU Dr. Petra Obrtlíková, Ph.D.
www.vfn.cz
e‑mail: petra.obrtlikova@vfn.cz;petra.obrtlikova@seznam.cz
Doručeno do redakce: 6. 5. 2013
Sources
1. Trneny M, Schwarz J, Pavlik T et al. Improving survival in patients with chronic lymphocytic leukemia – population based study. In: ASH Annual Meeting Abstracts 2011.
2. Goldin LR, Björkholm M, Kristinsson SY et al. Elevated risk of chronic lymphocytic leukemia and other indolent non‑Hodgkin’s lymphomas among relatives of patients with chronic lymphocytic leukemia. Haematologica 2009; 94 : 647 – 653.
3. Burger JA. Nurture versus nature: the microenvironment in chronic lymphocytic leukemia. Hematology Am Soc Hematol Educ Program 2011; 2011 : 96 – 103.
4. Hallek M, Cheson BD, Catovsky D et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute ‑ Working Group 1996 guidelines. Blood 2008; 111 : 5446 – 5456.
5. Eichhorst BF, Busch R, Stilgenbauer S et al. First‑line therapy with fludarabine compared with chlorambucil does not result in a major benefit for elderly patients with advanced chronic lymphocytic leukemia. Blood 2009; 114 : 3382 – 3391.
6. Hallek M, Fischer K, Fingerle ‑ Rowson G et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open ‑ label, phase 3 trial. Lancet 2010; 376 : 1164 – 1174.
7. Keating MJ, O’Brien S, Albitar M et al. Early results of a chemoimmunotherapy regimen of fludarabine, cyclophosphamide, and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol 2005; 23 : 4079 – 4088.
8. Obrtlikova P et al. Fludarabine, Cyclophosphamide and Rituximab (FCR) Related Prolonged Cytopenia Is Frequent and Adverse Factor Affecting Survival of Patients with Chronic Lymphocytic Leukemia (CLL). ASH Annual Meeting abstracts 2012; 120 : 1790.
9. Smolej L et al. Low ‑ Dose Fludarabine and Cyclophosphamide Combined with Rituximab In the Treatment of Elderly/ Comorbid Patients with chronic Lymphocytic Leukemia/ Small Lymphocytic Lymphoma (CLL/ SLL): Preliminary Results of Project Q ‑ Lite by Czech CLL Study Group. ASH Annual Meeting Abstracts 2010; 116 : 2466.
10. Coiffier B, Lepretre S, Pedersen LM et al. Safety and efficacy of ofatumumab, a fully human monoclonal anti‑CD20 antibody, in patients with relapsed or refractory B ‑ cell chronic lymphocytic leukemia: a phase 1 – 2 study. Blood 2008; 111 : 1094 – 1100.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 7-
All articles in this issue
- Onemocnění jater u diabetiků
- Účinky GLP-1 (glucagon‑like peptide 1) na játra
- Polypózy trávicího traktu
- Vrozené hyperbilirubinemie a molekulární mechanizmy žloutenky
- Cystické nádory pankreatu – naše zkušenosti
- Wilsonova choroba
- Vliv jaterní cirhózy na farmakokinetiku a farmakodynamiku léčiv
- Katetrizace jaterních žil – vybrané aspekty hodnocení
- Reaktivace chronické hepatitidy B
- Akutní pankreatitida – novinky v léčbě
- Postižení jater u nemocných s ne-Hodgkinovým lymfomem
- Léčba chronické infekce virem hepatitidy C na začátku nové éry
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie
- Mnohočetný myelom
- Pokroky v léčbě chronické lymfocytární leukemie
- Myelodysplastický syndrom – pokrok v léčbě v 21. století
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Cystické nádory pankreatu – naše zkušenosti
- Onemocnění jater u diabetiků
- Akutní pankreatitida – novinky v léčbě
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

