-
Medical journals
- Career
Oxidační stres u pacientů po transplantaci ledviny
Authors: J. Vostálová 1; A. Galandáková 1; P. Štrebl 2; J. Zadražil 2
Authors‘ workplace: Ústav lékařské chemie a biochemie Lékařské fakulty UP Olomouc, přednostka prof. RNDr. Jitka Ulrichová, CSc. 1; III. interní nefrologická, revmatologická a endokrinologická klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MU Dr. Josef Zadražil, CSc. 2
Published in: Vnitř Lék 2013; 59(4): 296-300
Category: Review
Overview
Úspěšná transplantace ledviny (TL) vede k normalizaci exkreční funkce a k úpravě metabolické a endokrinní funkce ledvin. Nejčastější příčinou morbidity a mortality u pacientů po TL jsou kardiovaskulární onemocnění, k jejichž rozvoji přispívá také oxidační stres (OS). Samotná transplantace, ale i období bezprostředně po TL, je spojeno se zvýšenou oxidační zátěží, která se postupně může snižovat. Na rozvoji OS se také podílejí některá imunosupresivní léčiva, především ze skupiny kalcineurinových inhibitorů, která tak nepřímo zvyšují riziko kardiovaskulárních komplikací.
Klíčová slova:
oxidační stres – transplantace ledviny – ischemie/ reperfuze – imunosupresivaÚvod
Transplantace ledviny (TL) je jednou z možností léčby u pacientů s terminálním onemocněním ledvin (TOL). Úspěšná TL vede k normalizaci vnitřního prostředí a k úpravě celé řady metabolických a endokrinních změn, které provázejí chronické selhání ledvin. Transplantovaní jedinci se po rekonvalescenci mohou zapojit do běžného života.
Akcelerovaná ateroskleróza a následné kardiovaskulární komplikace jsou hlavní příčinou morbidity a mortality u pacientů s chronickými chorobami ledvin. U transplantovaných pacientů jsou kardiovaskulární choroby příčinou 50 – 60 % všech úmrtí (obr. 1). Rizikové faktory přispívající ke vzniku aterogeneze jsou uvedeny v tab. 1 [1 – 3].
Image 1. Riziko kardiovaskulární mortality u pacientů s renální dysfunkcí v průběhu času v porovnání s jedinci v běžné populaci. Upraveno podle [3]. ![Riziko kardiovaskulární mortality u pacientů s renální dysfunkcí v průběhu času v porovnání s jedinci v běžné populaci. Upraveno podle [3].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7c35181a56e6375d7a6a72dbe62818d7.jpg)
Mortalita v důsledku kardiovaskulárních onemocnění je 10–20krát vyšší u pacientů s terminálním selháním ledvin (TOL) než u jedinců v běžné populaci. Riziko kardiovaskulární mortality u pacientů s TOL se zvyšuje s rostoucí dobou dialýzy před transplantací ledvin (TL), údajně je 10–20krát vyšší u pacientů léčených dialýzou v porovnání s jedinci v běžné populaci. Roční úmrtnost na kardiovaskulární choroby po TL výrazně klesá. Zvýšené riziko kardiovaskulární mortality zůstává bezprostředně po TL (0–3 měsíce), ale poté se snižuje na dvojnásobek v porovnání s běžnou populací. Je známo několik rizikových faktorů, které se po TL podílejí na zvýšení kardiovaskulární mortality, např. snížená funkce ledvin, přítomnost komorbidit (např. cukrovka) a vliv imunosupresiv. Ztráta štěpu s návratem k dialýze je spojena s významným nárůstem kardiovaskulární mortality, pohybuje se ve stejném rozmezí jako u pacientů s TOL. Opakovaná TL se podílí na opětovném snížení rizika kardiovaskulární mortality.
Poznámka: Odhady rizika jsou pouze přibližné s ohledem na velkou variabilitu mezi pacienty, u časové osy nejsou uvedeny jednotky.Table 1. Kardiovaskulární rizikové faktory. 
V posledních letech byla značná pozornost věnována oxidačnímu stresu (OS), který je řazen mezi rizikové faktory kardiovaskulární morbidity a mortality u transplantovaných pacientů [4,5]. Vysoká úroveň oxidační zátěže u pacientů po TL vede k poškození buněčných proteinů, lipidů a nukleových kyselin, k alteraci tkáňových struktur a k projevům orgánové dysfunkce [6]. Hypoteticky lze předpokládat, že po úpravě funkce ledvin úspěšnou transplantací dojde také k úpravě rovnováhy mezi tvorbou volných kyslíkových radikálů a antioxidačním systémem organizmu a ke snížení oxidační zátěže organizmu. Výsledky dosavadních studií však nejsou jednoznačné, a proto je problematika OS po TL stále intenzivně studována. Rozporuplné výsledky jsou rovněž o tom, zda a jakým způsobem ovlivňují OS imunosupresivní léčiva, zejména inhibitory kalcineurinu.
Ischemicko‑reperfuzní poškození a OS
Ischemicko‑reperfuzní poškození navozuje zvýšenou imunologickou reaktivitu organizmu příjemce a negativně ovlivňuje přežití transplantovaných ledvin [7]. Bezprostředně po TL je pozorován nárůst některých ukazatelů OS, který je způsoben reperfuzí ischemického štěpu [8 – 11]. Na produkci reaktivních forem kyslíku (ROS) se podílí celá řada faktorů. Mezi významné zdroje patří mitochondrie, které při reperfuzi produkují superoxidový radikál. Dalším zdrojem ROS jsou enzymy, které se podílejí na metabolizmu purinů. Xantinoxidoreduktáza (XOD) se nachází v těle ve dvou formách (obr. 2), buď jako xantindehydrogenáza (XD), která vytváří antioxidant kyselinu močovou, či jako xantinoxidáza (XO), která katalyzuje vznik ROS. Za normálních podmínek je jen asi 10 % XOD ve formě XO, v průběhu ischemie však dochází k intenzivní konverzi XOD na XO. Během reperfuze se kyslík stává akceptorem elektronů a dochází k nadprodukci ROS. Proto změny poměru aktivit XD a XO výrazným způsobem ovlivňují kvalitu a funkci štěpu v období po transplantaci. Někteří autoři doporučují sledovat změny aktivit enzymů metabolizujících xantin (XO, XD) bezprostředně před TL a v průběhu prvních 5 minut reperfuze, protože takto získané informace mají důležitý prognostický význam v posuzování kvality a funkce štěpu [12].
Image 2. Konverze xantinoxidoreduktázy: A) za normálních podmínek a B) v průběhu ischemie/reperfuze. 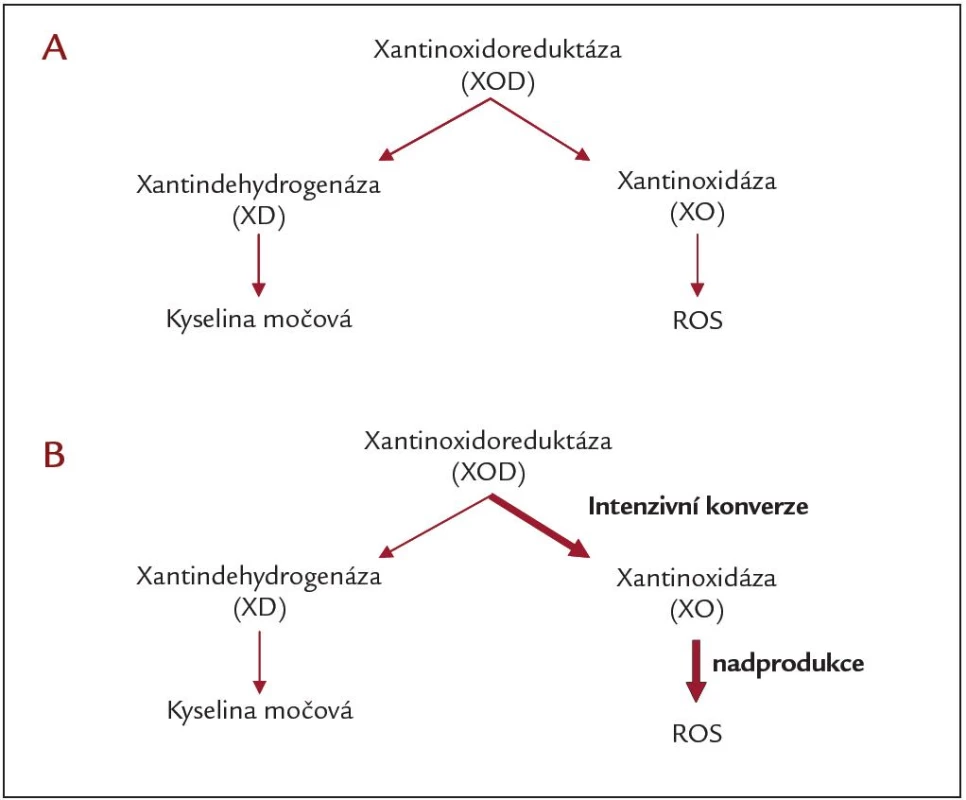
NADPH - oxidáza leukocytů aktivovaných cytokiny, komplementem a adhezivními molekulami je nezanedbatelným zdrojem ROS. Aktivované leukocyty se podílejí na aktivaci zánětlivé kaskády, která spolu s reaktivními formami kyslíku a dusíku (RONS) přispívá k poškození epiteliálních buněk proximálního tubulu. Ischemie je provázena akcelerací anaerobní glykolýzy a akumulací laktátu, snížením pH, poklesem hladiny adenozintrifosfátu, narušením stability lysozomů a uvolněním tranzitních kovů z proteinových přenašečů (transferin, ferritin, ceruloplazmin) (tab. 2). Tyto nevázané ionty se zapojují do tzv. Fentonovy reakce, při které vzniká velmi reaktivní hydroxylový radikál. Při reperfuzi se zvyšuje exprese inducibilní NO - syntázy a tvorba oxidu dusnatého (NO•) (tab. 2), který je řazen mezi reaktivní formy dusíku (RNS). V ledvinách se nacházejí všechny 3 izoformy NOS, 2 konstitutivní formy (endotelová a neuronální) a inducibilní forma (iNOS). iNOS je aktivována ischemií či zánětlivými mediátory. NO• reaguje se superoxidovým radikálem a vzniká peroxynitrit (obr. 3), který je reaktivnější než výchozí radikály a poškozuje proteiny, lipidy a DNA [6]. Peroxynitrit může deaktivovat antioxidační enzymy, např. superoxiddismutázu (SOD) [13]. Zvýšení hladiny ROS vede k nárůstu koncentrace prozánětlivých cytokinů a chemokinů. Zvyšuje se rovněž exprese adhezivních molekul na povrchu neutrofilů a monocytů. Bílé krvinky jsou aktivovány a dostávají se do tkání, kde se stávají dalším zdrojem ROS, které poškozují renální parenchym. Ischemie/ reperfuze ovlivňuje, ať už pozitivně či negativně, expresi celé řady genů, jako jsou geny antioxidačních enzymů (SOD, glutathion - S - transferázu), cytokinů, adhezivních molekul, cytochromu P450 a dalších. Tkáň pozměněná ischemií může mít sníženou antioxidační kapacitu a její schopnost eliminovat nadprodukci RONS vyvolanou následnou reperfuzí může být limitována, což může vyústit v další poškození parenchymu štěpu. Z těchto důvodů je úspěšné zvládnutí reperfuzní fáze důležité pro dobu funkčnosti transplantované ledviny [14 – 17].
Table 2. Nežádoucí změny probíhající v organizmu při ischemii a reperfuzi. 
Image 3. Vliv nadprodukce O<sup>2•-</sup> na hladiny reaktivních forem dusíku v organizmu. 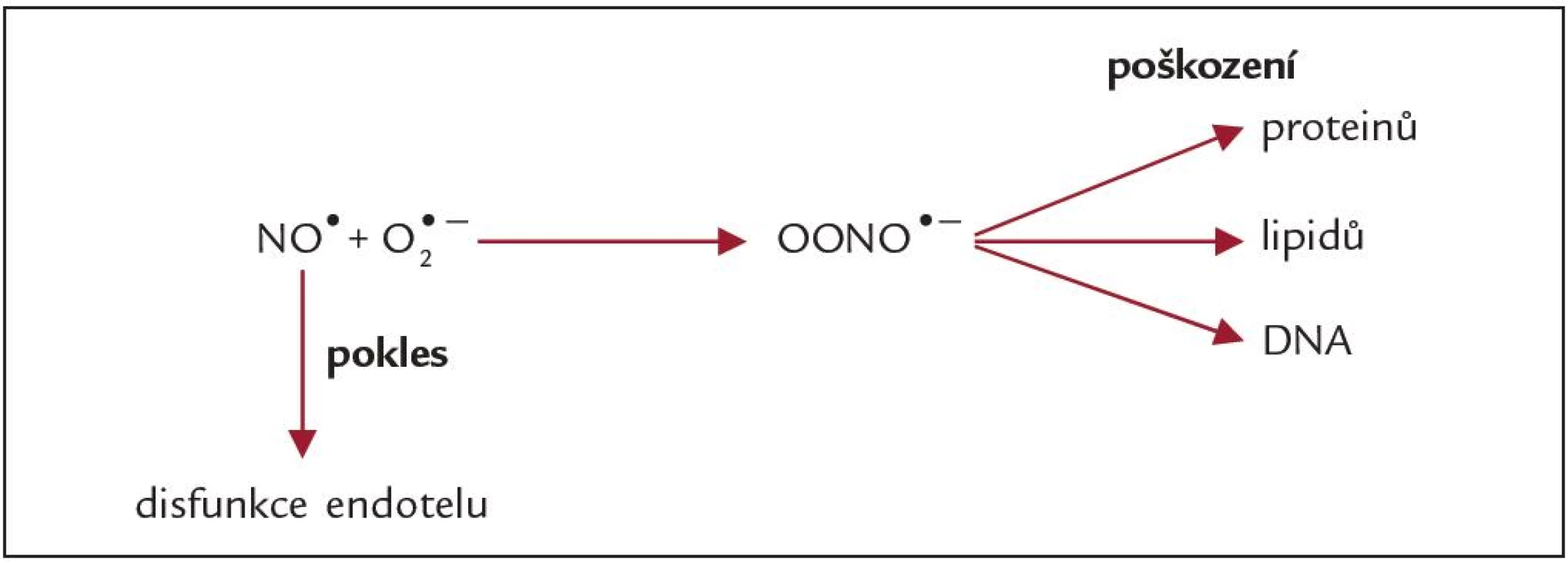
Možnostem, jak eliminovat poškození ledviny způsobené ischemií/ reperfuzí a jak zlepšit a prodloužit funkci štěpu, se zabývá celá řada pracovišť a výzkumných týmů. Před TL je ledvina uchovávána v roztoku, jehož složení by mělo minimalizovat poškození buněk a zvýšit kvalitu transplantátu. Je snaha obohacovat tyto roztoky látkami, které by prozánětlivé a oxidační procesy v tkáni potlačily. Další možností je modulace přirozených antioxidantů, jako je hemoxygenáza - 1, či podávání vychytávačů RONS, antioxidantů a antioxidačních enzymů, rostlinných extraktů, polyfenolů, derivátů karnitinu, inhibitorů iNOS a protizánětlivých preparátů, které vedou ke snížení ischemicko‑reperfuzního poškození. Bohužel dosavadní poznatky byly získány především z experimentů na zvířatech či na ex vivo modelech [14 – 16].
OS v potransplantačním období
Po úspěšné TL dochází k postupnému snižování OS, což se projevuje poklesem plazmatických hladin produktů OS a úpravou celkové antioxidační kapacity (TAC), hladin antioxidantů a prozánětlivých a protizánětlivých mediátorů [18 – 20]. Vural et al sledovali skupinu 23 pacientů po dobu 28 dnů po TL a pozorovali pokles hladiny malondialdehydu (MDA) a zvýšení aktivity glutationperoxidázy (GPX), celkové SOD, Zn/ Cu - izoenzymů a hladiny selenu. Hodnoty vybraných parametrů OS se u pacientů po TL blížily hodnotám naměřeným u zdravých lidí [21]. Při dlouhodobém sledování pacientů po TL (1 rok a více) byla v některých studiích pozorována pozvolná úprava markerů OS (MDA, produkty pokročilé oxidace proteinů – AOPP, GPX, SOD, kataláza, glutationreduktáza) do rozmezí hodnot obvyklých u zdravých osob [22 – 25]. Při porovnání antioxidačního stavu osob léčených peritoneální dialýzou a osob po TL bylo zjištěno, že po TL se normalizuje aktivita paraoxonázy a arylesterázy, čímž dochází ke zlepšení funkce lipoproteinů o vysoké hustotě (HDL) a současně dochází k snížení hladiny produktů peroxidace lipidů [26]. Jiná studie sice zaznamenala např. pokles hladiny MDA, tento pokles ovšem nedosáhl hodnot zdravých jedinců [20]. Na druhou stranu byl pozorován i opačný trend zvyšování zánětlivých markerů a produktů oxidačního poškození biomolekul [27 – 29], což svědčí o přetrvávajícím OS v období po transplantaci. Nedávno publikované výsledky prokázaly, že OS u osob po TL je možno ovlivnit složením diety. Ramezani et al prokázali, že zvýšený obsah w - 3 mastných kyselin v dietě snižuje OS u těchto osob [30].
Dalším faktorem, který dlouhodobě ovlivňuje kvalitu štěpu, je hladina kyseliny močové. I když je kyselina močová považována za hlavní součást antioxidační kapacity organizmu, ukazuje se, že urikemie negativně koreluje s délkou funkce štěpu [31]. Suplementace selenem, jakožto významným antioxidantem, nemá výrazný efekt na GPX. Zdá se však, že k úplné normalizaci aktivity GPX a plazmatické hladiny selenu dochází až po TL [32].
Imunosupresivní terapie a OS
Úroveň a délka funkce transplantované ledviny je závislá na celé řadě faktorů, zejména na věku dárce a příjemce orgánu, délce studené ischemie, zkušenostech operačního týmu, kvalitě pooperační péče a volbě imunosupresivní terapie. Imunosupresivní terapie je spojena s celou řadou vedlejších nežádoucích účinků (zvýšení rizika infekcí a nádorových onemocnění, patologických změn v metabolizmu lipidů a sacharidů, nefrotoxicity, hepatotoxicity a OS) [33]. Imunosupresivní schémata jsou založena na kombinaci léků na bázi kortikosteroidů (prednisolon, prednison, metylprednisolon), antimetabolitů (inhibitory purinového metabolizmu – azatioprin, mykofenolát sodný), kalcineurinových inhibitorů (cyklosporin A, takrolimus), inhibitorů serin/ treoninových proteinkináz (mTOR) a biologických preparátů na bázi monoklonálních a polyklonálních protilátek [34].
Základem imunosupresivních protokolů jsou v současné době kalcineurinové inhibitory, cyklosporin A a takrolimus. U těchto dvou imunosupresiv se předpokládá, že zvyšují OS po TL. In vitro bylo zjištěno, že při transformaci cyklosporinu A jaterními mikrozomálními oxidázami (cytochromy P450) vznikají volné radikály, zejména superoxidový radikál, v menší míře pak peroxid vodíku a hydroxylový radikál [35,36]. Jiná výzkumná skupina prokázala, že za tvorbu ROS jsou zodpovědné jiné enzymy než cytochromy P450 [37]. Dále bylo prokázáno, že tyto léky zvyšují produkci NO• indukcí exprese endotelové NO - syntázy. V důsledku reakce ROS s NO• dochází ke vzniku reaktivního nitrosylového radikálu a k poklesu NO•, což vede k poškození endotelu s následným zvýšením krevního tlaku, fibrogenezi a k chronické rejekci [38]. Varghese et al ve své studii potvrdili, že kalciuneurinová imunosupresiva mají prooxidační účinek. Zjistili, že LDL získané z krve pacientů, kteří byli léčeni takrolimem, jsou citlivější k oxidaci než LDL pacientů léčených přípravkem Sandimmun Neoral, který obsahuje kromě cyklosporinu A také vitamin E [39]. Další práce prokázala, že podávaní vitaminu C a E spolu s takrolimem vede k snížení OS [40]. I když oba léky, takrolimus a cyklosporin A, mají prooxidační vlastnosti, je stále v zájmu vědeckých týmů zjistit, jestli léčba takrolimem není provázena menší prooxidační zátěží. Cofan et al se pokusili vyhodnotit oxidační potenciál kalcineurinových imunosupresiv u pacientů léčených cyklosporinem A, kteří byli v důsledku rozvoje hyperplazie gingiv převedeni na takrolimus. I když hodnocený soubor byl malý, výsledky naznačují, že takrolimus se menší mírou podílí na rozvoji OS než cyklosporin A a současně příznivě ovlivňuje lipidový metabolizmus, čímž snižuje riziko kardiovaskulárních komplikací u osob po TL [41]. Obdobné výsledky zaznamenala skupina Martínez Castelao, která popsala zlepšení lipidového spektra u pacientů léčených takrolimem a zvýšení odolnosti LDL vůči oxidační zátěži [42]. U skupiny pacientů léčených cyklosporinem A došlo v průběhu 6 měsíců od TL ke zvýšení úrovně OS a hladiny produktů peroxidace lipidů, naopak u pacientů léčených takrolimem se hladina produktů peroxidace lipidů signifikantně snížila [43]. Oproti tomu práce Morena et al neprokázala u pacientů léčených takrolimem vyšší odolnost LDL k oxidaci v porovnání s pacienty léčenými cyklosporinem A. Citlivost LDL vůči OS byla u obou skupin pacientů obdobná [44]. U pacientů léčených cyklosporinem A nebo takrolimem nebyl pozorován rozdíl ve vybraných parametrech OS (MDA, GPX, SOD, SOD - Zn, SOD - Cu, selen) [21,25]. Obdobné výsledky byly zjištěny i ve studiích, kde se autoři zaměřili na sledování změn AOPP a TAC v průběhu 3 a 6 měsíců od TL u pacientů léčených takrolimem nebo cyklosporinem A. Po TL došlo k poklesu AOPP a úpravě TAC, ale nebyl zjištěn rozdíl mezi skupinami pacientů léčenými rozdílnými inhibitory kalcineurinu [45,46]. Pokles OS byl pozorován také jeden rok po TL snížením hladiny AOPP. Nedošlo však k signifikantnímu poklesu hladiny oxidovaných LDL, které jsou považovány za jeden z markerů kardiovaskulárních komplikací. Tito autoři nepozorovali rozdíl v míře OS mezi skupinami pacientů léčených takrolimem a cyklosporinem [23].
Hypertenze a OS
ROS vznikající v průběhu OS reagují s vazodilatátorem NO• a snižují jeho hladinu, což přispívá k endotelové dysfunkci a k rozvoji arteriální hypertenze [38]. Calo et al ve své práci zjistili, že pokud dojde k vzniku hypertenze po TL, je tato skutečnost spojena se zvýšením hladiny NADPH - oxidázy, která je zdrojem ROS. Současně dochází ke snížení TAC a hladiny hemoxygenázy - 1, která je považována za důležitý enzymatický antioxidant. Tyto nálezy nebyly zjištěny u jedinců s normálním krevním tlakem. Studie naznačila, že při léčbě hypertenze po TL je vhodné se zaměřit také na ovlivnění OS. Analýza dat však byla provedena na velmi malém souboru osob a tyto zajímavé výsledky bude zapotřebí ověřit v rozsáhlejší studii [47].
Závěr
Úspěšná TL vede k úpravě exkreční funkce ledvin, k normalizaci vnitřního prostředí a většiny metabolických změn, které provázejí chronické selhání ledvin. Po TL dochází ke snížení oxidační zátěže organizmu, ale k úplné normalizaci parametrů charakterizujících OS nedochází. K tomuto stavu přispívá také léčba inhibitory kalcineurinu, které jsou základním stavebním kamenem imunosupresivních režimů používaných po TL. Zvládnutí míry OS v období po transplantaci se odráží na době funkčnosti štěpu.
Práce vznikla v rámci projektů IGA MZ ČR NS 9964/ 4 a MŠ ČR (MSM 6198959216).
Seznam použitých zkratek
AOPP – produkty pokročilé oxidace proteinů
GPX – glutationperoxidáza
HDL – lipoprotein o vysoké hustotě
iNOS – inducibilní NO - syntáza
LDL – lipoprotein o nízké hustotě
MDA – malondialdehyd
mTOR – serin/ treoninové proteinkinázy
NO• – oxid dusnatý
OS – oxidační stres
RNS – reaktivní formy dusíku
ROS – reaktivní formy kyslíku
RONS – reaktivní formy kyslíku a dusíku
SOD – superoxiddismutáza
TAC – celková antioxidační kapacita
TL – transplantace ledvin
TOL – terminální onemocnění ledvin
XD – xantindehydrogenáza
XO – xantinoxidáza
XOD – xantinoxidoreduktáza
Ing. Adéla Galandáková, Ph.D.
http:/ / medchemrs.upol.cz/ profil/
e‑mail: galandakova.a@seznam.cz
Doručeno do redakce: 16. 11. 2011
Přijato po recenzi: 21. 2. 2013
Sources
1. Viklický O et al. Transplantace ledviny v klinické praxi. Praha: Grada Publishing 2008.
2. Viklický O. Kardiovaskulární onemocnění a jejich rizikové faktory po transplantaci ledviny. Postgraduální medicína 2008; 9 : 1008 – 1011.
3. Liefeldt L, Budde K. Risk factors for cardiovascular disease in renal transplant recipients and strategies to minimize risk. Transplant International. European Society for Organ Transplantation 2010; 23 : 1191 – 1204.
4. Roberts MA, Hare DL, Ratnaike S et al. Cardiovascular biomarkers in CKD: pathophysiology and implications for clinical management of cardiac disease. Am J Kidney Dis 2006; 48 : 341 – 360.
5. Pita - Fernandez S, Pertega - Diaz S, Valdes - Canedo F et al. Incidence of cardiovascular events after kidney transplantation and cardiovascular risk scores: study protocol. BMC Cardiovasc Disord. 2011; 11 : 2.
6. Vostálová J, Galandáková A, Štrebl P et al. Oxidační stres u pacientů s onemocnění ledvin. Vnitř Lék 2012; 58 : 202 – 207.
7. Eltzschig HK, Eckle T. Ischemia and reperfusion – from mechanism to translation. Nat Med 2011; 17 : 1391 – 1401.
8. Makropoulos W, Kocher K, Heintz B et al. Urinary thymidine glycol as a biomarker for oxidative stress after kidney transplantation. Ren Fail 2000; 22 : 499 – 510.
9. Biernacki M, Bigda J, Jankowski K et al. Increased serum levels of markers of oxidative stress during kidney transplantation. Transplant Proc 2002; 34 : 544 – 545.
10. Araujo M, Welch WJ. Oxidative stress and nitric oxide in kidney function. Curr Opin Nephrol Hypertens 2006; 15 : 72 – 77.
11. Snoeijs MG, van Heurn LW, Buurman WA. Biological modulation of renal ischemia - reperfusion injury. Curr Opin Organ Transplant 2010; 15 : 190 – 199.
12. Dołęgowska B, Błogowski W, Domański L. Clinical evidence of the association between serum perioperative changes in xanthine metabolizing enzymes activity and early post‑transplant kidney allograft function. J Am Coll Surg 2010; 211 : 587 – 595.
13. Yamakura F, Kawasaki H. Post‑translational modifications of superoxide dismutase. Biochim Biophys Acta 2010; 1804 : 318 – 325.
14. Perico N, Cattaneo D, Sayegh MH et al. Delayed graft function in kidney transplantation. Lancet 2004; 364 : 1814 – 1827.
15. Chatterjee PK. Novel pharmacological approaches to the treatment of renal ischemia – reperfusion injury: a comprehensive review. Naunyn Schmiedebergs Arch Pharmacol 2007; 376 : 1 – 43.
16. Chatauret N, Thuillier R, Hauet T. Preservation strategies to reduce ischemic injury in kidney transplantation: pharmacological and genetic approaches. Curr Opin Organ Transplant 2011; 16 : 180 – 187.
17. Nankivell BJ, Kuypers DR. Diagnosis and prevention of chronic kidney allograft loss. Lancet 2011; 378 : 1428 – 1437.
18. Simmons EM, Langone A, Sezer MT et al. Effect of renal transplantation on biomarkers of inflammation and oxidative stress in end‑stage renal disease patients. Transplantation 2005; 79 : 914 – 919.
19. Zahmatkesh M, Kadkhodaee M, Mahdavi – Mazdeh M et al. Oxidative stress status in renal transplant recipients. Exp Clin Transplant 2010; 8 : 38 – 44.
20. Joo DJ, Huh KH, Cho Y et al. Change in serum lipid peroxide as an oxidative stress marker and its effects on kidney function after successful kidney transplantation. Transplant Proc 2010; 42 : 729 – 732.
21. Vural A, Yilmaz MI, Caglar K et al. Assessment of oxidative stress in the early posttransplant period: comparison of cyclosporine A and tacrolimus‑based regimens. Am J Nephrol 2005; 25 : 250 – 255.
22. Moreno JM, Ruiz MC, Ruiz N et al. Modulation factors of oxidative status in stable renal transplantation. Transplant Proc 2005; 37 : 1428 – 1430.
23. Zadražil J, Horák P, Štrebl P et al. In vivo oxidized low - density lipoprotein (ox - LDL) aopp and tas after kidney transplantation: a prospective, randomized one year study comparing cyclosporine A and tacrolimus based regiments. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2012; 156 : 14 – 20.
24. Vostálová J, Galandáková A, Svobodová AR et al. Time – course evaluation of oxidative stress‑related biomarkers after renal transplantation. Ren Fail 2012; 34 : 413 – 419.
25. Vostálová J, Galandáková A, Svobodová AR et al. Stabilization of oxidative stress 1 year after kidney transplantation: effect of calcineurin immunosuppressives. Ren Fail 2012; 34 : 952 – 959.
26. Emre H, Keles M, Yildirim S et al. Comparison of the oxidant – antioxidant parameters and sialic acid levels in renal transplant patients and peritoneal dialysis patients. Transplant Proc 2011; 43 : 809 – 812.
27. Cueto – Manzano AM, Morales – Buenrostro LE, González – Espinoza L et al. Markers of inflammation before and after renal transplantation. Transplantation 2005; 80 : 47 – 51.
28. Cristol JP, Vela C, Maggi MF et al. Oxidative stress and lipid abnormalities in renal transplant recipients with or without chronic rejection. Transplantation 1998; 65 : 1322 – 1328.
29. Lojek A, Černý J, Nĕmec P et al. Phagocyte‑induced oxidative stress in patients with haemodialysis treatment and organ transplantation. Biofactors 1998; 8 : 165 – 168.
30. Ramezani M, Nazemian F, Shamsara J et al. Effect of Omega - 3 Fatty Acids on Plasma Level of 8 - Isoprostane in Kidney Transplant Patients. J Ren Nutr 2010; 17 : 196 – 199.
31. Haririan A, Metireddy M, Cangro C et al. Association of Serum Uric Acid With Graft Survival After Kidney Transplantation: A Time – Varying Analysis. Am J Transplant 2011; 11 : 1943 – 1150.
32. Zachara BA, Gromadzińska J, Wasowicz W et al. Red blood cell and plasma glutathione peroxidase activities and selenium concentration in patients with chronic kidney disease: a review. Acta Biochim Pol 2006; 53 : 663 – 677.
33. Cantarovich D, Vistoli F, Soulillou JP. Immunosuppression minimization in kidney transplantation. Front Biosci 2008; 13 : 1413 – 1432.
34. Viklický O. Imunosupresivní terapie. Postgraduální medicina 2008; 9 : 996 – 1006.
35. Walker RJ, Lazzaro VA, Duggin GG et al. Evidence that alterations in renal metabolism and lipid peroxidation may contribute to cyclosporine nephrotoxicity. Transplantation 1990; 50 : 487 – 492.
36. Ahmed SS, Strobel HW, Napoli KL et al. Adrenochrome reaction implicates oxygen radicals in metabolism of cyclosporine A and FK - 506 in rat and human liver microsomes. J Pharmacol Exp Ther 1993; 265 : 1047 – 1054.
37. Krauskopf A, Buetler TM, Nguyen NS et al. Cyclosporin A‑induced free radical generation is not mediated by cytochrome P – 450. Br J Pharmacol 2002; 135 : 977 – 986.
38. Calo LA, Davis PA, Giacon B et al. Oxidative stress in kidney transplant patients with calcineurin inhibitor‑induced hypertesion: Effect of ramipril. J Cardiovasc Pharmacol 2002; 40 : 625 – 631.
39. Varghese Z, Fernando RL, Turakhia G et al. Oxidizability of Low-Density Lipoproteins From Neoral and Tacrolimus - Treated Renal Transplant Patients. Transplant Proc 1998; 30 : 2043 – 2046.
40. Varghese Z, Fernando RL, Turakhia G et al. Calcineurin inhibitors enhance low - density lipoprotein oxidation in transplant patients. Kidney Int Suppl 1999; 71: S137 – S140.
41. Cofan F, Cofan M, Campos B et al. Effect of calcineurin inhibitors on low - density lipoprotein oxidation. Transplant Proc 2005; 37 : 3791 – 3793.
42. Martínez Castelao A, Ramos R, Serón D et al. Effect of cyclosporin and tacrolimus on lipoprotein oxidation after renal transplantation. Nekrologia 2002; 22 : 364 – 369.
43. Perrea DN, Moulakakis KG, Poulakou MV et al. Correlation between oxidative stress and immunosuppressive therapy in renal transplant recipients with an uneventful postoperative course and stable renal function. Int Urol Nephrol 2006; 38 : 343 – 348.
44. Morena M, Vela C, Garrigue V et al. Low-Density Lipoprotein Composition and Oxidation Are Not Influenced by Calcineurin Inhibitors in Renal Transplant Patients. Transplant Proc 2000; 32 : 2785 – 2786.
45. Štrebl P, Horčička jr. V, Krejči K et al. Oxidative stress after kidney transplantation: The role of immunosuppression. Dial Transplant 2010; 39 : 391 – 394.
46. Zadražil J, Štrebl P, Krejčí K et al. Effect of different calcineurin inhibitors on AOPP and TAS after kidney transplantation. Clin Biochem 2010; 43 : 559 – 565.
47. Calò LA, Dall‘Amico R, Pagnin E et al. Oxidative stress and post‑transplant hypertension in pediatric kidney - transplanted patients. J Pediatr 2006; 149 : 53 – 57.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 4-
All articles in this issue
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
- Oxidační stres u pacientů po transplantaci ledviny
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- Kazuistika získané hemofilie A
- Využití vildagliptinu z pohledu interního lékaře
- PET-CT dokumentovaný rychlý nástup léčebné odpovědi cyklofosfamidu, thalidomidu a dexametazonu u multicentrické formy Castlemanovy nemoci. Popis případu a přehled informací o léčbě
- Změny hmotnosti a kompenzace diabetu (HbA1c) u nemocných s diabetes mellitus 2. typu po přidání exenatidu (Byetta) ke stávající léčbě ve 28 diabetologických ambulancích v ČR – studie BIBY‑II (sledování 24 měsíců)
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Kteří příbuzní prvního stupně nemocných s kolorektálními neoplaziemi jsou nejvíce ohroženi
- Přínos systému vzdáleného sledování v dlouhodobé péči o pacienty s implantabilními kardiovertery‑ defibrilátory
- Aortální stenóza
- Tuberkulóza v České republice. Současný stav. Diagnóza, léčba, prevence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aortální stenóza
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

