Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
:
J. Mačák 1; J. Dvořáčková 1; J. Mačáková 2; P. Vlček 3
:
Ústav patologie Lékařské fakulty OU a FN Ostrava, přednostka prim. MU Dr. Jana Dvořáčková, Ph. D., MIAC
1; Katedra fyziologie a patofyziologie Lékařské fakulty OU Ostrava, přednosta doc. RNDr. Pavol Švorc, CSc.
2; Klinika nukleární medicíny a endokrinologie 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MU Dr. Petr Vlček, CSc.
3
:
Vnitř Lék 2013; 59(4): 317-320
:
Case Reports
Cílem sdělení je poukázat na medulární mikrokarcinom štítné žlázy, který může vzdáleně metastazovat stejně tak, jako to mohou dělat medulární makrokarcinomy. V tomto případě šlo o 54letého muže, který trpěl řadu týdnů pocitem tlaku na hrudi a suchým dráždivým kašlem. Na RTG plic se objevily drobné neostře ohraničené uzlíky nejasné etiologie. Byla provedena biopsie plic, kdy byl zjištěn neuroendokrinní karcinom s amyloidem a doporučeno vyšetření štítné žlázy s cílem potvrdit či vyloučit podezření na medulární karcinom. Bioptické vyšetření nabízelo i možnost primárního plicního neuroendokrinního karcinomu G1 a G2 nebo difuzní idiopatickou neuroendokrinní hyperplazii. Byla provedena řada vyšetření zobrazovacími metodami (CT, MR, PET- CT), avšak bez pozitivního výsledku ve štítné žláze. Přesto byla provedena tyreoidektomie. Následné bioptické vyšetření objevilo medulární mikrokarcinom velikosti 0,6 cm. Kromě metastazování do plic byla zjištěna i ložiska nádoru v krčních lymfatických uzlinách. V tomto případě poukazujeme na užitečnost těsné spolupráce patologa a klinického lékaře – endokrinologa. Ten může na základě výše hladiny kalcitoninu v séru zúžit diferenciálně diagnostickou rozvahu.
Klíčová slova:
medulární mikrokarcinom – metastázy do plic – metastázy do krčních lymfatických uzlin – imunohistologické vyšetření
Úvod
Medulární mikrokarcinom (MeMi) je definován jako nádor velikosti menší než 1 cm. Podobná kritéria platí i pro papilární mikrokarcinom štítné žlázy. Kazaure et al [1] publikovali sestavu 310 pacientů s MeMi. Průměrná velikost nádoru byla 5,7 mm a větších nádorů, velikosti 6– 10 mm, bylo v sestavě 53,9 %. Autoři zjistili, že nádory většinou postihují vlastní štítnou žlázu ve více než 90 % případů a pouze v 7,8 % se objevuje nádor mimo žlázu.
Jde zpravidla o pacienty středního věku, u kterých nebyla zjištěna hyperplazie C buněk ani multifokální ložiska. U těchto sporadických případů se nádor zjistí náhodně při bioptickém vyšetření operované štítné žlázy, při pitvě nebo při rutinním vyšetření kalcitoninu u nodulárně pozměněné štítné žlázy [2]. V předkládaném případě se na medulární karcinom štítné žlázy začalo pomýšlet po bioptickém vyšetření excize plicního parenchymu.
Popis případu
V našem případě šlo o 54letého muže, který několik měsíců trpěl pocitem tlaku na hrudi a suchým dráždivým kašlem, pro který byl přijat k celkovému vyšetření. Na RTG plic byla zjištěna drobná neostře ohraničená ložiska. Vzhledem k nejasnosti celého procesu se přistoupilo k biopsii plic. V plicním parenchymu byly zjištěny homogenní eozinofilně se barvící bezbuněčné hmoty, které tinkčními vlastnosti odpovídaly amyloidu. Mezi masami amyloidu byly blandně vyhlížející buňky, které tvořily drobná ložiska (obr. 1). Imunohistologické vyšetření ukázalo pozitivní výsledky s protilátkami proti kalcitoninu (rovněž homogenní masy amyloidu vykazovaly pozitivní nález), CD56, chromograninu, synaptofyzinu, cytokeratinu 7 a TTF- 1. Nález byl interpretován jako neuroendokrinní nádor s tvorbou amyloidu a doporučeno zevrubné vyšetření štítné žlázy a vyšetření hladiny kalcitoninu.
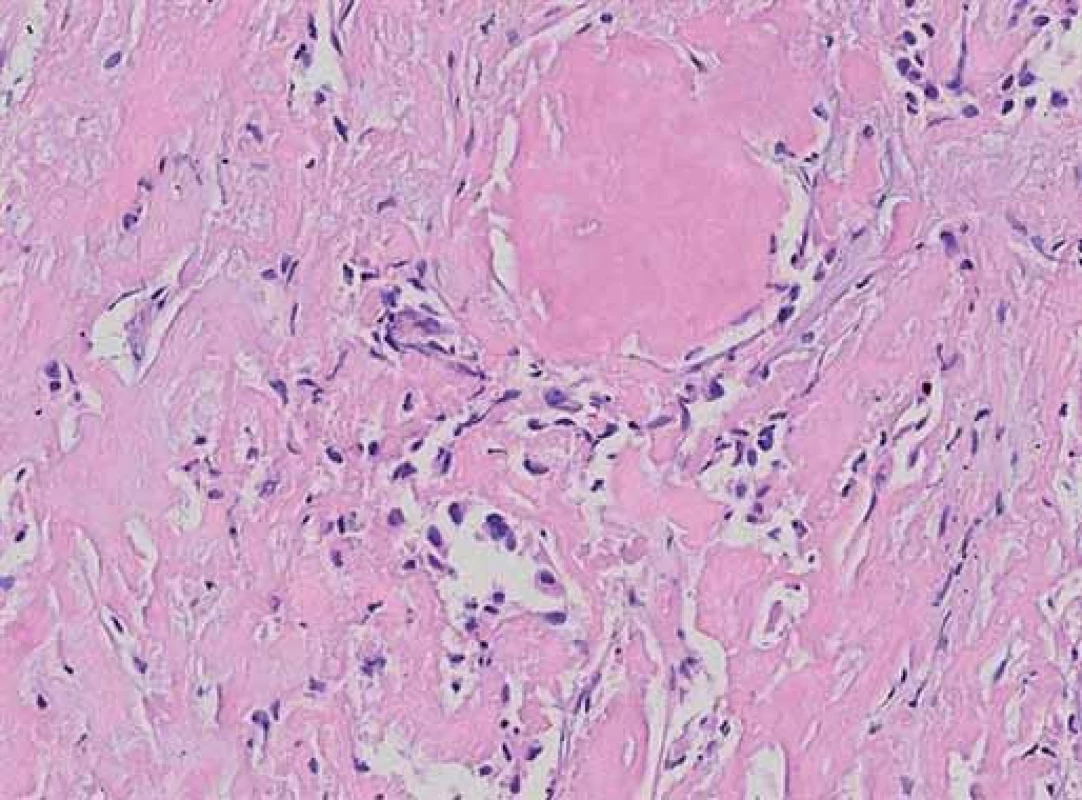
Proběhla série klinických vyšetření s cílem zjistit primární ložisko ve štítné žláze. Vyšetření počítačovou tomografií (CT), magnetickou rezonancí (MR) a pozitronovou emisní tomografií (PET- CT) neprokázala nádorové změny štítné žlázy, i když byla zjištěna ložiska zvýšeného metabolizmu glukózy v krčních lymfatických uzlinách a v plicích. Následovala bloková disekce krčních lymfatických uzlin. Bioptické vyšetření prokázalo metastázy v několika uzlinách. Nádor byl stejného vzhledu jako v předcházející biopsii plic. I přes klinicky negativní nález ve štítné žláze bylo doporučeno její odstranění.
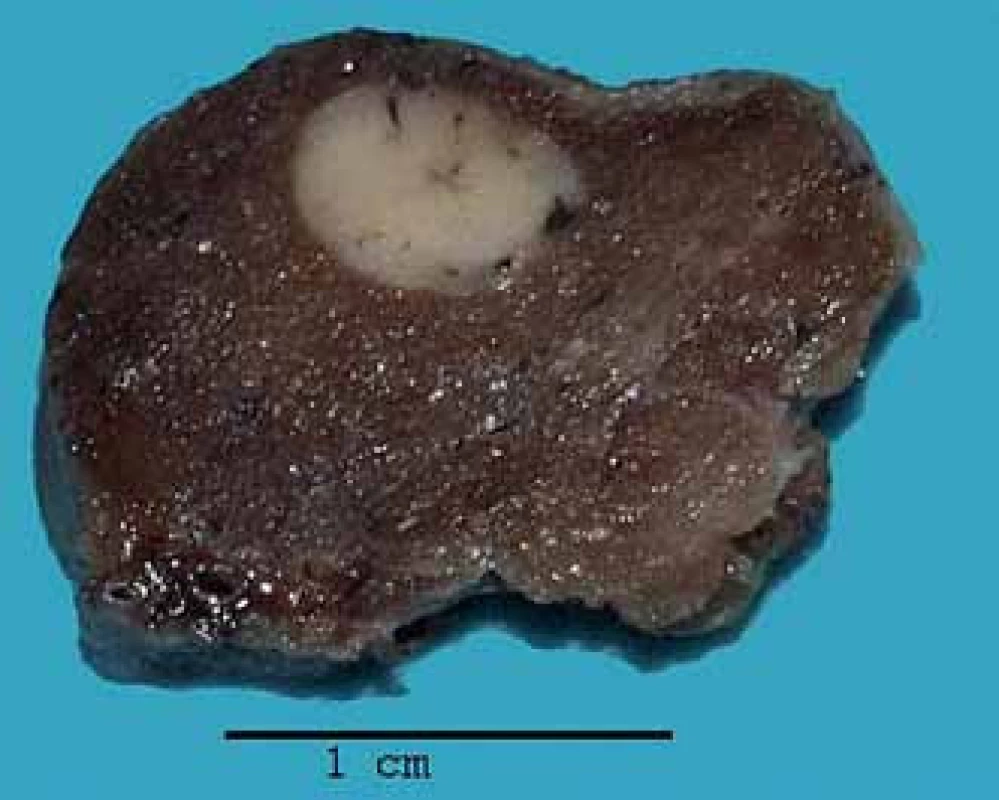
Následně byla provedena totální tyreoidektomie a v levém laloku štítné žlázy bylo zjištěno ložisko bělavé barvy velikosti 0,6 cm (obr. 2). Histologicky šlo o neopouzdřený nádor tvořený aciny nádorových buněk, která měla oválná jádra s jemně hrudkovitým chromatinem a výraznými jadérky. Plazma buněk byla lehce bazofilní a granulovaná. V nádoru ani v jeho okolí nebyla výraznější fibrotizace. Ložiska amyloidu nebyla přítomna. Vyšetření kongo- červení na amyloid bylo negativní. Imunohistochemické vyšetření nádoru ukázalo stejnou pozitivitu jako při předcházející biopsii plic. S protilátkou proti kalcitoninu reagovala většina nádorových buněk (obr. 3). Proliferační marker Ki- 67 byl pozitivní v méně než 1 % nádorových buněk. Závěr bioptického vyšetření byl MeMI levého laloku štítné žlázy.
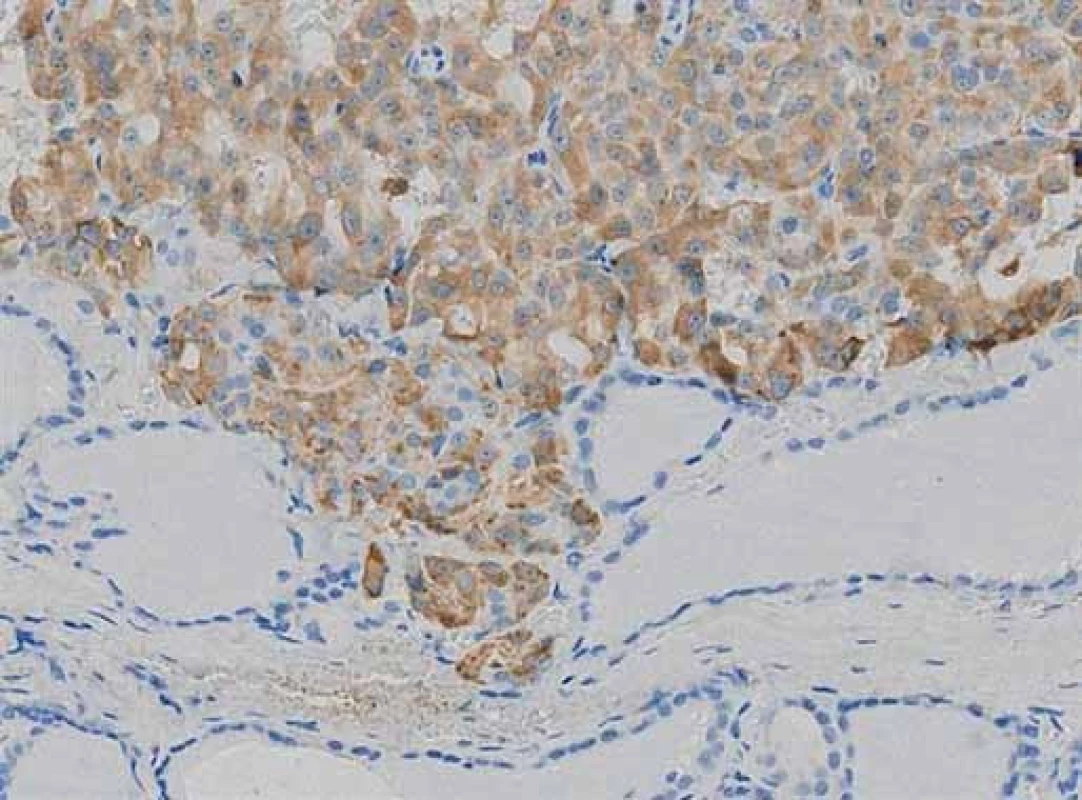
Diskuze
Medulární karcinom štítné žlázy (MTC) je málo obvyklý nádor, vycházející z parafolikulárních buněk (zvaných podle hormonální produkce proteohormonu kalcitoninu také C buňky).
Obecně lze říci, že prognóza medulárních karcinomů štítné žlázy leží mezi papilárními a folikulárními karcinomy na jedné straně a nejagresivnějšími, anaplastickými karcinomy na druhé straně. Prognóza pacientů se sporadickými medulárními karcinomy je rozdílná. V některých případech postačí odstranění primárního nádoru a okolních neprogredujících ložisek, v jiných případech dochází k rychlé progresi a ke generalizaci nádoru.
Medulární karcinom má 2 formy: sporadickou a familiární. Sporadická forma je častější a tvoří přibližně 75 % všech medulárních karcinomů. Většinou bývají postiženi lidé ve věku nad 45 roků a nádor bývá solitární. Familiární forma medulárního karcinomu postihuje osoby výrazně mladší, průměrný věk je asi 35 roků. Často se objevuje více nádorových ložisek oboustranně. Patří sem především nádory dětského věku. Tento familiární medulární karcinom se objevuje u mnohotné endokrinní neoplazie 2a (MEN 2a), MEN 2b a u syndromu familiárního medulárního karcinomu štítné žlázy (FMTC) [3].
Příčinou vzniku nádoru je zárodečná bodová mutace RET protoonkogenu lokalizovaného na chromozomu 10q11.2. U familiárního medulárního karcinomu jde o mutaci přítomnou již v zárodečné buňce, tudíž jde o mutaci postihující všechny buňky organizmu. Podle genetického vyšetření je možno v příbuzenstvu zjistit nepostižené jedince, kteří tak nemusejí podstupovat dříve nezbytná opakovaná vyšetření.
Ukazuje se, že tyto mutace nesouvisejí pouze se vznikem jednotlivých syndromů, ale spojují se také s agresivitou medulárních karcinomů. RET mutace v kodonu 918 se objevují u nejagresivněji probíhajících nádorů u MEN 2b (typicky s přítomností feochromocytomu, slizniční neurofibromatózou a marfanoidním habitem). Mutace RET protoonkogenu se vyskytují také ve 30– 70 % případů v nádorových buňkách sporadických medulárních karcinomů a u většiny z nich dochází opět k mutaci kodonu 918. Přitom přibližně u 10 % sporadických medulárních karcinomů se objevují mutace RET protoonkogenu i v zárodečných buňkách [4]. Jako nejméně agresivní bývají medulární karcinomy s mutacemi v kodonech 768 a 804. Ty se vyskytují u syndromu familiárního medulárního karcinomu [3]. To může být i odpovědí na otázku, proč se některé medulární karcinomy chovají mnohem agresivněji než jiné nádory velmi podobného histologického vzhledu.
K metastazování dochází nejčastěji do regionálních lymfatických uzlin, plic, jater a kostí. V některých případech vzdálené metastázy mohou svými příznaky stát v popředí klinického obrazu a vést k rozpakům patologa. Tak tomu bylo i v našem případě. Neuroendokrinní karcinomy plic G1 a G2 (dříve karcinoidy a atypické karcinoidy) a difuzní idiopatická plicní neuroendokrinní hyperplazie [5,6] mohou mít obdobný histologický a imunohistologický obraz jako metastázy medulárního karcinomu, i když většinou neobsahují amyloid. Byly však popsány i atypické karcinoidy s amyloidem [7– 9] a medulární karcinom plic s amyloidem, který je velmi podobný medulárnímu karcinomu štítné žlázy [10]. I když jde o léze relativně vzácné, je třeba uvést, že neuroendokrinní karcinomy G1 a G2 se mohou objevovat v plicním parenchymu multifokálně. Imunohistologicky pozitivně reagují s protilátkou proti kalcitoninu, TTF- 1 a cytokeratinu 7, tak jak to bylo v našem případě. Jejich odlišení od metastázy medulárního karcinomu může být obtížné. V posledních letech někteří autoři [11,12] doporučují užití protilátky proti transkripčnímu faktoru štítné žlázy Pax8. Pomocí této protilátky můžeme odlišit metastázu medulárního karcinomu do plic od plicního neuroendokrinního karcinomu.
Bez detailního klinického obrazu včetně zobrazovacích metod nemusí být závěr bioptického vyšetření vzdálené metastázy jednoznačný. Teprve hodnoty kalcitoninu v séru mohou napovědět, že jde o metastatický a nikoliv lokální nádorový proces. V našem případě dosahovaly hodnoty kalcitoninu 2 000 ng/ l. Na tomto místě je nutné upozornit na skutečnost, že u některých pacientů s prostou uzlovou strumou (0,5– 1 %) a s polynodózní strumou (4 %) byly rovněž nalezeny zvýšené hladiny kalcitoninu. Je‑li však nativní hladina kalcitoninu 100 ng/ l a více, popř. je 3– 5krát zvýšená po stimulačním kalcitoninovém testu (stimulace kalciovou solí v dávce 2,5– 3 mg elementárního kalcia/ kg tělesné hmotnosti je postačujícím sekretagogem; dříve používaný pentagastrin není u nás k dispozici), je diagnóza medulárního karcinomu jistá. Naopak normální hladina kalcitoninu medulární karcinom prakticky vylučuje.
Hladiny kalcitoninu u neuroendokrinních karcinomů plic G1 a G2 a u difuzní idiopatické plicní neuroendokrinní hyperplazie bývají řádově nižší. V našem případě ani zevrubné vyšetření štítné žlázy MR, CT a PET– CT neobjevilo nádor ve štítné žláze. Teprve její odstranění a bioptické vyšetření ukázalo MeMi. Ukazuje se, že výše uvedené metody při velikosti ložiska v průměru pod 1 cm selhávají. U pacientů s asymptomatickým průběhem onemocnění s trvalou hyperkalcitonemií bez korelátu zdroje sekrece je v poslední době navrhován termín asymptomatická hyperkalcitoninemie. U těchto nemocných je s výhodou vyšetření CEA, což je sice nespecifický nádorový marker pro medulární karcinom, ale je vhodný pro posouzení dynamiky onemocnění při trvale vysoké hladině kalcitoninu. Pokud CEA stoupá, pak to svědčí pro progresi onemocnění a vyžaduje to intenzivnější způsob hledání zdroje této sekrece [13,14].
Ukazuje se, že MeMi nemá prognostické parametry výrazně lepší ve srovnání s nádory mnohem větší velikosti. I nádory menší než 5 mm mohou mít fatální průběh [15]. Kazaure et al [1] publikovali sestavu 310 pacientů s MeMi. Deset roků přežívalo 95,7 % nemocných, při regionálním rozšíření 86,7 % a tam, kde byly zjištěny vzdálené metastázy, 10 roků přežívalo 50 % nemocných. Při srovnání těchto výsledků s medulárními karcinomy průměrné velikosti 2,8 cm v sestavě 1 252 pacientů [16] 10 roků přežívalo 95,6 % nemocných, v případech regionálního rozšíření 10 roků přežívalo 75,6 % a tam, kde byly vzdálené metastázy, přežívalo 40 % nemocných. Jde tedy o překvapivě podobné výsledky.
Obdobné výsledky byly zjištěny i ve vztahu papilárních mikrokarcinomů a papilárních karcinomů štítné žlázy. U obou typů nádoru se doporučuje obdobný přístup k terapii [15,17].
Léčení medulárních karcinomů je obtížné. V první řadě se přistupuje k radikální totální tyreoidektomii, zvláště u familiárních a multifokálních forem, a k odstranění krčních lymfatických uzlin, nejlépe modifikovanými blokovými krčními disekcemi. Lokální recidivy se objevují až u 35 % pacientů. Pět let přežívá 70– 80 % pacientů. Nádor nemá schopnost vychytávat jod, proto se v léčbě radiojod neuplatní (C buňky nemají akumulační schopnost pro radiojod). Nemocní poměrně špatně reagují na radioterapii a chemoterapii. Špatnou prognózu mají také starší pacienti a nemocní s generalizovaným nádorovým postižením v době diagnózy. Z histologického hlediska je vyšší agresivita nádoru spojena s přítomností nekróz, vysoké mitotické aktivity, ložisky skvamózní transformace a desmoplastické reakce [18]. Také nízká imunohistologická pozitivita s protilátkou proti kalcitoninu a zvýšená reaktivita s protilátkou proti CEA se považují za prognosticky nepříznivé znaky [3].
prof. MU Dr. Jirka Mačák, CSc.
www.osu.cz
e‑mail: macak.jirka@seznam.cz
Doručeno do redakce: 29. 1. 2013
Přijato po recenzi: 19. 2. 2013
Sources
1. Kazaure HS, Roman AS, Sosa JA. Medullary thyroid microcarcinoma. Cancer 2012; 118: 620– 627.
2. Baloch ZW, LiVolsi VA. Microcarcinoma of the thyroid. Adv Anat Pathol 2006; 13: 69– 75.
3. Rosai J. Rosai and Ackerman’s surgical pathology, tenth edition. MOSBY ELSEVIER 2011.
4. Čáp J, Ryška A. Aspirační cytologie. Hradec Králové: Nucleus HK 2003.
5. Leslie KO, Wick MR. Practical pulmonary pathology. A diagnostic approch. Philadelphia: ELSEVIER SAUNDERS 2011.
6. Travis WD, Brambilla E, Müller– Hermelink KH et al. Tumors of the lung, pleura, thymus and heart. Pathology & genetics. Lyon: IARC Press 2004.
7. Abe Y, Utsunomiva H, Tsutsumi Y. Atypical carcinoid tumor of the lung with amyloid stroma. Acta Pathol Jpn 1992; 42: 286– 292.
8. Štěrba J. Metastasizing bronchial carcinoid with amyloid in the stroma. Zentralbl Allg Pathol 1968; 111: 555– 561.
9. el- Gatit A, al- Kaisi N, Moftah S et al. Atypical bronchial carcinoid tumor with amyloid deposition. Eur J Surg Oncol 1994; 20: 586– 587.
10. Gordon HW, Miller R, Mittman C. Medullary carcinoma of the lung with amyloid stroma: a counterpart of medullary carcinoma of the thyroid. Human Pathol 1973; 4: 431– 436.
11. Conway A, Wiernik A, Lam ARC et al. Occult primary medullary thyroid carcinoma presenting with pituitary and parotid metastases: case report and review of the literature. Endocrin Pathol 2012; 23: 115– 122.
12. Nonaka D, Tang Y, Chiriboga L et al. Diagnostic utility of the thyroid transcription factor Pax8 and TTF- 1 (FOX E1) in thyroid epitelial neoplasms. Mod Pathol 2008; 21: 192– 200.
13. Vlček P. Endokrinologicko‑nukleárně medicinské aspekty v léčbě nádorů štítné žlázy. Vnitř Lék 2007; 53: 807– 811.
14. Vlček P, Michalová K, Táborská K et al. Radionuklidové zobrazovací metody používané v endokrinologii. Vnitř Lék 2006; 52: 969– 972.
15. Marcy PY, Thariat J, Peyrottes I et al. Fulminant lethal spread of occult papillary microcarcinoma of the thyroid. Thyroid 2010; 20: 445– 448.
16. Roman S, Lin R, Sosa JA. Prognosis of medullary thyroid carcinoma. Cancer 2006; 107: 2134– 2142.
17. Aurora N, Turbendian HK, Kato MA et al. Papillary thyroid carcinoma and microcarcinoma: is there a need to distinguish the two? Thyroid 2009; 19: 473– 477.
18. Kaserer K, Scheuba CH, Neuhold N et al. Sporadic versus familial medullary thyroid carcinoma. A histopathologic study of 50 consecutive patients. Am J Surg Pathol 2001; 25: 1245– 1251.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2013 Issue 4
Most read in this issue
- Aortic stenosis
- Lung metastases as the first manifestations of occult medullary microcarcinoma
- The „Short Physical Performance Battery“ in the Czech Republic – the pilot and validation study in older persons
- Perindopril in the treatment of hypertension and cardiovascular diseases: evolution continues with the orodispersible dosage form
