-
Medical journals
- Career
Aortální stenóza
Authors: P. Gregor; H. Línková
Authors‘ workplace: III. interní – kardiologická klinika 3. lékařské fakulty UK a FN Královské Vinohrady Praha, přednosta prof. MU Dr. Petr Widimský, DrSc., FESC
Published in: Vnitř Lék 2013; 59(4): 277-283
Category: Review
Overview
Práce se zabývá problematikou aortální stenózy. Zahrnuje poznatky týkající se etiopatogeneze, klinického obrazu, echokardiografického a katetrizačního vyšetření. Rozebírá kritéria léčby, zvláště kardiochirurgické.
Klíčová slova:
stenóza aorty – náhrada aortální chlopně – tlakové přetížení levé komory – echokardiografie u aortální stenózyÚvod
Aortální stenóza (AS) je nejčastější chlopenní vadou dospělých v Evropě a Severní Americe, současně je i 3. nejčastějším kardiovaskulárním onemocněním u nás po hypertenzi a ICHS [1,2].
V etiologii je nejčastější degenerativní, skleroticko‑kalcifikační původ u starých osob, který tvoří zhruba 80 % AS v západních zemích [3]. Kalcifikace začínají na bazích cípů a progredují směrem k jejich okrajům, srůsty v komisurách nepozorujeme. K jejímu dřívějšímu rozvoji dochází u nemocných se stejnými rizikovými faktory jako ateroskleróza (vyšší věk, hypertenze, poruchy lipidů, obezita, nikotinizmus, mužské pohlaví), je zde tedy v tomto směru určitá podobnost s ICHS včetně pozitivního průkazu zánětu a infekce u řady pacientů. Na druhém místě jde o vrozené vady. Nejčastěji je to bikuspidální chlopeň (obr. 1), u níž jsou cípy zpočátku jemné, až později dochází k jejich ztluštění a kalcifikaci. Vyskytuje u 1 – 2 % populace, častěji u mužů [2], obraz stenózy se u ní vytváří kolem 60. roku, kdy se tam dříve a ve větší míře než u zdravé chlopně začíná ukládat vápník, někdy je však vyjádřena i u podstatně mladších nemocných. Tvoří podle některých až 35 % operovaných s AS [4]. Manifestuje se obvykle o 10 – 20 let dříve ve srovnání s degenerativní vadou. Porevmatická AS je dnes již ve vyspělých zemích velmi vzácná (< 10 % operovaných). Dochází při ní ke srůstání cípů v komisurách a následnému ukládání vápníku, většinou bývá současně postižena i mitrální chlopeň.
Image 1. Bikuspidální stenotická aortální chlopeň – jícnová echokardiografie. 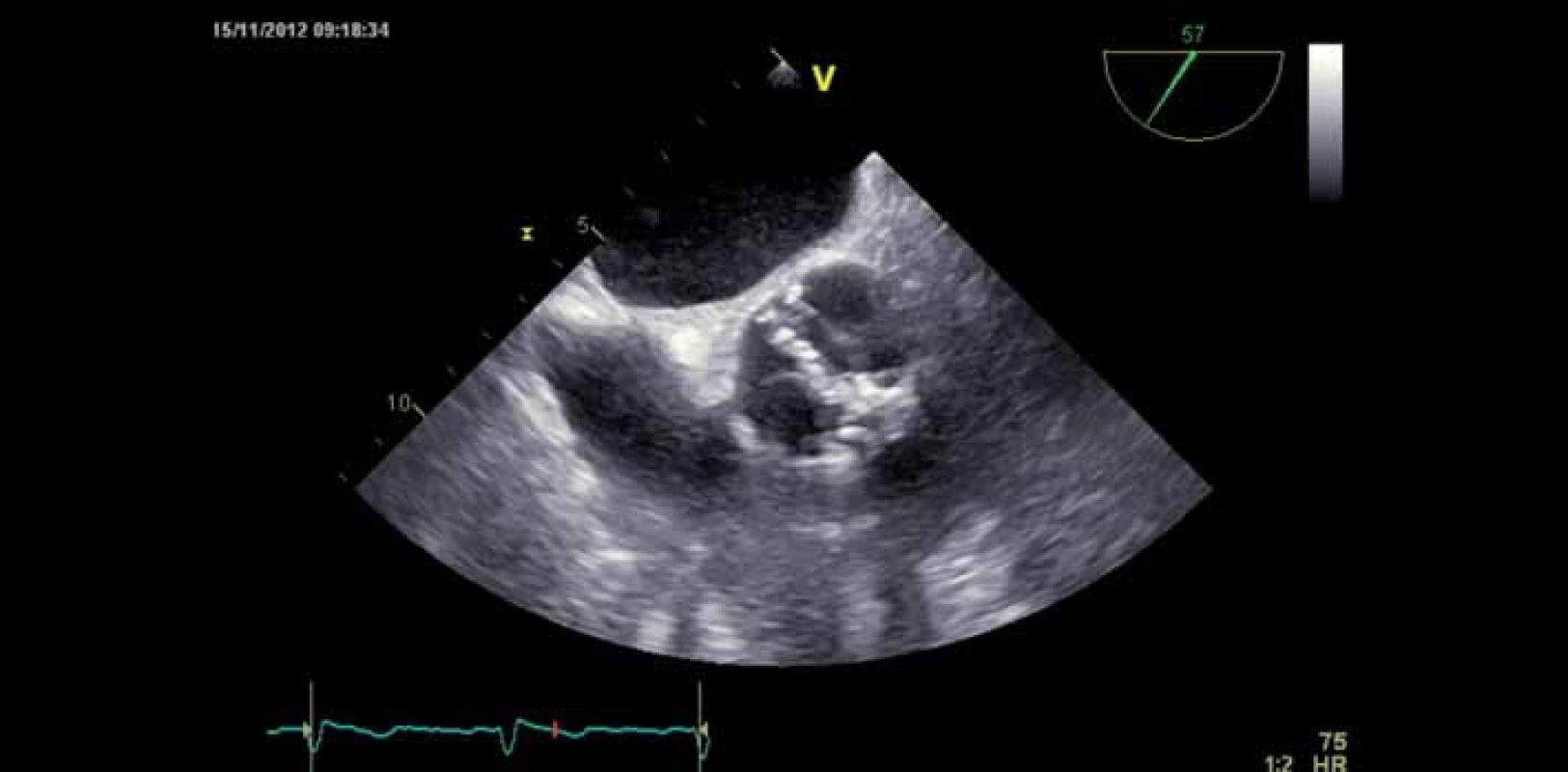
Vyskytovat se mohou i subvalvulární stenózy se zúžením v úrovni výtokového traktu levé komory. Jde o membranózní či fibromuskulární zúžení, v dospělosti vzácné, častější bývá subaortální stenóza u hypertrofické obstrukční kardiomyopatie. Supravalvulární stenóza je v dospělosti také velmi vzácná, uvedené dva typy stenóz stojí stranou našeho výkladu.
Z hlediska patofyziologie dochází u AS k tlakovému přetížení levé komory, na něž komora reaguje kompenzatorní hypertrofií myokardu. Vzniká koncentrická hypertrofie (bez její dilatace), díky níž dochází k snižování napětí stěny („wall stressu“ – S), a to podle Laplaceova zákona, kdy S = P × r/ 2h, kde h = tloušťka stěny, P = tlak v levé komoře, r = poloměr levé komory.
Koncentrická hypertrofie levé komory může dlouho AS kompenzovat, má však i své negativní důsledky v podobě zhoršení diastolického plnění (porucha relaxace) se vzestupem end-diastolického tlaku v levé komoře, koronární průtok – ač zvýšen v absolutních hodnotách – může být ve skutečnosti nižší po vztažení na jednotku hmotnosti myokardu [4]. Při postupném zvyšování systolického napětí stěny dochází k rozvoji systolické dysfunkce levé komory, podílí se na ni zřejmě i subendokardiální ischemie a intersticiální fibróza myokardu. Rozvíjí se plicní hypertenze, která je důsledkem přenosu zvýšeného tlaku z levé síně přes plicní kapiláry do řečiště a. pulmonalis.
Klinický obraz
Vada může zůstat dlouho asymptomatická. Postupně se objevuje charakteristická trias – ponámahové stenokardie, dušnost a především synkopy – v tomto stadiu jde již o pokročilou vadu, zejména pokud se k tomu přidají manifestní projevy levostranného selhávání. Průměrné přežití jen lehce převyšuje 2 roky po objevení známek levostranné nedostatečnosti, 3 roky od vzniku synkop a 5 let od počátku anginy pectoris [1,2].
Při fyzikálním vyšetření nacházíme typický drsný systolický šelest ejekčního typu s maximem nad aortou a propagací do karotid. Bývá však slyšet dobře i v prekordiu a na hrotě, což může působit matoucím dojmem (možná jeho záměna s šelestem při mitrální insuficienci), běžný bývá nález systolického víru. Ejekční typ šelestu je charakterizován vřetenovitým (crescendo - decrescendovým) průběhem a dále tím, že nezačíná hned po I. ozvě jako regurgitační šelesty, ale s určitým časovým zpožděním za ní (lze vystopovat dokonce i určitou závislost mezi délkou tohoto intervalu a závažností vady). U vrozené AS v mladším věku (dokud není chlopeň ještě kalcifikovaná) se též nachází časně systolický klik (stop v systolickém otevírání chlopně – analogický mechanizmus jako u mitrálního otevíracího zvuku) [5]. II. ozva může být paradoxně (v exspiriu) rozštěpena (pro prodloužení ejekce levé komory následuje aortální komponenta komponentu pulmonální, což se zvýrazní v exspiriu).
Periferní tep je malý a tlaková amplituda jen pomalu stoupá pro prodloužení ejekčního času („pulsus parvus et tardus“). Systolicko‑diastolické rozpětí krevního tlaku je sníženo.
EKG ukáže obvykle známky hypertrofie levé komory s možnými změnami repolarizační fáze ST‑T (především descendentní deprese úseku ST ve V5,6 s negativní vlnou T). Sklon elektrické osy srdeční bývá doleva, při níž lze pozorovat často i snížení kmitů R ve svodech V1 – 3, mohou být přítomny známky zatížení levé síně.
Na RTG bývají změny až v pozdějších stadiích vady. Jde především o aortální konfiguraci srdce (zaoblení levé hranice, zvýraznění aortálního „knoflíku“, prohloubení zářezu v levém kardiofrenickém úhlu), rozšíření srdečního stínu doleva, případně dilataci aorty a městnání na plicích.
CT vyšetření aorty s kontrastem by mělo být provedeno před plánovaným operačním zákrokem na aortě a u supravalvulárních stenóz aorty, někdy lze v této indikaci použít i magnetickou rezonanci.
Echokardiografie má u AS zásadní význam. Dvourozměrná echokardiografie umožňuje rozpoznat etiologii s podrobným popisem chlopenního postižení, kvantifikaci významnosti vady, určení rozsahu kalcifikací, zhodnocení dalších důležitých struktur (prstenec, bulbus, sino - tubulární junkce, ascendentní aorta) (obr. 2), hypertrofie a funkce levé komory. Z dvourozměrné echokardiografie lze přímo planimetrizací zjistit plochu aortálního ústí, dále lze změřit separaci cípů – tato vyšetření však mohou být u těžce kalcifikovaných chlopní nepřesná (obr. 3). Při nedostatečném zobrazení doplníme ještě jícnovou echokardiografii.
Image 2. Transezofageální echokardiografie – měření velikosti prstence (1), bulbu (2), sinotubulární junkce (3), vzestupné aorty (4) – standardní měření anatomických poměrů před TAVI. 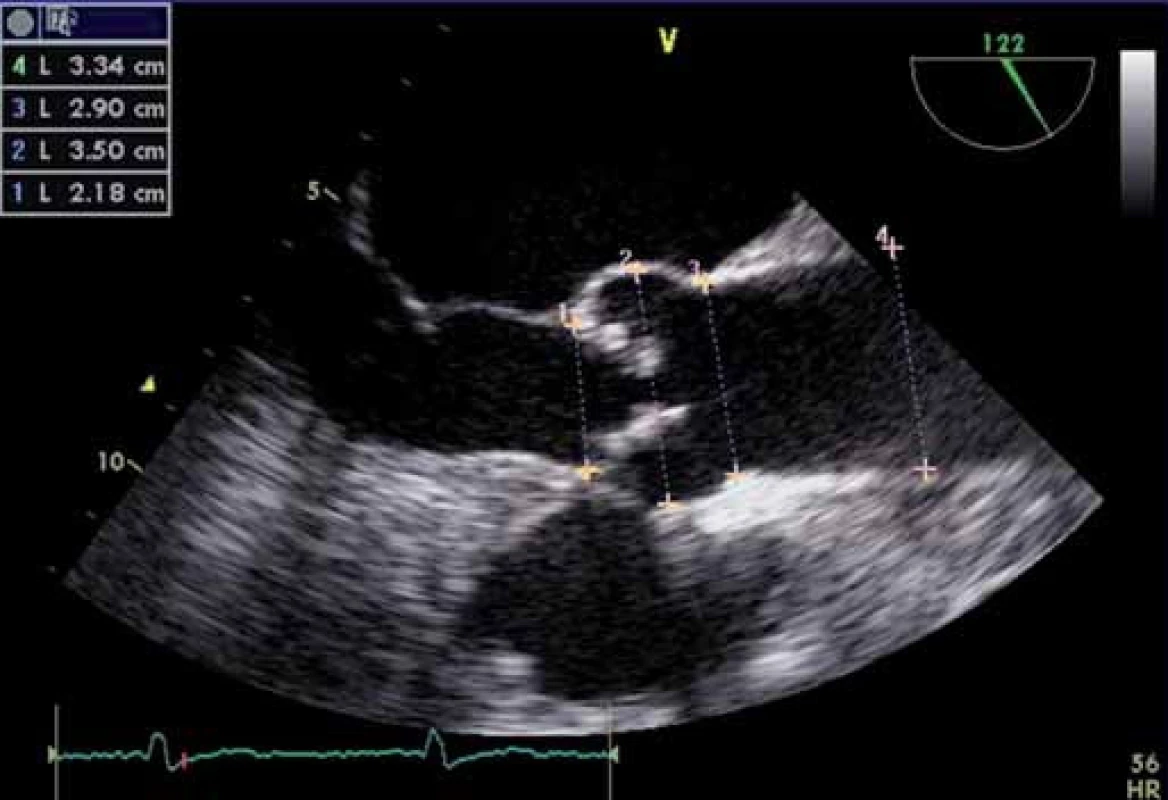
Image 3. Stenóza aorty degenerativní – parasternální dlouhá osa levé komory. Patrné je ztluštění aortálních cípů s kalcifikacemi, hypertrofie myokardu (septum 20 mm), šipkou je označeno místo měření rozměru LVOT, jednoho z parametrů sloužících k výpočtu AVA podle rovnice kontinuity. 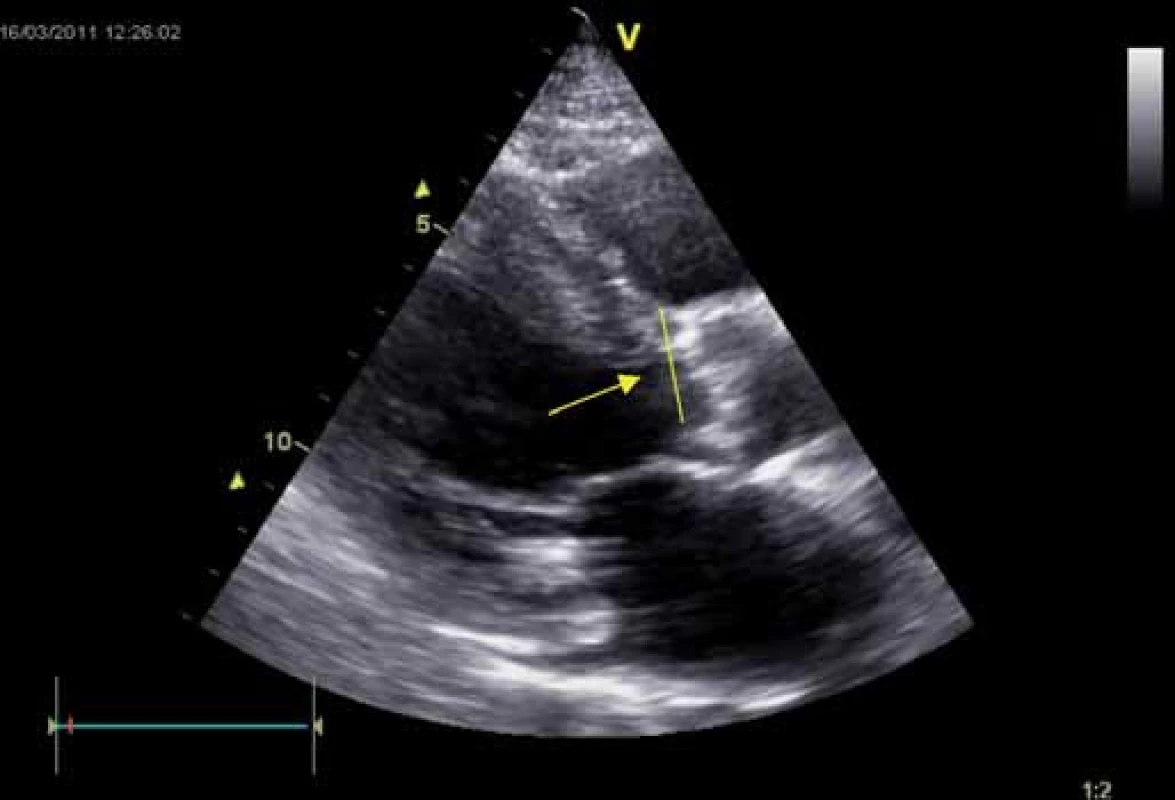
Dopplerovské hodnocení hemodynamické významnosti AS se zakládá na měření vrcholové rychlosti proudění stenotickou tryskou (obr. 4) a časově rychlostních integrálů (TVI) proudění tryskou a výtokovou částí levé komory [7]. Normální rychlost proudění aortou (v) nepřesahuje 1,7 m/ s, u významnějších stenóz je vyšší než 4 m/ s. Vrcholový gradient se počítá z maximální rychlosti v s pomocí zjednodušené modifikace Bernoulliho rovnice: PG = 4 × v2.
Image 4. Kritická stenóza aorty – kontinuální dopplerovské vyšetření. Maximální gradient 133 mm Hg, střední 90 mm Hg, V<sup>max</sup> 5,8 m/s. 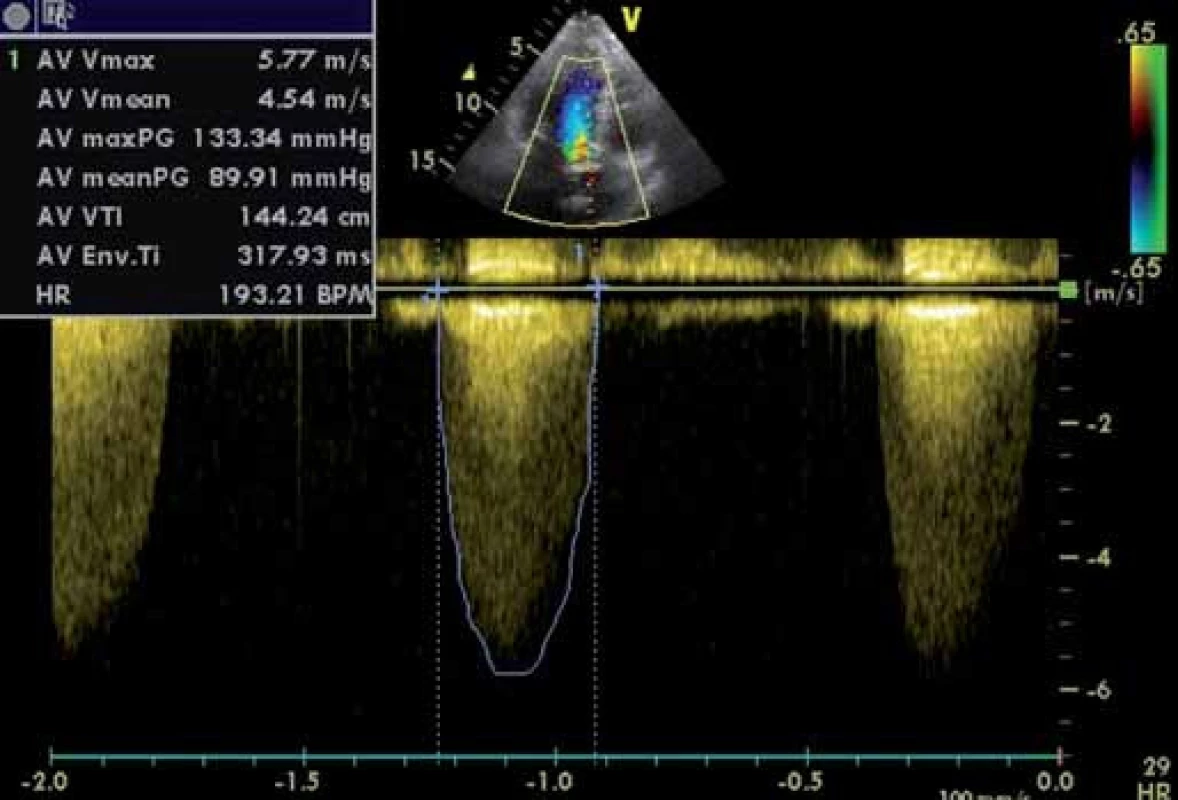
Střední gradient se pak zjišťuje z plochy pod TVI křivkou.
Plocha aortálního ústí jakožto cennější parametr než tlakový gradient (není závislá na průtoku) se počítá s pomocí zjednodušené rovnice kontinuity podle zásady, že z rychlosti (resp. časově rychlostního integrálu TVI) spojenou trubicí o známém průřezu (tedy i známé průřezové ploše) a ze změřené rychlosti se dá spočítat neznámá plocha na základě rovnice: V1 × A1 = V2 × A2, přičemž V1 je rychlost trubicí se známou plochou A1, zatímco V2 je rychlost ve spojené trubici s neznámou plochou A2. Za tuto neznámou plochu A2 dosadíme plochu aortálního ústí (AVA) a jednoduše upravíme výraz do podoby AVA = V1 × A1/ V2 s tím, že plochu A1 zjistíme jako plochu kružnice v úrovni výtokového traktu levé komory podle vzorce πr2 (místo r však měříme průměr, ve vzorci tedy d/ 2). Je pochopitelné, že při uvedeném výpočtu jde o velké zjednodušení skutečných poměrů (zejména výpočet plochy výtokového traktu) s potenciálním zdrojem nepřesností (obr. 3, 4 a 5), plochu lze, pochopitelně, také přímo změřit planimetrizací z dvourozměrné (nejlépe transezofageální) echokardiografie (obr. 6).
Image 5. Parametry LVOT – pulzní dopplerovské vyšetření. Výpočet AVA (viz i předchozí obrázky) pomocí rovnice kontinuity. 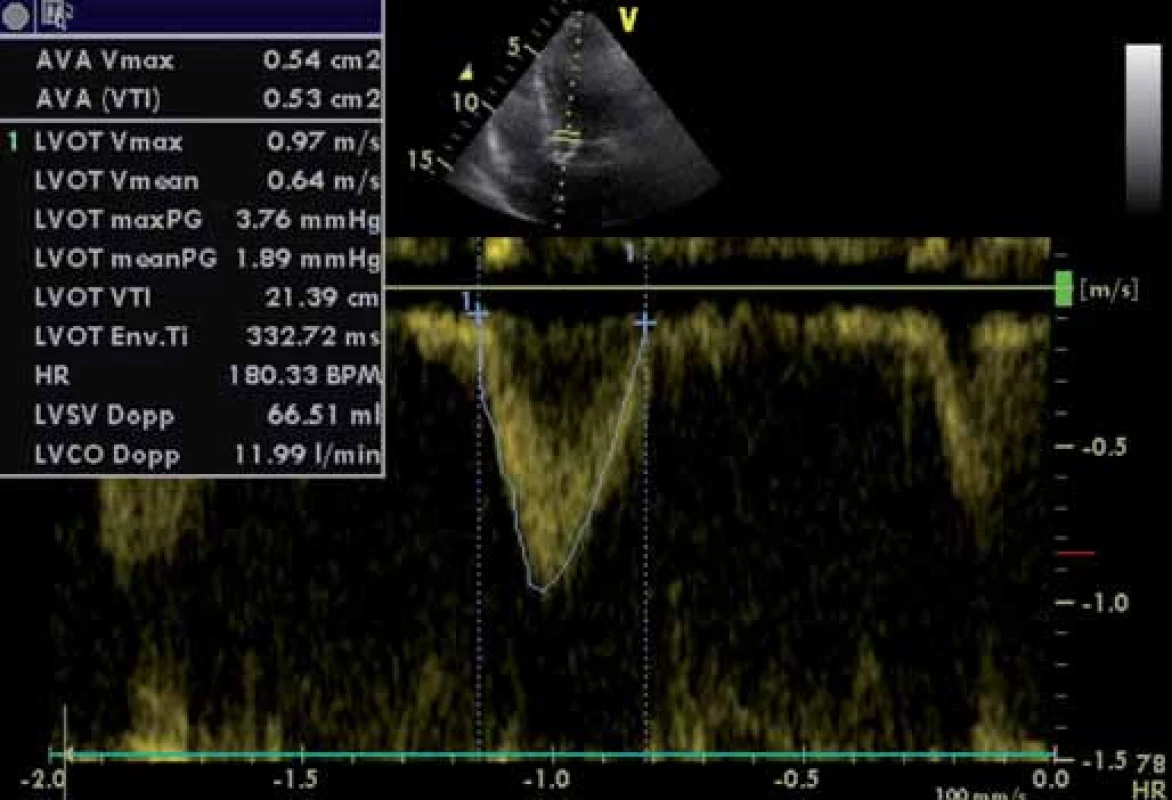
Image 6. Plocha aortálního ústí – planimetrické měření z TEE u stejného pacienta. 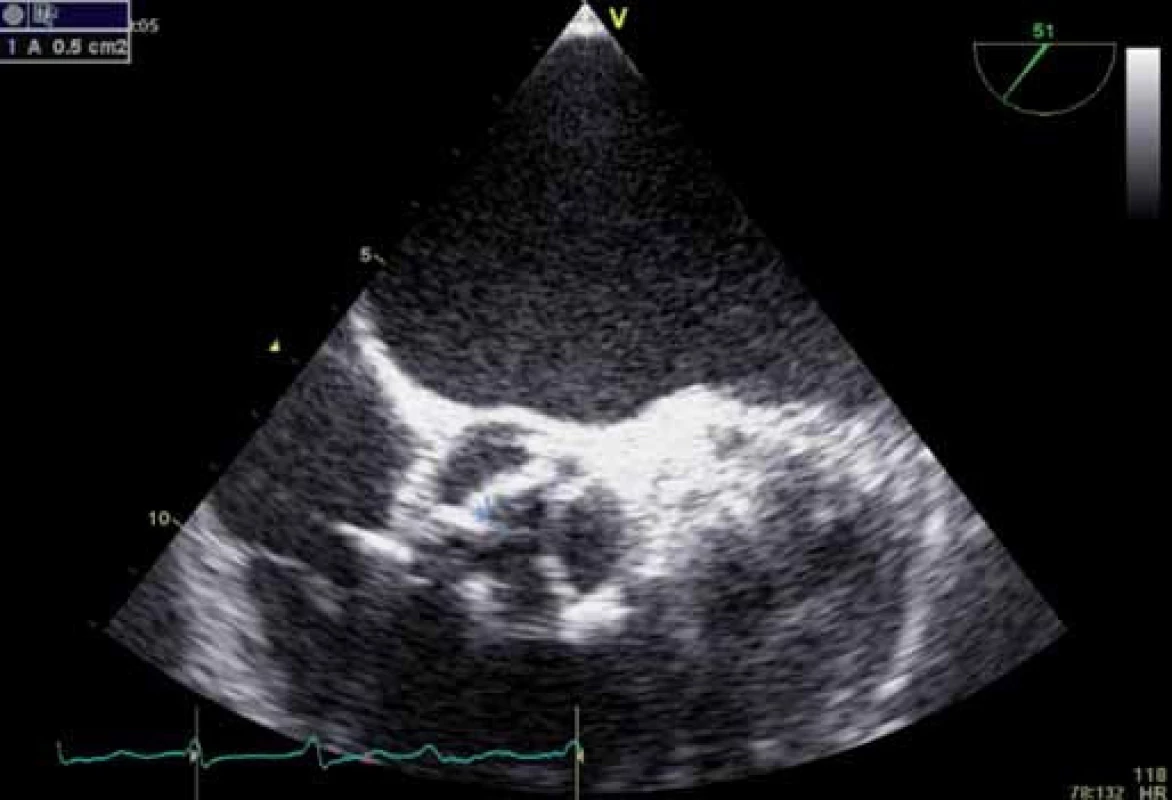
Normální plocha ústí je 2 – 4 cm2. Gradient mezi levou komorou a aortou se objevuje u plochy menší než 1,5 cm2, za těžkou stenózu se pokládá AVA < 1 cm2 nebo přesněji index plochy < 0,6 cm2/ m2.
Zátěžový test se obvykle provádí způsobem běžným při ergometrii, tedy zátěží se současným EKG záznamem (užívá se bicyklový ergometr, event. pohyblivý pás). Alternativně lze užít zátěžové echokardiografie na sklopném ergometru, která je však náročnější na vybavení a disponuje jí jen málo pracovišť. Zátěžový test je indikován u symptomatických těžkých stenóz k objektivizaci symptomatické reakce na zátěž (dušnost, stenokardie, synkopy). Za pozitivní odpověď podporující kardiochirurgický zákrok na aortální chlopni lze dále pokládat pokles krevního tlaku pod původní hodnotu, vznik horizontálních nebo descendentních depresí ST > 2 mm při negativní koronarografii či objevení komplexních komorových arytmií (komorové tachykardie). Pro operaci by mohl mluvit i vzestup tlakového gradientu po zátěži o více než 20 mm Hg [1]. U symptomatické AS je zátěžový test kontraindikován.
Naopak zátěžová farmakologická echokardiografie dobutaminem je vhodná u nemocných s AS s dysfunkcí levé komory (EF < 35 %) a malým gradientem [6,12,13]. Pokud po nízké dávce dobutaminu (do 20 µg/ kg/ min, jednotlivé stupně 5 min) dojde k významnému vzestupu gradientu (> 40 mm Hg) a jen k nevýznamnému zvětšení plochy ústí (< 0,2 cm2), jde jistě o významnou stenózu. Naopak „pseudovýznamná“ stenóza se projeví zvětšením plochy ústí (> 0,2 cm2) a jen nepodstatným vzestupem gradientu po zvýšení srdečního výdeje, vyvolaném lékem.
Katetrizace srdeční
Koronarografie je indikována před operací u mužů nad 40 let, u žen nad 45 let [6], dále při anamnéze nebo podezření na ICHS bez ohledu na věk či při dysfunkci levé komory. U těžší plicní hypertenze, dilatace pravostranných srdečních oddílů nebo současné trikuspidální insuficience by měla být provedena pravostranná katetrizace. Ventrikulografie a přesná invazivní kvantifikace významnosti vady je na místě při nejednoznačném či svou kvalitou nedostatečném výsledku echokardiografie.
Tlakové gradienty se katetrizačně u AS měří spíše výjimečně. Měří se většinou „peak to peak“ vrcholový gradient (od vrcholu tlakové křivky v aortě k vrcholu tlakové křivky v levé komoře), a dále střední gradient (výpočtem plochy ohraničené tlakovými křivkami z aorty a levé komory). V případě gradientu „peak to peak“ nejde o gradient odečtený v témže čase obou tlakových křivek, neboť vrchol tlakové křivky v aortě se lehce opožďuje za vrcholem tlaku v levé komoře. Katetrizačně lze samozřejmě změřit i maximální tlakový gradient (rozdíl tlaků v okamžiku vrcholu tlakové křivky v levé komoře), který se měří běžně z echokardiografie a který je pochopitelně o něco vyšší než gradient „peak to peak“. Oba gradienty jsou závislé na průtoku (viz níže), což je jejich nejvýraznější limitace. Výhodnější je proto plocha aortálního ústí (AVA), kterou lze zjistit pomocí formule Gorlinových podle vzorce:
kde HR = srdeční frekvence, PG = střední gradient v mm Hg, LVET = ejekční čas v sekundách, CO = srdeční výdej v ml/ min. Její přesnost velmi klesá u současné aortální insuficience (dilucí nebo podle Fickova principu se měří dopředný srdeční výdej, který je u aortální insuficience zmenšen o regurgitovanou krev). Někdy ji lze použít v zjednodušené podobě [4]: AVA = CO/ √PG.
Aortografie přichází v úvahu k přesnějšímu doplnění představy o významnosti aortální insuficience (většinou se však obejdeme s dopplerovským průkazem) a vzestupné aorty při její dilataci (zde však rovněž postačuje echokardiografie a CT u většiny nemocných).
K přesné kvantifikaci významnosti aortální stenózy slouží především plocha aortálního ústí, zvláště indexovaná na tělesný povrch. Normálně je 3 – 4 cm2, u těžkých stenóz leží pod 1,0 cm2 (indexovaná < 0,6 cm2/ m2). Gradient je pro posuzování významnosti méně vhodný, neboť je ovlivněn průtokem – při nízkém srdečním výdeji u dysfunkce levé komory je nízký, podobně tomu může být i u jiných typů poklesu tepového objemu (hypovolemie, sedace). Naopak u hyperkinetické cirkulace (současná regurgitace, anémie, tyreotoxikóza, rozčilení) se zvyšuje. U těžké aortální regurgitace může gradient nezřídka svědčit pro významnou stenózu, která je však ve skutečnosti jen středně těžká [4]. Měření plochy ústí tyto limitace nemá, je však více závislé na vyšetřujícím [1].
Za těžkou stenózu se pokládají stavy, kde střední gradient převyšuje 40 mm Hg, vrcholový „peak to peak“ gradient 60 mm Hg a maximální gradient s pomocí dopplerovské echokardiografie bývá v těchto případech nad 65 mm Hg (tab. 1).
Table 1. Klasifikace závažnosti aortální stenózy u nemocných s hemodynamicky vyrovnaným stavem (normální průtoky, normální srdeční frekvence) – upraveno podle [1,2]. ![Klasifikace závažnosti aortální stenózy u nemocných s hemodynamicky vyrovnaným stavem (normální průtoky, normální srdeční frekvence) – upraveno podle [1,2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ec408470caa53fdfaed088a255db94de.png)
Jak bylo uvedeno výše, střední gradient lze zjistit bez problémů echokardiograficky i katetrizačně, zatímco „peak to peak“ gradient lze změřit pouze z tlakových hodnot při katetrizaci. Echokardiograficky zjišťujeme pomocí Vmax hodnoty maximálního gradientu. Samotná maximální rychlost průtoku přes aortální chlopeň (Vmax) je u významných stenóz nad 4 m/ s, podobně jako poměr Vmax/ VLVOT, který rovněž přesahuje 4.
Při kvantifikaci AS se můžeme dopustit chyby buď u nemocných s dysfunkcí levé komory (EF < 35 %) a nízkým tlakovým gradientem (střední gradient < 30 mm Hg), nebo naopak u „pseudostenózy“, přesněji pseudovýznamné stenózy. Oba stavy lze správně rozpoznat s užitím zátěžové echokardiografie.
Přirozený vývoj
AS je dlouho asymptomatická, v tomto stadiu má i u významných vad dobrou prognózu, riziko náhlé smrti je 0,3 – 1 % [6,8]. Je však nutno u těchto významných vad počítat s progresí a objevením symptomů za 2 – 5 let [8]. U významnějších vad může dojít rychle i k srdeční dekompenzaci při přidruženém onemocnění (infekční a jiné). Po vzniku symptomů se riziko náhlé smrti prudce zvyšuje, průměrné přežití bez operace je 2 – 3 roky.
Rychlost v aortě narůstá u stenóz o 0,24 ± 0,3 m/ s za rok [2,9], plocha ústí klesá přibližně o 0,1 cm2 za rok, gradient narůstá o 7 mm Hg ročně [1]. K urychlení celého procesu může dojít u nemocných starších 50 let s renální insuficiencí, výraznými kalcifikacemi a ischemickou chorobou srdeční [9,10].
Asymptomatičtí pacienti se středně významnou stenózou by měli být kontrolováni kardiologicky a echokardiograficky 1krát ročně, u lehčích vad postačuje kontrola jednou za 2 – 3 roky [11]. Samozřejmě však ve frekvenci kontrol hrají roli kromě významnosti vady i další faktory, jako funkce levé komory, přítomnost dilatace aorty, dalších vad, plicní hypertenze [2]. Nově se objevivší symptomy, především u těžké AS, jsou indikací k časné kontrole a léčbě v kardiocentru a většinou též k zásadnímu urychlení indikace ke kardiochirgickému výkonu. U bikuspidálních vad by měli být vyšetřeni i pokrevní příbuzní.
Léčba
Největší počet pacientů s AS absolvuje terapii kardiochirurgickou – náhradu aortální chlopně. Tato terapie přináší zásadní zlepšení životní prognózy těžkých symptomatických vad, a to i u pacientů v 8. a 9. deceniu [1]. V úvahu přichází ještě provedení katetrizační implantace chlopně. Balónková valvuloplastika se dnes neprovádí nebo jen zcela výjimečně.
Konzervativní léčba může sloužit nanejvýše jako dočasné řešení. Nemocní s dyslipidemií by měli být zaléčeni statiny podle vžitých zásad, avšak terapie statiny by neměla být podávána pouze s cílem zpomalit progresi vady, neboť to nebylo jednoznačně prokázáno [1]. Je na místě i intervence dalších rizikových faktorů, pokud jsou přítomny. Samozřejmostí je symptomatická léčba u indikovaných nemocných – zvláště diuretika, v indikovaných případech i antiarytmická léčba. Výše uvedená terapie však – na rozdíl od operace – neovlivňuje prognózu. Aortální stenózy se týká i profylaxe infekční endokarditidy podle publikovaných doporučení [14].
Náhrada aortální chlopně se provádí za přesně definovaných kritérií, neboť předčasná indikace může pacienta poškodit (namísto rizika náhlé smrti v 1 % ročně připravujeme riziko operační mortality 2 – 3 %) [15], na druhou stranu po objevení symptomů u těžké vady by se operace neměla dále odkládat [1]. U pacientů mladších 65 let se používá mechanická (nejčastěji dvoudisková) protéza, která vyžaduje doživotní antikoagulační léčbu. U pacientů starších 65 let nebo u těch, u kterých je antikoagulační léčba kontraindikována, se používají bioprotézy. Výhodou bioprotéz je možnost užívání antiagregační léčby, nevýhodou je riziko degenerace chlopně asi za 15 let od operace (nebo i dříve). Ojediněle se provádí Rossova operace (aortální chlopeň se nahradí vlastní plicnicovou chlopní a místo ní se implantuje homograft nebo bioprotéza) nebo náhrada nemocné chlopně homograftem (speciálně upravená aortální chlopeň zemřelého dárce, upřednostňuje se u chlopní postižených infekční endokarditidou).
Náhrada aortální chlopně je vždy indikována u těžké stenózy provázené symptomy (dušnost, bolesti na hrudi, synkopy). U těžkých symptomatických AS s nízkým gradientem (střední < 30 mm Hg) při závažnější dysfunkci levé komory (EF < 35 %) je na místě provedení koronarografie a nejlépe i zátěžové dobutaminové echokardiografie. U zachovalé kontraktilní rezervy (vzestup ejekční frakce ≥ 10 %) je benefit z operace obvykle jednoznačný (funkce levé komory se u většiny pacientů zlepší). I u pacientů bez kontraktilní rezervy však může dojít po operaci k zlepšení funkce, i když operační riziko je zde velmi výrazně vyšší.
Asymptomatická AS má poměrně dobrou prognózu, i pokud je významná, obvykle se tedy neoperuje, vždy však vyžaduje velmi pečlivé kardiologické a echokardioagrafické kontroly. Operace je u asymptomatických nemocných s těžkou AS indikována při poklesu ejekční frakce pod 50 % a pochopitelně při objevení symptomů. Týká se to i symptomů, které se objeví v průběhu zátěžového testu včetně dalších jeho pozitivních známek (zvláště deprese ST, pokles TK, komorová tachykardie – viz výše). Operace by se měla zvážit i u nemocných s malým operačním rizikem v kombinaci s rychlejší progresí vady (uváděné progresí maximální transvalvulární rychlosti na aortálním ústí o ≥ 0,3 m/ s/ rok) s kritickou vadou (neindexovaná plocha < 0,6 cm2 a Vmax > 5,5 m/ s), nárůstem tlakového gradientu při zátěžovém testu > 20 mm Hg, u nemocných s těžkou hypertrofií (> 15 mm bez hypertenze) a výraznějším zvýšením natriuretických peptidů [1]. Vždy je však na místě pečlivý odběr anamnézy, možnost disimulace a podcenění symptomů samotným pacientem.
Především je však třeba si ujasnit, zda jde skutečně o asymptomatického pacienta. Výjimkou nejsou ani disimulující nemocní a dále pacienti, kteří se záměrně fyzicky nezatěžují, a tak ani nemohou své obtíže vyvolat. Na místě je pak provedení zátěžového testu u pacientů s významnější vadou. Celkově je patrná tendence rozšiřovat indikace operací více směrem k málo symptomatickým (a v některých situacích i k zdánlivě asymptomatickým) nemocným (především u progredujících a těžce kalcifikovaných vad) [2,8]. To vše se samozřejmě týká pouze významných AS.
Těžká plicní hypertenze je rizikovým faktorem operačních komplikací i mortality, příznivý výsledek operace však převažuje i zde nad vyšším operačním rizikem [15,17].
Dilatace vzestupné aorty není ani u AS nijak výjimečným nálezem, dřívější názory o tom, že jde o „postenotickou“ dilataci, související pouze s významností vlastní stenózy, nebyly jednoznačně potvrzeny [18]. Pro operaci je z tohoto hlediska důležité vědět, zda vzniká při AS vrozené s bikuspidální aortální chlopní, jejíž nositelé jsou ohroženi 5 – 9krát větším rizikem ruptury či disekce než ostatní populace [18]. Vzniká zde zřejmě z důvodu odlišné vrozené histologické stavby stěny aorty (cystická medionekróza připomíná Marfanův syndrom) [18], pokračuje i po náhradě chlopně, a proto jsou kritéria pro náhradu vzestupné aorty v případě Marfanova syndromu a bikuspidální aortální chlopně přísnější než u zbytku populace. K operaci je indikována dilatace kořene > 45 mm u Marfanova syndromu s rizikovými faktory (rodinná anamnéza disekce, nárůst > 2 mm/ rok, těžká mitrální nebo aortální insuficience, plánovaná gravidita), > 50 mm u bikuspidální aorty s rizikovými faktory (koarktace aorty, systémová hypertenze, rodinná anamnéza disekce, nárůst > 2 mm/ rok), > 55 u trojcípé aortální chlopně [1].
Nejlepší výsledky na náhradě aortální chlopně lze pozorovat u mladších nemocných s větším rozměrem aortální náhrady [6]. Naopak v případech úzkého aortálního anulu, kdy je nutno implantovat malou aortální protézu, může dojít k situaci, kdy efektivní plocha ústí může být příliš malá na povrch těla pacienta (ten může být naopak velký). Výsledkem je vznik tzv. „patient – prosthesis mismatch“ (PPM) s následným vznikem tlakového gradientu na dobře fungující implantované protéze [15]. V žádném případě nejde o okrajový problém – může postihovat více než 1/ 3 operovaných a může být spojen s vyšší operační mortalitou po operací AS (zejména pacientů s dysfunkcí levé komory) a s pomalejší regresí hypertrofie myokardu [15]. Přesná diagnostika PPM se děje s pomocí efektivní plochy ústí (EOA), a to po její indexaci na tělesný povrch [19]. Její hodnota ≤ 0,85 cm2/ m2 je pokládána za hranici pro PPM u aortální chlopně [19], těžký PPM je charakterizován jako EOA < 0,65 cm2/ m2. V pásmu 0,65 – 0,85 se nacházejí nemocní se středně těžkým PPM.
Při nutnosti aortokoronárního bypassu bývá obvyklé provést náhradu i u jen středně významné AS (střední gradient 25 – 40 mm Hg, AVA 1,0 – 1,5 cm2), rozhodnutí je však individuální s tím, že současnou aortální náhradu volíme zejména u nemocných mladších 70 let nebo s progredujícím chlopenním postižením [1]. Významnost současné mitrální insuficience u těžké AS bývá obvykle nadhodnocena, mitrální chlopeň se operuje většinou pouze při jejím organickém postižení (ruptura šlašinek, prolaps, infekční endokarditida, dilatace mitrálního anulu a jiné), v případech sekundárních postižení se její operace většinou neprovádí, neboť po řešení AS dochází zpravidla k jejímu zlepšení.
Katetrizační implantace aortální chlopně (TAVI – Transcatheter Aortic Valve Implantation) je zákrok sloužící jako určitá alternativa aortální náhrady především u nemocných s těžkou symptomatickou aortální stenózou, pro něž představuje kardiochirurgický zákrok významné riziko. Většinou se to týká velmi starých polymorbidních nemocných. Je to relativně nová metoda, která byla poprvé použita v roce 2002 a od té doby se poměrně široce rozšířila jako alternativní léčba těžké symptomatické aortální stenózy u pacientů s vysokým operačním rizikem. V klinické praxi jsou v současné době používané 2 systémy – balónkem expandovaná chlopeň Edwards Sapien a samoexpandibilní chlopeň Cor Valve.
Na druhou stranu je však perkutánní implantace kontraindikována u pacientů s očekávaným přežitím méně než 1 rok, dále u nemocných, u nichž nelze předpokládat zlepšení kvality života z důvodu přidružených chorob. Je však i celá řada dalších anatomických kontraindikací (příliš malý, nebo naopak příliš velký anulus, trombus v levé komoře, infekční endokarditida a řada dalších stavů, k jejichž podrobnostem zde nelze zacházet).
Balónková aortální valvuloplastika je paliativní rizikový zákrok s vysokým výskytem symptomatických restenóz již v 1. roce pro provedené plastice, navíc nezlepšuje prognózu nemocných [4], na rozdíl od valvuloplastiky mitrální byla již téměř opuštěna. Příčinou jsou těžké kalcifikace cípů aortální chlopně, které nedovolují jejich volný pohyb – balónková valvuloplastika nechává komisury ve stejném stavu, způsobuje však frakturaci chlopenních kalcifikátů, její účinek je dočasný [1,6].
Table 2. Indikační kritéria k operaci stenózy aorty – upraveno podle [1,6]. ![Indikační kritéria k operaci stenózy aorty – upraveno podle [1,6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7fc866e0f93f8a33aa69f39eccd85ab2.png)
prof. MU Dr. Pavel Gregor, DrSc.
www.fnkv.cz
e‑mail: pavel.gregor@fnkv.cz
Doručeno do redakce: 30. 11. 2012
Přijato po recenzi: 16. 1. 2013
Sources
1. Vahanian A, Alfieri O, Andreotti F et al. Guidelines on the management of valvular heart disesase (Version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology and the European Association for Cardio - Thoracic Surgery. Eur Heart J 2012; 33 : 2451 – 2496.
2. Linhartová K, Benešová M, Čerbák R et al. Etiologie chlopenních vad. In: Čerbák R (ed.) Nejčastější chlopenní vady: aortální stenóza a mitrální insuficience. Praha: Galén 2007, s. 188.
3. Vahanian A, Iung B, Pierard E et al. Valvular heart disease. In: Camm AJ, Lüscher TF, Serruys PW (ed.) The ESC Textbook of Cardiovascular Medicine. European Society of Cardiology, Blackwell Publishing 2009, 625 – 670.
4. Veselka J, Honěk T, Špatenka J et al. Získané chlopenní vady srdce. Praha: Medcor 2000, 59 – 84.
5. Gregor P, Widimský P et al. Kardiologie. Praha: Galén 1999, s. 595.
6. Popelová J, Benešová M, Brtko M et al. Doporučené postupy pro diagnostiku a léčbu chlopenních srdečních vad v dospělosti. Guidelines ČKS. Cor Vasa 2007; 49: K195 – K234.
7. Niederle P et al. Echokardiografie. Praha: Triton 2002, s. 359.
8. Pellika PA, Sarano ME, Nishimura RA et al. Outcome of 622 adults with asymptomatic, hemodynamically significant aortic stenosis prolonged follow‑up. Circulation 2005; 111 : 3290 – 3295.
9. Palta S, Pai AM, Gill KS et al. New insights into the progression of aortic stenosis: implications for secondary prevention. Circulation 2000; 101 : 2407 – 2502.
10. Rosenhek R, Klaar U, Schemper M et al. Mild and moderate aortic stenosis: natural history and risk stratification by echocardiography. Eur Heart J 2004; 25 : 199 – 205.
11. Otto CM Valvular Heart Diseases. Philadelphia: WB Saunders Comp 1999.
12. Bonow RO, Carabello BA, Chatterjee K et al. ACC/ AHA 2006 guidelines for the management of patients with valvular heart disease. J Am Coll Cardiol 2006; 48 : 1 – 148.
13. Conolly HM, Oh JK, Schaff HV et al. Severe aortic stenosis with low transvalvular gradient and severe left ventricular dysfunction. Result of aortic valve replacement in 52 patients. Circulation 2000; 101 : 1940 – 1946.
14. Beneš J, Gregor P, Mokráček A. Infekční endokarditida: doporučené postupy diagnostiky a léčby, dispenzarizace a profylaxe. Cor Vasa 2007; 49: K157 – K171.
15. Dominik J, Černý J. Novinky v operační léčbě chlopenních vad. In: Čerbák R (ed.) Nejčastější chlopenní vady: aortální stenóza a mitrální insuficience. Praha: Galén 2007 : 111 – 119.
16. Čerbák R. Změna indikačních kriterií k operaci. In: Čerbák R (ed.) Nejčastější chlopenní vady: aortální stenóza a mitrální insuficience. Praha: Galén, 2007 : 105 – 110.
17. Čerbák R, Bedáňová H, Bočková I et al. Plicní hypertenze u aortální stenózy. Cor Vasa 2004; 46 : 326 – 330.
18. Linhartová K, Beránek V, Šetrná F et al. Aortic stenosis severity is not a risk factor of poststenotic dilatation of the ascending aorta. Circ J 2007; 1 : 84 – 88.
19. Pibarot P, Dumesnil JG. Prosthesis - patient mismatch: definition, clinical impact, and prevention. Heart 2006; 92 : 1022 – 1029.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 4-
All articles in this issue
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
- Oxidační stres u pacientů po transplantaci ledviny
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- Kazuistika získané hemofilie A
- Využití vildagliptinu z pohledu interního lékaře
- PET-CT dokumentovaný rychlý nástup léčebné odpovědi cyklofosfamidu, thalidomidu a dexametazonu u multicentrické formy Castlemanovy nemoci. Popis případu a přehled informací o léčbě
- Změny hmotnosti a kompenzace diabetu (HbA1c) u nemocných s diabetes mellitus 2. typu po přidání exenatidu (Byetta) ke stávající léčbě ve 28 diabetologických ambulancích v ČR – studie BIBY‑II (sledování 24 měsíců)
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Kteří příbuzní prvního stupně nemocných s kolorektálními neoplaziemi jsou nejvíce ohroženi
- Přínos systému vzdáleného sledování v dlouhodobé péči o pacienty s implantabilními kardiovertery‑ defibrilátory
- Aortální stenóza
- Tuberkulóza v České republice. Současný stav. Diagnóza, léčba, prevence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aortální stenóza
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


