-
Medical journals
- Career
Rizikové faktory rekurentního a těžkého průběhu kolitidy vyvolané infekcí Clostridium difficile
Authors: L. Vojtilová 1; M. Pýchová 1; M. Freibergerová 1; J. Juránková 2; Z. Bortlíček 3; P. Husa 1
Authors‘ workplace: Klinika infekčních chorob Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Petr Husa, CSc. 1; Oddělení klinické mikrobiologie FN Brno, pracoviště Bohunice, přednostka prim. MUDr. Alena Ševčíková 2; Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty MU Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 3
Published in: Vnitř Lék 2013; 59(1): 23-30
Category: Original Contributions
Overview
Cíl práce:
Popsat rizikové faktory rekurentního průběhu a těžké formy infekce Clostridium difficile (CDI) v souboru pacientů hospitalizovaných na Klinice infekčních chorob FN Brno, pracoviště Bohunice.Materiál a metody:
Retrospektivní sledování epidemiologických, klinických a laboratorních dat 281 pacientů s prokázanou diagnózou infekce Clostridium difficile hospitalizovaných v období od 1. 1. 2007 do 31. 12. 2010.Výsledky:
Do první části hodnocení bylo zařazeno 233 pacientů, z nichž 87 (37,3 %) mělo záznam o rekurenci onemocnění a 146 (62,7 %) pacientů bylo bez rekurence CDI. Faktory spojené s rekurencí zahrnují 2 a více komorbidit, předchozí hospitalizaci v období 4 týdnů před začátkem CDI, užívání blokátorů protonové pumpy. Do druhé části hodnocení bylo zařazeno všech 281 pacientů, z toho těžký průběh CDI během kterékoliv epizody onemocnění byl zaznamenán u 181 (64,4 %), zbylých 100 (35,6 %) pacientů mělo lehký nebo středně těžký průběh CDI. Rizikovým faktorem vzniku těžké CDI je věk pacienta nad 65 let, anamnéza ischemické choroby srdeční, chronické renální insuficience, kombinace 2 a více komorbidit, předchozí hospitalizace v období 4 týdnů.Závěr:
Věk pacienta nad 65 let je rizikem pro těžký průběh CDI. Pacient s 2 a více komorbiditami nebo s anamnézou předchozí hospitalizace je rizikový jak pro rekurenci onemocnění, tak pro jeho těžký průběh. Užívání blokátorů protonové pumpy může vést k rekurenci, pravděpodobně na základě reinfekce spórami Clostridium difficile.Klíčová slova:
infekce Clostridium difficile – rizikové faktory rekurence CDI – rizikové faktory těžkého průběhu CDIÚvod
Toxigenní kmeny anaerobní bakterie Clostridium difficile jsou za určitých okolností vyvolavatelem průjmových onemocnění u lidí, i když klostridia patří k běžným komenzálům sliznice tlustého střeva. Klinicky se infekce Clostridium difficile (CDI – Clostridium difficile infection) projevuje jako akutní průjmové onemocnění s četnými průjmy, u nejtěžších forem jako ileus nebo toxické megakolon s vysokou mortalitou. Diagnóza je potvrzena průkazem toxigenního kmene Clostridium difficile ze stolice pacienta (pokud není prokázána jiná příčina průjmového stavu) nebo kolonoskopickým obrazem pseudomembranózní kolitidy. Onemocnění je spojeno s častými a opakovanými relapsy, které mohou vést k vyčerpání a smrti pacienta.
V zahraničí jsou zvýšená incidence a závažnější průběh onemocnění hlášeny od roku 2003. V této souvislosti byly identifikovány epidemické kmeny Clostridium difficile se zvýšenou produkcí toxinů, větší odolností spór a rezistencí vůči různým antibiotikům. V Severní Americe byl pomocí metody PCR ribotypizace jako nejčastější určen kmen 027. Ribotypy 001, 002, 014, 078 patří k nejčastějším epidemickým kmenům v Evropě [1–4]. Podle studie proběhlé v roce 2008 v 34 zemích Evropy se obávaný epidemický ribotyp 027 vyskytl jen v 5 % případů [4]. Z Kliniky infekčních chorob (KICH) FN Brno, pracoviště Bohunice, byly kultivovány a odeslány na ribotypizaci celkem 4 vzorky stolic od pacientů s těžkým průběhem onemocnění. Ribotypizace byla provedena v Ústavu lékařské mikrobiologie FN Motol v Praze, kde byl u všech identifikován ribotyp 176. Nepatří tedy ke zmiňovaným nejčastějším epidemickým kmenům v Evropě. Ribotyp 176 byl kromě České republiky detekován i během epidemií v Polsku. Analýza ribotypu 176 poukazuje na podobnost s epidemickým ribotypem 027. Oba ribotypy se vyznačují přítomností genu pro binární toxin a delecí nukleotidu 117 v rámci regulačního genu kódujícího negativně produkci toxinů [5]. Ochromení down-regulace produkce toxinů A a B vede in vitro k 16–23násobnému vzestupu jejich produkce [6].
Rizikové faktory vzniku CDI jsou dobře popsány. Patří k nim střevní dysmikrobie po předchozím užívání antibiotik, věk pacienta nad 65 let, polymorbidita, poruchy celkové a zejména střevní slizniční imunity. Předchozí hospitalizace významně ohrožuje pacienta kolonizací nemocničními kmeny Clostridium difficile. Méně jsou však popsány faktory predisponující k rekurentnímu nebo těžkému průběhu CDI, na které je zaměřena tato práce.
Rekurence, zejména vícečetné, patří k zásadním problémům léčby CDI. Po zvládnutí akutního stavu trvá ještě několik týdnů střevní dysmikrobie a je zvýšené nebezpečí reinfekce a nového pomnožení toxigenních kmenů ze spór přežívajících ve střevě (relaps).
Principy léčby CDI zůstávají podle nejnovějších doporučení nezměněny. U první epizody nebo první rekurence CDI s lehkým a středně těžkým průběhem se podává metronidazol 500 mg à 8 hod perorálně nebo intravenózně 10–14 dní. Při těžké formě CDI je indikován vankomycin 125 mg à 6 hod perorálně samostatně nebo v kombinaci s metronidazolem v dávce 500 mg à 8 hod intravenózně, rovněž 10–14 dní. U druhé a další rekurence se po 10–14denním podávání vankomycinu nebo kombinace vankomycinu a metronidazolu pokračuje pulzním podáváním vankomycinu v sestupném dávkování po dobu 4 týdnů [7]. Lékem, který má prokazatelně lepší účinnost v léčbě rekurencí než vankomycin, je fidaxomicin, který působí selektivně na Clostridium difficile a střevní flóru ovlivňuje minimálně. Ke srovnání po fidaxomicinu je popsáno 15,4 % recidiv oproti 25,3 % recidiv po vankomycinu, (p = 0,005) [8,9]. I v recentním přehledu 11 studií srovnávajících léčbu CDI současnými antibiotiky nevychází žádné z antibiotik jednoznačně lépe v iniciální léčbě, avšak rekurence po fidaxomicinu jsou méně časté než po vankomycinu [10,11]. Rifaximin je diskutovanou alternativou léčby rekurencí, dosud však nebylo jeho srovnání s jinými antibiotiky při léčbě rekurencí doloženo kontrolovanými studiemi. Randomizovanou dvojitě zaslepenou studií je doložen pokles incidence rekurentního CDI po rifaximinu (15 %) ve srovnání s placebem (31 %), oba přípravky byly podávány po dobu 20 dnů po ukončení standardní antibiotické léčby akutního stavu [12]. Dalším přístupem v léčbě rekurencí CDI po selhání medikamentózní léčba je fekální bakterioterapie. U pacientů refrakterních na konvenční léčbu je jako adjuvantní terapie zkoušeno podávání lidského intravenózního imunoglobulinu, zatím je prokázán jen efekt u pacientů s hypogamaglobulinémií. Jsou zkoušeny lidské monoklonální protilátky proti toxinu A a B, perorální hyperimunní bovinní sérum a toxoidová vakcína [1].
Materiál a metody
Retrospektivní sledování hodnotí klinická a epidemiologická data pacientů s prokázanou diagnózou infekce Clostridium difficile hospitalizovaných v letech 2007–2010 na KICH FN Brno, pracoviště Bohunice.
Infekce byla potvrzena průkazem toxinů A a B ve stolici pacientů. U všech pacientů s endoskopicky diagnostikovanou pseudomembranózní kolitidou byl proveden i průkaz toxinu ve stolici. Při negativním nálezu toxinu a trvajícím klinickém podezření na probíhající CDI se vyšetření stolice několikrát opakovalo s odstupem minimálně 1 dne. U všech pacientů bylo provedeno i kultivační vyšetření stolice na obligátní střevní patogeny k vyloučení jiné infekční příčiny průjmů.
Do sledování nebyli zahrnuti pacienti, kteří měli CDI diagnostikovanou na jiném pracovišti, na KICH byli přijati pouze k terapii a laboratorní průkaz infekce se u těchto pacientů již neprováděl. Dále nebyli sledováni pacienti s CDI léčení na KICH ambulantně.
Mikrobiologické vyšetření se provádělo na Oddělení klinické mikrobiologie (OKM) FN Brno, pracoviště Bohunice. Toxiny A a B Clostridium difficile se v letech 2007–2009 prokazovaly metodou ELISA (Enzyme Linked Immunosorbent Assay) na přístroji mini-VIDAS firmy Bio-Merieux. V roce 2010 se používala metoda imunochromatografie Clostridium difficile Quik chek complete firmy Techlab.
Statisticky byl analyzován datový soubor 281 pacientů. Výsledková část je dělena do dvou kapitol. V 1. části je provedeno vyhodnocení predispozičních faktorů podle výskytu rekurence CDI, ve 2. části vyhodnocení podle závažnosti CDI. Při hodnocení rekurence CDI byli z porovnání vyjmuti pacienti, kteří mají záznam o jedné hospitalizaci a zároveň zemřeli během hospitalizace (n = 42), a stejně tak pacienti, u kterých došlo k úmrtí do 30 dnů od propuštění (n = 6). Celkem tedy bylo v 1. části analyzováno 233 pacientů. Do 2. části hodnocení bylo zahrnuto všech 281 pacientů. Kritéria pro těžký průběh CDI byla převzata z dokumentu Doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile, garantovaného Společností infekčního lékařství České lékařské společnosti J. E. Purkyně, Společností pro epidemiologii a mikrobiologii České lékařské společnosti J. E. Purkyně a Společností pro lékařskou mikrobiologii České lékařské společnosti J. E. Purkyně z roku 2012 [7]. Kritéria jsou shrnuta v tab. 1.
Table 1. Příznaky svědčící pro těžký průběh klostridiové kolitidy (převzaté z dokumentu Doporučený postup diagnostiky a léčby kolitidy vyvolané <i>Clostridium difficile</i> [7]). ![Příznaky svědčící pro těžký průběh klostridiové kolitidy (převzaté z dokumentu Doporučený postup diagnostiky a léčby kolitidy vyvolané <i>Clostridium difficile</i> [7]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/49ecc2e2e5520431a82c2e6c50daf9e6.png)
Pro jednotlivé parametry byla na základě jednorozměrné logistické regrese počítána odds ratio (OR) pro relaps onemocnění, respektive pro těžký průběh onemocnění. Příslušný odhad byl vždy doplněn o 95% interval spolehlivosti (IS) a hladinu významnosti p (Waldův test). Zvolená hladina významnosti testů je α = 0,05. V případě neuvedení referenční kategorie je vždy výsledek vztažen k doplňku pacientů do celkového souboru 233 (v 1. části) nebo 281 pacientů (ve 2. části). Při vyhodnocení laboratorních parametrů vzhledem k rekurenci CDI byla statistická významnost hodnocena neparametricky pomocí Mann-Whitneyho testu (M-W test).
Výsledky
V letech 2007–2010 bylo na KICH hospitalizováno 281 pacientů (106 mužů, 37,7 %) s CDI laboratorně prokázanou na OKM FN Brno. Věkový průměr všech pacientů byl 73,2 roku, s minimem 19 a maximem 99 let, věkový medián činil 79 let.
Predispoziční faktory pro vznik rekurence CDI
Po vyřazení 48 pacientů, u kterých nebyla rekurence možná pro úmrtí během první epizody CDI, bylo v této části analyzováno 233 pacientů, z nichž 87 (37,3 %) mělo rekurenci onemocnění a 146 (62,7 %) pacientů bylo bez rekurence CDI.
Ve věkové kategorii nad 65 let bylo celkem 174 pacientů, z toho 70 (40,2 %) mělo rekurenci, hodnota p = 0,119. Věk nad 65 let tedy nebyl v našem souboru rizikovým faktorem vzniku rekurence CDI, stejně jako pohlaví pacienta. Z komorbidit byl v anamnéze pacientů sledován výskyt ischemické choroby srdeční, diabetes mellitus, cévního onemocnění mozku, chronické renální insuficience, imobility pacienta, chronické obstrukční plicní nemoci a onkologického onemocnění. Při kombinaci 2 a více komorbidit bylo signifikantně vyšší riziko rekurence, p = 0,013 (tab. 2).
Table 2. Vyhodnocení rekurence CDI vzhledem ke vstupním charakteristikám pacientů. 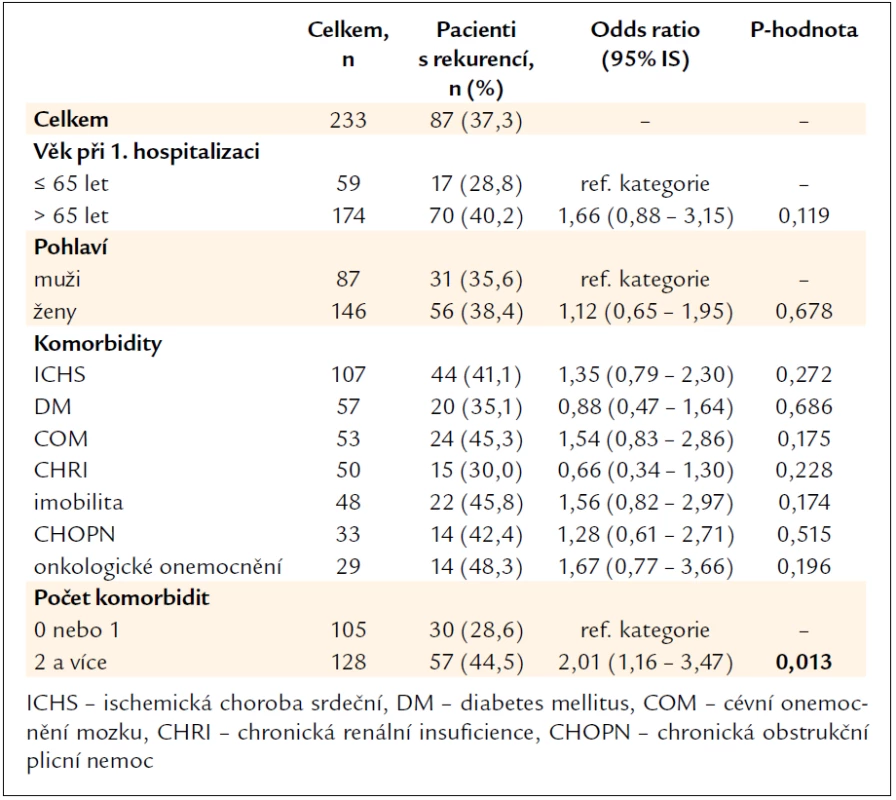
Významným rizikovým faktorem byla předchozí hospitalizace v nemocničním zařízení za poslední 4 týdny před vznikem CDI. Předtím hospitalizovaných bylo 149 pacientů, z toho rekurenci mělo 71 (47,7 %) pacientů, OR 3,87, IS 2,06–7,28, p < 0,001. Pobyt v penzionu nebo v domově důchodců nebyl rizikem pro rekurenci CDI, z celkem 24 pacientů, kteří před vznikem CDI pobývali v domově důchodců, mělo rekurenci (45,8 %) pacientů, p = 0,366.
Předchozí užívání antibiotik v období 2 měsíců před diagnózou CDI mělo v dokumentaci uvedeno 207 pacientů, z toho 82 pacientů užívalo 2 a více antibiotik. Jednotlivé skupiny antibiotik ani jejich kombinace nejsou ve vztahu ke vzniku rekurence CDI, jako rizikový se jeví důvod podání antibiotik pro infekci dutiny břišní (skupina onemocnění zahrnuje cholecystitidu, cholangoitidu, peritonitidu, apendicitidu, abscesy malé pánve), rekurenci mělo 10 (71,4 %) z celkem 14 pacientů, p = 0,008. Z dalšího pohledu měli častěji rekurenci pacienti, u kterých se příznaky průjmu objevily během 1. týdne od ukončení vyvolávající antibiotické léčby (tab. 3).
Table 3. Vyhodnocení rekurence CDI vzhledem k předchozí terapii. 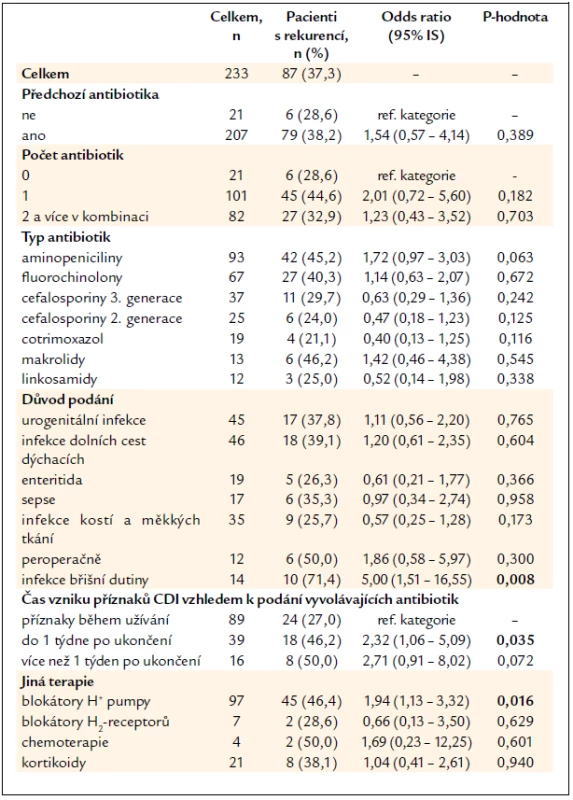
Sledováno bylo i předchozí užívání antiulcerózní terapie a léků snižujících imunitní odpověď organizmu. Z celého souboru pacientů užívalo blokátory protonové pumpy 97 pacientů, z toho rekurenci mělo 45 (46,4 %) pacientů, p = 0,016, užívání blokátorů protonové pumpy tedy zvyšovalo riziko rekurence onemocnění. Předchozí užívání blokátorů histaminových H2-receptorů, léčba systémovými kortikoidy v době vzniku CDI nebo užívání cytostatik za poslední 2 měsíce nemělo vliv na vznik rekurence CDI (tab. 3).
V našem souboru rozvoj nozokomiální klostridiové infekce poměrně překvapivě následně snižoval riziko rekurence onemocnění. CDI jako nozokomiální infekci na KICH akvírovalo 47 z 233 pacientů, z nichž rekurenci měli jen 4 (8,5 %) pacienti, OR 0,12, IS 0,04–0,33, p < 0,001.
Vyhodnocení rekurence CDI podle druhu a délky kauzální terapie první epizody onemocnění zobrazuje tab. 4, výsledky však nejsou jednoznačné (viz diskuze). Užívání probiotik jako podpůrné léčby při kauzální antibiotické terapii nebylo přínosem pro zamezení vzniku rekurence CDI.
Table 4. Vyhodnocení rekurence CDI podle kauzální terapie první epizody onemocnění. 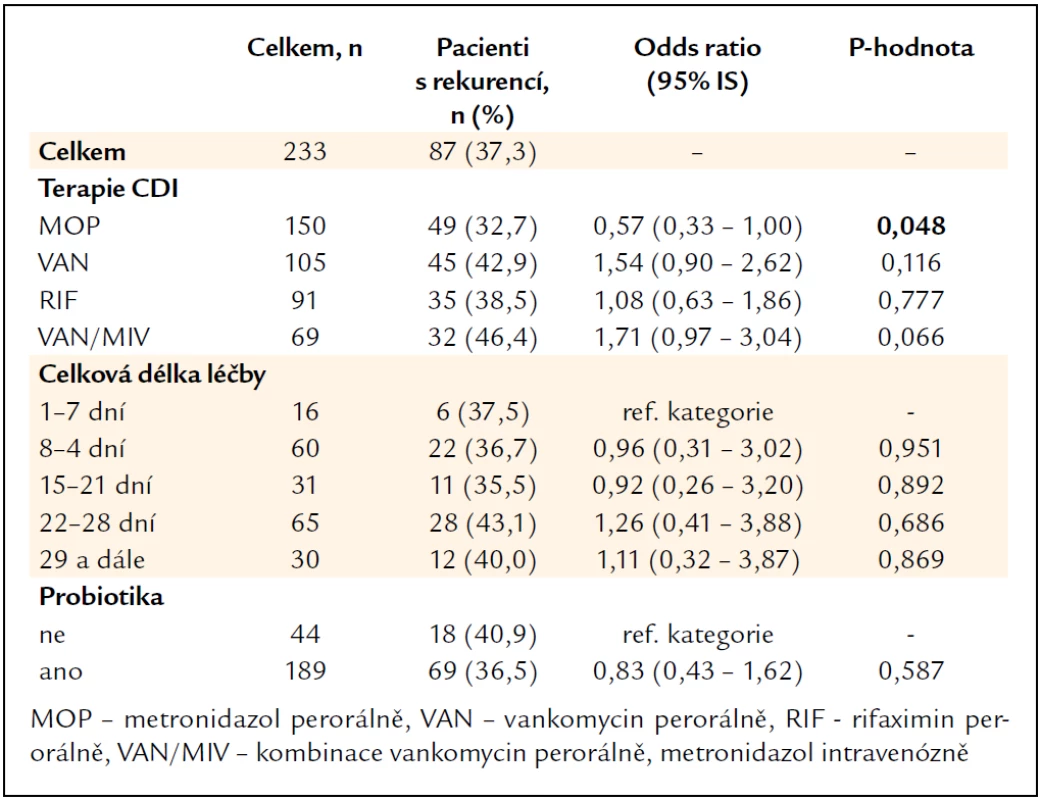
Laboratorní parametry pacientů, konkrétně hodnota leukocytů, neutrofilů v periferní krvi a kreatininu, C-reaktivního proteinu a prokalcitoninu v séru byly vyhodnoceny ve vztahu k rekurenci onemocnění. Statisticky signifikantně byly zvýšeny průměrné hodnoty neutrofilů u pacientů s rekurencí 14,1 × 109/l (medián 11,7 × 109/l) oproti pacientům bez rekurence (průměr 11,7 × 109/l, medián 9,6 × 109/l, p = 0,05). Ostatní laboratorní parametry nevykazovaly statisticky významné rozdíly mezi pacienty s rekurencí a bez rekurence (tab. 5).
Table 5. Vyhodnocení laboratorních parametrů vzhledem k rekurenci CDI. 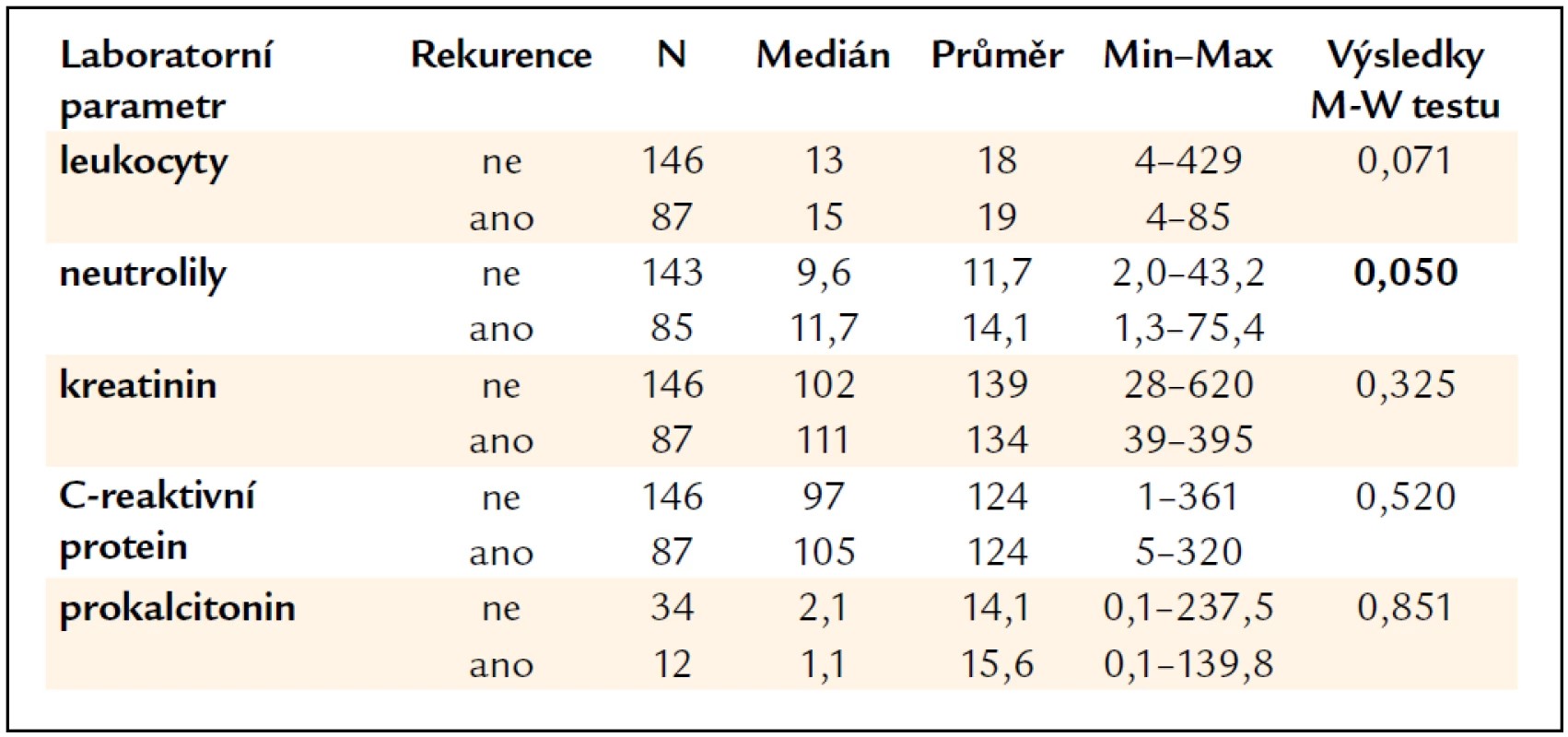
Predispoziční faktory pro vznik těžkého průběhu CDI
Do vyhodnocení bylo zahrnuto všech 281 pacientů, z toho těžký průběh CDI během kterékoliv epizody onemocnění byl zaznamenán u 181 (64,4 %) pacientů, zbylých 100 (35,6 %) pacientů mělo lehký nebo středně těžký průběh CDI.
Jednoznačně rizikovým faktorem vzniku těžké CDI byl věk pacienta nad 65 let, z celkem 216 pacientů nad 65 let jich mělo 152 (70,4 %) těžký průběh, p < 0,001. Pohlaví pacienta nebylo ve vztahu k tíži onemocnění. Ze sledovaných komorbidit vycházela jako riziková skupina pacientů s anamnézou ischemické choroby srdeční a chronické renální insuficience, pro vznik těžké CDI byly rovněž rizikoví pacienti s 2 a více komorbiditami (tab. 6).
Table 6. Vyhodnocení těžkého průběhu CDI vzhledem ke vstupním charakteristikám pacientů. 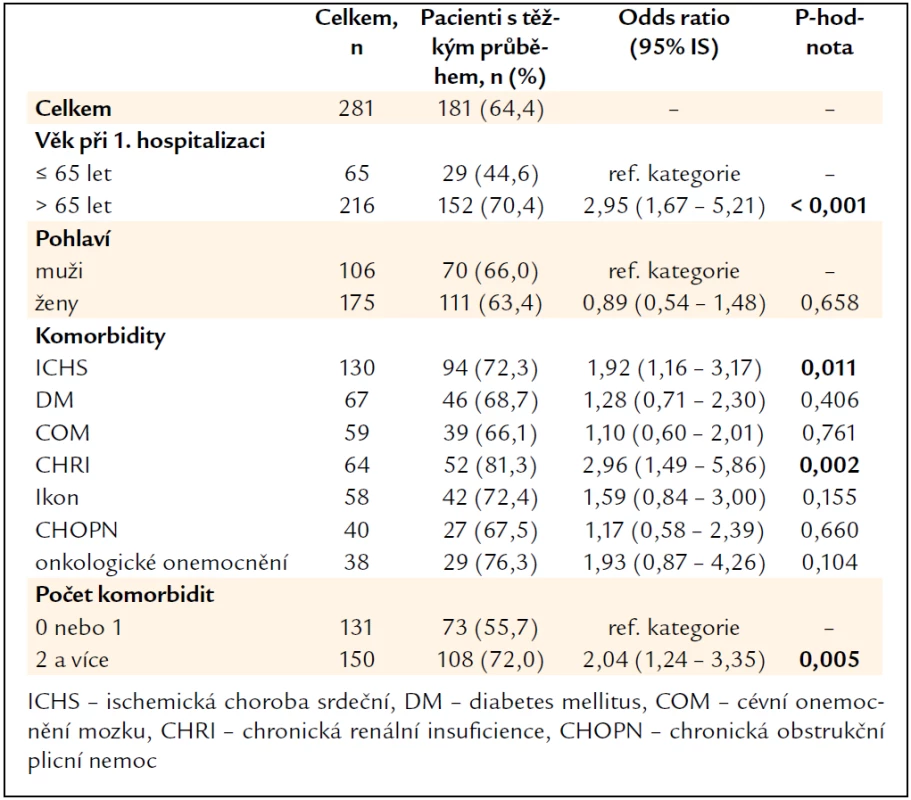
Pacienti, kteří byli hospitalizováni v intervalu 4 týdnů před vznikem CDI, měli častěji těžký průběh onemocnění. Ze 188 předtím hospitalizovaných pacientů mělo těžký průběh CDI 134 (71,3 %) pacientů, OR 2,43, IS 1,45–4,06, p = 0,001. Pobyt v penzionu nebo v domově důchodců nebyl rizikem ani pro těžkou CDI, z 31 pacientů z domova důchodců mělo těžký průběh 21 (67,7 %) pacientů, OR 1,18, IS 0,53–2,62, p = 0,682.
Předchozí užívání antibiotik jednotlivě, ani jejich kombinace nebyly rizikem pro vznik těžké CDI, častěji však byl zachycen těžký průběh po léčbě urogenitálních infekcí a po peroperačním podání antibiotik. Pacienti, u kterých se příznaky CDI projevily až po více než 1 týdnu od ukončení léčby, byli statisticky méně postiženi těžkým průběhem CDI než pacienti, kteří měli potíže již během léčby antibiotiky nebo do jednoho týdne po ní. Užívání antiulcerózní terapie, léčba systémovými kortikoidy v době vzniku CDI nebo užívání cytostatik za poslední 2 měsíce nemělo vliv na tíži CDI (tab. 7).
Table 7. Vyhodnocení těžkého průběhu CDI vzhledem k předchozí terapii. 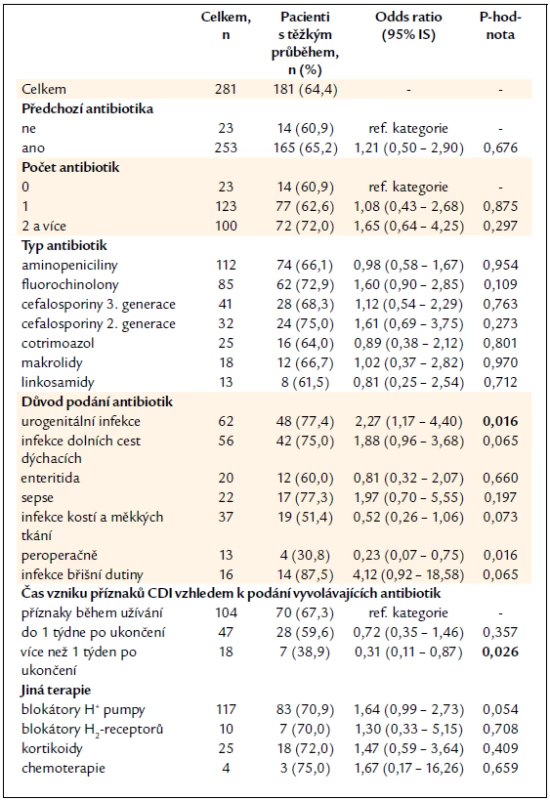
Diskuze
Během let 2007–2010 byl na KICH FN Brno, pracoviště Bohunice, zaznamenán výrazný vzestup počtu onemocnění CDI. Před rokem 2007 to byly jenom jednotlivé případy. Tento trend kopíruje výskyt CDI hlášených v České republice. Pro srovnání, studie autorů Polívková et al z Infekční kliniky FN na Bulovce v Praze zahrnovala 82 pacientů za období od 1. 1. 2008 do 30. 6. 2010 [13].
Průběh CDI u pacienta nad 65 let se již sám o sobě považuje za závažný i bez klinických známek těžké kolitidy, tento fakt se potvrdil i v našem hodnocení. Věk nad 65 let nebyl významný pro riziko rekurence CDI. Počet komorbidit v anamnéze je úměrný věku pacientů, proto kombinace 2 a více sledovaných komorbidit je rizikem jak rekurence, tak těžkého průběhu CDI. Předpokládaný vliv imobility pacienta na rekurenci či těžký průběh CDI se v naší studii nepotvrdil.
V literatuře se CDI rozděluje na nemocniční (vznik po 48 hod od přijetí do nemocnice), komunitně vzniklou spojenou s předchozí hospitalizací (do 4 týdnů po předchozí hospitalizaci) a komunitní (vzniklou více než 12 týdnů od předchozí hospitalizace). Období vzniku 4–12 týdnů po předchozí hospitalizaci se označuje jako neurčité [14]. Ve vyšetřovaném souboru je významným rizikovým faktorem rekurence i tíže CDI předchozí hospitalizace v období 4 týdnů. Pobyt v penzionu nebo domově důchodců bez předchozí hospitalizace není podle našich výsledků rizikem pro vznik CDI. Asymptomatické nosičství Clostridium difficile ve stolici bylo popsáno u 10 % obyvatelů zařízení pro seniory v Irsku, 7 % bylo toxin pozitivních [15]. Údaje o nosičství v naší zemi známé nejsou.
Užívání antibiotik je považováno za nejzávažnější rizikový faktor pro kolonizaci střeva kmeny Clostridium difficile. Nejrizikovější skupinou antibiotik jsou linkosamidy, aminopeniciliny, cefalosporiny a fluorochinolony. Za relativně bezpečnou skupinu antibiotik se považují aminoglykosidy, cotrimoxazol, základní peniciliny, karbapenemy a tetracykliny [16–18]. Užívání žádné konkrétní vyvolávající skupiny antibiotik nelze dát, podle našich výsledků, do souvislosti s rizikem rekurence či těžkého průběhu CDI, i když na menším souboru pacientů ve Spojených státech amerických bylo užívání fluorochinolonů popsáno jako rizikový faktor relabující CDI [19]. Podání antibiotik na infekci dutiny břišní souvisí s rozvojem rekurence spíše pro poruchu motility střevních kliček při infekci než pro dysmikrobii vyvolanou podaným antibiotikem. Podobně lze vysvětlit statisticky významný výsledek vzniku těžké CDI po peroperačním podávání antibiotik, kdy těžký stav pacienta je následkem operace a nikoliv následně akvírované CDI. Vysoký výskyt závažných forem CDI po antibiotickém přeléčení urogenitálních infekcí je možný v souvislosti s jejich častou léčbou fluorochinolony, i když v našem souboru se fluorochinolony samotné jako rizikový faktor neprokázaly.
Snížená kyselost žaludečního sekretu predisponuje k řadě střevních infekcí. Užívání blokátorů protonové pumpy některé studie uvádějí jako rizikový faktor, jiné to však nepotvrdily [20–23]. Howell et al dokládají zvýšené riziko nozokomiální infekce Clostridium difficile v závislosti na farmakologické supresi tvorby žaludeční kyseliny [20]. Další studie, čítající 125 pacientů, identifikuje jako signifikantní rizikový faktor rekurence CDI užívání blokátorů protonové pumpy (OR 3,48, IS 1,64–7,69, p = 0,016), stejně jako věk nad 65 let a nízkou hladinu sérového albuminu (< 25 g/l) [24]. Námi prokázaný vztah užívání blokátorů protonové pumpy k riziku rekurence CDI ukazuje spíše na reinfekci Clostridium difficile než na relaps předchozího onemocnění. Nemocný s klostridiovou kolitidou vylučuje milióny spór v každém mililitru průjmové stolice a kontaminuje jimi své okolí. K opětovnému rozvoji infekce proto u disponovaných osob dochází velmi snadno. Je důležité si uvědomit, že příčinou těchto rekurencí není selhání poskytnuté antibiotické léčby v důsledku rezistence klostridií [7].
Rychlá diagnostika a adekvátní léčba přímo na specializovaném pracovišti v případě nozokomiálně akvírovaných CDI na KICH vysvětluje nízké procento následných rekurencí. Tento fakt poukazuje na nezbytnou surveillance zejména na odděleních s vyšším rizikem vzniku onemocnění (interní oddělení, oddělení břišní chirurgie, urologie, onkologie a další).
Vyhodnocení vztahu rekurence CDI k druhu použité kauzální léčby první epizody CDI nebylo průkazné, interferuje s tíží CDI a stavem pacienta, podle kterého se volila daná kombinace léčiv nebo délka užívání. Tedy protektivně se jevící léčba perorálním metronidazolem spíše souvisí s indikací u lehkého nebo středně těžkého průběhu CDI. Naproti tomu kombinace perorálního vankomycinu a parenterálního metronidazolu indikovaná u těžkých případů CDI vycházela jako riziková kombinace léčiv pro vznik rekurence CDI. Efekt probiotik v primární či sekundární prevenci CDI nebyl dosud přesvědčivě doložen, i naše výsledky se s tím shodují. Naproti tomu je zde možnost poškození pacienta při bakteriemii (Lactobacillus spp.) nebo fungemii (Saccharomyces boulardii) [16,18,21,25].
Z laboratorních parametrů s tíží onemocnění a prognózou koreluje především leukocytóza s výrazným posunem doleva, výše C-reaktivního proteinu v případě CDI takovou výpovědní hodnotu nemá. CDI s leukocytózou přes 20 × 109/l je spojeno s vyšší úmrtností, komplikovaným průběhem, je často refrakterní na léčbu a má vyšší riziko rekurence [4]. V našich výsledcích se potvrdilo zvýšení průměrné hodnoty neutrofilů u pacientů s rekurencí. Limitací hodnocení laboratorních parametrů je, že nejsou hodnoceny vstupní parametry při příjmu pacienta, protože část pacientů byla přeložena z jiných oddělení na KICH a byla již antibiotiky léčena. Zaznamenány jsou nejvyšší laboratorní parametry dosažené v průběhu všech hospitalizací pro CDI na KICH. Nelze tedy uzavřít, že pacienti s vstupní hodnotou neutrofilů přes 14,1 × 109/l jsou více disponováni ke vzniku rekurence CDI.
Závěr
Z retrospektivního sledování klinických a epidemiologických dat pacientů hospitalizovaných na KICH s prokázanou diagnózou infekce Clostridium difficile v letech 2007–2010 vyplývají tyto závěry:
- Věk pacienta nad 65 let je rizikem pro těžký průběh CDI.
- Pacient s 2 a více komorbiditami nebo s anamnézou předchozí hospitalizace (4 týdny před vznikem CDI) je rizikový jak pro rekurenci onemocnění, tak pro jeho těžký průběh.
- Užívání blokátorů protonové pumpy může zvyšovat počet rekurencí, pravděpodobně na základě reinfekce spórami Clostridium difficile. V průběhu léčby CDI je vhodné vysazení nebo dočasné přerušení užívání léků tlumících žaludeční aciditu, samozřejmě s přihlédnutím k jejich indikaci. Řetězec reinfekcí lze přerušit nezbytnou izolací nemocných, používáním bariérové ochrany a jednorázových pomůcek. Nezbytnou součástí je pravidelná hygiena rukou personálu (nepoužívat roztoky na bázi alkoholu) a dezinfekce povrchů sporicidními prostředky.
MUDr. Lenka Vojtilová
www.fnbrno.cz
e-mail: lvojtilova@fnbrno.cz
Doručeno do redakce: 10. 10. 2012
Přijato po recenzi: 27. 11. 2012
Sources
1. Kuijper EJ, van Dissel JT, Wilcox MH. Clostridium difficile: changing epidemiology and new treatment options. Curr Opin Infect Dis 2007; 20 : 376–383.
2. Cheknis AK, Sambol SP, Davidson DM et al. Distribution of Clostridium difficile strains from a North American, European and Australian trial of treatment for Clostridium difficile infections: 2005–2007. Anaerobe 2009; 15 : 230–233.
3. Akerlund T, Alefjord I, Dohnhammar U et al. Geographical clustering of cases of infection with moxifloxacin-resistant Clostridium difficile PCR – ribotypes 012, 017 and 046 in Sweden, 2008 and 2009. Euro Surveill 2011; 16: pii=19 813.
4. Bauer MP, Notermans DW, van Benthem BH et al. Clostridium difficile infection in Europe: a hospital-based survey. Lancet 2011; 377 : 63–73.
5. Nyč O, Pituch H, Matějková J et al. Clostridium difficile PCR ribotype 176 in the Czech Republic and Poland. Lancet 2011; 377 : 1407.
6. Razavi B, Apisarnthanarak A, Mundy LM. Clostridium difficile: emergence of hypervirulence and fluoroquinolone resistance. Infection 2007; 35 : 300–307.
7. Beneš J, Husa P, Nyč O. Doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile, dostupný na www.infekce.cz.
8. Louie TJ, Miller MA, Mullane KM et al. Fidaxomicin versus Vancomycin for Clostridium difficile Infection. N Eng J Med 2011; 364 : 422–431.
9. Hausmann J, Zeuzem S, Schröder O. Fidaxomicin – the next step? A new narrow-spectrum macrocyclic antibiotic for the management of Clostridium difficile infection. Gastroenterology 2011; 141 : 1116–1118.
10. Drekonja DM, Butler M, MacDonald R et al. Comparative Effectivenes of Clostridium difficile Treatments. Ann Intern Med. 2011; 155 : 839–847.
11. Cornely OA, Crook DW, Esposito R et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada and the USA: a double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis 2012; 12 : 281–289.
12. Garey KW, Ghantoji SS, Shah DN et al. A randomized, double-blinded, placebo-controlled pilot study to assess the ability of rifaximin to prevent recurrent diarrhoea in patients with Clostridium difficile infection. J Antimicrob Chemother 2011; 66 : 2850–2855.
13. Polívková S, Sýkorová B, Džupová O et al. Výskyt a charakter infekcí vyvolaných Clostridium difficile u pacientů s průjmovým onemocněním v pražské fakultní nemocnici. Klin mikrobiol inf lek 2010; 16 : 206–210.
14. Cohen SH, Gerding DN, Johnson S et al. Clinical Practice Guidelines for Clostridium difficile Infection in Adults: 2010 Update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect Control Hosp Epidemiol 2010; 31 : 431–455.
15. Ryan C, Murphy C, Twomey C et al. Asymptomatic carriage of Clostridium difficile in an Irish continuing care institution for elderly: prevalence and characteristics. Ir J Med Sci 2010; 179 : 245–250.
16. Owens RC. Clostridium difficile – associated disease. Changing epidemiology and implications for management. Drugs 2007; 67 : 487–503.
17. Hubert B, Loo VG, Bourgault AM et al. A portrait of the geographic dissemination of the Clostridium difficile North American pulsed-field type 1 strain and the epidemiology of Clostridium difficile-associated disease in Québec. CID 2007; 44 : 238–244.
18. Beneš J, Sýkorová B. Kolitida vyvolaná Clostridium difficile. Zpráva z kongresu ICAAC 2006. Klin mikrobiol inf lek 2006; 12 : 247–251.
19. Cadena J, Thompson GR 3rd, Patterson JE et al. Clinical predictors and risk factors for relapsing Clostridium difficile infection. Am J Med Sci. 2010; 339 : 350–355.
20. Howell MD, Novack V, Grugurich P et al. Iatrogenic gastric acid suppression and the risk of nosocomial Clostridium difficile infection. Arch Intern Med 2010; 170 : 784–790.
21. Cloud J, Kelly CP. Update on Clostridium difficile associated disease. Curr Opin in Gastroenterol 2007; 23 : 4–9.
22. DuPont HL, Garey K, Caeiro JP et al. New advances in Clostridium difficile infection: changing epidemiology, diagnosis, treatment and control. Curr Opin Infect Dis 2008, 21 : 500–507.
23. Dubberke ER, Reske KA, Yan Y et al. Clostridium difficile-associated disease in a setting of endemicity: Identification of novel risk factors. CID 2007; 45 : 1543–1549.
24. Kim JW, Lee KL, Jeong JB et al. Proton pump inhibitors as a risk factor for recurrence of Clostridium difficile-associated diarrhea. World J Gastroenterol 2010; 16 : 3573–3577.
25. Bergmann D, Koten J, Beneš Z et al. Pseudomembranózní kolitida. Vnitř Lék 2007; 53 : 1100–1107.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 1-
All articles in this issue
- Cílená léčiva a jejich přínos pro terapii vnitřních chorob
- Výsledky katetrové ablace fibrilace síní u pacientů nad 65 let
- Rizikové faktory rekurentního a těžkého průběhu kolitidy vyvolané infekcí Clostridium difficile
- Existuje závislost mezi hladinou adipocyte fatty acid binding proteinu a kalciovým skóre u asymptomatických příbuzných pacientů s KVO?
- Léčba AL-amyloidózy v roce 2012, přínos nových léků (bortezomibu, thalidomidu a lenalidomidu). Přehled publikovaných klinických studií
- Léky indukovaná osteoporóza
- Zvláštnosti diagnostiky a terapie exokrinní pankreatické nedostatečnosti
- AII antagonisté v léčbě hypertenze a prevenci CMP
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léky indukovaná osteoporóza
- Rizikové faktory rekurentního a těžkého průběhu kolitidy vyvolané infekcí Clostridium difficile
- Zvláštnosti diagnostiky a terapie exokrinní pankreatické nedostatečnosti
- Výsledky katetrové ablace fibrilace síní u pacientů nad 65 let
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

