-
Medical journals
- Career
Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
Authors: J. Halámková 1; I. Kiss 1; J. Tomášek 1; Z. Pavlovský 2; Š. Tuček 1; M. Penka 3
Authors‘ workplace: Klinika komplexní onkologické péče Lékařské fakulty MU a MOÚ Brno, přednosta prof. MUDr. Rostislav Vyzula, CSc. 1; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Josef Feit, CSc. 2; Oddělení klinické hematologie FN Brno, přednosta prof. MUDr. Miroslav Penka, CSc. 3
Published in: Vnitř Lék 2012; 58(2): 129-134
Category: Reviews
Overview
Fibrinolýza pomáhá regulovat hemostázu, a zabraňuje tak vytvoření neadekvátně velkého trombu, který by mohl omezit průtok krve cévním řečištěm. Hlavním enzymem podílejícím se na fibrinolýze je plazmin. Tkáňový aktivátor plazminogenu (tPA) a urokináza (uPA) jsou agens konvertující plazminogen na aktivní plazmin, tvoří společně s receptorem pro urokinázu (uPAR) a inhibitory urokinázy (PAI 1, PAI 2, PAI 3 a protease nexin) plazminogen aktivátor systém (PAS), který je mimo jiné součástí metastatické kaskády a významnou měrou se podílí na invazivním růstu a angiogenezi maligních nádorů. Pro samotnou fibrinolýzu má zásadní význam tPA, uPA se pak podílí na degradaci tkání jak při fyziologických, tak i patologických pochodech. Receptor pro uPA – uPAR je navázán na buněčnou membránu prostřednictvím glykosylfosfatidylinositolu. Navázáním uPA na uPAR dochází k aktivaci proteintyrosinkináz, proteinkinázy C a MAP-kinázy. Současně byla popsána i přímá signální cesta Jak/STAT kaskádou s využitím signální transdukce Scr-like proteintyrosinkinázy. Exprese uPAR je regulována řadou růstových faktorů, např. EGF, bFGF a HGF. Zdá se, že jednotlivé faktory PAS se podílí na procesu malignizace nádorových onemocnění. Na otázku, do jaké míry je jejich vliv zásadní u konkrétních malignit, by měl odpovědět další výzkum. V článku autoři předkládají souhrn poznatků o interakci fibrinolýzy a nádorového procesu, speciálně o vlivu urokinázy a dalších aktivátorů a jejich inhibitorů na metastazování maligních tumorů. Text obsahuje informace o faktorech, jejichž zavedení do praxe je zatím předmětem četných diskuzí, nicméně do budoucna by jednotlivé faktory PAS mohly hrát významnou úlohu při plánování strategie léčby a zároveň by se mohly stát i terčem cílené terapie.
Klíčová slova:
plazminogen aktivátor systém – uPA – uPAR – PAI 1 – PAI 2
Fibrinolýza pomáhá regulovat hemostázu, a zabraňuje tak vytvoření neadekvátně velkého trombu, který by mohl omezit průtok krve cévním řečištěm, dochází při ní k degradaci fibrinu na fibrinové monomery. Hlavním enzymem podílejícím se na fibrinolýze je plazmin, který je produkován v inaktivní formě jako plazminogen v játrech, jeho poločas rozpadu je kolem 2 dnů, ale v závislosti na aktivaci fibrinolytického systému může být i výrazně kratší. Tkáňový aktivátor plazminogenu (tPA) a urokináza (uPA) jsou agens konvertující plazminogen na aktivní plazmin (obr. 1).
Image 1. Zjednodušené schéma fibrinolýzy. 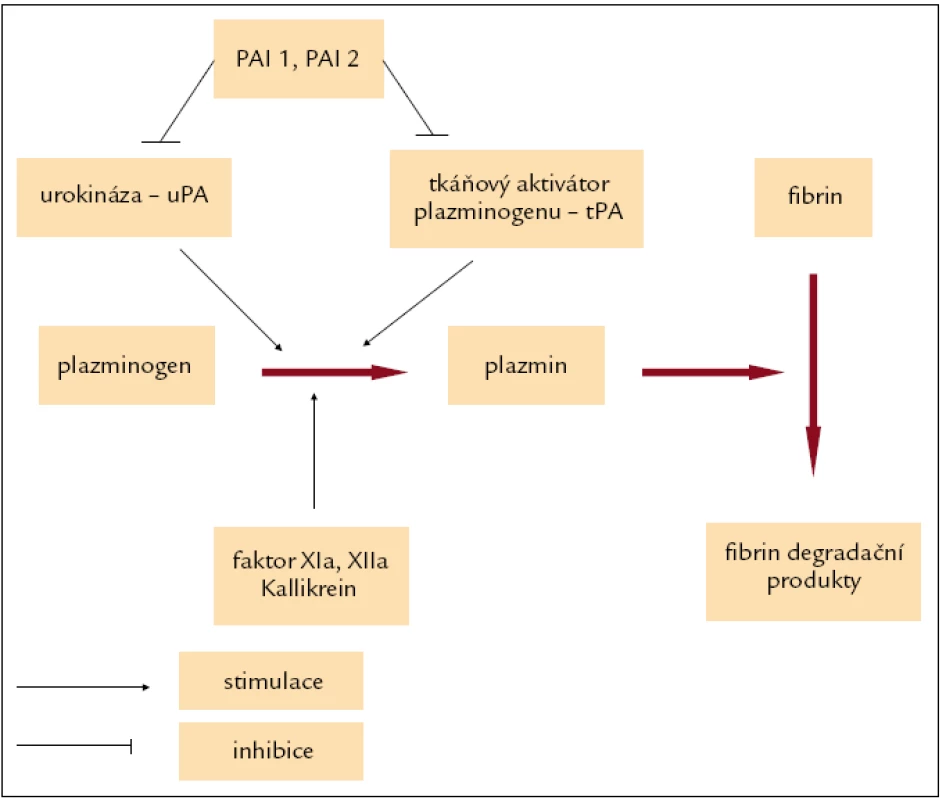
Tkáňový aktivátor plazminogenu (tPA) je serinovou proteinázou, která je přítomna v cévních endoteliích a v buňkách téměř všech parenchymatózních orgánů, zvláště plic, ledvin, prostaty a placenty, odkud se uvolňuje při poranění (např. operace). V plazmě cirkuluje společně v komplexu s inhibitorem urokinázy 1 (PAI 1), méně než 5 % je ho ve volné (aktivní) formě [1]. Urokináza (uPA) je serinová proteináza, která hraje zásadní roli v aktivaci plazminogenu na plazmin, který patří mezi serinové proteinázy, a současně se podílí na aktivaci matrixmetaloproteináz, latentních elastáz, růstových faktorů a cytokinů, které se účastní degradace elementů extracelulární matrix, jako jsou fibrin a laminin. Je syntetizována z proenzymu prourokinázy (pro-uPA nebo sc-uPA). Pro-uPA je aktivována prostřednictvím řady proteináz, zahrnující např. plazmin, katepsin B/L, kallikrein, trypsin-like enzymy, thermolysin, NGF-γ, na enzymaticky aktivní vysokomolekulární formu uPA (HMW). HMW-uPA je dále degradována na nízkomolekulární enzymaticky aktivní formu uPA (LMW) a enzymaticky inaktivní amino-terminální fragment (ATF). ATF epitop v sobě zahrnuje growth-factor-like doménu (GFD). GFD umožňuje vazbu uPA na uPAR [2]. Plazmin se podílí též na aktivaci neaktivních matrixmetaloproteináz. Společně se svým receptorem (uPAR), tkáňovým aktivátorem (tPA, který je syntetizován z proenzymu pro-tPA nebo sc-tPA) a inhibitory urokinázy (PAI 1, PAI 2, PAI 3 – identický s inhibitorem proteinu C a protease nexin) [1] tvoří plazminogen aktivátor systém (PAS), který je součástí metastatické kaskády a významnou měrou se podílí na invazivním růstu a angiogenezi maligních nádorů [2]. V nedávné době byla navržena nová nomenklatura, v níž byl PAI 1 označen jako serpin E1, PAI 2 serpin B2 a PAI 3 serpin A5 [3].
uPA hraje zásadní roli v degradaci tkání při fyziologických i patologických pochodech, na rozdíl od tPA, který má zásadní význam pro fibrinolýzu. PAI 1, který tvoří 60 % ze všech inhibitorů aktivátorů plazminogenu, inhibuje jak uPA, tak tPA. Zajímavostí je, že byla zjištěna nízká exprese uPA a vysoká tPA u normální tkáně střeva, na rozdíl od kolorektálních karcinomů, kde je aktivita tPA nízká oproti vysoké aktivitě uPA [4].
uPAR je membránový glykoprotein, receptor pro uPA, označovaný také jako CD 87. Navázáním uPA k uPAR dochází k aktivaci signální transdukce, jejímž výsledkem je stimulace buněčné proliferace, modulace adheze a zvýšení buněčné migrace (obr. 2) [5]. Nejvýznamnější specifické inhibitory jsou PAI 1 a PAI 2, které reagují s receptorem uPA, ale ne s pro-uPA, oba náleží do rodiny serpinů (serine protease inhibitor super-family) [6].
Image 2. Multifunkční potenciál uPA. Upraveno podle [16]. ![Multifunkční potenciál uPA. Upraveno podle [16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bda07080681bf4adcda7b3f4b064d3f1.png)
PAI 1 je jednořetězcový glykoprotein sestávající z 379 aminokyselin, jeho gen je lokalizován na 7. chromozomu a je tvořen převážně v hladké svalovině cév, v megakaryocytech, endoteliích, granulocytech, monocytech, makrofázích a nádorových buňkách. Jedná se o serpin, přítomný v plazmě a v α-granulích trombocytů, má schopnost vazby na vitronectin [7–9]. Komplex vitronectin-PAI 1 má delší poločas rozpadu a inhibuje migraci hladkých svalových buněk blokádou αvβ3 integrinu k vitronectinu [10,11]. Kromě αvβ3 integrinu se váže i na další ze skupiny integrinů jako αvβ1, αvβ5, αIIbβ3 a α8β1 [12]. Interakcí PAI 1 s uPA/uPAR komplexem vede k internalizaci této trojice, která stimuluje buněčnou proliferaci, naproti tomu komplex PAI 2/uPA/uPAR není internalizován, ale zpracován na buněčném povrchu [13]. PAI 1 je nejúčinnějším inhibitorem uPA a tPA. Navázání PAI 1 na uPAR vázaného k uPA vede k internalizaci uPA komplexu prostřednictvím endocytických receptorů low density lipoprotein (LDL) receptorové rodiny, jako je protein příbuzný LDL receptoru (LDL receptor related protein – LRP). Navázání uPA k PAI 1 přeruší normální PAI 1-vitronectin interakci a zahájí konformační změny v PAI 1, které umožňují expozici skrytému vysoce afinnímu vazebnému místu na LRP [14]. Obvykle je plazmatická hladina PAI 1 nízká a jeho vysoká hladina je asociována s různými typy onemocnění, např. vaskulárními chorobami či maligními tumory.
PAI 2, známý také jako placentární plazminogen aktivátor inhibitor, existuje ve 2 formách: v intracelulární neglykosylované a extracelulární glykosylované formě. Gen pro PAI 2 se nachází na 18. chromozomu a inhibuje pouze uPA [15]. PAI 2 se vyskytuje v trofoblastickém epitelu a je syntetizován leukocyty. Donedávna mu bylo jako hlavní úloha, podle některých autorů, přisuzováno ovlivnění koagulace u těhotných. Při jeho hlubším zkoumání však vychází najevo jeho nemálo významná role v procesu růstu maligních tumorů (obr. 3).
Image 3. Imunohistochemické barvení tkáně kolorektálního karcinomu – nádorové buňky jsou pozitivní na PAI 2 (zvětšeno 200krát). 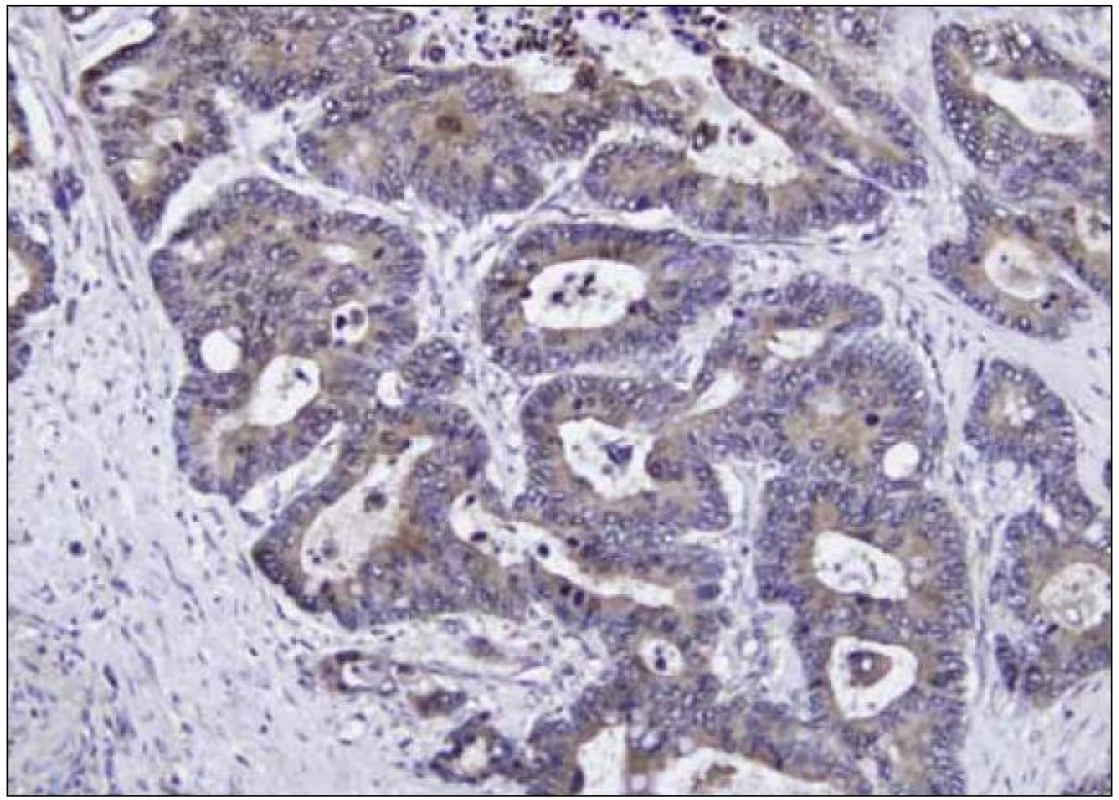
U nádorových buněk je tedy působení PAI 1 a PAI 2 odrazem jejich rozdílných fyziologických biologických funkcí. PAI 1 tedy navázáním komplexu uPA/uPAR vede k stimulaci růstu a současně k redistribuci uPAR na povrchu buněk zajišťující zpětně invazivitu tumorózní tkáně. Na druhé straně PAI 2 by měl být tím pravý inhibitorem PAS, nejen inhibicí aktivity urokinázy, ale i zabráněním migrace tumorózních buněk blokádou uPAR [16].
PAI 3 má nízkou afinitu k uPA i tPA, je označován také jako inhibitor proteinu C. Inhibuje trombin, faktor Xa, faktor XIa a komplex trombin-trombomodulin. Je exprimován v játrech, varlatech, ledvinách a pankreatu. Role PAI 3 a protease nexinu zatím není zcela objasněná [1]. Na experimentech s null PAI 3 myšmi bylo zjištěno, že u nich nejsou abnormality v koagulaci a v hemostáze, ale u myších samců byla zjištěna infertilita. Předpokládá se tedy, že by PAI 3 mohl mít význam ve spermatogenezi [17].
In vivo je to hlavně rovnováha aktivátorů a jejich inhibitorů, která určuje degradaci fibrinu a extracelulární matrix působenou plazminem [15].
Invazivita a metastazování maligních tumorů
V rámci metastatické kaskády dochází k uvolnění buňky z primárního ložiska, prostupu přes bazální membránu a extracelulární matrix do cévního systému, kterým se dostává na stanovené místo, kde opět prostoupí bazální membránou a extracelulární matrix a založí vzdálenou metastázu. Základním procesem je tedy buněčná adheze zprostředkovaná integriny, kadheriny, kateniny, selektiny, imunoglobuliny a dalšími adhezivními molekulami a extracelulárními proteolytickými enzymy, jako jsou např. matrixmetaloproteinázy, cysteinproteinázy (např. katepsin B, L a D) a serinproteinázy (např. urokináza). Kromě proteolytického efektu byla prokázána účast urokinázy i v procesu angiogeneze, jíž se účastní svou katalytickou funkcí, ale i parakrinně//autokrinním efektem na buněčnou migraci [18]. To bylo potvrzeno in vitro experimentálními modely [19]. I když přesný mechanizmus zatím není znám, je jisté, že uPAR neslouží pouze k ukotvení uPA, ale podílí se na signální kaskádě. Jakým způsobem však zatím není jasné, neboť uPAR je GPI (glykosylfosfatidyl inositol) kotveným proteinem a nemá cytoplazmatickou doménu, předpokládá se tedy využití transmembránových integrinů [20]. Potenciálními induktory angiogeneze jsou také fibrin, fibronektin a jejich degradační produkty, které mají chemotaktický efekt na endoteliální buňky.
Plazminogen aktivátor systém a jeho význam v invazi, metastazování a angiogenezi
Lze říci, že plazminogenem vázané molekuly hrají zásadní roli v invazi a metastazování tumoru. Aktivace uPA je regulována prostřednictvím urokinázového receptoru (uPAR). Navázání uPA na jeho receptor uPAR akceleruje aktivaci uPA z inaktivního proenzymu pro-uPA, jehož konverze je katalyzována plazminem, koagulačním faktorem XIIa a katepsinem B a L. Interakce uPAR s extracelulární matrix se děje prostřednictvím vitronectinu [21], tato interakce je zesílena navázáním uPA a snížena prostřednictvím PAI 1. Komplex uPA/uPAR má vysokou afinitu k vitronectinu, a to především k jeho doméně označované jako somatomedin B. PAI 1 je schopen vazbu uPAR k somatomedin B doméně inhibovat. Vitronectin je vázán s fibrinem, podílí se na migraci nádorových buněk ve fibrinové matrix, a tím na lokální invazi tumoru a vzdáleném metastazování. Základním procesem invazivního růstu nádoru je totiž degradace bazální membrány a proteinů extracelulární matrix, což umožňuje migraci nádorových buněk. uPAR je navázán na buněčnou membránu prostřednictvím glykosylfosfatidyl inositolu. Navázáním uPA na uPAR dochází k aktivaci proteintyrozinkináz [22], proteinkinázy C [23] a MAP kinázy [24]. Současně byla popsána i přímá signální cesta Jak/STAT kaskádou s využitím signální transdukce Scr-like proteintyrosinkinázy [25]. Exprese uPAR je regulována řadou růstových faktorů, např. EGF, bFGF a HGF. Extracelulární interakce mezi uPA, uPAR, α5β1 integrinem a fibronektinem iniciuje intracelulární signální kaskádu zprostředkovanou přes epidermální růstový faktor [26]. uPAR/uPA/PAI 1 systém se také podílí na angiogenezi indukované prostřednictvím VEGF [27].
Zajímavé je, že PAI 1 pozitivní buňky byly zachyceny spíše v centrálních částech tumorů, zatímco na periferii byla zjištěna vysoká exprese uPA společně se známkami tkáňové destrukce, což podporuje teorii, podle níž by inhibitor mohl chránit tkáň proti působení uPA [6]. Bylo zjištěno, že PAI 1 inhibuje uPA dependentní invazivitu buněčných linií karcinomu plic, ovariálního karcinomu, choriokarcinomu či fibrosarkomu [28–30]. Rostoucí exprese PAI 1 v nádorové tkáni je však u těchto pacientů spojena s horší prognózou. Tím je jeho role v celé šíři nádorového růstu zatím neobjasněná [31,32]. Proč je rostoucí hladina proteolytického inhibitoru spojena s horší prognózou, je tedy nejasné. Avšak užitím PAI 1 deficientních transgenních myší bylo zjištěno, že lokální invaze a s tumorem asociovaná angiogeneze jsou závislé na přítomnosti PAI 1 [33–35]. Jak se tedy PAI 1 podílí na tumorózní progresi? Vysvětlení může být následující: indukce uPAR vede k modifikaci integriny zprostředkované buněčné adheze prostřednictvím interakce s vitronectinem. Vazba uPA navázáním na uPAR vede k vzrůstu afinity k vitronectinu, je tedy pravděpodobné, že zvýšení PAI 1 sníží buněčnou adhezi k extracelulární matrix interferencí s uPAR navázaným na vitronectin, tímto pak zjednoduší buněčnou invazi a migraci [11,36–39].
PAI 1 se váže nejen na volný uPA, ale i na uPA vázaný k uPAR. Nemáme zatím vysvětlení například pro skutečnost, že u kolorektálních karcinomů je uPA exprimován hlavně na nádorových buňkách a PAI 1 nalézán převážně na endoteliích, na rozdíl třeba od karcinomu prsu, kde je uPA, uPAR a PAI 1 exprimován jak na nádorových, tak i na okolních buňkách stromatu [40]. Role PAS v metastatickém procesu není tedy závislá pouze na proliferačním a invazivním potenciálu vlastních nádorových buněk, ale vyžaduje existenci podpůrného vaskularizovaného nádorového stromatu, což představuje vzájemnou komunikaci mezi nádorovou linií a hostitelským prostředím a vytvoření nových cév v procesu angiogeneze. Angiogenezí je obecně označována novotvorba cév, proces podstatný pro růst tumoru. Jedná se o stav přísně regulovaný rovnováhou mezi aktivátory a inhibitory angiogeneze. Podkladem je rozpuštění bazální membrány, proliferace endotelií, jejich migrace a vytvoření nové cévy. Angiogeneze je stimulována hypoxií a právě hypoxie vede k zvýšení exprese uPAR a PAI 1 na endoteliálních buňkách [41]. Řada angiogenních faktorů jako např. VEGF, bFGF indukuje expresi uPA, tPA, uPAR a PAI 1, zatímco TGF β snižuje expresi uPA a posiluje PAI 1 produkci [42,43]. Důležitou roli v destrukci extracelulární matrix hrají kromě serinových proteináz (uPA, PAI 1) i katepsin B (CATB) a katepsin L (CATL), které jsou cysteinovými proteinázami [44,45]. Přesný mechanizmus, jakým se PAI 1 podílí na angiogenezi, však zatím nebyl objasněn. Zásadní je ale jeho význam při ochraně extracelulární matrix proti degradaci a vytvoření sítě pro migrující endoteliální buňky. PAI 1 prokázal u různých buněčných linií schopnost ochrany proti apoptóze, ať už spontánní, či léky indukované. Mechanizmus, kterým toho dosáhne, však zatím není znám [46].
Někteří autoři se domnívají, že PAI 1 nebo jeho nedostatek alteruje se signálními cestami jako např. PI3K/Akt a Jak/STAT a je zahrnut do procesů udržení integrity endoteliálních buněk, a tím i regulace buněčné smrti. PAI 1 ovlivňuje apoptózu snížením buněčné adheze a působením na intracelulární signální dráhy. Umožní to jeho schopnost inhibice generace plazminu, inhibice kaspázy 3 a schopnost inhibice buněčné adheze zprostředkované vitronectinem. Právě inhibice kaspázy 3 prostřednictvím PAI 1 může směrovat intracelulární buněčnou signalizaci od indukce apoptózy k indukci proliferace [47,48].
Plazminogen aktivátor systém jako cíl antitumorózní léčby
Jako první podali důkaz o antitumorózním efektu plazminu Cliffton a Grossi v roce 1956, kdy využili podání plazminu u pokusných králíků v návaznosti na intravenózní aplikaci nádorových buněk [49]. V současnosti se výzkum zaměřuje na několik cest, kterými by bylo možné ovlivnit PAS, a tím i procesy, kterých se v rámci nádorového růstu účastní:
- a) vytvoření nízkomolekulárních inhibitorů zaměřených přímo proti enzymaticky aktivnímu místu uPA,
- b) proteolyticky inaktivní uPA nebo jí podobné peptidy,
- c) monoklonální nebo polyklonální protilátky proti uPA či uPAR blokující uPA/uPAR interakci,
- d) rekombinantní, solubilní formy uPAR interferující s navázáním uPA na povrch nádorové buňky,
- e) inhibice syntézy PAS – využitím antisens oligodeoxynukleotidů nebo RNA zaměřená proti uPA nebo uPAR expresi,
- f) toxiny napojené na uPA,
- g) virové vektory přenášející jednotlivé genové komponenty pro PAS [16].
Zatím jsou však zkoušeny preparáty zaměřující se na PAS spíše u jiných onemocnění, jako např. Tiplaxtinin – inhibitor PAI 1(PAI-039), malá molekula, která oslabuje remodelaci cév, ke které dochází např. při aktivaci systému renin-angiotenzin u arteriální hypertenze. První výsledky jsou však publikovány s pozitivním efektem i na tumorózní angiogenezi u zvířecích modelů [50].
Závěr
Jak již bylo uvedeno, jednotlivé faktory PAS se jistě podílí na procesu malignizace nádorových onemocnění. Na otázky, do jaké míry je jejich vliv zásadní u konkrétních malignit a jak by mohl být terapeuticky nasměrován ve prospěch nemocného, by měl odpovědět další výzkum. V článku je souhrnně předložen přehled teoretických i klinických poznatků, které na své rutinní zavedení do praxe zatím čekají. Autoři článku však chtějí na podkladě publikovaných informací upozornit na vzájemnou provázanost koagulace, fibrinolýzy a procesu invaze a metastazování maligního onemocnění. Do budoucna by totiž jednotlivé faktory PAS mohly hrát významnou úlohu při plánování strategie léčby a zároveň by se mohly stát i terčem cílené terapie.
Tato práce byla podpořena výzkumným záměrem Ministerstva zdravotnictví ČR: FUNDIN MZ0MOU2005.
MUDr. Jana Halámková, Ph.D.
www.mou.cz
e-mail: jana.halamkova@mou.cz
Doručeno do redakce: 21. 6. 2011
Přijato po recenzi: 4. 8. 2011
Sources
1. Brummel-Ziedins K, Orfeo T, Swords JN et al. Blood coagulation and fibrinolysis. In: Greer JP, Foerster J, Rodgers JM et al (eds). Wintrobe’s Clinical Hematology. Baltimore: Lippincott Wiliams & Wilkins 2009 : 528–619.
2. Schmitt M, Harbeck M, Thomssen C et al. Clinical impact of the plasminogen activation system in tumor invasion and metastasis: Prognostic relevance and target therapy. Thromb Haemost 1997; 78 : 285–296.
3. Silverman GA, Bird PI, Carrell RW et al. The serpins are an expanding superfamily of structurally similar but functionally diverse proteins: evolution, mechanism of inhibition, novel functions, and a revised nomenclature. J Biol Chem 2001; 276 : 33293–33296.
4. De Bruin PA, Griffioen G, Verspaget HW et al. Plasminogen activators and tumor development in the human colon: activity levels in normal mucosa, adenomatous polyps, and adenocarcinomas. Cancer Res 1987; 47 : 4654–4657.
5. Duffy MJ. The urokinase plasminogen activator system: role in malignancy. Curr Pharm Des 2004; 10 : 39–49.
6. Pyke C, Kristensen P, Ralfkiaer E et al. The plasminogen activation system in human colon cancer: Messenger RNA for the inhibitor PAI-1 is located in endothelial cells in tumor stroma. Cancer Res 1991; 51 : 4067–4071.
7. Fya WP, Shapiro AD, Shih JL et al. Brief report: Complete deficiency of plasminogen-activator inhibitor type 1 due to a frame-shift mutation. N Engl J Med 1992; 327 : 1729–1733.
8. Carmeliet P, Stassen JM, Schoonjans L et al. Plasminogen activator inhibitor-1 gene-deficient mice. II. Effect on haemostasis, thrombosis and thrombolysis. J Clin Invest 1993; 92 : 2756–2760.
9. Hill SA, Shaughnessy SG, Joshua P et al. Differential mechanisms targeting type 1 plasminogen activator inhibitor and vitronectin into the storage granules of a human megakaryocytic cell line. Blood 1996; 87 : 5061–5073.
10. Stefansson S, Peticlerc E, Wong MK et al. Inhibition of angiogenesis in vivo by plasminogen activator inhibitor-1. J Biol Chem 2001; 276 : 8135–8141.
11. Stefansson S, Lawrence DA. The serpin PAI-1 inhibits cell migration by blocking integrin alpha V beta 3 binding to vitronectin. Nature 1996; 383 : 441–443.
12. Sugiura Y, Ma L, Sun B et al. The plasminogen-plasminogen activator (PA) system in neuroblastoma: role of PA inhibitor-1 in metastasis. Cancer Res 1999; 59 : 1327–1336.
13. Nykjaer A, Conese M, Christensen EI et al. Recycling of the urokinase receptor upon internalization of the uPA: serpin complexes. EMBO J 1997; 16 : 2610–2620.
14. Chazaud B, Ricoux R, Christov C et al. Promigratory effect of plasminogen activator inhibitor-1 on invasive breast cancer cell populations. Am J Pathol 2002; 160 : 237–246.
15. Baker EA, Bergin FG, Leaper DJ et al. Plasminogen activator system, vascular endothelial growth factor and colorectal cancer progression. Mol Pathol 2000; 53 : 307–312.
16. Schmitt M, Wilhelm O, Reuning U et al. The urokinase plasminogen activator system as a novel target for tumour therapy. Fibrinolysis Proteol 2000; 14 : 114–132.
17. Meijers JC, Marquart JA, Bertina MR et al. Protein C inhibitor (plasminogen activator inhibitor-3) and the risk of venous thrombosis. Br J Haematol 2002; 118 : 604–609.
18. Mignatti P, Rifkin DB. Plasminogen activators and matrix metalloproteinases in angiogenesis. Enzyme Prot 1996; 49 : 117–137.
19. Pepper MS, Sappino AP, Stöcklin R et al. Up-regulation of urokinase receptor expression on migrating endotelial cells. J Cell Biol 1993; 122 : 673–684.
20. Ploug M, Ronne E, Behrendt N et al. Cellular receptor for urokinase plasminogen activator. Carboxyl-terminal processing and membrane anchoring by glycosylphosphatidylinositol. J Biol Chem 1991; 266 : 1926–1933.
21. Waltz DA, Natkin LR, Fujita RM et al. Plasmin and plasminogen activator inhibitor type 1 promote cellular motility by regulating the interaction between the urokinase receptor and vitronectin. J Clin Invest 1997; 100 : 58–67.
22. Resnati M, Guttinger M, Valcamonica S et al. Proteolytic cleavage of the urokinase receptor substitutes for the agonist-induced chemotactic effect. EMBO J 1996; 15 : 1572–1582.
23. Busso N, Masur SK, Lazega D et al. Induction of cell migration by pro-urokinase binding to its receptor: possible mechanism for signal transduction in human epitelial cells. J Cell Biol 1994; 126 : 259–270.
24. Nguyen DH, Hussaini IM, Gonias SL. Binding of urokinase-type plasminogen activator to its receptor in MCF-7 cells activates extracellular signal regulated kinase 1 and 2 which is required for increased cellular motility. J Biol Chem 1998; 273 : 8502–8507.
25. Dumler I, Weis A, Mayboroda OA et al. The Jak/Stat pathway and urokinase receptor signaling in human aortic vascular smooth muscle cells. J Biol Chem 1998; 273 : 315–321.
26. Durand MK, Bødker JS, Christensen A et al. Plasminogen activator inhibitor 1 and tumour growth, invasion and metastasis. Tromb Haemost 2004; 91 : 439–449.
27. Prager GW, Breuss JM, Steurer S et al. Vascular endothelial growth factor receptor-2-induced initial endothelial cell migration depends on the presence of the urokinase receptor. Circ Res 2004; 94 : 1562–1570.
28. Brückner A, Filderman AE, Kirchheimer JC et al. Endogenous receptor-bound urokinase mediates tissue invasion of the human lung carcinoma cell lines A549 and Calu-1. Cancer Res 1992; 52 : 3043–3047.
29. Kobayashi H, Moniwan N, Gotoh J et al. Role of activated protein C in faciliting basement membrane invasion by tumor cells. Cancer Res 1994; 54 : 261–267.
30. Praus M, Collen D, Gerard RD. Both u-PA inhibition and vitronectin binding by plasminogen activator inhibitor 1 regulate HT1080 fibrosarcoma cell metastasis. Int J Cancer 2002; 102 : 584–591.
31. Harbeck N, Schmitt M, Kates RE et al. Clinical utility of urokinase-type plasminogen activator and plasminogen activator inhibitor-1 determination in primary breast cancer tissue for individualized therapy concepts. Clin Breast Cancer 2002; 3 : 196–200.
32. Taponeco F, Curcio C, Giuntini A et al. Expression and prognostic significance of urokinase and plasminogen activator inhibitor type-1 in endometrial hyperplazia and cancer. J Exp Clin Canc Res 2001; 20 : 239–246.
33. Bajou K, Noël A, Gerard RD et al. Absence of host plasminogen activator inhibitor 1 prevents cancer invasion and vascularization. Nat Med 1998; 4 : 923–928.
34. Rak J, Klement P, Yu J. Genetic determinats of cancer coagulopathy, angiogenesis an disease progression. Vnitř Lék 2006; 52 (Suppl 1): 135–138.
35. Penka M. Activation of blood coagulation in oncology patient. Vnitř Lék 1997; 43 : 337–339.
36. Deng C, Cirriden SA, Wang S et al. Is plasminogen activator inhibitor 1 the molecular switch that governs urokinase receptor-mediated cell adhesion and release? J Cell Biol 1996; 134 : 1563–1571.
37. Kanse SM, Kost C, Wilhelm OG et al. The urokinase receptor is a major vitronectin-binding protein on endothelial cells. Exp Cell Res 1996; 224 : 344–353.
38. Abe J, Urano T, Konno H et al. Larger and more invasive colorectal carcinoma contains larger amounts of plasminogen activator inhibitor type 1 and its relative ratio over urokinase receptor correlates well with tumor size. Cancer 1999; 86 : 2602–2611.
39. Malý J, Blažek M, Bláha M et al. Changes in hemostasis in malignant diseases. Vnitř Lék 2002; 48 : 614–618.
40. Rakic JM, Maillard C, Jost M et al. Role of plasminogen activator-plasmin system in tumor angiogenesis. Cell Mol Life Sci 2003; 60 : 463–473.
41. Uchiyama T, Kurabayashi M, Ohyama Y et al. Hypoxia induced transcription of the plasminogen activator inhibitor 1 gene through genistein-sensitive tyrosine kinase pathways in vascular endothelial cells. Arterioscl Throm Vas 2000; 20 : 1155–1161.
42. Premzl A, Turk V, Kos J. Intracellular proteolytic activity of cathepsin B is associated with capillary-like tube formation by endothelial cells in vitro. J Cell Biochem 2006; 97 : 1230–1240.
43. Smith OP. Thrombotic complications in children with cancer. Vnitř Lék 2009; 55 : 223–226.
44. Danø K, Behrendt N, Høyer-Hansen G et al. Plasminogen activations and cancer. Thromb Haemost 2005; 93 : 676–681.
45. Krueger S, Kalinski T, Wolf H et al. Interactions between human colon carcinoma cells, fibroblasts and monocytic cells in coculture-regulation of cathepsin B expression and invasiveness. Cancer Lett 2005; 223 : 313–322.
46. Kwaan HC, Wang J, Svoboda K et al. Plasminogen activator inhibitor 1 may promote tumour growth through inhibition of apoptosis. Br J Cancer 2000; 82 : 1702–1708.
47. Balsara RD, Ploplis VA. Plasminogen activator inhibitor-1: the double-edged sword in apoptosis. Thromb Haemost 2008; 100 : 1029–1036.
48. Schneider DJ, Chen Y, Sobel BE. The effect of plasminogen activator inhibitor type 1 on apoptosis. Thromb Haemost 2008; 100 : 1037–1040.
49. Clifton EE, Grossi CE. Effect of human plasmin on the toxic effects and growth of blood borne metastasis of the Brown-Pearce carcinoma and the V2 carcinoma of rabbit. Cancer 1956; 9 : 1147–1152.
50. Leik CE, Su EJ, Nambi P et al. Effect of pharmacologic plasminogen activator inhibitor-1 inhibition on cell motility and tumor angiogenesis. J Thromb Haemost 2006; 4 : 2710–2715.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 2-
All articles in this issue
- Přehled dosud publikovaných analýz srovnávajících efektivitu léčby inzulinovou pumpou a režimu několika injekcí inzulinu denně u diabetiků 1. typu
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Celiakie – opomíjená diagnóza
- Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
- Příznaky bažení po jídle u dětí staršího školního věku a jejich vztah k body-mass indexu
- Klinické dôsledky zväčšenia ľavej predsiene
- Hemokoagulační mechanizmy v procesu aterotrombózy
- Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
- Měkké tkáně, hormony a skelet
- Lieky a štítna žľaza
- Vývoj koagulačních markerů chronické diseminované intravaskulární koagulace (DIK) u pacienta s mnohočetnou angiomatózou v průběhu léčby antiangiogenními léky: interferonem α, thalidomidem a lenalidomidem
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinické dôsledky zväčšenia ľavej predsiene
- Lieky a štítna žľaza
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

