-
Medical journals
- Career
Resynchronizačná liečba srdcového zlyhávania – stále veľa otáznikov
Authors: P. Muríň; P. Mitro; G. Valočik; B. Stančák
Authors‘ workplace: Kardiologická klinika Lekárskej fakulty UPJŠ a Východoslovenského ústavu srdcových a cievnych chorôb, a. s., Košice, Slovenská republika, prednosta doc. MUDr. Branislav Stančák, CSc.
Published in: Vnitř Lék 2011; 57(10): 819-825
Category: Reviews
Overview
Potenciálny prínos resynchronizačnej liečby prejavujúci sa zlepšením kvality a dĺžky života u pacientov so srdcovým zlyhávaním v súčasnosti nie je možné dosiahnuť u všetkých pacientov. Výskyt 30 % non-responderov je dôvodom hľadania nových kritérií predikujúcich odpoveď na resynchronizačnú liečbu. Neprítomnosť mechanickej dyssynchrónie, viability myokardu a adekvátnej pozície intrakardiálnej ľavokomorovej elektródy pravdepodobne limituje odpoveď na resynchronizačnú liečbu. Nezastupiteľnú úlohu pri výbere vhodných pacientov zohráva stále EKG.
Kľúčové slová:
biventrikulárna kardiostimulácia – dyssynchrónia – responderResynchronizačná liečba (cardiac resynchronization therapy – CRT) sa stala neoddeliteľnou súčasťou manažmentu pacientov v pokročilom štádiu chronického srdcového zlyhávania (SZ). CRT predstavuje nefarmakologickú liečbu SZ, ktorá redukuje ako morbiditu, tak aj mortalitu u týchto pacientov [1]. CRT je voľbou u pacientov s adekvátne vyťaženou farmakologickou liečbou chronického srdcového zlyhávania [2].
Synergická činnosť myokardu zabezpečuje optimálnu činnosť srdca. Týka sa to jednotlivých častí komôr (intraventrikulárna synchrónia), vzájomnej súčinnosti pravej a ľavej komory (interventrikulárna synchrónia), aj zladenia činnosti predsiení a komôr (atrioventrikulárna synchrónia). Predĺženie fyziologickej elektrickej aktivácie myokardu komôr ( t. j. porucha elektrickej synchrónie) sa na EKG prejaví rozšírením QRS komplexu > 120 ms. Najčastejšie takto rozšírený QRS komplex má morfologicky tvar blokády ľavého Tawarovho ramienka (BLTR) [3], ku ktorej môže dôjsť:
- narušením subendokardiálne uloženého prevodového systému ĽK lebo
- štrukturálnymi zmenami myokardu ľavej komory (rôzny obsah nefunkčného fibrózneho tkaniva) [4].
Vznik dyssynchrónie nepriaznivo ovplyvňuje srdcový výkon a tým ďalej prispieva k progresii srdcového postihnutia. Výskyt elektrickej dyssynchrónie u pacientov s chronickým SZ je častý a je nezávislým prediktorom mortality. QRS > 120 ms sa vyskytuje približne u 1/3 pacientov so SZ [5].
Úprava dyssynchrónie je cieľom CRT, ktorej prostriedkom je biventrikulárna kardiostimulácia. Resynchronizácia myokardu (a tým zlepšenie SZ) sa dosiahne vytvorením „elektrického bypassu“, čiže arteficiálnou stimuláciou neskoro aktivovanej oblasti myokardu ľavej komory (ĽK). ĽK je pritom aktivovaná z 2 samostatných vĺn: jedna vychádza z pravokomorovej elektródy, druhá z uloženia stimulačnej ľavokomorovej elektródy [6]. Samotný výkon pozostáva z implantácie 2 stimulačných elektród do pravostranných oddielov srdca (pravá predsieň, pravá komora) a jednej elektródy na povrch ĽK. Ľavokomorová elektróda je zavedená epikardiálne buď transvenóznym prístupom do vetiev koronárneho sínusu, alebo chirurgicky (torakoskopiou, minitorakotomiou). Uvedené elektródy sú napojené na kardiostimulátor, ktorý sa nachádza subkutánne alebo submuskulárne v podkľúčkovej oblasti.
Podľa odporúčaní Európskej kardiologickej spoločnosti je CRT indikovaná u symptomatických pacientov so SZ, ktorí napriek optimálnej farmakologickej liečbe spĺňajú nasledujúce kritériá [7]:
- závažná systolická dysfunkcia (ejekčná frakcia – EF ≤ 35 %),
- QRS ≥ 120 ms u pacientov vo funkčnej skupine NYHA III–IV, resp. QRS ≥ 150 ms vo funkčnej skupine NYHA II.
V poslednej aktualizácii odporúčaní na CRT [7] sa nevyžaduje echokardiografické meranie rozmeru ĽK, v porovnaní s predchádzajúcimi, kde 3. požadovaným kritériom bol enddiastolický rozmer ĽK > 55 mm.
Uvedené odporúčania posudzujú dyssynchróniu na základe rozšírenia QRS komplexu bez ohľadu na jeho morfológiu. Napriek tomu, najlepšie zlepšenie na CRT vykazujú pacienti s predimplantačnou morfológiou BLTR v porovnaní s pacientmi s blokádou pravého Tawarovho ramienka (BPTR), resp. inou nešpecifickou poruchou vnútrokomorového vedenia [8].
Tieto indikačné kritéria sa ale nejavia ako postačujúce, nakoľko pozitívna odpoveď na CRT sa opakovane dokumentovala len u 70 % týchto pacientov (responderov) [9].
Vzhľadom k vysokej prevalencii SZ, ekonomickej náročnosti liečby pomocou CRT, je výskyt takmer 30 % non--responderov znepokojujúci, a preto je potrebné hľadať iné indikačné parametre, ktoré by lepšie predikovali odpoveď na liečbu CRT.
Kto je responder?
Posudzovanie pozitívnej odpovede pacientov na CRT v jednotlivých klinických štúdiách nie je rovnaké. Často sa stretávame s rozporom, či sledovať klinické alebo echokardiografické parametre, resp. ich kombináciu. Medzi najčastejšie porovnávané ukazovatele klinického stavu pacienta patria: NYHA klasifikácia, 6-minútový test chôdzou, vrcholová spotreba O2 pri záťaži, dotazníky kvality života. Multicentrická štúdia MUSTIC porovnávala zmenu klinického stavu pacientov s CRT pri zapnutej a vypnutej biventrikulárnej kardiostimulácii. Pri aktívnej biventrikulárnej stimulácii pacienti prešli o 22 % viac počas 6-minútového testu chôdzou, kvalita života sa zlepšila o 32 %, spotreba kyslíka na vrchole záťaže stúpla o 8 % [10]. Podobný dizajn štúdie na podklade porovnávania klinického stavu pacientov pri zapnutej a vypnutej CRT mali randomizované štúdie MIRACLE a MIRACLE-ICD. Počas aktívnej biventrikulárnej kardiostimulácie pacienti v rôznych vekových skupinách vykazovali štatisticky významné zlepšenie v NYHA triede (–0,84 vo veku < 65 rokov, –0,78 vo veku 65–75 rokov, -0,78 vo veku > 75 rokov) [11].
Echokardiografické parametre posudzujúce odpoveď na CRT sa zameriavajú najmä na porovnávanie stupňa systolickej dysfunkcie ĽK (ejekčná frakcia) a miery remodelácie ĽK (end--systolický a end-diastolický rozmer a objem ĽK) pred a po implantácii CRT [12]. V štúdii MIRACLE pacienti po 6 mesiacoch od implantácie biventrikulárneho kardiostimulátora vykazovali nárast EF o 4,6 % [13].
Konsenzus, ktorý parameter je najlepším markerom adekvátnej odpovede na CRT, nie je definovaný. Bleeker et al u 144 pacientov poukázali na to, že 70 % pacientov po implantácii CRT vykazovalo klinické zlepšenie (hodnotené redukciou NYHA ≥ 1 triedu) v porovnaní s 56 %, ktorí mali echokardiografické známky reverznej remodelácie ĽK [14]. Reverzná remodelácia ĽK bola hodnotená redukciou systolického objemu o viac ako 15 %. Diskrepancia medzi týmito výsledkami nie je známa, ale predpokladá sa, že samotná implantácia kardiostimulátora prináša placebo efekt, zodpovedajúci za subjektívne klinické zlepšenie, ktoré nekoreluje s objektívnymi echokardiografickými známkami remodelácie ĽK. Podobne ani echokardiografické známky remodelácie myokardu nemusia znamenať lepší klinický stav pacienta. Existujú pacienti, ktorí sú „až príliš chorí“, a preto ich stav progreduje k smrti aj napriek komplexnému intenzívnemu manažmentu [15].
Aký význam má EKG pri výbere pacientov s CRT?
Rozšírenie QRS ≥ 120 ms na elektrokardiograme je v rámci platných indikačných kritérií na CRT jediný parameter odrážajúci myokardiálnu dyssynchróniu. Najlepšia odpoveď sa dosahuje pri šírke QRS komplexu 150 ms [16]. Je však preukázané, že elektrická dyssynchrónia nemusí korelovať s mechanickou dyssynchróniou a naopak. Ischémia myokardu poruchou regionálnej kontraktility často vytvára mechanickú dyssynchróniu bez narušeného elektrického vedenia, čo je jasným príkladom existencie elektromechanickej disociácie. V súčasnosti platí, že významná mechanická inter - a intraventrikulárna dyssynchrónia sú časté, a to bez ohľadu na šírku QRS komplexu [17]. Kashani et al metaanalýzou publikovaných štúdií (2 063 pacientov) poukázali, že elektrická dyssynchrónia sa ukazuje ako nedostatočne predikujúci faktor určujúcich responderov na CRT v 33 z 34 štúdií [3]. Zdôvodnením tohto výsledku môže byť fakt, že šírka QRS komplexu koreluje viac s interventrikulárnou a nie intraventrikulárnou mechanickou dyssynchróniou ĽK, ktorá pravdepodobne zohráva dôležitejšiu úlohu v predikcii responderov [18].
Na 12-zvodovom EKG sa často stretávame so zistením, že šírka QRS sa líši od zvodu k zvodu. Povrchovým elektrokardiografickým mapovaním Samol et al dokumentovali najlepšiu koreláciu medzi QRS integrálom a mechanickou interventrikulárnou dyssynchróniou v oblastiach blízkym prekordiálnym zvodom V1 a V2 [19]. Pacienti s deviáciou srdcovej elektrickej osi doľava horšie odpovedajú na liečbu CRT ako pacienti s normálnou orientáciou elektrickej osi, čo pravdepodobne súvisí s progresiou štrukturálneho postihnutia myokardu [20].
Významným faktorom na uplatnenie sa CRT je dostatočná masa funkčného myokardu. Prítomnosť jazvovitého tkaniva, ktoré je charakterizované absenciou kontraktility, znemožňuje adekvátnu resynchronizáciu myokardu. Magnetickou rezonanciou (magnetic resonance imaging – MRI) pri kritériu ≤ 15 % celkového jazvovitého postihnutia myokardu predikcia responderov na CRT má senzitivitu 85 % a špecificitu 90 % [21].
EKG korelátom na kvantifikáciou jazvovitého tkaniva je Selvesterov QRS skórovací systém. Princíp spočíva v dôkladnej analýze QRS komplexu (trvanie Q a R vĺn, R a S amplitúd, zárezov R vlny) na 12-zvodovom EKG. Každému zmenenému QRS komplexu umožňuje prideliť určitý počet bodov, pričom 1 bod reprezentuje 3 % jazvovitého postihnutia ĽK. Uvedený skórovací systém je možné použiť aj u pacientov s BLTR ischemickej aj neischemickej etio-lógie [22].
Interpretovanie šírky QRS komplexu pred a po implantácii biventrikulárneho kardiostimulátora je jednoduchou mierkou na predikovanie reverznej remodelácie myokardu. Zúženie QRS komplexu postimplantačne sa pokladá za pozitívny prediktívny faktor remodelácie [23]. Vysokú pozitívnu prediktívnu hodnotu postimplantačne má aj nárast amplitúdy R kmitov vo zvodoch V1 a V2, ako aj zmena orientácie elektrickej srdcovej osi zľava doprava [24].
Mechanická dyssynchrónia stále v úzadí?
Aj keď potenciál predikcie responderov na CRT na základe mechanickej dyssynchrónie je sľubný a nepopierateľný, väčšina dôkazov je založená len na malých štúdiách [25]. Váha týchto štúdií neumožňuje zaradiť tieto parametre medzi vstupné kritéria na CRT, a preto majú t. č. len aditívny význam.
V klinickej praxi ide o echokardiografické stanovenie interventrikulárnej dyssynchrónie medzi pravou a ľavou komorou a intraventrikulárnej dyssynchrónie ĽK.
Interventrikulárna dyssynchrónia je definovaná časovým rozdielom medzi elektromechanickým oneskorením ľavej a pravej komory. Elektromechanické oneskorenie ĽK je doba od začiatku QRS komplexu do začiatku systolického aortálneho toku, ktorý ľahko získame dopplerovskou echokardiografiou pri umiestnení vzorkovacieho objemu medzi cípy aortálnej chlopne. Podobne elektromechanické oneskorenie PK je doba od začiatku QRS komplexu do začiatku systolického pulmonálneho toku. Za významnú interventrikulárnu dyssynchróniu je väčšinou považovaný rozdiel medzi elektromechanickými oneskoreniami oboch komôr > 40 ms (obr. 1A, 1B). Význam stanovenia interventrikulárnej dyssynchrónie ako indikácia na CRT je avšak sporný. Sumár 24 štúdií, ktoré použili echokardiografiu na predikovanie pozitívnej odpovede na CRT, poukazuje, že len 2 štúdie demonštrovali určitú váhu interventrikulárnej dyssynchrónie, v porovnaní so všetkými 24, ktoré vykazovali istú prediktívnu odpoveď použitím parametrov intraventrikulárnej dyssynchrónie ĽK [18].
Obr. 1A, 1B. Echokardiografické určovanie mechanickej interventrikulárnej dyssynchrónie. Vľavo zobrazenie preejekčného intrevalu ľavej komory, vpravo preejekčného intervalu pravej komory. Rozdiel preejekčných intervalov je 27 ms, tzn. bez známok mechanickej interventrikulárnej dyssynchrónie (materiál kardiologickej klinky LF UPJŠ a VUSCH a.s.). 
Intraventrikulárna dyssynchrónia je najčastejšie charakterizovaná časovým rozdielom vzniku vrcholných kontrakcií jednotlivých regiónov ĽK.
K najčastejšie použitým technikám na zobrazenie intraventrikulárnej mechanickej dyssynchrónie patrí echokardiografia, medzi metódy jej zobrazenia patria:
- konvenčné metodiky (M-mode echokardiografia, štandardná pulzná dopplerovská echokardiografia),
- tkanivová dopplerovská echo-kardiografia,
- vector velocity imaging (strain, strain rate; obr. 2),
- 3D echokardiografia,
- speckle tracking echokardiografia.
Image 1. Strain rate zobrazenie mechanickej intraventrikulárnej dyssynchrónie. Jednotlivá krivka predstavuje rýchlosť deformácie príslušného segmentu myokardu (viď vpravo hore). Vrcholové rýchlosti deformácie bielej a najmä žltej krivky sú signifikantne oneskorené (325 ms) v porovnaní s ostatnými krivkami. (materiál kardiologickej klinky LF UPJŠ a VUSCH a.s.) 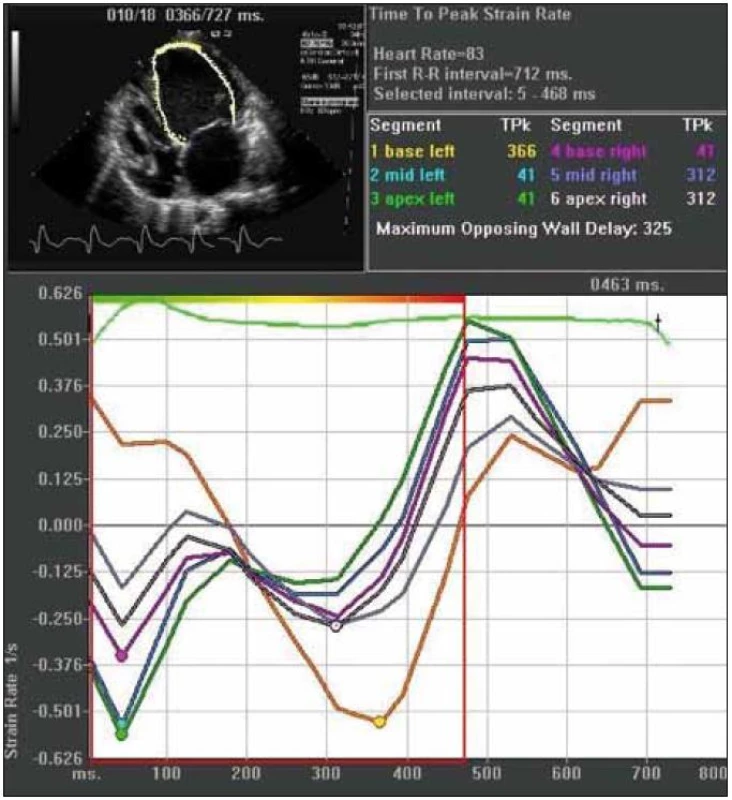
Overenie významu hodnotenia mechanickej intraventrikulárnej dyssynchrónie k predikcii responderov na CRT bolo predmetom multicentrickej randomizovanej štúdie PROSPECT (Predictors of response to CRT). Testovala 12 rôznych echokardiografických parametrov používaných ku kvantifikácii mechanickej dyssynchrónie u 498 pacientov indikovaných na CRT podľa platných odporúčaní. Zahŕňala parametre M-mode zobrazenia, štandardnej pulznej dopplerovskej echokardiografie a hlavne tkanivovej dopplerovskej echokardiografie. Výsledkom bolo zistenie, že testované echokardiografické parametre nedokázali dostatočne spoľahlivo rozlíšiť responderov od non-responderov, a preto ich nie je možné odporučiť medzi kritéria pre výber pacientov k liečbe CRT (tab. 1) [26]. Ich najväčším nedostatkom je hodnotenie mechanickej dyssynchrónie z obmedzených oblastí ĽK, problémy reprodukovania (vysoká inter - a intraobservačná variabilita), nedostatočné odlíšenie pasívneho pohybu myokardu od skutočnej kontrakcie.
Table 1. Výsledky štúdie PROSPECT: porovnanie výťažnosti echokardiografických metodík posudzujúcich mechanickú dyssynchróniu na predikovanie responderov na CRT. Upravené podľa [26]. ![Výsledky štúdie PROSPECT: porovnanie výťažnosti echokardiografických metodík posudzujúcich mechanickú dyssynchróniu na predikovanie responderov na CRT. Upravené podľa [26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/44334e3c66f62c56fb88971b98ecd88f.jpg)
Vo svetle týchto zistení by echokardiografická metodika kvantifikujúca mechanickú dyssynchróniu mala odrážať skutočnú kontrakciu celého myokardu s dobrou reprodukovateľnosťou. Zo súčasne používaných echokardiografických metód má k tomu najbližšie 3D a speckle tracking echokardiografia.
Aké sú možnosti umiestenia ľavokomorovej elektródy?
Nakoľko biventrikulárna kardiostimulácia predstavuje liečbu SZ u pacientov s dyssynchróniou myokardu, ani optimálne zvolené indikačné kritéria nemusia znamenať benefit pre pacienta, ak sa ľavokomorová elektróda nenachádza v oblasti najneskoršej aktivácie ĽK. Na diagnostiku najneskôr sa kontrahujúceho segmentu, t. j. miesta mechanickej dyssynchrónie, môžeme použiť niekoľko vyššie uvedených echokardiografických metód. Najčastejšie sa toto miesto nachádza v oblasti voľnej steny ĽK, a preto umiestnenie ľavokomorovej elektródy do jednej z vetiev koronárneho sínusu v postero-laterálnej oblasti ĽK sa ukazuje ako najlepšie [27]. Transvenózne umiestnenie elektródy do tohto miesta je však limitované interindividuálnou variabilitou priebehu vetiev koronárneho sínusu s adekvátnym kalibrom. V takomto prípade je vhodné zvážiť riziko a benefit chirurgických prístupov k implantácii epikardiálnej elektródy (torakoskopicky, minitorakotomicky). Aby sme predišli tomuto neželanému zisteniu počas transvenózneho zavádzania elektródy, do popredia sa dostávajú multidetektorová CT angiografia a venózna fáza koronárnej angiografie. Tieto zobrazovacie techniky predimplantačne umožňujú posúdiť anatómiu koronárneho sínusu [28,29].
V súčasnosti platí, že implantáciu ľavokomorovej elektródy presne do miesta najväčšej dyssynchrónie (určovanej neinvazívne) nie je možné zaistiť. Na detailnú analýzu elektrickej aktivácie myokardu je možné použiť invazívne intrakardiálne mapovanie [30].
Ďalším faktorom, vplývajúcim na priaznivú odpoveď pacientov po implantácii CRT, je myokardiálna viabilita. Prvotné klinické štúdie poukazujú na inverzný vzťah rozsahu myokardiálnej fibrózy a odpovede na CRT [31]. Jazvovité tkanivo (fibrotické), charakterizované nedostatkom kontraktilnej rezervy, sa ukazuje ako negatívny prediktor odpovede. Je možné, že viabilita stojí v pozadí zistení, že pacienti s ischemickou etiológiou horšie odpovedajú na CRT ako pacienti s idiopatickou kardiomyopatiou [32]. Taktiež neúspech vyššie uvedenej štúdie Prospect, ktorá predikovala responderov na základe mechanickej dyssynchrónie s nízkou výťažnosťou, môže byť spôsobený práve nedostatočnou viabilitou myokardu. Malé klinické štúdie použitím kontrastnej a záťažovej echokardiografie poukazujú, že zachovaná regionálna viabilita v mieste umiestnenia ĽK elektródy, ako aj globálna kontraktilná rezerva predikujú responderov CRT. Ypenburg et al poukázali, že nárast EF > 7,5 % počas dobutamínovej echokardiografie predikuje responderov so senzitivitou 76 % a špecificitou 86 % [33].
Biventrikulárna stimulácia s alebo bez použitia implantabilného kardioverter-defibrilátora (ICD)?
Prevalencia náhlej srdcovej smrti (NSS) u pacientov trpiacich SZ dosahovala v posledných 20 rokoch približne 40 %. Množstvo prípadov NSS je nepriamo úmerné závažnosti SZ. V štúdii MERIT-HF došlo k NSS u 64 % pacientov zaradených do funkčnej skupiny NYHA II, v porovnaní s 59 % pacientmi v triede III a 33 % pacientmi v triede IV [34]. Najčastejším mechanizmom NSS je komorová fibrilácia a komorová tachykardia [35].
Je preukázané, že ICD redukuje výskyt NSS lepšie ako antiarytmiká a tým zohráva dôležitú úlohu u pacientov so SZ. CRT s defibrilačnou elektródou je odporúčaná u všetkých pacientov splňujúcich kritéria na CRT v rámci sekundárnej prevencie NSS, resp. v primárnej prevencii NSS pri predpoklade prežívania viac ako 1 rok [7]. Problémom použitia ICD v primárnej prevencii NSS je avšak stále vysoká cena (CRT s ICD je 3–5-krát drahšie ako CRT). Počet implantácií CRT s ICD je preto regulovaný tak, aby ho konkrétny systém zdravotníctva bol schopný naplniť. Súčasťou komplexného manažmentu by mali byť aj farmakologické preparáty, ktoré pôsobia preventívne na ischemické príhody a tým znižujú výskyt NSS [36].
V minulosti CRT vo väčšine klinických štúdií bola indikovaná len u symptomatických pacientov so SZ vo funkčnej triede NYHA III–IV. Otázku, či rovnaký benefit je dosiahnuteľný aj u menej symptomatických pacientov, zodpovedali multicentrické randomizované štúdie REVERSE a MADIT-CRT. Štúdia REVERSE zahŕňala 610 pacientov vo funkčnej triede NYHA I–II s EF ≤ 40 %, QRS ≥ 120 ms s end-diastolickým rozmerom ĽK ≥ 55 mm, ktorým implantovali CRT. Po randomizovanom výbere pacientov, ktorým CRT aktivovali, resp. deaktivovali, sledovali výskyt klinického zhoršenia (primárny endpoint) a známky reverznej remodelácie ĽK (sekundárny endpoint) [37]. Po 12 mesiacoch zistili nesignifikantný rozdiel v primárnom endpointe, avšak pacienti s aktivovaným CRT vykazovali signifikantné známky reverznej remodelácie (zníženie endsystolických a enddiastolických objemov ĽK, nárast EF). Štúdia MADIT-CRT sledovala kombinovaný výskyt mortality alebo dekompenzácie SZ (ktorýkoľvek príde skôr) po implantácii CRT kombinovaného s ICD v porovnaní so samotným ICD [16]. Zahŕňala 1 820 menej symptomatických (NYHA I–II) vysoko rizikových pacientov (EF < 30 %) s ischemickou alebo non-ischemickou kardiomyopatiou so šírkou QRS ≥ 130 ms.
Výsledky štúdie boli vcelku jasné v prospech ramena CRT kombinovaného s ICD, ktoré v porovnaní so samotným ICD vykazovalo:
- relatívnu redukciu mortality z akýchkoľvek príčin alebo príhod SZ o 34 %,
- 41 % relatívnu redukciou príhod prvej dekompenzácie SZ,
- väčší benefit vykazovali pacienti so šírkou QRS ≥ 150 ms.
Uvedené štúdie sa podieľali na nedávnom rozšírení odporúčaní Európskej kardiologickej spoločnosti na CRT, ktorú t. č. indikujeme aj u pacientov v skupine NYHA II, s EF ≤ 35 % a QRS ≥ 150 ms [7].
Záver
Aj napriek tomu, že CRT má za sebou už desaťročnú históriu v manažmente chronického srdcového zlyhávania, jej potenciálny prínos nie je možné štandardne dosiahnuť u každého pacienta. Úskalia nachádzame v indikačných kritériách, kde sa elektrická dyssynchrónia javí ako nepostačujúca a zároveň mechanická dyssynchrónia ako nepresne kvantifikovateľná. Taktiež jazva v mieste najneskoršej aktivácie myokardu sa ukazuje byť faktorom, ktorý limituje odpoveď na CRT u pacientov s ischemickou chorobou srdca.
Ak by sme aj obmedzili výber pacientov istými striktnými kritériami, obmedzujúcim faktorom môže byť nedostačujúca venózna drenáž v mieste plánovanej implantácie ľavokomorovej elektródy. Tieto a ešte oveľa viac otázok bude nutné v budúcnosti zodpovedať. Naše očakávania od CRT sú vysoké, pretože srdcové zlyhávanie nemá len vysokú mortalitu, ale hlavne výrazne znižuje kvalitu ľudského života.
MUDr. Pavol Murín
www.lf.upjs.sk
e-mail: bankovcan@yahoo.com
Doručeno do redakce: 6. 10. 2010
Přijato po recenzi: 22. 2. 2011
Sources
1. Cleland JG, Daubert JC, Erdmann E et al. Cardiac Resynchronization-Heart Failure (CARE-HF) Study Investigators. The effect of cardiac resynchronization therapy on morbidity and mortality in heart failure. N Engl J Med 2005; 352 : 1539–1549.
2. Vítovec J, Špinar J. Léčba chronického srdečního selhání. Cor et Vasa 2008; 50 : 259–267.
3. Kashani A, Barold SS. Significance of QRS complex duration in patients with heart failure. J Am Coll Cardiol 2005; 46 : 2183–2192.
4. Mazzoleni A, Curtin ME, Wolff R et al. On the relationship between heart weights, fibrosis, and QRS duration. J Electrocardiol 1975; 8 : 233–236.
5. Baldasseroni S, Opasich C, Gorini M et al. Italian Network on Congestive Heart Failure Investigators. Left bundle-branch block is associated with increased 1-year sudden and total mortality rate in 5517 outpatients with congestive heart failure: a report from the Italian network on congestive heart failure. Am Heart J 2002; 143 : 398–405.
6. Peichl P, Riedlbauchova L. Patofyziologie srdečního selhání a mechanismus srdeční resynchronizační terapie. Kardiol Rev 2004; 4 : 7–11.
7. Dickstein K, Vardas PE, Auricchio A et al. ESC Committee for Practice Guidelines (CPG). 2010 Focused Update of ESC guidelines on device therapy in heart failure: an update of the 2008 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure and the 2007 ESC guidelines for cardiac and resynchronization therapy. Developed with the special contribution of the Heart Failure Association and the European Heart Rhythm Association. Eur Heart J 2010; 31 : 2677–2687.
8. Rickard J, Kumbhani DJ, Gorodeski EZ et al. Cardiac resynchronization therapy in non-left bundle branch block morphologies. Pacing Clin Electrophysiol 2010; 33 : 590–595.
9. Deplagne A, Ploux S, Ritter P. Relationship between left ventricular stimulation characteristics at implantation and echocardiographic response after 6 months of cardiac resynchronization therapy. Europace 2010; 12 : 1757–1761.
10. Cazeau S, Leclercq C, Lavergne T et al. Multisite Simulation in Cardiomyopathies (MUSTIC) Study Investigators. Effects of multisite biventricular pacing in patients with heart failure and intraventricular conduction delay. N Engl J Med 2001; 344 : 873–880.
11. Kron J, Aranda JM jr, Miles WM et al. Benefit of cardiac resynchronization in elderly patients: results from the Multicenter InSync Randomized Clinical Evaluation (MIRACLE) and Multicenter InSync ICD Randomized Clinical Evaluation (MIRACLE-ICD) trials. J Interv Card Electrophysiol 2009; 25 : 91–96.
12. Fornwalt BK, Spraque WW, BeDell P et al. Agreement Is Poor Among Current Criteria Used to Define Response to Cardiac Resynchronization Therapy. Circulation 2010; 121 : 1985–1991.
13. Abraham WT, Fisher WG, Smith AL et al. MIRACLE Study Group. Multicenter InSync Randomized Clinical Evaluation. Cardiac resynchronization in chronic heart failure. NEJM 2002; 346 : 1845–1853.
14. Bleeker GB, Bax JJ, Fung JW et al. Clinical versus echocardiographic parameters to assess response to cardiac resynchronization therapy. Am J Cardiol 2006; 97 : 260–263.
15. Cleland JG, Tageldien A, Buga L et al. Should We Be Trying to Define Responders to Cardiac Resynchronization Therapy? J Am Coll Cardiol Imgaging 2010; 3 : 541–549.
16. Moss AJ, Hall WJ, Cannom DS et al. MADIT-CRT Trial Investigators. Cardiac-resynchronization therapy for the prevention of heart-failure events. N Engl J Med 2009; 361 : 1329–1338.
17. Ghio S, Konstantin C, Klersy C et al. Interventricular and intraventricular dyssynchrony are common in heart failure patients, regardless of QRS duration. Eur Heart J 2004; 25 : 571–578.
18. Bax JJ, Abraham T, Barold SS et al. Cardiac resynchronization therapy: part 1 – issues before device implantation. J Am Coll Cardiol 2005; 46 : 2153–2167.
19. Samol A, Klotz S, Stypmann J et al. QRS integral: an electrocardiographic indicator of mechanical interventricular asynchrony. J Electrocardiol 2010; 43 : 242–250.
20. Reddy M, Shen X, Soma S et al. Effect of left axis deviation on cardiac resynchronization therapy response in patients with left bundle branch block. J Am Coll Cardiol 2010; 55; A3–E2.
21. White JA, Yee R, Yuan X et al. Delayed enhancement magnetic resonance imaging predicts response to cardiac resynchronization therapy in patients with intraventricular dyssynchrony. J Am Coll Cardiol 2006; 48 : 1953–1960.
22. Strauss DG, Selvester RH, Lima JAC et al. ECG quantification of myocardial scar in cardiomyopathy patients with or without conduction defects: correlation with cardiac magnetic resonance and arrhythmogenesis. Circ Arrhythmia Electrophysiol 2008; 1 : 327–336.
23. Lecoq G, Leclercq C, Leray E et al. Clinical and electrocardiographic predictors of a positive response to cardiac resynchronization therapy in advanced heart failure. Eur Heart J 2005; 26 : 1094–1100.
24. Sweeney MO, van Bommel RJ, Hellkamp AS et al. Analysis of ventricular activation using surface electrocardiography to predict left ventricular reverse volumetric remodeling during cardiac resynchronization therapy. Circulation 2010; 121 : 626–634.
25. Suffoletto MS, Dohi K, Cannesson M et al. Novel speckle-tracking radial strain from routine black-and-white echocardiographic images to quantify dyssynchrony and predict response to cardiac resynchronization therapy. Circulation 2006; 113 : 960–968.
26. Chung ES, Leon AR, Tavazzi L et al. Results of the Predictors of Response to CRT (PROSPECT) trial. Circulation 2008; 117; 2608–2616.
27. Rossillo A, Verma A, Saad EB et al. Impact of coronary sinus lead position on biventricular pacing. Mortality and echocardiographic evaluation during long-term follow-up. J Cardiovasc Electrophysiol 2004; 15 : 1120–1125.
28. Blendea D, Shah RV, Auricchio A et al. Variability of coronary venous anatomy in patients undergoing cardiac resynchronization therapy: a high speed rotational venography study. Heart Rhythm 2007; 4 : 1155–1162.
29. Jongbloed MR, Lamb HJ, Bax JJ et al. Noninvasive visualization of the cardiac venous system using multislice computed tomography. J Am Coll Cardiol 2005; 45 : 749–753.
30. Kautzner J, Peichl P. Selecting CRT candidates: the value of intracardiac mapping. Europace 2008; 10 (Suppl 3): 106–109.
31. Bleeker GB, Kaandorp TA, Lamb HJ et al. Effect of posterolateral scar tissue on clinical and echocardiographic improvement after cardiac resynchronization therapy. Circulation 2006; 113 : 969–976.
32. Gasparini M, Mantica M, Galimberti P et al. Is the outcome of cardiac resynchronization therapy related to the underlying etiology? Pacing Clin Electrophysiol 2003; 26 : 175–180.
33. Ypenburg C, Sieders A, Bleeker GB et al. Myocardial contractile reserve predicts improvement in left ventricular function after cardiac resynchronization therapy. Am Heart J 2007; 154 : 1160–1165.
34. The MERIT-HF study group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (Merit-HF). Lancet 1999; 353 : 2001–2007.
35. Rubart M, Zipes DP. Mechanisms of sudden cardiac death. J Clin Invest 2005; 115 : 2305–2315.
36. Taborsky M, Heinc P, Doupal V. Antiarytmika vs implantabilní kardiovertery-defibrilátory v prevenci náhle srdeční smrti: Definitivně vyřešená otázka? Kardiol Rev 2010; 12 : 26–31.
37. Linde C, Gold MR, Abraham WT et al. REVERSE (REsynchronization reVErses Remodeling in Systolic left vEntricular dysfunction) Study Group. Randomized trial of cardiac resynchronization in mildly symptomatic heart failure patients and in asymptomatic patients with left ventricular dysfunction and previous heart failure symptoms. J Am Coll Cardiol 2008; 52 : 1834–1843.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 10-
All articles in this issue
- Diagnostický algoritmus synkop: integrativní přístup
- Léčba akutní exacerbace chronické obstrukční plicní nemoci za hospitalizace a na lůžku intenzivní péče
- Úloha centrálneho nervového systému v etiopatogenéze chorôb periférnych orgánov
- Prognostické faktory u chronické lymfocytární leukemie
- Benígny solitárny vred slepého čreva
- MR dokumentované vymizení infiltrace infundibula hypofýzy u pacientů s histiocytózou z Langerhansových buněk po léčbě 2-chlorodeoxyadenosinem
- Náklady na rehospitalizaci pacientů s akutním srdečním selháním
- Očkování proti virové hepatitidě B u pacientů s chronickým selháním ledvin – dvacetileté zkušenosti
- Normální hodnoty tlaků v plicním oběhu u zdravých osob v klidu a při cvičení
- Resynchronizačná liečba srdcového zlyhávania – stále veľa otáznikov
- Kritické zhodnocení optimální farmakoterapie u kandidátů srdeční resynchronizační léčby – zkušenosti jednoho centra
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Normální hodnoty tlaků v plicním oběhu u zdravých osob v klidu a při cvičení
- Léčba akutní exacerbace chronické obstrukční plicní nemoci za hospitalizace a na lůžku intenzivní péče
- Resynchronizačná liečba srdcového zlyhávania – stále veľa otáznikov
- Prognostické faktory u chronické lymfocytární leukemie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

