-
Medical journals
- Career
Postižení CNS histiocytózou z Langerhansových buněk a Erdheimovou-Chesterovou nemocí. Přínos PET-CT vyšetření pro diagnostiku a vyhodnocení léčebné odpovědi
Authors: Z. Adam 1; Z. Řehák 2; R. Koukalová 2; P. Szturz 1; L. Pour 1; M. Krejčí 1; T. Nebeský 3; J. Vaníček 4; R. Hájek 1; J. Mayer 1
Authors‘ workplace: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Oddělení nukleární medicíny a pozitronové emisní tomografie Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák 2; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Vlastimil A. Válek, CSc. 3; Klinika zobrazovacích metod Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MUDr. Petr Krupa, CSc. 4
Published in: Vnitř Lék 2010; 56(Supplementum 2): 94-104
Category: Langerhans cell histiocytosis and some other Hematology rare diseases
Overview
Na našem pracovišti registrujeme celkem 23 pacientů s histiocytózou z Langerhansových buněk (LCH) a 2 pacienty s Erdheimovou-Chesterovou nemocí. Z tohoto 25členného souboru má 8 pacientů některou z forem postižení CNS histiocytárním onemocněním. Čtyři pacienti z této osmičlenné skupiny byli na našem pracovišti konzultováni pro diabetes insipidus vzniklý v dospělosti. Provedli jsme u nich PET-CT vyšetření s cílem detekovat extrakraniální projevy té nemoci, která způsobila také diabetes insipidus. PET-CT vyšetření u všech těchto pacientů odhalilo extrakraniální patologické změny, z nichž byl odebrán materiál pro histologické vyšetření. Ve dvou případech byla prokázána LCH a v dalších dvou případech Erdheimova-Chesterova nemoc. U pátého pacienta jsme pomocí MR vyšetření detekovali intrakraniální expanzi z okcipitální kosti, která komprimovala mozek v oblasti zrakového centra a způsobovala výpady zorného pole. Pomocí kontrolního MR a PET-CT vyšetření po ukončené léčbě kladribinem jsme potvrdili kompletní remisi. U šesté nemocné s bolestmi hlavy byl suspektní, ale nejasný MR nález z oblasti temporálního laloku. Změnu MR signálu bylo možné interpretovat jako pozdní poradiační změny anebo jako LCH infiltraci této části laloku. PET-CT zobrazení prokázalo patologicky zvýšenou akumulaci fluorodeoxyglukózy v této oblasti, odpovídající maligní infiltraci. Pokles akumulace fluorodeoxyglukózy při kontrolním vyšetření po 2 cyklech kladribinu z SUV 12 na 5 potvrdil senzitivitu nemoci na aplikovanou léčbu. U sedmého a osmého pacienta byla diagnóza LCH stanovena již v dětství a teprve v dospělosti vznikly neurologické problémy typu ataxie a dysatrie. PET-CT vyšetření prokázalo sníženou akumulaci fluorodeoxyglukózy v cerebellu a v bazálních gangliích, odpovídající MR obrazu atrofie této oblasti a zároveň vyloučilo recidivu nemoci.
Závěr:
Celotělové PET-CT vyšetření může být přínosem pro rozpoznání příčiny diabetes insipidus, může potvrdit aktivní ložiska LCH v mozkové tkáni, a naopak snížení akumulace fluorodeoxyglukózy je typickým projevem pozdních neurodegenerativních změn, které vzácně vznikají po mnohaletém průběhu LCH.Klíčová slova:
PET-CT – histiocytóza z Langerhansových buněk – Erdheimova-Chesterova nemoc – diabetes insipidus – kladribin – 2-chlorodeoxyadenosinÚvod
Histiocytóza z Langerhansových buněk je vzácné onemocnění. V dětském věku má tato nemoc agresivnější průběh, než je tomu v dospělosti. U dospělých pacientů má nemoc ve většině případů neagresivní průběh a nejsou výjimkou ani spontánní remise. Z hlediska rozsahu nemoci se rozlišují následující formy LCH:
- unifokální forma LCH: v těle je přítomno pouze jedno izolované ložisko. Obvykle to bývá solitární kostní eozinofilní granulom;
- multifokální forma LCH: v těle je více ložisek v rámci určité tkáně či orgánu. U dospělých to bývají nejčastěji vícečetná kostní ložiska nebo difuzní postižení plicního parenchymu;
- multisystémová (synonymem multiorgánová) forma LCH: nemoc postihuje více orgánů a tkání.
V dospělosti nemoc postihuje nejčastěji kosti ve formě eozinofilního kostního granulomu, o něco méně často pak kůži a plíce, postižení ostatních orgánů je vzácnější. Postižení centrálního nervového systému v dospělosti je mnohem vzácnější, než je tomu v dětském věku, ale má podobné formy jako v dětském věku:
- postižení hypotalamu a hypofýzy. Buňky LCH mají nevysvětlenou afinitu právě k hypotalamu a hypofýze. Klinicky se to nejčastěji projeví deficitem antidiuretického hormonu, klinické projevy deficitu ostatních hormonů jsou méně časté, ale je nutno s nimi počítat. Na MR zobrazení mozku je nejobvyklejším projevem infiltrát v oblasti stopky infundibula.
- infiltráty CNS mimo hypotalamus a hypofýzu. Tyto infiltráty mohou být buď důsledkem extraoseální expanze Langerhansových buněk z primárního kostního ložiska do CNS, nebo mohou vznikat v CNS bez souvislosti s kostmi kalvy.
- pozdní neurodegenerativní změny, obligátně počínající v oblasti cerebella a bazálních ganglií, způsobující ataxii a poruchu řeči. Později se neurodegenerace rozšiřuje i na obě hemisféry.
Postižení CNS lze detekovat metodou CT nebo MR. PET-CT vyšetření je nová metoda, s jejíž pomocí lze excelentně detektovat extrakraniální rozsah nemoci a po léčbě pak vyhodnocovat léčebnou odpověď u pacientů s LCH. Pouze nečetné publikace se věnují přínosu PET-CT pro postižení mozku touto chorobou, a proto v následujícím příspěvku chceme upozornit na přínos PET-CT vyšetření pro postižení CNS histiocytózou z Langerhansových buněk
Metody zobrazení a soubor pacientů
PET a PET-CT vyšetření, metodika
U pacientů souboru jsme prováděli PET a později PET-CT po 6hodinovém lačnění v euglykemii. Aplikovaná aktivita byla v rozmezí 312–409 MBq 18F-FDG i.v. Akumulační fáze byla 60 min. Akvizice byla prováděna do roku 2008 na PET skeneru ECAT ACCEL SIEMENS ve 3D modu (3 vyšetření u 1 nemocného v letech 2004–2007) a později od roku 2008 na hybridním PET-CT skeneru True Point PET-CT Biograph 64 SIEMENS, a to vždy v rozsahu proximální třetiny stehen – baze lební, ve 4 případech i se snímáním hlavy. U Erdheimovy-Chesterovy choroby byly snímány i končetiny. Snímána byla emisní a také transmisní data s korekcí absorpce a iterativní rekonstrukcí dat. Při akvizici na PET-CT skeneru je možné použít režim low dose CT (LD-CT) nebo high dose CT (HD-CT). Vzhledem k opakovaným kontrolám byl ve většině případů zvolen low dose CT protokol, díky kterému jsme výrazně zredukovali radiační zátěž. CT data byla rekonstruována v poli o šíři 500 nebo 700 mm dle habitu pacienta. Parametry LD-CT protokolu byly tyto: slice 5 mm, kolimace 24 × 1,2 mm, faktor stoupání (pitch) 0,8 mm. Parametry HD-CT protokolu byly zvoleny tyto: slice 5 mm, kolimace 24 × 1,2 mm, pitch 0,8 mm. Pro zvýraznění struktur plicního parenchymu byl použit rekonstrukční algoritmus: slice 1,5–2,0 mm, kernel B 80 f (ultra sharp), recon. increment 0,4 mm, window – lung.
Míru metabolické aktivity jsme stanovovali semikvantitativní analýzou SUVmax (maximum standardized uptake value) v měřitelné lézi (např. v lymfatické uzlině, ložisku).
Soubor pacientů
Na našem pracovišti registrujeme celkem 23 pacientů s LCH a 2 pacienty s Erdheimovou-Chesterovou nemocí [1,2]. Postižení CNS bylo prokázáno u 8 z celkového počtu 25 nemocných. Jedná se o 7 mužů a 1 ženu, medián věku, v němž bylo prokázáno postižení CNS histiocytárním onemocněním, je 34,4 (25–57) let. V dalším textu uvedeme popis jednotlivých případů a soubor pacientů rozdělíme dle typu poškození CNS.
Diferenciální diagnostika diabetes insipidus vzniklého v dospělosti
Na naše pracoviště byli odesláni celkem 4 pacienti s diabetes insipidus, zjištěným v dospělosti. Biopsie stopky hypofýzy je spojena s rizikem jejího poškození a minimum odebrané tkáně nemusí přitom vést k histologickému ověření diagnózy. Proto jsme u těchto osob provedli PET-CT vyšetření s cílem detekovat extrakraniální známky choroby, která vedla k poškození hypofýzy. Ve všech námi popsaných případech PET-CT vyšetření prokázalo extrakraniální patologická ložiska, z nichž jsme odebrali vzorky pro histologické vyšetření. Uvedeme stručný popis těchto případů a shrneme je do tabulky.
Pacient s diabetes insipidus a kožními projevy LCH
U 1. pacienta, narozeného 1973, byl dia-betes insipidus diagnostikován v roce 2005, ve 32 letech věku. MR mozku prokázala infiltrát v infundibulu hypofýzy. S tímto nálezem byl sledován bez dalšího zákroku.
V roce 2007 bylo provedeno PET vyšetření, které sice v oblasti CNS nezachytilo aktivitu odpovídající maligní tkáni, zatímco v oblasti perianální bylo jasné solitární ložisko patologicky zvýšené akumulace fluorodeoxyglukózy. Histologické vyšetření materiálu z verukózního periananálního infiltrátu prokázalo LCH.
Z nálezu kožní formy LCH jsme pak dedukovali, že infiltrát ve stopce hypofýzy bude také způsoben stejnou nemocí, protože u LCH je známa vysoká afinita této nemoci právě ke stopce hypofýzy a k hypotalamu.
Na základě PET vyšetření byla dia-gnóza uzavřena jako multisystémová forma postihující CNS a kůži, nebylo prokázáno postižení jiné tkáně či jiného orgánu, což bylo prognosticky příznivé. Po aplikaci 2-chlorodeoxyadenosinu vymizela perianální infiltrace a také vymizel infiltrát stopky hypofýzy.
Kontrolní PET-CT i MR mozku bylo provedeno v roce 2010 a bylo bez recidivy nemoci, infundibulum bylo nadále bez patologického infiltrátu.
Pacient s diabetes insipidus a asymptomatickou plicní formou LCH
U 2. pacienta, narozeného 1974, byl diabetes insipidus prokázán v roce 2007, ve 33 letech věku. Současně byl zjištěn deficit dalších hormonů, dominantně androgenů. Při MR zobrazení byla zjištěna rozšířená stopka hypofýzy s patologickým infiltrátem. V roce 2009 bylo v rámci hledání příčiny diabetes insipidus provedeno PET-CT vyšetření. CT zobrazení prokázalo v plicním parenchymu četné drobné cystické útvary různého tvaru, o průměru 0,8–0,9 cm a ojedinělé drobné plicní nodularity a okrsky zesíleného intersticia. V PET obraze byla pouze hraniční akumulace fluorodeoxyglukózy v oblasti nazofaryngu.
V této fázi plicního postižení neměl mladý muž zatím žádné plicní příznaky a funkční vyšetření plic bylo normální. Následující bronchoalveolární laváž prokázala 10 % buněk exprimujících CD1a antigen a obsahujících protein S100. Tento nález odpovídal plicnímu postižení LCH.
V tomto případě jsme pomocí PET-CT zobrazení detekovali postižení plic LCH, cytologicky je ověřili a podobně jako v předchozím případě soudíme, že infiltrát stopky hypofýzy bude mít původ v LCH. Na kontrolním MR vyšetření po 4. z plánovaných 6 cyklů 2-chlorodeoxyadenosinem bylo popsáno zmenšení průměru infiltrátu hypofýzy z 5,5 na 3,0 mm.
Zde uvádíme pouze MR obraz a fúze PET a MR zobrazení (obr. 1 a 2).
Image 1. Patologický infiltrát infundibula hypofýzy při MR zobrazení. 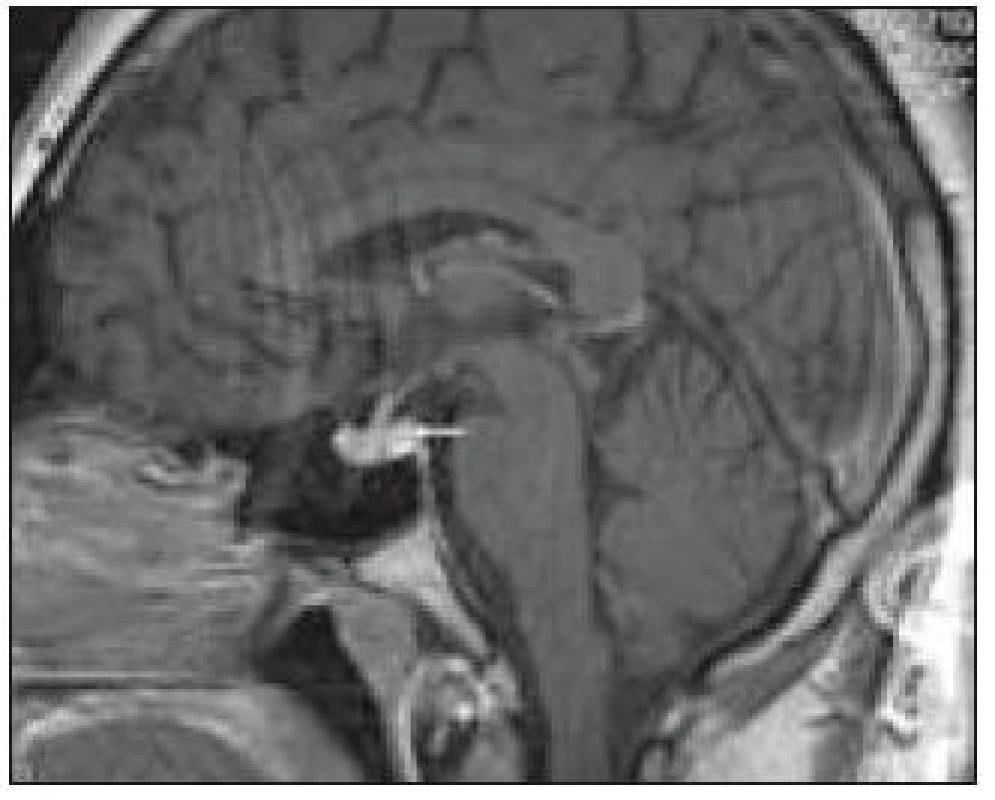
Image 2. PET mozku (sagitální a koronární řez). Fyziologicky vysoká akumulace FDG (fluorodeoxyglukózy) v mozkové kůře, bazálních gangliích, v lymfatické tkáni nosohltanu, svalovině jazyka. Drobné ložisko lehce vyšší akumulace radiofarmaka v hypofyzární stopce hodnoceno jako patologické. 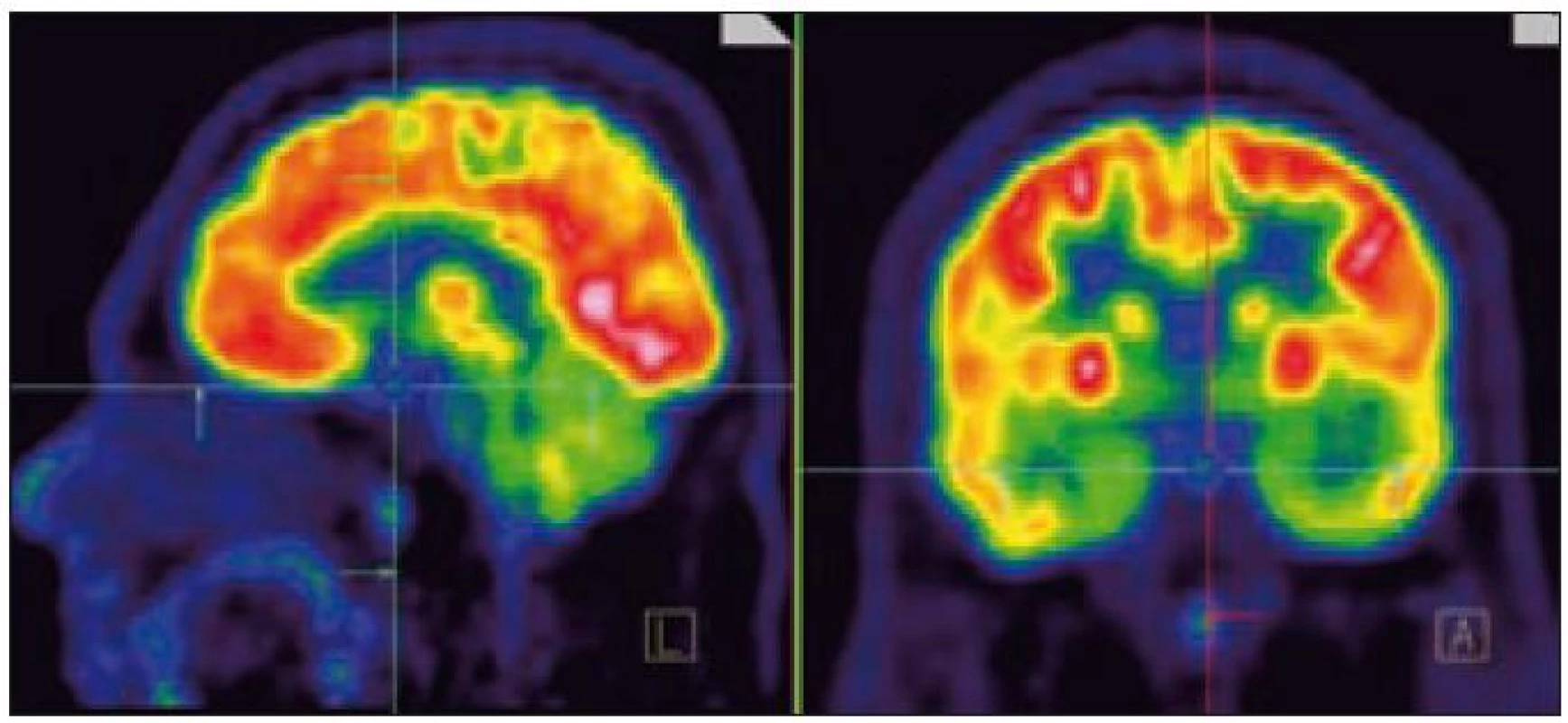
Pacient s diabetes insipidius, následovaným neurologickým postižením při Erdheimově-Chesterově nemoci
3. pacient, narozený 1965, měl v roce 2004 (v 39 letech) prokázán diabetes insipidus. Po zavedení substituce adiuretinem byl bez dalších zdravotních potíží do roku 2008, kdy se postupně rozvinula dysartrie a následně porucha hybnosti ve formě frustní pravostranné hemiparézy. V roce 2006 byl zjištěn první patologický nález na MR mozku – zesílení stopky hypofýzy patologickou infiltrací o průměru 4–5 mm. V následujícím roce byly nalezeny další infiltráty v CNS, již mimo hypofýzu. Na opakovaných MR zobrazeních do roku 2008 narůstal počet infiltrátů CNS a zvětšovala se jejich velikost. Neurochirurgové provedli v roce 2008 pokus o biopsii stopky hypofýzy. Histologické vyšetření získaného malého vzorku tkáně neobjasnilo diagnózu, ale následky diagnostického výkonu způsobily panhypopituitarizmus.
V roce 2009 jsme provedli PET-CT vyšetření. CT zobrazila nepravidelnou strukturu skeletu s nápadnými sklerotickými ložisky v jinak prořídlé kostní struktuře, změny byly nejvíce zřetelné v dlouhých kostech dolních končetin, dále pak v kostech pánve, kalvy, v pažních kostech, zatímco z páteře byl postižen pouze jeden obratel. Dalším patologickým nálezem bylo zesílení stěny aorty až na 8 mm (coated aorta). V retroperitoneu byly zřetelné fibrotické změny. Aplikovaná fluorodeoxyglukóza se akumulovala v dlouhých kostech a v dalších kostních ložiscích, popsaných na CT zobrazení, a dále v zesílené stěně hrudní a břišní aorty, kde byla hodnota SUV 3,6. Scintigrafie skeletu 99mTc-pyrofosfátem znázornila stejná kostní ložiska jako zobrazení pomocí fluorodeoxyglukózy. Všechny tyto změny odpovídaly obrazu Erdheimovy-Chesterovy nemoci.
Diagnóza Erdheimovy-Chesterovynemoci byla ověřena biopsií ložiska v lopatě kosti pánevní. PET-CT vyšetření v tomto případě odhalilo kostní extrakraniální projevy Erdheimovy-Chesterovy nemoci, která způsobila diabetes insipidus jako první příznak nemoci.
Pacient s diabetes insipidus, horečkou nejasného původu a bolestí horních i dolních končetin při Erdheimově-Chesterově nemoci
4. pacient, narozený 1953, měl od roku 2005 diabetes insipidus a také horečku nejasného původu. Dále jej trápily difuzní bolesti kostí v oblasti dolních končetin. Na MR zobrazení mozku byl popsán patologický infiltrát stopky hypofýzy. Tkáň hypofýzy byla v dorzální části objemnější a přitom byla absence vysokého signálu neurohypofýzy.
V roce 2009 bylo provedeno první PET-CT vyšetření. V CT obraze bylo nalezeno zesílení stěny aorty, periaortální fibróza v hrudní a ještě více v břišní oblasti, diskrétní fibrózní změny perirenálně a hyperostotické a sklerotické změny kostí dolních a horních končetin. V kostech končetin, v oblasti epifýz, se zvýšeně akumulovala fluorodeoxyglukóza s hodnotami SUV až 10.
Biopsie lopaty kosti kyčelní byla provedena před PET-CT vyšetřením a byla bez patologického nálezu. V oblasti lopat pánevních kostí však nebyla zvýšená akumulace fluorodeoxyglukózy. Proto po PET-CT zobrazení byla ortopedy provedena cílená biopsie femuru. Histologicky byla prokázána Erdheimova-Chesterova choroba.
Shrnutí přínosu PET-CT vyšetření prostanovení příčiny diabetes insipidus, který se objevil v dospělosti, uvádí tab. 1.
Table 1. U pacientů s diabetes insipidus, vzniklým v dospělosti, bylo provedeno PET-CT vyšetření s cílem nalézt extrakraniální projevy nemoci, která způsobila diabetes insipidus, a histologicky stanovit diagnózu. 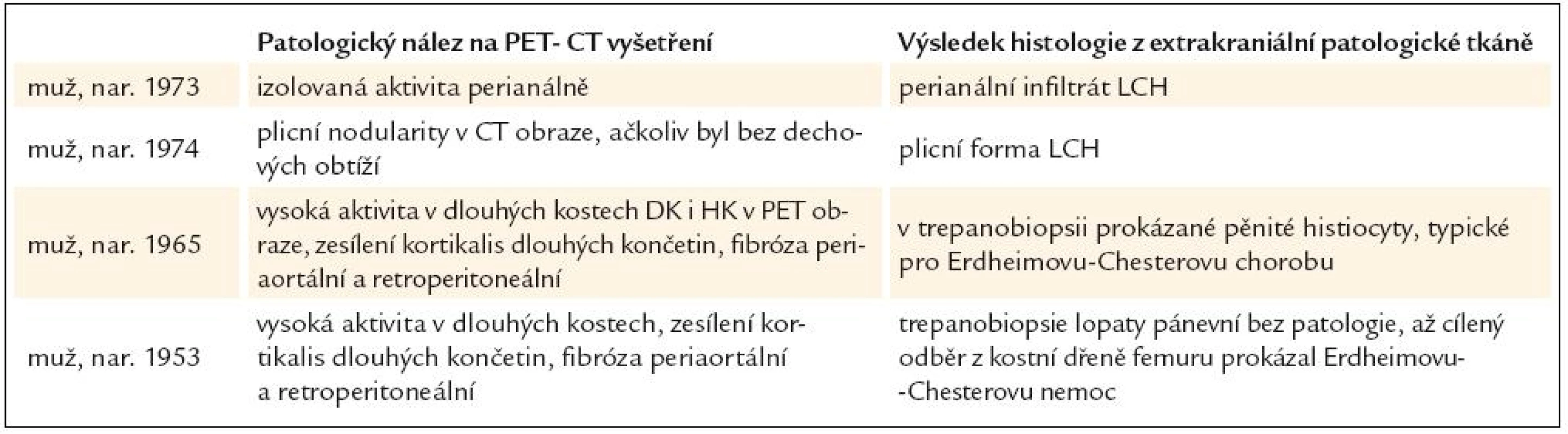
Pacienti s LCH, kteří mají postiženy kosti kalvy a u nichž dochází k extraoseální intrakraniální expanzi LCH tkáně do CNS nebo mají s kostmi nesouvisející infiltrát v CNS
Pacient s expanzí hmot LCH z okcipitální kosti do nitra kalvy, vyvolávající poruchu zraku
Muž, narozený 1978, měl v roce 2002 diagnostikované osteolytické ložisko ve femuru, z něhož byla histologicky ověřena LCH, původně považována za jednoložiskovou formu nemoci. V roce 2003 se mu v okcipitální lokalizaci objevilo měkké zduření o ploše 3 × 3 cm. Postupně, jak se ložisko zvětšovalo, si muž začal stěžovat na poruchy zraku s výpady zrakového pole. Z chirurgicky odstraněných měkkých hmot v okcipitální oblasti vyšla histologicky opět LCH. MR mozku znázornilo osteolýzu a infiltrát v okcipitální kosti, který se šířil oboustranně parasagitálně epidurálně až do oblasti zadní jámy lební, bez infiltrace dury. Prokázaná byla ale i další kostní ložiska, frontoparietálně vpravo a parietálně vlevo. U tohoto muže šlo tedy o multifokální postižení skeletu s expanzí do nitra kalvy.
Po léčbě kladribinem (2-chlorodeoxyadenosinem) intrakraniální expanze zcela vymizela a zcela vymizely i neurologické příznaky. Intrakraniální expanzi před léčbou a po léčbě znázorňují obr. 3 a 4. Metoda PET-CT byla použita až později, pro další sledování po léčbě, v roce 2010 měl tento muž negativní PET-CT vyšetření, které potvrdilo 7 let trvání remise.
Image 3. Pacient s multifokální kostní formou LCH, u něhož v hmoty LCH expandovaly z okcipitální části kalvy intrakraniálně, komprimovaly zrakové centrum. Pacient udával poruchu zraku, značné výpady zorného pole. V tomto případě však nešlo o přímé prorůstání LCH z kostí přes meningy do CNS. 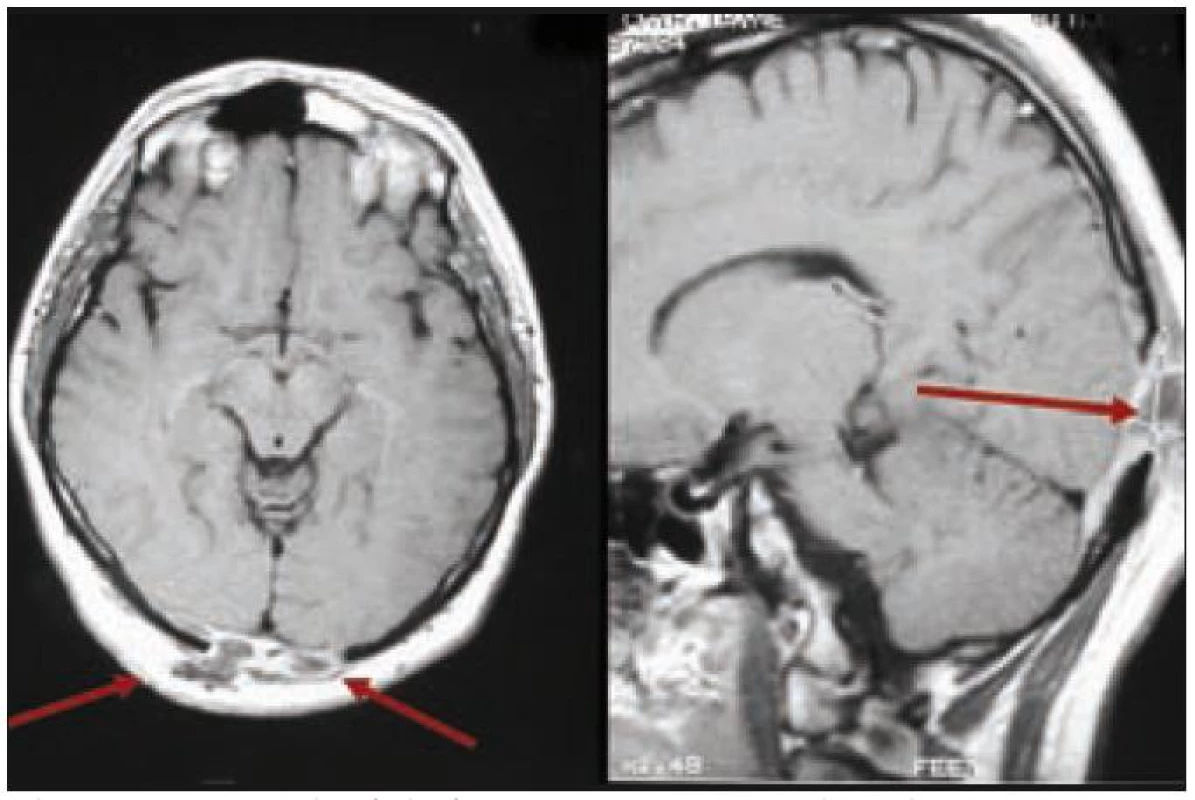
Image 4. Tentýž pacient po chemoterapii, která sestávala ze stimulačního režimu etoposid + cyklosfosfosfamid se sběrem kmenových buněk krvetvorby z periferní krve, a následujících 4 cyklech 2- CDA. Po léčbě došlo k totální regresi ložisek, remise trvá již 7. rok od ukončení léčby. 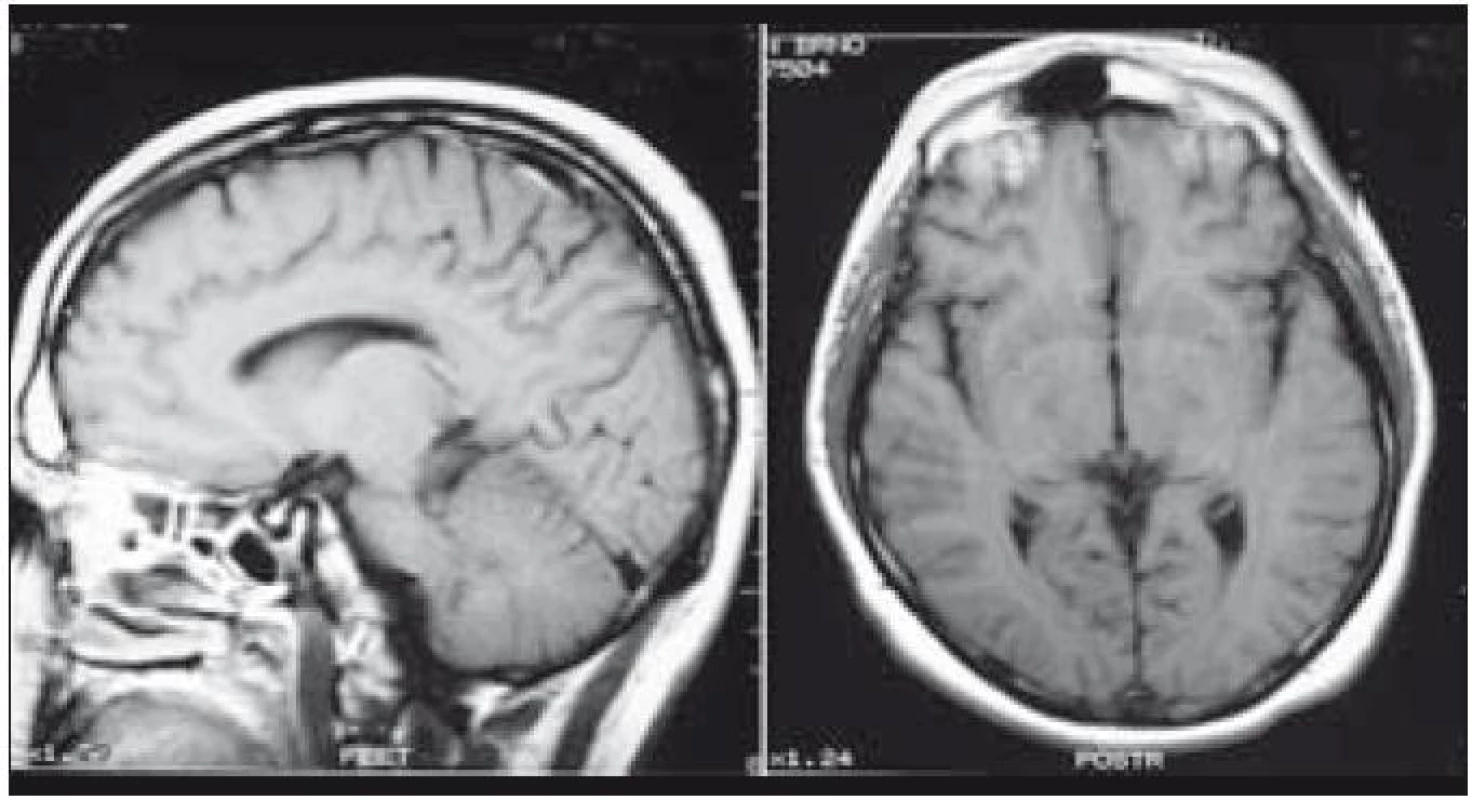
Pacientka s bolestmi hlavy a s infiltrátem LCH v temporálním laloku
Žena, narozená 1953, měla diagnózu LCH zjištěnou ve 23 letech, takže za sebou má již 34letou historii opakovaných relapsů v oblasti lební baze, spánkové kosti a v poslední době i v krční páteři a také na kůži. V roce 2009 a 2010 se objevily bolesti hlavy.
MR zobrazení hlavy potvrdilo postižení oblasti spánkové kosti, která byla již dříve opakovaně ozářena, kumulativní dávka činila 80 Gy. Zcela nově byly detekovány patologické změny v oblasti temporálního laloku, jak dokumentuje obr. 5 a 6. Interpretace změn, zřetelných na MR zobrazení, nebyla jednoznačná. Nebylo možné odlišit ložiskové poradiační změny v CNS od infiltrace mozkové tkáně v této oblasti. Vyšetření magnetickou rezonancí neumožnilo jednoznačný závěr o etiologii těchto změn. Proto bylo provedeno PET-CT vyšetření, které popsalo patologicky zvýšenou aktivitu v oblasti uvedeného ložiska. Na základě PET-CT vyšetření byla diagnóza upřesněna na LCH infiltrát temporálního laloku (obr. 7). Pokles akumulace fluorodeoxyglukózy při kontrolním vyšetření po 2 cyklech kladribinu (z SUV 12,53 na SUV 5,71) potvrdil senzitivitu této nemoci na aplikovanou léčbu.
Image 5. a 6. MR vyšetření mozku po aplikaci kontrastní látky, axiální a koronární rovina. Nepravidelná sytící se infiltrace temporálního laloku vpravo a okolních plen jsou směsí pooperačních, poradiačních změn a zbytkové infiltrace, vzájemně již z MR vyšetření neodlišitelných. 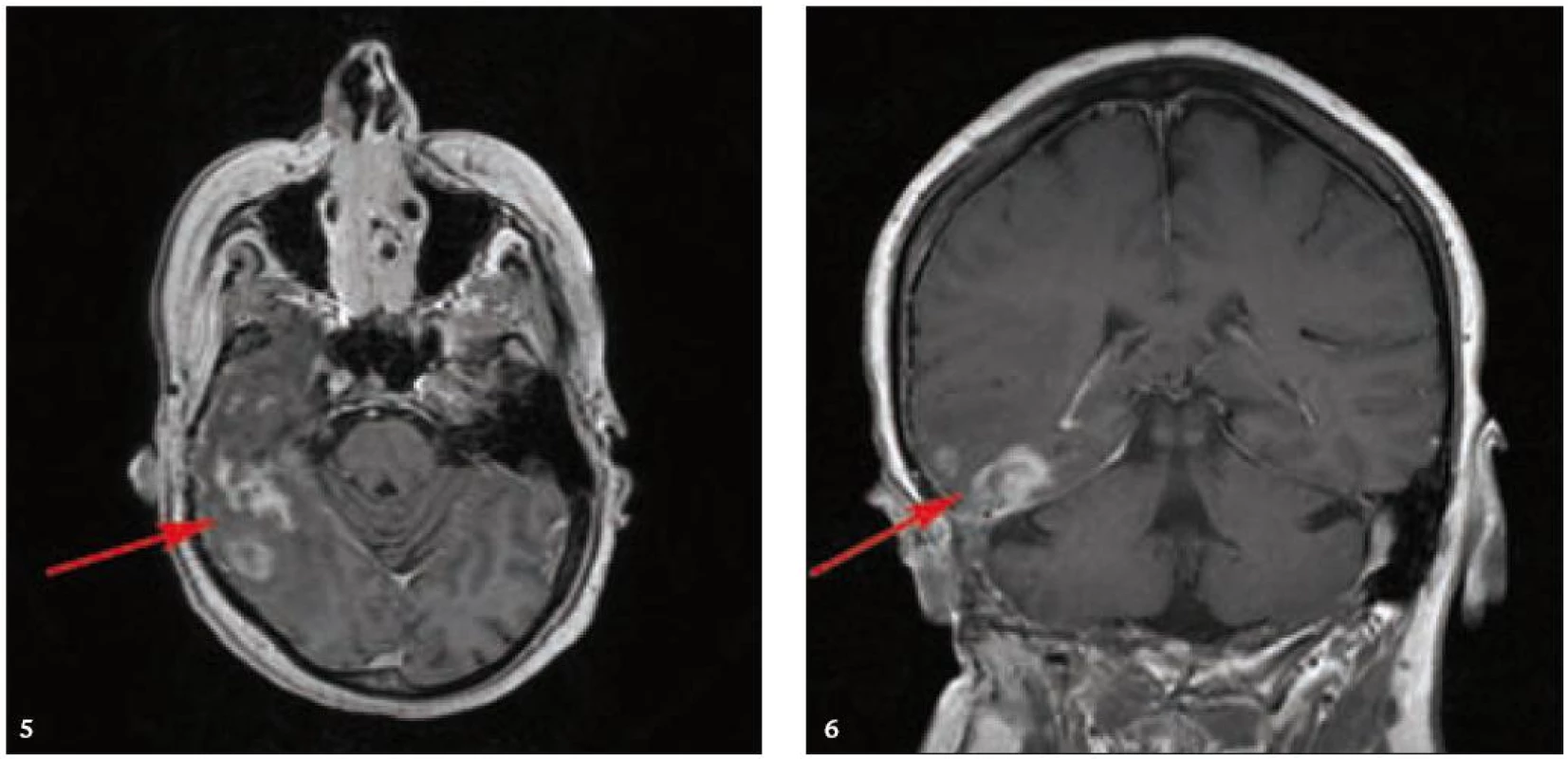
Image 6. PET – Low-dose CT mozku. Ložisko vyšší akumulace FDG temporálně vpravo, SUV<sub>max</sub> 12,53. Relativně nižší akumulace radiofarmaka v okolní kůře temporálního laloku vpravo. 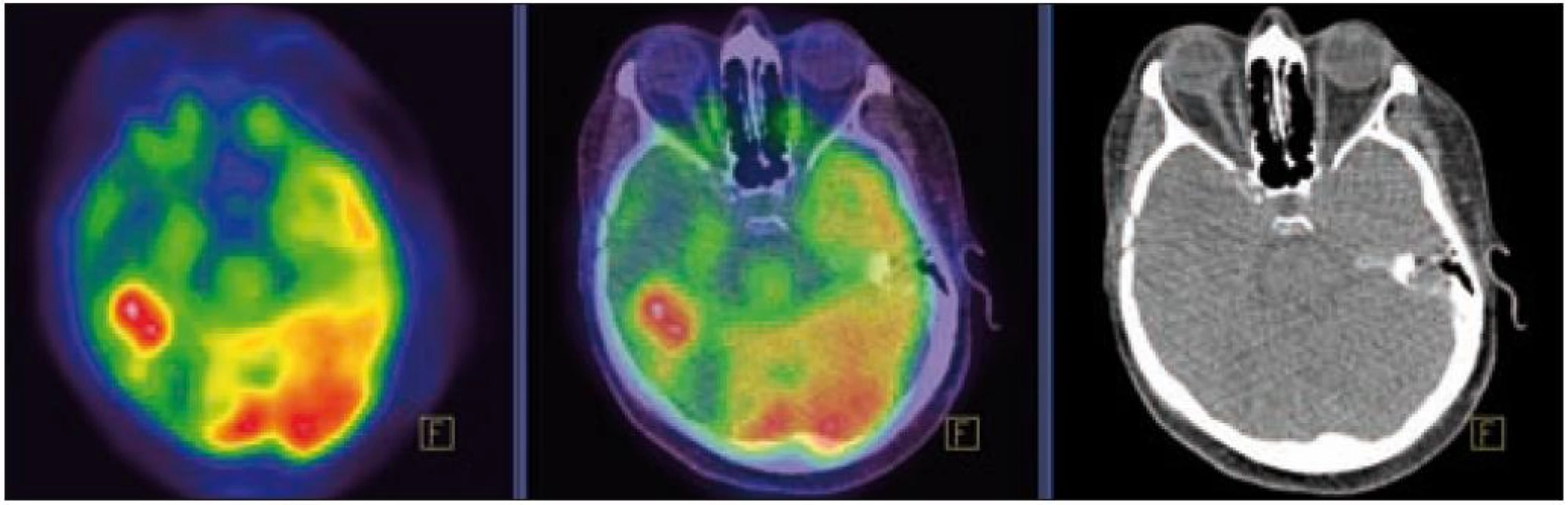
Pacienti, u nichž se po mnohaletém průběhu LCH objevily neurologické příznaky typu ataxie a dysartrie
U 2 pacientů, u nichž od stanovení diagnózy uběhlo 20 a 34 let, se v průběhu sledování objevily neurologické problémy – dysartrie, poruchy chůze, závratě, porucha stability a koordinace pohybů. Stáli jsme tedy před otázkou, zda jde o relaps nemoci v CNS s infiltrací určitých struktur nebo o jiný typ poškození mozku. Odpovědi jsme se snažili získat pomocí PET-CT a MR vyšetření mozku.
Pacient s ataxií a dysartrií po 20 letech od stanovení diagnózy LCH
Muž, narozený v roce 1976, s LCH diagnostikovanou v dětském věku (diabetes insipidus a kožní infiltráty od 5 let věku), měl velmi časté recidivy nemoci a měl četná ložiska v kostech kalvy. V roce 2001 začal udávat diplopii a neurolog dále konstatoval ataxii a dysartrii. Provedené MR popsalo atrofické změny v oblasti bazálních ganglií a dále v bílé a šedé hmotě mozečku, odpovídající neurodegenerativním změnám, typickým pro LCH. Na kontrolním PET vyšetření byla zřetelně snížená akumulace fluorodeoxyglukózy v oblasti bazálních ganglií a v mozečku, bez jakéhokoliv dalšího ložiska v těle. Snížení akumulace fluorodeoxyglukózy v určité oblasti mozku signalizuje sníženou funkci, a tedy degenerativní změny. MR a PET-CT zobrazení umožnily uzavřít diagnózu jako pozdní neurodegenerativní postižení CNS bez prokazatelné aktivity LCH kdekoliv v těle. V průběhu dalších 7 let se neurologické poškození postupně zhoršovalo, pacient nebyl schopen ovládat svěrače, byl upoután na vozík a dysartrie ztěžovala komunikaci. V dubu 2008 pacient umřel, dle pitvy byla příčinou plicní embolie.
PET-CT a MR vyšetření v tomto případě potvrdilo hypometabolizmus v cerebellu, typický pro tento typ pozdních následků LCH.
Pacient s ataxií a dysartrií po 34 letech od stanovení diagnózy LCH
Muž, narozený v roce 1975, trpěl LCH od 1. roku života. První neurologické potíže se objevily v roce 1993 (dysatrie, nejistá chůze, závratě). Neurolog popsal centrální vestibulární syndrom, neúplný neocerebelární syndrom vpravo a naznačenou pravostrannou pyramidovou symptomatologii. Tyto problémy spontánně téměř ustoupily a mladý muž zvládal manuální zaměstnání. Při opakovaných kontrolách nebyla zjištěna recidiva nemoci. V září roku 2009 se však neurologický stav znovu náhle a výrazně zhoršil, objevily se opět závratě, nejistota při chůzi, zhoršená řeč, takže podobné potíže, jako měl v roce 1993, ale intenzivnější. Stáli jsme tedy před otázkou, zda jsou potíže způsobeny recidivou nemoci v CNS nebo jiným postižením CNS.
V září roku 2009 bylo provedeno PET-CT vyšetření, na němž byly v CT obraze zřetelné atrofické změny mozečku, rozšíření likvorových prostor. Při PET zobrazení byla nalezena souměrná a přiměřená aktivita v kůře mozkových hemisfér a v bazálních gangliích. Naproti tomu byla nalezena difuzně nízká akumulace fluorodeoxyglukózy v mozečkových hemisférách. PET-CT vyšetření trupu bylo bez patologie. Takže jediným patologickým nálezem při PET zobrazení byl hypometabolizmus (snížená akumulace fluorodeoxyglukózy) v oblasti cerebella a dle CT mozku zřetelná atrofie cerebella (obr. 8 a 9). MR zobrazení mozku došlo ke stejnému závěru, dominovala výrazná atrofie mozečku a rozšířená 4. komora (obr. 10–12). Informace o změnách v mozku získané pomocí PET-CT zobrazení a MR zobrazení odpovídají pozdním degenerativním změnám, které se výjimečně objeví po mnoha letech trvání této nemoci. Uvedená vyšetření zcela vyloučila možnost vzniku nového aktivního ložiska LCH v mozku nebo jinde v těle.
Image 7. PET – low dose CT mozku. Snížená akumulace fluorodeoxyglukózy v oblasti cerebella, sagitální projekce atrofické změny cerebella v CT zobrazení. 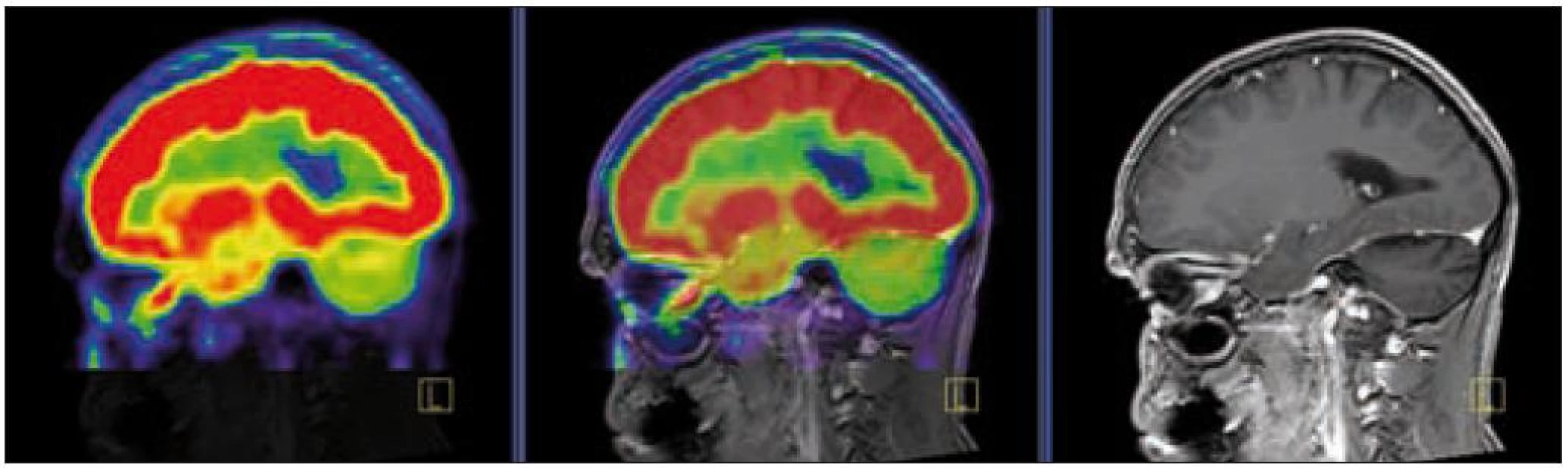
Image 8. PET – low dose CT mozku. Snížená akumulace fluorodeoxyglukózy v oblasti cerebella, sagitální projekce atrofické změny cerebella v CT zobrazení. 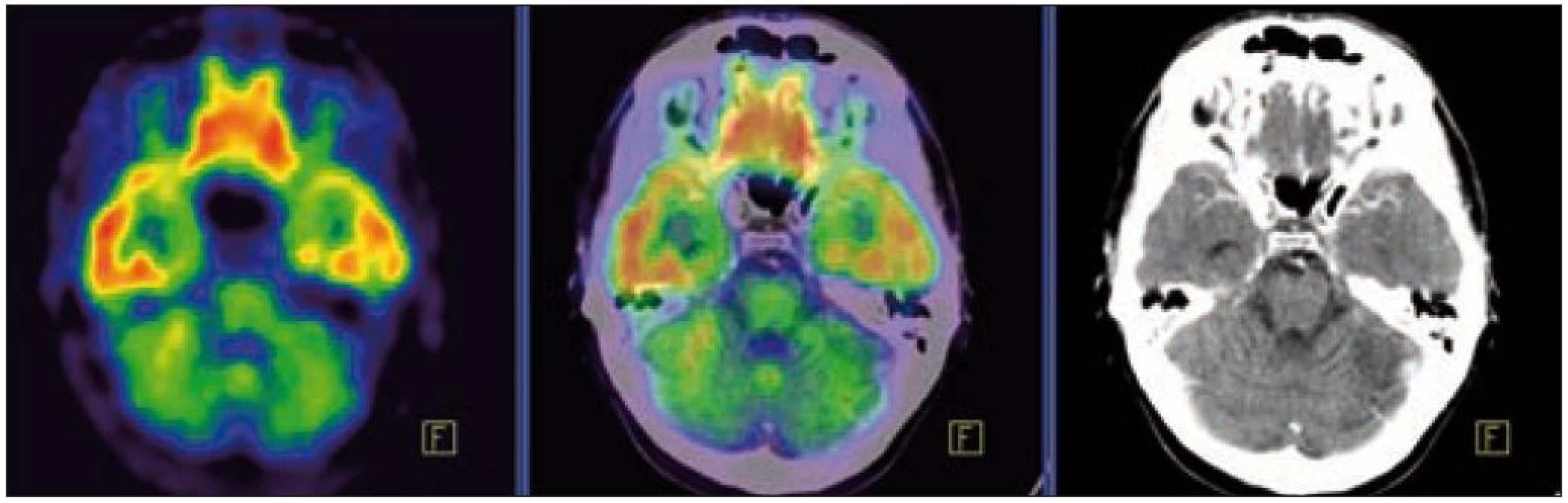
Image 9. MR zobrazení. T2 TSE v axiální rovině: mozečková atrofie. 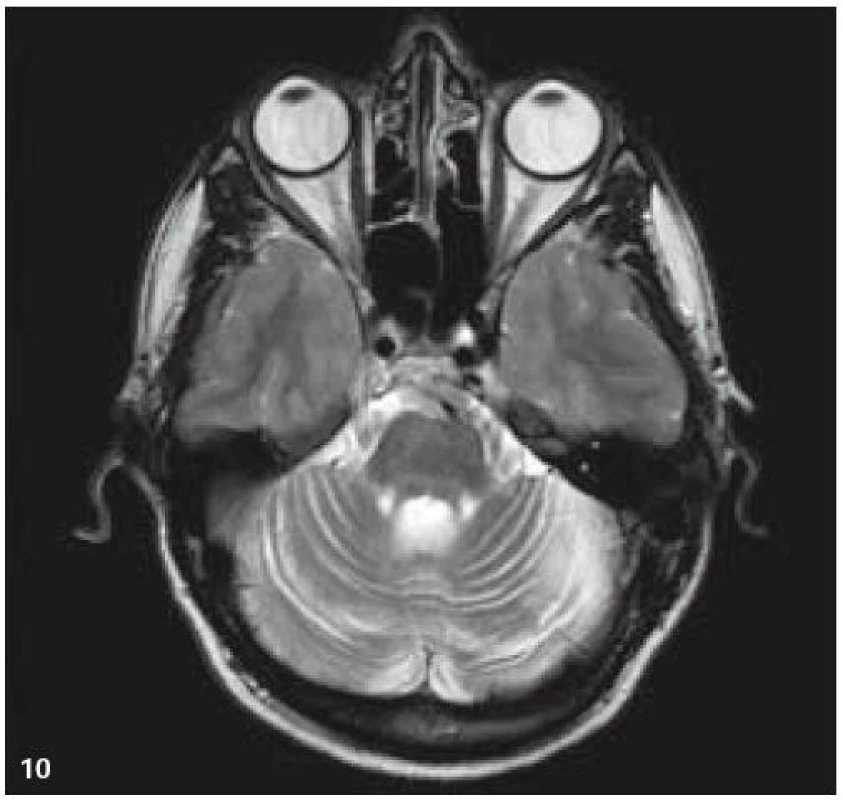
Image 10. MR zobrazení. T2 FLAIR v koronární rovině: mozečková atrofie. 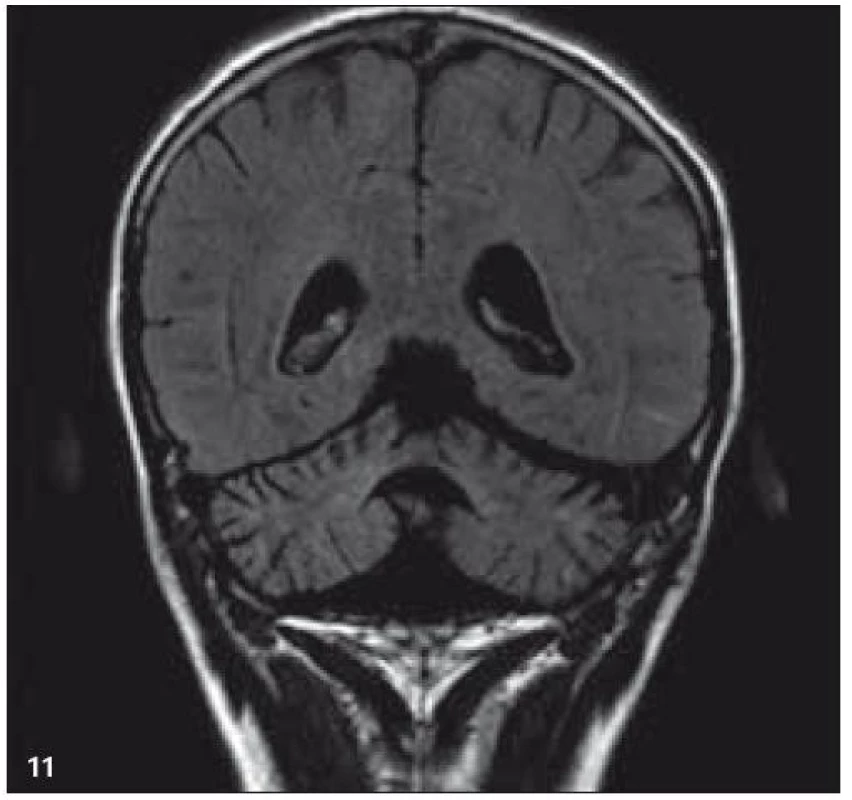
Image 11. MR zobrazení. T2 FLAIR v koronární rovině: zvýšený signál v oblasti amygdalohippokampálních komplexů. 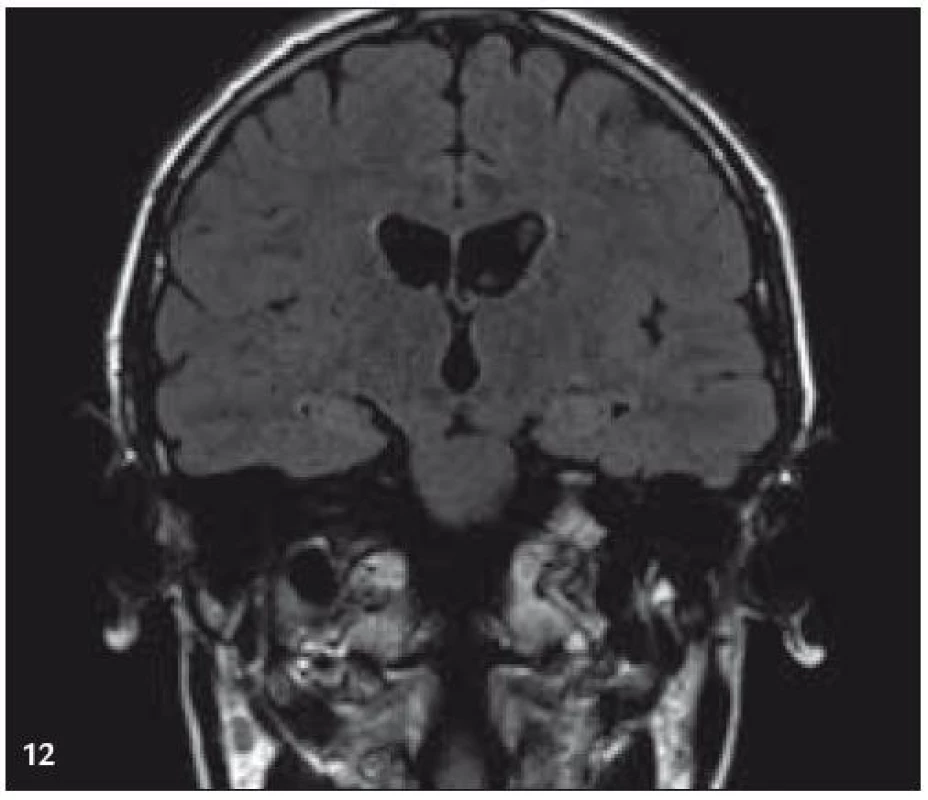
PET-CT vyšetření v tomto případě opět jednoznačně potvrdilo degenerativní změny v oblasti cerebella a zřetelně je odlišilo od možné nové infiltrace CNS v rámci recidivy nemoci.
Diskuze
LCH je vzácnou nemocí, obvykle v dospělosti postihuje kosti, plíce a kůži. V podstatě však může i v dospělosti postihnout kterýkoliv orgán. Z hlediska vlivu nemoci na kvalitu života je nejzávažnější poškození centrálního nervového systému. U dětí je postižení CNS častější než u dospělých, a proto odborná literatura popisuje častěji mozkovou formu LCH v dětském věku než v dospělosti [3–7]. V dospělosti, podobně jako je tomu u dětí, bývá nejčastější postižení hypotalamu a hypofýzy.
Na rozdíl od ostatních tkání, v nichž jsou popisovány spontánní recidivy, je poškození CNS opravdu jen zcela výjimečně přechodné [8,9], obvykle bývá trvalé [10].
Vzhledem k nemožnosti zkoumat průběh těchto komplikací opakovanými biopsiemi, musí poznání vycházet ze zobrazovacích metod, nemnohých výsledků biopsií a autoptických studií a případně analýz cerebrospinálního moku [11].
Postižení hypotalamu a hypofýzy
Buňky LCH mají nevysvětlenou afinitu právě k hypotalamu a k hypofýze. Klinicky se to nejčastěji projeví deficitem antidiuretického hormonu, čili diabetes insipidus. Bylo by však chybou domnívat se, že infiltrace stopky hypofýzy či hypotalamu způsobuje pouze diabetes insipidus. Obvykle bývá deficit i dalších hypofyzárních hormonů, který však nemusí způsobovat jasné klinické příznaky.
Protože LCH a diabetes insipidus patří k sobě, je vhodné si u každého pacienta s nově vzniklým diabetes insipidus položit otázku, zda právě LCH nezpůsobila diabetes insipidus. A dále, pokud prokážeme diabetes insipidus, je nutné cíleně pátrat po případném deficitu dalších hypofyzárních hormonů [10,15–17]. U dvou našich pacientů s infiltrátem stopky hypofýzy LCH je současně snížena hladina gonadotropinu a u jednoho našeho pacienta s Erdheimovou-Chesterovou nemocí je přítomen kompletní iatrogenní panhypopituitarizmus.
Diabetes insipidus v dospělosti mohou vyvolat i jiné choroby, PET-CT má však potenciál zachytit extrakraniální projevy i jiných nemocí, které mohou způsobovat diabetes insipidus [11,18–21,23–26].
Pro průkaz poškození hypotalamu a stopky hypofýzy či hypofýzy samotné se používá MR zobrazení. Nejčastěji je popisován infiltrát v oblasti stopky infundibula, méně často pak patologický infiltrát v hypofýze či obraz prázdného tureckého sedla [27–30].
Při patologické infiltraci jiných orgánů, než je CNS, se obvykle provádí biopsie a diagnóza se stanovuje na podkladě histologického hodnocení odebraného materiálu. Provedení biopsie infundibula hypofýzy však není bez rizika, jak nakonec můžeme ilustrovat na našem pacientovi, u něhož se po biopsii stopky hypofýzy rozvinul kompletní panhypopituitarizmus, aniž by tento zákrok vedl ke stanovení diagnózy. Komplikace při tomto zákroku jsou popisovány i jinými autory [31–35].
V případě našich 4 nemocných s diabetes insipidus přineslo PET-CT vyšetření informaci o extrakraniálních patologických ložiscích. Jednou to bylo ložisko s vysokou akumulací fluo-rodeoxyglukózy na kůži perianálně, z něhož byla histologicky prokázána LCH. V druhém případě CT komponenta celotělového PET-CT vyšetření odhalila strukturální změny plicního parenchymu typické pro plicní formu LCH u nemocného bez respiračních příznaků. Ve třetím a čtvrtém případě PET-CT vyšetření odhalilo vysokou akumulaci fluorodeoxyglukózy v dlouhých kostech, typickou pro Erdheimovu-Chesterovu chorobu.
Domníváme se proto, že u dospělého pacienta s nově vzniklým diabetes insipidus je vhodné provést PET-CT vyšetření s cílem detekovat extrakraniální projevy té nemoci, která způsobila diabetes insipidus, a jejich charakter pak ověřit biopsií.
Infiltráty CNS mimo hypotalamo-hypofyzární osu
Tyto infiltráty mohou vznikat jak propagací z primárního kostního ložiska do CNS, tak přímo v mozkových plenách či v CNS bez souvislosti s kostí. Popisují se případy nově vzniklé epilepsie, jejíž etiologií bylo ložisko LCH [36] či jiné neurologické příznaky dle lokalizace ložiska LCH v mozku [37–40]. Z literárních popisů je jasné, že tento typ postižení je méně častý než hypotalamicko-hypofyzární infiltrace. Tato ložiska jsou obvykle detekována pomocí CT a MR zobrazení.
V našem souboru máme jednoho pacienta s intrakraniální expanzí LCH v oblasti okcipitální, která způsobovala poruchu zraku, výpady zorného pole a jednu pacientku, u níž byla prokázána infiltrace v oblasti spánkového laloku bez MR prokazatelné spojitosti s kostním postižením. U této nemocné nebylo možné MR zobrazení jednoznačně interpretovat jako ložisko LCH v mozkové tkáni, protože podobnou změnu signálu na MR mohly způsobit změny v mozkové tkáni po radioterapii. PET-CT vyšetření v tomto případě prokázalo vysokou akumulaci fluorodeoxyglukózy, odpovídající maligní tkáni. Pokles akumulace fluorodeoxyglukózy v průběhu chemoterapie potvrdil maligní infiltraci a senzitivitu tohoto infiltrátu v CNS na podanou léčbu.
Léčba infiltrace CNS histiocytózou z Langerhansových buněk
Klasické léčebné postupy pro multifokální či multisystémovou formu nemoci, založené na merkaptopurinu a vinblastinu [41], nelze použít, protože tyto léky nepronikají v dostatečně účinné koncentraci do CNS. V současnosti se za lék první volby pro pacienty s infiltrací mozku LCH považuje kladribin, který v dostatečně účinné dávce proniká hematoencefalickou bariérou [42–46].
Tento lék jsme podali také našim pacientům s infiltrátem LCH ve stopce hypofýzy. V prvním případě jsme dosáhli vymizení infiltrátu infundibula a remise trvá již 5 let od ukončení léčby. V druhém případě je k dispozici zatím jenom kontrolní vyšetření po 4. cyklu chemoterapie, které prokázalo zmenšení průměru infiltrátu z 5,5 na 3,0 mm.
Z dvou pacientů s Erdheimovou-Chesterovou nemocí došlo k výraznému zlepšení pouze u jednoho z nich.
V případě infiltrátu LCH, který postihoval temporální lalok, jsme pomocí PET-CT zobrazení prokázali léčebnou odpověď již po 2. cyklu 2-chlorodeoxyadenosinu. V ložisku v temporálním laloku poklesla akumulace fluorodeoxyglukózy o více než o 50 % (SUV pokleslo z 12,53 na 5,71), takže dosaženou léčebnou odpověď hodnotíme jako parciální remisi.
Pozdní neurodegenerativní změny, obvykle počínající v mozečku a v bazálních gangliích, způsobující ataxii a poruchu řeči
U pacientů s diagnózou LCH stanovenou v dětství se po mnoha letech (obvykle až v dospělosti) velmi vzácně vyskytují takzvané pozdní neurodegenerativní změny. Tento typ postižení mozku postupně progreduje a je nevratný. Etiologie tohoto procesu není zcela známa a nemáme zatím ani účinnou léčbu, kterou by bylo možné proces pozastavit.
Pozdní neurodegenerativní změny postihují nejčastěji cerebellum, nucleusdentatus, cerebellární bílou hmotu a mozkový kmen. Projevují se hypore-flexií, ataxií, závratěmi, dysartrií, nystagmem, tremorem, diplopií, psychomotorickou retardací a neuropsychologickými defekty.
Současné patofyziologické informace o tomto procesu vycházejí z nemnohých autoptických a bioptických studií, které neprokázaly buňky, exprimující znak CD1+, v ložiscích postižených neurodegenerativními změnami. V ložiscích dominovala výrazná zánětlivá infiltrace, obsahující CD8 lymfocyty, což odpovídá T buněčnému zánětlivému procesu, který je provázen destrukcí neuronů a axonů se sekundární demyelinizací, připomínající paraneoplastickou encefalitidu [47–59].
První metodou, která zobrazila neurodegenerativní změny, bylo CT a posléze s rozvojem odpovídající technologie pak MR [60–64]. PET-CT vyšetření bylo pro detekci těchto změn použito až v poslední době a dle 3 publikací, které hodnotí přínos PET-CT pro tento typ poškození, umožňuje právě PET-CT zobrazení sledování dynamiky tohoto procesu [65–67].
V našich dvou případech odpovídala lokalizace snížení akumulace fluorodeoxyglukózy rozsahu pozdních denegerativních změn dle MR vyšetření. Nepřítomnost jiného patologického ložiska v těle nemocných odpovídala trvající remisi LCH.
Závěr pro praxi
- PET-CT vyšetření považujeme za velmi přínosné pro nemocné s diabetes insipidus vzniklým v dospělosti, může odhalit extrakraniální projevy té nemoci, která vedla ke vzniku diabetes insipidus, a nasměrovat cílený histologický odběr na tyto extrakraniální projevy.
- PET-CT vyšetření se osvědčilo při neurologických symptomech pacientů s LCH. Umí odlišit LCH infiltraci CNS s vysokou akumulací fluorodeoxyglukózy od pozdních neurodegenerativních změn.
Tato publikace byla připravena v rámci projeku MUNI/A/1012/2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod“, a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS10387 a NS10406.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 9. 9. 2010
Sources
1. Adam Z, Szturz P, Pour L et al. Histiocytóza z Langerhansových buněk u dospělých osob. Postgrad Med 2010; 12 : 704–711.
2. Adam Z, Krejčí M, Pour L et al. Odlišné průběhy recidivující anebo multisystémové formy histiocytózy z Langerhansových buněk. Popis 22 případů z jednoho pracoviště. Vnitř Lék 2010; 56 : 542–557.
3. Grois N, Prayer D, Prosch H et al. CNS LCH Co-operative Group. Neuropathology of CNS disease in Langerhans cell histiocytosis. Brain 2005; 128 : 829–838.
4. Report of the Histiocyte Society workshop on “Central nervous system (CNS) disease in Langerhans cell histiocytosis (LCH)”. Med Pediatr Oncol 2009; 29 : 73–78.
5. Grois N, Fahrner B, Arceci RJ et al. Histiocyte Society CNS LCH Study Group. Central nervous system disease in Langerhans cell histiocytosis. J Pediatr 2010; 156 : 873–881.
6. D’Ambrosio N, Soohoo S, Warshall C et al. Craniofacial and intracranial manifestations of Langerhans cell histiocytosis: report of findings in 100 patients. AJR Am J Roentgenol 2008; 191 : 589–597.
7. Davidson L, McComb JG, Bowen I et al. Craniospinal Langerhans cell histiocytosis in children: 30 years’ experience at a single institution. J Neurosurg Pediatr 2008; 1 : 187–195.
8. Ryan P, Walterfang M, Scholes A et al. Recovery of cognitive function in neuropsychiatric Langerhan’s cell histiocytosis. Psychiatry Clin Neurosci 2006; 60 : 629–632.
9. Gunny R, Clifton A, Al-Memar A. Spontaneous regression of supratentorial intracerebral Langerhans’ cell histiocytosis. Br J Radiol 2004; 77 : 685–687.
10. Nanduri VR, Bareille P, Pritchard J et al. Growth and endocrine disorders in multisystem Langerhans’ cell histiocytosis. Clin Endocrinol (Oxf) 2000; 53 : 509–515.
11. Stockschlaeder M, Sucker C. Adult Langerhans cell histiocytosis. Eur J Haematol 2006; 76 : 363–368.
12. Grois N, Prosch H, Waldhauser F et al. Pineal gland abnormalities in Langerhans cell histiocytosis. Pediatr Blood Cancer 2004; 43 : 261–266.
13. Horn EM, Coons SW, Spetzler RF et al. Isolated Langerhans cell histiocytosis of the infundibulum presenting with fulminant diabetes insipidus. Childs Nerv Syst 2006; 22 : 542–544.
14. Prosch H, Grois N, Prayer D et al. Central diabetes insipidus as presenting symptom of Langerhans cell histiocytosis. Pediatr Blood Cancer 2004; 43 : 594–599.
15. Prosch H, Grois N, Bökkerink J et al. Central diabetes insipidus: Is it Langerhans cell histiocytosis of the pituitary stalk? A diagnostic pitfall. Pediatr Blood Cancer 2006; 46 : 363–366.
16. Amato MC, Elias LL, Elias J et al. Endocrine disorders in pediatric – onset Langerhans Cell Histiocytosis. Horm Metab Res 2006; 38 : 746–751.
17. De Buyst J, Massa G, Christophe C et al. Clinical, hormonal and imaging findings in 27 children with central diabetes insipidus. Eur J Pediatr 2007; 166 : 43–49.
18. Carpinteri R, Patelli I, Casanueva FF et al. Pituitary tumours: inflammatory and granulomatous expansive lesions of the pituitary. Best Pract Res Clin Endocrinol Metab 2009; 23 : 639–650.
19. Müssig K, Beschorner R. Rare differential diagnosis of diabetes insipidus. Dtsch Med Wochenschr 2008; 133 : 2159–2160.
20. Rupp D, Molitch M. Pituitary stalk lesions. Curr Opin Endocrinol Diabetes Obes 2008; 15 : 339–345.
21. Makras P, Alexandraki KI, Chrousos GP et al. Endocrine manifestations in Langerhans cell histiocytosis. Trends Endocrinol Metab 2007; 18 : 252–257.
22. Ghirardello S, Garrè ML, Rossi A et al. The diagnosis of children with central diabetes insipidus. J Pediatr Endocrinol Metab 2007; 20 : 359–375.
23. Ghirardello S, Malattia C, Scagnelli P et al. Current perspective on the pathogenesis of central diabetes insipidus. J Pediatr Endocrinol Metab 2005; 18 : 631–645.
24. Maghnie M, Cosi G, Genovese E et al. Central diabetes insipidus in children and young adults. N Engl J Med 2000; 343 : 998–1007.
25. Maghnie M. Diabetes insipidus. Horm Res 2003; 59 (Suppl 1): 42–54.
26. Maghnie M, Ghirardello S, De Bellis A et al. Idiopathic central diabetes insipidus in children and young adults is commonly associated with vasopressin-cell antibodies and markers of autoimmunity. Clin Endocrinol (Oxf)2006; 65 : 470–478.
27. Varan A, Cila A, Akyüz C et al. Radiological evaluation of patients with pituitary langerhans cell histiocytosis at diagnosis and at follow-up. Pediatr Hematol Oncol 2008; 25 : 567–574.
28. Demaerel P, Van Gool S. Paediatric neuroradiological aspects of Langerhans cell histiocytosis. Neuroradiology 2008; 50 : 85–92.
29. Prayer D, Grois N, Prosch H et al. MR imaging presentation of intracranial disease associated with Langerhans cell histiocytosis. AJNR Am J Neuroradiol 2004; 25 : 880–891.
30. Halefoglu AM. Magnetic resonance imaging of thickened pituitary stalk proceeding to Langerhans cell histiocytosis in a child. Australas Radiol 2006; 50 : 175–178.
31. Killory BD, Ponce FA, Wait SD et al. Endoscopic intraventricular biopsy of infundibular Langerhans cell histiocytosis: case report. Neurosurgery 2009; 65: E214–E215.
32. Charalampaki P, Reisch R, Ayad A et al. Endoscopic endonasal pituitary surgery: surgical and outcome analysis of 50 cases. J Clin Neurosci 2007; 14 : 410–415.
33. Sudhakar N, Ray A, Vafidis JA. Complications after trans-sphenoidal surgery: our experience and a review of the literature. Br J Neurosurg 2004; 18 : 507–512.
34. Grois N, Pötschger U, Prosch H et al. Risk factors for diabetes insipidus in langerhans cell histiocytosis. Pediatr Blood Cancer 2006; 46 : 228–230.
35. Tashiro T, Sano T, Xu B et al. Spectrum of different types of hypophysitis: a clinicopathologic study hypophysitis in 31 cases. Endocr Pathol 2002; 13 : 183–185.
36. Jain RS. Langerhans cell histiocytosis presenting as adult onset epilepsy. Int J Clin Pract 2003; 57 : 739–741.
37. Patton N, Lai T, Robbins P et al. Presumed choroidal langerhans cell histiocytosis following a previously resected solitary central nervous system lesion in an adult. Arch Ophthalmol 2006; 124 : 1193–1195.
38. Manning L, Sellal F. Hypothalamic amnesia and frontal lobe function disorders after Langerhans cell histiocytosis. J Neurol Neurosurg Psychiatry 2003; 74 : 1348.
39. Ghosal N, Kapila K, Kakkar S et al. Langerhans cell histiocytosis infiltration in cerebrospinal fluid: a case report. Diagn Cytopathol 2001; 24 : 123–125.
40. Cagli S, Oktar N, Demirtas E. Langerhans’ cell histiocytosis of the temporal lobe and pons. Br J Neurosurg 2004; 18 : 174–180.
41. von Stebut E, Schadmand-Fischer S, Bräuninger W et al. Successful treatment of adult multisystemic Langerhans cell histiocytosis with psoralen-UV-A, prednisolone, mercaptopurine and vinblastine. Arch Dermatol 2008; 144 : 649–653.
42. Binning MJ, Brockmeyer DL. Novel multidisciplinary approach for treatment of langerhans cell histiocytosis of the skull base. Skull Base 2008; 18 : 53–58.
43. Montella L, Insabato L, Palmieri G. Imatinib mesylate for cerebral Langerhans’-cell histiocytosis. N Engl J Med 2004; 351 : 1034–1035.
44. Allen CE, McClain KL. Langerhans cell histiocytosis: a review of past, current and future therapies. Drugs Today (Barc) 2007; 43 : 627–643.
45. Watts J, Files B. Langerhans cell histiocytosis: central nervous system involvement treated successfully with 2-chlorodeoxyadenosine. Pediatr Hematol Oncol 2001; 18 : 199–204.
46. Dhall G, Finlay JL, Dunkel IJ et al. Analysis of outcome for patients with mass lesions of the central nervous system due to Langerhans cell histiocytosis treated with 2-chlorodeoxyadenosine. Pediatr Blood Cancer 2008; 50 : 72–79.
47. van der Knaap MS, Arts WF, Garbern JY et al. Cerebellar leukoencephalopathy: most likely histiocytosis-related. Neurology 2008; 71 : 1361–1367.
48. Wnorowski M, Prosch H, Prayer D et al. Pattern and course of neurodegeneration in Langerhans cell histiocytosis. J Pediatr 2008; 153 : 127–132.
49. Van’t Hooft I, Gavhed D, Laurencikas Eet al. Neuropsychological sequelae in patients with neurodegenerative Langerhans cell histiocytosis. Pediatr Blood Cancer 2008; 51 : 669–674.
50. Gavhed D, Akefeldt SO, Osterlundh G et al. Biomarkers in the cerebrospinal fluid and neurodegeneration in Langerhans cell histiocytosis. Pediatr Blood Cancer 2009; 53 : 1264–1270.
51. Shuper A, Stark B, Yaniv Y et al. Cerebellar involvement in Langerhans’ cell histiocytosis: a progressive neuropsychiatric disease. J Child Neurol 2000; 15 : 824–826.
52. Weiss SE, O’Connor L, Welsh JS. Refinement of radiation therapy based on PET data in an adult with Langerhans cell histiocytosis of soft tissues. Clin Adv Hematol Oncol 2006; 4 : 290–292.
53. Mittheisz E, Seidl R, Prayer D et al. Central nervous system-related permanent consequences in patients with Langerhans cell histiocytosis. Pediatr Blood Cancer 2007; 48 : 50–56.
54. Imashuku S, Ishida S, Koike K et al. Japan LCH Study Group. Cerebellar ataxia in pediatric patients with Langerhans cell histiocytosis. J Pediatr Hematol Oncol 2004; 26 : 735–739.
55. Grois N, Prayer D, Prosch H et al. Neuropathology of CNS disease in Langerhans cell histiocytosis. Brain 2005; 128 : 829–838.
56. Martin-Duverneuil N, Idbaih A, Hoang-Xuan K et al. French Langerhans Cell Histiocytosis Study Group. MRI features of neurodegenerative Langerhans cell histiocytosis. Eur Radiol 2006; 16 : 2074–2082.
57. Mittheisz E, Seidl R, Prayer D et al. Central nervous system-related permanent consequences in patients with Langerhans cell histiocytosis. Pediatr Blood Cancer 2007; 48 : 50–56.
58. Grois N, Fahrner B, Arceci RJ et al. Histiocyte Society CNS LCH Study Group. Central nervous system disease in Langerhans cell histiocytosis. J Pediatr 2010; 156 : 873–881.
59. Bös M, Grothe C, Urbach H et al. Cerebellar syndromes in Langerhans’ cell histiocytosis. Nervenarzt 2007; 78 : 437–440.
60. Prosch H, Grois N, Wnorowski M et al. Long-term MR imaging course of neurodegenerative Langerhans cell histiocytosis. AJNR Am J Neuroradiol 2007; 28 : 1022–1028.
61. Ertan G, Huisman TA. Susceptibility-weighted imaging in neurodegeneration in Langerhans cell histiocytosis. J Pediatr 2010; 156 : 1032.
62. Imashuku S, Okazaki NA, Nakayama M et al. Japan LCH Study Group. Treatment of neurodegenerative CNS disease in Langerhans cell histiocytosis with a combination of intravenous immunoglobulin and chemotherapy. Pediatr Blood Cancer 2008; 50 : 308–311.
63. Steiner M, Prayer D, Asenbaum S et al. Modern imaging methods for the assessment of Langerhans’ cell histiocytosis-associated neurodegenerative syndrome: case report. J Child Neurol 2005; 20 : 253–257.
64. Ribeiro MJ, Idbaih A, Thomas C et al. 18F-FDG PET in neurodegenerative Langerhans cell histiocytosis: results and potential interest for an early diagnosis of the disease. J Neurol 2008; 255 : 575–580.
65. Calming U, Bemstrand C, Mosskin M et al. Brain 18FDG PET scan in central nervous system langerhans cell histiocytosis. J Pediatr 2002; 141 : 435–440.
66. Büchler T, Cervinek L, Belohlavek O et al. Langerhans cell histiocytosis with central nervous system involvement: follow-up by FDG-PET during treatment with cladribine. Pediatr Blood Cancer 2005; 44 : 286–288.
67. Mahnel R, Tan KH, Fahlbusch R et al. Problems in differential diagnosis of non Langerhans cell histiocytosis with pituitary involvement: case report and review of literature. Endocr Pathol 2002; 13 : 361–368.
68. Salsano E, Savoiardo M, Nappini S et al. Late-onset sporadic ataxia, pontine lesion, and retroperitoneal fibrosis: a case of Erdheim-Chester disease. Neurol Sci 2008; 29 : 263–267.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue Supplementum 2-
All articles in this issue
- Postižení CNS histiocytózou z Langerhansových buněk a Erdheimovou-Chesterovou nemocí. Přínos PET-CT vyšetření pro diagnostiku a vyhodnocení léčebné odpovědi
- Postižení plic u pacientů s multiorgánovou formou histiocytózy z Langerhansových buněk. Popis 8 pacientů a přehled literatury
- Přínos PET-CT pro diagnostiku a sledování plicní formy histiocytózy z Langerhansových buněk
- Přehled léčby histiocytózy z Langerhansových buněk u osob dospělého věku
- Použití kladribinu v první linii léčby multifokální anebo multiorgánové formy histiocytózy z Langerhansových buněk u dospělých osob
- Radioterapie histiocytózy z Langerhansových buněk
- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Nekrobiotický xantogranulom – vzácná kožní komplikace u nemocného s mnohočetným myelomem
- Leukemie z dendritických buněk CD4+56+, typ DC2
- Systémová mastocytóza
- Představení histiocytárních chorob, o nichž pojednává toto supplementum časopisu Vnitřní lékařství
- Histiocytóza z Langerhansových buněkz pohledu patologa
- Diagnostická patológia non-Langerhansových histiocytóz
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
- Granulomatóza z Langerhansových buněk
- Projevy histocytózy z Langerhansových buněk v ORL oblasti
- Projevy histiocytózy z Langerhansových buněk v orofaciální oblasti
- Histiocytóza z Langerhansových buněk – kožní aspekty onemocnění
- Histiocytóza z Langerhansových buněk u dospělých
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Systémová mastocytóza
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

