-
Medical journals
- Career
Stanovenie progresie karcinómu prostaty využitím metodiky RT‑PCR
: A. Zummerová 1; M. Blaško 2; D. Böhmer 3; J. Filo 2; P. Kováč 1; Vanda Repiská 3
: Súdnolekárske a patologicko‑anatomické pracovisko ÚDZS Bratislava, Slovenská republika, vedúci lekár MU Dr. Roman Kuruc 1; Urologická klinika Lekárskej fakulty UK a UN akad. L. Dérera Bratislava, Slovenská republika, prednosta prof. MU Dr. Ján Breza, DrSc. 2; Ústav lekárskej biológie, genetiky a klinickej genetiky Lekárskej fakulty UK a UN Bratislava, Slovenská republika, prednosta doc. MUDr. Daniel Böhmer, PhD. 3
: Vnitř Lék 2010; 56(11): 1130-1137
: Original Contributions
Cieľom našej štúdie bolo zistiť možné využitie metodiky RT‑PCR (Reverse Transcriptase-Polymerase Chain Reaction – spätná polymerázová reťazová reakcia) ako diagnostickej a prognostickej metódy pre určenie stupňa progresie karcinómu prostaty. Táto metodika sa bežne využíva na detekciu cirkulujúcich rakovinových buniek v periférnej krvi pacientok so zhubným nádorom prsníka a našou snahou bolo zaviesť túto metodiku i pri karcinóme prostaty. Jej prínosom je včasné zachytenie rozsevu rakovinových buniek, tzv. mikrometastáz, v periférnej krvi, ako jednej z prvých kaskád začínajúceho metastatického procesu. Na základe stanovenia progresie ochorenia je potom možné zvoliť vhodný individuálny prístup liečby u jednotlivých pacientov. Pomocou tejto metodiky sme analyzovali súbor 50 mužov: 28 pacientov s klinicky lokalizovaným, resp. lokálne pokročilým karcinómom prostaty, 7 pacientov s klinicky overeným metastatickým rozsevom ochorenia, 8 pacientov s benígnou hyperpláziou prostaty a 7 zdravých mladých mužov.
Kľúčové slová:
karcinóm prostaty – RT‑PCR reakcia – mikrometastázy – prostatický špecifický antigén – prostatický špecifický membránový antigénÚvod
Karcinóm prostaty (CaP) patrí medzi najčastejšie sa vyskytujúce zhubné nádory u mužov v Európe i v USA [1]. Zo všetkých malígnych nádorov incidencia karcinómu prostaty narastá najrýchlejšie s vekom. Viac než 95 % karcinómov prostaty sú adenokarcinómy. Karcinóm prostaty sa vyznačuje širokou škálou klinických, patologických, histologických, genetických a molekulárných prejavov a práve toto spektrum môže sťažovať rozhodnutia o liečbe individuálnych pacientov [2]. Práve preto karcinóm prostaty patrí v súčasnosti medzi najviac študované malígne ochorenia.
Karcinóm prostaty má dlhú predklinickú fázu vývoja a mnohokrát sa diagnostikuje skôr, ako sa stane klinicky symptomatický. To umožňuje diagnostikovať aj klinicky nezávažné karcinómy [3]. Veľa karcinómov prostaty je totiž latentných, bez dôsledkov pre pacienta a liečba by u týchto pacientov bola zbytočná a zaťažujúca. Na druhej strane, iné karcinómy sú výrazne agresívne, a ak ostanú bez liečby, vedú k smrti pacienta [4]. Práve posúdenie závažnosti ochorenia a následný výber vhodnej liečby je obzvlášť ťažký, keďže príznaky karcinómu prostaty a rýchlosť progresie ochorenia sa značne líšia od pacienta k pacientovi [5]. Najväčšia pozornosť je v dnešnej dobe venovaná nielen odhaleniu rizikových faktorov a včasnej detekcii tohto ochorenia [6,7], ale snahou je čo možno najadekvátnejšie posúdiť, či sa jedná o klinicky nezávažný alebo závažný typ karcinómu, a stanoviť štádium progresie ochorenia, s čím súvisí následný výber adekvátnej terapie.
Štandardne používané prognostické parametre karcinómu prostaty, ako určenie stupňa diferenciácie nádorových buniek (grading, Glesonovo skóre), rozsahu nádorového ochorenia (staging, TNM klasifikácia), stanovenie hodnoty prostatického špecifického antigénu (PSA) v krvi a sledovanie jeho dynamiky, sa zdajú byť nedostatočné pri predikcii správania karcinómu prostaty [8,9]. Tendencie zaviesť molekulárno-genetické metódy pre hodnotenie stupňa progresie ochorenia sa dostávajú čoraz viac do popredia, najmä pri detekcii včasných štádií metastatického procesu [10]. Hľadanie nových parametrov schopných lepšie predvídať biologické správanie nádoru je jediná cesta vedúca k individualizovanému prístupu v liečbe jednotlivých pacientov.
Pokúsili sme sa urobiť jednu z prvých analýz vybraných ukazovateľov v Slovenskej republike. Zaviedli sme využitie metodiky RT-PCR (Reverse Transcriptase-Polymerase Chain Reaction – Spätná polymerázová reťazová reakcia) pre detekciu cirkulujúcich nádorových buniek, tzv. mikrometastáz, v periférnej krvi pacientov s karcinómom prostaty. Táto metóda sa používa v mnohých krajinách pre hodnotenie progresie karcinómu prsníka, obličiek, močového mechúra a našim cieľom bolo predstaviť túto metódu pre laboratóriá na Slovensku. Hlavným cieľom našej štúdie bolo overiť najmä spoľahlivosť tejto metodiky.
Materiál
Počas 5 rokov našej štúdie (od roku 2004 do roku 2009) sme analyzovali súbor 50 mužov. Dvadsaťosem z nich tvorili pacienti s lokalizovaným, resp. lokálne pokročilým karcinómom prostaty, u ktorých štandardnými vyšetrovacími metódami neboli zistené metastázy. Všetci títo pacienti podstúpili radikálnu prostatektómiu a ich zdravotný stav bol pravidelne sledovaný, samozrejme i so sledovaním hladín PSA v krvi. Cieľom našej štúdie bolo použitím metodiky RT-PCR zachytiť prvotné štádium progresie ochorenia pomocou detekcie mikrometastáz v periférnej krvi týchto pacientov. Zamerali sme sa na expresiu génu pre PSA (prostate specific antigen) a PSMA (prostate specific membrane antigen). Tieto antigény sú produkované ako normálnymi, tak aj malígne zmenenými bunkami prostaty. Analyzovali sme expresiu PSA a PSMA kódujúceho génu pomocou detekcie jeho RNA produktu v cirkulujúcich prostatických bunkách.
RT-PCR reakciu pre PSA a pre PSMA sme u týchto pacientov vykonali pred radikálnou prostatektómiou a 2 roky po operácii a zisťovali sme vzťah týchto výsledkov s klinickým stavom pacientov 4 roky po vykonanej radikálnej prostatektómii. Údaje o hladinách PSA v krvi týchto pacientov, ktoré sme mali k dispozícii, boli z obdobia tesne pred operáciou, krátky čas po operácii, 1 rok po operácii a 2 roky po operácii. Tieto údaje sme takisto porovnali so súčasným zdravotným stavom pacientov.
Potom sme pomocou RT-PCR reakcie analyzovali 7 pacientov s klinicky diagnostikovanými metastázami karcinómu prostaty, 8 pacientov s benígnou hyperpláziou prostaty a 7 zdravých mladých mužov. Všetci vyšetrovaní muži boli vo veku 48–80 rokov.
Ako negatívnu kontrolu sme použili periférnu krv zdravých mladých žien vo veku 18–24 rokov a malígne tkanivo získané z prostaty pacientov s pokročilým štádiom ochorenia bolo použité ako pozitívna kontrola.
Metódy
Na detekciu prítomnosti možných mikrometastáz v periférnej krvi pacientov s karcinómom prostaty bola použitá metodika RT-PCR (Reverse Transcriptase-Polymerase Chain Reaction – spätná polymerázová reťazová reakcia). Pre tieto rakovinové prostatické bunky cirkulujúce v periférnej krvi je typická expresia génu pre PSA a PSMA. Prvým krokom bola izolácia bunkových elementov z periférnej krvi pacientov, pričom predpokladom bolo, že prípadné nádorové bunky prostaty sú súčasťou izolovanej bunkovej frakcie [11]. Získanie dostatočného množstva buniek z periférnej krvi bolo nevyhnutné pre následnú analýzu. Druhým krokom bola izolácia RNA z buniek, konkrétne mRNA. Následne bola použitá RT-PCR reakcia, ktorá umožňuje prepis RNA vyizolovanej z periférnej krvi pacientov do komplementárnej DNA (cDNA) a jej následnú amplifikáciu [12]. Na uskutočnenie tohto procesu sa využíva súprava známa pod názvom PLATINUM Quantitative RT-PCR Thermoscript One Step System. Tento systém zabezpečuje oboje – reverznú transkripciu, čiže prepis RNA do cDNA, i amplifikáciu novonasyntetizovanej cDNA, čiže polymerázovú reťazovú reakciu (Polymerase Chain Reaction – PCR) [13,14]. Primery použité v tomto kroku sa však ukázali ako nedostatočne špecifické. Preto sme zvolili nested PCR reakciu, pre ktorú slúžil ako templát produkt predchádzajúcej RT-PCR reakcie. V nested PCR reakcii bol použitý set vnútorných primerov pre selektívnu amplifikáciu menšieho úseku DNA, ktorý sa nikde inde v genóme nenachádza. Výsledné produkty nested PCR reakcie, čiže konečný požadovaný namnožený úsek PSA a PSMA génu, mali dĺžku 231bp (PSA) a 142bp (PSMA) a detegovali sme ich pomocou separácie gélovou elektroforézou (obr. 1). Amplifikácia tohto špecifického PSA/PSMA génového produktu by mala korelovať s prítomnosťou PSA/PSMA exprimujúcich prostatických buniek v periférnej cirkulácii [15]. Pre realizáciu našej štúdie sme teda museli určiť sekvenciu vhodných primerov, vytvoriť vhodný algoritmus programov pre náš teplotný cyklátor a upraviť všetky reakcie pre naše laboratórne podmienky.
1. Ukážka vyhodnotenia výsledkov RT‑PCR reakcie pre PSA pred RP pomocou gélovej elektroforézy. 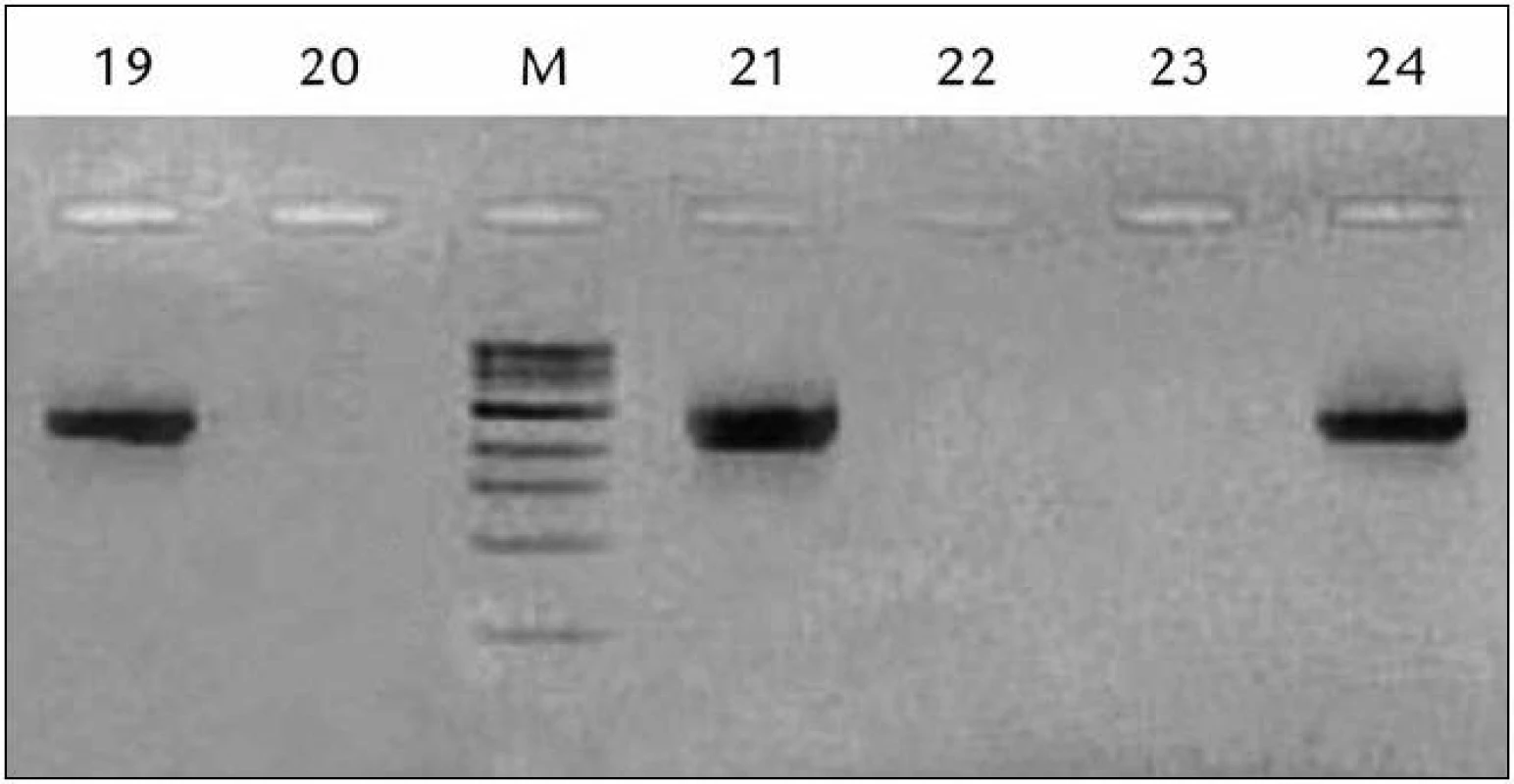
M – marker, 19– 24 – pacienti, 19, 21, 24 pozit., 20,22,23 negat., RP – radikálna prostatektómia Výsledky
Výsledky RT-PCR reakcie 28 pacientov s lokalizovaným, resp. lokálne pokročilým karcinómom prostaty uvádzame pre porovnanie spolu so štandardne používanými prognostickými parametrami karcinómu prostaty – s Gleasonovym skóre (TNM klasifikácia) a hladinou PSA v krvi (tab. 1).
1. Prehľad výsledkov RT‑PCR reakcie u pacientov s lokalizovaným, resp. lokálne pokročilým karcinómom prostaty a ich porovnanie s klasickým skórovacím systémom. 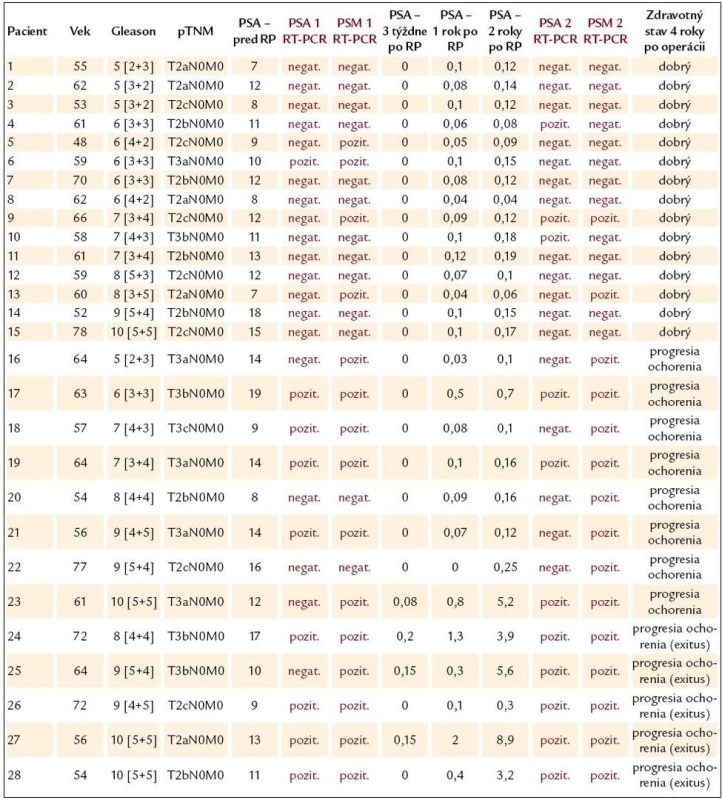
RP – radikálna prostatektómia, PSA1 RT‑PCR, PSM1 RT‑PCR – výsledky RT‑PCR reakcie pred radikálnou prostatektómiou, PSA2 RT‑PCR, PSM2 RT‑PCR – výsledky RT‑PCR reakcie 2 roky po radikálnej prostatektómii, PSA antigén – hodnoty sú uvedené v ng/ ml U 9 z 28 pacientov s klinicky diagnostikovaným lokalizovaným, resp. lokálne pokročilým karcinómom prostaty, bol výsledok RT-PCR reakcie pre PSA aj pre PSMA pred podstúpením radikálnej prostatektómie pozitívny. Šesť z týchto pacientov vykazovalo pozitívny RT-PCR výsledok pre PSA i pre PSMA aj 2 roky po operácii. Ich zdravotný stav sa postupne zhoršoval, v relatívne krátkom čase sa u nich objavili metastázy a 4 z nich už zomreli. Jeden z 9 pacientov, ktorí mali pozitívny výsledok RT-PCR pre PSA a PSMA pred operáciou, mal negatívne výsledky RT-PCR reakcie ako pre PSA, tak aj pre PSMA 2 roky po operácii. Zdravotný stav tohto pacienta nevykazuje žiadnu progresiu ochorenia. Poslední 2 z 9 pacientov s pozitívnym PSA a PSMA výsledkom RT-PCR reakcie pred radikálnou prostatektómiou mali negatívny výsledok pre PSA, avšak pozitívny výsledok RT-PCR reakcie pre PSMA 2 roky po operácii. U týchto pacientov boli zistené metastázy v kostiach.
Šesť z 28 pacientov s lokalizovaným karcinómom prostaty malo negatívny výsledok RT-PCR reakcie pre PSA a pozitívny výsledok RT-PCR pre PSMA pred radikálnou prostatektómiou. Nezávisle od výsledkov RT-PCR reakcie pre PSA 2 roky po operácii, 5 z týchto pacientov malo pozitívny výsledok RT-PCR pre PSMA aj 2 roky po operácii, pričom 1 z týchto 5 pacientov už zomrel a u 2 sa vytvorili metastázy. Zvyšní 2 pacienti s pozitívnym výsledkom RT-PCR reakcie pre PSMA po operácii zatiaľ nemajú žiadne zdravotné problémy, nepozoruje sa progresia ochorenia. U týchto pacientov navrhujeme pravidelné monitorovanie. Posledný zo 6 pacientov mal 2 roky po operácii negatívny výsledok pre PSMA. U tohto pacienta sa nepozoruje progresia ochorenia. Z uvedených výsledkov môžeme konštatovať, že nezávisle na výsledky RT-PCR reakcie pre PSA, pozitívny výsledok RT-PCR reakcie pre PSMA s vysokou presnosťou predpovedal progresiu ochorenia. Predpokladáme, že RT-PCR reakcia pre PSMA má lepšiu prognostickú hodnotu progresie ochorenia ako pre PSA.
Napokon, 13 z 28 pacientov malo pred operáciou negatívny výsledok RT-PCR reakcie pre PSA i pre PSMA. Deväť z nich malo negatívny výsledok pre PSA a negatívny výsledok pre PSMA aj 2 roky po operácii a ďalší 2 mali po operácii pozitívny výsledok pre PSA a negatívny výsledok pre PSMA. Zdravotný stav všetkých týchto 11 pacientov je veľmi dobrý, nevykazujú žiadnu progresiu ochorenia. Posledný 2 z 13 pacientov mali 2 roky po operácii negatívny výsledok RT-PCR reakcie pre PSA a pozitívny výsledok pre PSMA. Ich zdravotný stav sa zhoršuje, ochorenie progreduje a objavili sa u nich už aj metastázy v kostiach či niektorých ďalších orgánoch. Tiež to môže svedčiť o lepšej výpovednej hodnote RT-PCR reakcie pre PSMA.
Použitím RT-PCR reakcie sme diagnostikovali i 7 pacientov s klinicky overenými metastázami. RT-PCR reakcia pre PSA a tiež pre PSMA bola pozitívna u všetkých týchto pacientov. Výsledky RT-PCR reakcie u 8 pacientov s benígnou hyperpláziou prostaty boli negatívne ako pre PSA, tak aj pre PSMA. Podobne bola RT-PCR reakcia u 7 zdravých mladých mužov negatívna pre oba parametre.
Diskusia
PSA antigén a detekcia jeho sérových hladín je v súčasnosti jedným z najčastejšie využívaných skríningových a prognostických parametrov používaných v klinickej urologickej praxi; má však viacero limitov. Zdôrazníme niektoré z nich. Ako horná hranica normálu sa považuje hodnota PSA 4,0 ng/ml. U mužov s karcinómom prostaty sa táto hladina zvyčajne zvyšuje [16]. Rakovinové prostatické bunky totiž obyčajne produkujú viac PSA, avšak aj akékoľvek iné podmienky, ktoré narušujú normálnu architektúru prostaty, vrátane nodulárnej hyperplázie, prostatitídy či prostatolitiázy, môžu tiež spôsobiť zvýšenie sérovej hladiny PSA. Rovnako transrektálna či transperineálna biopsia prostaty, masáž prostaty, cystoskopia a transuretrálna resekcia prostaty zvyšujú sérové hladiny PSA [17]. Na druhej strane však v menšine prípadov karcinómu prostaty, najmä tých, ktoré sú obmedzené na prostatu, sérové hladiny PSA nie sú zvýšené. Okrem toho, zdrojom patologicky zvýšenej produkcie PSA pri karcinóme prostaty a kostných metastázach sú najčastejšie dobre diferencované adenokarcinómové štruktúry a produkcia PSA spravidla klesá s poklesom diferenciácie [18]. Napokon, PSA antigén bol pôvodne považovaný za špecifický produkt tkaniva prostaty. Bolo však zistené, že tento antigén nie je tkanivovo špecifický. Pomocou imunohistochemických metód boli zistené malé hladiny tohto antigénu i v krvi pacientov, resp. pacientok s karcinómom prsníka, zhubným nádorom pľúc, endometria či periuretrálnych žliaz [19].
Kvôli týmto obmedzeniam, týkajúcich sa špecificity i senzitivity, je využitie PSA antigénu pre diagnostiku a skríning karcinómu prostaty ako izolovaného parametra nie úplne spoľahlivé. Lepšie uplatnenie má sledovanie PSA antigénu v krvi u pacientov po radikánej prostatektómii, avšak aj v týchto prípadoch je jeho prognostická hodnota limitovaná. Pre posilnenie jeho postavenia ako prognostického faktora sa sleduje jeho dynamika (velocita PSA), najmä PSA doubling time (čas zdvojnásobenia PSA), určuje sa pomer medzi hodnotou sérového PSA a objemom prostaty (denzita PSA), meria sa voľná vs viazaná forma PSA v obehu (PSA ratio), pričom sa samozrejme tieto hodnoty porovnávajú s vekovo štandardizovanými referenčnými rozpätiami PSA (vek-špecifické PSA) [20].
Cieľom výskumov molekulárnej biológie je nájsť vhodné markery biologického správania sa karcinómu prostaty, a tým napomôcť k určeniu stratégie a agresivity liečby. V periférnej krvi cirkulujúce prostatické bunky sa považujú za malígne, pretože imunologická reakcia nepredpokladá prežitie normálnych a benígnych hyperplastických prostatických buniek v periférnej cirkulácii. Prítomnosť týchto buniek v periférnej cirkulácii nemusí za každých okolností indikovať výskyt metastáz. Telo sa ich totiž môže zbaviť bez toho, aby sa vytvorilo metastatické ložisko. Úspešnosť metodiky RT-PCR in vivo teda závisí od prebiehajúcej diseminácie mikrometastáz v krvi a na úspešnosti imunitného systému pri odstraňovaní týchto cirkulujúcich tumorových buniek [21]. Tumorové bunky v cirkulácii však môžu byť prvým krokom v kaskáde tvorby metastáz karcinómu prostaty [22]. Detekcia cirkulujúcich prostatických rakovinových buniek tak môže indikovať výskyt metastáz a môže slúžiť ako nezávislý prognostický faktor u pacientov s CaP.
Experimentálne štúdie ukazujú, že metodika RT-PCR môže detegovať jednu PSA exprimujúcu prostatickú bunku na 100 miliónov ďalších buniek in vitro. Pomocou tejto metodiky môže byť detegovaná jedna PSA pozitívna bunka v 5 ml periférnej krvi pacienta. Prítomnosť 1 000 PSA exprimujúcich buniek v periférnej cirkulácii by mala vyústiť v pozitívnu RT-PCR reakciu. Senzitivita tejto metodiky je teda dosť vysoká na to, aby odhalila menší počet cirkulujúcich buniek, ako je potrebný pre tvorbu metastáz (približne 10 000 cirkulujúcich tumorových buniek v periférnej krvi). Odhaduje sa to z pokusov robených na zvieratách [23].
Čo sa týka výsledkov našej štúdie, môžeme skonštatovať, že výsledky RT-PCR reakcie pre PSA a PSMA dobre korelujú so zdravotným stavom pacientov. Aj pri porovnaní so štandardnými prognostickými parametrami, ako je Gleasonove skóre, rozsah ochorenia či hladina PSA antigénu v sére, vidieť koreláciu a možno predpokladať prognostickú relevanciu tejto metodiky. V niektorých prípadoch sa dokonca detekcia mikrometastáz v periférnej krvi pacientov pomocou RT-PCR reakcie javila ako lepší prognostický faktor progresie ochorenia než sledovanie hladiny PSA antigénu v sére.
Z našich výsledkov uvedených v tab. 1môžeme vidieť, že pozitívny výsledok RT-PCR reakcie pre PSA a PSMA znamenal väčšinou progresiu ochorenia a vznik metastáz. Takisto pacienti s negatívnym výsledkom RT-PCR reakcie pre PSA a pozitívnym výsledkom pre PSMA vykazovali vo väčšine prípadov zhoršenie zdravotného stavu. Choroba u nich progredovala a čoskoro boli pomocou scintigrafie skeletu diagnostikované metastázy. Niektoré štúdie proklamujú, že úroveň detekcie nádorových buniek s pozitívnou RT-PCR pre PSMA je signifikantne vyššia než pre PSA, pretože PSMA, nie PSA, je vysoko exprimované v anaplastických bunkách, hormónrezistentných bunkách a v kostných metastázach [24]. Spozorovali sme tiež, že u pacientov s pozitívnym RT-PCR výsledkom pre PSA a negatívnym výsledkom pre PSMA sa v prevažnej miere nezistila progresia ochorenia; zdravotný stav týchto pacientov bol optimálny. Dá sa predpokladať vyššia citlivosť a prognostická hodnota RT-PCR reakcie pre PSMA ako pre PSA. Pacienti s negatívnym výsledkom RT-PCR reakcie pre PSA aj pre PSMA tiež nepreukazovali žiadnu progresiu ochorenia. Usudzujeme, že v čase realizácie RT-PCR reakcie nemali títo pacienti detekovateľnú hladinu mikrometastáz v periférnej krvi. Viaceré štúdie dokazujú potrebu opakujúceho testovania série postupne odobraných vzoriek krvi pomocou RT-PCR reakcie, ktoré má podstatne lepšiu prognostickú hodnotu ako analýza jednej odobratej vzorky krvi. U pacientov s negatívnym nálezom RT-PCR na PSA a PSMA je teda obzvlášť dôležité kontinuálne sledovanie prítomnosti mikrometastáz v periférnej krvi.
Pre lepšie posúdenie prognostického významu RT-PCR reakcie bolo vykonaných niekoľko štatistických analýz. Signifikantnosť výsledkov RT-PCR reakcie ako prognostického parametra budúceho zdravotného stavu pacientov sme hodnotili u 28 pacientov s lokalizovaným, resp. lokálne pokročilým karcinómom prostaty, ktorí podstúpili radikálnu prostatektómiu. Hodnotená bola samostatne výpovedná hodnota výsledku RT-PCR pre PSA a pre PSMA a potom ich kombinácia, pričom sme hodnotili výsledky ako pred operáciou (tab. 2–4), tak aj 2 roky po operácii. Vo všetkých prípadoch bol výsledok štatisticky signifikantný (P < 0,05), čo znamená, že výsledky RT-PCT pre PSA a pre PSMA sa dajú chápať ako významný prognostický parameter vo vzťahu k súčasnému zdravotnému stavu pacientov. Bolo vyrátané aj odd ratio pre predpovedanie progresie ochorenia, ktoré pre predoperačný výsledok RT-PCR reakcie pre PSA bolo 22,4 (95 % konfidenčný interval, 2,3–100; P = 0,03) a pre predoperačné PSMA 15,12 (95 % konfidenčný interval, 2,3–100; P = 0,03).
2. Kontingenčná tabuľka vzťahu výsledku RT‑PCR reakcie pre PSA pred RP a súčasného zdravotného stavu pacientov. 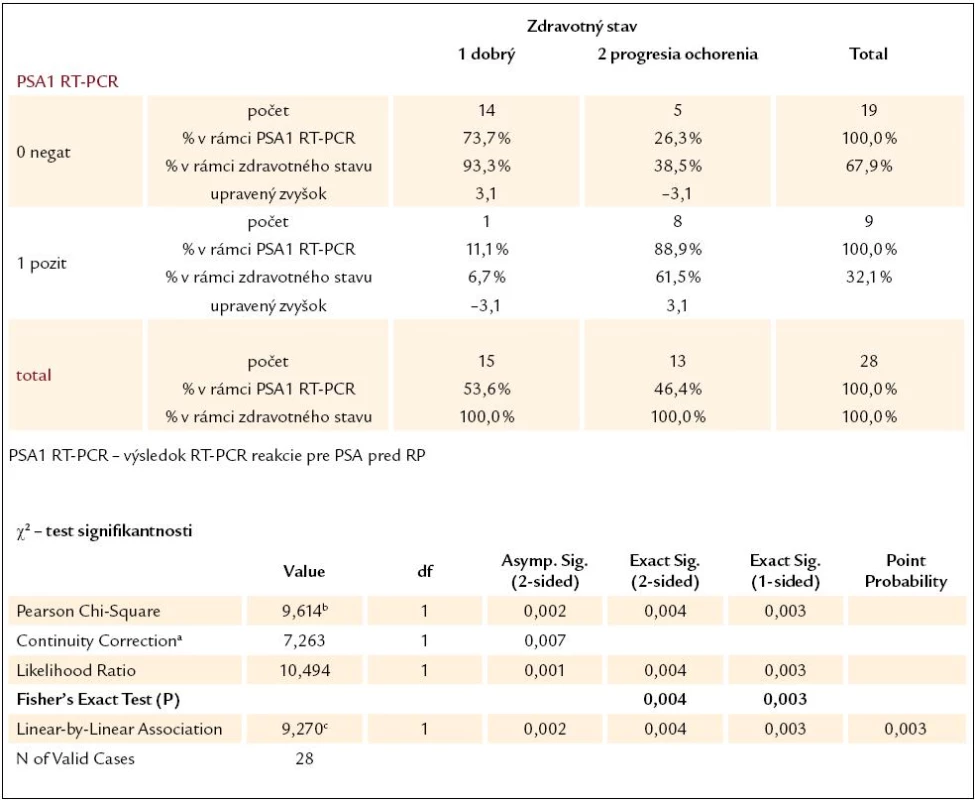
a computed only for a 2 × 2 table b 2 cells (50,0%) have expected count less than 5. The minimum expected count is 4,18. c The standardized statistic is 3,045. 3. Kontingenčná tabuľka vzťahu výsledku RT-PCR reakcie pre PSM pred RP a súčasného zdravotného stavu pacientov. 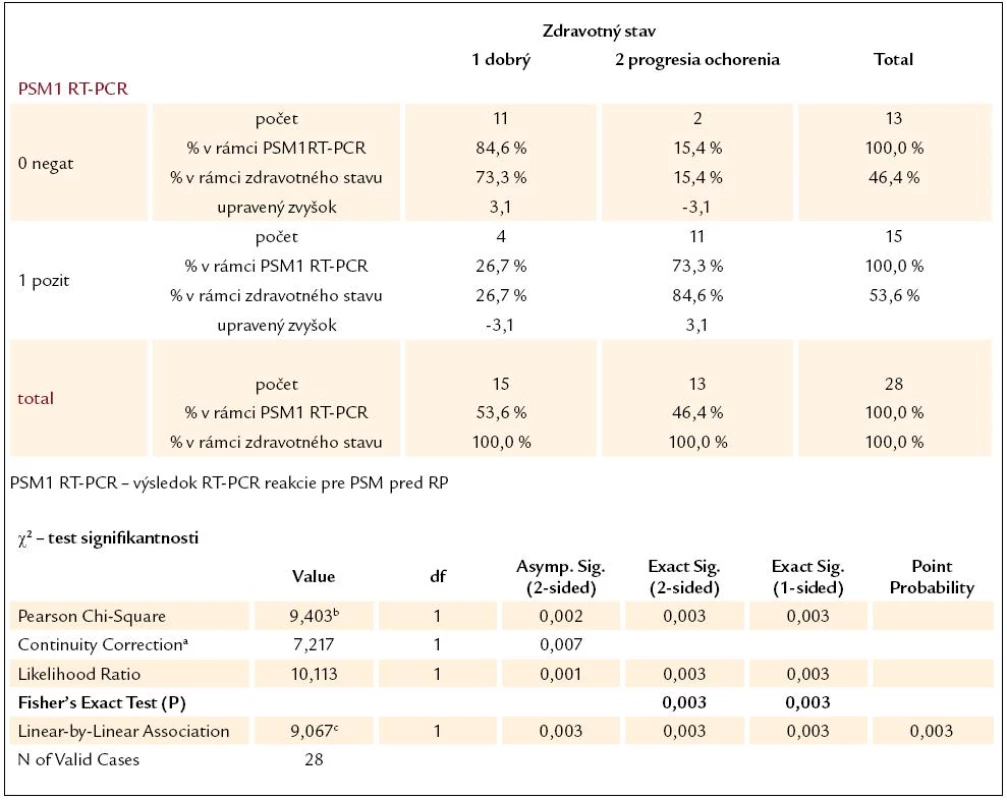
a computed only for a 2 × 2 table b 0 cells (0%) have expected count less than 5. The minimum expected count is 6,04. c The standardized statistic is 3,011. 4. Kontingenčná tabuľka vzťahu výsledku RT-PCR reakcie pre PSA + PSM pred RP a súčasného zdravotného stavu pacientov. 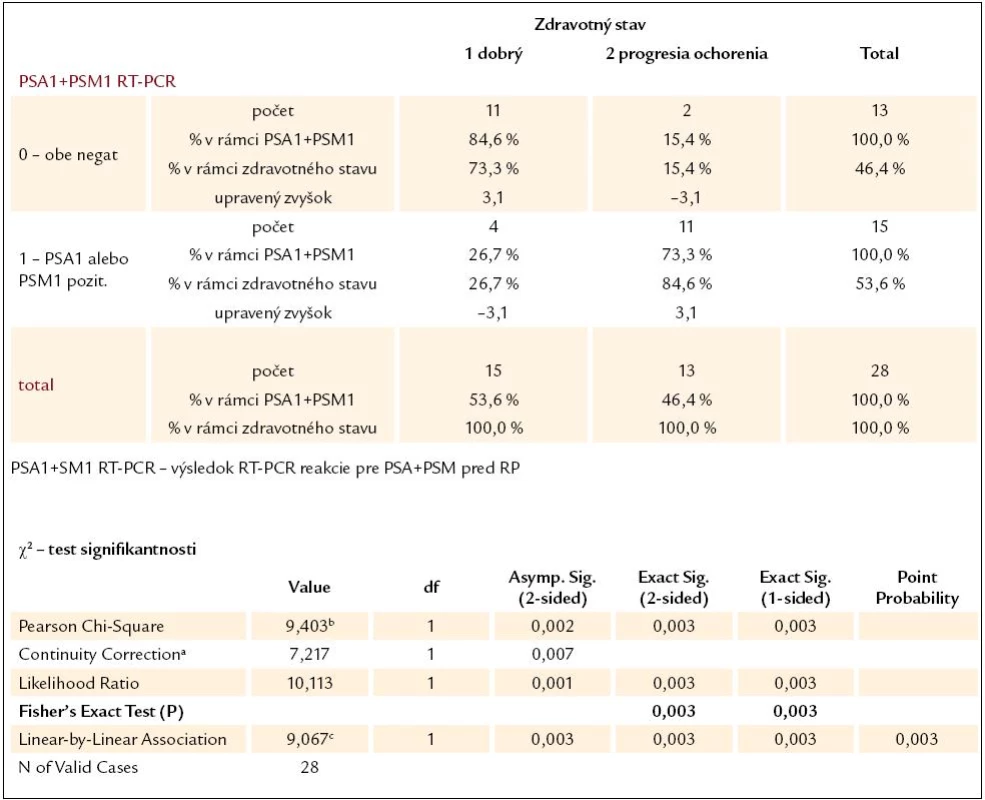
a computed only for a 2 × 2 table b 0 cells (0%) have expected count less than 5. The minimum expected count. Rovnako sme posúdili predpovednú hodnotu PSA antigénu, štandardne používaného prognostického paramentra. Keďže všetci 28 pacienti mali pred operáciou hodnoty PSA antigénu nad hornou hranicou normálu (> 4,0 ng/ml), hodnotili sme predikčnú hodnotu hladiny PSA antigénu v krvi 1 a 2 roky po vykonanej radikálnej prostatektómii. Tieto výsledky sme dali do súvisu s terajším zdravotným stavom pacientov. Hodnota 0,2 ng/ml PSA antigénu v krvi po radikálnej prostatektómii bola považovaná za hornú hranicu podľa medzinárodnej dohody definujúcej rekurenciu ochorenia. Výsledky potvrdili signifikanciu tohto prognostického parametra (P = 0,005 pre PSA 1 rok po operácii a P = 0,000 pre PSA 2 roky po operácii).
Mnohé štúdie dokazujú vysokú citlivosť RT-PCR reakcie. Takmer vo všetkým prípadoch výskumy svedčia pre vyššie riziko rekurencie karcinómu prostaty po radikálnej prostatektómii u RT-CR pozitívnych pacientov [25,26]. Vo viacerých prípadoch sa výsledok RT-PCR reakcie pre PSMA javí ako relevantnejší marker progresie ochorenia než výsledok RT-PCR reakcie pre PSA. K uceleným záverom je však potrebné vykonať sériu ďalších analýz. RT-PCR metodika sa však každopádne zdá byť prísľubom do budúcnosti.
Záver
Potvrdili sme zhodu medzi výsledkom RT-PCR reakcie a klinickým stavom ochorenia. Preukázali sme, že pozitívne výsledky RT-PCR reakcie dobre korelovali s progresiou ochorenia. Takmer u všetkých pacientov s pozitívnym výsledkom RT-PCR reakcie sa v krátkom čase objavili metastázy a viacerí z nich i zomreli. Dôležité je zdôrazniť, že nami diagnostikovaní pacienti, čiže pozitívni na PSA a PSMA, mali metastázy, ktoré klinici ešte neboli schopní v tom čase odhaliť. Na druhej strane negatívne výsledky boli v súlade s dobrým zdravotným stavom pacientov. Vo viacerých prípadoch sa výsledok RT-PCR reakcie pre PSMA javil ako senzitívnejší a relevantnejší marker progresie ochorenia než výsledok RT-PCR reakcie pre PSA. Pozitívny výsledok RT-PCR reakcie pre PSA, a najmä pre PSMA, by tak mohol slúžiť ako prediktor extrakapsulárneho šírenia a začínajúceho metastatického procesu.
Metodika RT-PCR by v súčinnosti so štandardne používanými prognostickými parametrami mohla predstavovať vhodný prístup pri detekcii včasných štádií metastázovania karcinómu prostaty, pri predpovedaní progresie ochorenia, a tým byť nápomocným prostriedkom nových stratégií určovania vhodnej terapie pre jednotlivých pacientov. K definitívnym záverom je však nevyhnutný ďalší výskum tejto metodiky. RT PCR metodika sa však každopádne zdá byť prísľubom do budúcnosti.
Skratky
RT-PCR – Reverse Transcriptase-Polymerase Chain Reaction – spätná polymerázová reťazová reakcia, PCR – Polymerase Chain Reaction – polymerázová reťazová reakcia, PSA – prostatic specific antigen – prostatický špecifický antigén, PSMA – prostate specific membrane antigen – prostatický špecifický membránový antigén
MU Dr. Anežka Zummerová
www.udzs.sk
e-mail: anezkazummerova@gmail.com
Sources
1. Fletcher CH. Histology of tumors. Vol. 1. Philadelphia: Churchill Livingstone Elsevier 2007 : 755 – 778.
2. Tanagho EA, McAninch JW. Smithova všeobecná urológia. Martin: Vydavateľstvo Osveta 2006 : 392 – 394.
3. Kliment J, Horňák M. Karcinóm prostaty. Martin: Vydavateľstvo Osveta 1999.
4. Chon CH, Lai FC, McNeal JE et al. Use of extended systematic sampling in patients with a prior negative prostate needle biopsy. J Urol 2002; 167 : 2457 – 2460.
5. Rubin E, Gorstein F, Rubin R et al. Rubin’s pathology: clinicopathologic foundations of medicine. 4th ed. Philadelphia: Lippincott Williams & Wilkins 2005 : 921 – 925.
6. Svačina S. Tumours of kidneys, urinary bladder and prostate in obesity and diabetes. Vnitř Lék 2008; 54 : 464 – 467.
7. Broďák M, Romzová M, Kosina J. Urologic surgery in diabetes. Vnitř Lék 2008; 54 : 457 – 463.
8. Egevad L. Recent trends in Gleason grading of prostate cancer: I. Pattern interpretation. Anal Quant Cytol Histol 2008; 30 : 190 – 198.
9. Leak B, Wei JT, Gabel M et al. Relevant patient and tumor considerations for early prostate cancer treatment. Semin Urol Oncol 2002; 20 : 39 – 44.
10. Lamb DS, Slaney D, Smart R et al. Prostate cancer: the new evidence base for diagnosis and treatment. Pathology 2007 : 39 : 537 – 544.
11. Jung K, Henke W, Lein M et al. Polymerase chain reaction in the detection of micrometastases and circulating tumor cells. Cancer 1996; 78 : 2445 – 2448.
12. Haas CJ, Wagner T, Wawroschek F et al. Combined application of RT‑PCR and immunohistochemistry on paraffin embedded sentinel lymph nodes of prostate cancer patients. Pathol Res Pract 2005; 200 : 763 – 770.
13. Katz AE, Olsson CA, Raffo AJ et al. Molecular staging of prostate cancer with the use of an enhanced reverse transcriptase – PCR assay. Urology 1994; 43 : 765 – 775.
14. Wood DP Jr, Banks ER, Humphreys S et al. Sensitivity of immunohistochemistry and polymerase chain reaction in detecting prostate cancer cells in bone marrow. J Histochem Cytochem 1994; 42 : 505 – 511.
15. Altimari A, Grigioni A, Benedettini E et al. Diagnostic role of circulating free plasma DNA detection in patients with localized prostate cancer. Am J Clin Pathol 2008; 129 : 756 – 762.
16. Jemal A, Siegel R, Ward E et al. Cancer statistics, 2006. CA Cancer J Clin 2006; 56 : 106 – 130.
17. Bartsch G, Khoury S, Murai M et al. Prostate Cancer. Paris: Health Publications 2003.
18. Choo R, DeBoer G, Klotz L et al. PSA doubling time of prostate carcinoma managed with watchful waiting observation alone. Int J Radiat Oncol Biol Phys 2001; 50 : 615 – 620.
19. Narita D, Raica M, Anghel A et al. Immunohistochemical localization of prostate - specific antigen in benign and malignant breast conditions. Rom J Morphol Embryol 2005; 46 : 41 – 45.
20. Moul JW. Prostate specific antigen only progression of prostate cancer. J Urol 2000; 163 : 1632 – 1642.
21. Ghossein RA, Scher HI, Gerald WL et al. Detecting of circulating tumor cells in patients with localized and metastatic prostatic carcinoma: clinical implications. J Clin Oncol 1995; 13 : 1195 – 1200.
22. Engstrom C. Hot flashes. Clin J Oncol Nurs 2006; 10 : 533 – 535.
23. Repiská V, Zummerová A, Mikloši M et al. Využitie metódy RT‑PCR pri detekcii cirkulujúcich mikrometastáz. Rozhl Chir 2003; 82 : 95 – 102.
24. Schmittgen TD, Teske S, Vessella RL et al. Expression of prostate specific membrane antigen and three alternatively spliced variants of PSMA in prostate cancer patients. Int J Cancer 2003; 107 : 323 – 329.
25. Moreno JG, Croce CM, Fischer R et al. Detection of hematogenous micrometastasis in patients with prostate cancer. Cancer Res 1992; 52 : 6110 – 6112.
26. Repiská V, Mikloši M, Zummerová A et al. Detection of circulating tumor cells in patients with prostate cancer. Bratislava: Biologia 2005 : 703 – 709.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 11-
All articles in this issue
- Metastatic involvement of the heart and pericardium – MR case reports
- Diffuse plane normolipemic xanthomatosis and necrobiotic xanthogranuloma associated with monoclonal gammopathy – determining the disease stage with PET‑ CT and treatment experience. Two case studies and literature review
- Autoimmune polyendocrine syndrome type 2 associated with autoimmune hypophysitis and coeliac disease
- Lymphoma‑like course in aggressive adult multisystem Langerhans cell histiocytosis and the benefit of PET/ CT imaging in evaluation of diffuse metabolic activity of lung parenchyma
- Central hemiparesis as manifestation of systemic vasculitis
- Professor Frantisek Por MD and Professor Robert Klopstock MD, students at Budapest and Prague Faculties of Medicine
- A different view of acute upper gastrointestinal bleeding in liver cirrhosis patients
- Risk stratification by cardiac gated SPECT combined with coronary artery calcium score in patients with diabetes mellitus and/ or renal failure
- Determination of the progression of prostate cancer using RT‑PCR method
- Osteoporosis in chronic obstructive pulmonary disease
- Angiotensin converting enzyme inhibitors and angiotensin II receptor blockers in atrial fibrillation
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Central hemiparesis as manifestation of systemic vasculitis
- Autoimmune polyendocrine syndrome type 2 associated with autoimmune hypophysitis and coeliac disease
- Lymphoma‑like course in aggressive adult multisystem Langerhans cell histiocytosis and the benefit of PET/ CT imaging in evaluation of diffuse metabolic activity of lung parenchyma
- Determination of the progression of prostate cancer using RT‑PCR method
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

