-
Medical journals
- Career
Hormony tukové tkáně
: M. Haluzík 1; P. Trachta 1; D. Haluzíková 1,2
: III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Štěpán Svačina, DrSc., MBA 1; Ústav tělovýchovného lékařství 1. lékařské fakulty UK a VFN Praha, přednosta doc. MU Dr. Zdeněk Vilikus, CSc. 2
: Vnitř Lék 2010; 56(10): 1028-1034
: Obesity 2010
Tuková tkáň byla dlouhou dobu považována za pasivní místo ukládání energie ve formě triglyceridů bez přímého vlivu na regulaci energetické homeostázy. Tento pohled byl zásadně změněn výzkumy v 1. polovině 90. let minulého století, které prokázaly hormonální produkci tukové tkáně. V současné době je známo, že tuková tkáň produkuje kolem 100 faktorů s parakrinní nebo endokrinní aktivitou, které hrají významnou úlohu v metabolických regulacích, řízení příjmu potravy, zánětu a řady dalších dějů. Pouze malá část z těchto hormonů je produkována výlučně tukovou tkání, většina je naopak primárně tvořena v jiných tkáních či orgánech. Za hormonální produkci tukové tkáně nejsou zodpovědné pouze vlastní adipocyty, ale také preadipocyty, imunokompetentní a endoteliální buňky přítomné v tukové tkáni a řada dalších. Tento článek podává přehled současných znalostí o endokrinní funkci tukové tkáně se zaměřením na její změny u obezity. Popisuje dále možnou úlohu tukové tkáně při vzniku inzulinové rezistence, diabetu 2. typu, aterosklerózy a dalších onemocnění spojených s obezitou.
Klíčová slova:
tuková tkáň – endokrinní funkce – leptin – adiponectin – resistin – obezita – aterosklerózaÚvod
Podobně jako byla obezita dlouho považována pouze za jakousi kosmetickou vadu a její přímý vztah ke vzniku diabetu, kardiovaskulárních nemocí a zvýšené mortalitě byl dlouho přehlížen, byla i tuková tkáň z hlediska možné aktivní úlohy v metabolických regulacích zcela opomíjena. V učebnicích fyziologie byly dlouho uváděny pouze 3 základní funkce tukové tkáně: funkce tepelného izolátoru, funkce mechanické ochrany proti nárazům, a především funkce zásobního energetického zdroje. Teprve počátkem 90. let minulého století bylo zjištěno, že tuková tkáň produkuje řadu hormonů a cytokinů, a že se tak velmi aktivně podílí na regulaci příjmu potravy, energetického výdeje a řady metabolických dějů v lidském organizmu [1–3]. Dalším logickým krokem, který následoval, byla odpověď na otázku, zda a jak se mění endokrinní funkce tukové tkáně u obezity.
Záhy bylo prokázáno, že obezita je spojena s významnými změnami endokrinní funkce tukové tkáně ve smyslu zvýšení produkce faktorů s metabolicky negativními účinky a snížení produkce faktorů s vlivy metabolicky pozitivními [4]. Lze tedy předpokládat, a řada nových poznatků tomu nasvědčuje, že endokrinní dysfunkce tukové tkáně je významným pojítkem mezi obezitou a dalšími onemocněními vyskytujícími se v rámci tzv. metabolického syndromu: tedy inzulinovou rezistencí/diabetes mellitus 2. typu, dyslipidemií, arteriální hypertenzí a zvýšeným rizikem aterosklerózy a jejích komplikací [5].
Fyziologický význam tukové tkáně v lidském organizmu v roce 2010
Tradičně uváděné funkce tukové tkáně, tedy tepelně izolační funkce, mechanická ochrana vnitřních orgánů a především funkce energetické rezervy, jsou i nadále považovány za velmi významné. Důležitost tukové tkáně jako místa pro uložení energie ve formě zásobních tuků – triglyceridů – se jasně ukazuje u transgenních myších modelů zcela postrádajících tukovou tkáň i u pacientů s lipoatrofickým diabetem. U těchto stavů dochází k výraznému ukládání triglyceridů v jiných tkáních a orgánech – především svalové a jaterní tkáni – což vede ke vzniku těžké jaterní steatózy a ztučnění svalu s následným rozvojem inzulinové rezistence a těžkého diabetu s výrazně zvýšenými hladinami inzulinu a lipidů [6,7]. Hlavním důvodem těchto metabolických změn je negativní působení ektopicky uložených lipidů a jejich metabolitů na inzulinovou signální kaskádu v uvedených tkáních a orgánech s rozvojem inzulinové rezistence [8]. Zajímavým faktem je, že kompenzaci diabetu i další metabolické odchylky u myších modelů i pacientů s lipoatrofickým diabetem výrazně zlepšuje podávání jednoho z adipocytárních hormonů leptinu [9].
Jinou důležitou funkcí tukové tkáně je její význam při konverzi některých hormonálních prekurzorů na aktivní hormony a také její úloha při ukládání lipofilních toxinů a léků.
V lidské tukové tkáni je tvořen hormon kortizol pomocí enzymu 11-β-OH-steroid dehydrogenázy typu 1 z inaktivního prekurzoru kortizonu [10]. Tuková tkáň je také hlavním zdrojem estrogenů u postmenopauzálních žen. Účinkem P450 aromatázy zde vznikají z C19 steroidních prekurzorů (především androstendionu) estron a estradiol. Význam této funkce tukové tkáně může stoupat u obézních žen, u kterých jsou pak hladiny estrogenů několikanásobně zvýšeny, což vede mimo jiné i ke vzestupu rizika karcinomu prsu [11].
V posledních letech je intenzivně zkoumán i význam tukové tkáně jako místa kumulace léků a nově především jako místa kumulace toxických lipofilních látek. Lipofilní toxické látky zevního prostředí se mohou také kumulovat v tukové tkáni [12]. Příkladem jsou organické pesticidy, polychlorované bifenyly, dioxiny a dibenzofurany, polybromované zpomalovače hoření a další nezařazené polutanty. Význam těchto látek spočívá v jejich potenciální interakci s řadou funkcí a regulačních procesů v tukové tkáni (vazba na androgenní či estrogenní receptory, ovlivnění diferenciace či endokrinní funkce adipocytů, interference s ukládáním lipidů či dalšími metabolickými funkcemi adipocytů atd.). Výzkum významu kumulace xenobiotik v tukové tkáni je pouze na počátku. Lze však předpokládat, že i zde mohou být zjištěny významné vztahy k metabolickým regulacím a některým onemocněním vázaným na obezitu. Funkce tukové tkáně je přehledně shrnuta v tab. 1.
1. Funkce tukové tkáně v lidském organizmu. 
Složení tukové tkáně a buňky produkující hormony
Kostrou tukové tkáně, na níž je řada buněk částečně fixována, je síť kolagenových vláken. Vlastní tukové buňky – adipocyty – jsou kvantitativně nejdůležitější součástí [13]. Kromě adipocytů jsou v tukové tkáni také zásobní krevní cévy, tzv. stromavaskulární buňky uložené v okolí těchto cév, fibroblasty, leukocyty, makrofágy, preadipocyty a řada dalších buněk. Složení tukové tkáně navíc není neměnné. Při změnách nutričního stavu kolísá obsah triglyceridů v adipocytech, což mění jejich velikost i metabolické vlastnosti. Platí, že štíhlí lidé mají menší adipocyty, zatímco u obézních mají adipocyty velký objem v důsledku vysokého obsahu lipidů. Velikost adipocytů a jejich obsah lipidů významně ovlivňuje jejich metabolické vlastnosti včetně citlivosti na účinky inzulinu (snížená u velkých adipocytů obézních naplněných lipidy) a endokrinní produkce (adipocyty obézních jedinců produkují více prozánětlivých a méně protizánětlivých faktorů než u jedinců štíhlých) [14].
Imunokompetentní buňky v tukové tkáni a jejich endokrinní funkce
Tuková tkáň obsahuje poměrně značné množství imunokompetentních buněk. Tradičně jsou uváděny především makrofágy, ale nepochybně se zde vyskytují i další podtypy včetně lymfocytů a řady dalších. Před několika lety bylo v experimentálních studiích zjištěno, že obsah makrofágů v tukové tkáni významně kolísá v závislosti na obsahu tukové tkáně v organizmu [15]. V experimentech bylo dále prokázáno, že u myší s geneticky či dietou indukovanou obezitou je významně zvýšený obsah makrofágů ve srovnání se štíhlými zvířaty [16]. Počet makrofágů pozitivně koreloval nejen s obsahem tuku v organizmu, ale především s velikostí adipocytů. Čím tedy „obéznější“ byly adipocyty, tím větší byla infiltrace tukové tkáně makrofágy. Pokles hmotnosti vedl pak také ke snížení počtu makrofágů v tukové tkáni. Tento objev vedl k formulaci hypotézy o subklinickém zánětu v tukové tkáni jako o zdroji subklinického zánětu u pacientů s obezitou. Klinické studie totiž ukazují, že u pacientů s obezitou dochází ke vzniku chronické zánětlivé reakce, která je detekovatelná např. mírným zvýšením koncentrace C reaktivního proteinu [17]. Při podrobnějších výzkumech bylo zjištěno, že zásadní není pouze celkový počet makrofágů, ale také jejich vlastnosti. Ukazuje se, že existují přinejmenším 2 subpopulace adipocytárních mikrofágů, z nichž jedny jsou prozánětlivé a působí metabolicky škodlivě (jejich počet se zvyšuje při obezitě) a druhé protizánětlivé a metabolicky pozitivní (více jich mají štíhlí jedinci) [18].
Vysoký obsah imunokompetentních buněk v tuku má zřejmě ještě další význam. Tuková tkáň může sloužit jako rezervoár těchto buněk pro případ systémové zánětlivé reakce. V tomto případě může pravděpodobně dojít i ke vzniku nových makrofágů v tukové tkáni a k jejich vycestování zpět do krevního řečiště.
Typy tukové tkáně v lidském organizmu a jejich vztah k endokrinní produkci
Z metabolického hlediska je podstatné rozlišovat jednotlivé typy bílé tukové tkáně: především podkožní a viscerální (nitrobřišní) tukovou tkáň. Viscerální tuková tkáň je metabolicky aktivnější, má menší velikost adipocytů a její produkty se portálním oběhem dostávají přímo do jater, což může přímo ovlivnit řadu metabolických procesů. Hromadění viscerální tukové tkáně v organizmu je označováno jako centrální neboli androidní obezita. Tento typ obezity je považován z hlediska kardiovaskulárních komplikací za rizikovější než nárůst tukové tkáně subkutánní v oblasti boků a hýždí (tzv. gynoidní obezita) [19].
Kromě vlastní nitrobřišní tukové tkáně se zdá, že existují ještě další podtypy tukové tkáně s odlišnými vlastnostmi. V poslední době je intenzivně zkoumána tzv. epikardiální tuková tkáň, kterou je obalen srdeční sval. Některé studie ukazují, že množství této tkáně pozitivně koreluje s metabolickými riziky a že u pacientů s aterosklerózou produkuje tato tkáň výrazně více prozánětlivých a metabolicky negativních faktorů než vlastní nitrobřišní tkáň viscerální [20].
Obecně je uváděno, že viscerální tuková tkáň je ve srovnání s podkožní tukovou tkání více infiltrována makrofágy a že produkuje více prozánětlivých a metabolicky škodlivých faktorů [21]. Tento údaj vychází z jasných výsledků experimentálních studií na hlodavcích, zatímco klinických důkazů o jeho platnosti je podstatně méně [22].
Hormony tukové tkáně
Hovoříme-li o endokrinní produkci tukové tkáně, nemáme na mysli pouze látky produkované adipocyty, ale také látky produkované dalšími buňkami přítomnými v tukové tkáni (tab. 2 a 3). Velmi důležitým, byť zatím málo prozkoumaným faktem je vzájemná interakce mezi adipocyty, makrofágy a dalšími buňkami v tukové tkáni. Do tukové tkáně navíc mohou vstupovat i nové imunokompetentní buňky z cirkulace, a významně tak modifikovat její vlastnosti [18]. Parakrinní produkce faktorů produkovaných makrofágy se významně podílí na regulaci metabolické i hormonální funkce adipocytů a naopak.
2. Přehled nejdůležitějších proteinových hormonů produkovaných adipocyty. 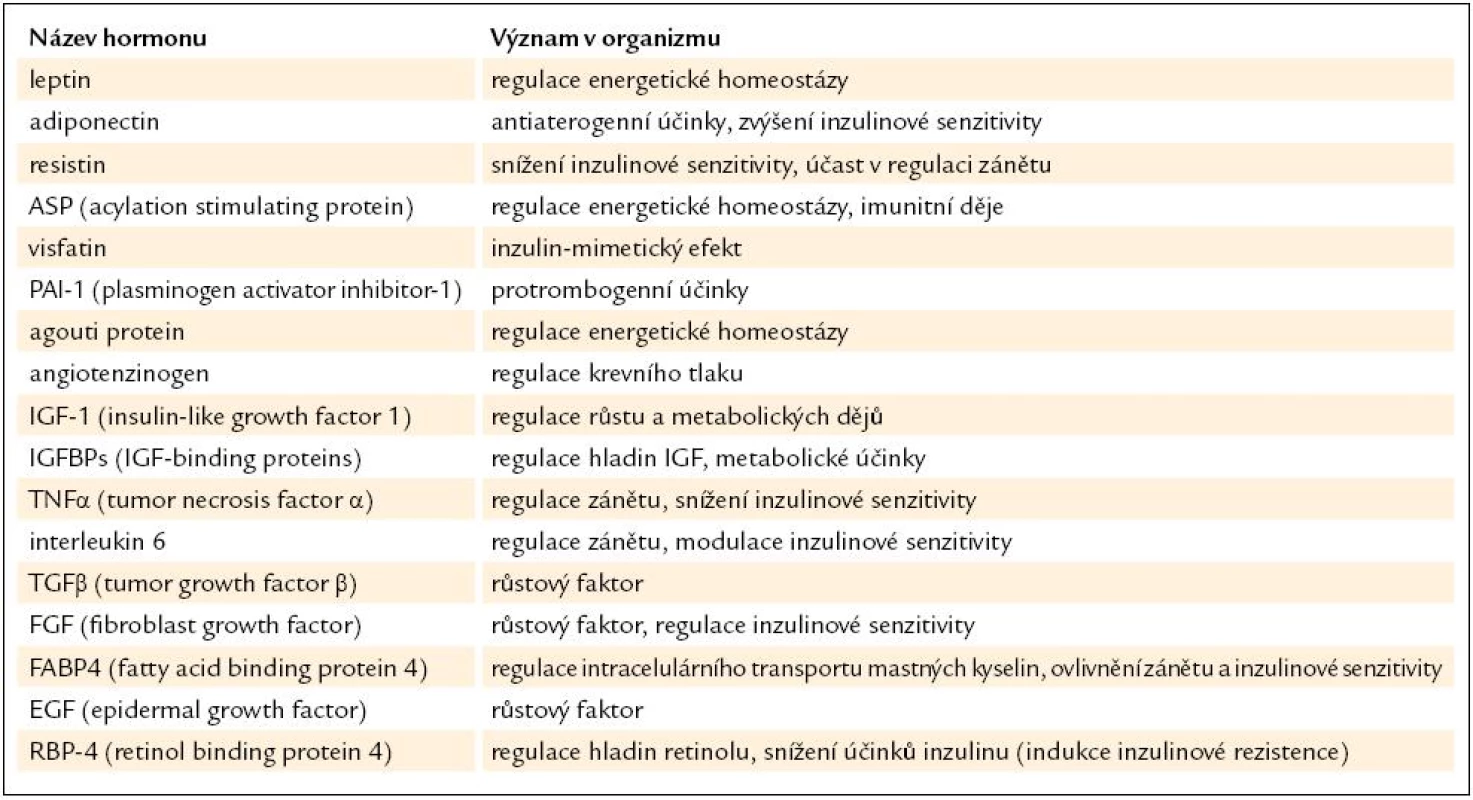
3. Kombinované dělení produktů tukové tkáně podle místa produkce a funkce. 
Jedno z možných dělení hormonů tukové tkáně je tedy podle produkujících buněk na působky tvořené převážně či výlučně adipocyty (leptin, adiponectin) a hormony tvořené jak adipocyty, tak jinými buňkami v tukové tkáni (tumor necrosis factor-α, interleukin-6 a další). V tukové tkáni je tvořena i řada působků, které jsou primárně produkovány v jiných tkáních či orgánech (angiotenzinogen, prozánětlivé cytokiny atd.). Kombinované dělení produktů tukové tkáně podle místa produkce a funkce je uvedeno v tab. 3. Tuková tkáň je mimo jiné významným místem produkce proaterogenně působících cytoadhezivních molekul, protrombogenních látek typu PAI-1 (inhibitor aktivátoru plazminogenu 1), růstových a angiogenních faktorů i chemokinů. Právě zvýšená produkce chemokinů stimuluje vstup imunokompetentních buněk z cirkulace do tuku, a může tak zvyšovat jeho zánětlivou aktivitu.
Produkce prozánětlivých a proaterogenních faktorů je vyšší ve viscerální (event. epikardiální) tukové tkáni ve srovnání s tukovou tkání podkožní [22,23]. Je také zvýšená u pacientů s obezitou, diabetes mellitus a/nebo pokročilou aterosklerózou. Vzhledem k počtu faktorů produkovaných tukovou tkání není možné všechny podrobněji popisovat, zde se proto zaměříme především na faktory s prokázaným nebo předpokládaným významem v etiopatogenezi metabolických změn a přidružených onemocnění provázejících obezitu v rámci syndromu inzulinové rezistence.
Vybrané hormony tukové tkáně se vztahem k regulaci příjmu potravy a metabolickým důsledkům obezity
Leptin je proteinový hormon produkovaný převážně adipocyty. Byl objeven v roce 1994 metodou pozičního klonování u morbidně obézní ob/ob myši a své jméno dostal podle řeckého leptos, což znamená tenký nebo štíhlý [1]. Tato myš se vyznačuje extrémní obezitou, dyslipidemií, inzulinovou rezistencí a přítomností diabetes mellitus 2. typu. Bylo prokázáno, že uvedené odchylky jsou u ob/ob myší způsobeny mutací genu pro leptin a že rekombinantní podávání leptinu všechny uvedené odchylky normalizuje. Předpoklad, že lidskou obezitu bude možné snadno vyléčit podáváním leptinu, se však nepotvrdil. Bylo zjištěno, že jak u zvířat s prostou obezitou, tak i u obézních lidí hladiny leptinu obvykle pozitivně korelují s obsahem tuku v organizmu – jsou tedy zvýšeny u obézních a sníženy u štíhlých jedinců [24]. Leptin tak představuje cirkulující hormonální signál, který informuje hypotalamické centrum sytosti o stavu tukových zásob organizmu. Úplné chybění leptinu v důsledku mutace genu pro leptin vede u lidí k morbidní obezitě. Úplné chybění leptinu je u lidí stav velmi vzácný a podávání leptinu obézním jedincům bez mutace leptinového genu nepřineslo očekávané výsledky při léčbě obezity. Nadějnější by mohlo být kombinované podávání leptinu s některými gastrointestinálními hormony (např. amylinem či GLP-1 agonisty), které hmotnost obézních pacientů snižuje více [25].
Nejpravděpodobnější úlohou v leptinu v lidském organizmu je jeho regulační vliv u malnutričních stavů, kdy snížení jeho hladin spouští řadu dějů vedoucích k šetření energie a umožňujících přežití jedince při nedostatečném přívodu energie.
Kromě přímých regulačních vlivů leptinu na energetickou homeostázu a příjem potravy má tento hormon nepochybně řadu dalších účinků a zvýšení jeho hladin se může spolupodílet např. na vzniku arteriální hypertenze spojené s obezitou. Bylo prokázáno, že leptin vede ke zvýšení krevního tlaku jednak centrální aktivací sympatického nervového systému, jednak ovlivněním diurézy a zpětného vychytávání sodíku v ledvinách [26]. V experimentu byly prokázány i výrazné vlivy leptinu na regulaci angiogenezy, kostního metabolizmu, proliferace hematopoetických kmenových buněk a řadu dalších dějů [13]. Klinický význam všech těchto účinků je však nejistý.
Adiponectin je proteinový hormon produkovaný prakticky výlučně adipocyty, přestože některé práce ukazují, že místem produkce se za určitých okolností může stát i svalová tkáň. V experimentálních studiích bylo prokázáno, že hladiny adiponectinu i jeho exprese v tukové tkáni jsou výrazně snížené u modelů obezity, inzulinové rezistence a aterosklerózy [27]. Podávání adiponectinu tyto odchylky prakticky normalizuje. I přes tyto významné pokroky v našich znalostech o úloze adiponectinu v regulaci inzulinové senzitivity a zánětu existuje i nadále řada nejasností ohledně významu tohoto hormonu v metabolických regulacích a jeho možného klinického využití. Hladiny adiponectinu jsou totiž až tisícinásobně vyšší než např. koncentrace inzulinu či leptinu. Adiponectin navíc cirkuluje v různých izoformách a má tendenci tvořit multimery, které se zdají mít různou afinitu a aktivitu v různých tkáních [28].
Na rozdíl od leptinu jsou hladiny adiponectinu sníženy u lidí s obezitou, ale také s inzulinovou rezistencí a aterosklerózou [29,30]. Jeho zvýšení je typicky nacházeno u štíhlých jedinců a sportovců [31]. Dosud není zcela jasné, nakolik má snížení hladin adiponectinu etiopatogenetický vztah ke vzniku diabetu 2. typu, inzulinové rezistence a aterosklerózy nebo nakolik je pouze markerem rozvoje těchto onemocnění [32]. Jisté je, že v experimentu podávání adiponectinu všechny tyto stavy přinejmenším částečně upravuje. Zajímavým faktem je, že jedna ze skupin perorálních antidiabetik používaných při léčbě diabetu 2. typu – thiazolidindiony neboli glitazony – hladiny adiponectinu významně zvyšují, což může částečně vysvětlovat jejich antidiabetické účinky [33,34]. Podávání adiponectinu by tak teoreticky mohlo zlepšit nejen obezitu, ale také dyslipidemie a poruchy glukózové homeostázy u pacientů s obezitou. Problémem je, že podávané dávky by musely být velmi vysoké. Velmi obtížné je rovněž synteticky vyrobit multimerní molekuly, které jsou zřejmě hlavní účinnou cirkulující formou.
Resistin je proteinový hormon původně objevený jako předpokládané pojítko mezi obezitou a inzulinovou rezistencí [35]. Objeven byl jako jeden z faktorů, které byly v tukové tkáni nejvýrazněji sníženy po podávání thiazolidindionů. Jeho hladiny jsou v experimentu obvykle zvýšeny u obézních zvířat, jeho podávání vede k inzulinové rezistenci v jaterní tkáni. První experimenty ukazovaly, že inhibice účinků resistinu např. podáváním protilátek proti tomuto hormonu vedlo ke zvýšení inzulinové senzitivity. Předpokládalo se tedy, že ovlivnění produkce resistinu by mohlo být jedním ze způsobů ovlivnění inzulinové rezistence v klinické praxi. Pozdější klinické studie význam resistinu v regulaci inzulinové senzitivity poněkud zpochybnily. Především bylo prokázáno, že na rozdíl od hlodavců je resistin u lidí produkován převážně mikrofágy, a to pravděpodobně více makrofágy mimo tukovou tkáň než přímo v tukové tkáni [36]. Některé studie prokazují zvýšení hladin resistinu u obezity a inzulinové rezistence, jiné tuto změnu neprokázaly [37]. Celkově lze konstatovat, že u lidí je resistin spíše cytokinem produkovaným imunokompetentními buňkami než adipocytárním hormonem. Hlavním regulačním faktorem produkce resistinu je aktivace zánětlivé reakce, která vede k významnému zvýšení hladin resistinu. Hladiny i lokální produkce resistinu jsou tak výrazně zvýšeny u pacientů s akutním zánětem (např. kriticky nemocní pacienti) nebo některými chronickým zánětlivými nemocemi (např. revmatoidní artritida) [38]. Klinické využití modulace hladin resistinu je zatím značně nejisté. Navíc nejsou k dispozici ani způsoby, jak hladiny resistinu přímo ovlivnit.
Produkce komponent systému renin-angiotenzin-aldosteron v tukové tkáni
Zablokování systému renin-angiotenzin-aldosteron na úrovni vzniku a/nebo působení angiotenzinu ACE inhibitory nebo AT1-blokátory je jedním z důležitých přístupů v léčbě arteriální hypertenze. Bylo prokázáno, že řada z komponent systému renin-angiotenzin-aldosteron (především angiotenzionogen) je produkována v tukové tkáni a že tato produkce je zvýšena především ve viscerální tukové tkáni pacientů s obezitou [39]. V naší studii jsme prokázali, že akutní stres typu kardiochirurgické operace rovněž výrazně zvyšuje expresi angiotenzinu v epikardiálním tuku [40]. Zvýšená produkce komponent systému renin-angiotenzin-aldosteron se zdá mít nejen potenciální význam při vzniku arteriální hypertenze u obezity, ale i negativní lokální metabolické důsledky v tukové tkáni. Angiotenzinogen negativně ovlivňuje diferenciaci adipocytů i inzulinovou senzitivitu v tukové tkáni i inzulinovou senzitivitu. Dalším důkazem důležitosti lokální produkce systému renin-angiotenzin-aldosteron v tukové tkáni jsou velké klinické studie s ACE inhibitory, resp. AT1-blokátory, které prokazují, že kromě poklesu krevního tlaku dochází u takto léčených pacientů i ke snížení incidence diabetes mellitus 2. typu [41]. Předpokládá se, že hlavním mechanizmem pozitivních metabolických účinků blokády systému renin-angiotenzin-aldosteron je právě jejich přímé působení v tukové tkáni. V našich experimentálních studiích na lipoatrofických transgenních myších jsme prokázali, že přítomnost tukové tkáně je nezbytná pro pozitivní metabolické účinky zablokování systému renin-angiotenzin-aldosteron. Není však nutná pro jejich účinky antihypertezní (Kaválková et al, nepublikované výsledky).
Hormony tukové tkáně a nádory
Obezita je rizikovým faktorem pro vznik některých nádorů a řada poznatků nasvědčuje tomu, že změny hormonální produkce tukové tkáně mohou při tomto procesu hrát svou roli [42]. Existuje řada studií prokazujících, že např. resistin může in vitro růst některých nádorů stimulovat, zatímco adiponectin má účinky opačné. Klinicky však tyto poznatky dosud významněji využity nebyly.
Další hormony tukové tkáně s potenciální úlohou v metabolických regulacích
Řadu hormonů produkovaných tukovou tkání jsme zde podrobněji nezmínili, protože znalosti o jejich působení zatím pocházejí převážně z experimentálních studií a jejich změny u lidí nejsou známy nebo jsou tyto informace zatím omezené. Jako velmi zajímavý kandidát nejen z hlediska detekce rizikových faktorů sdružených s obezitou, ale i z hlediska potenciálního léčebného ovlivnění se jeví např. fatty acid binding protein 4 (FABP4) [43]. Tento protein je důležitým regulátorem intracelulárního metabolizmu volných mastných kyselin. Jeho hladiny jsou zvýšeny u pacientů s obezitou, diabetes mellitus 2. typu a aterosklerózou a snížení jeho hladin v experimentu má mimořádně pozitivní metabolické účinky [44].
Dalším intenzivně diskutovaným faktorem je retinol binding protein 4 (RBP-4), jehož hladiny jsou podle některých studií rovněž zvýšeny u obezity a inzulinové rezistence a jeho zablokování má pozitivní metabolické účinky [45]. Výsledky jsou však podstatně méně přesvědčivé než v případě FABP4.
Velmi zajímavá je pak skupina nově identifikovaných fibroblastových růstových faktorů (FGF), které jsou produkovány v jaterní i tukové tkáni, avšak působí převážně v tukové tkáni. Metabolicky významný je především FGF-21, jehož podávání v experimentu snižuje hmotnost a zlepšuje hyperglykemii i dyslipidemii nejen u hlodavců, ale i u diabetických opic [46]. Hlavním mechanizmem účinku je zřejmě zvýšení glukózového transportéru typu GLUT-2 právě v tukové tkáni s následnou stimulací vychytávání glukózy v tuku [47]. Tento mechanizmus přinejmenším částečně vysvětluje pozitivní metabolické účinky tohoto faktoru.
Perspektivy využití endokrinní funkce tukové tkáně v klinické praxi
Na základě současných znalostí lze předpokládat pozitivní dopad ovlivnění endokrinní funkce tukové tkáně u řady onemocnění (obezita, dyslipidemie, diabetes mellitus 2. typu, arteriální hypertenze atd.). Z terapeutického hlediska připadá v úvahu několik možností využití ovlivnění endokrinní funkce tukové tkáně v klinické praxi:
- substituce adipocytárních hormonů s pozitivními metabolickými účinky, které jsou sníženy u pacientů s obezitou či jinými nemocemi (např. adiponectinu);
- snížení produkce adipocytárních hormonů s negativními metabolickými účinky, které jsou u obézních pacientů zvýšeny (např. TNF-α, resistin apod.);
- zvýšení produkce adipocytárních hormonů s pozitivními metabolickými účinky (např. adiponectinu);
- nalezení látek stimulujících stejné receptory jako adipocytární hormony s pozitivními metabolickými účinky (např. osmotin v případě adiponectinových receptorů);
- zablokování působení adipocytárních hormonů s negativními metabolickými účinky (např. inhibice FABP4).
V klinické praxi bylo zatím vyzkoušeno jen málo z uvedených přístupů. Jediný adipocytární hormon dosud podávaný v širších klinických studiích byl leptin. Jeho podávání nepřineslo významnější efekty u obézních pacientů s vysokými hladinami leptinu, bylo však mimořádně úspěšné u pacientů s morbidní obezitou v důsledku mutace leptinového genu, kde došlo k významnému poklesu příjmu potravy a prakticky k normalizaci tělesné hmotnosti i přidružených metabolických odchylek [48]. Podávání leptinu také významně snížilo nadměrný příjem potravy a zlepšilo metabolickou kompenzaci u pacientů s lipoatrofickým diabetem [9]. U těchto pacientů došlo po podávání leptinu k významnému poklesu glykemie i při snížení antidiabetické medikace včetně vysazení inzulinu a ke značnému poklesu hladin volných mastných kyselin a triglyceridů. Došlo také prakticky k normalizaci jaterní steatózy a ke značnému zlepšení inzulinové senzitivity v jaterní i svalové tkáni. Výše zmiňovaná kombinace podávání depotního leptinu (metreleptin) se syntetickým analogem amylinu pramlintidem přineslo v jedné klinické studii nadějné výsledky ve vztahu k poklesu hmotnosti u pacientů s obezitou [25].
Dosud nejsou k dispozici klinické studie s podáváním adiponectinu, přestože z hlediska v experimentu prokázaných inzulin-senzitizujících a antiaterogenních účinků jde jednoznačně o adipocytární hormon s největší perspektivou potenciálního terapeutického využití. Hlavní důvody, proč adiponectin dosud nebyl zkoušen v klinické praxi, byly naznačeny výše. Je to především jeho velmi komplexní struktura s vytvářením multimerů, které je velmi obtížné nasyntetizovat ke klinickému použití. Dalším důvodem jsou relativně vysoké koncentrace tohoto hormonu v cirkulaci, které dosahují až tisícinásobku hladin jiných hormonů a k dosažení terapeutického účinku by tak bylo zřejmě třeba relativně vysokých dávek tohoto hormonu.
Velmi významným objevem potvrzujícím potenciální význam adiponectinu při léčbě diabetu je fakt, že podávání PPAR-γ agonistů – glitazonů vede k významnému zvýšení hladin adiponectinu a předpokládá se, že právě zvýšení hladin tohoto hormonu je jedním z důležitých mechanizmů inzulin senzitizujících účinků těchto léků u pacientů s DM 2. typu [49]. Z hlediska protizánětlivého působení především v tukové tkáni jde o velmi významné léky s pozitivními metabolickými účinky. Zároveň však jde o léky, které mají řadu dalších metabolických a jiných účinků. Význam vlastního ovlivnění zánětu a endokrinní produkce tukové tkáně v jejich celkových účincích je tak obtížné posoudit.
Potenciálně zajímavým přístupem v klinické praxi by mohlo být také podávání fibroblastového růstového faktoru 21. Zatím však také nejsou k dispozici žádné klinické studie na toto téma.
Endokrinní funkce tukové tkáně je velmi atraktivním výzkumným tématem, jehož širší praktické využití v klinické praxi je však zatím stále poměrně vzdálené. Navíc ani měření hladin adipocytárních hormonů není většinou v praxi dostupné (snad s výjimkou měření hladin leptinu). Jedinou v tuto chvíli jednoznačně oprávněnou indikací pro měření adipocytárnách hormonů v praxi je v měření hladin leptinu u dětí s těžkými formami obezity vzniklými v časném věku. Takto je možné určit jedince s mutací leptinového genu (ti by měli hladiny leptinu prakticky nulové). U těchto jedinců by substituce rekombinantního leptinu mohla mít výrazné antiobezitické a pozitivní metabolické účinky. Nabízí se i měření dalších faktorů, např. adiponectinu či FABP4 v rámci lepšího určení kardiovaskulárního rizika. Zatím však není potvrzeno, že by tyto faktory měly větší výpovědní hodnotu než v současné době používané markery kardiovaskulárního rizika.
Poděkování
Podpořeno MZOVFN2005 a SVV-2010-260503.
prof. MU Dr. Martin Haluzík, DrSc.
www.vfn.cz
www.tukovatkan.cz
e-mail: mhalu@lf1.cuni.cz
Sources
1. Zhang Y, Proenca R, Maffei M et al. Positional cloning of the mouse obese gene and its human homologue. Nature 1994; 372 : 425 – 432.
2. Hotamisligil GS, Shargill NS, Spiegelman BM. Adipose expression of tumor necrosis factor‑alpha: direct role in obesity‑linked insulin resistance. Science 1993; 259 : 87 – 91.
3. Hotamisligil GS, Arner P, Caro JF et al. Increased adipose tissue expression of tumor necrosis factor‑alpha in human obesity and insulin resistance. J Clin Invest 1995; 95 : 2409 – 2415.
4. Havel PJ. Control of energy homeostasis and insulin action by adipocyte hormones: leptin, acylation stimulating protein, and adiponectin. Curr Opin Lipidol 2002; 13 : 51 – 59.
5. Svačina S, Owen K. Syndrom inzulínové rezistence. Praha: Triton 2003.
6. Reitman ML, Mason MM, Moitra J et al. Transgenic mice lacking white fat: models for understanding human lipoatrophic diabetes. Ann N Y Acad Sci 1999; 892 : 289 – 296.
7. Garg A, Vinaitheerthan M, Weatherall PT et al. Phenotypic heterogeneity in patients with familial partial lipodystrophy (dunnigan variety) related to the site of missense mutations in lamin a/ c gene. J Clin Endocrinol Metab 2001; 86 : 59 – 65.
8. Shulman GI. Cellular mechanisms of insulin resistance. J Clin Invest 2000; 106 : 171 – 176.
9. Oral EA, Simha V, Ruiz E et al. Leptin‑replacement therapy for lipodystrophy. N Engl J Med 2002; 346 : 570 – 578.
10. Stewart PM, Boulton A, Kumar S et al. Cortisol metabolism in human obesity: impaired cortisone – – > cortisol conversion in subjects with central adiposity. J Clin Endocrinol Metab 1999; 84 : 1022 – 1027.
11. Macciò A, Madeddu C, Mantovani G. Adipose tissue as target organ in the treatment of hormone ‑ dependent breast cancer: new therapeutic perspectives. Obes Rev 2009; 10 : 660 – 670.
12. Müllerová D, Kopecký J. White adipose tissue: storage and effector site for environmental pollutants. Physiol Res 2007; 56 : 375 – 381.
13. Haluzík M. Poruchy výživy a leptin. Praha: Grada Publishing 2002.
14. Ravussin E, Smith SR. Increased fat intake, impaired fat oxidation, and failure of fat cell proliferation result in ectopic fat storage, insulin resistance, and type 2 diabetes mellitus. Ann N Y Acad Sci 2002; 967 : 363 – 378.
15. Xu H, Barnes GT, Yang Q et al. Chronic inflammation in fat plays a crucial role in the development of obesity‑related insulin resistance. J Clin Invest 2003; 112 : 1821 – 1830.
16. Weisberg SP, McCann D, Desai M et al. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest 2003; 112 : 1796 – 1808.
17. Haffner SM. Insulin resistance, inflammation, and the prediabetic state. Am J Cardiol 2003; 92 : 18J – 26J.
18. Lumeng CN, Bodzin JL, Saltiel AR. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J Clin Invest 2007; 117 : 175 – 184.
19. Després JP. Cardiovascular disease under the influence of excess visceral fat. Crit Pathw Cardiol 2007; 6 : 51 – 59.
20. Kremen J, Dolinkova M, Krajickova J et al. Increased subcutaneous and epicardial adipose tissue production of proinflammatory cytokines in cardiac surgery patients: possible role in postoperative insulin resistance. J Clin Endocrinol Metab 2006; 91 : 4620 – 4627.
21. Curat CA, Wegner V, Sengenès C et al. Macrophages in human visceral adipose tissue: increased accumulation in obesity and a source of resistin and visfatin. Diabetologia 2006; 49 : 744 – 747.
22. Dolinková M, Dostálová I, Lacinová Zet al. The endocrine profile of subcutaneous and visceral adipose tissue of obese patients. Mol Cell Endocrinol 2008; 291 : 63 – 70.
23. Lacinová Z, Michalský D, Kasalický M et al. The influence of obesity on the gene expression of adiponectin and its receptor in subcutaneous adipose tissue. Vnitř Lék 2007; 53 : 1190 – 1197.
24. Haluzíková D, Haluzík M, Nedvídková J et al. Effect of physical activity on serum leptin levels. Sb Lék 2000; 101 : 89 – 92.
25. Ravussin E, Smith SR, Mitchell JA et al. Enhanced weight loss with pramlintide/ metreleptin: an integrated neurohormonal approach to obesity pharmacotherapy. Obesity (Silver Spring) 2009; 17 : 1736 – 1743.
26. Aizawa ‑ Abe M, Ogawa Y, Masuzaki H et al. Pathophysiological role of leptin in obesity‑related hypertension. J Clin Invest 2000; 105 : 1243 – 1252.
27. Trujillo ME, Scherer PE. Adiponectin – journey from an adipocyte secretory protein to biomarker of the metabolic syndrome. J Intern Med 2005; 257 : 167 – 175.
28. Polak J, Kovacova Z, Holst C et al. Total adiponectin and adiponectin multimeric complexes in relation to weight loss‑induced improvements in insulin sensitivity in obese women: the NUGENOB study. Eur J Endocrinol 2008; 158 : 533 – 541.
29. Hotta K, Funahashi T, Arita Y et al. Plasma concentrations of a novel, adipose‑specific protein, adiponectin, in type 2 diabetic patients. Arterioscler Thromb Vasc Biol 2000; 20 : 1595 – 1599.
30. Haluzikova D, Roubicek T, Haluzik M. Adiponectin and atherosclerosis. Vnitř Lék 2007; 53 : 359 – 363.
31. Housova J, Anderlova K, Krizova J et al. Serum adiponectin and resistin concentrations in patients with restrictive and binge/ purge form of anorexia nervosa and bulimia nervosa. J Clin Endocrinol Metab 2005; 90 : 1366 – 1370.
32. Housová J, Housa D, Haluzík M. Adiponektin – nový adipocytární hormon se vztahem k obezite a inzulínové rezistenci. Vnitř Lék 2005; 51 : 221 – 225.
33. Maeda N, Takahashi M, Funahashi T et al. PPARgamma ligands increase expression and plasma concentrations of adiponectin, an adipose‑derived protein. Diabetes 2001; 50 : 2094 – 2099.
34. Haluzik M, Svacina Š. Metabolický syndrom a nukleární receptory PPAR. Praha: Grada Publishing 2005.
35. Steppan CM, Bailey ST, Bhat S et al. The hormone resistin links obesity to diabetes. Nature 2001; 409 : 307 – 312.
36. Savage DB, Sewter CP, Klenk ES et al. Resistin/ Fizz3 expression in relation to obesity and peroxisome proliferator‑activated receptor ‑ gamma action in humans. Diabetes 2001; 50 : 2199 – 2202.
37. Haluzik M, Haluzikova D. The role of resistin in obesity‑induced insulin resistance. Curr Opin Investig Drugs 2006; 7 : 306 – 311.
38. Senolt L, Housa D, Vernerova Z et al. Resistin in rheumatoid arthritis synovial tissue, synovial fluid and serum. Ann Rheum Dis 2007; 66 : 458 – 463.
39. Engeli S, Schling P, Gorzelniak K et al. The adipose‑tissue renin‑angiotensin‑aldosterone system: role in the metabolic syndrome? Int J Biochem Cell Biol 2003; 35 : 807 – 825.
40. Roubicek T, Dolinkova M, Blaha J et al. Increased angiotensinogen production in epicardial adipose tissue during cardiac surgery: possible role in a postoperative insulin resistance. Physiol Res 2008; 57 : 911 – 917.
41. Scheen AJ. Prevention of type 2 diabetes mellitus through inhibition of the Renin‑Angiotensin system. Drugs 2004; 64 : 2537 – 2565.
42. Housa D, Housova J, Vernerova Z et al. Adipocytokines and cancer. Physiol Res 2006; 55 : 233 – 244.
43. Xu A, Wang Y, Xu JY et al. Adipocyte fatty acid‑binding protein is a plasma biomarker closely associated with obesity and metabolic syndrome. Clin Chem 2006; 52 : 405 – 413.
44. Boord JB, Maeda K, Makowski L et al. Combined adipocyte ‑ macrophage fatty acid‑binding protein deficiency improves metabolism, atherosclerosis, and survival in apolipoprotein E ‑ deficient mice. Circulation 2004; 110 : 1492 – 1498.
45. Graham TE, Yang Q, Blüher M et al. Retinol‑binding protein 4 and insulin resistance in lean, obese, and diabetic subjects. N Engl J Med 2006; 354 : 2552 – 2563.
46. Dostalova I, Haluzikova D, Haluzik M. Fibroblast growth factor 21: a novel metabolic regulator with potential therapeutic properties in obesity/ type 2 diabetes mellitus. Physiol Res 2009; 58 : 1 – 7.
47. Kharitonenkov A, Shanafelt AB. Fibroblast growth factor ‑ 21 as a therapeutic agent for metabolic diseases. Bio Drugs 2008; 22 : 37 – 44.
48. Farooqi IS, Matarese G, Lord GM et al. Beneficial effects of leptin on obesity, T cell hyporesponsiveness, and neuroendocrine/ metabolic dysfunction of human congenital leptin deficiency. J Clin Invest 2002; 110 : 1093 – 1103.
49. Pajvani UB, Hawkins M, Combs TP et al. Complex distribution, not absolute amount of adiponectin, correlates with thiazolidinedione ‑ mediated improvement in insulin sensitivity. J Biol Chem 2004; 279 : 12152 – 12162.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 10-
All articles in this issue
- The incidence of obesity and its complications in the Czech Republic
- Genetics of obesity
- Clinical and genetic aspects of monogenic obesity
- Complications of obesity – pathogenesis
- Smoking and obesity
- Past, present and future of obesity pharmacotherapy
- Metabolic surgery
- Physical activity in the treatment of obesity
- Obesity and arterial hypertension
- Adipose tissue hormones
- Treatment of an obese diabetic
- Obesity and a risk of carcinoma
- Obesity – the risk factor of cardiovascular disease in patients with chronic kidney disease?
- Eating disorders in obese individuals – a psychiatric or internal medicine issue?
- Obesity prevention
- A new concept of clinical classification of obesity
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Genetics of obesity
- Adipose tissue hormones
- Obesity prevention
- The incidence of obesity and its complications in the Czech Republic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

