-
Medical journals
- Career
Plazmatické hladiny neuropeptidu Y, ghrelinu a leptinu u pacientek s anorexia nervosa a jejich změny po šestitýdenní realimentaci
Authors: L. Beranová 1; D. Sedláčková 1; J. Kopečková 1; V. Hainer 1; H. Papežová 2; H. Kvasničková 1; J. Nedvídková 1
Authors‘ workplace: Laboratoř klinické a experimentální neuroendokrinologi e Endokrinologického ústavu Praha, vedoucí pracoviště RNDr. Jara Nedvídková, CSc. 1; Oddělení poruch příjmu potravy Psychiatrické kliniky 1. lékařské fakulty UK a VFN Praha, vedoucí pracoviště prof. MU Dr. Hana Papežová, CSc. 2
Published in: Vnitř Lék 2009; 55(10): 925-928
Category: Original Contributions
Overview
Úvod:
Anorexia nervosa je charakterizována výraznými změnami v sekreci hormonů ovlivňujících příjem potravy, energeticko u homeostázu a dlouhodobo u regulaci tělesné hmotnosti. Cílem této studi e bylo stanovit u pacientek s anorexia nervosa plazmatické hladiny ne uropeptidu Y, ghrelinu a leptinu a změny těchto hormonů po 6týdenní částečné nutriční realimentaci, která probíhala během hospitalizace. Pacienti a metodika: Do studie bylo zařazeno 10 žen s anorexia nervosa restriktivního typu (body mass index 14,74 ± 0,43; věk 23,3 ± 1,0), diagnostikovaných podle DSM - IV a v době studie hospitalizovaných na jednotce specializované pro poruchy příjmu potravy, a 10 zdravých kontrolních žen (body mass index 21,45 ± 0,72; věk 24,3 ± 0,8). Bazální plazmatické hladiny neuropeptidu Y, ghrelinu a leptinu byly měřeny na počátku a konci léčby. Výsledky: U pacientek s anorexia nervosa byly zjištěny významně zvýšené bazální plazmatické hladiny neuropeptidu Y a ghrelinu ve srovnání s kontrolními ženami, hladiny leptinu měly tyto pacientky významně nižší. Po 6 týdnech léčby hladiny ghrelinu u pacientek s anorexia nervosa významně poklesly a hladiny leptinu se zvýšily. Plazmatické hladiny neuropeptidu Y se během léčby nezměnily, průměrný body mass index u pacientek s anorexia nervosa významně vzrostl. Závěr: Plazmatické hladiny ghrelinu a leptinu se u pacientek s anorexia nervosa měnily očekávaným směrem podle změny tělesné hmotnosti. Plazmatické hladiny neuropeptidu Y nevykázaly v tomto směru významno u změnu. Hladiny leptinu tak spolu s dlouhodobě zvýšenými hladinami neuropeptidu Y ukazují na přetrvávající dysregulaci mechanizmů řídících tělesno u hmotnost a apetit.Klíčová slova:
anorexia nervosa – neuropeptid Y – ghrelin – leptin – krátkodobá realimentaceÚvod
V posledních letech u nás stále dochází k nárůstu incidence a prevalence poruch příjmu potravy. Nejzávažnějším onemocněním je anorexia nervosa (AN), která je charakterizována výraznými, psychicky podmíněnými abnormalitami v příjmu potravy. Intenzivní obavy z nárůstu tělesné hmotnosti a zkreslené vnímání vlastního těla vede nemocné k závažnému omezení příjmu kalorií a úmyslnému hladovění, a to i v případě, že hmotnost je zcela přiměřená nebo pod hranicí normy [13]. Komplikacemi dlouhodobé podvýživy, zejména restriktivní formy AN, jsou poruchy endokrinních a imunitních funkcí, plicní, renální a gastrointestinální komplikace, poškození myokardu a osteoporóza [12]. U pacientů s AN dochází k výrazným změnám v sekreci hormonů, které ovlivňují příjem potravy, energetickou homeostázu a dlouhodobou regulaci tělesné hmotnosti [31].
Hlavním mozkovým centrem pro řízení příjmu potravy a udržení energetické homeostázy organizmu je hypotalamus [12]. Mezi významné orexigenní hormony hypotalamu patří neuropeptid Y (NPY). Přibližně 40% NPY je tvořeno v nucleus arcuatus (ARC) [9], menší množství uvolňují i další hypotalamická jádra a některé periferní tkáně mimo oblast mozku [32]. Podle nedávných nálezů secernují NPY v malém množství také buňky abdominální tukové tkáně [32].
Studie prováděné dosud u pacientek s AN uvádějí různé bazální plazmatické hladiny NPY. V některých studiích byly u těchto pacientek nalezeny hladiny NPY zvýšené oproti zdravým kontrolním ženám [5,20], jiní autoři naopak poukazují na snížené bazální hladiny NPY u AN [1]. Vyšší bazální hladiny NPY u pacientek s AN mohou být vysvětlovány potlačením vnímavosti homeostatického systému těchto pacientek k orexigennímu vlivu NPY. V současné době je známo málo o periferních účincích NPY. U zdravých jedinců NPY uvolňovaný centrální nervovou soustavou (CNS) navozuje pocit hladu a současně podporuje diferenciaci preadipocytů v tukové tkáni, kterénásledně také produkují v malém množství NPY. Nadbytečný příjem potravy tak vede ke zvyšování tukové rezervy a počtu adipocytů [11]. Těmto nálezům odpovídají i dřívější pozorování zvýšených plazmatických hladin NPY u obézních osob [2].
Ghrelin je orexigenní hormon produkovaný majoritně v žaludku. Zvyšuje příjem potravy a snižuje výdej energie a spolu s dalšími signály tak informuje centrum energetické rovnováhy o tom, kdy je nutné zásoby energie doplnit [16]. V hypotalamu ghrelin působí na centra v ARC tím, že se váže na receptory neuronů, obsahujících NPY a agouti related peptide (AgRP), které ovlivňují chuť k jídlu a příjem potravy. Neurony v ARC jsou cílovou tkání i pro leptin, a to zejména proopiomelanocortinové (POMC-CART) a NPY-AgRP neurony. Aktivace orexigenních AgRP-NPY jader zvyšuje chuť k jídlu a metabolizmus, zatímco aktivace POMC-CART neuronů má opačný efekt [10]. Hladina ghrelinu v krvi vzrůstá během půstu a klesá přibližně během hodiny po přijetí potravy [12,19]. U pacientů s AN jsou plazmatické koncentrace ghrelinu v důsledku negativní energetické bilance a dlouhodobého hladovění významně vyšší než u zdravých jedinců [4,19,24,29].
Za jednoho z hlavních antagonistů ghrelinu je považován anorexigenní hormon leptin, který potlačuje příjem potravy tím, že převádí do mozku signály týkající se energetických zásob organizmu [10,15,18]. Leptin je produkovaný převážně tukovou tkání a účastní se dlouhodobé regulace tělesné hmotnosti, energetické bilance a regulace tělesné teploty [6,25,28]. Jeho množství je u pacientů s AN významně nižší než u zdravých jedinců, v přímém vztahu k redukovanému množství tělesného tuku [5,8,17,23,30].
U pacientek s AN dochází během realimentace ke zvýšení tělesné hmotnosti a spolu s tím ke změnám v hladinách hormonů ovlivňujících příjem potravy. Plazmatické hladiny ghrelinu se vracejí částečně nebo zcela na normální úroveň, v závislosti na délce a úspěšnosti léčby. Plazmatické hladiny leptinu se po realimentaci u pacientek s AN zvyšují v závislosti na váhovém příbytku [3,12,14,19,21]. Plazmatické hladiny NPY a jejich změny během léčby byly dosud jen velmi málo prozkoumány, a navíc je jen obtížně zjistitelný zdroj jeho sekrece.
Cílem studie bylo u sledované skupiny pacientek s AN restriktivního typu zjistit bazální plazmatické hladiny NPY, ghrelinu a leptinu a jejich změny po 6týdenní částečné realimentaci, která probíhala během hospitalizace.
Soubor nemocných a metodika
Sledovaný soubor tvořilo 10 žen s DSM-IVdiagnostikovanou anorexia nervosa restriktivního typu (věk 23,3 ± 1,0; BMI 14,74 ± 0,43), hospitalizovaných na Psychiatrické klinice 1. LF UK a VFN, a 10 zdravých kontrolních žen (věk 24,3 ± 0,8; BMI 21,45 ± 0,72). V den odběru krve bylo provedeno základní lékařské vyšetření a změřena tělesná výška a hmotnost. Žádná z probandek netrpěla závažným akutním ani chronickým onemocněním. Zdravým ženám byla krev odebírána ve folikulární fázi menstruačního cyklu, pacientky s AN měly amenoreu. Pacientkám byla krev odebrána 2krát, poprvé na počátku hospitalizace a podruhé po 6týdenní léčbě. Realimentace a úprava jídelního režimu byla součástí komplexního terapeutického programu podle terapeutických doporučení [22]. Pacientky po 1–2 týdnech adaptace dostávaly klasickou racionální dietu s bílkovinnými přídavky 3 000–4 000 kcal, která mohla být obohacena podle závažnosti malnutrice sippingem nutričních nápojů, po poradě s lékařem nutricionistou. Všechny zúčastněné probandky podepsaly před zahájením studie informovaný souhlas s účastí ve studii, schválené Etickou komisí Endokrinologického ústavu.
Krev byla odebírána ráno v 7.30 hod po celonočním půstu, z loketní žíly, do zkumavek s Na2EDTA a aprotininem (pro získání plazmy a inhibici proteáz). Bezprostředně po odběru byla krev uložena do ledové tříště, stočena při 4 °C a získaná plazma byla zamražena při –30 °C. Následně byly radioimunologickou metodou (RIA) pomocí komerčních kitů stanoveny bazální plazmatické hladiny NPY, ghrelinu a leptinu (Linco Research, Inc., St. Charles, Missouri, USA).
Naměřené hodnoty pacientek s AN před léčbou byly statisticky porovnány s hodnotami po léčbě pomocí párového neparametrického Wilcoxonova testu a dále s hodnotami kontrolního souboru 10 zdravých žen za použití Kruskal-Wallisova testu následovaného Kruskal-Wallisovými Z-testy vícenásobného porovnávání. Výsledky jsou vyjádřeny jako aritmetické průměry ± SEM, hladina významnosti byla zvolena p < 0,05.
Výsledky
Porovnání sledovaných parametrů jeuvedeno v tab. 1. Hladiny plazmatického ghrelinu byly u pacientek s AN před léčbou významně vyšší než u zdravých žen, hladiny leptinu a BMI měly pacientky významně snížené. Po 6týdenním léčebném období došlo u pacientek s AN ke snížení hladin ghrelinu, které však zůstaly stále vyšší ve srovnání se zdravými ženami. Plazmatické hladiny leptinu se po částečné realimentaci významně zvýšily, zůstaly však nižší než průměrné hodnoty zdravých žen. Hladiny plazmatického NPY byly u pacientek s AN významně vyšší než u zdravých kontrol a po 6týdenní realimentaci nedošlo k významným změnám. Průměrná hodnota BMI se během léčby významně zvýšila.
Table 1. Hormonální charakteristiky pacientek s AN před a po 6týdenní realimentaci a porovnání s kontrolní skupino u zdravých žen. 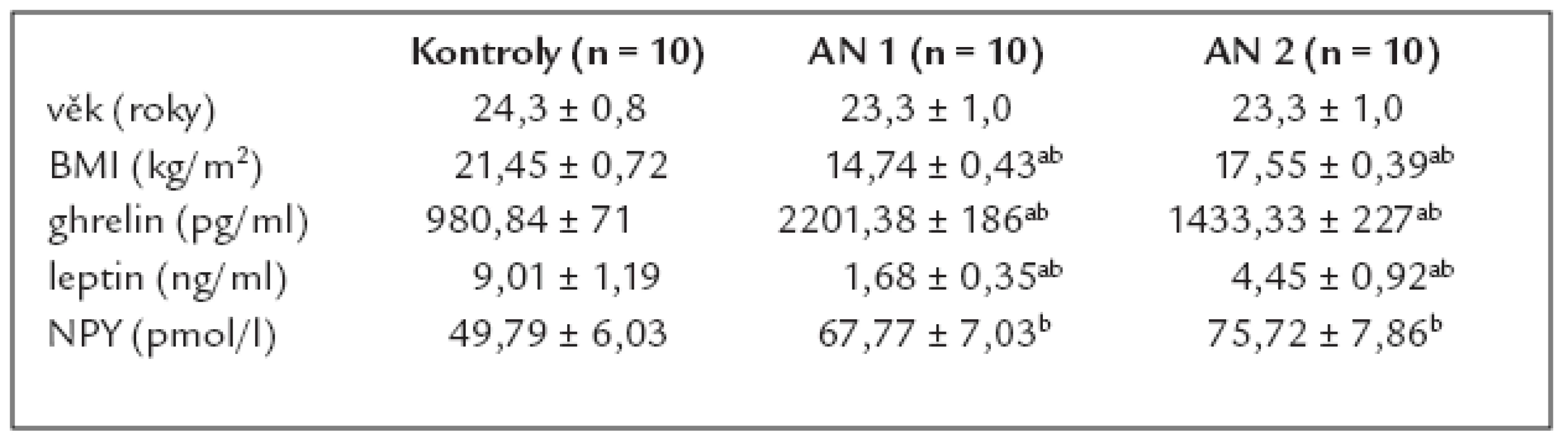
AN 1 – pacientky s anorexi a nervosa před léčbou, AN 2 – pacientky s anorexi a nervosa po 6týdenní léčbě, kontroly – kontrolní soubor zdravých žen Data jsou vyjádřena jako průměr ± SEM. ap < 0,05 AN 1 vs AN 2; bp < 0,05 AN 1, AN 2 vs Kontroly. Diskuze
V této studii jsme sledovali u pacientek s AN vybrané hormony související s řízením příjmu potravy a energetického metabolizmu – orexigenní peptidy NPY a ghrelin a anorexigenní leptin. Nalezli jsme zvýšené bazální plazmatické hladiny NPY u pacientek s AN, což je v souladu s již publikovanými výsledky [5,20]. Ve studii Escobara et al po 16týdenním realimentačním období a váhovém příbytku pacientek s AN plazmatické hodnoty NPY poklesly [5]. V naší studii jsme po kratším 6týdenním realimentačním období nezaznamenali pokles plazmatického NPY, jeho průměrné hladiny zůstaly významně vyšší a u poloviny pacientek došlo dokonce k jeho mírnému zvýšení během léčby. Jedním z možných vysvětlení může být, že NPY má funkci dlouhodobého regulátoru příjmu potravy a jeho hladiny se mění až po déletrvajících změnách výživového stavu organizmu. Poměr hladiny plazmatického ghrelinu, který stimuluje uvolnění NPY při hladu, k plazmatickému NPY však po relativně krátkodobé realimentaci našich pacientek poklesl z výrazně vyšší hodnoty na hodnoty blízké kontrolním osobám. Důvodem je významné snížení plazmatických hodnot ghrelinu během realimentace. V nedávné době Kos et al (2008) zjistili, že NPY je v určitém množství produkován také abdominální tukovou tkání, a může se tak účastnit zpětnovazebné signalizace o adipozitě, a dokonce být částečně odpovědný za omezení sekrece leptinu u pacientek s AN. Lze soudit, že plazmatické hladiny NPY u pacientek s AN zůstávají na vyšší hodnotě vzhledem k tomu, že regulační zásahy orexigenního ghrelinu a anorexigenního leptinu nejsou ještě na takové úrovni, aby zajistily energetickou bilanci odpovídající normě.
Plazmatické hladiny ghrelinu byly u sledovaných pacientek s AN v důsledku negativní energetické bilance na počátku realimentačního období významně zvýšené. Po šesti týdnech léčby hladiny ghrelinu významně poklesly, stále však zůstaly vyšší než u zdravých žen. Tyto výsledky ukazují na částečné potlačení chronického hladovění u pacientek s AN a jsou v souladu s dříve publikovanými pracemi [3,12,14,19,21]. Plazmatické hladiny leptinu u pacientek s AN jsou v souvislosti s nadměrným úbytkem tukové tkáně výrazně snížené, což se potvrdilo i u námi sledované skupiny. Po šesti týdnech léčby hladiny leptinu výrazně vzrostly, i když stále zůstaly nižší než hodnoty zdravých žen. Tyto výsledky korespondují se studiemi Haluzíka et al [7], Svobodové et al [26] a Tagamiho et al [27] a potvrzují úlohu leptinu jako citlivého výživového parametru [7,26,27]. Hodnoty BMI se během 6týdenní léčby významně zvýšily, nedosáhly však ještě minimální hodnoty udávané pro zdravé ženy. Tato skutečnost také odpovídá tomu, že jak plazmatický NPY a ghrelin, tak ani leptin nedosáhly po léčbě hodnot kontrolních žen.
Závěr
Ze získaných výsledků vyplývá, že sledované hormony reagují na nutriční stav organizmu a mění se u pacientek s anorexia nervosa spolu s nárůstem tělesné hmotnosti. Během 6týdenního realimentačního období se u pacientek s AN plazmatické hladiny ghrelinu a leptinu posouvaly směrem k hodnotám kontrolních žen. Plazmatická hladina NPY zůstala na vyšší hodnotě zřejmě vzhledem k tomu, že regulační zásahy ghrelinu a leptinu nebyly ještě na takové úrovni, aby zajistily energetickou bilanci odpovídající normě. Započatá diferenciace preadipocytů pravděpodobně stimulací NPY pokračovala a tomu odpovídala i jeho zvýšená hladina.
Poděkování
Tato studie vznikla za podpory grantu IGA NR/9158-3 a VZ 21620816. Děkujeme Miloslavě Jungmannové za spolupráci při odběrech pacientek, Dianě Riegerové a Nadě Procházkové za technickou podporu při analytických laboratorních stanoveních.
RNDr. Jara Nedvídková, CSc.
www.endo.cz
e mail: jnedvidkova@endo.cz
Sources
1. Baranowska B, Wolinska - Witort E, Wasilewska - Dzi ubinska E et al. Plasma leptin, neuropeptide Y (NPY) and galanin concentrati ons in bulimia nervosa and in anorexia nervosa. Neuro Endocrinol Lett 2001; 22 : 356 – 358.
2. Baranowska B, Wolinska - Witort E, Wasilewska - Dzi ubinska E et al. The role of neuropeptides in the disturbed control of appetite and hormone secreti on in eating disorders. Neuro Endocrinol Lett 2003; 24 : 431 – 434.
3. Bronský J, Nedvídková J, Schmidtová J et al. Ghrelin, leptin, IGF‑I, IGF BP - 3 and their relati onship in girls with mental anorexia before and after realimentati on. J Pedi atr Gastroenter Nutr 2004; 39: S74.
4. Čáp J. Ghrelin and anorexia nervosa. Vnitř Lék 2002; 48 : 919 – 920.
5. Escobar L, Freire JM, Espinosa R et al. Determinati on of insulin, leptin and neuropeptide Y by radio immuno analysis in patients with morbid obesity and anorexia nervosa after therapeutic intervention. Rev Esp Med Nucl 2002; 21 : 3 – 11.
6. Friedman JM. The functi on of leptin in nutriti on, weight, and physiology. Nutr Rev 2002; 60: S1 – S14.
7. Haluzík M, Papežová H, Nedvídková J et al. Serum leptin levels in patients with anorexia nervosa before and after partial refeeding, relationships to serum lipids and biochemical nutritional parameters. Physiol Res 1999; 48 : 197 – 202.
8. Haluzík M, Kábrt J, Nedvídková J et al. Serum leptin levels in female patients with protein‑calorie malnutriti on and its relation to biochemical indicators of nutritional status. Vnitř Lék 1999; 45 : 202 – 205.
9. Hillebrand JJ, de Wi ed D, Adan RA. Neuropeptides, food intake and body weight regulati on: a hypothalamic focus. Peptides 2002; 23 : 2283 – 2306.
10. Hosoda H, Kojima M, Kangawa K. Ghrelin and the regulation of food intake and energy balance. Mol Interv 2002; 2 : 494 – 503.
11. Kos K, Harte AL, James S et al. Secretion of neuropeptide Y (NPY) in human adipose tissue and its role in maintenance of adipose tissue mass. Am J Physiol Endocrinol Metab 2007; 293: E1335 – E1340.
12. Kojima M, Kangawa K. Ghrelin: structure and functi on. Physi ol Rev 2005; 85 : 495 – 522.
13. Krch FD. Poruchy příjmu potravy. Praha: Grada 2005.
14. Kršek M, Rosická M, Haluzík M et al. The changes in serum leptin levels and their relati onship to IGF‑I, its binding proteins and leptin in women patients with anorexia nervosa. Vnitř Lék 2002; 48 : 948 – 951.
15. Krykorková I, Nedvídková J. Nedávno objevené hormony s účastí v energetické homeostázi. Čas Lék Čes 2003; 2 : 80 – 83.
16. van der Lely AJ, Tschop M, Heiman ML et al. Biological, Physi ological, Pathophysiological, and Pharmacological aspects of ghrelin. Endocr Rev 2004; 25 : 426 – 457.
17. Monteleone P, Di Lietto A, Tortorella A et al. Circulating leptin in patients with anorexia nervosa, bulimia nervosa or binge-eating disorder: relationship to body weight, eating patterns, psychopatology and endocrine changes. Psychiatry Res 2000; 94 : 121 – 129.
18. Nedvídková J, Papežová H, Haluzík M et.al. Interacti on between serum leptin levels and hypothalamo - hypophyse al - thyro id axis in patients with anorexia nervosa. Endocr Res 2000; 26 : 219 – 230.
19. Nedvídková J, Krykorková I, Barták Vet al. Loss of meal - Induced Decrease in Plasma ghrelin Levels in Patients with Anorexia Nervosa. J Clin Endocrinol Metab 2003; 88 : 1678 – 1682.
20. Oświ ecimska J, Zi ora K, Geisler G et al. Prospective evaluati on of leptin and neuropeptide Y (NPY) serum levels in girls with anorexia nervosa. Neuro Endocrinol Lett 2005; 26 : 301 – 304.
21. Otto B, Cuntz U, Frueha uf E et al. Weight Gain decrease elevated plasma ghrelin concentrati ons of patients with anorexia nervosa. Eur J Endocrinol 2001; 145 : 669 – 673.
22. Papežová H, Kocourková J, Koutek J. Poruchy příjmu potravy. In: Raboch J, Anders M, Praško J et al (eds). Psychiatri e. Doporučené postupy psychiatrické péče II. Praha: Infopharm 2006 : 127 – 140.
23. Pařízková J, Křížová J, Jiskra J et al. Leptin levels in female patients with restrictive and purgative types of anorexia nervosa. Čas Lék Čes 2003; 142 : 289 – 291.
24. St-Pi erre DH, Wang L, Taché Y. Ghrelin: a novel player in the gut - brain regulati on of growth hormone and energy balance. News Physi ol Sci 2003; 18 : 242 – 246.
25. Strader AD, Woods CS. Gastrointestinal hormones and food intake. Gastroenterology 2005; 128 : 175 – 191.
26. Svobodová J, Haluzík M, Papežová H et al. Vliv částečné realimentace na sérové koncentrace leptinu a klidový energetický výdej u pacientek s mentální anorexi í. Čas Lék Čes 1999; 24 : 748 – 752.
27. Tagami T, Satoh N, Usui T et al. Adiponectin in anorexia nervosa and bulimia nervosa. J Clin Endocrinol Metab 2004; 89 : 1833 – 1837.
28. Teff KL, Elli ott SS, Tschöp M et al. Dietary Fructose reduces circulating insulin and leptin, attenuates postprandial suppression of ghrelin and increases triglycerides in women. J Clin Endocrinol Metab 2004; 89 : 2963 – 2972.
29. Tschöp M, Weyer C, Tataranni PA et al Circulating ghrelin levels are decre ased in human obesity. Diabetes 2001; 50 : 707 – 709.
30. Weigle DS, Cummings DE, Newby PD et al. Roles of leptin and ghrelin in the loss of body weight caused by a low fat, high carbohydrate diet. J Clin Endocrinol Metab 2003; 88 : 1577 – 1586.
31. Wren AM, Seal JL, Cohen MA et al. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab 2001; 86 : 5992 – 5995.
32. Yang K, Gu an H, Arany E et al. Neuropeptide Y is produced in visceral adipose tissue and promotes proliferation of adipocyte precursor cells via the Y1 receptor. FASEB J 2008; 22 : 2452 – 2464.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue 10-
All articles in this issue
- Charakteristika ulceráci í na nohách u diabetikov
- Plazmatické hladiny neuropeptidu Y, ghrelinu a leptinu u pacientek s anorexia nervosa a jejich změny po šestitýdenní realimentaci
- Sekundární dyslipidemie navozená současnými perorálními kontraceptivy
- BNP a echokardiografické parametre u pacientov s chronickými chorobami obličiek a dialyzovaných chorých
- Vztah mezi kvalito u života a BODE indexem u bývalých kuřáků ve stabilní fázi chronické obstrukční plicní nemoci
- 24letý muž s horečkami, multiorgánovou dysfunkcí a rychle progredujícím ARDS
- Léčba refluxní choroby jícnu – současný stav
- Polohový test – víme o něm opravdu všechno?
- Neuroendokrinní nádory žaludku
- Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009
- Nežádo ucí účinky amiodaronu na kůži
- IgA pemfigus provázející mnohočetný myelom vymizel při léčbě bortezomibem (Velcade), cyklofosfamidem a dexametazonem. Popis případu a přehled literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009
- Léčba refluxní choroby jícnu – současný stav
- Polohový test – víme o něm opravdu všechno?
- Neuroendokrinní nádory žaludku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

