-
Medical journals
- Career
Tradičné rizikové faktory aterosklerózy u pacientov so syndrómom obštrukčného spánkového apnoe-hypopnoe
Authors: E. Szabóová 1; Z. Tomori 2; J. Gonsorčík 1; J. Petrovičová 3
Authors‘ workplace: IV. interná klinika Lekárskej fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednosta prof. MUDr. Ivan Tkáč, Ph. D. 1; Ústav fyziológie Lekárskej fakulty UPJŠ Košice, Slovenská republika, prednosta prof. MUDr. Viliam Donič, CSc. 2; Ústav lekárskej informatiky Lekárskej fakulty UPJŠ Košice, Slovenská republika, prednosta Ing. Jaroslav Majerník, Ph. D. 3
Published in: Vnitř Lék 2008; 54(4): 352-360
Category: Original Contributions
Overview
Kardiovaskulárna morbidita a mortalita chorých so syndrómom obštrukčného spánkového apnoe-hypopnoe (OSAHS) je vysoká.
Cieľom našej práce bolo analyzovať, či zvýšený výskyt rizikových faktorov aterosklerózy u chorých s OSAHS môže vysvetľovať ich zvýšenú kardiovaskulárnu morbiditu.Metodika:
33 mužov s OSAHS stredného stupňa a 16 mužov bez OSAHS bolo rozdelených na kardiovaskulárne zdravých, hypertonikov a chorých s ischemickou chorobou srdca. Porovnávali sme výskyt tradičných rizikových faktorov aterosklerózy (vek, hyperlipoproteinémia, diabetes mellitus, artériová hypertenzia, fajčenie, obezita, pozitívna rodinná anamnéza), kompenzáciu metabolických rizikových faktorov, morfometriu srdca, hemodynamické parametre, markery aterosklerózy, mikroalbuminúriu a respiračné parametre.Výsledky:
Na všetkých stupňoch kardiovaskulárneho postihnutia mali chorí s/bez OSAHS porovnateľný rizikový profil, líšili sa ale respiračnými parametrami (určujúcimi OSAHS), naviac kardiovaskulárne zdraví s OSAHS vs non OSAHS hrubšou zadnou stenou ľavej komory (9,73 ± 1,17 vs 8,29 ± 1,38 mm, p < 0,04), intimo-mediálnou hrúbkou karotickej artérie (0,83 ± 0,14 vs 0,63 ± 0,08 mm, p < 0,00l) a hypertonici s OSAHS vs non OSAHS väčším diametrom pravej (28,4 ± 2,7 vs 26,25 ± 0,96 mm, p < 0,02) a ľavej komory (47,6 ± 3,3 vs 43,75 ± 0,96 mm, p < 0,01).Záver:
Zistili sme závažnejšiu aterosklerózu a horšie echokardiografické parametre u chorých s OSAHS v porovnaní s chorými bez OSAHS. Vzhľadom na porovnateľný výskyt rizikových faktorov a pravdepodobnosť ich optimálneho ovplyvnenia je možné uvažovať o OSAHS ako o samostatnom rizikovom faktore kardiovaskulárnych ochorení. Toto tvrdenie je nutné si ďalej overiť na prospektívnych štúdiách.Kľúčové slová:
obštrukčné spánkové apnoe - ateroskleróza - rizikové faktory - kardiovaskulárna morbidita a mortalitaÚvod
Syndróm spánkového apnoe-hypopnoe (SAHS) definujeme ako výskyt viac ako 10 apnoicko-hypopnoických epizód za l hod spánku, čo pri typickom klinickom obraze vedie k desaturácii krvi kyslíkom o viac ako 3 % [1]. Rozoznávame obštrukčný, centrálny a zmiešaný typ SAHS. Najčastejšie sa vyskytuje obštrukčný typ. Prevalencia OSAHS v populácii vo veku 30-60 rokov sa podľa Wisconsin Sleep Cohort Study odhaduje na 15 % u mužov a 5 % u žien [2]. OSAHS charakterizuje obštrukcia v horných dýchacích cestách, v dôsledku čoho neprúdi vzduch do pľúc napriek silnému respiračnému úsiliu [3]. V klinickom obraze dominuje hlasité chrápanie, apnoickými pauzami prerušované dýchanie v spánku, extrémna denná spavosť, poruchy kognitívnych funkcií a depresia.
OSAHS svojím komplexným účinkom ovplyvňuje funkciu rôznych orgánových systémov. Jeho najzávažnejšie následky sú kardiovaskulárne, ktoré sú hlavnou príčinou zvýšenej morbidity a mortality týchto ľudí [4]. Mortalita chorých so SAHS je vyššia ako vekom a body mass indexom (BMI) porovnateľnej populácie, riziko náhlej mozgovo-cievnej príhody (NMCP), ischemickej choroby srdca (ICHS) a srdcového zlyhávania rastie s apnoicko-hypopnoickým indexom (5,6). Nie je zatiaľ dokázané, či zvýšená kardiovaskulárna morbidita a mortalita u ľudí s OSAHS je spôsobená akcelerovanou aterosklerózou (AS). Ak áno, nevieme, či je to podmienené samotným OSAHS, koincidujúcimi rizikovými faktormi AS alebo ich kombináciou. Experimentálne práce na zvieratách dokázali, že hypoxémia urýchľuje degeneratívne zmeny cievnej steny [7]. Apnoicko-hyperpnoické cykly sú charakterizované prechodnou hypoxémiou a po prebudení a následnej hyperventilácii rýchlou reoxygenáciou. Hypoxia a následná reoxygenácia predstavuje vážne metabolické riziko, analogické reperfúznemu poškodeniu. Väčšina autorov dnes považuje OSAHS za aditívny rizikový faktor kardiovaskulárnych ochorení [5,6]. Ak sa ku komponentom syndrómu X pridruží OSAHS, hovoríme o syndróme Z (8). Hodnotiť OSAHS v úlohe rizikového faktora AS je veľmi ťažké [7,9,10], pretože tradičné rizikové faktory (vek, mužské pohlavie, hyperlipoproteinémia - HLP, diabetes mellitus - DM, artériová hypertenzia - AH, fajčenie, obezita, pozitívna rodinná anamnéza) sa vyskytujú aj u chorých s OSAHS. Diagnostika skorých štádií AS sa zakladá na detekcii biochemických, funkčných a morfologických zmien. Na detekciu predklinického (intimo-mediálna hrúbka cievnej steny - IMT) ale i neskorého štádia AS sa používa ultrasonografické vyšetrenie a. carotis.
Cieľom našej práce bolo porovnať výskyt a ovplyvnenie tradičných rizikových faktorov AS a vyhodnotiť prejavy AS u chorých s/bez OSAHS, ako možnú príčinu ich zvýšenej kardiovaskulárnej morbidity.
Súbor
Základný súbor 49 jedincov bol rozdelený na 2 skupiny:
- 33 jedincov s OSAHS a
- 16 jedincov bez OSAHS (kontrolný súbor).
Obe skupiny boli ďalej rozdelené na 3 podskupiny:
- a) klinicky zdravých jedincov bez zjavného kardiovaskulárneho ochorenia,
- b) hypertonikov,
- c) chorých s ICHS.
Početnosť a základnú charakteristiku jednotlivých podskupín uvádza tab. 1a a 1b. Vzhľadom na nízku prevalenciu OSAHS u žien do súboru boli zaradení len muži. Do súboru sme nezaradili chorých so zlyhaním vitálnych orgánov, bronchiálnou astmou, komplikovanou aterosklerózou neumožňujúcou spoluprácu, malignitou, závažnou hematologickou abnormalitou, ťažkým motorickým deficitom a s non compliance. Do súboru sme nezaradili diabetikov l. typu a z diabetikov 2. typu tých, ktorí mali závažné chronické komplikácie diabetu, ev. boli liečení inzulínom. Nikto zo zaradených pacientov nebol alkoholikom a nebol liečený pomocou kontinuálneho pozitívneho pretlaku cez nos (nCPAP). Vek mužov ≥ 45 rokov bol definovaný ako rizikový [11]. HLP, resp. dyslipoproteinémia (DLP) bola klasifikovaná podľa medzinárodných odporúčaní pre všetky skupiny rovnakými hladinami krvných lipidov (zvýšená hladina celkového a LDL-cholesterolu, resp. triacylglycerolov a znížená hladina HDL-cholesterolu) [11,12]. Pri klasifikácii sme rešpektovali nutnosť porovnania výsledkov s prácami iných autorov používajúcich podobné kritéria (13). Hodnota sérových lipidov bola stanovená priemerom z 2 odberov krvi v priebehu 1 - 8 týždňov. HLP bola potvrdená aj užívaním hypolipidemickej liečby a záznamom o diagnóze HLP v zdravotnej dokumentácii. DM bol definovaný užívaním antidiabetickej liečby alebo opakovaným stanovením glykémie nalačno v žilovej plazme > 7 mmol/l, resp. hodnotou glykémie > 11mmol/l v 120. minúte orálneho glukózového tolerančného testu, prevedeného za odporúčaných podmienok u jedincov s hraničnou glykémiou nalačno [14]. AH bola potvrdená užívaním antihypertenzív alebo hodnotou príležitostného krvného tlaku (TK) ≥ 140/90 mm Hg pri klinickom vyšetrení, resp. odporúčanými limitmi počas ambulantného monitorovania (priemerný celodenný TK: 125 - 130/80 mm Hg, priemerný denný TK: 130 - 135/85 mm Hg, priemerný nočný TK: > 120/70 mmHg). Kontrola tlaku a technika vyšetrenia boli prevedené podľa štandardných postupov [11,15-17]. Za fajčiara sme označili jedinca pravidelne fajčiaceho, resp. ktorý prestal fajčiť nie dávnejšie ako 3 mesiace pred zaradením do štúdie. Bývalý fajčiar prestal fajčiť pred týmto obdobím [18]. Obezita bola definovaná BMI > 30 kg/m2, centrálna obezita obvodom pása > 102 cm [11,16]. Pozitívna rodinná anamnéza bola definovaná výskytom ICHS u prvostupňových príbuzných u mužov vo veku < 55 rokov, u žien < 65 rokov [11]. Referenčná hodnota pre hyperurikémiu v našom laboratóriu je ≥ 420 μmol/l. Diagnostické kritéria pre ICHS v našej práci: prítomnosť klinických symptómov (angina pectoris, prekonaný IM, stav po PTCA, po koronárnom bypasse), pozitívna záťažová ergometria alebo pozitívna záťažová táliová scintigrafia a/alebo nález signifikantnej (> 50 %) stenózy na koronarograme [19]. Apnoe sme hodnotili ako pokles prietoku vzduchu nosom na ≤ 20 % bazálnej hodnoty, ev. jeho úplne vymiznutie na > 10 s. Počas hypopnoe je pokles prietoku vzduchu na 20-70 % bazálnej hodnoty. Epizóda OSA je spojená s poklesom, ev. vymiznutím prietoku vzduchu na > 10 s, paradoxným torakoabdominálnym pohybom a zvýšeným ezofageálnym tlakom. Ak je > 85 % všetkých epizód apnoe/hypopnoe obštrukčného typu, hovoríme o OSAHS [3].
Metódy
Všetci jedinci boli vyšetrení v spánkovom laboratóriu a na ambulancii neinvazívnej kardiológie IV. internej kliniky LF UPJŠ v Košiciach. Hodnotili sme anamnézu, zdravotnú dokumentáciu, fyzikálne vyšetrenie, výsledky biochemickej analýzy krvi a moču, 24hodinové monitorovanie krvného tlaku (ABPM), transtorakálnu echokardiografiu (ECHOKG), polysomnografický záznam a ultrasonografické (USG) vyšetrenie magistrálnych ciev. Identifikovali sme dietetické návyky, súčasnú a predchádzajúcu medikáciu. Stanovovali sme BMI a centrálnu obezitu meraním obvodu pásu. ABPM vyšetrenie bolo uskutočnené prístrojom Meditech ABPM 03, ojedinele Cardiotens 01. Parametre a indexy využívané v našej práci: diurnálny index, priemerný celodenný, denný a nočný systolický, resp. diastolický tlak krvi. ECHOKG vyšetrenie bolo realizované na prístroji AU4 Idea firmy Esaote Biomedica 2,5 MHz sondou z parasternálneho, ev. apikálneho prístupu. Morfometrické parametre zohľadnené v našej práci: ejekčná frakcia ľavej komory (ĽK), rozmery ľavej predsiene, ľavej a pravej komory, hrúbka interventrikulárneho septa a zadnej steny ĽK na konci diastoly.
Každý jedinec absolvoval celonočné polysomnografické vyšetrenie, ktoré bolo realizované polysomnografom Alice 3 (firmy Healthdyne, Brussel), ktorý umožňuje registrovať > 20 parametrov. Parametre a indexy používané v našej práci: apnoicko-hypopnoický index (AHI) - počet apnoicko-hypopnoických epizód za l hod spánku, minimálna a priemerná saturácia hemoglobínu kyslíkom, priemerná saturácia po desaturáciach väčších ako 4 % a index zobúdzacej reakcie.
Na vyšetrenie extrakraniálneho úseku karotického riečiska sme použili vysokorozlišovací ultrazvuk AU4 Idea firmy Esaote Biomedica, 7,5 MHz sondu. Vyšetrovali sme v B obraze, v reálnom čase, pri 5násobnom zväčšení. Vyšetrili sme extrakraniálny úsek a. carotis communis, interna, externa a a. vertebralis. Určovali sme stupeň AS lézií a IMT cievnej steny. IMT sme definovali súhlasne s literatúrou [20], z jedného definovaného segmentu zadnej steny a. carotis communis (ACC) 2 cm od rozdeľovača toku, v mieste jej predpokladanej maximálnej hrúbky. Vykonali sme 2 merania vpravo i vľavo, u každého celkom 4 merania. Stupeň stenózy bol určený z priečneho obrazu a podľa maximálnej prietokovej rýchlosti dopplerovského signálu [21]. Testovaná reproducibilita vyšetrenia (intraobservačná variabilita s priemerom absolútnych rozdielov meraní 0,085 mm) bola porovnateľná s literatúrou. Vybrané parametre používané v našej práci: maximálna hodnota IMT (IMTmax) v mm, prítomnosť AS plátov, ev. stenóz.
Vzorky krvi a moču boli analyzované na biochemickom oddelení. Parametre používané v našej práci (glykémia, celkový, LDL - a HDL-cholesterol, triacylglyceroly, kyselina močová a mikroalbuminúria) boli priamo stanovené štandardnými laboratórnymi testmi.
Údaje boli spracované štatistickým programom STATISTICA 1999. Kontinuálne parametre boli udávané ako priemer ± štandardná deviácia, alternatívne údaje sme udávali v % výskytu. Na testovanie rovnosti stredných hodnôt jednotlivých parametrov sme použili neparametrický Mannovho-Whitneyho test. Za signifikantnú hladinu významnosti sme považovali hodnotu p < 0,05. Na porovnanie alternatívnych údajov sme použili χ2, Fisherov exaktný t-test, resp. korekciu χ2 testu podľa Yatesa.
Výsledky
Základnú charakteristiku jednotlivých podskupín uvádzame v tab. 1a. Výskyt rizikových faktorov AS v jednotlivých podskupinách s/bez OSAHS ukazuje tab. 1b. Hemodynamické parametre (ECHOKG, ABPM), prognostické ukazovatele (mikroalbuminúria) a markery AS v podskupinách s/bez OSAHS hodnotíme v tab. 2.
Tab. 1a. Základná charakteristika jedincov s/bez OSAHS v podskupinách klinicky, resp. kardiovaskulárne zdravých, hypertonikov a chorých s ischemickou chorobou srdca. 
Tab. 1b. Výskyt rizikových faktorov AS v podskupinách kardiovaskulárne zdravých, hypertonikov a chorých s ischemickou chorobou srdca. 
Table 1. Hemodynamické parametre, prognostické ukazovatele, markery aterosklerózy u jedincov s/bez OSAHS v podskupinách kardiovaskulárne zdravých, hypertonikov a chorých s ischemickou chorobou srdca. 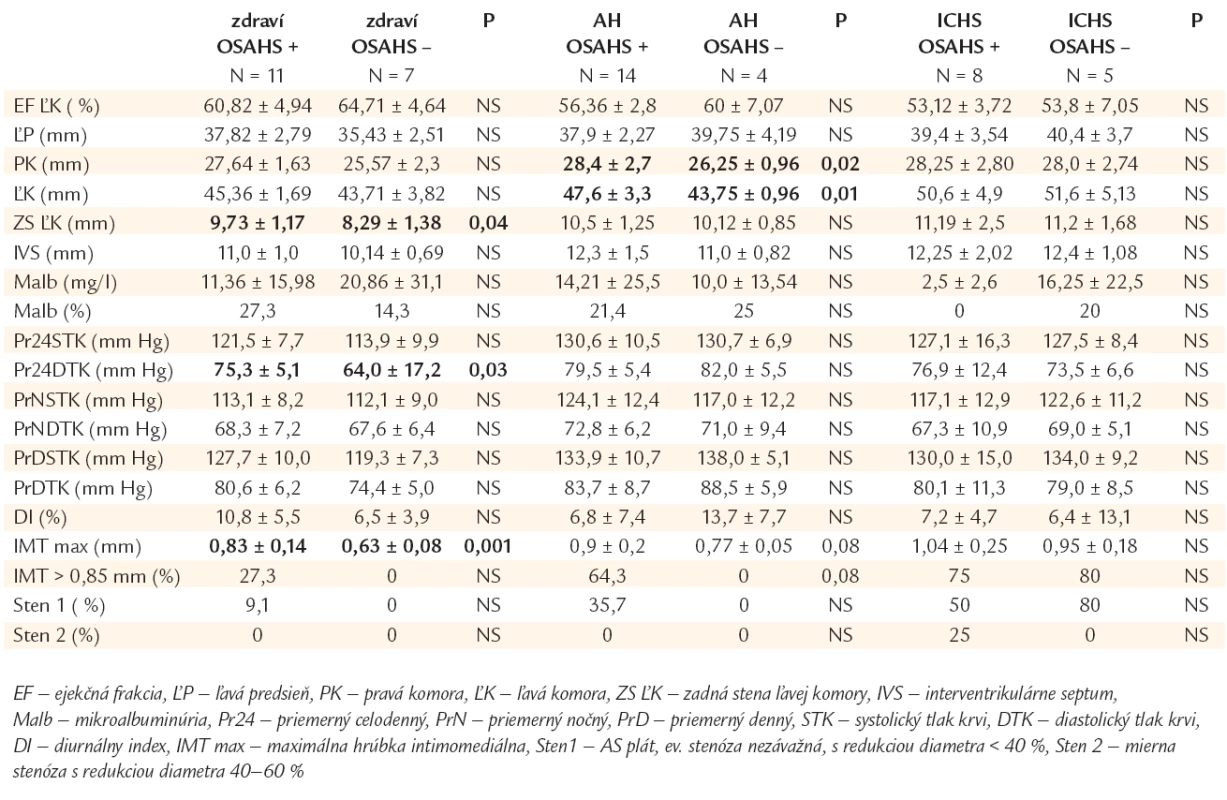
Z kardiovaskulárneho hľadiska klinicky zdraví jedinci s OSAHS mali porovnateľný rizikový profil so zdravými bez OSAHS, líšili sa od nich štatisticky významne menším počtom bývalých fajčiarov (0 vs 42,9 %, p < 0,05). Obe podskupiny sa navzájom nelíšili ani kontrolou metabolických rizikových faktorov. Priemerné hodnoty krvného tlaku boli porovnateľné a v referenčných medziach v oboch podskupinách, s vyššími hodnotami u jedincov s OSAHS (signifikantne bol vyšší len priemerný celodenný diastolický TK). OSAHS jedinci mali signifikantne hrubšiu zadnú stenu ĽK, väčšie rozmery ľavej predsiene, interventrikulárneho septa i oboch komôr a nižšiu ejekčnú frakciu ĽK. Nelíšili sa navzájom mierou mikroalbuminúrie. Markery predklinickej AS (IMTmax signifikantne, IMT > 0,85 mm) ako i pokročilej AS (výskyt AS plátov, stenóz) boli výraznejšie v OSAHS podskupine. Štatisticky významné rozdiely v niektorých respiračných parametroch boli charakteristické pre OSAHS (priemerná saturácia po desaturáciach > 4 %: 87,3 ± 2,95 vs 92,0 ± 2,65 %, p < 0,05, minimálna saturácia oxyhemoglobínu - minSaO2: 79,1 ± 8,5 vs 91,0 ± 2,5 %, p < 0,005, AHI: 20,4 ± 8,7 vs 2,4 ± 0,97/h, p < 0,0005).
Hypertonici s OSAHS sa signifikantne nelíšili rizikovým profilom od hypertonikov bez OSAHS. Metabolické rizikové faktory boli porovnateľne kontrolované v oboch podskupinách. Cieľové hodnoty krvného tlaku boli dosiahnuté u l/3 chorých s OSAHS (vrátane polovice diabetikov) a u 1/4 chorých bez OSAHS (l zaradený diabetik nedosiahol optimálne hodnoty). Pacienti boli liečení prevažne monoterapiou (60 % s OSAHS vs 50 % bez OSAHS). Dvoj-, resp. trojkombináciou antihypertenzív bolo liečených 30 %, resp. 7 % hypertonikov s OSAHS vs 25, resp. 25 % bez OSAHS. Jeden hypertonik s diabetom a OSAHS nedosiahol cieľové hodnoty krvného tlaku ani pri liečbe 5 hypotenzívami. Z podávaných antihypertenzív dominovali blokátory Ca kanálov, inhibítory ACE a betablokátory. ECHOKG dokumentovalo prevažne väčšie rozmery srdca u chorých s OSAHS (signifikantne rozmery pravej a ľavej komory). Obe podskupiny sa nelíšili výskytom mikroalbuminúrie. Skoré a neskoré prejavy AS boli závažnejšie u chorých s OSAHS. Signifikantné rozdiely v niektorých respiračných parametroch boli očakávané (minSaO2: 74,4 ± 10,6 vs 88,2 ± 3,3 %, p < 0,005, AHI: 28,4 ± 17,5 vs 4,0 ± 2,5/h, p < 0,001, index zobúdzacej reakcie: 28,5 ± 15,7, vs 6,1 ± 0,7/h).
Aj skupiny s ICHS mali porovnateľný rizikový profil. Distribúcia orgánových komplikácií AS bola rovnomerná. Hypertenzia bola u 50 % chorých s OSAHS a 40 % chorých jedincov bez OSAHS (vrátane l z dvoch diabetikov) optimálne kontrolovaná. U chorých s OSAHS bolo 50 % chorých na monoterapii, takmer 40 % si vyžadovalo dvoj-, resp. troj-, 10 % až štvorkombináciu antihypertenzív. U chorých bez OSAHS rovnaký pomer pacientov bolo liečených jedným, resp. dvomi antihypertenzívami, u 20 % bola potrebná štvorkombinácia. Z antihypertenzív dominovali betablokátory, inhibítory ACEI, blokátory Ca kanálov a diuretiká v oboch podskupinách. Obaja diabetici bez OSAHS boli na nízkych dávkach orálnych antidiabetík dlhodobo optimálne metabolicky kompenzovaní s aktuálnymi glykémiami nalačno 3,6, resp. 5,8 mmol/l. V ECHOKG parametroch, ani v hladinách mikroalbuminúrie sme podstatné rozdiely nenašli medzi skupinami. Hrúbka IMT a prejavy pokročilej AS boli výraznejšie u chorých s OSAHS (stredne závažné stenózy). V respiračných parametroch sa chorí s OSAHS oproti kontrole líšili významne len hodnotou AHI (32,2 ± 19,6 vs 6,1 ± 2,9/h).
Diskusia
Prejavy predklinickej, resp. pokročilej AS boli závažnejšie u chorých s OSAHS na každom stupni kardiovaskulárneho postihnutia. Najťažšie zmeny boli pozorované u chorých s ICHS, najvýraznejšie rozdiely oproti kontrole však boli nájdené medzi zdravými, kde výskyt rizikových faktorov bol najmenší. Pacienti s OSAHS mali také AS zmeny, aké pacienti bez OSAHS, ale so závažnejším kardiovaskulárnym postihnutím. Prítomnosť OSAHS naviac zhoršovala ejekčnú frakciu ĽK v každej podskupine a morfologické parametre srdca u zdravých a hypertonikov, nie však u chorých s ICHS. Mikroalbuminúria v našom súbore nekorešpondovala s kardiovaskulárnym postihnutím ani s prítomnosťou OSAHS. Podľa našich výsledkov prítomnosť OSAHS zhoršuje kardiovaskulárnu prognózu, a znamená pre pacienta približne také riziko, ako „o stupeň“ závažnejšie kardiovaskulárne postihnutie. Výsledky našich predchádzajúcich prác na väčšom súbore chorých dokumentovali nie len závažnejšiu AS, ale aj väčší výskyt a komplikovanejšie formy dysrytmií u chorých s OSAHS ako u kontrolnej skupiny bez OSAHS [22], pričom dysrytmie aj AS zmeny boli podobné pacientom bez OSAHS, ale so závažnejším kardiovaskulárnym postihnutím [22,23].
Rizikové faktory AS boli porovnateľne zastúpené u jedincov s/bez OSAHS na každom stupni kardiovaskulárneho postihnutia. U „klinicky zdravých“ OSAHS jedincov 4 rizikové faktory (z 9 sledovaných) mali nesignifikantne väčší výskyt (vek, HLP, obezita, resp. centrálna obezita, hyperurikémia). Vzhľadom k tomu, že v tejto skupine nikto nemal také závažné rizikové faktory ako AH a DM, a vplyv prítomných rizikových faktorov nehodnotíme ako silný (tab. 1a dokumentuje stredný vek, hraničnú až ľahkú HLP - novozistenú, nadváhu s hraničnou centrálnou obezitou, hraničnú hyperurikémiu), nie je možné vylúčiť vplyv komplexného pôsobenia spánkového apnoe na karotickú AS, v prejavoch ktorej sa najvýraznejšie líšili OSAHS jedinci oproti kontrole práve v tejto skupine. Nie len stupňom AS, ale aj hodnotou ejekčnej frakcie ĽK a morfológiou srdca sa „klinicky zdraví“ OSAHS jedinci priblížili hypertonikom bez OSAHS. U OSAHS hypertonikov len 2 neovplyvniteľné rizikové faktory (vek, pozitívna rodinná anamnéza) sa vyskytovali častejšie oproti hypertonikom bez OSAHS. Napriek horšiemu rizikovému profilu hypertonikov bez OSAHS a porovnateľnej kontrole rizikových faktorov v oboch skupinách dokumentujeme opäť výraznejšie prejavy predklinickej AS u hypertonikov s OSAHS (ale tiež aj nižšiu ejekčnú frakciu ĽK a väčšie rozmery srdcových dutín), ktorými boli porovnateľní s chorými so závažnejšou kardiovaskulárnou patológiou - ICHS bez OSAHS. Je známy úzky vzájomný vzťah medzi IMT a rizikovými faktormi AS. Posledné roky viacerí autori referovali aj o korelácii medzi IMT a stupňom i trvaním hypoxémie [19,23-25], čo môže vysvetľovať nie len výrazné rozdiely vo výskyte patologických hodnôt IMT medzi hypertonikmi s/bez OSAHS v našej práci, ale aj nepriamo potvrdzovať význam OSAHS v patogenéze AS. Chorí s ICHS a OSAHS mali nevýznamne vyššiu prevalenciu AH, fajčenia, pozitívnej rodinnej anamnézy a hyperurikémie oproti kontrolnej skupine. Menej závažný rizikový profil u OSAHS chorých je spojený so závažnejšou AS aj u chorých s ICHS.
Apnoicko-hyperpnoické cykly s osciláciami vnútrohrudného tlaku spôsobujú výrazné výkyvy systémového a pľúcneho artériového tlaku, čo znamená objemovú a tlakovú záťaž pre pracujúci myokard a následne jeho štrukturálne zmeny. Vyhodnotením echokardiografických parametrov sme identifikovali určité zmeny, ktoré môžu byť v asociácii s OSAHS: pokles systolickej funkcie ĽK, dilatácia srdcových dutín a hypertrofia myokardu ĽK. Uvedené funkčné a štrukturálne zmeny boli najvýraznejšie u „klinicky zdravých“ a hypertonikov. Aditívny účinok OSAHS na remodeláciu myokardu bol v našej práci menej zreteľný u chorých s ICHS. Súvisí to zrejme s rozsahom už vytvorených zmien, ktoré pôsobenie OSAHS už výraznejšie nemenilo.
Na každom stupni kardiovaskulárneho postihnutia potvrdzujeme nesignifikantne horší lipidový profil u osôb s OSAHS. Môže to súvisieť s nadváhou, ale aj s nočnou hypoxémiou a chronickou sympatikovou aktiváciou. Hypercholesterolémia izolovaná alebo v kombinácii s inými DLP tvorila 50 % všetkých DLP u oboch skupín zdravých jedincov. V skupinách hypertonikov tento podiel bol 40 % u OSAHS, resp. 0 % u bez OSAHS chorých, v skupine chorých s ICHS 14,3 % u OSAHS, resp. 20 % u chorých bez OSAHS. Dôslednejšia kontrola cieľových hodnôt lipidov v ICHS skupine bez OSAHS sa prejavila nižšou priemernou hodnotou celkového cholesterolu oproti chorým bez OSAHS.
V našom súbore všetkých osôb s OSAHS bola len mužská populácia, s priemerným vekom 54,2 ± 9,4 rokov, BMI 28,91 ± 4,4 kg/m2 a obvodom pása 101,8 ± 9,96 cm. 84,85 % jedincov bolo rizikového veku, HLP sa vyskytovala v 54,5 %, DM v 6,1 %, AH v 63,6 %, fajčenie (fajčiari + bývalí fajčiari) v 57,6 %, obezita v 27,3 % (BMI), centrálna obezita v 42,4 %, pozitívna rodinná anamnéza v 21,2 % a hyperurikémia v 24,2 %. Nepotvrdili sme signifikantný rozdiel v hladinách glykémie, celkového, LDL-, HDL-cholesterolu, triacylglycerolov a kyseliny močovej, ani v prevalencii nami sledovaných rizikových faktorov u všetkých osôb s OSAHS oproti všetkým osobám bez OSAHS.
Mužské pohlavie a obezita sú takmer pravidlom u chorých s OSAHS. Pre vysokú prevalenciu OSAHS u mužov (15 % vo veku 30-60 rokov) [26] v štúdiách porovnávajúcich kardiovaskulárnu morbiditu a mortalitu chorých s OSAHS bez korelačných analýz je zvykom vykonať triedenie kontrolného súboru podľa pohlavia. My sme z týchto dôvodov zaraďovali len mužov.
Iba zhruba 30 % ľudí s OSAHS nie je obéznych [27], preto väčšina publikovaných prác nehodnotí výskyt obezity. Vzhľadom na vyšší výskyt obezity aj asociovaná dyslipoproteinémia je u chorých s OSAHS častejšia. Podľa „Copenhagen Male Study“ je známe, že obezita, fajčenie a konzumácia alkoholu sú spojené s 20-30 % vyšším rizikom vzniku chrápania.
V literatúre je výskyt hypertenzie u OSAHS udávaný rôzne (presný výskyt nie je známy pre vysoké % nediagnostikovaných prípadov OSAHS v populácii) [1]. Hypertenzia sa vyskytuje u 50-80 % chorých s OSAHS (28). V „Sleep Heart Health Study“ (2 840 jedincov) prevalencia hypertenzie sa zvyšovala s AHI (u AHI = 15-30, resp. AHI > 30 bola prevalencia hypertenzie 46 %, resp. 59 %) [5,6].
Podľa niektorých autorov prevalencia DM je 35 % u chorých s OSAHS [1]. Iné literárne zdroje udávajú iný výskyt diabetu. Na základe hodnotenia prevalencie 2. typu DM u 1 387 pacientov s OSAHS v štúdii Wisconsin Sleep Cohort Reichmuth uvádza 14,7 % výskyt diabetu u jedincov s AHI ≥ 5 a 2,8 % u jedincov s AHI < 5 [29]. Friedlander referuje o trojnásobne vyššej pravdepodobnosti súčasného ochorenia na diabetes mellitus [30].
Prevalencia fajčenia u chorých s OSAHS je 35 %, bez OSAHS len 18 % [31]. Poľskí autori u 260 obéznych mužov s ťažkým stupňom OSAHS (BMI = 33,1 ± 6,2 kg/m2, vek 51,5 ± 9,9 rokov, AHI = 44 ± 24, priemerná nočná saturácia oxyhemoglobínu SaO2 = 89,2 ± 5,4 %) našli v 56,2 % hyperurikémiu [32]. Výskyt ostatných tradičných rizikových faktorov je porovnateľný s bežnou populáciou.
Koehler na malom súbore, kde hodnotil (na rozdiel od nás) najťažšie formy SAHS (AHI 75,5/hod) zistil závažnejší rizikový profil (priemerná BMI 36,8 kg/m2, výskyt AH 8l,3%, HLP a hyperurikémie 56,3 %) [33]. Laaban medzi chorými s ťažkou obezitou (BMI > 40 kg/m2) a OSAHS našiel signifikantne väčšiu hrúbku interventrikulárneho septa, pľúcnu hypertenziu a dennú hypoxémiu, nenašiel však štatisticky významný rozdiel oproti tým, ktorí nemali SAHS (podobne aj my) v tradičných rizikových faktoroch: BMI, veku, fajčení, výskyte DM, AH (nehodnotil HLP), ale ani v ICHS a infarkte myokardu (34). Ip pri hodnotení vaskulárnych rizikových faktorov u chorých s OSAHS našiel na rozdiel od nás signifikantne vyššiu hladinu triacylglycerolov [35], nie však signifikantné rozdiely v hladine glykémie, celkového, HDL - a LDL-cholesterolu (podobne nám) oproti chorým bez OSAHS. Lavie súhlasne s nami nenašiel signifikantný rozdiel u zdravých/s ICHS so SAHS oproti zdravým/s ICHS bez SAHS vo veku, BMI, hladine celkového, HDL-, LDL-cholesterolu, triacylglycerolov a DM [36].
Úloha spánkového apnoe v procese aterogenézy môže byť väčšia, ako sa doposiaľ myslelo [19,23-25]. Kľúčovým mechanizmom v patogenéze AS u chorých s OSAHS je chronická intermitentná hypoxémia a sympatiková hyperaktivita s následnou endotelovou dysfunkciou, aktiváciou vazokonstrikčných, proagregačných, prozápalových faktorov a stimuláciou neoangiogenézy s remodelovaním ciev. Počas hypoxémie je metabolizmus bunky orientovaný na anaeróbnu glykolýzu. Intracelulárne klesá pH, zvyšuje sa transmembránový potenciál, elektróny sa ľahšie uvoľňujú z molekúl, vznikajú veľmi reaktívne intermediáty [37]. Tvorba kyslíkových radikálov významne narastá počas reoxygenácie. Nerovnováha medzi tvorbou voľných radikálov a antioxidačnou ochranou vedie k oxidačnému poškodeniu [38]. Aj keď názory sa rôznia, vo všeobecnosti sa dá predpokladať, že pri SAS reoxygenácia spôsobuje oxidačný stres najmä znížením aktivity antioxidačných mechanizmov v bunke, menej nadprodukciou voľných radikálov. Sledovanie na malom počte pacientov nepreukázalo rozdiely v hladinách nitrotyrozínu (marker oxidačného, resp. nitrozového stresu spôsobeného NO) medzi pacientmi so SAS a kontrolnou skupinou [39]. Ani iné markery oxidačného stresu neboli u pacientov so SAS zvýšené pred ani po spánku bez nCPAP [39]. Pacienti s ťažkým SAS mali výrazne nižšiu antioxidačnú kapacitu oproti zdravej kontrole [40]. Oxidačný stres je úzko spojený s kabonylovým stresom [41]. Doteraz karbonylový stres vo vzťahu k SAS podľa nám dostupných informácií nebol sledovaný.
Mimoriadny význam v patogenéze AS má poškodenie cievneho endotelu. Dysfunkčný endotel sa vyznačuje poruchou relaxácie závislej od NO a vytvára podmienky pre iniciáciu AS procesu [38]. Markery endotelovej dysfunkcie boli detekované aj u chorých s OSAHS, a to vyšetrením poruchy vazodilatácie závislej od endotelu [42]. U chorých s epizódami OSA hladiny cievneho endotelového rastového faktora (VEGF) odzrkadľujú mieru kyslíkovej desaturácie, zvyšujú sa v noci počas spánku v porovnaní s kontrolným súborom a klesajú po liečbe nCPAP [43]. Intracelulárna adhezívna molekula-l, cievna adhezívna molekula-l, E-selektín, adhezívne molekuly monocytov CD15 a CD11 boli takisto zvýšené u chorých s OSAHS, s tendenciou poklesu po liečbe nCPAP [44-46]. U pacientov s OSAHS boli nájdené aj vyššie plazmatické hladiny C-reaktívneho proteínu (CRP), interleukínu (IL)-6, IL-8 a faktora nekrotizujúceho nádory α (TNFα), po nCPAP hladiny CRP a IL-6 sa znížili [47-49].
Obštrukcia horných dýchacích ciest s následnou hypoxémiou (ev. hyperkapniou, acidózou) a zmenami intratorakálneho tlaku naštartuje celý rad reflexných mechanizmov, výsledkom ktorých je prebudenie sa zo spánku, hyperventilácia a aktivácia sympatikového nervového systému. Počas apnoických epizód dochádza k prudkým zmenám systémovej a cerebrálnej hemodynamiky [1,9]. Počas hypoxémie a apnoe sa zvyšuje hladina katecholamínov, vrchol dosahuje na konci apnoe v súvislosti so zobudením s následným zvýšením systémovej vaskulárnej rezistencie, zvýšením systémového a pľúcneho artériového tlaku. Chorí s OSAS majú zvýšené celodenné vylučovanie katecholamínov močom a zvýšenú hladinu endotelínu-l, čo tracheostómia či liečba pomocou nCPAP znížili [5].
Záver
Chorí s OSAHS majú horšiu kardiovaskulárnu morbiditu a mortalitu ako jedinci bez OSAHS. V našej prierezovej štúdii dokumentujeme závažnejšiu AS a horšie echokardiografické parametre u chorých s OSAHS. Vzhľadom na porovnateľný rizikový profil a ich optimálnu kontrolu v oboch skupinách je možné uvažovať o OSAHS ako o samostatnom kardiovaskulárnom rizikovom faktore. Toto tvrdenie je však nutné si overiť na veľkých súboroch chorých, so zaradením ženskej populácie ako i chorých s najťažšími stupňami OSAHS. Len prospektívna štúdia môže ukázať, či kauzálna liečba OSAHS (pomocou nCPAP) môže zlepšiť kardiovaskulárnu morbiditu ev. mortalitu u týchto chorých. Do získania presvedčivých dôkazov OSAHS ostáva zatiaľ významným aditívnym kardiovaskulárnym rizikovým faktorom.
MUDr. Eva Szabóová, Ph.D.
www.upjs.sk
e-mail: angiolog@ipower.sk
Doručeno do redakce: 6. 9. 2006
Přijato po recenzi: 11. 2. 2008
Sources
1. Tomori Z, Redhammer R, Donič V et al. Základy spánkovej medicíny. Košice: Vojenská letecká akadémia 1999.
2. Young T, Palta M, Dempsey J et al. The occurence of sleep-disordered breathing among middle-aged adults. N Engl J Med 1993; 328 : 1230-1235.
3. American Sleep Disorders Association (ASDA) Report. Sleep-related breathing disorders in adults: recommendations for syndrome definition and measurement techniques in clinical research. Sleep 1999; 22 : 667-689.
4. Parish JM, Somers VK. Obstructive sleep apnea and cardiovascular disease. Mayo Clin Proc 2004; 79 : 1036-1046.
5. Young T, Peppard PE. Epidemiological evidence for an association of sleep disordered breathing with hypertension and cardiovascular disease. In: Bradley TD, Floras JS. Sleep apnea. Implications in cardiovascular and cerebrovascular disease. New York: Marcel Dekker 2000 : 261-283.
6. Shahar E, Whitney CW, Redline S et al. Sleep-disordered breathing and cardiovascular disease: cross-sectional results of the Sleep Heart Health Study. Amer J Respir Crit Care Med 2001; 163 : 19-25.
7. Dean RT, Wilcox I. Possible heterogenic effects of hypoxia during obstructive sleep apnea. Sleep 1993; 16: S15-S22.
8. Grunstein RR. Metabolic aspects of sleep apnea: does sleep apnea promote obesity? Sleep 1996; 19(10 Suppl): S218-220.
9. Szabóová E, Tomori Z, Gonsorčík J et al. Kardiovaskulárne následky obštrukčného typu spánkové apnoe. Cardiol 1999; 8 : 27-34.
10. Silvestrini M, Rizzato B, Placidi F et al. Carotid artery wall thickness in patients with obstructive sleep apnoea syndrome. Stroke 2002; 33 : 1782-1785.
11. ATP III Update 2004. Implications of Recent Clinical Trials for the National Cholesterol Education Program (NCEP). Adult Treatment Panel III Guidelines. Circulation 2004; 110 : 227-239.
12. Kollár J. Rukoväť porúch lipidového metabolizmu. Košice: UPJŠ Košice 1997.
13. Suzuki T, Nakano H, Maekawa J et al. Obstructive sleep apnea and carotid-artery intima-media thickness. Sleep 2004; 27 : 129-133.
14. American Diabetes Association. Clinical practice recommendations 2005. Diagnosis and Classification of Diabetes mellitus. Diabetes Care 2005; 28 : 37-42.
15. Cífková R, Horký K, Widimský J sr et al. Doporučení diagnostických a léčebných postupů u arteriální hypertenze - verze 2004. Doporučení České spoločnosti pro hypertenzi. Vnitř Lék 2004; 50 : 709-722.
16. European guidelines on cardiovascular disease prevention in clinical practice. 3rd Joint Task Force of European and other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur J Cardivoasc Prev Rehab 2003; 10(Suppl 1): 2-80.
17. 2007 Guidelines for the management of arterial hypertension. Eur Heart J 2007; 28 : 1462-1536.
18. Nakashima A, Yoriaka N, Asakimori Y et al. Different risk factors for the maximum and the mean carotid intima-media thickness in hemodialysis patients. Intern Med 2003; 42 : 1095-1099.
19. Schulz R, Seeger W, Fegbeutel C et al. Changes in exctracranial arteries in obstructive sleep apnoea. Eur Resp J 2005; 25 : 69-74.
20. Pignoli P, Tremoli E, Poli A et al. Intimal plus medial thickness of the arterial wall: as direct measurement with ultrasound imaging. Circulation 1986; 74 : 1399-1406.
21. Bluth EI, Stavros AT, Marich KW et al. Carotid duplex sonography: A multi-center recommendations with obstructive sleep apnoea syndrome. J Amer Dent Assoc 2000; 131 : 1178-1184.
22. Szabóová E, Gonsorčík J, Tomori Z et al. Ovplyvňuje syndróm spánkového apnoe závažnosť dysrytmií? VII. zjazd SKS s medzinárodnou účasťou 2002. 10.-12. 10. 2002, Košice. Cardiol 2002; 11(Suppl 2): 22S.
23. Szabóová E, Tomori Z, Donič V et al. Sleep apnoea inducing hypoxemia is associated with early signs of carotid atherosclerosis in males. Resp Physiol Neurobiol 2007; 155 : 121-127.
24. Drager LF, Bortolotto LA, Lorenzi MC et al. Early signs of atherosclerosis in obstructive sleep apnoea. Amer J Respir Crit Care Med 2005; 172 : 613-618.
25. Baguet JP, Hammer L, Lévy P et al. The severity of oxygen desaturation is predictive of carotid wall thickening and plaque occurence. Chest 2005; 128 : 3407-3412.
26. Kiely JL, McNicholas WT. Cardiovascular risk factors in patients with obstructive sleep apnoe syndrome. Eur Resp J 2000; 16 : 128-133.
27. Bradley TD, Phillipson EA. Pathogeneseis and pathophysiology of the obstructive sleep apnea syndrome. Med Clin North Amer 1985; 69 : 1169-1185.
28. Hla KM, Young TB, Bidwell T at al. Sleep apnea and hypertension. A population based study. Ann Intern Med 1994; 120 : 382-388.
29. Reichmuth KJ, Austin D, Skatrud JB et al. Association of sleep apnea and type II diabetes. A population-based study. Amer J Respir Crit Care Med 2005; 172 : 1590-1595.
30. Friedlander A. Sleep apnea linked to increased diabetes risk. J Oral Maxillofacial Surg 1999; 6 : 11-28.
31. Kashyap R, Hock LM, Bowman AJ. Higher prevalence of smoking in patient diag-nosed as having obstructive sleep apnea. Sleep breath 2001; 5 : 167-172.
32. Plywaczewski R, Bednarek M, Jonczak L et al. Hyperuricaemia in males with obstructive sleep apnoea. Pneumonol Alergol Pol 2005; 73 : 254-259.
33. Koehler U, Fus E, Grimm W et al. Heart block in patients with obstructive sleep apnoea: pathogenetic factors and effects of treatment. Eur Respir J 1998; 11 : 434 - 439.
34. Laaban JP, Cassuto DE, Orvoen-Frija E et al. Cardiorespiratory consequnces of sleep apnoea syndrome in patients with massive obesity. Eur Respir J 1998; 11 : 20-27.
35. Ip MS, Lam KS, Ho C et al. Serum leptin and vascular risk factors in obstructive sleep apnea. Chest 2000; 118 : 580-586.
36. Lavie L, Perelman A, Lavie P. Plasma homocysteine levels in obstructive sleep apnea: association with cardiovascular morbidity. Chest 2001; 120 : 900-908.
37. Stanley WC. Metabolic dysfunction in the diabetic heart. In: Stanley WC, Rydén L. The diabetic coronary patients. London: Science Press 1999 : 13-28.
38. Štvrtinová V, Ferenčík M, Hulín I et al. Cievny endotel ako operátor prenosu informácií medzi kardiovaskulárnym a imunitným systémom. Bratisl Lek Listy 1998; 99 : 5-19.
39. Svatikova A, Wolk R, Wang HH et al. Circulating free nitrotyrosine in obstructive sleep apnea. Amer J Physiol Regul Integr Comp Physiol 2004; 287: R284-R287.
40. Christou K, Moulas AN, Pastaka C et al. Antioxidant capacity therapy in obstructive sleep apnea patients. Sleep Med 2003; 4 : 225-228.
41. Ceriello A, Motz E. Is oxidative stress the pathogenic mechanism underlying insulin resistance, diabetes, and cardiovascular disease? The common Soil hypothesis revisited. Arterioscler Thromb Vasc Biol 2004; 24 : 816-823.
42. Kato M, Roberts-Thomson P, Philips BG et al. Impairment of endothelium-dependent vasodilatation of resistence vessels in patients with obstructive sleep apnea. Circulation 2000; 102 : 2607-2610.
43. Lavie L, Kraiczi H, Hefetz A et al. Plasma vascular endothelial growth in sleep apnea syndrome: effects of nasal continuous positive air pressure treatment. Amer J Respir Crit Care Med 2002; 165 : 1624-1628.
44. Chin K, Nakamura T, Shimizu K et al. Effects of nasal continuous positive airway pressure on soluble cell adhesion molecules in patients with obstructive sleep apnea syndrome. Amer J Med. 2000; 109 : 562-567.
45. Dyugovskaya L, Lavie P, Lavie L. Increased adhesion molecules expression and production of reactive oxygen species in leukocytes of sleep apnea syndrome. Amer J Respir Crit Care Med 2002; 165 : 934-939.
46. Wieber SJ. The cardiac consequences of the obstructive sleep apnea-hypopnea syndrome. Mt Sinai J Med 2005; 72 : 10-12.
47. Alzoghaibi MA, Bahammam AS. Lipid peroxides, superoxid dismutase and circulating IL-8 and GCP-2 in patients with severe obstructive sleep apnea: a pilot study. Sleep Breath 2005; 9 : 119-126.
48. Yokoe T, Minoguchi K, Matsuo H et al. Elevated levels of C-reactive protein and interleukin-6 in patients with obstructive sleep apnea syndrome are decreased by nasal continuous positive airway pressure. Circulation 2003; 107 : 1129-1134.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 4-
All articles in this issue
- Perikardiocentéza po kardiologické operaci – naše zkušenosti
- Vyšší výskyt tyreopatií u achalázie jícnu. Genetická, autoimunitní, regionální či jen náhodná souvislost?
- Možnosti posouzení změn glomerulární filtrace na podkladě predikčních formulí
- Tradičné rizikové faktory aterosklerózy u pacientov so syndrómom obštrukčného spánkového apnoe-hypopnoe
- Výsledky projektu PREDICTIVE v České republice
- Patogeneze inzulinové rezistence u vybraných endokrinopatií
- Exenatid a jeho místo v léčbě diabetes mellitus 2. typu
- Hypoglykémia
- Význam stanovení viability myokardu před revaskularizací u pacientů s ischemickou kardiomyopatií a systolickou dysfunkcí levé komory srdeční
- Lidské leukocytární antigeny z hlediska CD klasifikace
- EKG zmeny pri akútnej intoxikácii alkoholom
- Příprava nemocných s poruchou hemostázy ke stomatochirurgickým výkonům
- Lymeská karditida – vzácná příčina dilatační kardiomyopatie a poruch srdečního rytmu: kazuistika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perikardiocentéza po kardiologické operaci – naše zkušenosti
- Lymeská karditida – vzácná příčina dilatační kardiomyopatie a poruch srdečního rytmu: kazuistika
- EKG zmeny pri akútnej intoxikácii alkoholom
- Lidské leukocytární antigeny z hlediska CD klasifikace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

