-
Medical journals
- Career
Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
: V. Štvrtinová 1; V. Šefránek 2; J. Murín 3; A. Dukát 4; J. Tomka 2; I. Vulev 5; O. Bzdúchová 1; A. Džupina 1; J. Bilický 5
: Slovenská angiologická spoločnosť Slovenskej lekárskej spoločnosti, predsedkyňa prof. MUDr. Viera Štvrtinová, CSc. 1; Slovenská spoločnosť pre cievnu chirurgiu Slovenskej lekárskej spoločnosti, predseda prof. MUDr. Vladimír Šefránek, CSc. 2; Slovenská kardiologická spoločnosť Slovenskej lekárskej spoločnosti, predseda prof. MUDr. Ján Murín, CSc. 3; Slovenská internistická spoločnosť Slovenskej lekárskej spoločnosti, predseda prof. MUDr. Andrej Dukát, CSc. 4; Slovenská radiologická spoločnosť Slovenskej lekárskej spoločnosti, predseda prof. MUDr. Jozef Bilický, CSc. 5
: Vnitř Lék 2008; 54(2): 195-202
: Guidelines
V práci sa uvádzajú diagnostické a terapeutické postupy periférneho artériového ochorenia končatín, odporúčané piatimi odbornými spoločnosťami Slovenskej lekárskej spoločnosti (Slovenskou angiologickou spoločnosťou, Slovenskou spoločnosťou pre cievnu chirurgiu, Slovenskou kardiologickou spoločnosťou, Slovenskou internistickou spoločnosťou a Slovenskou rádiologickou spoločnosťou). Periférne artériové ochorenie (PAO) končatín je dôležitým prejavom systémovej aterosklerózy. Čím nižší je členkovo-brachiálny tlakový index, tým väčšie je riziko vzniku závažných kardiovaskulárnych príhod (napr. infarktu myokardu alebo cievnej mozgovej príhody). Napriek tomu, pacienti s PAO nie sú dostatočne liečení ani antidoštičkovými látkami ani hypolipidemiky v porovnaní s pacientmi s koronárnou chorobou srdca.
Kľúčové slová:
periférne artériové ochorenie končatín - diagnostika - liečbaDefinícia
V ostatných rokoch sa vo svetovom písomníctve pre ochorenia periférnych končatinových tepien končiace ischémiou začal používať názov peripheral arterial disease (PAD) - periférne artériové ochorenie končatín (PAO). Termín PAO však nezahrňuje len ochorenia končatinových artérií, ale aj ochorenia iných tepnových riečísk, s výnimkou koronárnych artérií. V týchto odporúčaniach sa sústredíme na PAO dolných končatín.
PAO končatín, najčastejšie spôsobené aterosklerózou, nielen znižuje kvalitu života ochorením zasiahnutého jedinca (často vedie k amputácii končatiny), ale vzhľadom na skutočnosť, že ateroskleróza je globálnym či systémovým ochorením, prítomnosť PAO zvyšuje riziko vzniku infarktu myokardu, cievnej mozgovej príhody a smrti. PAO končatinových artérií predstavuje teda tú „vaskulárnu časť“ kardiovaskulárnych ochorení. Nezriedka majú pacienti zároveň zasiahnuté 2 či 3 cievne riečiská (obr. 1), ako ukázala štúdia CAPRIE na vzorke takmer 20 000 osôb [1], či prospektívna štúdia 1 886 pacientov starších ako 62 rokov [2]. Časté je najmä súčasné postihnutie koronárnych a končatinových tepien.
1. Manifestácie aterotrombózy sú zvyčajne prítomné vo viac ako jednom arteriálnom riečisku u jednotlivého pacienta*. 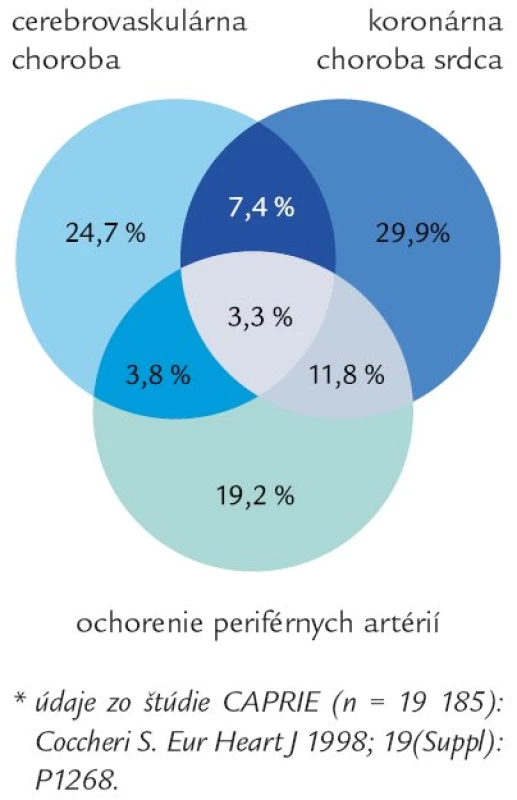
Výskyt
Periférne artériové ochorenie končatinových tepien sa vyskytuje asi u 5-10 % populácie staršej ako 60 rokov, pričom jej výskyt je rozdielny v jednotlivých epidemiologických štúdiách v závislosti od toho, akými diagnostickými metódami sa výskyt PAO určoval - či len na základe anamnestických údajov alebo pomocou prístrojových vyšetrovacích metód. V hospitalizačnej štúdii 990 pacientov liečených z rôznych príčin na internom oddelení sa zistilo, že anamnesticky 6 % pacientov trpelo na PAO, ale meranie členkovo-brachiálneho tlakového indexu odhalilo, že až 43,7 % pacientov malo tento index nižší ako 0,9 [3]. V nemeckej epidemiologickej štúdii vykonanej na vzorke 6 880 pacientov (priemerného veku 72,5 roka), kde praktickí lekári merali členkovo-brachiálny tlakový index (ABI) u všetkých pacientov starších ako 65 rokov, sa zistila prevalencia PAO (ABI menej ako 0,9) u 19,8 % mužov a 16,8 % žien [4].
Epidemiologické údaje o výskyte PAO na Slovensku či v Čechách nie sú k dispozícii, a ak boli nejaké publikované, tak len na veľmi malých súboroch pacientov. O výskyte kritickej končatinovej ischémie (KKI) - najzávažnejšej formy PAO - spoľahlivé epidemiologické údaje taktiež chýbajú, ale predpokladá sa, že sa vyvinie asi u 10 % pacientov s claudicatio intermitens [5]. Odhaduje sa, že incidencia KKI je asi 500-1 000 nových prípadov na 1 milión obyvateľov, teda na Slovensku ročne vznikne asi 2 500-5 000 nových prípadov KKI, pričom 3/4 z nich je možné intenzívnou liečbou zachrániť pred amputáciou. Je však vysoko pravdepodobné, že skutočný výskyt KKI je podstatne vyšší [6]. V priebehu 6 mesiacov od vzniku KKI umiera 20 % pacientov, amputáciu podstúpi 35 % pacientov, za 2 roky od vzniku KKI je plne mobilných len 40 % pacientov [7].
Etiológia
Ischémia je výsledkom prechodnej alebo stálej disproporcie medzi reálnou kyslíkovou potrebou daného tkaniva a skutočnou dodávkou krvi cez príslušné artérie do myokardu, mozgu, obličky či končatín. Nedostatočná dodávka krvi k príslušným tkanivám môže mať rôzne príčiny. V industrializovaných krajinách je príčinou vzniku ischémie dolných končatín najčastejšie ateroskleróza (viac ako v 90 %), ale je potrebné si uvedomiť, že existuje celá škála rôznych chorobných procesov, ktoré môžu v konečnom dôsledku vyústiť do tkanivovej ischémie (tab. 1). Kým ischemická choroba DK je väčšinou následkom obliterujúcej aterosklerózy, ischemická choroba horných končatín (ICHHK) je spôsobená aterosklerózou len výnimočne. Dôsledné určenie príčiny ischémie končatín je základnou podmienkou úspešnej liečby pacienta.
1. Etiologická klasifikácia chronického PAO. 
Klasifikácia
Ischemickú chorobu končatín rozdeľujeme na akútnu formu (akútna končatinová ischémia) a chronickú formu. Pod pojmom periférne artériové ochorenie sa rozumie chronická forma ochorenia.
Periférne artériové ochorenie končatinových tepien má široké spektrum príčin vedúcich v konečnom dôsledku k obmedzeniu chôdze (v prípade postihnutia DK) či k zníženiu funkčnosti horných končatín, a tak spôsobuje postupnú invalidizáciu pacienta. I keď funkčnú klasifikáciu PAO vytvoril René Fontaine už pred polstoročím, dodnes je celosvetovo akceptovaná, i keď prešla drobnými úpravami či doplneniami [7,8] (tab. 2).
2. Funkčná klasifikácia PAO podľa Fontainea (upravená). 
Klinický obraz
Prvé, bezpríznakové štádium, býva diagnostikované väčšinou náhodne. Pri fyzikálnom vyšetrení môžeme nájsť šelest nad tepnami, prípadne oslabené pulzácie. Niektorí pacienti sa sťažujú na pocit chladu alebo pocit mravenčenia v prstoch či chodidle, ktoré najmä v prípade, ak je len na jednej končatine, budí podozrenie na možnú organicky podmienenú ischémiu.
Klaudikačná bolesť je vlastne ekvivalentom anginy pectoris v končatinách.
Klaudikačná bolesť je charakterizovaná typickou námahovou bolesťou, objavujúcou sa počas chôdze, ktorá prinúti pacienta spomaliť, krívať až zastaviť, pričom bolesť spontánne ustúpi po zastavení do niekoľko min (priemerne za 3-4 min) a pacient je schopný pokračovať ďalej v chôdzi. Pre klaudikačnú bolesť je typické, že sa objavuje vždy po prejdení toho istého či rovnakého úseku, i keď, najmä zo začiatku, môže byť táto vzdialenosť odlišná. Vznik bolesti môže byť postupný alebo náhly. Náhle skrátenie klaudikačnej vzdialenosti je väčšinou spôsobené trombózou ateroskleroticky zúženej tepny. Okrem progresie samotného ochorenia má na skrátenie klaudikačnej vzdialenosti vplyv aj rýchlosť chôdze, chlad a fajčenie. Ak je uzáver dobre kompenzovaný kolaterálnym obehom, môže vzniknutá bolesť prinútiť k spomaleniu chôdze, ale ak pacient pokračuje napriek bolesti, dôjde k postupnému otvoreniu kolaterál a bolesť môže ustúpiť. Je dôležité pamätať na skutočnosť, že bolesť pri intermitentnej klaudikácii vždy závisí od stupňa fyzickej námahy. Tak sa dá vysvetliť, že pacienti s degeneratívnymi ochoreniami kĺbov, pacienti po mozgovo-cievnych príhodách, či iných ochoreniach, nútiacich k obmedzeniu chôdze, môžu byť napriek závažnej stenóze končatinových tepien kompletne asymptomatickí vo vzťahu ku klaudikačnej bolesti a PAO sa prejaví až vznikom pokojovej bolesti.
Pokojová ischemická bolesť sa objavuje v horizontálnej polohe, začína obvykle v noci a väčšinou ustúpi pri zvesení končatiny z postele alebo po postavení sa, kedy v dôsledku zvýšenia hydrostatického tlaku dôjde k zvýšeniu prietoku a prekrvenia. Objavenie sa pokojovej bolesti je prognosticky nepriaznivým príznakom, nakoľko znamená, že bazálne končatinové prekrvenie je kriticky znížené. Vo väčšine prípadov ide o veľmi silnú, neznesiteľnú bolesť, ktorá reaguje len na silné ópiové analgetiká. Pri chronickom PAO je bolesť lokalizovaná v nohe, teda v prstoch, v chrbáte nohy či v stupaji, teda nikdy nepresahuje talokrurálny kĺb. Jedinou výnimkou je akútny tepnový uzáver, kedy sa bolesť môže šíriť z nohy na predkolenie i ďalej smerom proximálnym. Pokojová ischemická bolesť je typická pre III. a IV. štádium PAO.
V prípade diabetických pacientov s PAO býva často uvedený klinický obraz do veľkej miery modifikovaný súčasne prítomnou somatickou i autonómnou diabetickou polyneuropatiou, a to v dvoch smeroch. Po prvé, ťažká neuropatia môže spôsobiť, že pacienti nepociťujú klaudikačné ani pokojové bolesti, a to aj napriek závažnej až kritickej ischémii. Po druhé, samotná neuropatia môže spôsobovať niektoré príznaky podobné ischémii (napr. nočné bolesti nôh) aj pri priechodných artériách. Je však dôležité zdôrazniť, že tak ischemická, ako aj neuropatická končatina predstavujú dva extrémy, s ktorými sa u pacientov stretneme len zriedka, oveľa častejšie je prítomná kombinácia, teda „neuroischemická končatina“.
Diagnostika PAO
V diagnostike sa zameriavame nielen na potvrdenie či vylúčenie samotnej choroby, ale vždy sa snažíme určiť aj vyvolávajúcu príčinu, funkčné štádium ochorenia, ako aj jeho anatomickú lokalizáciu.
Klinická diagnostika PAO je založená na pozitívnej anamnéze klaudikačnej alebo pokojovej bolesti, na fyzikálnom vyšetrení končatín v zmysle oslabených či chýbajúcich pulzácií na periférii končatín (ADP a/alebo ATP), ako aj na prítomnosti šelestu nad a. femoralis či a. poplitea a na pozitívnom polohovom a námahovom teste [8,9] (tab. 3). Ak sú 2 z uvedených 3 vyšetrovacích metód pozitívne, ide s vysokou pravdepodobnosťou o ischémiu v oblasti dolných končatín.
3. Kritériá pre klinickú diagnostiku PAO. 
Medzi základné diagnostické metódy ochorenia patrí dôkladná anamnéza, fyzikálne vyšetrenie, funkčné polohové a námahové skúšky, meranie členkovo-brachiálneho tlakového indexu a laboratórne testy, zamerané na odhalenie etiológie ochorenia (tab. 4).
4. Základné diagnostické metódy PAO. 
Základnou diagnostickou vyšetrovacou metódou pri PAO je zmeranie systolického tlaku v oblasti členku Dopplerovým ultrazvukovým meračom. Posudzujeme nielen absolútne hodnoty tlaku na oboch DK, ale aj členkovo-ramenový tlakový index (ankle brachial pressure index - ABI), čo je pomer medzi systolickým tlakom nameraným na členku a na ramene a u zdravých jedincov je vyšší ako 1,0. I keď sa zdá, že ide o jednoduchú metodiku, napriek tomu sa zistili interindividuálne rozdiely, preto meranie ABI by mal robiť skúsený vyšetrujúci [10]. Zmena tlakového indexu o 0,1 a viac je spojená so zmenou klinického stavu jedinca. Z tohto dôvodu, ako aj kvôli interindividuálnym rozdielom u rôznych vyšetrujúcich, sa normálne hodnoty ABI udávajú nad 0,9 až 1,0, i keď zdraví ľudia majú tento index vždy vyšší ako 1,0 [11]. V klaudikačnom štádiu PAO je tento index obyčajne medzi 0,6-0,9, pri KKI býva 0,5 a menej. Ukázalo sa, že tlakový členkovo ramenový index je nepriamym ukazovateľom aterosklerotického postihnutia koronárneho, mozgového či renálneho riečišťa. Jeho hodnota je ukazovateľom prognózy pacienta. Hodnota ABI menej ako 0,5 je spojená so zvýšeným výskytom koronárnej choroby srdca. Prežívanie pacientov s ABI menej ako 0,3 je signifikantne kratšie ako pacientov s hodnotou členkovo-ramenového indexu 0,3-0,91 [7]. U každého človeka staršieho ako 70 rokov, alebo u fajčiara, diabetika, hypertonika, či pacienta s dyslipoproteinémiou, najmä staršieho ako 50 rokov, by sa mal skríningovo zmerať členkovo-brachiálny tlakový index [12-14] (tab. 5).
5. Skupiny osôb, ktorým by sa mal merať členkovobrachiálny index. 
Zmeranie ABI objektívne potvrdí alebo vylúči prítomnosť hemodymanicky závažného periférneho artériového ochorenia. Naviac nám umožní zhruba stanoviť závažnosť PAO, a pri segmentálnom meraní tlakov na končatine aj hrubú anatomickú lokalizáciu ochorenia. V prípade, že ABI je medzi 0,9 a 1,0, musíme vždy zmerať tlakový index ešte po záťaži. Podobne aj v prípade, že nameráme index vyšší ako 1,0, ale na základe anamnézy či fyzikálneho vyšetrenia máme podozrenie na PAO, zmeriame ABI aj po záťaži. Ako záťažový test môžeme použiť podrepy alebo výstupy na špičky alebo intenzívnu chôdzu (v prípade, že máme k dispozícii bežiaci pás, môžeme ho použiť a prípadne zmerať hneď klaudikačnú vzdialenosť). Pokles tlakového indexu po záťaži o 20 % je diagnostickým kritériom pre PAO [15]. Členkovo ramenový index meriame minútu po skončení záťaže. So stúpajúcou závažnosťou stenózy sa zvyšuje pokles tlakového indexu po cvičení ako aj doba jeho návratu k pôvodnej hodnote pred cvičením. U zdravých osôb sa ABI nemení, resp. môžeme pozorovať jeho mierny vzostup.
U diabetikov meranie distálneho tlaku často zlyháva kvôli mediokalcinóze. Tepna je rigidná, nie je ju možné komprimovať manžetou tlakomeru a hodnoty distálnych tlakov sú potom falošne vysoké (ABI býva viac ako 1,3). Mediokalcinózu si môžeme potvrdiť na natívnej bočnej RTG snímke predkolenia. Keďže mediokalcinóza sa na prstových tepnách vyskytuje len ojedinele, v takomto prípade môžeme zmerať prstový tlak (najčastejšie na palci), k čomu však je potrebná špeciálna prstová manžeta. Prstový tlak môžeme zmerať aj pletyzmograficky. Mala by sa urobiť aj duplexná sonografia, ktorá poskytne informácie o anatomickej lokalizácii i rozsahu tepnového poškodenia.
Špeciálne vyšetrovacie metódy môžeme rozdeliť na zobrazovacie a ostatné (tab. 6). Zobrazovacie diagnostické metódy delíme na neinvazívne a invazívne.
6. Špeciálne prístrojové vyšetrovacie metódy PAO. 
U klaudikujúcich pacientov je dôležité vyšetrenie na bežiacom páse (treadmill), ktoré umožňuje presne zmerať bezbolestnú vzdialenosť, ako aj maximálnu vzdialenosť, ktorú je pacient schopný prejsť. Bolesť pri chôdzi sa objavuje tým skôr, čím je stenotický proces závažnejší a čím menej je uzáver kompenzovaný kolaterálnym obehom. Vyšetrenie robíme na bežiacom páse za štandardných podmienok (sklon pásu od 0 do 15 stupňov a rýchlosť pásu od 2 do 6 km/hod) [16]. Na niektorých pracoviskách je zaužívané vyšetrenie robiť v modifikácii podľa Linharta - rýchlosť bežiaceho pásu 3,5 km/hod a sklon pásu 7 stupňov [9]. Vyšetrenie na treadmille je indikované nielen k spresneniu anamnestických údajov o dĺžke klaudikačnej vzdialenosti, ale predovšetkým opakovanými meraniami môžeme kontrolovať úspešnosť liečby či progresiu ochorenia. Vyšetrenie je samozrejme kontraindikované pri kritickej končatinovej ischémii. V prípade, že nemáme treadmill k dispozícii, slúži na objektivizáciu klaudikačnej vzdialenosti test chôdzou, kedy vyšetrovaný kráča napr. po zmeranej nemocničnej chodbe v rytme metronómu [17].
U pacientov v III. a IV. štádiu PAO Podľa Fontaineovej klasifikácie, ako aj u pacientov s veľmi krátkou klaudikačnou vzdialenosťou (št. IIc) je nevyhnutné vykonať angiografické vyšetrenie za účelom zistenia anatomickej lokalizácie ochorenia, ako aj výberu najvhodnejšej liečebnej metódy (endovaskulárnej či angiochirurgickej). Všetci pacienti s kritickou končatinovou ischémiou by mali mať aj kontinuálne dopplerovské vyšetrenie segmentálnych tlakov [12], ako aj vyšetrenú mikrocirkuláciu, aspoň pomocou transkutánneho merania parciálneho tlaku kyslíka.
Ateroskleroticky podmienené periférne artériové ochorenie musíme považovať za systémové ochorenie [18]. Preto u každého pacienta s potvrdenou diagnózou PAO pátrame po prejavoch aterosklerózy aj v ďalších riečiskách - karotické, koronárne, renálne, ako aj na aorte (aneuryzma). Mali by sme vyšetriť sonograficky karotické artérie, ako aj brušnú aortu. EKG záznam je samozrejmosťou.
Liečba PAO
V liečbe ischemickej choroby dolných končatín sa uplatňujú jednak konzervatívne postupy (ovplyvnenie rizikových akcelerujúcich faktorov aterosklerózy, kinezioterapia, medikamentová liečba) a jednak radikálne postupy, a to buď metódy intervenčnej rádiológie (perkutánna translumenová angioplastika, trombolýza, stenty) alebo metódy chirurgické (rekonštrukčné operácie, endarterektómie, amputácie).
Pacienti s aterosklerotickým periférnym obliterujúcim ochorením končatinových artérií majú zvýšené riziko vzniku infarktu myokardu (IM), cievnej mozgovej príhody (NCMP) ako aj kardiovaskulárnej smrti. Preto zmena životného štýlu, agresívna liečba rizikových faktorov akcelerujúcich aterosklerózu, ako aj protidoštičková liečba je u pacientov s PAO nevyhnutná [19].
Výber vhodnej liečebnej metódy je individuálny, ale do istej miery závisí od funkčného štádia ochorenia. Kým v štádiu II (podľa Fontaineovej klasifikácie) sa používa skôr konzervatívna liečba, v III. a IV. štádiu sa vždy treba pokúsiť o radikálnu liečbu. Zjednodušene môžeme povedať, že medikamentová liečba ovplyvňuje mikrocirkuláciu, kým cieľom intervenčných postupov je ovplyvnenie makrocirkulácie, a tým zvýšenie krvného prietoku a tlaku do ischemických oblastí. Taktika revaskularizačnej liečby závisí od množstva faktorov, ako je dĺžka stenózy, počet lézií (multietážové postihnutie), významnosť stenózy, ale aj pridružené ochorenia a celkový stav pacienta.
Liečba I. štádia PAO
V prvom asymptomatickom štádiu ovplyvňujeme u pacientov rizikové faktory, pacient musí prestať fajčiť a redukovať nadváhu. Dôležité je tiež celkové zvýšenie fyzickej aktivity, vrátane dostatku chôdze, ale aj kondičných cvičení, nakoľko pravidelná fyzická aktivita sa považuje za protektívny faktor aterogenézy. Všetci pacienti s diagnostikovaným ochorením by mali dostávať farmakologickú liečbu, ako sa uvádza v tab. 7 [20].
7. Farmakologická liečba na redukciu KV príhod u pacientov s PAO na základe medicíny dôkazov (podľa Canadian Cardiovascular Society Consensus 2005). 
Protidoštičková liečba sa podáva nielen z dôvodu zabrániť progresii ochorenia v oblasti končatinových tepien, ale aj v snahe zabrániť srdcovým či mozgovým komplikáciám [21]. Je indikovaná u všetkých pacientov (symptomatických aj asymptomatických) s diagnostikovaným PAO na redukciu rizika IM, NCMP alebo cievnej smrti na základe medicíny dôkazov.
Počnúc prvým štádiom ochorenia podávame pacientom protidoštičkové látky: kyselinu acetylsalicylovú (ASA) alebo klopidogrel alebo tiklopidín. Ukázalo sa, že klopidogrel znižuje relatívne riziko náhlej cievnej mozgovej príhody a infarktu myokardu a cievnej smrti o 23 % viac v porovnaní s ASA [1]. ASA a klopidogrel sú uprednostnené pred tiklopidínom [1,7,14]. Odporúčané dávkovanie: nízke až stredné dávky kyseliny acetylsalicylovej (75-325 mg) alebo klopidogrel v dávke 75 mg denne.
Liečba klaudikácií
V klaudikačnom štádiu je dôraz na konzervatívnu liečbu, a to kombináciou fyzikálnej liečby s medikamentovou terapiou (tab. 8). V štádiu II. dochádza totiž pri správnej konzervatívnej terapii v priebehu 5 rokov k zlepšeniu alebo stabilizácii ochorenia až u 75 % pacientov, 25 % pacientov sa však zhorší, pričom 5 % sa musí podrobiť intervencii a 2 % amputácii [7].
8. Liečba klaudikačného štádia ischemickej choroby končatín. 
Hlavnou liečebnou metódou II. štádia je rehabilitácia, v zmysle známeho hesla „prestaň fajčiť, začni chodiť“. Prestať fajčiť sa snažíme pomôcť pacientom aj zaradením do špeciálnych odvykacích programov za pomoci psychológa či psychoterapeuta. Pravidelná fyzická aktivita je druhou nevyhnutnou požiadavkou. Uplatňuje sa predovšetkým pohybová liečba (kinezioterapia), hlavne intervalový svalový tréning, chôdzou alebo cvičením (má byť intenzívny, ale nemá navodzovať klaudikačnú bolesť), cvičenia v stoji, rotačné cvičenia podľa Ratschova či cievne cvičenia podľa Buergera, najlepšie pod odborným dohľadom. Cieľom pohybovej liečby je otvorenie efektívneho kolaterálneho obehu, zvýšenie tolerancie bolesti a metabolická adaptácia ischemických oblastí. Svalový tréning je účinný vtedy, keď je pacient správne motivovaný, cvičí pravidelne a dlhodobo. Veľké štúdie dokázali zvýšenie bezbolestnej klaudikačnej vzdialenosti o 30-150 % len vďaka pravidelnému tréningu chôdzou. Pravidelné cvičenie môže byť v tomto štádiu pre pacienta rovnako prospešné ako bypassová chirurgia alebo angioplastika [13].
Dôvodom pre konzervatívnu liečbu II. štádia PAO je aj skutočnosť, že chirurgicky riešené úseky zostávajú priechodné len po určitú dobu, a ak dôjde k uzatvoreniu bypassu, býva hemodynamická situácia ešte horšia (nárast uzáveru distálne).
K radikálnemu lumen-otváraciemu či lumen-obnovujúcemu riešeniu v II. štádiu ochorenia pristupujeme len v prípade naliehania pacienta alebo v prípade veľmi krátkej klaudikačnej vzdialenosti (štádium IIc - klaudikácie pod 50 metrov). Aj krátka klaudikačná vzdialenosť je však akceptovateľná u polymorbidného, starého či inou chorobou (angina pectoris, hemiparéza, ťažká koxartróza) obmedzovaného pacienta. U každého pacienta musíme zvážiť individuálne profit a riziko invazívneho radikálneho liečebného zásahu. K rozhodovaniu prispieva aj pravidelné neinvazívne sledovanie (meranie klaudikačnej vzdialenosti na treadmille, určovanie členkovo-brachiálneho tlakového indexu) efektu liečby každých 3-6 mesiacov [22].
Liečba kritickej končatinovej ischémie (KKI)
Pacient s diagnostikovanou kritickou končatinou ischémiou (štádium Fontaine III a IV) by mal byť čo najskôr riešený tímom špecialistov (angiológ, cievny chirurg, vaskulárny a intervenčný radiológ). Vždy sa snažíme najprv zlepšiť perfúziu v ischemickej oblasti revaskularizačným výkonom, buď endovaskulárnym (angiorádiologickým) alebo angiochirurgickým. Ku konzervatívnej liečbe pristupujeme vtedy, ak nie je možné vykonať revaskularizačný výkon, resp. ak bol takýto výkon neúspešný. Mnohé princípy liečby KKI sú totožné s princípmi opísanými v liečbe claudicatio intermittens (CI), aj keď poradie ich dôležitosti je odlišné. Kým pri CI je nevyhnutné urýchlene modifikovať či liečiť akcelerujúce rizikové faktory aterosklerózy, pri KKI už liečba rizikových faktorov nie je tak urgentná. Na druhej strane pri KKI je základnou a neodkladnou požiadavkou liečba bolesti. Analgetickú liečbu volíme individuálne, neváhame ani s použitím opiátov, avšak analgetická liečba nikdy nesmie oddialiť definitívne riešenie ischémie. Alternatívou u pacientov s KKI, u ktorých nie je možné vykonať radikálny revaskularizačný výkon, je podávanie prostanoidov [23]. Infúzna liečba s prostaglandínom E1 je poslednou možnou alternatívou pred amputáciou.
Medzi všeobecné zásady konzervatívnej liečby KKI patrí:
- liečba bolesti
- liečba trofických defektov
- starostlivosť o nohy (predovšetkým ochrana pred poranením)
- liečba infekcie (v prípade infikovaných vredov či gangrény je dôležitá parenterálna systémová liečba antibiotikami v dostatočne vysokých dávkach)
- liečba život ohrozujúcich koexistujúcich ochorení.
Napr. úspešná liečba sdrcovej insuficincie, zvýšený vývrhový objem ľavej komory, môže zlepšiť periférne prekrvenie, a tým aj prispieť k liečbe KKI. Na druhej strane príliš agresívna liečba artériovej hypertenzie môže kriticky znížiť perfúziu končatiny a prispieť tak k zvýrazneniu bolesti či oddialeniu hojenia ischemického ulkusu.
Primárnym cieľom revaskularizácie (endovaskulárnej alebo chirurgickej) je zabezpečiť dostatočný prítok krvi do ischemických oblastí a tým odstrániť bolesti a zahojiť trofické zmeny.
Antikoagulačné a protidoštičkové lieky predstavujú neoddeliteľnú súčasť terapeutického arzenálu cievno-chirurgických pracovísk. Možnosť ovplyvnenia hemostázy a hemokoagulácie je limitujúcim predpokladom akéhokoľvek výkonu v súčasnej cievnej chirurgii. Dôvody, pre ktoré v cievnej chirurgii podávame medikamenty, ovplyvňujúce zrážanie krvi, môžeme rozdeliť do 3 skupín:
- Bezprostredná perioperačná heparinizácia zabraňujúca koagulácii krvi po naložení svorky na rekonštruovaný arteriálny úsek: pri aortálnych rekonštrukciách 0,75 mg, pri infrainguinálnych rekonštrukciách 1 mg heparinu na kg hmotnosti pacienta; v bezprostrednom pooperačnom období, t.j. v operačný deň, pokračujeme spravidla vo frakcionovanej subkutánnej aplikácii heparinu v dávke 3krát 5 000-3krát 7 500 j. V ďalších pooperačných dňoch prechádzame na heparíny s nízkou molekulovou hmotnosťou v profylaktických dávkach, po stabilizácii pacienta a rán konvertujeme na perorálnu antitrombotickú liečbu tak, ako je to uvedené v ďalšom odstavci.
- Adjuvantná protidoštičková alebo antikoagulačná liečba po chirurgických rekonštrukciách alebo perkutánnych endovaskulárnych intervenciách (PEI), prípadne hybridných (kombinovaných) výkonoch, zabraňujúca včasnému (do 30 dní) alebo neskorému (do 1 roka) zlyhaniu rekonštrukcie a súčasne výrazne redukujúca riziko kardiovaskulárnej smrti pacientov s PAO. ASA v uvedených dávkach sa odporúča ako protidoštičková látka prvej voľby. V prípade neznášanlivosti alebo neefektivity podávame klopidogrel, ktorý preferujeme aj v prípadoch spojených so zvýšeným rizikom uzáveru rekonštrukcie (najmä pri redukovaných odtokových pomeroch). Antikoagulačná liečba kumarínovými preparátmi je indikovaná v špecifických prípadoch, najmä vtedy, keď má pacient kardiálne ochorenie, vyžadujúce túto liečbu. Po femoropopliteálnych rekonštrukciách sa nedokázal priaznivý efekt na dlhodobú priechodnosť rekonštrukcií.
- Dlhodobé podávanie protidoštičových preparátov pacientom s verifikovaným PAO vo všetkých klinických štádiách (I-IV podľa Fontainea) v prevencii artériovej aterotrombózy: ASA 75-375 mg denne, klopidogrel 75 mg 1krát denne; tieto lieky sú preferované voči tiklopidínu, iné medikamenty (indobufen, dipyridamol) sa neodporúčajú vzhľadom na to, že ich účinnosť sa nedokázala. Protidoštičková liečba je potrebná po celý život u pacienta s dokázaným PAO.
Farmakoterapia pacientov v súvislosti s endovaskulárnou liečbou
Thienopyridíny sa v klinickej praxi presadili svojim mimoriadne silným efektom na prevenciu subakútneho uzáveru vaskulárneho stentu (na podklade in-stent trombózy) pri porovnaní s aplikáciou len ASA [24,25], ktorý bol v štúdii MATTIS [26] dokázaný aj v randomizovanej podobe.
Prenesením odporúčaní k perkutánnym koronárnym intervenciám (PCI) o klinickom využití klopidogrelu máme v súvislosti s periférnymi vaskulárnymi intervenciami (PVI) plné oprávnenie po endovaskulárnych intervenciách so zvýšeným rizikom subakútnej trombózy nahradiť terapiu heparínom tzv. duálnym potencovaním protidoštičkovej liečby klopidogrelom (75 mg/denne) s ASA (100 mg/denne), ktorá je aplikovaná dlhodobo (1-12 mesiacov).
Perkutánnou intervenciou so zvýšeným rizikom subakútnej trombózy je každá implantácia vaskulárneho stentu alebo stentgraftu, ale aj napríklad PCI alebo PVI so suboptimálnym výsledným efektom, ako je ponechaná parciálna disekcia a nezávažná reziduálna stenóza po perkutánnej angioplastike. Duálnu protidoštičkovú liečbu rizikových PVI možno zahájiť jednorázovým podaním 300 mg klopidogrelu bezprostredne pred výkonom alebo 4-dňovým predliečením s denným podávaním 75 mg klopidogrelu v nasledujúcich schémach:
- Prevencia subakútnej in-stent trombózy:
- všetky implantácie stentov (1-3 mesiace)
- implantácie stentgraftov (3-12 mesiacov) (možné parciálne prekrytie aortových ostií stentom).
- Prevencia subakútnej trombózy pri rizikových PVI:
- subintimálne rekanalizácie
- suboptimálny efekt po angioplastike (1-3 mesiace)
- zlý odtok do periférie
- krurálne intervencie pri kritickej končatinovej ischémii.
- Predliečenie alebo jednorázové nasycovanie - prevencia tromboembolických komplikácií pri supraaortových intervenciách (spolu s prevenciou subakútnej trombózy stentu):
- karotický stenting
- intrakraniálny stenting
- angioplastika a stenting vertebrobazilárneho systému a a. subclavia (3-12 mesiacov).
Odporúčaná liečba periférneho artériového ochorenia končatín zatiaľ nie je jednotná, avšak klinická prax a výskum prinášajú stále novšie poznatky. Terapeutické rozhodnutie u jednotlivého pacienta by malo byť výsledkom multidisciplinárneho prístupu angiológa, cievneho chirurga, vaskulárneho a intervenčného rádiológa, pričom v prípade nutnosti sa na liečbe zúčastňujú aj iní medicínski špecialisti, ako napr. reumatológovia či imunológovia v prípade vaskulitíd, diabetológovia ev. ortopédi v prípade diabetickej nohy, kardiológovia či neurológovia v prípade súčasného ochorenia srdca či mozgu. Dôležitou súčasťou menežmentu pacienta je aj ošetrovateľská starostlivosť a profesionálna psychosociálna podpora.
Sumarizácia dlhodobej medikamentóznej liečby pacientov s PAO
Pacienti s PAO v akomkoľvek klinickom štádiu (I-IV) majú dlhodobo dostávať tieto lieky: antitrombotiká (ASA alebo klopidogrel), ACE inhibítor, statín (obidva lieky bez ohľadu na prítomnosť arteriálnej hypertenzie resp. hyperlipoproteinémie), pacienti s diabetes mellitus perorálne antidiabetiká alebo inzulinoterapiu podľa stupňa poruchy glycidového metabolizmu. V prípade výrazne limitujúcich až mutilujúcich klaudikácií je oprávnené podávanie reologických a vazoaktívnych liekov. Hypolipidemiká (statíny) a hypotenzíva sú dokázateľne účinné v prevencii progresie ochorenia (PAO, koronárna a mozgová ateroskleróza), vzniku kardiovaskulárnych príhod a náhlej kardiovaskulárnej smrti. Spomedzi hypotenzív sú liekmi prvej voľby ACE inhibítory bez ohľadu na ich antihypertenzívny efekt [27].
prof. MUDr. Viera Štvrtinová, CSc.
II. interná klinika LF UK a FNsP
Mickiewiczova 13
813 69 Bratislava
Slovenská republika
e-mail: vierastvrtinova@centrum.sk
Doručeno do redakce: 2. 11. 2007
Sources
1. CAPRIE steering committee. A randomized, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events. Lancet 1996; 348 : 1329-1339.
2. Aronow WS, Ahn C. Prevalence of coexistence of coronary artery disease, peripheral arterial disease, and atherothrombotic brain infarction in men and women < 62 years of age. Am J Cardiol 1994; 74 : 64-65.
3. Heidrich H, Wenk R, Hesse P. Frequency of asymptomatic peripheral arterial disease in patients entering the department of general and internal medicine of a general-care hospital. Vasa 2004; 33 : 63-67.
4. Diehm C, Schuster A, Allenberg JR et al. High prevalence of peripheral arterial disease and co-morbidity in 6880 primary care patients: cross-sectional study. Atherosclerosis 2004; 172 : 95-105.
5. European Working Group on Critical Limb Ischemia, Second European Consensus on Chronic Critical Limb Ischemia. Circulation 1991; 84 (Suppl IV): 1-26.
6. Nogren L. Critical limb ischaemia: an overview. Critical ischemia 1998; 7 : 89-94.
7. TASC - Management of Peripheral Arterial Disease (PAD). TransAtlantic Inter-Society Consenzus (TASC). Int Angiol 2000; 19 (Suppl 1): 1-310.
8. Puchmayer V, Roztočil K. Praktická angiologie. 2. rozšírené a přepracované vydání. Praha: Triton 2007.
9. Staněk F. Ischemická choroba dolních končetin (ICHDK) - chronické formy. In: Karetová D, Staněk F (Eds). Angiologie pro praxi. Praha: Maxdorf 2001, 21-75.
10. Ray SA, Srodon PD, Taylor RS et al. Reliability of ankle-brachial index measurement by junior doctors. Br J Surg 1994; 81 : 181-190.
11. Rutherford RB, Baker JD, Ernst C et al. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997; 26 : 517-538.
12. Heidrich H, Wenk R, Hesse P. Frequency of asymptomatic peripheral arterial disease in patients entering the department of general and internal medicine of a general-care hospital. Vasa 2004; 33 : 63-67.
13. Hiatt WR. Medical treatment of peripheral arterial disease and claudication. N Engl J Med 2001; 344 : 1608-1620.
14. Hirsch AT, Haskal ZJ, Hertzer NR et al. ACC/AHA 2005 Guidelines for Management of Patients With Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic): Executive Summary. JACC 2006; 47 : 1239-1312.
15. Orchard TJ, Strandness DE. Assessment of peripheral vascular disease in diabetes: report and recommendations of an international workshop sponsored by the American Diabetes Association and the American Heart Association September 18-20, 1992, New Orleans, Louisiana. Circulation 1993; 88 : 819-828.
16. Cachovan M. Ergometrie. In: Alexander K (Ed). Gefässkrankenheiten. Urban a Schwarzenberg: München - Wien - Baltimore 1994, 142-144.
17. Andreozzi GM, Arosio E, Martini R. Consensus on Intermittent Claudication, ABANO Terme, Italy, 2005 CEVF-CI.
18. Federman DG, Bravata DM, Kirsner RS. Peripheral arterial disease. A systemic disease extending beyond the affected extremity. Geriatrics 2004; 59 : 29-39.
19. Hackam DG, Goodman SG, Anand SS. Management of risk in peripheral artery disease: recent therapeutic advances. Am Heart J 2005; 150 : 35-40.
20. Abramson BL, Huckell V, Anand S et al. Canadian Cardiovascular Society Consensus Conference: Peripheral arterial disease - Executive summary. Can J Cardiol 2005; 21 : 997-1006.
21. Bounameaux H, Wutschert R. Drug treatment strategies for peripheral obliterative arteriopathy. Drugs 1998; 56(Suppl 3): 17-23.
22. Hiatt WR. The US experience with cilostazol in treating intermittent claudication. Atherosclerosis 2005 (dostupné na www.elsevier.com/locate/atherosclerosis).
23. Štvrtinová V, Ambrózy E, Kriška M. Lieky pri poruchách periférnej cirkulácie. In: Kriška M (Ed). Memorix klinickej farmakológie. Bratislava: SAP 2006 : 257-262.
24. Rupprecht HJ, Darius H, Borkowski U et al. Comparison of antiplatelet effects of aspirin, ticlopidine or their combination after stent implantation. Circulation 1998; 97 : 1046-1052.
25. Makkar RR, Eigler NL, Kaul S. Effects of clopidogrel, aspirin and combined therapy in a porcine ex vivo modelof high-shear induced stent thrombosis. Eur Heart J 1998; 19 : 1538-1546.
26. Urban P, Macaya C, Rupprecht HJ et al. Randomised evaluation of anticoagulation versus antiplatelet therapy after coronary stent implantation in high-risk patient: the multicenter aspirin and ticlopidine trial after intracoronary stenting (MATTIS). Circulation 1998; 98 : 2126-2132.
27. Štvrtinová V, Šefránek V, Murín J et al. Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín. Odporúčania Slovenskej angiologickej spoločnosti, Slovenskej spoločnosti pre cievnu chirurgiu, Slovenskej kardiologickej spoločnosti, Slovenskej internistickej spoločnosti a Slovenskej rádiologickej spoločnosti.. Kardiológia 2006; 6 : 317-326.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 2-
All articles in this issue
- Monitoring of anti-tumour cell-mediated response in patients with renal cell carcinoma, disturbance of T cell proliferation
- Definition of 24hour ambulatory blood pressure values corresponding to office blood pressure values of 130/80 mm Hg
- Factors related to NT-proBNP values in haemodynamically stable patients with normal systolic function of the left ventricle
- Invasive aspergillosis in hematooncological patients: advantages and disadvantages of various diagnostic methods, treatment options and financial costs of therapy
- Dyslipidaemia inducted by antiretroviral agents
- Blood vessel reconstruction infections: a practical view
- Importance of the endocannabinoid system in the regulation of energy homeostasis
- Peripheral arterial disease of extremities – guidelines for diagnostic and treatment
- At least 60 deaths could be avoided in this country every day!
- The scintigraphic 99mTc-MAA imaging quantification of the right-to-left shunt in a patients with multiple pulmonary arteriovenous malformation and familial teleangiectasis
- Current Use of Magnetic Resonance Imaging in Cardiology
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Peripheral arterial disease of extremities – guidelines for diagnostic and treatment
- The scintigraphic 99mTc-MAA imaging quantification of the right-to-left shunt in a patients with multiple pulmonary arteriovenous malformation and familial teleangiectasis
- Factors related to NT-proBNP values in haemodynamically stable patients with normal systolic function of the left ventricle
- Monitoring of anti-tumour cell-mediated response in patients with renal cell carcinoma, disturbance of T cell proliferation
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

