-
Medical journals
- Career
Prolaktín – marker aktivity systémových ochorení spojiva?
Authors: Ž. Macejová 1; D. Trejbal 2; M. Oetterová 1; I. Lazúrová 1
Authors‘ workplace: I. Interná klinika Lekárskej fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednostka prof. MUDr. Ivica Lazúrová, CSc. 1; IV. interná klinika Lekárskej fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednosta prof. MUDr. Ivan Tkáč, CSc. 2
Published in: Vnitř Lék 2008; 54(11): 1039-1044
Category: Original Contributions
Overview
Etiopatogenéza autoimunitných ochorení nebola jednoznačne objasnená. Autoimunitné ochorenia vznikajú u jednotlivcov s genetickou predispozíciou. Z endogénnych faktorov svoju úlohu zohrávajú aj pohlavné hormóny, najmä prolaktín. Cieľom práce bolo vyšetriť bazálne a TRH testom stimulované hodnoty prolaktínu u pacientov so systémovými ochoreniami spojiva: systémový lupus erythematosus (SLE), systémová skleróza, Sjögrenov syndróm, dermatomyozitída.
Súbor a metódy:
Autori vyšetrili 43 pacientov so systémovými ochoreniami spojiva: 20 pacientov s SLE, 7 pacientov so Sjögrenovým syndrómom, 7 so systémovou sklerózou a 9 s dermatomyozitídou. Priemerný vek pacientov: 39,87 rokov. Ako kontrolu vyšetrili 30 dobrovoľníkov, priemerný vek 35,17 rokov.Výsledky:
Hladina prolaktínu u pacientov so systémovými ochoreniami spojiva bola 14,629 ng/ml, čo je viac ako u kontrolnej skupiny (6,952 ng/ml), bez štatistickej významnosti. Po i.v. stimulácii došlo po 20 min k štatisticky významnému vzostupu prolaktínu u pacientov (62,630 ng/ml) v porovnaní s kontrolnou skupinou (30,982 ng/ml). Tento štatisticky významný rozdiel pretrvával aj 60 min po podaní TRH – kontrolná skupina 16,43 ng/ml, pacienti so systémovými ochoreniami spojiva 36,890 ng/ml. Rozdiely v hladinách prolaktínu u jednotlivých systémových ochorení spojiva neboli štatisticky významné. Pozitívna korelácia v skupine chorých bola nájdená medzi stimulovanými hodnotami prolaktínu a hodnotou FW. Celkovo však nebola nájdená jednoznačná korelácia medzi laboratórnou aktivitou a hladinami prolaktínu.Záver:
V práci autori zistili, že poststimulované hodnoty prolaktínu u pacientov so systémovými ochoreniami spojiva sú štatisticky významne vyššie v porovnaní s kontrolnou skupinou. Korelačnými analýzami nebola zistená jednoznačná súvislosť medzi zápalovou aktivitou a hladinami prolaktínu, preto autori predpokladajú, že stredne zvýšené hodnoty prolaktínu sú u pacientov so systémovými ochoreniami spojiva skôr rizikový faktor ochorenia ako marker zápalu.Kľúčové slová:
prolaktín – systémové ochorenia spojiva – aktivita ochoreniaÚvod
Systémové ochorenia spojiva predstavujú orgánovo-nešpecifické autoimunitné ochorenia. Všetky makromolekulové zložky tela sú potenciálnymi antigénmi pre jedinca. Autoimunita je imunitná odpoveď namierená proti vlastným antigénom [3]. Pre organizmus môže, ale nemusí byť škodlivá. Predpokladá sa, že má úlohu pri odstraňovaní poškodených buniek, pri odstraňovaní antigénovo zmenených buniek, pravdepodobne sa zúčastňuje na obrane proti nádorovému bujneniu a je dôležitá pri vývine imunitného systému v ontogenéze. Ak sa autoimunitná reakcia prejaví pre organizmus nepriaznivo, ide o autoimunitnú chorobu [3]. Autoimunitné choroby môžu postihnúť prakticky ktorýkoľvek orgán alebo tkanivo. Typickým orgánovo-nešpecifickým ochorením je systémový lupus erythematosus (SLE).
Etiopatogenéza autoimunitných ochorení aj napriek dlhoročnému úsiliu nebola jednoznačne objasnená. Autoimunitné ochorenia vznikajú u jednotlivcov s genetickou predispozíciou, o čom svedčí fakt, že výskyt autoimunitných ochorení je častejší u dvojčiat a častejšie sa vyskytujú u jedincov s určitým typom HLA antigénu. Svoju úlohu zohrávajú aj exogénne faktory, ktoré môžu spustiť ochorenie. Z endogénnych faktorov sú dôležité pohlavné hormóny, najmä prolaktín.
Zistenie, že prolaktín ovplyvňuje imunitný systém, podnietil vznik úvah, že môže zasahovať do etiopatogenézy autoimunitných ochorení.
Cieľom práce bolo vyšetriť bazálne a stimulované hodnoty prolaktínu u pacientov so systémovými ochoreniami spojiva: SLE, systémová skleróza, Sjögrenov syndróm, dermatomyozitída. Na stimulovanie sme použili štandardný i.v. TRH test/0,2 mg.
Súbor pacientov a metódy
Vyšetrili sme pacientov so systémovými ochoreniami spojiva: SLE, systémová skleróza, Sjögrenov syndróm, dermatomyozitída. Pacienti boli hospitalizovaní na II. internej a I. internej klinike FNsP alebo vedení v reumatologickej ambulancii FN L. Pasteura počas rokov 1996–2007.
Súbor tvorilo 43 pacientov: 20 pacientov s SLE – 17 žien a 3 muži, 7 pacientov so Sjögrenovým syndrómom – 6 žien, 1 muž, 7 pacienti so systémovou sklerózou – 7 žien, 0 mužov a 9 pacientov s dermatomyozitídou – 7 žien a 2 muži.
Priemerný vek pacientov bol 39,87 ro-kov. Pozitivita ANA/IF bola u 31 pacientov (72,0 %). Pacienti neužívali liečbu, ktorá by interferovala s hladinami prolaktínu. Niektorí pacienti užívali NSA, antimalariká alebo hepatoprotektíva, táto liečba však 3 dni pred vyšetrením bola vynechaná.
Ako kontrolu sme vyšetrili 30 zdravých dobrovoľníkov: 21 žien a 9 mužov vo veku od 25 do 52 rokov, priemerný vek 35,17 ± 13,623. Priemerný vek mužov bol 34,2 rokov, priemerný vek žien 36,6 rokov.
U každého pacienta sme okrem objektívneho vyšetrenia vykonali laboratórne vyšetrenie krvi za rovnakých podmienok. Stanovovali sme: sedimentáciu erytrocytov (FW), krvný obraz (KO), reaktanty akútneho zápalu: CRP, ceruloplazmín, celkové bielkoviny, elektroforézu bielkovín, bazálne a stimulované hladiny prolaktínu. Na stimuláciu sme použili tyreoliberín (TRH) 0,2 mg firmy Berlin‑Chemie, ktorý sme aplikovali vo forme rýchlej intravenóznej infúzie. Po aplikácii i.v. 0,2 mg syntetického tyreoliberínu sme odobrali vzorky krvi po 20 a po 60 min. Je známe, že TRH je mohutným stimulátorom sekrécie prolaktínu a vyšetrovanie stimulovaných hodnôt prolaktínu sa považuje za oveľa citlivejší indikátor sekrécie hormónu ako vyšetrenie bazálnych hladín.
Pri vyšetrovaní hladín prolaktínu smedôsledne dodržiavali nasledujúce zásady:
- test sme robili ráno nalačno, 2 hod po prebudení
- zásadný dôraz sme kládli na liekovú anamnézu (psychofarmaká, antihypertenzíva, estrogény)
- krv sme po odbere scentrifugovali a až do vyšetrenia skladovali pri teplote –20 °C
- u žien sme odber realizovali na 10. deň menštruačného cyklu
Hladiny prolaktínu sme stanovovali chemiluminiscenčnou metódou – imunochemická reakcia s monoklónovou protilátkou na prístroji Imunolite.
Štatistické spracovanie
V rámci deskriptívnej štatistiky sme pri hodnotení kvantitatívnych údajov použili aritmetický priemer, smerodajnú odchýlku (± SD) a frekvencie. Hodnotenie tesnosti vzťahu medzi premennými sme v závislosti od charakteru dát realizovali Pearsonovými a Spearmanovými koeficientmi korelácie, s hladinami významnosti: p < 0,001***, p < 0,01**, p < 0,05*. Na vzájomné porovnávanie kvantitatívnych parametrov dvoch skupín (muži vs ženy, akútni vs chronickí pacienti) sme použili t‑test pre dva nezávislé výbery a Kolmogorov-Smirnovov test – neparametrickú obdobu t‑testu. Na porovnanie parametrov viacerých vyšetrovaných skupín sme použili ANOVU s korekciou pre viacnásobné porovnanie (Scheffeho Post Hoc test, p < 0,05*) a Kruskal-Wallisov H-test.
Výsledky
Pri sledovaní zmien hladín prolaktínu po i.v. stimulácii tyreoliberínom u celej vyšetrovanej vzorky sme zistili podobné reakcie u jednotlivých vyšetrovaných skupín, avšak so signifikantnými rozdielmi medzi jednotlivými skupinami, ako to uvádzame nižšie. Bazálne hladiny prolaktínu po i.v. podaní TRH vystúpili u všetkých skupín a maximum dosiahli po 20 min od i.v. podania TRH. O 60 min od stimulácie došlo u všetkých vyšetrovaných skupín k postupnému poklesu hladín PRL, ale ani u jednej skupiny sa hodnoty PRL nevrátili ešte k bazálnym hodnotám.
Kontrolná skupina – zdravá populácia
V tab. 1 uvádzame bazálne hodnotyprolaktínu a hodnoty prolaktínu poi.v. aplikácii 0,2 mg tyreoliberínu s od-stupom 20 a 60 min u kontrolnej – zdravej populácie, ktorú tvorilo 30 dobrovoľníkov.
Table 1. Bazálne a TRH testom stimulované hodnoty PRL u kontrolnej skupiny. 
Ako z uvedených údajov vyplýva, bazálne hodnoty prolaktínu v kontrolnej – zdravej – skupine boli vo fyziologickom rozpätí (6,952 ng/ml). Po i.v. stimulácii došlo k zvýšeniu hladín prolaktínu podľa predpokladu, po 20 min na 30,982 ng/ml. Toto zvýšenie sa pomaly upravovalo, o čom svedčí postupný pokles hladín PRL po 60 min na 16,43 ng/ml.
Pacienti so systémovými ochoreniami spojiva
Priemerná bazálna hodnota PRL u pacientov so systémovými ochoreniami spojiva bola 14,629 ng/ml, čo je viac ako u kontrolnej skupiny, rozdiel však nie je štatisticky významný. Po 20 min od i.v. stimulácie TRH došlo k zvýšeniu hladín PRL na 62,630 ng/ml, čo je v porovnaní s kontrolnou skupinou (30,982 ng/ml) signifikantne vyššie (p < 0,001). Tento štatisticky významný rozdiel pretrvával aj po 60 min od podania TRH – pacienti 36,890 ng/ml, kontrolná skupina 16,43 ng/ml – p < 0,001 (tab. 2, graf 1).
Table 2. Bazálne a TRH testom stimulované hodnoty PRL u pacientov so systémovými ochoreniami spojiva. 
Graph 1. Bazálne a TRH testom stimulované hodnoty PRL u pacientov so systémovými ochoreniami spojiva. 
Pacientov v skupine systémové ochorenia spojiva sme rozdelili na podskupiny na jednotlivé ochorenia: SLE, systémová skleróza, Sjögrenov syndróm, dermatomyozitída. Bazálne a stimulované hodnoty PRL u takto rozdelenej skupiny uvádzame v tab. 3.
Table 3. Priemerné hodnoty PRL po i.v. stimulácii TRH u jednotlivých skupín systémových ochorení spojiva. 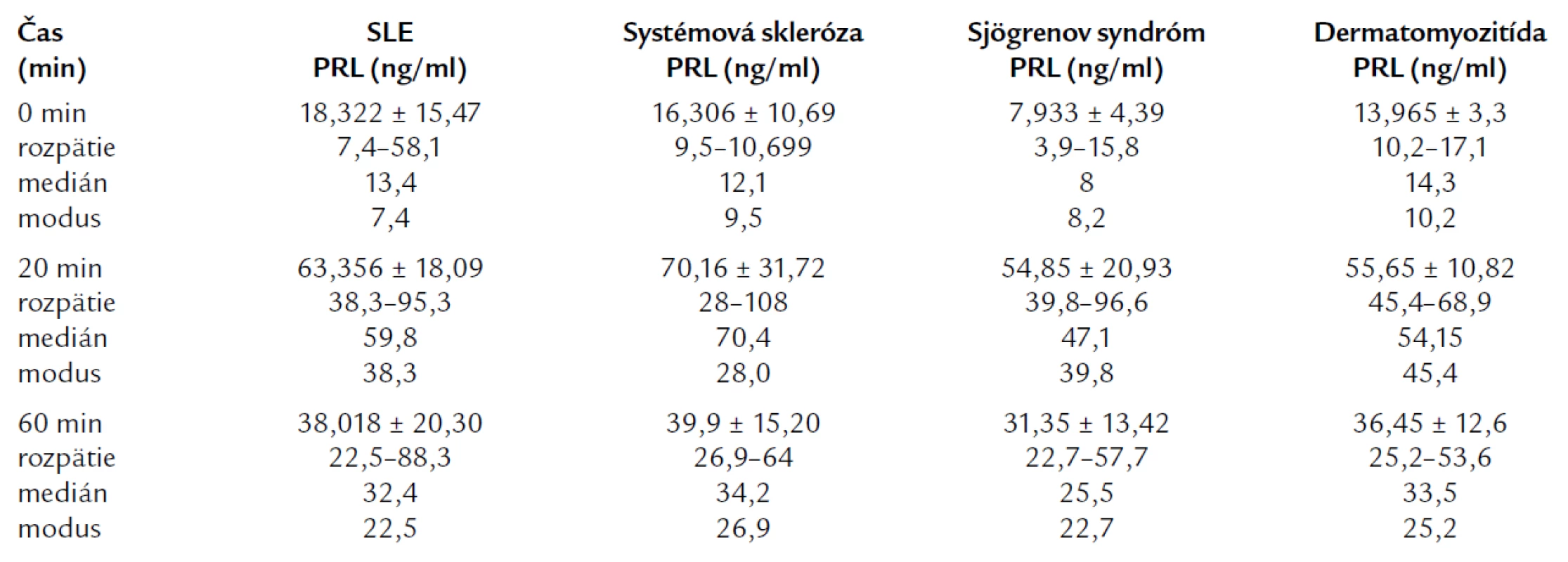
V grafe 2 sú porovnaní pacienti s jednotlivých skupín autoimunitných ochorení. Ako z tabuľky a grafu vyplýva, najvyššie bazálne hodnoty PRL sme našli u pacientov s SLE a sklerodermiou. Po i.v. aplikácii tyreoliberínu (TRH 0,2 mg) sme po 20 min zistili najvyššie hladiny PRL u pacientov so sklerodermiou a mierne nižšie u pacientov s SLE. Rozdiel medzi najvyššie dosiahnutými hodnotami (sklerodermia) a najnižšími (Sjögrenov syndróm) bol 15,31 ng/ml. Po 60 min sú hodnoty PRL vo všetkých skupinách približne rovnaké. V tab. 4 uvádzame priemerné hodnoty sledovaných laboratórnych parametrov u pacientov so systémovými ochoreniami spojiva rozdelenými do jednotlivých skupín.
Table 4. Priemerné hodnoty sledovaných parametrov v jednotlivých skupinách systémových ochorení spojiva. 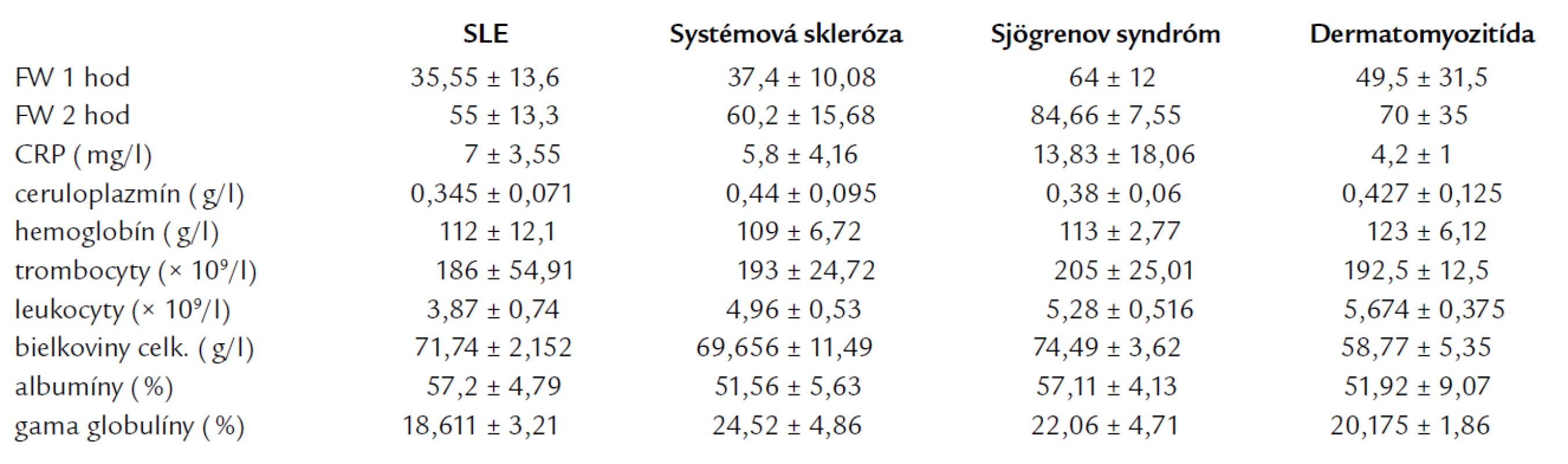
Pri vyhodnotení korelačných analýz sme zistili pozitívne korelácie medzi počtom leukocytov a hemoglobínom a negatívne korelácie medzi hemoglobínom a ceruloplazmínom, medzi trombocytmi a ceruloplazmínom a medzi leukocytmi a ceruloplazmínom. Negatívnu koreláciu sme našli medzi hladinou PRL 60 min po i.v. podaní TRH a trombocytmi. Zaujímavý je tiež nález pozitívnej korelácie medzi stimulovanými hodnotami prolaktínu a FW. Negatívnu koreláciu nachádzame medzi stimulovanou hladinou PRL po 60 min a CRP.
Diskusia
Problematika hladín prolaktínu u pacientov s autoimunitnými ochoreniami stále viac priťahuje pozornosť. V literatúre sa možno stretnúť s množstvom prác, ktoré sa zaoberajú sledovaním hladín prolaktínu a jeho účinkami na etiopatogenézu autoimunitných ochorení [5,21,11]. PRL sa dostáva do záujmu reumatológov aj imunológov, pretože má mnohé vlastnosti známych cytokínov a hematologických rastových faktorov [6]. Receptory pre prolaktín boli dokázané na mnohých bunkách imunitného systému. Experimentálne štúdie na zvieratách dokázali, že skutočne zohráva úlohu v patogenéze experimentálne navodenej autoimunitnej encefalitídy a adjuvantnej artritídy u potkanov. Boli publikované práce, ktoré sledovali pacientov s hyperprolaktinémiou bez zjavnej klinickej manifestácie. Po 5 rokoch sa u jedného vyvinula Graves-Basedowova hypertyreóza, u druhého sa po 2 rokoch vyvinula dermatomyozitída [11]. Sledovanie pacientov s primárnym Sjögrenovým syndrómom dokázalo, že 46 % bolo hyperprolaktinemických, a zvýšené hladiny prolaktínu boli dokázané aj u pacientov so sklerodermiou [22]. Zvýšené sérové hladiny prolaktínu boli dokázané aj u dievčat s juvenilnou reumatoidnou artritídou [13]. Veľký záujem je o sledovanie hladín prolaktínu u pacientov so systémovým lupus erythematosus (SLE). Väčšina autorov potvrdila zvýšené hladiny PRL u pacientov s SLE v porovnaní so zdravou populáciou, ale aj tu nachádzame kontroverzné výsledky. Niektorí autori [14,16] dokázali koreláciu medzi aktivitou ochorenia u SLE a hladinami prolaktínu. Iní autori našli zvýšené hladiny PRL, ale bez korelácie s aktivitou ochorenia [8]. Podľa niektorých prác ťažké formy SLE s orgánovým postihnutím boli spojené s hyperprolaktinémiou. Vysoké hodnoty PRL boli markerom postihnutia CNS u pacientov s juvenilnou SLE [4]. Blanco-Favera et al našli vysoké hladiny prolaktínu u pacientov s lupus nefritídou, nenašli však príčinný vzťah [1]. Rovenský et al nezistili zvýšenie bazálnych ani hypoglykémiou stimulovaných hodnôt prolaktínu u pacientiek s neaktívnou formou SLE [18]. Títo autori sledovali aj hypotalamicko‑pituitárnu odpoveď u pacientiek s reumatoidnou artritídou na inzulínom indukovanú hypoglykémiu. Záverom konštatujú, že hypotalamicko‑pituitárna odpoveď u pacientov s RA je pozmenená v zmysle zvýraznenej somatotropnej a redukovanej laktotropnej odpovede [19]. Zároveň zistili, že u pacientiek s RA s vyššími hodnotami PRL bolo nutné na zvládnutie klinickej a humorálnej zápalovej aktivity podať vyššie dávky kortikoidov ako u žien s normálnou hladinou prolaktínu [20].
Buskila et al [2] zistili až u 75 % hyperprolaktinemických žien pozitívne nálezy autoprotilátok proti rôznym, v klinickej praxi rutinne vyšetrovaným antigénom.
Table 5. Korelačné analýzy u pacientov so systémovými ochoreniami spojiva. 
Bazálne hodnoty prolaktínu u pacientov so systémovými ochoreniami spojiva boli vyššie ako u zdravej populácie, tento rozdiel však nebol štatisticky významný. Tento náš nález sa zhoduje s inými autormi [7,15]. Po i.v. stimulácii TRH (0,2 mg) došlo u pacientov k vzostupu hladín prolaktínu. Tento vzostup už bol signifikantne významný v porovnaní s kontrolnou skupinou. Pravdepodobne u pacientov s rôznymi typmi autoimunitných ochorení ide o dysreguláciu sekrécie prolaktínu v zmysle mierne zvýšených hladín za bazálnych podmienok a nadmerného zvýšenia po rôznych formách stimulácie. Tento nález potvrdzuje aj práca autorov Dostál et al [5], ktorý sledovali hladiny PRL u pacientov s RA a so systémovým lupus erythematosus (SLE). Zistili, že vyššie hodnoty PRL sa vyskytujú ako u pacientov s SLE, tak aj u pacientov s RA v porovnaní s kontrolnou skupinou, ale tento rozdiel sa pri opakovanom odbere hladín PRL zmierňuje. Predpokladajú teda, že u pacientov s RA ako aj s SLE došlo k nadmernej stimulácii sekrécie PRL v stresovej situácii.
Graph 2. Hladiny PRL po TRH u jednotlivých skupín systémových ochorení spojiva. 
Vyšetrovanie bazálnych a stimulovaných hladín PRL u pacientov s reumatoidnou artritídou [12] taktiež potvrdilo vyššie poststimulačné hodnoty prolaktínu u pacientov s RA, spolu s pozitívnou koreláciou medzi hladinami prolaktínu a mierou funkčnej neschopnosti hodnotenej dotazníkom HAQ.
Z korelačných analýz vyplýva, že u pacientov so systémovými ochoreniami spojiva sme našli pozitívne korelácie medzi počtom leukocytov a hemo-globínom a negatívne korelácie medzi hemoglobínom a ceruloplazmínom, medzi trombocytmi a ceruloplazmínom a medzi leukocytmi a ceruloplazmínom. Tieto vzťahy sa dali predpokladať. Negatívnu koreláciu sme našli medzi hladinou PRL 60 min po i.v. podaní TRH a trombocytmi. Zaujímavý je tiež nález pozitívnej korelácie medzi stimulovanými hodnotami prolaktínu a FW, čo by mohlo znamenať, že vyššie hodnoty poststimulačných hladín prolaktínu nachádzame u pacientov s vyššou sedimentáciou, a teda s vyššou aktivitou ochorenia. Títo pacienti sú zároveň aj trombocytopenický. Negatívnu koreláciu však nachádzame medzi stimulovanou hladinou PRL po 60 min a CRP. Tento údaj by vyvracal predchádzajúce tvrdenie. Keď však vychádzame z predpokladu, že u pacientov so SLE hladiny CRP neodrážajú aktivitu ochorenia, resp. že aj u vysoko aktívnych pacientov býva CRP v norme [17], nález negatívnej korelácie medzi CRP a PRL 60 nie je až tak nevysvetliteľný.
Celkovo sme nenašli jednoznačnú koreláciu medzi hladinami prolaktínu a aktivitou zápalu, preto v zhode s inými autormi predpokladáme, že mierna forma hyperprolaktinémie je skôr rizikový faktor autoimunitných ochorení ako marker zápalu.
Záver
Prepojenie neuroendokrinného a imunitného systému je zložité a komplexné. V etiopatogenéze autoimunitných ochorení zohrávajú dôležitú úlohu pohlavné hormóny. V literatúre sa možno stretnúť s množstvom prác, ktoré sa zaoberajú sledovaním hladín prolaktínu u pacientov s autoimunitnými ochoreniami. Väčšina autorov dokázala zvýšené hladiny prolaktínu u pacientov s RA, a to ako bazálne, tak aj po rôznych formách stimulácie.
V našej práci sme v zhode s inými autormi potvrdili vyššie hodnoty PRL u pacientov so systémovými ochoreniami spojiva, poststimulačné hodnoty PRL boli štatisticky významne vyššie v porovnaní s kontrolnou skupinou.
Nález hyperprolaktinémie u pacientov so systémovými ochoreniami spojiva považujeme skôr za rizikový faktor ochorenia než za prejav aktivity ochorenia.
Lepšie pochopenie interakcií medzi neuroendokrinným a imunitným systémom, objasnenie faktorov, ktoré vedú k regulácii uvoľňovania PRL, vzťah medzi sekréciou PRL a ďalších hormónov, vplyv hormónov na imunitný systém pomôžu objasniť etiopatogenézu autoimunitných ochorení a prispejú k novým terapeutickým možnostiam.
doc. MUDr. Želmíra Macejová, Ph.D.
www.upjs.sk
e‑mail: zelmira.macejova@upjs.sk
Doručeno do redakce: 16. 10. 2006
Přijato po recenzi: 6. 7. 2008
Sources
1. Blanco-Favela F, Alvarez G Q, Miranda AL. Association between prolactin and disease activity in systematic lupus erythematosus. Influence of statistical power. J Rheumatol 1999; 26 : 55–59.
2. Buskila D, Berezin M, Gur Het al. Autoantibody profile in the sera of women with hyperprolactinemia. J Autoimmun 1995; 8 : 415–524.
3. Cebecauer L, Kozáková D, Bošák V. Autoimunita a autoprotilátky pri systémových reumatických chorobách: In: Rovenský J et al. Reumatológia v teórii a praxi IV. Martin: Osveta 1996, 36–58.
4. El-Graft A, Salah S, Shaarawy M et al. Prolactin hormone in juvenile systemic lupus erythematosus: A possible relationship to disease activity and CNS manifestations. J Rheumatol 1996; 23 : 374 – 377.
5. Dostál C, Moszkorová L, Musilová L et al. Serum prolactin stress values in patients with systemic lupus erythematosus. Ann Rheum Dis 2003; 62 : 487–488.
6. Dostál C, Marek J. Prolaktin – významný činiteľ vzťahu medzi neuroendokrinným a imunitným systémom človeka – editorial. Vnitř Lék 2005; 51 : 1228–1231.
7. Jara LJ, Silviera LH, Cuellar MI et al. Hyperprolactinaemia in Reiter’s syndrome. J Rheumatol 1994; 21 : 1292–1297.
8. Jimena P, Aguirre MA, Lopez-Corbelo A et al. Prolactin levels in patients with systemic lupus erythematosus: a case controlled study. Lupus 1998; 7 : 383–386.
9. Jorgensen C, Bressot N, Bolognac C et al. Dysregulation of the hypothalamo-pituitary axis in the rheumatoid arthritis. J Rheumatol 1995; 22 : 1829–1833.
10. Jorgensen C, Mazaid H, Bologna C et al. Kinetics of prolactin release in a rheumatoid arthritis. Clin Exp Rheumatol 1995; 13 : 705–709.
11. Kawai T, Katoh K, Tani K. Hyperprolactinemia preceding development of autoimmune disease. J Rheumatol 1996; 23 : 1483–1484.
12. Macejová Ž, Nagyová I, Trejbal D et al. Vzťah medzi hodnotami prolaktínu a mierou funkčnej neschopnosti hodnotenej dotazníkom HAQ u pacientov sreumatoidnou artritídou. Vnitř Lék 2005; 51 : 1260–1265.
13. McMuray RW, Allen SH, Pepmeuller PH et al. Elevated serum prolactin levels in children with juvenile rheumatoid arthritis and antinuclear antibodies seropositivity. J Rheumatol 1995; 22 : 1577–1580.
14. Neidhard M. Elevated serum prolactin or elevated prolactin/cortisol ratio are associated with autoimmune processes in systemic lupus erythematosus and other connective tissue diseases. J Rheumatol 1996; 23 : 478–481.
15. Neidhart M. Prolactin in autoimmune disease. Proc Soc exp Biol Med 1998; 217 : 408–419.
16. Rezaieyazdi Z, Hesamifard A. Correlation between serum prolactin levels and lupus activity. Rheumatol Int 2006; 26 : 1036–1039.
17. Rovenský J, Dostál C, Lukáč J et al. Systémový lupus erythematosus. In: Ďuriš I et al. Princípy internej medicíny. Bratislava: Slovak Academic Press 2001, 1425–1434.
18. Rovenský J, Blažíková S, Rauová L et al. The hypothalamic-pituitary response in SLE. Regulation of prolactin, growth hormone and cortisol release. Lupus 1998; 7 : 409–413.
19. Rovenský J, Bakošová J, Koska J et al. Somatotropic, lactotropic and adrenocortical responses to insulin‑induced hypoglycemia in patients with rheumatoid arthritis. Ann NY Acad Sci 2002; 966 : 263–270.
20. Rovenský J, Bakošová J, Payer J et al. Increased demand for steroid therapy in hyperprolactinemic patients with rheumatoid arthritis. Int J Tissue React 2001; 23 : 145–149.
21. Szilasiová J, Klímová E. Susac Syndrome: Retinocochleocerebral Vasculopathy. Croatian Medical Journal 2004; 45 : 228–343.
22. Vera-Lastra O, Jara LJ, Medina G et al. Functional hyperprolactinemia and hypophyseal microadenoma in systemic sclerosis. J Rheumatol 2006; 33 : 1108–1112.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 11-
All articles in this issue
- Bezpečnost dlouhodobého podávání losartanu v běžné klinické praxi: neintervenční studie NCT-CZ 14/04/LOZ
- Prolaktín – marker aktivity systémových ochorení spojiva?
- Subklinické akutní rejekce v protokolárních biopsiích 3 měsíce po transplantaci ledviny
- Význam stanovování inhibinu B v klinické andrologické praxi
-
Histiocytóza z Langerhansových buněk u osob dospělého věku – nemoc s mnoha tvářemi.
Zkušenosti jednoho pracoviště a přehled projevů nemoci - Akutní embolizace do tepen splanchnického řečiště – přehled současných diagnostických přístupů a terapie
- Využití pozitronové emisní tomografie (18F‑FDG PET) v diagnostice chronických periaortitid
- Hypokalemická periodická paralýza u pacientů s hypertyreózou
- Nově diagnostikovaný syndrom Churga-Straussové u pacientky s podezřením na akutní koronární syndrom
- Perzistentní průjmy, hypotenze a polyneuropatie
- Vztah mezi familiární kombinovanou hyperlipidemií a inzulinovou rezistencí
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypokalemická periodická paralýza u pacientů s hypertyreózou
-
Histiocytóza z Langerhansových buněk u osob dospělého věku – nemoc s mnoha tvářemi.
Zkušenosti jednoho pracoviště a přehled projevů nemoci - Bezpečnost dlouhodobého podávání losartanu v běžné klinické praxi: neintervenční studie NCT-CZ 14/04/LOZ
- Význam stanovování inhibinu B v klinické andrologické praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

