-
Medical journals
- Career
Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV
Authors: J. Perušičová
Authors‘ workplace: Diabetologické centrum Interní kliniky 2. lékařské fakulty UK a FN Motol, Praha, přednosta prof. MUDr., Milan Kvapil, CSc.
Published in: Vnitř Lék 2007; 53(9): 1005-1009
Category: Review
Overview
Podání analoga GLP-1 rezistentního k účinku DPP-IV nebo terapeutická inhibice těchto enzymů, umožňující zvýšení hladin GLP-1, jsou zcela nové cesty v přístupu léčby diabetes mellitus 2. typu. Inkretinová terapeutická strategie v sobě skrývá velkou potenciální sílu pomoci zlepšit nemocným s cukrovkou jejich neuspokojivou kompenzaci, a tím snížit riziko manifestace všech cévních komplikací. Nízké cirkulující hladiny GLP-1 (i GIP) nalačno se rychle zvyšují po jídle a následně jsou degradovány účinkem dipeptidyl peptidáz IV (DPP-IV) na inaktivní formy. DPP-IV jsou široce přítomné enzymy v organizmu, které proteolyticky degradují GLP-1 a GIP (i další působky). Zabránění jejich inaktivačnímu působení podáním inhibitorů DPP-IV zajistí zvýšení hladin GLP-1, které jsou u diabetiků 2. typu snížené a následně zajistí zlepšení glukózové homeostázy u těchto nemocných. Inhibitory DPP-IV reprezentují hlavní novou třídu PAD a jejich metabolický profil nabízí řadu unikátních klinických výhod pro léčbu nemocných s diabetes mellitus 2. typu.
Klíčová slova:
GLP-1 - DPP-IV - diabetes mellitus 2. typuÚvod
Myšlenka, že působky uvolňované ze střeva se účastní také regulace endokrinní sekrece v ostrůvkových buňkách slinivky břišní, není nová. Prvně se o ní můžeme dočíst již před více jak 100 lety (ještě v předinzulinové éře) [28]. Také gastroenterologové znají již dlouhou dobu pojem entero-inzulinární osa [33]. Ale teprve dostupnost laboratorního stanovení hladin inzulinu v krvi odstartovala rozvoj poznání a pochopení mechanizmů, kterými střevní působky (hormony) ovlivňují metabolizmus glukózy. Pokud je stejné množství glukózy podáváno ústy a intravenózně, hladiny glukózy v krvi jsou identické, ale po perorálním podání je odezva v inzulinové sekreci vyšší (obr. 1). To znamená, že glukóza není jedinou molekulou, která stimuluje uvolňování inzulinu v B-buňkách, ale na zvýšení sekrece se podílejí také střevní působky. Tento fenomén (tj. vyšší sekrece inzulinu po perorálním podání glukózy) se nazývá „inkretinový efekt“ a látky, které jej vyvolávají, jsou „inkretiny“ [9]. U lidí jsou nejdůležitějšími inkretiny glukagon-like peptid 1 (GLP-1) a na glukóze závislý uvolňující se polypeptid (GIP - glucose dependent insulin releasing polypeptide). GIP byl dříve označován jako gastrický inhibiční polypeptid. Oba jmenované hormony jsou členy glukagonové „superrodiny“ [3,4,6,20,34].
Image 1. „Inkretinový efekt“ – hladiny inzulinu v krvi po podání glukózy perorálně a intravenózně u neobézních zdravých osob. 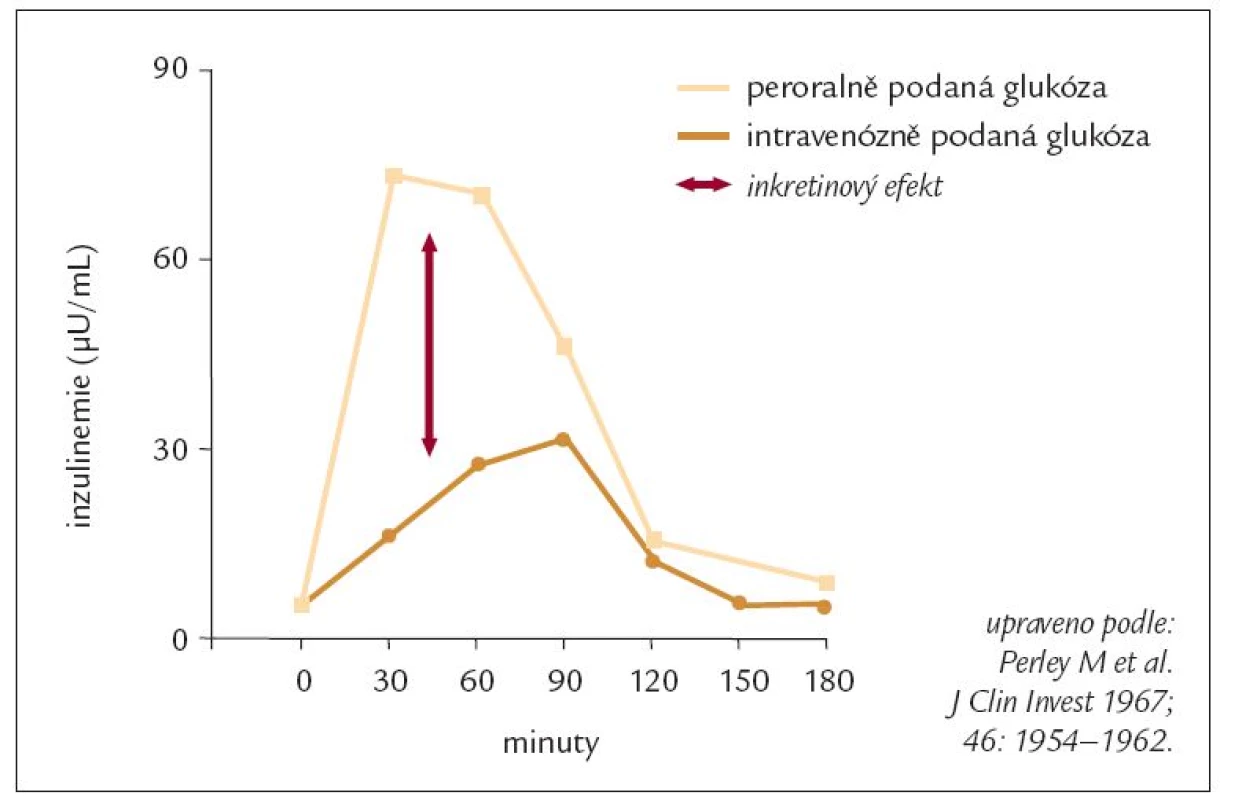
Z hlediska ovlivnění glukózového metabolizmu je významnější GLP-1, který je uvolňován z mukozálních endokrinních L-buněk distální části střev (ileum a kolón). Cirkulující hladiny GLP-1(i GIP) jsou ve stadiu lačnění velmi nízké, ale rychle se zvyšují po jídle, aby byly v zápětí degradovány účinkem dipeptidyl peptidáz IV na inaktivní formy [12]. Dipeptidyl peptidázy IV (DPP-IV) tak oba inkretiny mění na noninzulinotropní látky. GLP-1 není zvýšeně uvolňován pouze vlivem podaného jídla, ale také stimulací sympatické nervové soustavy (například fyzickou aktivitou).
DPP-IV jsou široce přítomné enzymy včetně vilózního vaskulárního endotelu kapilár a z toho plyne, že většina GLP-1 a GIP, když se dostávají do portálního řečiště, jsou již v inaktivní formě. Po podání inkretinů intravenózně zdravým osobám i nemocným s diabetes mellitus 2. typu (DM2T) je jejich poločas u GIP 5-7 min a GLP-1, který má 2 bioaktivní formy (7-37 a 7-36 amid), pouze 1-2 min. Účinek GLP-1 je zprostředkován vazbou na specifické receptory, které se nacházejí v gastrointestinálním traktu (GIT), endokrinním pankreatu (v A - i B-buňkách), plicích, ledvinách, srdci a mozku (hypotalamus, area postrema). Důležitou roli při vylučování GLP-1 hrají ledviny (cestou glomerulární filtrace i tabulárního katabolizmu). Rychlé odstranění GLP-1 z plazmy ale nekoreluje s dobou jeho účinku [7,14,25-27,35,39].
Fyziologické působení GLP-1 uvádí v přehledu tab. 1. Je prokázáno, že u diabetiků 2. typu je uvolňování (sekrece) GLP-1 snížená, ale odezva organizmu na jeho působení je zachovalá. To znamená, že plazmatická koncentrace GLP-1 je u nemocných s DM2T i porušenou glukózovou tolerancí (PGT) snížená v porovnání s odpovídajícím věkem a BMI zdravým osobám [31]. GLP-1, který je uvolňován po jídle, zvyšuje glukózou indukovanou inzulinovou sekreci, potlačuje jaterní produkci glukózy (snižuje sekreci glukagonu v A-buňkách pankreatických ostrůvků) a indukuje také pocit sytosti. Na menším zvýšení glykemií po jídle se může podílet i snížená motilita žaludku a tenkého střeva vlivem GLP-1.
Table 1. Biologické mnohonásobné působení GLP-1. 
GLP-1 má ale i jiné, přímé, nemetabolické vlivy na pankreatické buňky. Na jedné straně zvyšuje proliferaci B-buněk a na straně druhé snižuje jejich apoptózu. Tak ve svém důsledku přispívá ke zvýšení masy B-buněk a zajišťuje zdroj inzulinové sekrece. Mnohočetné působení GLP-1 v organizmu ovlivňující glukózový metabolizmus může znamenat, že v rozvoji DM2T typu hraje porušená funkce inkretinů patogenetickou roli.
Normalizace inkretinové cesty představuje nový přístup k léčbě DM2T.
Pokud vycházíme z výše uvedených informacích o limitaci možnosti použití nativní molekuly GLP-1 v léčebném procesu, kterou je jejich velmi krátký poločas účinku díky degradaci enzymy DPP-IV, pak se nabízejí 2 alternativní cesty vývoje farmakologicky účinného léku:
- vývoj analoga GLP-1, který by byl rezistentní k působení dipeptidyl peptidáz IV (inkretinová mimetika),
- vývoj inhibitorů DPP-IV, které by zabránily rychlé enzymatické degradaci endogenního glukagon-like peptidu 1 (inkretinové zvyšovače).
Prevalence DM2T se stále významně zvyšuje. Současné léčebné možnosti nejsou schopné efektivně snížit nebo zvrátit progresi choroby a zabránit postupné manifestaci chronických komplikací diabetu. Proto se stále ozývají hlasy odborníků s požadavkem nových léčebných prostředků. Inkretinový léčebný přístup takovou novou a úspěšnou farmakoterapii nabízí.
DPP-IV rezistentní analoga GLP-1
V přírodě existuje exendin-4, což je peptid izolovaný ze slin americké ještěrky, který má obdobné vlastnosti a účinky jako GLP-1, váže se na jeho receptory, ale nepodléhá enzymatickému štěpení dipetidyl peptidázami. Byla vyrobena jeho syntetická verze pod názvem exenatid. Preparát byl vyzkoušen a bylo prokázáno, že po jeho podání dochází ke snížené motilitě a potlačení sekrece kyselin žaludku, snížení motility tenkého střeva a zpomalení absorpce živin s následným snížením postprandiálních fluktuací glykemií.
Již první velké klinické studie, které byly publikovány v letech 2004-2005, dokladovaly nejenom redukci HbA1c a pokles glykemie nalačno i postprandiálně u diabetiků 2. typu neuspokojivě kompenzovaných dosavadní léčbou metforminem, sulfonylureovými deriváty i kombinaci obou, ale jeho podávání vedlo k dlouhodobému a významnému poklesu hmotnosti. Léčba je ale provázena vedlejšími gastrointestinálními příznaky, z nichž je dominující mírná až střední nauzea, jejíž frekvence a intenzita je závislá na podávané dávce (incidence 33-47 %), následovaná zvracením, případně průjmem (v průměru u 10-13 % nemocných) [5,8,19,30].
Prvním dostupným lékem ze skupiny „inkretinových mimetik“ s prokázanou bezpečností a dobrou tolerancí nemocnými s DM2Tje exenatid s názvem Byetta, která byla schválena k běžnému používání v dubnu roku 2005. Byetta je určena k parenterální aplikaci (subkutánní injekce) 2krát denně ve fixní dávce 5 µg nebo 10 µg a na trhu je v kartridžích v předplněných aplikačních perech.
Druhým GLP-1 analogem, který se v blízké budoucnosti dostane na trh, je liraglutid, acylovaný, dlouze působící analog GLP-1, u kterého je významně snížená degradace jeho molekuly enzymatickými DPP-IV. Také u tohoto preparátu již první klinické studie dokumentovaly , že liraglutid je plný agonista GLP-IV receptorů a jeho podání je provázeno zlepšením všech porušených aktivit GLP-1. Poločas liraglutidu je delší než exenatidu Byetta (12-14 hod), a proto je dostačující jeho aplikace 1krát denně.
Obě uvedená analoga GLP-1 mají v léčbě diabetiků 2. typu 3 velké přednosti před jinými perorálními antidiabetiky (PAD) nebo inzulinem:
- nezpůsobují hypoglykemie (hypoglykemie mohou být rizikem při současném podávání sulfonylureových PAD)
- podporují sekreci inzulinu i u těch nemocných, kteří již nereagují na sulfonylureové deriváty zvýšením sekrece inzulinu
- významně snižují hmotnost
Jejich relativními nevýhodami jsou:
- injekční podávání
- vedlejší účinky na GIT
Inhibitory pipeptidyl peptidáz IV
DPP-IV jsou hlavní inaktivující enzymy GLP-1. Svým složením jde o dva transmembranózní glykoproteiny, které mají duální funkci: jako regulující proteázy a jako vázající proteiny. Kromě GLP-1 jsou jejich dalšími substráty peptidy, které mají alanin nebo prolin jako předposlední N-terminální aminokyselinu - neuropeptid Y (NPY), peptid YY, GHRH (growth hormone-releasing hormone), GIP, parakrinní chemokiny, makrofágy uvolňované chemokiny i gliadin (na prolin bohatý protein).
Odhalení situace, že DPP-IV degradují GLP-1 v plazmě, a to jak endogenního glukagon-like peptidu, tak i exogenně podaného, otevřelo zcela novou strategii léčby nemocných s DM2T. Druhou alternativní inkretinovou terapeutickou cestou, která by také zajistila zvýšení hladin GLP-1, je dočasně zamezit degradačnímu účinku DPP-IV vývojem inhibitorů účinku těchto enzymů [1,2].
Při hledání vhodné molekuly zjistili autoři, že existuje řada chemických látek, které reverzibilně blokují působení DPP-IV. Mezi používanými PAD je to např. metformin, který vykazuje blokující účinky na DPP-IV [37,38]. Např. u metforminu je po podání 1 g perorálně dosažena jeho koncentrace v krvi 20 µmol/l. A bylo prokázáno, že hladina 25 µmol/l je již dostatečně efektivní k potlačení aktivity DPP-IV (návrat k bazální aktivitě je do 24 hod). Z důvodů inhibice DPP-IV by bylo lépe podávat nemocným metformin 2-3krát denně. Skupina odborníků v čele s Lindsayem sledovala u 8 obézních diabetiků 2. typu s HbA1c 7,8 ± 0,6 % aktivitu dipeptidyl peptidáz IV po podávání metforminu nebo placeba. U skupiny nemocných po podání metforminu došlo k významnému snížení aktivity DPP-IV, zatímco po placebu nebyla žádná změna zaznamenána [24]. Ne všichni, kdo se problematice metforminu jako inhibitoru DPP-IV zabývali, tento vliv jednoznačně potvrdili. Sice ještě není jasné, zda prokázaný akutní vliv metforminu bude zjistitelný i při jeho chronickém podávání nemocným s DM2T, ale jistě se seznamujeme s novým možným mechanizmem působení metforminu na snížení hyperglykemií. I když tímto způsobem neovlivní metforminu příliš glykemii a inzulinemii nalačno, tak se jistě podílí na snížení postprandiálních glykemií tím, že přispívá k redukci degradace entero-inzulinárních hormonů po jídle. I další látky s určitým inhibujícím vlivem na působení DPP-IV se našly především ve skupině perorálních antidiabetik. Postupně bylo prokázáno, že mírně degradující účinek na DPP-IV prokazují deriváty thiazolidindionů, sulfonylureová PAD a meglitinidy. Ovšem tyto látky působí účinně až ve vysokých koncentracích, které se běžně v klinické praxi pro léčbu DM2T neužívají. Zatím má nejvíce důkazů o inhibičním působení metformin a ze všech ostatních PAD se zdá být nejsilnějším nateglinid [10,11,15,16].
Japonští autoři v tomto roce publikovali zajímavou experimentální práci - vycházeli ze skutečnosti, že PAD akarbóza a voglibóza (inhibitory α-glukozidáz) mají stejné cílové místo pro snižování hyperglykemií po jídle jako DPP-IV. Experimentálními zvířaty byli normální myši, u kterých autoři testovali účinek obou léků na postprandiální glykemie po testovacích jídlech s odlišným obsahem glycidůa tuku [36]. Zjistili, že:
- a) DPP-IV inhibitory vykazují oproti inhibitorům α-glukozidáz konzistentnější snížení postprandiálních glykemií, a to nezávisle na typu a množství glycidů v testovacím jídle
- b) kombinace DPP-IV inhibitorů a inhibitorů α-glukozidáz se dá považovat za slibnou léčebnou strategii pro snížení hladin glykemií po jídle
Jedním z prvních reverzibilních inhibitorů dipeptidyl peptidáz, který byl zkoušen v klinické studii, byl diprotin A a po něm řada dalších podobných molekul, ale jejich inhibiční vliv (i když ve studiích in vitro slibný) byl in vivo nedostatečný a prodloužení účinku GLP-1 v organizmu nedokázalo významněji zvýšit působení GLP-1 na glukózový metabolizmus.
Inhibitory DPP-IV byly původně vyvíjeny pouze jako látky dočasně omezující degradační schopnosti tohoto enzymu vůči GLP-1, ale později se ukázalo, že účinné inhibitory mají i jiné působící vlivy:
- stabilizují ostatní inkretiny (GIP, PACAP - pituitární adenyl-cyklázu aktivující peptid)
- snižují antagonistický vliv tvořících se fragmentů inkretinů
Podání inhibitorů degradace inkretinů zvyšuje cirkulující hladiny biologicky aktivních forem, ale celková hladina GLP-1 a GIP (degradované a intaktní peptidy) je spíše snížená (v experimentálních studií na psech [17].
Kritickou rolí DPP-IV je fyziologicky kontrolovat glukózovou homeostázu, a proto jsou tyto enzymy potenciálním cílem pro léčbu DM2T. Na jedné straně bylo odhaleno, že pravděpodobně existují i non-DPP-IV mechanizmy degradace GLP-1 (např. neutrální endopeptidázy) [18]. Dipeptidyl peptidázy IV jsou široce přítomné enzymy v organizmu. Proto zůstává na druhé straně otázkou, jak se projeví skutečnost, že DPP-IV degradují i jiné fyziologicky produkované bioaktivní peptidy a jak se na jejich hladinách i účinku v organizmu projeví blokace těchto enzymů. Farmaceutické firmy v poslední době vycházely z těchto dvou skutečností a snažily se o vývoj vysoce selektivních inhibitorů zmíněných serinových dipeptidyl peptidáz IV, které by ovlivňovaly především gastrointestinální inkretiny účastnící se regulace glukózového metabolizmu a které by tak byly vhodnými antidiabetickými léky pro klinickou praxi.
Dále je důležité připomenout, že DPP-IV mohou hrát důležitou roli v imunitní odezvě organizmu. Někteří autoři klinických studií potvrdili, že DPP-IV působí jako stimulační lymfocytární molekula vázající se na mimobuněčnou bílkovinnou matrix. Nadto je tímto serinovým typem proteáz degradována i řada cytokinů a růstových faktorů. Tyto nálezy evokují představu, že DPP-IV hrají určitou roli jednak v manifestaci některých imunologických onemocněních, jako je revmatoidní artritida, a jednak mohou být spoluzodpovědny za imunitní reakce po transplantacích [21-23].
Zajímavé zjištění publikoval Green se svými spoluautory: enzymatická, proteolytická degradace inkretinů vlivem působení DPP-IV vede k tvorbě fragmentů těchto peptidů, které (na rozdíl od původní molekuly) nemají inzulinotropní aktivitu [13].
Největší pozornost je v poslední době věnována 3 inhibitorům DPP-IV: sitagliptinu, vildagliptinu a saxagliptinu.
prof. MUDr. Jindřiška Perušičová, DrSc.
www.fnmotol.cz
e-mail: jindra.perusicova@lfmotol.cuni.cz
Doručeno do redakce: 20. 6. 2007
Přijato po recenzi: 17. 8. 2007
Sources
1. Ahrén B. What mediate the benefits associated with dipeptidyl peptidase-IV inhibition? Diabetologia 2005; 48 : 605-607.
2. Ahrén B. Inhibition of dipeptidyl peptidase-IV reduces glycemia, sustains insulin levels and reduces glucagon levels in type 2 diabetes. J Clin Endocr Metab 2004; 89 : 2078-2084.
3. Ahrén B. Gut peptides and type 2 diabetes mellitus treatment. Curr Diab Rep 2003; 3 : 365-372.
4. Ahrén B Glucagon-like peptide 1 (GLP-1) - a gut hormone of potential interest in the treatment of diabetes. Bioesays 1998; 20 : 642-651.
5. Bray GM. Exenatide. Am J Health Syst Pharm 2006; 63 : 411-418.
6. Brunzell JD, Robertson RP, Lerner RL et al. Relationships between fasting plasma glucose levels and insulin secretion during intravenous glucose tolerance tests. J Clin Endocrinol Metab 1976; 42 : 222-229.
7. Burcelin R, Dolci W, Thorens B. Long-lasting antidiabetic effect of a dipeptidyl peptidase IV-resistant analog of glucagons-like peptide-1. Metabolism 1999; 48 : 252-258.
8. Buse JB, Henry RR, Han J et al. for the Exenatide-113 Clinical Study Group: Effects of exenatide (exendin-4) on glycemic control over 30 weeks in sulphonylurea-treated patients with type 2 diabetes. Diabetes Care 2004; 27 : 2628-2635.
9. Creutzfeldt W, Ebert R: New developments in the incretin concept. Diabetologia 1985; 28 : 565-573.
10. Drucker DJ. Minireview: the glucagon-like peptides. Endocrinology 2001; 142 : 521-527.
11. Drucker DJ. Therapeutic potential of dipeptidyl peptidase IV inhibitors for the treatment of type 2 diabetes. Expert Opin Invest Drugs 2003; 12 : 87-100.
12. Gautier JF, Fetita S, Sobngwi E et al. Biological actions of the incretins GIP and GLP-1 and therapeutic perspectives in patients with type 2 diabetes. Diabetes Metab 2005; 31 : 233-242.
13. Green BD, Irwin N, Flatt PR. Pituitary adenylate cyclase-activating peptide (PACAP): Assessment of dipeptidyl peptidase IV degradation, insulin-releasing activity and antidiabetic potential. Peptides 2006; 27 : 1349-1358.
14. Holst JJ, Deacon FC. Glucagon-like peptide-1 mediates the therapeutic actions of DPP-IV inhibitors. Diabetologia 2005; 48 : 612-615.
15. Hui H, Zhao X, Perfetti R. Structure and function studies of glucagon-like peptide 1 (GLP-1): the designing of a novel pharmacological agent for the treatment of diabetes. Diabetes Metab Res Rev 2005; 21 : 313-331.
16. Hui H, Farila L, Merkel P et al. The short half-life of glucagon-like peptide-1 in plasma does not reflect its long-lasting beneficial effects. Eur J Endocrinol 2002; 146 : 863-869.
17. Hu H, Norparvar A, Yhao X et al. Glucagon-like peptide-1 inhibits apoptosis of insulin secreting cells via a cyclic 5´adenosine monophosphate-dependent protein kinase A - and a phosphatidylinositol 3-kinase-dependent pathway. Endocrinology 2003; 144 : 1444-1455.
18. Hupe-Sodmann K, McGregor GP, Bridenbaugh R et al. Characterisation of the processing by human neutral endopeptidase 24.11 of GLP-1(7-36) amide and comparison of the substrate specificity of the enzyme for other glucagons-like peptides. Regul Pept 1995; 58 : 149-156.
19. Gedulin BR, Nikoulina SE, Smith PA et al. Exenatide (exendin 4) improves insulin sensitivity and -cell mass in insulin resistant obese fa/fa Ucker rats independent of glycemia and body weight. Endocrinology 2005; 146 : 2069-2076.
20. Iltz JL, Baker DE et al. Exenatide: An incretin mimetic for the treatment of type 2 diabetes mellitus. Clin Ther 2006; 28 : 652-664.
21. Jeanfavre DD, Woska JR, Pargelis CA et al. Effect of deoxycoformycin and Val-boroPro on the associated catalytic activities of lymphocyte CD26 and ecto-adenosine deaminase. Biochem Pharmacol 1996; 52 : 1757-1765.
22. Korom S, Meester I, Maas E et al. CD26 expression and enzymatic activity in recipients of kidney allografts. Transplant Proc 2002; 34 : 1753-1754.
23. Kubota T, Flentke GR, Bachovchin WW et al. Involement of dipeptidyl peptidase IV in an in vivo immune response. Clin Exp Immunol 1992; 89 : 192-197.
24. Lindsay JR, Duffyt NA, McKillop AM et al. Inhibition of dipeptidyl peptidase IV activity by oral metformin in type 2 diabetes. Diabet Med 2005; 22 : 654-657.
25. Mannucci E, Pala L, Ciani S et al. Hyperglycaemia increases dipeptidyl peptidase IV activity in diabetes mellitus. Diabetologia 2005; 48 : 1168-1172.
26. Mentlein R Dipetidyl-peptidase IV (CD26) - role in the inactivation of regulatory peptides. Regul Pept 1999; 85 : 9-24.
27. Mest HJ, Mentlein R. Dipeptidyl peptidase inhibitors as new drugs for the treatment of type 2 diabetes. Diabetologia 2005; 48 : 616-620.
28. Moore B, Edie ES, Abram JH. On the treatment of diabetes mellitus by acid extract of duodenal mucous membrane. Biochem J 1906; 1 : 28-38.
29. Nauck MA, El-Ouaghlidi A. The therapeutic actions of DPP-IV inhibition are not mediated by glucagons-like peptide-1. Diabetologia 2005; 48 : 608-611.
30. O’Harte FP, Abdel-Wahab YH, Conlon JM et al. Glycation of glucagon-like peptide-1(7-36) amide: characterization and impaired action on rat insulin secreting cells. Diabetologia 1998; 41 : 1187-1193.
31. Toft-Nielsen MB, Damholt MB, Madsbad S et al. Determinants of the impaired secretion of the glucagon-like peptide 1 in type 2 diabetes. J Clin Endocrinol Metab 2001; 86 : 3717-3723.
32. Tsu H, Chen X, Chen CT et al: 2-{3-{2-{(2S)-2-Cyano-1-pyrrolidinyl}-2-oxoethylamino}-3-methyl-1-oxobutyl}-1,2,3,4-tetrahydroisoquinoline: A potent, Sellective and Orally Bioavailable Dipeptide-Derived Inhibitor of Dipeptidyl Peptidase IV. J Med Chem 2006; 49 : 373-380.
33. Unger RH, Eisentraut AM. Entero-insular axis. Arch Intern Med 1969; 124 : 261-266.
34. Uwaifo GI, Ratner RE Novel pharmacologic agents for type 2 diabetes. Endocrinol Metab Clin N Am 2005; 34 : 155-197.
35. Weber AE. Dipeptidyl Peptidase IV inhibitors for the treatment of diabetes. J Med Chem 2004; 47 : 4135-4141.
36. Yamazaki K, Inoue T, Yasuda N et al. Comparison of efficacies of a dipeptidyl peptidase
IV inhibitor and alfa-glucosidase inhibitors in oral carbohydrate and meal tolerance tests and the effects of their combination in mice. J Pharmacol Sci 2007; 104 : 29-38.
37. Yasuda N, Inoue T et al. Enhanced secretion of glucagon-like peptide 1 by biguanide compounds. Biochem Biophy Res Commun 2002; 298 : 779-784.
38. Zander M, Taskiran M et al. Additive glucose-lowering effects of glucagon-like peptide-1 and metformin in type 2 diabetes. Diabetes Care 2001; 24 : 720-725.
39. Zander M, Madsbad S, Deacon CF et al. The metabolite generated by dipeptidyl-peptidase 4 metabolism of glucagon-like peptide-1 has no influence on plasma glucose levels in patients with type 2 diabetes. Diabetologia 2005; 49 : 369-374.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 9-
All articles in this issue
- Výsledek celotělového FDG-PET vyšetření predikuje osud nemocných s difuzním velkobuněčným lymfomem jak při použití v intermediárním stagingu, tak při použití na konci standardní chemoterapie
- Dlouhodobé sledování pacientů s klinickými známkami krvácení do horní části trávicího traktu a negativním endoskopickým nálezem
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
- Immodin v léčbě imunoparalýzy nemocných v intenzivní péči
- Sérová hladina retinol-binding proteinu 4 u obéznych s inzulínovou rezistenciou a jedincov s diabetom 2. typu liečených metformínom
- QT dynamicita v rizikové stratifikaci u pacientů po infarktu myokardu
- Endoskopické nálezy v horním trávicím traktu u pacientů s jaterní cirhózou
- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Současné možnosti robotické kardiochirurgie
- Časná diagnostika invazivních mykotických infekcí u hematoonkologických nemocných pomocí sérologických metod
- Primárny aldosteronizmus
- Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Primárny aldosteronizmus
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

