-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV
Incretin strategy in the treatment of type 2 diabetes mellitus - DPPIV
Administration of GLP-1 analogue resistant to DPPIV or therapeutic inhibition of the enzymes, allowing for an increase in the levels of GLP-1, are the very new approaches to the treatment of type 2 diabetes mellitus. Incretin therapy has an immense potential of improving unsatisfactory compensation in diabetic patients thus reducing the risk of manifestation of all arterial complications. Low fasting circulating levels of GLP-1 (and also GIP) grow rapidly after eating and are subsequently degraded to inactive forms by dipeptidyl peptidases IV (DPPIV). DPPIV are enzymes widely present in the body which proteolytically degrade GLP - 1 and GIP (as well as other active substances). The preventing of their inactivation effect by administering DPPIV inhibitors allows for increasing the GLP-1 levels, which are reduced in type 2 diabetic patients, and subsequently improves glucose homeostasis in such patients. DPPIV inhibitors represent the principal new class of PAD, and their metabolic profile offers a number of unique clinical advantages for the treatment of patients with type 2 diabetes mellitus.
Key words:
GLP-1 – DPPIV – type 2 diabetes mellitus
Autoři: J. Perušičová
Působiště autorů: Diabetologické centrum Interní kliniky 2. lékařské fakulty UK a FN Motol, Praha, přednosta prof. MUDr., Milan Kvapil, CSc.
Vyšlo v časopise: Vnitř Lék 2007; 53(9): 1005-1009
Kategorie: Přehledný referát
Souhrn
Podání analoga GLP-1 rezistentního k účinku DPP-IV nebo terapeutická inhibice těchto enzymů, umožňující zvýšení hladin GLP-1, jsou zcela nové cesty v přístupu léčby diabetes mellitus 2. typu. Inkretinová terapeutická strategie v sobě skrývá velkou potenciální sílu pomoci zlepšit nemocným s cukrovkou jejich neuspokojivou kompenzaci, a tím snížit riziko manifestace všech cévních komplikací. Nízké cirkulující hladiny GLP-1 (i GIP) nalačno se rychle zvyšují po jídle a následně jsou degradovány účinkem dipeptidyl peptidáz IV (DPP-IV) na inaktivní formy. DPP-IV jsou široce přítomné enzymy v organizmu, které proteolyticky degradují GLP-1 a GIP (i další působky). Zabránění jejich inaktivačnímu působení podáním inhibitorů DPP-IV zajistí zvýšení hladin GLP-1, které jsou u diabetiků 2. typu snížené a následně zajistí zlepšení glukózové homeostázy u těchto nemocných. Inhibitory DPP-IV reprezentují hlavní novou třídu PAD a jejich metabolický profil nabízí řadu unikátních klinických výhod pro léčbu nemocných s diabetes mellitus 2. typu.
Klíčová slova:
GLP-1 - DPP-IV - diabetes mellitus 2. typuÚvod
Myšlenka, že působky uvolňované ze střeva se účastní také regulace endokrinní sekrece v ostrůvkových buňkách slinivky břišní, není nová. Prvně se o ní můžeme dočíst již před více jak 100 lety (ještě v předinzulinové éře) [28]. Také gastroenterologové znají již dlouhou dobu pojem entero-inzulinární osa [33]. Ale teprve dostupnost laboratorního stanovení hladin inzulinu v krvi odstartovala rozvoj poznání a pochopení mechanizmů, kterými střevní působky (hormony) ovlivňují metabolizmus glukózy. Pokud je stejné množství glukózy podáváno ústy a intravenózně, hladiny glukózy v krvi jsou identické, ale po perorálním podání je odezva v inzulinové sekreci vyšší (obr. 1). To znamená, že glukóza není jedinou molekulou, která stimuluje uvolňování inzulinu v B-buňkách, ale na zvýšení sekrece se podílejí také střevní působky. Tento fenomén (tj. vyšší sekrece inzulinu po perorálním podání glukózy) se nazývá „inkretinový efekt“ a látky, které jej vyvolávají, jsou „inkretiny“ [9]. U lidí jsou nejdůležitějšími inkretiny glukagon-like peptid 1 (GLP-1) a na glukóze závislý uvolňující se polypeptid (GIP - glucose dependent insulin releasing polypeptide). GIP byl dříve označován jako gastrický inhibiční polypeptid. Oba jmenované hormony jsou členy glukagonové „superrodiny“ [3,4,6,20,34].
Obr. 1. „Inkretinový efekt“ – hladiny inzulinu v krvi po podání glukózy perorálně a intravenózně u neobézních zdravých osob. 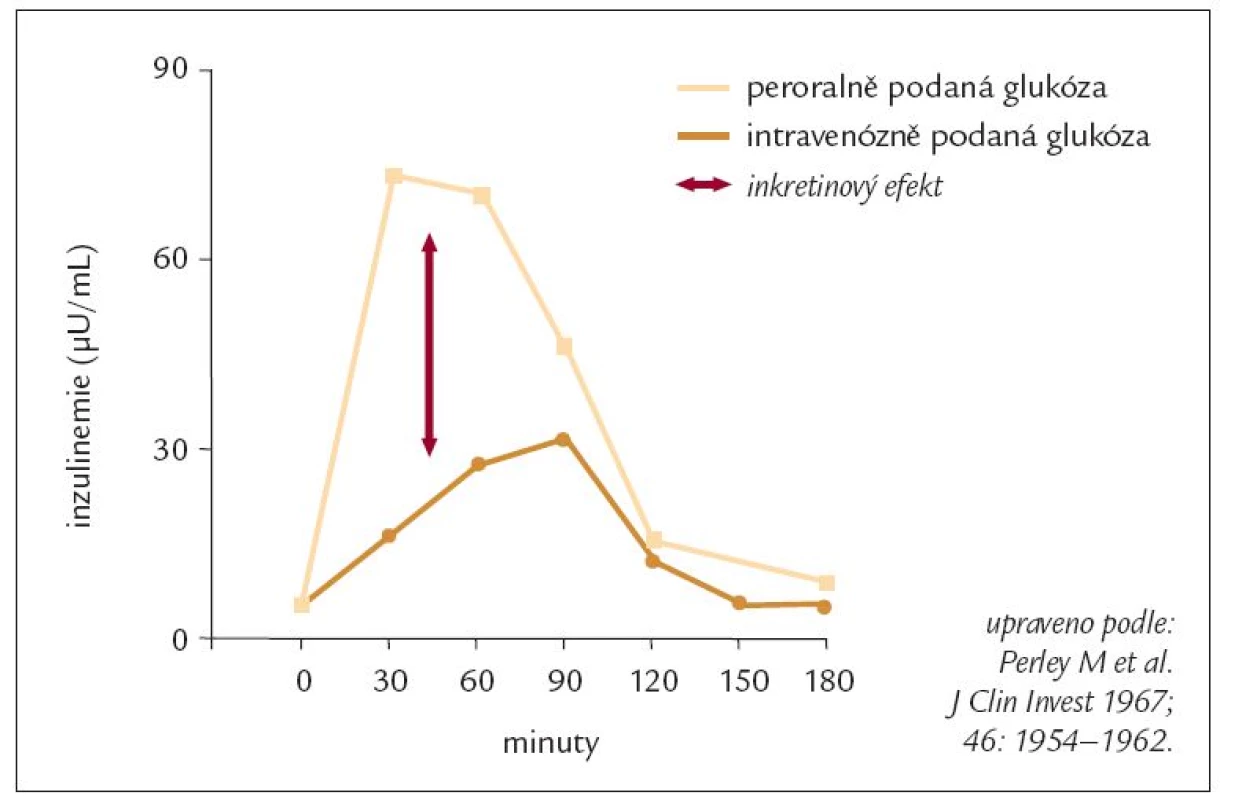
Z hlediska ovlivnění glukózového metabolizmu je významnější GLP-1, který je uvolňován z mukozálních endokrinních L-buněk distální části střev (ileum a kolón). Cirkulující hladiny GLP-1(i GIP) jsou ve stadiu lačnění velmi nízké, ale rychle se zvyšují po jídle, aby byly v zápětí degradovány účinkem dipeptidyl peptidáz IV na inaktivní formy [12]. Dipeptidyl peptidázy IV (DPP-IV) tak oba inkretiny mění na noninzulinotropní látky. GLP-1 není zvýšeně uvolňován pouze vlivem podaného jídla, ale také stimulací sympatické nervové soustavy (například fyzickou aktivitou).
DPP-IV jsou široce přítomné enzymy včetně vilózního vaskulárního endotelu kapilár a z toho plyne, že většina GLP-1 a GIP, když se dostávají do portálního řečiště, jsou již v inaktivní formě. Po podání inkretinů intravenózně zdravým osobám i nemocným s diabetes mellitus 2. typu (DM2T) je jejich poločas u GIP 5-7 min a GLP-1, který má 2 bioaktivní formy (7-37 a 7-36 amid), pouze 1-2 min. Účinek GLP-1 je zprostředkován vazbou na specifické receptory, které se nacházejí v gastrointestinálním traktu (GIT), endokrinním pankreatu (v A - i B-buňkách), plicích, ledvinách, srdci a mozku (hypotalamus, area postrema). Důležitou roli při vylučování GLP-1 hrají ledviny (cestou glomerulární filtrace i tabulárního katabolizmu). Rychlé odstranění GLP-1 z plazmy ale nekoreluje s dobou jeho účinku [7,14,25-27,35,39].
Fyziologické působení GLP-1 uvádí v přehledu tab. 1. Je prokázáno, že u diabetiků 2. typu je uvolňování (sekrece) GLP-1 snížená, ale odezva organizmu na jeho působení je zachovalá. To znamená, že plazmatická koncentrace GLP-1 je u nemocných s DM2T i porušenou glukózovou tolerancí (PGT) snížená v porovnání s odpovídajícím věkem a BMI zdravým osobám [31]. GLP-1, který je uvolňován po jídle, zvyšuje glukózou indukovanou inzulinovou sekreci, potlačuje jaterní produkci glukózy (snižuje sekreci glukagonu v A-buňkách pankreatických ostrůvků) a indukuje také pocit sytosti. Na menším zvýšení glykemií po jídle se může podílet i snížená motilita žaludku a tenkého střeva vlivem GLP-1.
Tab. 1. Biologické mnohonásobné působení GLP-1. 
GLP-1 má ale i jiné, přímé, nemetabolické vlivy na pankreatické buňky. Na jedné straně zvyšuje proliferaci B-buněk a na straně druhé snižuje jejich apoptózu. Tak ve svém důsledku přispívá ke zvýšení masy B-buněk a zajišťuje zdroj inzulinové sekrece. Mnohočetné působení GLP-1 v organizmu ovlivňující glukózový metabolizmus může znamenat, že v rozvoji DM2T typu hraje porušená funkce inkretinů patogenetickou roli.
Normalizace inkretinové cesty představuje nový přístup k léčbě DM2T.
Pokud vycházíme z výše uvedených informacích o limitaci možnosti použití nativní molekuly GLP-1 v léčebném procesu, kterou je jejich velmi krátký poločas účinku díky degradaci enzymy DPP-IV, pak se nabízejí 2 alternativní cesty vývoje farmakologicky účinného léku:
- vývoj analoga GLP-1, který by byl rezistentní k působení dipeptidyl peptidáz IV (inkretinová mimetika),
- vývoj inhibitorů DPP-IV, které by zabránily rychlé enzymatické degradaci endogenního glukagon-like peptidu 1 (inkretinové zvyšovače).
Prevalence DM2T se stále významně zvyšuje. Současné léčebné možnosti nejsou schopné efektivně snížit nebo zvrátit progresi choroby a zabránit postupné manifestaci chronických komplikací diabetu. Proto se stále ozývají hlasy odborníků s požadavkem nových léčebných prostředků. Inkretinový léčebný přístup takovou novou a úspěšnou farmakoterapii nabízí.
DPP-IV rezistentní analoga GLP-1
V přírodě existuje exendin-4, což je peptid izolovaný ze slin americké ještěrky, který má obdobné vlastnosti a účinky jako GLP-1, váže se na jeho receptory, ale nepodléhá enzymatickému štěpení dipetidyl peptidázami. Byla vyrobena jeho syntetická verze pod názvem exenatid. Preparát byl vyzkoušen a bylo prokázáno, že po jeho podání dochází ke snížené motilitě a potlačení sekrece kyselin žaludku, snížení motility tenkého střeva a zpomalení absorpce živin s následným snížením postprandiálních fluktuací glykemií.
Již první velké klinické studie, které byly publikovány v letech 2004-2005, dokladovaly nejenom redukci HbA1c a pokles glykemie nalačno i postprandiálně u diabetiků 2. typu neuspokojivě kompenzovaných dosavadní léčbou metforminem, sulfonylureovými deriváty i kombinaci obou, ale jeho podávání vedlo k dlouhodobému a významnému poklesu hmotnosti. Léčba je ale provázena vedlejšími gastrointestinálními příznaky, z nichž je dominující mírná až střední nauzea, jejíž frekvence a intenzita je závislá na podávané dávce (incidence 33-47 %), následovaná zvracením, případně průjmem (v průměru u 10-13 % nemocných) [5,8,19,30].
Prvním dostupným lékem ze skupiny „inkretinových mimetik“ s prokázanou bezpečností a dobrou tolerancí nemocnými s DM2Tje exenatid s názvem Byetta, která byla schválena k běžnému používání v dubnu roku 2005. Byetta je určena k parenterální aplikaci (subkutánní injekce) 2krát denně ve fixní dávce 5 µg nebo 10 µg a na trhu je v kartridžích v předplněných aplikačních perech.
Druhým GLP-1 analogem, který se v blízké budoucnosti dostane na trh, je liraglutid, acylovaný, dlouze působící analog GLP-1, u kterého je významně snížená degradace jeho molekuly enzymatickými DPP-IV. Také u tohoto preparátu již první klinické studie dokumentovaly , že liraglutid je plný agonista GLP-IV receptorů a jeho podání je provázeno zlepšením všech porušených aktivit GLP-1. Poločas liraglutidu je delší než exenatidu Byetta (12-14 hod), a proto je dostačující jeho aplikace 1krát denně.
Obě uvedená analoga GLP-1 mají v léčbě diabetiků 2. typu 3 velké přednosti před jinými perorálními antidiabetiky (PAD) nebo inzulinem:
- nezpůsobují hypoglykemie (hypoglykemie mohou být rizikem při současném podávání sulfonylureových PAD)
- podporují sekreci inzulinu i u těch nemocných, kteří již nereagují na sulfonylureové deriváty zvýšením sekrece inzulinu
- významně snižují hmotnost
Jejich relativními nevýhodami jsou:
- injekční podávání
- vedlejší účinky na GIT
Inhibitory pipeptidyl peptidáz IV
DPP-IV jsou hlavní inaktivující enzymy GLP-1. Svým složením jde o dva transmembranózní glykoproteiny, které mají duální funkci: jako regulující proteázy a jako vázající proteiny. Kromě GLP-1 jsou jejich dalšími substráty peptidy, které mají alanin nebo prolin jako předposlední N-terminální aminokyselinu - neuropeptid Y (NPY), peptid YY, GHRH (growth hormone-releasing hormone), GIP, parakrinní chemokiny, makrofágy uvolňované chemokiny i gliadin (na prolin bohatý protein).
Odhalení situace, že DPP-IV degradují GLP-1 v plazmě, a to jak endogenního glukagon-like peptidu, tak i exogenně podaného, otevřelo zcela novou strategii léčby nemocných s DM2T. Druhou alternativní inkretinovou terapeutickou cestou, která by také zajistila zvýšení hladin GLP-1, je dočasně zamezit degradačnímu účinku DPP-IV vývojem inhibitorů účinku těchto enzymů [1,2].
Při hledání vhodné molekuly zjistili autoři, že existuje řada chemických látek, které reverzibilně blokují působení DPP-IV. Mezi používanými PAD je to např. metformin, který vykazuje blokující účinky na DPP-IV [37,38]. Např. u metforminu je po podání 1 g perorálně dosažena jeho koncentrace v krvi 20 µmol/l. A bylo prokázáno, že hladina 25 µmol/l je již dostatečně efektivní k potlačení aktivity DPP-IV (návrat k bazální aktivitě je do 24 hod). Z důvodů inhibice DPP-IV by bylo lépe podávat nemocným metformin 2-3krát denně. Skupina odborníků v čele s Lindsayem sledovala u 8 obézních diabetiků 2. typu s HbA1c 7,8 ± 0,6 % aktivitu dipeptidyl peptidáz IV po podávání metforminu nebo placeba. U skupiny nemocných po podání metforminu došlo k významnému snížení aktivity DPP-IV, zatímco po placebu nebyla žádná změna zaznamenána [24]. Ne všichni, kdo se problematice metforminu jako inhibitoru DPP-IV zabývali, tento vliv jednoznačně potvrdili. Sice ještě není jasné, zda prokázaný akutní vliv metforminu bude zjistitelný i při jeho chronickém podávání nemocným s DM2T, ale jistě se seznamujeme s novým možným mechanizmem působení metforminu na snížení hyperglykemií. I když tímto způsobem neovlivní metforminu příliš glykemii a inzulinemii nalačno, tak se jistě podílí na snížení postprandiálních glykemií tím, že přispívá k redukci degradace entero-inzulinárních hormonů po jídle. I další látky s určitým inhibujícím vlivem na působení DPP-IV se našly především ve skupině perorálních antidiabetik. Postupně bylo prokázáno, že mírně degradující účinek na DPP-IV prokazují deriváty thiazolidindionů, sulfonylureová PAD a meglitinidy. Ovšem tyto látky působí účinně až ve vysokých koncentracích, které se běžně v klinické praxi pro léčbu DM2T neužívají. Zatím má nejvíce důkazů o inhibičním působení metformin a ze všech ostatních PAD se zdá být nejsilnějším nateglinid [10,11,15,16].
Japonští autoři v tomto roce publikovali zajímavou experimentální práci - vycházeli ze skutečnosti, že PAD akarbóza a voglibóza (inhibitory α-glukozidáz) mají stejné cílové místo pro snižování hyperglykemií po jídle jako DPP-IV. Experimentálními zvířaty byli normální myši, u kterých autoři testovali účinek obou léků na postprandiální glykemie po testovacích jídlech s odlišným obsahem glycidůa tuku [36]. Zjistili, že:
- a) DPP-IV inhibitory vykazují oproti inhibitorům α-glukozidáz konzistentnější snížení postprandiálních glykemií, a to nezávisle na typu a množství glycidů v testovacím jídle
- b) kombinace DPP-IV inhibitorů a inhibitorů α-glukozidáz se dá považovat za slibnou léčebnou strategii pro snížení hladin glykemií po jídle
Jedním z prvních reverzibilních inhibitorů dipeptidyl peptidáz, který byl zkoušen v klinické studii, byl diprotin A a po něm řada dalších podobných molekul, ale jejich inhibiční vliv (i když ve studiích in vitro slibný) byl in vivo nedostatečný a prodloužení účinku GLP-1 v organizmu nedokázalo významněji zvýšit působení GLP-1 na glukózový metabolizmus.
Inhibitory DPP-IV byly původně vyvíjeny pouze jako látky dočasně omezující degradační schopnosti tohoto enzymu vůči GLP-1, ale později se ukázalo, že účinné inhibitory mají i jiné působící vlivy:
- stabilizují ostatní inkretiny (GIP, PACAP - pituitární adenyl-cyklázu aktivující peptid)
- snižují antagonistický vliv tvořících se fragmentů inkretinů
Podání inhibitorů degradace inkretinů zvyšuje cirkulující hladiny biologicky aktivních forem, ale celková hladina GLP-1 a GIP (degradované a intaktní peptidy) je spíše snížená (v experimentálních studií na psech [17].
Kritickou rolí DPP-IV je fyziologicky kontrolovat glukózovou homeostázu, a proto jsou tyto enzymy potenciálním cílem pro léčbu DM2T. Na jedné straně bylo odhaleno, že pravděpodobně existují i non-DPP-IV mechanizmy degradace GLP-1 (např. neutrální endopeptidázy) [18]. Dipeptidyl peptidázy IV jsou široce přítomné enzymy v organizmu. Proto zůstává na druhé straně otázkou, jak se projeví skutečnost, že DPP-IV degradují i jiné fyziologicky produkované bioaktivní peptidy a jak se na jejich hladinách i účinku v organizmu projeví blokace těchto enzymů. Farmaceutické firmy v poslední době vycházely z těchto dvou skutečností a snažily se o vývoj vysoce selektivních inhibitorů zmíněných serinových dipeptidyl peptidáz IV, které by ovlivňovaly především gastrointestinální inkretiny účastnící se regulace glukózového metabolizmu a které by tak byly vhodnými antidiabetickými léky pro klinickou praxi.
Dále je důležité připomenout, že DPP-IV mohou hrát důležitou roli v imunitní odezvě organizmu. Někteří autoři klinických studií potvrdili, že DPP-IV působí jako stimulační lymfocytární molekula vázající se na mimobuněčnou bílkovinnou matrix. Nadto je tímto serinovým typem proteáz degradována i řada cytokinů a růstových faktorů. Tyto nálezy evokují představu, že DPP-IV hrají určitou roli jednak v manifestaci některých imunologických onemocněních, jako je revmatoidní artritida, a jednak mohou být spoluzodpovědny za imunitní reakce po transplantacích [21-23].
Zajímavé zjištění publikoval Green se svými spoluautory: enzymatická, proteolytická degradace inkretinů vlivem působení DPP-IV vede k tvorbě fragmentů těchto peptidů, které (na rozdíl od původní molekuly) nemají inzulinotropní aktivitu [13].
Největší pozornost je v poslední době věnována 3 inhibitorům DPP-IV: sitagliptinu, vildagliptinu a saxagliptinu.
prof. MUDr. Jindřiška Perušičová, DrSc.
www.fnmotol.cz
e-mail: jindra.perusicova@lfmotol.cuni.cz
Doručeno do redakce: 20. 6. 2007
Přijato po recenzi: 17. 8. 2007
Zdroje
1. Ahrén B. What mediate the benefits associated with dipeptidyl peptidase-IV inhibition? Diabetologia 2005; 48 : 605-607.
2. Ahrén B. Inhibition of dipeptidyl peptidase-IV reduces glycemia, sustains insulin levels and reduces glucagon levels in type 2 diabetes. J Clin Endocr Metab 2004; 89 : 2078-2084.
3. Ahrén B. Gut peptides and type 2 diabetes mellitus treatment. Curr Diab Rep 2003; 3 : 365-372.
4. Ahrén B Glucagon-like peptide 1 (GLP-1) - a gut hormone of potential interest in the treatment of diabetes. Bioesays 1998; 20 : 642-651.
5. Bray GM. Exenatide. Am J Health Syst Pharm 2006; 63 : 411-418.
6. Brunzell JD, Robertson RP, Lerner RL et al. Relationships between fasting plasma glucose levels and insulin secretion during intravenous glucose tolerance tests. J Clin Endocrinol Metab 1976; 42 : 222-229.
7. Burcelin R, Dolci W, Thorens B. Long-lasting antidiabetic effect of a dipeptidyl peptidase IV-resistant analog of glucagons-like peptide-1. Metabolism 1999; 48 : 252-258.
8. Buse JB, Henry RR, Han J et al. for the Exenatide-113 Clinical Study Group: Effects of exenatide (exendin-4) on glycemic control over 30 weeks in sulphonylurea-treated patients with type 2 diabetes. Diabetes Care 2004; 27 : 2628-2635.
9. Creutzfeldt W, Ebert R: New developments in the incretin concept. Diabetologia 1985; 28 : 565-573.
10. Drucker DJ. Minireview: the glucagon-like peptides. Endocrinology 2001; 142 : 521-527.
11. Drucker DJ. Therapeutic potential of dipeptidyl peptidase IV inhibitors for the treatment of type 2 diabetes. Expert Opin Invest Drugs 2003; 12 : 87-100.
12. Gautier JF, Fetita S, Sobngwi E et al. Biological actions of the incretins GIP and GLP-1 and therapeutic perspectives in patients with type 2 diabetes. Diabetes Metab 2005; 31 : 233-242.
13. Green BD, Irwin N, Flatt PR. Pituitary adenylate cyclase-activating peptide (PACAP): Assessment of dipeptidyl peptidase IV degradation, insulin-releasing activity and antidiabetic potential. Peptides 2006; 27 : 1349-1358.
14. Holst JJ, Deacon FC. Glucagon-like peptide-1 mediates the therapeutic actions of DPP-IV inhibitors. Diabetologia 2005; 48 : 612-615.
15. Hui H, Zhao X, Perfetti R. Structure and function studies of glucagon-like peptide 1 (GLP-1): the designing of a novel pharmacological agent for the treatment of diabetes. Diabetes Metab Res Rev 2005; 21 : 313-331.
16. Hui H, Farila L, Merkel P et al. The short half-life of glucagon-like peptide-1 in plasma does not reflect its long-lasting beneficial effects. Eur J Endocrinol 2002; 146 : 863-869.
17. Hu H, Norparvar A, Yhao X et al. Glucagon-like peptide-1 inhibits apoptosis of insulin secreting cells via a cyclic 5´adenosine monophosphate-dependent protein kinase A - and a phosphatidylinositol 3-kinase-dependent pathway. Endocrinology 2003; 144 : 1444-1455.
18. Hupe-Sodmann K, McGregor GP, Bridenbaugh R et al. Characterisation of the processing by human neutral endopeptidase 24.11 of GLP-1(7-36) amide and comparison of the substrate specificity of the enzyme for other glucagons-like peptides. Regul Pept 1995; 58 : 149-156.
19. Gedulin BR, Nikoulina SE, Smith PA et al. Exenatide (exendin 4) improves insulin sensitivity and -cell mass in insulin resistant obese fa/fa Ucker rats independent of glycemia and body weight. Endocrinology 2005; 146 : 2069-2076.
20. Iltz JL, Baker DE et al. Exenatide: An incretin mimetic for the treatment of type 2 diabetes mellitus. Clin Ther 2006; 28 : 652-664.
21. Jeanfavre DD, Woska JR, Pargelis CA et al. Effect of deoxycoformycin and Val-boroPro on the associated catalytic activities of lymphocyte CD26 and ecto-adenosine deaminase. Biochem Pharmacol 1996; 52 : 1757-1765.
22. Korom S, Meester I, Maas E et al. CD26 expression and enzymatic activity in recipients of kidney allografts. Transplant Proc 2002; 34 : 1753-1754.
23. Kubota T, Flentke GR, Bachovchin WW et al. Involement of dipeptidyl peptidase IV in an in vivo immune response. Clin Exp Immunol 1992; 89 : 192-197.
24. Lindsay JR, Duffyt NA, McKillop AM et al. Inhibition of dipeptidyl peptidase IV activity by oral metformin in type 2 diabetes. Diabet Med 2005; 22 : 654-657.
25. Mannucci E, Pala L, Ciani S et al. Hyperglycaemia increases dipeptidyl peptidase IV activity in diabetes mellitus. Diabetologia 2005; 48 : 1168-1172.
26. Mentlein R Dipetidyl-peptidase IV (CD26) - role in the inactivation of regulatory peptides. Regul Pept 1999; 85 : 9-24.
27. Mest HJ, Mentlein R. Dipeptidyl peptidase inhibitors as new drugs for the treatment of type 2 diabetes. Diabetologia 2005; 48 : 616-620.
28. Moore B, Edie ES, Abram JH. On the treatment of diabetes mellitus by acid extract of duodenal mucous membrane. Biochem J 1906; 1 : 28-38.
29. Nauck MA, El-Ouaghlidi A. The therapeutic actions of DPP-IV inhibition are not mediated by glucagons-like peptide-1. Diabetologia 2005; 48 : 608-611.
30. O’Harte FP, Abdel-Wahab YH, Conlon JM et al. Glycation of glucagon-like peptide-1(7-36) amide: characterization and impaired action on rat insulin secreting cells. Diabetologia 1998; 41 : 1187-1193.
31. Toft-Nielsen MB, Damholt MB, Madsbad S et al. Determinants of the impaired secretion of the glucagon-like peptide 1 in type 2 diabetes. J Clin Endocrinol Metab 2001; 86 : 3717-3723.
32. Tsu H, Chen X, Chen CT et al: 2-{3-{2-{(2S)-2-Cyano-1-pyrrolidinyl}-2-oxoethylamino}-3-methyl-1-oxobutyl}-1,2,3,4-tetrahydroisoquinoline: A potent, Sellective and Orally Bioavailable Dipeptide-Derived Inhibitor of Dipeptidyl Peptidase IV. J Med Chem 2006; 49 : 373-380.
33. Unger RH, Eisentraut AM. Entero-insular axis. Arch Intern Med 1969; 124 : 261-266.
34. Uwaifo GI, Ratner RE Novel pharmacologic agents for type 2 diabetes. Endocrinol Metab Clin N Am 2005; 34 : 155-197.
35. Weber AE. Dipeptidyl Peptidase IV inhibitors for the treatment of diabetes. J Med Chem 2004; 47 : 4135-4141.
36. Yamazaki K, Inoue T, Yasuda N et al. Comparison of efficacies of a dipeptidyl peptidase
IV inhibitor and alfa-glucosidase inhibitors in oral carbohydrate and meal tolerance tests and the effects of their combination in mice. J Pharmacol Sci 2007; 104 : 29-38.
37. Yasuda N, Inoue T et al. Enhanced secretion of glucagon-like peptide 1 by biguanide compounds. Biochem Biophy Res Commun 2002; 298 : 779-784.
38. Zander M, Taskiran M et al. Additive glucose-lowering effects of glucagon-like peptide-1 and metformin in type 2 diabetes. Diabetes Care 2001; 24 : 720-725.
39. Zander M, Madsbad S, Deacon CF et al. The metabolite generated by dipeptidyl-peptidase 4 metabolism of glucagon-like peptide-1 has no influence on plasma glucose levels in patients with type 2 diabetes. Diabetologia 2005; 49 : 369-374.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Primárny aldosteronizmus
- Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV
- 5. medzinárodný kongres o výskume uremického syndrómu a uremickej toxicity, 7. nefrologická konferencia baltických štátov.
- Prof. MUDr. Jaromír Hradec, CSc., šedesátníkem
- Vzpomínka na emeritního primáře interního oddělení Krajské nemocnice T. Bati, a.s., ve Zlíně, prim. MUDr. Rostislava Lukaštíka
- Novák Z, Chrastina J, Říha I. Atlas of Endoscopic Neurosurgery. Atlas endoskopické neurochirurgie.
- Úvodník
- Výsledek celotělového FDG-PET vyšetření predikuje osud nemocných s difuzním velkobuněčným lymfomem - editorial
- Jaká je role katétrové ablace A-V junkce a trvalé kardiostimulace v době, kdy lze fibrilaci síní všech forem léčit selektivní katetrovou ablací? - editorial
- Léčba fibrilace síní v době katétrové ablace - editorial
- Možnosti imunomodulační terapie u kriticky nemocných - lepší diagnostika znamená účinnější léčbu - editorial
- Tuková buňka stále plodnější - editorial
- Únavový syndrom v onkologii - editorial
- Invazivní houbové infekce u nemocných po transplantaci kmenových buněk krvetvorby: vývoj v diagnostice, prevenci a léčbě v posledním desetiletí - editorial
- Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV - editorial
- Výsledek celotělového FDG-PET vyšetření predikuje osud nemocných s difuzním velkobuněčným lymfomem jak při použití v intermediárním stagingu, tak při použití na konci standardní chemoterapie
- Dlouhodobé sledování pacientů s klinickými známkami krvácení do horní části trávicího traktu a negativním endoskopickým nálezem
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
- Immodin v léčbě imunoparalýzy nemocných v intenzivní péči
- Sérová hladina retinol-binding proteinu 4 u obéznych s inzulínovou rezistenciou a jedincov s diabetom 2. typu liečených metformínom
- QT dynamicita v rizikové stratifikaci u pacientů po infarktu myokardu
- Endoskopické nálezy v horním trávicím traktu u pacientů s jaterní cirhózou
- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Současné možnosti robotické kardiochirurgie
- Časná diagnostika invazivních mykotických infekcí u hematoonkologických nemocných pomocí sérologických metod
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Primárny aldosteronizmus
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



