-
Medical journals
- Career
Dyslipidemie u nemocných léčených peritoneální dialýzou
Authors: A. Zharfbin
Authors‘ workplace: II. interní klinika Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta doc. MUDr. Miroslav Souček, CSc.
Published in: Vnitř Lék 2006; 52(11): 1051-1057
Category: Original Contributions
Overview
Dyslipidemie ohrožuje nefrologické pacienty jednak svým aterogenním působením a jednak tím, že může urychlovat progresi renálního postižení.
Cílem naší práce bylo:
1. zjistit vliv peritoneální dialýzy (PD) se standardním (glukózovým) dialyzačním roztokem na koncentraci krevních lipidů a lipoproteinů v průběhu 30měsíční léčby, 2. porovnat tyto výsledky se souborem pacientů v pravidelném hemodialyzačním programu (HD) a v predialýze (pacientů s plazmatickým kreatininem 250 – 400 µmol/l).Soubor a metodika:
Byla měřena koncentrace celkového cholesterolu, LDL-cholesterolu, HDL-cholesterolu, non-HDL-cholesterolu, triglyceridů, lipoproteinu(a), apolipoproteinu A-1 a B, albuminu, glukózy, glykovaného hemoglobinu (HbA1c) a C-reaktivního proteinu (CRP). Bylo vyšetřeno 24 pacientů v PD, 20 pacientů v HD programu a 20 pacientů v predialýze.Výsledky:
U pacientů na PD se během 6 měsíců statisticky významně zvýšil celkový cholesterol, non-HDL-cholesterol a LDL-cholesterol, lipoprotein(a) (p < 0,005), triglyceridy (p < 0,05), snížil HDL-cholesterol (p < 0,005) a signifikantně také zvýšil CRP (p < 0,05) a body mass index (BMI) (p < 0,05). Po 30 měsících PD byl zjištěn pokles celkového cholesterolu a triglyceridů na hodnoty, jež měli pacienti před zahájením PD (p < 0,005). U pacientů na PD zůstal signifikantně vyšší non-HDL-cholesterol, LDL-cholesterol, lipoprotein(a) (p < 0,005). Došlo k signifikantnímu zvýšení glykemie, HbA1c, CRP a BMI po 30 měsících ve srovnání se souborem nemocných na HD a v predialýze (p < 0,05). HDL-cholesterol zůstal signifikantně nižší i po 30 měsících sledování (p < 0,005).Závěr:
Vyšší hodnoty lipoproteinu(a), LDL-cholesterolu a nižší hodnoty HDL-cholesterolu u pacientů na PD oproti pacientům na HD a v predialýze mohou nepříznivě ovlivnit další prognózu těchto nemocných.Klíčová slova:
peritoneální dialýza - dyslipidemie - lipoprotein(a)Úvod
Dyslipidemie je rizikovým faktorem pro vznik aterosklerózy a rozvoj kardiovaskulárních komplikací a může být příčinou předčasného vzniku ischemické choroby srdeční. Na rozvoji dyslipidemie se většinou podílí vlivy genetické a vlivy zevního prostředí. K tomu se mohou připojit i vlivy jiných onemocnění (sekundární dyslipidemie), které pak potencují vlivy genetické. Sekundární dyslipidemie sama o sobě může být pro nemocného závažné onemocnění, vyžadující adekvátní léčbu. K sekundárním dyslipidemiím patří i dyslipidemie nemocných s chorobami ledvin: dyslipidemie u nefrotického syndromu, u chronického selhání ledvin a u pacientů léčených dialyzačními metodami, jak hemodialýzou, tak peritoneální dialýzou a u nemocných po transplantaci ledvin [19]. U pacientů s chronickou renální insuficiencí bývá často zvýšena koncentrace triglyceridů, lipoproteinů VLDL, IDL a LDL, často dochází k poklesu HDL-cholesterolu a zvyšuje se koncentrace lipoproteinu(a) - Lp(a). Podobné změny lze nalézt také u nemocných v chronickém dialyzačním programu, tj. při hemodialýze a peritoneální dialýze.
Nemocní léčení jakoukoliv formou dialýzy mají zvýšené riziko vzniku aterosklerózy. Kardiovaskulární komplikace (ischemická choroba srdeční, infarkt myokardu, cévní mozková příhoda) jsou hlavními příčinami jejich úmrtí. Hypertriglyceridemie a vyšší Lp(a) jsou rovněž rizikovými faktory aterosklerózy [8]. Dyslipidemie u uremických pacientů pravděpodobně přispívá k vaskulárním komplikacím.
Soubor nemocných a metodika
Celkem bylo vyšetřeno 64 nemocných, z toho 24 léčených peritoneální dialýzou (PD; 19 léčených kontinuální ambulantní peritoneální dialýzou - CAPD a 5 léčených automatickou peritoneální dialýzou - APD). Kontrolní skupinou bylo 20 pacientů léčených hemodialýzou (HD) a 20 pacientů s chronickou renální insuficiencí v predialýze. V průběhu sledování 4 nemocní ze skupiny PD vypadli (2 zemřeli a 2 byli transplantováni) a z skupiny HD 1 pacient byl transplantován ke konci sledování. Charakteristiku souboru pacientů ukazuje tab. 1. Délka dialýzy byla u PD a HD pacientů obdobná, průměrná doba dialýzy byla 36 měsíců. Průměrný věk byl vyšší o 3,5 roku ve skupině HD a o 4,7 roku ve skupině predialýzy oproti souboru pacientů v PD. Celkem 39,4 ± 11 % nemocných bylo léčeno fluvastatinem již před zařazením do sledování. Pacienti, kteří užívali jiné statiny před zařazením do sledování, byli převedeni na fluvastatin již 45 ± 15 dnů před 1. odběrem. Pacienti užívali Lescol 40 mg, resp. Lescol XL 80 mg. Po dobu sledování nebyla dávka hypolipidemik měněna a ostatním nebyla hypolipidemika podávána. U 2 pacientů ze skupiny PD byl fluvastatin vysazen pro nežádoucí účinky. Ze skupiny predialýzy 3 pacienti užívali fluvastatin nepravidelně a vynechávali dávky.
Charakteristiky jednotlivých skupin pacientů jsou uvedeny v tab. 1.
Table 1. Charakteristika jednotlivých skupin pacientů. 
Naši nemocní nebyli léčeni Nutrinealem, tj. roztokem s obsahem směsi aminokyselin 1,1 %. Celkem 95 % našich pacientů používalo standardní dialyzační roztoky na bázi glukózy s koncentrací 1,36 %. Zbývajících 5 % pacientů mělo jednu prodlevu pomocí Icodextrinu, tj. 7,5% polymeru glukózy, v průběhu 30měsíců léčby. Pouze 3 z nich použili při noční výměně 2,3% roztok glukózy. Během sledování jsme zaznamenali u 3 pacientů z PD výskyt akutní peritonitidy.
Do sledování nebyli zařazeni pacienti léčení glukokortikoidy a jinými imunosupresivy a pacienti s proteinurií přes 3 g/24 hod, protože nefrotický syndrom sám o sobě vyvolává poruchu lipidového metabolizmu. Základní onemocnění, která vedla k selhání ledvin u nemocných léčených PD a v kontrolních skupinách, jsou uvedena v tab. 2.
Table 2. Přehled základních onemocnění. 
Žilní krev k laboratornímu vyšetření byla odebírána po 12hodinovém lačnění, u pacientů léčených HD vždy před zahájením dialyzační procedury. U nemocných léčených PD a HD bylo provedeno vyšetření před zařazením do dialyzační léčby, 6 měsíců a 30 měsíců po zařazení do PD, eventuálně HD. U pacientů v predialyzačním období bylo provedeno vyšetření před vstupem do sledování a dále pak v odstupu 6 a 30 měsíců.
Nikdo z pacientů nebyl vyšetřen při akutní infekci nebo za akutního pooperačního stavu.
Ve všech vzorcích byla provedena tato laboratorní vyšetření: celkový cholesterol - T-C, HDL-cholesterol - HDL-C), triglyceridy - TG, apolipoprotein A-1 - Apo-A1, apolipoprotein B - Apo B, lipoprotein(a) - Lp(a). Vypočteny byly tyto parametry: LDL-cholesterol (LDL-C), poměr T-C/HDL-C, non-HDL-C. Dále byla měřena glykemie, glykovaný hemoglobin (HbA1c), albumin, C-reaktivní protein (CRP) a byl stanoven body mass index (BMI). Koncentrace TC, TG, HDL-C byla stanovena enzymovými metodami na automatickém analyzátoru ADVIA 1650. Koncentrace apoA-1, apo B, Lp(a) a CRP byla měřená imunoturbidimetricky, albumin fotometricky (vše analyzátor ADVIA 1650). Koncentrace LDL-cholesterolu byla vypočtena dle Friedewaldovy rovnice. HbA1c byl stanoven metodou vysokotlaké kapalinové chromatografie (analyzátor TOSOH).
Pro srovnání hodnocených parametrů mezi skupinami PD, HD a predialýzy byl použit neparametrický nepárový Mannův-Whitneyův U-test. Pro srovnání parametrů před vstupem do PD, HD a po 6 měsících a po 30 měsících byl použit neparametrický párový Wilcoxonův test. Data byla hodnocena na hladině významnosti α = 5 %.
Výsledky
Výchozí hodnoty měřených laboratorních parametrů před zařazením do PD, HD a predialýzy před vstupem do sledování jsou uvedeny v tab. 3.
Table 3. Výchozí hodnoty měřených laboratorních parametrů před zařazením do PD, HD a predialýzy před vstupem do sledování. 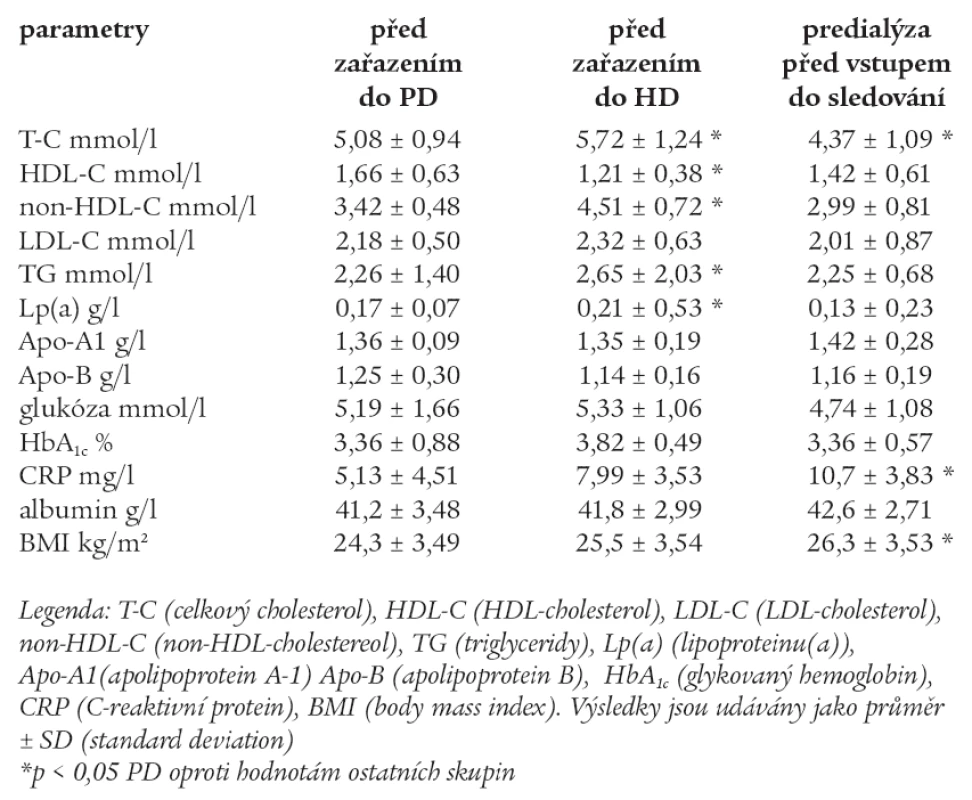
U skupiny HD byly signifikantně vyšší hodnoty T-C, non-HDL-C, TG a Lp(a) před zařazením do pravidelního dialyzačního programu.
HDL-C byl nejnižší u skupiny HD a T-C byl nejnižší ve skupině predialýzy. CRP a BMI byly vyšší signifikantně ve skupině predialýzy a byly nejnižší ve skupině PD před zařazením do sledování. Ostatní parametry byly srovnatelné ve všech skupinách jak u PD, tak u HD a predialýzy.
Hodnoty měřených laboratorních parametrů před zařazením do PD, po 6 měsících a po 30 měsících na PD jsou uvedeny v tab. 4.
Table 4. Hodnoty měřených laboratorních parametrů před zařazením do PD, po 6 měsících a po 30 měsících na PD. 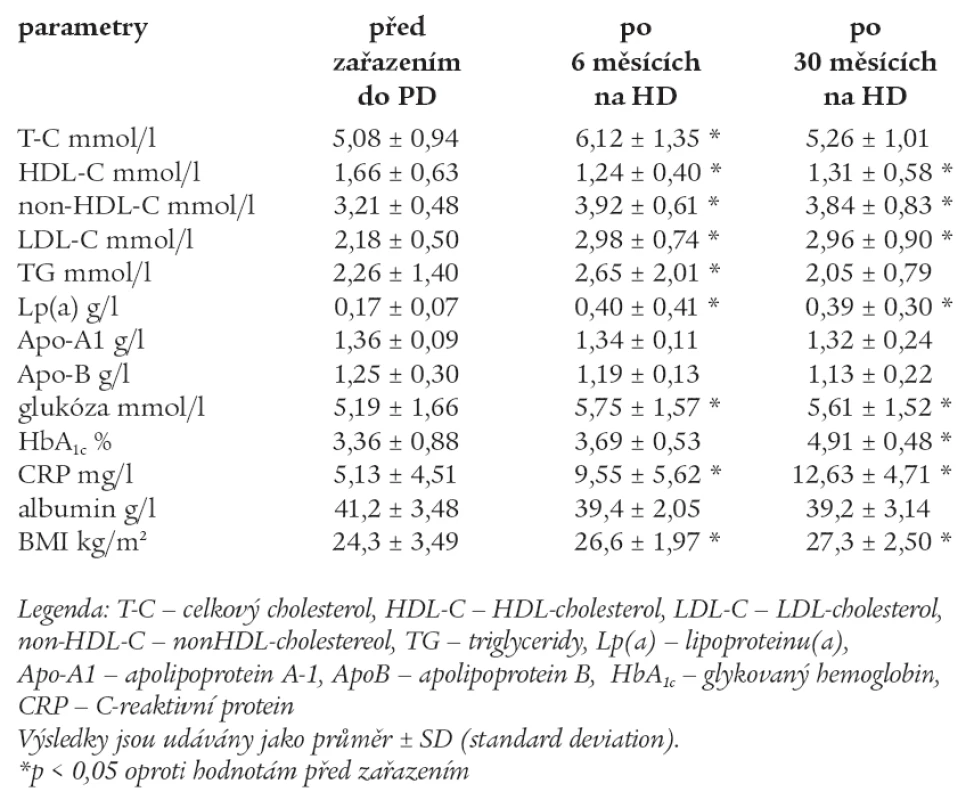
U skupiny PD po 6 měsících sledování byly signifikantně vyšší hodnoty T-C, non-HDL-C, LDL-C, TG, glukózy, CRP, BMI a snížily se hodnoty HDL-C.
U skupiny PD po 30 měsících došlo k poklesu T-C a TG na hodnoty, jež měli pacienti před zahájením PD, ale u této skupiny pacientů zůstaly signifikantně vyšší hodnoty non-HDL-C, LDL-C, Lp(a), glukózy, CRP a BMI. Zvýšil se signifikantně HbA1c.
Pacienti na PD v průběhu sledování byli zváženi s dialyzačním roztokem v dutině břišní (intraperitoneálně), což představuje v průměru 2 litry při jedné výměně, a tato hodnota nebyla odečtena z celkové tělesné hmotnosti.
Hodnoty měřených laboratorních parametrů před zařazením do HD, po 6 měsících a 30 měsících na HD jsou uvedeny v tab. 5.
Table 5. Hodnoty měřených laboratorních parametrů před zařazením do HD, po 6 měsících a 30 měsících na HD. 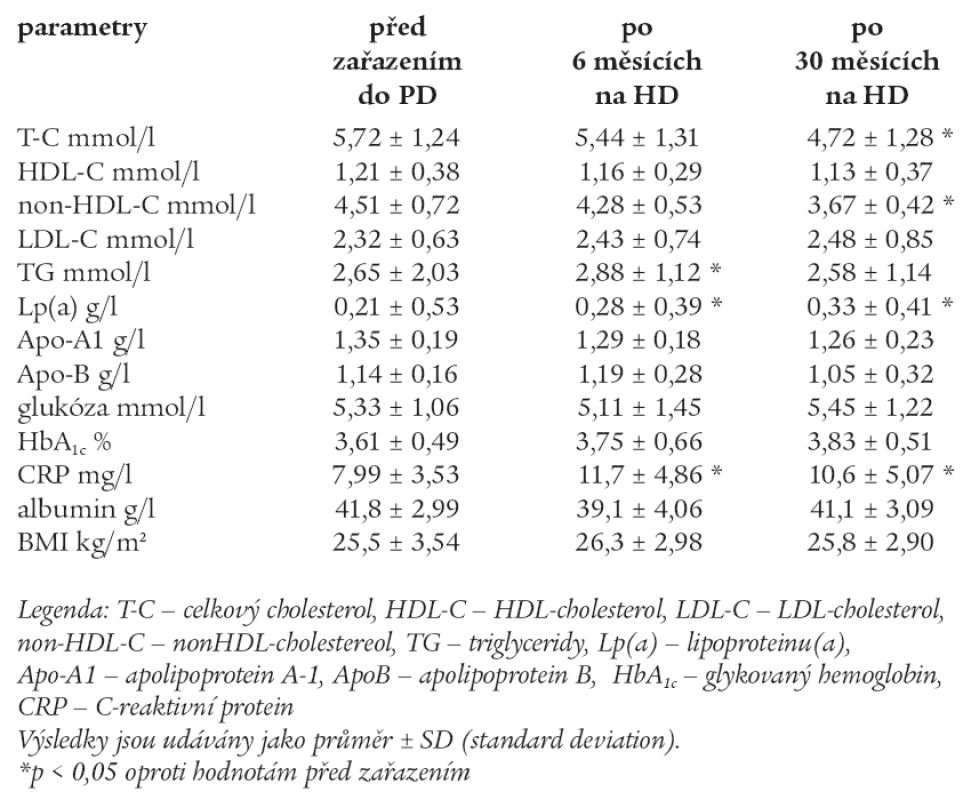
U skupiny HD po 6 měsících byly signifikantně vyšší TG, Lp(a) a CRP, snížily se hodnoty non-HDL. Po 30 měsících došlo k signifikantnímu poklesu T-C, non-HDL-C. Lp(a) a CRP zůstaly signifikantně vyšší. Ostatní parametry se signifikantně nezměnily oproti hodnotám před zařazením do HD.
Hodnoty měřených laboratorních parametrů pacientů predialýzy před vstupem do sledování, po 6 měsících a po 30 měsících sledování jsou uvedeny v tab. 6.
Table 6. Hodnoty měřených laboratorních parametrů pacientů predialýzy před vstupem do sledování, po 6 měsících a 30 měsících sledování. 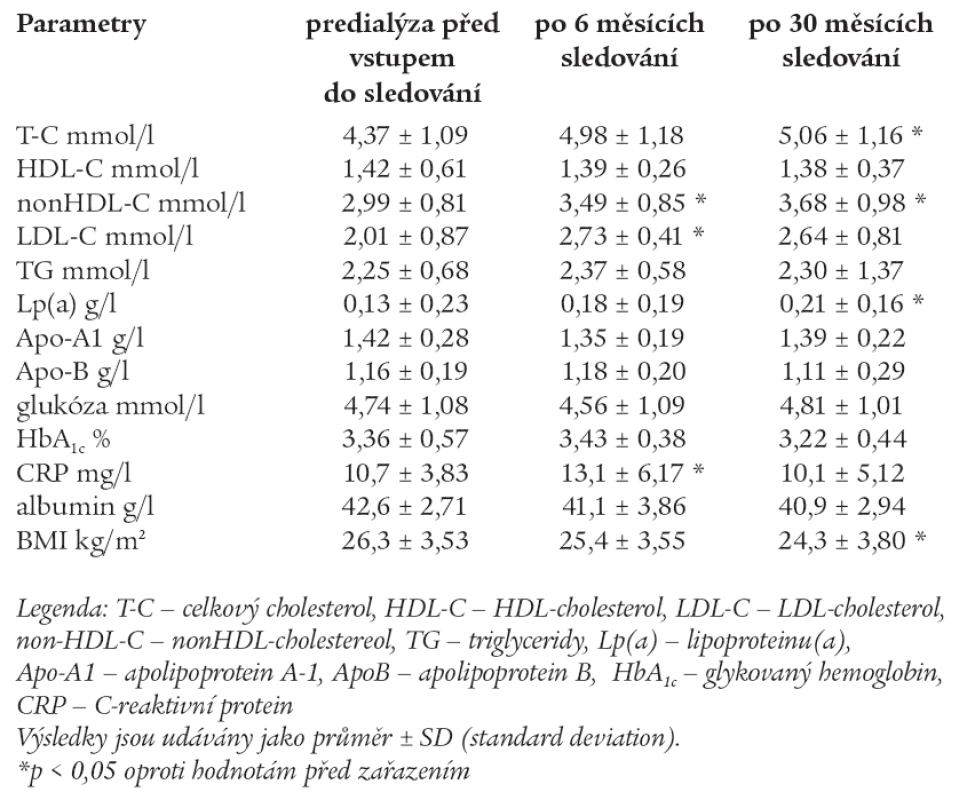
Ve skupině predialýzy došlo v průběhu 6 měsíců sledování k signifikantnímu zvýšení non-HDL-C, LDL-C a CRP. Po 30 měsících sledování došlo k signifikantnímu zvýšení TC. Non-HDL-C a LDL-C zůstaly statisticky významně vyšší i po 30 měsících. HDL-C zůstal prakticky beze změn, TG byly nesignifikantně zvýšeny po celou dobu sledování a nedošlo k změně ani po 30 měsících. Lp(a) se signifikantně zvýšil po 30 měsících sledování. CRP byl oproti druhým skupinám signifikantně vyšší, jinak byl vyšší již na začátku sledování a po přechodném signifikantním zvýšení byl zjištěn jeho pokles k hodnotám, jaké byly před zahájením sledování. BMI se oproti vstupní hodnotě signifikantně snížil po 30 měsících. Ostatní parametry zůstaly bez signifikantních změn.
Srovnání krevních lipidů a dalších parametrů mezi skupinami PD, HD a predialýzou po 30 měsících sledování jsou uvedeny v tab. 7.
Table 7. Srovnání krevních lipidů a dalších parametrů mezi skupinami PD, HD a predialýzou po 30 měsících sledování. 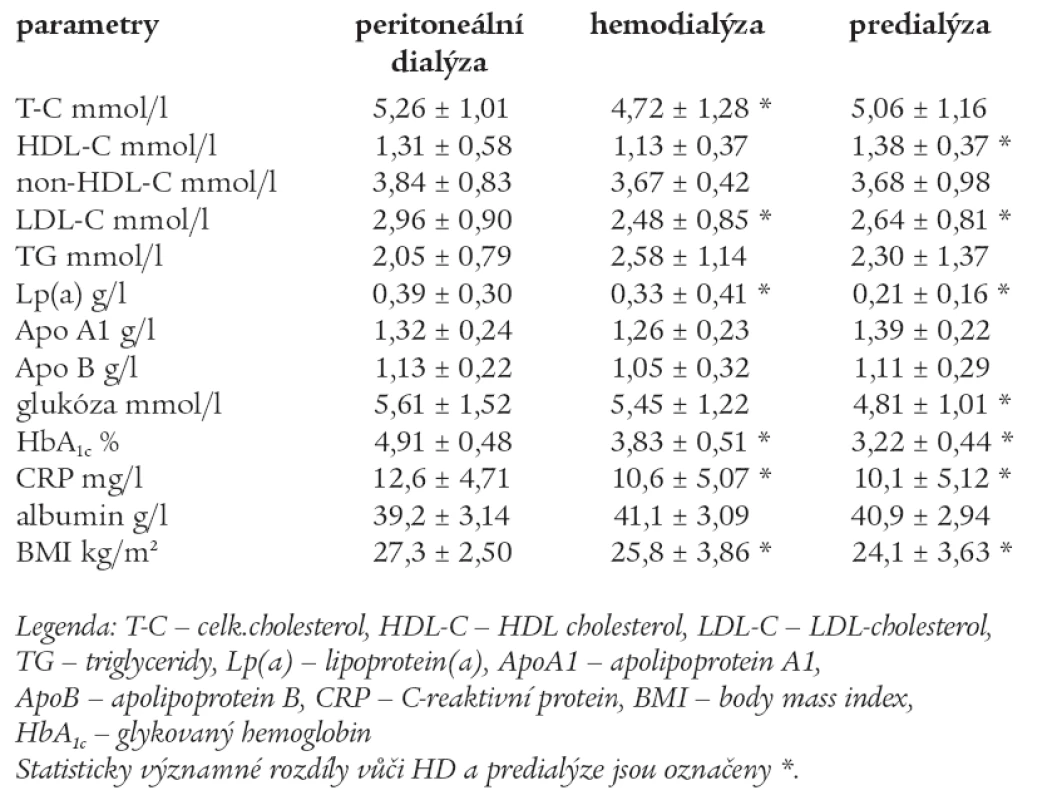
Po 30 měsících sledování byly ve skupině PD zjištěny signifikantně vyšší hodnoty T-C vůči HD (p < 0,05). Ve skupině predialýzy signifikantně vyšší hodnoty HDL-C vůči HD (p < 0,05). Ve skupině PD byly zjištěny nejvyšší hodnoty LDL-C a Lp(a) oproti HD a predialýze, rozdíly dosáhly statistické významnosti (p < 0,05). Mezi skupinami byly zjištěny signifikantně vyšší HbA1c, CRP a BMI ve skupině PD (p < 0,05). Ve skupině PD byla signifikantně vyšší glukóza vůči predialýze (p < 0,05). Albumin byl vyšší ve skupině HD, ale rozdíl nedosáhl statistické významnosti. Pacienti léčení HD a v predialýze měli normální hladinu T-C.
Diskuse
Dyslipidemie se u chronické renální insuficience (CHRI) manifestuje již v časné fázi choroby a u pacientů s lepší zbytkovou funkcí má mírnější formu [1]. Dyslipidemie u CHRI má multifaktoriální etiologii a na jejím rozvoji se podílí několik mechanizmů: snížená aktivita lipoproteinové a jaterní lipázy, periferní inzulinová rezistence, hyperparatyreoidizmus a nedostatek L-karnitinu [27].
U PD se podílí na rozvoji dyslipidemie také kontinuální absorpce glukózy, která zvyšuje tvorbu TG (ta je zřejmě důsledkem zvyšující se koncentrace lipoproteinů bohatých na triglyceridy) [7]. Poruchu může potencovat nízká aktivita enzymů zodpovědných za katabolizmus lipoproteinů bohatých na TG. U nemocných léčených PD byla prokázána nižší aktivita jaterní lipázy [17].
Změny v koncentracích krevních lipidů a lipoproteinů jsou také závislé na způsobu léčby (HD, PD, transplantace ledvin). U PD bývá častější zvýšení T-C, LDL-C, Lp(a), apo-B a větší pokles HDL-C a apo-A1 ve srovnání s HD [19,20].
Po transplantaci ledviny často dochází k vzestupu LDL, někdy i VLDL, čímž se mění typ hyperlipoproteinemie - vedle typu IV nacházíme typ IIb, vzácně II podle Fredricksona. Významnou roli zde hraje přírůstek tělesné hmotnosti, časté poruchy sacharidového metabolizmu a dlouhodobá imunosupresivní léčba [25).
U našich pacientů se ve skupině PD v průběhu 6 měsíců zvýšila hodnota T-C o 1,04 mmol/l, non-HDL-C o 0,71 mmol/l, hodnota LDL-C o 0,75 mmol/l, TG o 0,39 mmol/l a Lp(a) o 0,23 g/l, což je statisticky významné pro tyto sledované parametry za toto období.
Po 30 měsících PD byl zjištěn pokles celkového cholesterolu a triglyceridů na hodnoty, jež měli pacienti před zahájením PD. U pacientů na PD zůstal signifikantně vyšší non-HDL-C, LDL-C, Lp(a). HDL-C zůstal signifikantně nižší a došlo k nesignifikantnímu poklesu ApoB, hodnota ApoA1 se nezměnila.
Je známo, že u nemocných léčených PD, bývá koncentrace TG, T-C vyšší v prvních měsících léčby, a to díky absorpci glukózy z dialyzačního roztoku. Pak však dochází ke stabilizaci, a dokonce k poklesu na výchozí hodnoty [28]. Vzhledem k tomu, že absorpce glukózy z dialyzátu v průběhu PD má kontinuální charakter, stabilizace toho stavu a následný pokles v hladinách cholesterolu a TG je zajímavý fenomén. V tomto případě lze předpokládat metabolickou a dietní adaptaci nemocných na zátěž glukózou [5,26].
Nízký HDL-C může být důsledkem ztrát apo-AI a AII dialyzátem [3].
Snížená hladina HDL-C u diabetiků na PD je také ovlivněna podáním hypertonického dialyzačního roztoku s glukózou. CAPD s použitím hypertonických roztoků má nežádoucí účinky na systémovou hemodynamiku, má také negativní dopad na glykemii a na životnost peritoneální membrány [16].
Již před zařazením do PD vykazuje 68 % pacientů mírnou hypercholesterolemii a 47 % pacientů lehkou hypertriglyceridemii [5]. Restrikcí karbohydrátů v dietě na 240 - 250 g/24 hod lze u pacientů léčených PD snížit hladiny triglyceridů [26].
Hypertriglyceridemie může být způsobena také akcentací poruchy metabolizmu lipidů při chronickém selhání ledvin a může být jednou z příčin urychlené aterosklerózy [10]. Nemocní léčení PD mají v séru zvýšené aterogenní lipoproteiny bohaté na TG [7]. Hodnota LDL je vyšší u 48 % pacientů léčených PD ve srovnání s 23 % nemocných léčených hemodialýzou a u 7 % zdravých dobrovolníků. Zvýšení LDL-C je spojeno se zvýšeným rizikem výskytu infarktu myokardu u nemocných s renálním selháním [14].
Hypertriglyceridemie je provázena zvýšením trombogenity, výskytem malých denzních LDL-částic, které jsou snáze oxidovatelné. Ze studií poslední doby to dokládá například 8letá studie mužské populace v Kodani (København, Dánsko) [9], do níž bylo zařazeno 2 906 mužů ve věku 53-74 let bez ICHS. V této studii byla hladina TG významným rizikovým faktorem vzniku ICHS nezávisle na dalších hlavních rizikových faktorech včetně HDL-C. Metaanalýza 17 populačních studií prokázala, že každé zvýšení hladiny TG o 1 mmol/l bylo spojeno se zvýšením kardiovaskulárního rizika o 32 % u mužů a o 76 % u žen [2]. Po vyloučení vlivu hodnot HDL-C a ostatních rizikových faktorů kleslo riziko u mužů na 14 % a u žen na 37 %, nicméně zůstalo statisticky významné. Vysoká koncentrace TG se jeví též nezávislým rizikovým faktorem ischemických cévních mozkových příhod a tranzitorní ischemické ataky (TIA příhod) podle analýzy registru studie BIP (Bezafibrate Infarction Prevention study) u 11 177 pacientů s ICHS [25].
U souborů našich pacientů léčených PD se po zahájení PD statisticky významně zvýšil CRP jako marker zánětlivých procesů a došlo k dalšímu nárůstu CRP během 30 měsíců léčby pomocí PD. Toto může svědčit o tom, že pacienti léčení PD mohou být pro způsobu léčení ohroženější intraperitoneálně mikrozánětlivým prostředím [15]. Důvodem zvýšení hladiny CRP u našich pacientů pravděpodobně nebyl výskyt peritonitidy, protože u těchto pacientů nebyly provedeny odběry během akutního zánětu.
Při PD dochází ke vstřebání 100-200 g glukózy denně. Tato absorpce glukózy může potenciálně přispět k aterogenním změnám v metabolizmu lipidů a lipoproteinů v séru, ale některé změny jsou přechodné a podporují adaptaci peritonea na zátěž glukózou [12]. Zvýšený příjem glukózy může vést k hyperglykemii, hypertriglyceridemii, hyperinzulinemii, k obezitě, k omezení chuti k jídlu, a tím ke sníženému příjmu bílkovin [22]. Tím jsou především postihováni diabetici a mnohdy je u nich zapotřebí zvyšovat dávky inzulinu nebo perorálních antidiabetik.
U skupiny PD došlo k signifikantním zvýšení hladiny krevního cukru a glykovaného hemoglobinu, a to hlavně u diabetiků. Byly také zvýšeny dávky inzulinu a perorálních antidiabetik. U 1 diabetika bylo nutné zvýšit dávky inzulinu o 4 - 6 j denně.
Albumin byl v normálním rozmezí hodnot jak před zařazením do PD, tak během PD. Jeho průměrná koncentrace byla 39,2 g/l. To dosvědčuje, že naši nemocní netrpí malnutricí, i když představují ztráty bílkovin při PD v průměru 5 - 10 g za den a během peritonitid se mohou zvýšit až o 100 % [22].
U našich pacientů byl průměrný BMI signifikantně vyšší u skupiny PD a toto zvýšení tělesné hmotnosti patří k metabolickým komplikacím PD, které zahrnují kromě zvýšení tělesné hmotnosti, hyperglykemii, hypercholesterolemii a hypertriglyceridemii. Tyto metabolické poruchy jsou spojeny pravděpodobně s metodou léčby, při níž může samotná glukóza, která se používá při peritoneální dialýze v roztocích jako osmotické agens, sloužit jako substrát pro syntézu lipoproteinů. Také chronická hyperhydratace u některých z pacientů na PD má spolupodíl na zvyšování BMI. Použití Icodextrinu jako polymeru glukózy s nižší absorpcí glukózy bylo spojeno s nižší hladinou T-C a LDL. Použití Icodextrinu bylo dokonce spojeno s nižší hladinou leptinu u PD pacientů [11].
V predialýze se BMI oproti vstupní hodnotě snížil pravděpodobně díky nízkoproteinové dietě, při které někteří pacienti snižují celkový příjem potravy a tím i celkové energie, ale nedošlo k statisticky významnému poklesu albuminu v séru.
39,4 % pacientů ze všech skupin bylo léčeno hypolipidemiky, která mohla ovlivnit výchozí hodnoty T-C a další parametry lipidového metabolizmu. U skupiny pacientů před zařazením do HD byla léčba hypolipidemiky zastoupena nejméně, resp. u většiny pacientů z této skupiny nebylo její nasazení indikováno. Největší zastoupení v léčbě fluvastatinem měla skupina pacientů z predialýzy.
Hladiny Lp(a) u PD pacientů bývají výrazně vyšší v těch případech, v nichž je vyšší koncentrace Lp(a) v dialyzátu. To je zapříčiněno zvýšenou exkrecí Lp(a) do dialyzátu a hyperprodukcí Lp(a) játry. Vyšší hladina Lp(a) u PD ve srovnání s HD naznačuje možný vliv typu dialyzační procedury. Existuje souvislost mezi Lp(a) a parametry týkajícími se dialyzační procedury (dávka dialýzy, absorpce glukózy peritoneem, ztráty bílkovin a clearance bílkovin) [23]. V longitudinální studii 1 200 PD pacientů se Lp(a) signifikantně zvýšil po zahájení CAPD a po 3-5 měsících léčby. Korelace významně se zvyšující hladiny Lp(a) s peritoneální clearance albuminu a β2-mikroglobulinu naznačuje, že za mechanizmem zvýšení hladiny Lp(a) stojí velké ztráty bílkovin dialyzátem, a to i přes zvýšenou syntézu Lp(a) v játrech a snížení katabolizmu Lp(a) u PD. Konečně, korelace mezi Lp(a) a peritoneální absorpcí glukózy také potvrzuje například souvislost mezi zvýšenou hladinou Lp(a) a dialyzační procedurou - zejména v transportu bílkovin a glukózy peritoneem [6].
Lp(a) byl identifikován začátkem 90. let 20. století jako nezávislý faktor pro aterosklerotické cévní choroby [18].
Statiny mají benefiční efekt na hladiny lipidů a na trombogenitu u PD pacientů, ovlivňují agregaci trombocytů a vnější koagulační cestu, zlepšují fibrinolýzu a také endoteliální dysfunkci [13].
Metabolizmus proteinů i přes ztráty bílkovin dialyzátem nebyl u našich pacientů významně ovlivněn.
Závěr
U našeho souboru PD pacientů jsme nalezli statisticky významně zvýšené hodnoty LDL-C a Lp(a) vůči pacientům v HD a v predialýze. Je zřejmě, že peritoneální dialýza má jako metoda náhrady funkce ledvin vliv na zhoršování metabolizmu lipidů a lipoproteinů. Tento nález přispívá ke zvyšování rizika aterosklerózy a může nepříznivě ovlivnit také další prognózu těchto pacientů.
Konvenční glukózové roztoky mohou mimo jiné nepříznivě ovlivňovat metabolizmus sacharidů a lipidů a mohou vyvolat sacharidy indukovanou hypertrigylceridemii, která byla pozorovaná také u našich pacientů.
K potvrzení těchto nálezů by přispěly studie s větším počtem pacientů, které by byly statisticky přesvědčivější, zaznamenaly by i možný vztah k celkové a kardiovaskulární nemocnosti a úmrtnosti.
MUDr. Assad Zharfbin
II. interní klinika LF MU a FN u sv. Anny
www.fnusa.cz
e-mail: assadullah.zharfbin@fnusa.cz
Doručeno do redakce: 16. 4. 2004
Přijato po recenzi: 26. 7. 2006
Sources
1. Attman PO, Alaupovic P. Lipid and apolipoprotein profile, dyslipoproteinemia-relation to renal function and dialysis. Nephron 1991; 57 : 401-410.
2. Austin MA, Hokanson JE, Edwards KL. Hypertriglyceridemia as a cardiovascular risk factor. Am J Cardiology 1998; 81: suppl. 4A: 7B-12B.
3. Cancarini G, Constation E, Brunori G et al. Nutritional status of long term CAPD patients. Adv Perit Dial 1992; 8 : 84-86.
4. Davidson MH on behalf of the Fluent Investigation Group. Fluvastatin Long-Term Extention Trial (FLUENT): Summary of efficacy and safety. Am J Med 1994; 96 (Suppl 6A): 41A-44A.
5. Davidson MH, Hauptman J, Digirlamo O. Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat a randomized controlled trial. JAMA 1999; 13 : 278-280.
6. Heimburger O, Stenvinkel P, Berglund L et al. Increased plasma lipoprotein(a) in continuous ambulatory peritoneal dialysis is related to peritoneal transport of proteins and glucose. Nephron 1996; 72 : 135-140.
7. Hodis HN, Mack WJ. Triglyceride-rich lipoproteins and progression of atherosclerosis. European Heart Journal 2003; 24(Suppl A): 81-85.
8. Janicki K, Solski J, Janicka L et al. Lipid and apolipoproteins disturbances in hemodialysis, peritoneal dialysis and renal transplant patients. Ann Univ Mariae Curie Sklodowska (Med) 2004; 59 : 459-466.
9. Jeppesen J, Hein HO, Suadicani P et al. Triglyceride concentrations and ischemic heart disease. An eight-year follow-up in the Copenhagen male study. Circulation 1998; 97 : 1029-1036.
10. Kimak E, Solski J, Janicka L Lipoprotein profiles at different stages of chronic renal insufficiency. Renal failure 2000; 22 : 63-71.
11. le Poole CY, van Ittersum FJ, Weijmer MC et al. Clinical effects of a peritoneal dialysis regiment low in glucose in new peritoneal dialysis patients: a randomized crossover study. Adv Perit Dial 2004; 20 : 170-176.
12. Lindholm B, Norbeck HE Serum lipids and lipoproteins during continuous ambulatory peritoneal dialysis. Acta Med Scand 1986; 220 : 143-151.
13. Malyszko J, Malyszko JS, Hryzsko T et al. Influence of simvastatin on aspects of thrombogensis in CAPD patients. Perit Dial Int 2003; 23 : 260-266.
14. O'Neal DN, Best JD, Petri M et al. Initial hypoalbuminemia and hyperlipidemia persist during chronic peritoneal dialysis. Nephron 2003; 76 : 56-61.
15. Park SH, Lee EG, Kim IS et al. Effect of glucose degradation products on the peritoneal membrane in a chronic inflammatory infusion model of peritoneal dialysis in the rat. Perit Dial Int 2004; 24 : 115-122.
16. Selby NM, Fonseca S, Hulme L et al. Hypertonic glucose-based peritoneal dialysate is associated with higher blood pressure and averse hemodynamics as compared with icodextrin. Nephrol Dial Transplant 2005;20 : 1848-1853.
17. Shoji T, Nishizawa Y, Nishitani H et al. Roles of hypoalbuminemia and lipoproteins lipase on hyperlipoproteinemia in continuous ambulatory peritoneal dialysis. Metabolisms 1991; 40 : 1002-1008.
18. Siamopoulos KC, Elisaf MS, Bairaktari HT et al. Lipid parameters including lipoprotein(a) in patients undergoing CAPD and hemodialysis. Perit Dial Int 1995; 15 : 342-347.
19. Soška V. Sekundární hyperlipoproteinémie - přehled a význam. Abstr. IV: kongres o ateroskleróze, Špindlerův Mlýn, 7.-9. 12. 2000. DMEV 2000; 3: Suppl. 2 : 30.
20. Soška V. Poruchy metabolismu lipidů, diagnostika a léčba. Praha: Grada Publishing 2001, 166.
21. Soška V, Lojek A, Sobotová D. Vliv jednorázové hemodialýzy na koncentraci krevních lipidů a lipoproteinů. Klin Biochem Metab 2000; 8 : 114-117.
22. Sulková S et al. Peritoneální dialýza. Syllabova knižnice sv. 1, Jessenius Praha 1993
23. Tanaka S. Alterations of serum lipoprotein(a) levels in continus ambulatory peritoneal dialysis (CAPD) patients. Nippon Jinzo Gakkai Shi 1994; 36 : 746-751.
24. Tanne D, Koren-Morag N, Graff E et al (for the BIP Study Group). Blood lipids and first-ever ischemic stroke/transient ischemic attack in the Bezafibrate Infarction Prevention (BIP) registry. High triglycerides constitue an independent risk factor. Circulation 2001; 104 : 289-297.
25. Teplan V. Metabolismus a ledviny. Praha: Grada Publishing 2000 : 59.
26. Turgan C, Feehally J, Bennet S et al. Accelerated hypertriglyceridemia in patients on continuous ambulatory peritoneal dialysis and proventable abnormality. Int J Artif Organs 1981; 4 : 158-160.
27. Wanner C, Frommherz K, Horl WH. Hyperlipoproteinemia in chronic renal failure, pathophysiological and therapeutic aspects. Kardiology 1991; 78 : 202-217.
28. Zharfbin A, Soška V, Sobotová D. Změny krevních lipidů u nemocných léčených peritoneální dialýzou. XXX. nefrologický kongres, Luhačovice, 17. - 19. 6. 2004. Aktuality v nefrologii 2004; Suppl 10 : 36-37 (Abstr).
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 11-
All articles in this issue
- Riziková medikace a kontrastní látkou indukovaná nefropatie u pacientů s diabetem a hypertenzí
- Tako tsubo syndrom - nový přírůstek do rodiny akutních stavů v kardiologii: aktuální sdělení
- Pozdní komplikace chronických zánětů respiračního traktu u nemocných s běžnou variabilní imunodeficiencí
- Význam anamnézy v diferenciálnej diagnostike reflexných a kardiogénnych synkopálnych stavov
- 18F-FDG PET v diagnostice vaskulitid velkých cév
- Prevalence hladin C−reaktivního proteinu u dospělé populace dvou regionů České republiky a jejich vztah k tělesnému složení
- Dyslipidemie u nemocných léčených peritoneální dialýzou
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Postihnutie kardiovaskulárneho systému u diabetikov so súčasne prítomnou poruchou funkcie štítnej žľazy
- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

