-
Medical journals
- Career
Úloha apoptózy u kardiovaskulárních onemocnění
Authors: P. Hude
Authors‘ workplace: I. interní kardio-angiologická klinika Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta prof. MUDr. Jiří Vítovec CSc.
Published in: Vnitř Lék 2005; 51(10): 1114-1119
Category: Reviews
Overview
Aktivní buněčná smrt (apoptóza) přestavuje geneticky determinovaný způsob zániku buněk. Je tedy protipólem proliferační aktivity tkáně. Integrita mnohobuněčného organizmu je dána dynamickou rovnováhou mezi produkcí nových buněk a zánikem buněk jiných. To umožňuje udržet v průběhu celé ontogeneze i v postnatálním životě optimální počet buněk ve tkáních s různou proliferační aktivitou. Buněčná smrt se tak stává normální a základní součástí morfogeneze. Je popsán význam apoptózy u některých kardiovaskulárních onemocnění: hypertenze, ischemické choroby srdeční, srdečního selhání, kardiomyopatií a rejekci srdečního štěpu.
Klíčová slova:
apoptóza – patogeneze – kardiovaskulární onemocněníÚvod
Apoptóza - programovaná buněčná smrt - je intenzivně sledovaným biologickým procesem, který bezprostředně souvisí s řadou dějů, jako je diferenciace tkání a formování orgánů během embryonálního vývoje, poruchy růstu, vznik nádorů, tkáňová homeostáza apod.
Pojem apoptóza pochází z řečtiny a znamená „opadávání listí“. Poprvé byla popsána v roce 1971 [20]. Co se týče historie, je třeba zdůraznit, že apoptóza byla definována pouze morfologicky a téměř vždy byla interpretována v ostrém kontrastu vůči nekróze. Působení určité noxy, jako je ischemie, toxické poškození, infekce apod spouští náhodnou akcidentální smrt buňky, kterou označujeme jako nekrózu. Tento proces bychom mohli nazvat buněčnou vraždou.
Oproti tomu u apoptózy jde o programovanou buněčnou smrt, již geneticky zakódovanou, která je zahajována určitými spouštěcími mechanizmy. Na rozdíl od nekrózy jde tedy o jakousi buněčnou sebevraždu [6,15].
Apoptóza je komplex dějů vedoucích k buněčné smrti za fyziologických nebo patologických podmínek. Jednotlivé fáze celého procesu se dají rozdělit na změny morfologické a biochemické. Ke změnám morfologickým náleží svraštění buňky, ztráta mezibuněčných kontaktů, kondenzace jaderného chromatinu, rozpad chromatinu, rozpad buňky na apoptotická tělíska a končí fagocytózou apoptotických tělísek bez zánětlivé reakce (obr. 1).
Image 1. Morfologické změny při apoptóze – svraštění buňky (1), vyčlenění buňky a ztráta mezibuněčných kontaktů (2), kondenzace jaderného chromatinu (3), fragmentace na apoptotická tělíska (4), fagocytóza jinými buňkami (5). 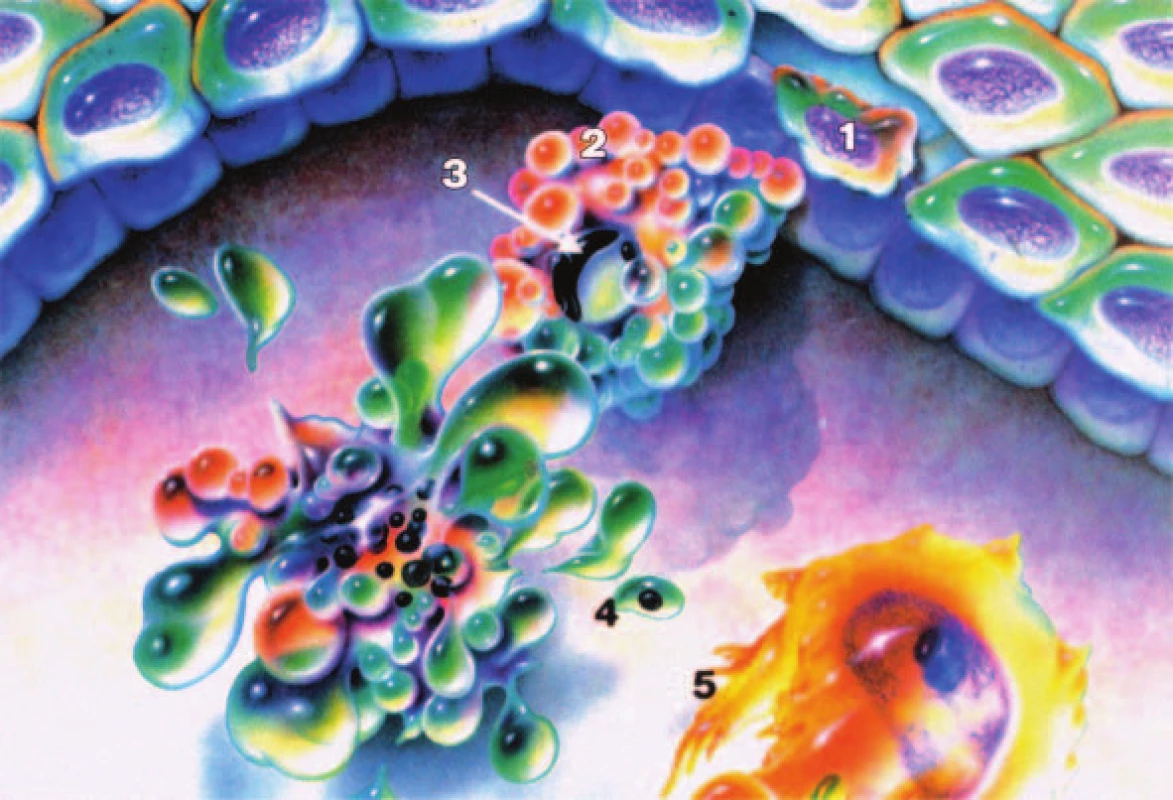
Mezi biochemické změny, které předcházejí změnám morfologickým, patří zhroucení membránového potenciálu mitochondrií, uvolnění cytochromu C, aktivace kaspázové řady a fragmentace DNA, která je způsobena natrávením dvouvláknové molekuly v internukleozomálních oblastech na dvouvláknové fragmenty o velikosti asi 180-200 párů bází nebo jejich násobků.
Apoptóza tedy může být zahájena nejen fyziologickými stimuly souvisejícími s programem uloženým uvnitř genomu buňky (v rámci udržení tkáňové homeostázy nebo embryonálního vývoje), ale může být vyprovokována i nefyziologickými vnějšími faktory [29]. Podle současných představ nastává apoptotická smrt buňky za 12 až 24 hodin po iniciálním stimulu. Do této doby jsou všechny mechanizmy, které by vedly ke smrti buňky, schopny reverzibility. Následné aktivace signálních cest a aktivace transkripce vedou k typickým změnám při apoptóze, při které dojde k fragmentaci DNA působením specifických endonukleáz a rozpadu buňky spolu s fagocytózou buněčných zbytků. Tyto změny mají již nezvratný charakter [31].
Laboratorní průkaz apoptózy
Detekce apoptotických buněk je možná mnoha způsoby. Děje se tak např. průkazem fragmentace DNA v apoptotických buňkách TUNEL testem (TdT-mediated X-dUTP Nick End Labeling) [19,35]. Je založený na vazbě značených nukleotidů na místa zlomů DNA v apoptotických buňkách (obr. 2).
Image 2. TUNEL pozitivní jádro kardiomyocytu. 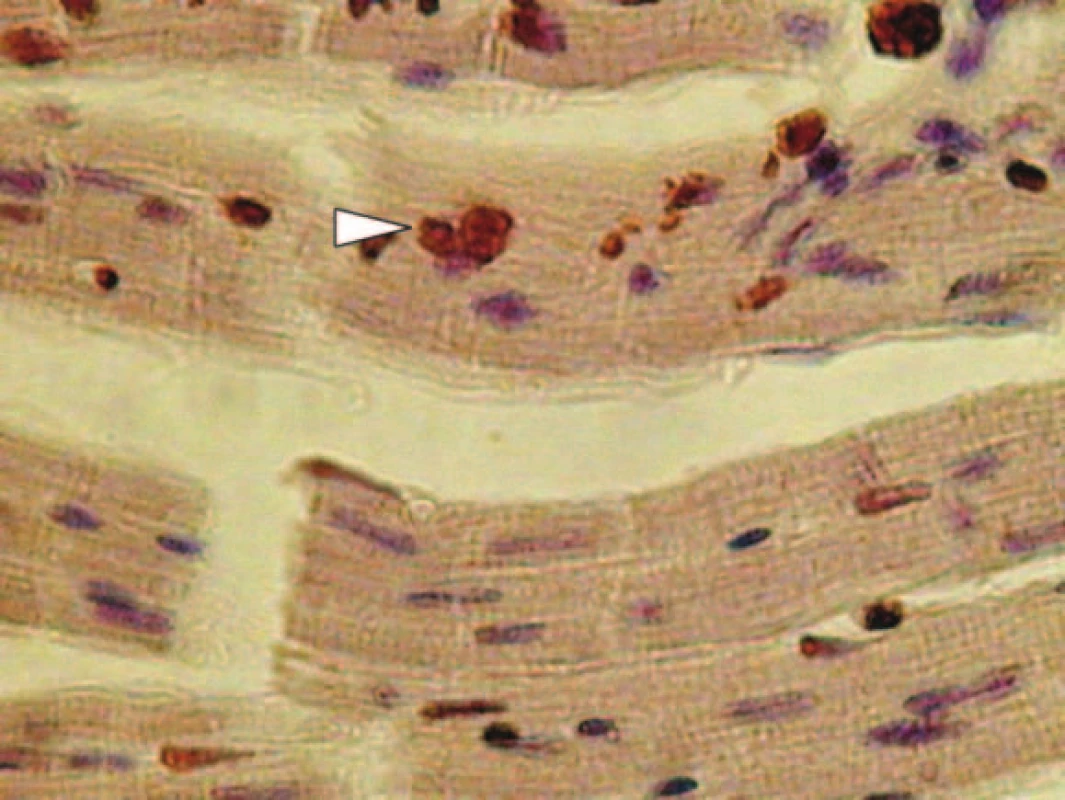
Jiná metoda používá tzv. „single cell gel electrophoresis assay“ (Comet Assay). Metoda je založena na skutečnosti, že denaturované naštěpené fragmenty DNA účinkem elektrického proudu (při elektroforéze) migrují ven z buňky postižené apoptózou, zatímco nefragmentovaná DNA v buňce zůstává. Průkaz apoptózy spočívá v detekci specifického tvaru: „ocas komety“, který je patrný po obarvení fluorescenčním barvivem ve fluorescenčním mikroskopu.
DNA ladder assay spočívá v průkazu pravidelných fragmentů DNA o 180-200 párů bází nebo jejich násobků. Tyto fragmenty se při agarosové elektroforéze zobrazují jako pravidelné proužky, „žebříček“. U nekrózy pozorujeme rozštěpenou DNA na nepravidelné fragmenty jako rozmáznutý pruh (obr. 3).
Image 3. DNA ladder assay – „žebříček“. Rozdíl v zobrazení apoptózy (A) a nekrózy (B). 
Další skupinu detekčních metod představuje průkaz časných markerů apoptózy, ke kterým patří skupina proteáz zvaných kaspázy. Tyto enzymy vedou k nezvratnému poškození řady klíčových proteinů buňky. Lze je prokázat:
- in vitro enzymatickým testem
- in vivo detekcí štěpných produktů jejich substrátem
- imunohistochemicky.
Jednou z možností stanovení apoptózy představují techniky, které prokazují změny buněčné membrány při apoptóze, a to translokace fosfatidylserinu a uvolnění cytochromu C. Anexin V se váže na fosfatidylserin, který se v průběhu apoptózy dostává na vnější stranu plazmatické membrány [30].
Průběh a význam apoptózy
Průběh apoptózy je zakódován a kontrolován geneticky (tab. 1). Můžeme pozorovat spouštěcí mechanizmy, receptorový aparát, intracelulární amplifikační kaskádu a efektorový systém vedoucí k proteolýze a fragmentaci DNA. Existuje řada mechanizmů, jejichž prostřednictvím je v buňce indukována apoptóza. Senzitivita buněk k apoptóze kolísá v závislosti na mnoha faktorech, jako je exprese proapoptotických a antiapoptotických proteinů, na buněčném cyklu, typu a závažnosti stimulů. V některých případech jsou to zevní signály, jako je vazba ligandů (např. Fas, TNFα) na tzv. receptory smrti na povrchu buněk (FasR, TNFR) [1,14], v jiných případech to jsou vnitřní signály indukované buněčným stresem (např. ischemií či oxidativním stresem). Důležitou roli v regulaci buněčné smrti zde hrají mitochondrie, resp. proteiny z rodiny Bcl-2, vázané na vnější membránu mitochondrií [47]. Převaha proapoptotických proteinů (Bax, Bad) nad antiapoptotickými proteiny (Bcl-2, Bcl-Xl) vede k perforaci mitochondriální membrány a uvolnění cytochromu C [21]. V obou typech stimulů pak následuje aktivace kaskády cysteinových proteáz (Caspase 1-13) a poškození jaderné DNA [13,22]. Na průběh apoptózy má vliv i působení lokálních cytokinů (interferon γ, interleukin 1 β, TGFβ).
Table 1. Časové rozdělení změn během apoptózy. 
Pomocí apoptózy odstraňuje mnohobuněčný organizmus buňky nadbytečné, geneticky poškozené či buňky, které se vyvinuly nesprávně. Apoptóza je tedy za fyziologických okolností životně důležitý jev zabezpečující normální vývoj organizmu. Setkáváme se s ní u řady fyziologických dějů, například v průběhu embryogeneze srdce se apoptóza podílí na správném utváření srdečních komor [45], ale i postnatálně při přestavbě fetální cirkulace, cyklických ovariálních a děložních změnách v reprodukčním věku ženy atd. Její narušení může pak hrát významnou roli v patogenezi a progresi řady chorobných stavů, včetně maligních tumorů, syndromů imunodeficience, u neurologických a také kardiovaskulárních onemocnění.
Mezi faktory a vlivy, které se významně uplatňují při spuštění apoptózy v oblasti kardiovaskulárního aparátu, patří hypoxie, ischemie, tlakové a objemové přetížení, superoxidové radikály, zánět, cytokiny, angiotenzin II, katecholaminy, růstové faktory a různé další vlivy.
V poslední době bylo publikováno mnoho prací zabývajících se apoptózou v oblasti kardiologie. Apoptóza se podílí na řadě kardiovaskulárních chorob či stavů, které jsou uvedeny v tab. 2 [10,18,25-27,32,34,40].
Table 2. Průkaz apoptózy u kardiovaskulárního onemocnění. 
Apoptóza a arteriální hypertenze
V případě arteriální hypertenze dochází k proliferaci a hypertrofii kardiomyocytů, buněk hladkého svalstva cév a remodelaci myokardu. Při hypertrofii a remodelaci v oblasti kardiovaskulárních tkání vzniká nová rovnováha mezi zvýšeným buněčným růstem, stimulovanými proliferativními podněty a apoptotickou aktivitou. Jedná se o časově omezenou přechodnou „up-regulaci“ apoptózy, která se uplatňuje hlavně na začátku procesu hypertrofie a také po zahájení terapie, například antihypertenzivy (apoptotické okno) [15]. V experimentu bylo prokázáno zvýšení apoptotické aktivity na spontánně hypertenzních potkanech (SHR), potkanech s renální hypertenzí nebo angiotenzinem II vyvolanou hypertenzí ve srovnání se skupinou kontrolních normotenzních krys [5,10]. Přechod kompenzované hypertrofie srdeční do stadia srdečního selhání u SHR je doprovázen redukcí kardiomyocytů v srdeční mase [4]. Proto můžeme apoptózu považovat za jeden z možných mechanizmů přechodu kompenzované hypertrofie srdeční do srdečního selhání. Stejně tak klinická data podporují nálezy prokázané v experimentu. Zvýšená aktivita apoptózy kardiomyocytů byla zjištěna u pacientů s esenciální hypertenzí a hypertrofií srdeční, s angiograficky negativním nálezem ve smyslu ischemické choroby srdeční a normální srdeční funkcí [9]. Poslední práce ukázaly vyšší výskyt apoptózy kardiomyocytů, jako i zvýšenou detekci aktivní formy caspase-3 řadící se mezi efektorové kaspázy u hypertenzních pacientů s chronickým srdečním selháním v porovnání s hypertenzními pacienty s hypertrofií levé komory srdeční a normální srdeční funkcí [10]. Experiment na SHR prokázal pokles apoptotické aktivity kardiomyocytů po podání takových skupin léčiv, jako jsou ACE-inhibitory a blokátory receptorů angiotenzinu II, typ AT1, některé blokátory vápníkových kanálů či karvedilol se svým antioxidačním účinkem [8,10].
Apoptóza při infarktu myokardu, ischemickém a reperfuzním poškození
Reperfuzní postižení orgánů (RPO) vzniká tam, kde je dočasně přerušena cirkulace a následná obnova cirkulace může vést k superponovanému zhoršení až selhání funkce orgánu. To se děje např. po rekanalizaci infarktové tepny, v transplantologii při konzervaci a transportu orgánu a také v kardiochirurgii při kardioplegické zástavě myokardu. Podstatou RPO je znovu se objevující porucha cirkulace v reperfundovaném orgánu, jemuž dominuje zánět, který může mít až autoagresivní rysy. Je dobře známo, že reperfuze je spojena s výrazným zvýšením tvorby volných radikálů a se zvýšením hladiny Ca uvnitř buňky. Tyto stavy patří mezi spouštěcí faktory apoptózy [7]. Jiné genové exprese zahrnují proapoptotické a antiapoptotické stimuly, jejichž poměr přispívá ke zvýšení rezistence buňky nebo naopak k jejímu aktivnímu konci [44].
Ischemie myokardu a reperfuze jsou spojeny se ztrátou buněk oběma základními mechanizmy, nekrózou i apoptózou [48]. Existuje mnoho nálezů prokazujících apoptózu kardiomyocytů v různých stadiích ischemického poškození od experimentálních zvířecích modelů [3,11] až po explantáty myokardu z lidských srdcí [14]. Reperfuzní poškození ještě zvyšuje počet apoptotických kardiomyocytů, než bývá detekováno v ischemizované tkáni. Množství kardiomyocytů, které podlehnou apoptóze, je menší v reperfundovaných oblastech srdečních než v částech vystavených trvalé ischemii [11,15]. U akutního infarktu myokardu byla většinou apoptóza detekována v okrajových částech infarktového ložiska, na rozdíl od normálního myokardu, kde se apoptóza vyskytuje jen zcela ojediněle [34,38].
Proapoptotické a antiapoptotické stimuly jsou modifikovány celou řadou signálních látek, produktů metabolizmu a také farmak, např. reaktivními kyslíkovými radikály, oxidem dusnatým, thiol redukujícími látkami, inhibitory proteáz nebo ovlivněním pohybu kalcia přes buněčnou membránu. V tomto směru jsou zajímavá i moderní inhalační anestetika, u nichž se objevil podobný ochranný účinek na ischemický myokard, jaký má krátkodobá ischemie [39,43]. Mechanizmus ochranného účinku inhalačních anestetik je vysvětlován stabilizací integrity mitochondriální membrány.
Apoptóza a srdeční selhání
Také v průběhu srdečního selhání může ztráta kardiomyocytů probíhat oběma způsoby zániku buněk, tedy apoptózou i nekrózou. Ischemie myokardu, tlakové a/nebo objemové přetížení, změněná exprese genů či zvýšená hladina cytokinů spouští další mechanizmy, které vedou ke ztrátám kardiomyocytů apoptózou, kompenzační hypertrofii buněk, remodelaci myokardu a postupné progresi srdečního selhání [28].
Nejen experimentální práce zabývající se apoptózou u srdečního selhání, ale i klinické studie na explantovaných srdcích pacientů, kteří podstoupili srdeční transplantaci z důvodů terminálního srdečního selhání, dokázaly přítomnost apoptotických kardiomyocytů v postiženém myokardu. U SHR bylo pozorováno větší množství apoptotických kardiomyocytů při kombinaci hypertenze se srdečním selháním, než jen při samotné hypertenzi [24]. Známky apoptózy byly prokázány také v kardiomyocytech psů se srdečním selháním [36]. V explantátech z lidských srdcí s těžkým srdečním selháním bylo nalezeno v průměru 2 318 apoptotických kardiomyocytů na 1 milion buněk. Toto množství bylo 238krát větší v porovnání s kontrolní skupinou bez srdečního postižení [32].
Hypotéza, že apoptóza je zahrnuta při progresi různých srdečních chorob vedoucích do stadia těžkého srdečního selhání, je založena na několika faktech:
- a) srdeční selhání se vyvíjí častěji u pacientů s hypertenzí, srdeční hypetrofií a po infarktu myokardu, tedy stavech, u kterých byla apoptóza nalezena
- b) potvrzená přítomnost apoptózy kardiomyocytů v myokardu pacientů s těžkým chronickým srdečním selháním
- c) programovaná buněčná smrt může být vyvolána v izolovaných srdečních buňkách vystavených působení látek, které jsou ve zvýšených hladinách přítomny při rozvoji srdečního selhání
- d) látky, které zlepšují přežívaní pacientů se srdečním selháním, vedou ke snížení počtu apoptotických kardiomyocytů [33].
Angiotenzin II a katecholaminy řadíme mezi proapoptotické faktory. Proto byly v posledních letech provedeny práce, které potvrzují antiapoptotický efekt určitých skupin léků, mezi které patří ACE-inhibitory, blokátory AT I receptoru pro angiotenzin II či beta-blokátory, např. karvedilol se svou antioxidační aktivitou [12,46].
Apoptóza a kardiomyopatie
Již výše uvedená data o programované buněčné smrti kardiomyocytů u srdečního selhání, ale i v dalších patologických stavech, jsou úzce spjata také s rozvojem kardiomyopatií. Zvýšená apoptóza kardiomyocytů je jednou z možností vysvětlujících vznik a postupný rozvoj příznaků dilatační kardiomyopatie. Circulus vitiosus může být nastolen tím, že při disperzní apoptóze buněk se extracelulárně uvolňuje ATP, která sama může spouštět apoptózu dalších buněk, a tak urychlovat proces zániku kardiomyocytů. Při porovnání idiopatické dilatační kardiomyopatie a ischemické kardiomyopatie lidských explantátů srdečních nebyl nalezen signifikantní rozdíl v počtu apoptotických kardiomyocytů [32]. Také při hodnocení myokardu od pacientů s kardiomyopatií pravé komory srdeční na podkladě arytmogenní dysplazie pravé komory byla zjištěna apoptóza kardiomyocytů u 75 % pacientů. V kontrolní kardiologicky nepostižené skupině apoptóza nebyla pozorována [25]. Pravděpodobně i při přechodu některých virových myokarditid do fáze dilatační kardiomyopatie může hrát spuštění apoptózy virovou infekcí rozhodující úlohu.
Doxorubicin je účinným a rozšířeným chemoterapeutikem, které se využívá při terapii solidních nádorů, lymfomů a leukemií. Klinické využití je limitováno závažnými nežádoucími účinky, z nichž nejrizikovějším je kardiotoxicita často vedoucí k srdečnímu selhání. Vznik doxorubicinem indukované kardiomyopatie se vysvětluje celou řadou mechanizmů. K nim náleží inhibice syntézy nukleových kyselin a proteinů, alterace transkripčních mechanizmů, přetížení vápníkem, hyperlipidemie a vznik kyslíkových radikálů. Souhrn těchto poruch rezultuje v aktivaci apoptózy kardiomyocytů s následným selháním srdce [41].
Rejekce u transplantovaného srdce
Prognóza pacientů v terminálním stadiu srdečního selhání zůstává i v dnešní době velmi závažná. Do jednoho roku umírá asi 50 % těchto pacientů. Pro tuto skupinu nemocných je srdeční transplantace metodou volby, pokud se jedná o pacienty refrakterní na farmakologickou léčbu, a jejich stav nelze úspěšně chirurgicky řešit jiným způsobem. Také srdeční transplantace přináší s sebou mnoho komplikací a úskalí. Mezi nejčastější patří rejekce a vaskulopatie štěpu, infekce, metabolické komplikace, malignity a další. Světové registry ukazují, že tyto komplikace vedou až k 50% mortalitě pacientů po 10 letech od srdeční transplantace. V posledních letech se řeší také otázka účasti apoptózy kardiomyocytů na akutní rejekci srdečního štěpu. Akutní buněčná rejekce je děj charakterizovaný aktivací T-lymfocytů a uvolněním cytokinů, jež bývá spojeno se zvýšením apoptotické aktivity. Existují studie popisující vzrůstající počet apoptotických kardiomyocytů se zvyšujícím se stupněm akutní buněčné rejekce [17,23,37], které podporují předpoklad podílu zvýšené apoptózy kardiomyocytů na poškození štěpu a jeho možné dysfunkci. Na druhou stranu jiné práce neprokázaly přítomnost apoptózy kardiomyocytů při akutní buněčné rejekci, ale dokumentují pozitivitu apoptózy T-lymfocytů [2,16,42].
Zavěr
Existují dva základní mechanizmy buněčné smrti: nekróza a apoptóza. Je jasné, že apoptóza hraje důležitou úlohu v různých fyziologických a patologických stavech. Apoptóza kardiomyocytů byla potvrzena u různých kardiovaskulárních stavů a chorob, které mohou pokračovat do stadia akutního či chronického srdečního selhání. Na druhou stranu nebylo dokázáno, že by apoptóza kardiomyocytů byla jediným faktorem odpovědným za progresi srdečních onemocnění, dysfunkce myokardu a jeho selhání. Existuje a probíhá mnoho prací, které se snaží do hloubky objasnit úlohu apoptózy a možnost jejího ovlivnění v kardiovaskulárním aparátu.
Podpořeno výzkumným záměrem MŠM 14110004.
MUDr. Petr Hude
www.fnusa.cz
e-mail: petr.hude@fnusa.cz
Doručeno do redakce: 1. 2. 2005
Přijato po recenzi: 11. 3. 2005
Sources
1. Ashkenazi A, Dixit VM. Death receptors: signaling and modulation. Science 1998; 281 : 1305-1308.
2. Bergese SD, Klenotic SM, Wakely ME et al. Apoptosis in murine cardiac grafts. Transplantation 1997; 63 : 320.
3. Buja LM, Entman ML Modes of myocardial injury and cell death in ischemic heart diseases. Circulation 1998; 98 : 1355-1357.
4. Conrad CH, Brooks WW, Hayes JA et al. Myocardial fibrosis and stiffness with hypertrophy and heart failure in the spontaneously hypertensive rat. Circulation 1995; 91 : 161-170.
5. Díez J, Panizo A, Hernández M et al. Cardiomyocyte apoptosis and angiotensin-converting enzyme in spontaneously hypertensive rats. Hypertension 1997; 30 : 1029-1034.
6. Duke RC, Ojcius DM, Young JDE. Cell suicide in health and disease. Sci Am 1996; 275 : 80-87.
7. Fliss H, Gattinger D. Apoptosis in ischemic and reperfused rat myocardium. Circ Res 1996; 79 : 949-956.
8. Fortuno MA, González A, Ravassa S et al. Clinical implications of apoptosis in hypertensive heart disease. Am J Heart Circ Physiol 2003; 284: H1495-H1506.
9. González A, López B, Ravassa S et al. Stimulation of cardiac apoptosis in essential hypertension: potential role of angiotensin II. Hypertension 2002; 39 : 75-80.
10. González A, Fortuno M, Querejeta R et al. Cardiomyocyte apoptosis in hypertensive cardiomyopathy. Cardiovasc Res 2003; 59 : 549-562.
11. Gottlieb RA, Burleson KO, Kloner RA et al. Reperfusion injury induces apoptosis in rabbit cardiomyocytes. J Clin Invest 1994; 94 : 1621-1628.
12. Goussev A, Sharov VG, Shimoyama H et al. Effects of ACE inhibition on cardiomyocyte apoptosis in dogs with chronic heart failure. Am J Physiol 1998; 275: H626-H631.
13. Grüter MG. Caspases: key players in programmed cell death. Curr Opin Cell Biol 2000; 10 : 649-655.
14. Hinescu ME. Cardiac apoptosis: from organ failure to allograft rejection. J Cell Mol Med 2001; 5 : 143-152.
15. Horký K. Patofyziologický význam apoptózy u kardiovaskulárních onemocnění. Cor Vasa 1999; 41 : 31-34.
16. Hökl J, Černý J, Němec P et al. Apoptóza periferních T lymfocytů během imunosuprese s použitím Neoralu nebo Tacrolimu a během rejekčních epizod a jejich léčba u příjemců srdečního štěpu. Cor Vasa 2004; 46 : 343-345.
17. Hude P, Horký M, Krejčí J et al. Apoptosis plays role in cellular rejection after human heart transplantation. European Journal of Heart Failure 2004; 3S: 9.
18. James TN. Normal and abnormal consequences of apoptosis in the human heart. From postnatal morphogenesis to paroxysmal arrhythmias. Circulation 1994; 90 : 556-573.
19. Kanoh M, Takemura G, Misao J et al. Significance of myocytes with positive DNA in situ nick end-labelling (TUNEL) in hearts with dilated cardiomyopathy. Circulation 1999; 99 : 2757-2764.
20. Kerr JFR. Shrinkage necrosis: distinc mode of cellular death. J Pathol 1971; 105 : 13-20.
21. Kluck RM, Bossy-Wetzel E, Green DR et al. The release of cytochrome c from mitochondria: a primary site for Bcl-2 regulation of apoptosis. Science 1997; 275 : 1132-1136.
22. Kroemer G, Reed JC. Mitochondrial control of cell death. Nature Med 2000; 6 : 513-519.
23. Laguens RP, Meckert PM, Martino JS et al. Identification of programmed cell death (apoptosis) in situ by labeling of nuclear DNA fragments in heart biopsy samples during acute rejection episodes. J Heart Lung Transplant 1996; 15 : 911.
24. Li Z, Bing OH, Long X et al. Increased cardiomyocyte apoptosis during the transition to heart failure in the spontaneously hypertensive rat. Am J Pathol 1997; 272: H2313-H2319.
25. Mallat Z, Tedgui A, Fontaliran F et al. Evidence of apoptosis in arrhythmogenic right ventricular dysplasia. New Engl J Med 1996; 335 : 1190-1196.
26. Narula J, Acio ER, Narula N el al. Annexin-V imaging for noninvasive detection of cardiac allograft rejection. Nat Med 2001; 7 : 1347-1352.
27. Narula J, Haider N, Virmani R et al. Apoptosis in myocytes in end-stage heart failure. New Engl J Med 1996; 335 : 1182-1189.
28. Nováčková K, Aschermann M et al. Současný pohled na patofyziologii srdečního selhání. Cor Vasa 2000; 42 : 178-184.
29. Novosad J, Kodydková K, Krejsek J. Apoptóza, její mechanismy a medicínský význam. I.Definice apoptózy a její průběh na buněčné úrovni. Vnitř Lék 2001; 47 : 381-386.
30. Novosad J, Kodydková K, Krejsek J. Apoptóza, její mechanismy a medicínský význam. II. Poruchy regulace apoptózy a jejich souvislost s rozvojem onemocnění. Vnitř Lék 2001; 47 : 387-390.
31. Ohno M, Takemura G, Ohno A et al. “Apoptotic” myocytes in infarct area in rabbit hearts may be oncotic myocytes with DNA fragmentation. Circulation 1998; 98 : 1422-1430.
32. Olivetti G, Abbi R, Quaini F et al. Apoptosis in the failing human heart. N Engl J Med 1997; 336 : 1131-1141.
33. Olivetti G, Maestri R, Cigola E et al. Does apoptosis play a role in the progression of heart failure? Dialogues in Cardio Med 1998; 2 : 91-94.
34. Saraste A, Pulkki K, Kallajoki M et al. Apoptosis in human acute myocardial infarction. Circulation 1997; 95 : 320-323.
35. Scarabelli TM, Knight RA, Rayment NB et al. Quantitative assessment of cardiac myocyte apoptosis in tissue sections using the fluorescent-based TUNEL technique enhanced with counterstains. J Immunol Methods 1999; 228 : 23-28.
36. Sharov VG, Sabbah HN, Shimoyama H et al. Evidence of cardiomyocyte apoptosis in myocardium of dogs with chronic heart failure. Am J Pathol 1996; 148 : 141-149.
37. Szabolcs M, Ravalli S, Minanov O et al. Apoptosis and increased expression of nitric oxide synthase in human allograft rejection. Transplantation 1998; 65 : 804.
38. Takemura G, Ohno M, Hayakawa Y et al. Role of apoptosis in the disappearance of infiltrated and proliferated interstitial cells after myocardial infarction. Circ Res 1998; 82 : 1130-1138.
39. Toller WG, Kersten JR, Pagel PS et al. Sevoflurane reduces myocardial infarct size and decreases the time threshold for ischemic preconditioning in dogs. Anesthesiol 1999; 91 : 1437-1446.
40. Toyozaki T, Hiroe M, Tanaka M et al. Levels of soluble Fas ligand in myocyarditis Am J Cardiol 1998; 82 : 246-248.
41. Umlauf J, Horký M. Molecular biology of doxorubicin-induced cardiomyopathy. Experimental and Clinical Cardiology 2002; 7 : 35-39.
42. Van Hoffen E, Van Wichen DF, Leemans JC et al. T cell apoptosis in human heart allografts: Association with lack of co-stimulation. Am J Pathol 1998; 153 : 813.
43. Wagner R, Piler P, Horváth R et al. Význam apoptózy v myokardiální tkáni po reperfuzi v kardiochirurgii. Cor Vasa 2004; 46 : 24-28.
44. Yaoita H, Ogawa K, Maehara K et al. Apoptosis in relevant clinical situations: contribution of apoptosis in myocardial infarction. Cardiovasc Res 2000; 45 : 630-641.
45. Yet ET. Life and death in the cardiovascular system. Circulation 1997; 95 : 782-786.
46. Yue TL, Ma XL, Chen XS et al. Carvedilol prevents cardiac ischemic damage and apoptosis in rabbit cardiomyocytes (Abstr). Circulation 1996; 94: I-226.
47. Zamzami N, Susin SA, Marcheti P et al. Mitochondrial control of nuclear apoptosis. J Exp Med 1996; 183 : 1533-1544.
48. Zhao Z, Nakamura M, Wang N et al. Reperfusion induces myocardial apoptotic cell death. Cardiovasc Res 2000; 45 : 651-660.
49. Ziori CH, Zioris CH, Kyriakidis M. Apoptosis in heart failure. Hellenic J Card 2003; 44 : 56-70.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 10-
All articles in this issue
-
Fokální síňová tachykardie
Klinické projevy, místa vzniku a výsledky katetrové ablace - Srovnání katetrizační a chirurgické léčby defektu septa síní typu ostium secundum u dospělých pacientů
- Vysoká prevalence a špatná kontrola hypertenze v ordinacích praktických lékařů
- Prevalence a možné rizikové faktory rozvoje samoléčení antibiotiky v České republice
- Erytropoetin v léčbě nemocných s myelodysplastickým syndromem
- Význam L-karnitinu u pacientů s chronickým renálním selháním léčených hemodialýzou
- Úloha apoptózy u kardiovaskulárních onemocnění
- Protrombotický stav ako súčasť metabolického syndrómu
- Infekční endokarditida umělé mitrální chlopně
-
Diagnostika a léčba chronické hepatitidy B
Doporučený postup České hepatologické společnosti a Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně
-
Fokální síňová tachykardie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Fokální síňová tachykardie
Klinické projevy, místa vzniku a výsledky katetrové ablace - Infekční endokarditida umělé mitrální chlopně
- Srovnání katetrizační a chirurgické léčby defektu septa síní typu ostium secundum u dospělých pacientů
- Protrombotický stav ako súčasť metabolického syndrómu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

