-
Medical journals
- Career
Antikoagulační terapie – známe její interakce?
Authors: Katarína Bielaková
Authors‘ workplace: Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno
Published in: Geriatrie a Gerontologie 2021, 10, č. 3: 127-133
Category: Review Article
Overview
Antikoagulační terapie patří mezi klíčové postupy v medicíně pro svou schopnost snižovat srážlivost krve. Dlouhé roky to byly kumarinové deriváty, které tvořily pilíř antikoagulační terapie. Nyní jsou postupně nahrazovány přímými orálními antikoagulancii (DOAC). Je známým faktem, že užívání warfarinu má celou řadu nevýhod, jako je nízký terapeutický index s nutností častých laboratorních kontrol účinnosti léčby, riziko krvácení, pomalý nástup účinku a dlouhé přetrvávání efektu po přerušení léčby. Nicméně velkým problémem antikoagulační terapie, na který řada pacientů zapomíná, je její interakce s léky a potravinami. Je velkou výhodou skupiny DOAC, zejména u geriatrického pacienta s polyfarmakoterapií, že jejich terapeutický efekt je méně ovlivnitelný interakcemi s potravou a medikací.
Klíčová slova:
lékové interakce – dabigatran – warfarin – antikoagulační terapie – rivaroxaban – přímá antikoagulancia – edoxaban – apixaban
Úvod
Historicky užívaný preparát warfarin, původně používaný jako jed na krysy a do humánní medicíny schválený před víc než 60 lety, má celou řadu nevýhod. Musíme počítat s tím, že má nízký terapeutický index s nutností častých laboratorních kontrol účinnosti léčby, dále je u něj riziko krvácení, pomalý nástup účinku a potýkáme se též s dlouhým přetrváváním efektu po přerušení léčby.
I když se DOAC snaží zaujmout vyšší podíl na trhu, warfarin zůstává na předním místě, co se týče spotřeby antikoagulačních preparátů. Přehledně situaci zpracovala ve své práci Hochelová.(1) V grafu 1 je znázorněna celková spotřeba perorálních antikoagulancií v České republice 2007–2016. V roce 2016 činil warfarin 68,77 % z celkové spotřeby perorálních antikoagulancií, dabigatran etexilát 9,40 %, rivaroxaban 14,45 % a apixaban 7,38 %. Warfarin si zachovává prvenství nejen ve spotřebě, ale je také nejlevnější (graf 2). Z celkového objemu finančních prostředků vynaložených na antikoagulační terapii bylo na DOAC vynaloženo 4× víc finančních prostředků než na warfarin a na LMWH (nízkomolekulární heparin) to bylo oproti warfarinu přibližně 10× víc.(1)
Graph 1. Spotřeba perorální antikoagulační terapie v České republice 2007–2016(1) 
(DDD – definovaná denní dávka) Graph 2. Finanční prostředky vynaložené na antikoagulační terapii v České republice 2007–2016 (v Kč)(1) 
Lékové interakce antikoagulační terapie
Podle mechanismu vzniku můžeme lékové interakce řadit mezi farmaceutické (reakce mezi jednotlivými léčivými látkami), farmakodynamické (reakce mezi farmaky na cílovém recepčním místě) a farmakokinetické (vzájemné interakce léčiv v biologických systémech při jejich cestě k cílovému místu účinku a při jejich bioeliminaci).(2)
Problémem, na který musíme u antikoagulační terapie myslet, je, že léčiva mají úzké terapeutické okno – nižší koncentrace zvyšují riziko trombotických komplikací a na druhé straně vyšší hladiny mohou navodit krvácení. Z klinických studií je známo, že při léčbě antagonisty vitaminu K (warfarin) je účinné a bezpečné inhibice koagulace dosaženo po 50–70 % léčebného času, nicméně v reálné praxi je toto číslo ještě nižší.(3)
Kumarinové deriváty – warfarin a jeho četné interakce
Warfarin je směs dvou aktivních enantiomerů. (R)-warfarin je metabolizován primárně CYP1A2 a CYP3A4. (S) - warfarin je metabolizován primárně CYP2C9. Léky, které soutěží jako substráty pro tyto cytochromy nebo inhibují jejich aktivitu, mohou zvyšovat plazmatické koncentrace warfarinu a INR, a tím zvyšovat riziko krvácení.(4) Problémem warfarinu jsou četné interakce s mnoha léčivy, potravou či nápoji.
Je více mechanismů, které se uplatňují při jeho interakcích, jako je absorpce antikoagulancia, dále vytěsnění antikoagulancia z vazby na albumin, potenciace inhibičního účinku antikoagulancia na metabolismus vitaminu K a v neposlední řadě i změna hepatálního metabolismu warfarinu mechanismem enzymatické indukce či inhibice mikrosomálních enzymů.(5) Známý je efekt potravy na účinek warfarinu, který se snižuje požíváním velkého množství potravin bohatých na vitamin K. Pacienti s nepřiměřeným příjmem potravin s obsahem vitaminu K jsou závislí na vitaminu K2 produkovaném střevními bakteriemi. U těchto pacientů může řada antibiotik redukovat syntézu vitaminu K2, a tím navodit zvýšený účinek warfarinu.
V běžné praxi vyžaduje léčba tímto preparátem obezřetnost, protože se jedná o léčivo s velmi variabilní inter - i intraindividuální antikoagulační účinností. Jak již bylo uvedeno, je metabolizován prostřednictvím více enzymových cest, přičemž CYP2C9 je polymorfní. Důležité je, že warfarin inhibuje vitamin K epoxid reduktázu, která je též polymorfní.(6) Jednotlivé polymorfní varianty jsou různě citlivé k působení antivitaminů K. Výsledkem je předem obtížně odhadnutelný antikoagulační efekt warfarinu s vysoce individuální dávkou pro každého pacienta, která se pohybuje od 1 mg do 10 mg denně, případně i více. Není známo jiné perorální antikoagulans, které má tak významné rozdíly v dávkování a které doprovází tolik lékových interakcí jako právě warfarin. Warfarin má nejvyšší popsaný počet lékových interakcí (je jediným léčivem, které má standardně v databázích lékových interakcí uváděno 300 nebo více lékových interakcí), přičemž mnohé z nich jsou klinicky závažné.(7) Vybrané interakce s léčivy ukazuje tabulka 1.(8)
Jednou z příčin vychýlení hodnot INR u stabilizovaného pacienta, na kterou musíme myslet, jsou kromě zvýšeného příjmu vitaminu K v potravě (zejména zelená zelenina) právě lékové interakce. Při bedlivém zkoumaní se zjistí, že pacient má nově předepsané léčivo – antidepresivum, antibiotikum nebo užil volně prodejné antirevmatikum a nenahlásil to svému lékaři.(8) Je nutno sledovat obsah vitaminu K v konzumovaných potravinách a snažit se o jeho vyrovnaný příjem (tab. 2). Zeleninu není vhodné paušálně zakazovat, jedná se o velmi prospěšnou potravinu, která by neměla chybět v jídelníčku seniorů. Častou chybou seniorů je, že přestanou konzumovat zeleninu úplně.
Table 1. Interakce ovlivňující farmakodynamický a farmakokinetický účinek warfarinu(8) 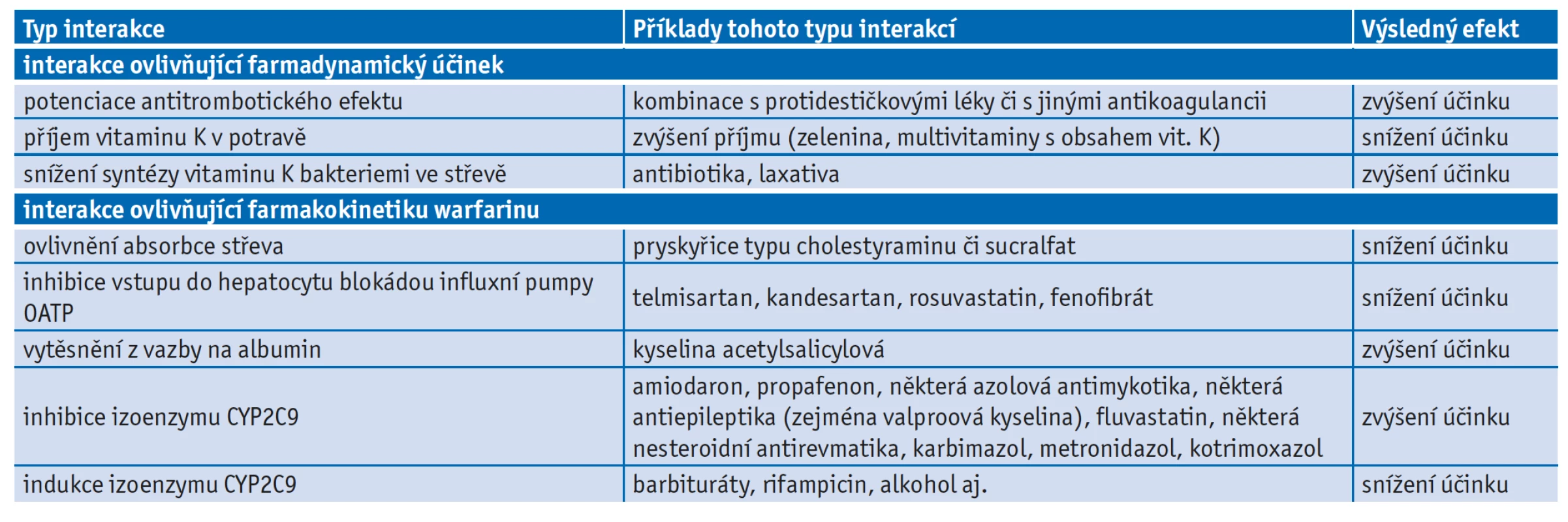
Table 2. Přehled zdrojů vitaminu K v potravě(4) 
Table 3. Řešení vybraných častých interakcí warfarinu s léčivy(15) 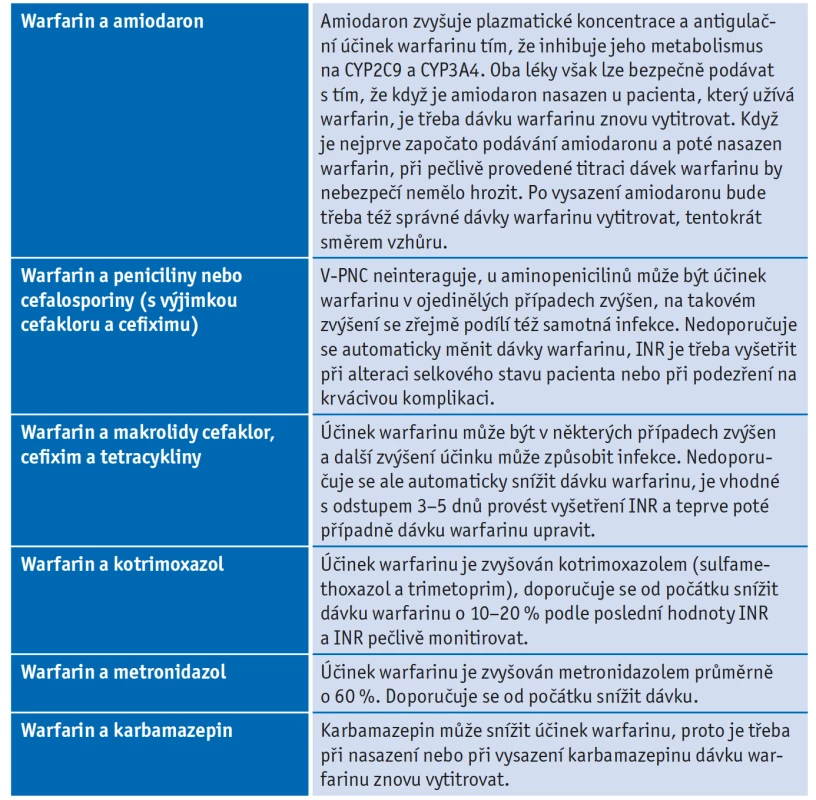
Monitoring INR je klíčový, což může být překážkou u geriatrických pacientů s omezenou mobilitou, kteří mají často insuficientní periferní žilní přístup a častokrát není možné monitoring INR realizovat v domácím prostředí.(9)
Jak bylo výše uvedeno, warfarin má celou řadu interakcí, nyní ale chceme upozornit zejména na často užívané léky, které zvyšují INR a u nichž musíme počítat s vyšším rizikem krvácení. Patří k nim nesteroidní antiflogistika, ASA, heparin, amiodaron, omeprazol, kortikosteroidy, erythromycin, tetracyklin, fluvastatin, simvastatin, tamoxifen, alopurinol nebo alkohol.
Na snížení INR musíme naopak pomýšlet u současného užívaní warfarinu s haloperidolem, aldactonem, antihistaminiky, vitaminem K, rifampicinem, antithyroideálními léky či cyklosporinem.
U starších pacientů s fibrilací síní se poměrně často užívá amiodaron, málo se však pomýšlí na to, že potenciaci účinku antikoagulační léčby warfarinem je možno očekávat až v odstupu 3 týdnů. Je nutné na tuto možnost myslet a INR pravidelně monitorovat.
Řešení některých vybraných lékových interakcí s warfarinem ukazuje tabulka 3.(8)
Lékové interakce dabigatranu
Ze skupiny DOAC proběhla v ČR první registrace u dabigatranu (Pradaxa) – v roce 2008, indikován byl k primární prevenci žilních tromboembolických příhod u dospělých pacientů po elektivní náhradě kyčelního nebo kolenního kloubu. V srpnu 2011 došlo k rozšíření indikace o prevenci cévní mozkové příhody a systémové embolie u dospělých pacientů s nonvalvulární atriální fibrilací. Doporučená dávka u fibrilace síní je 150 mg 2× denně, nižší dávka 110 mg 2× denně se podává seniorům nad 80 let a pacientům, kteří užívají verapamil.(10)
Dabigatran snižuje výskyt cévních mozkových příhod a embolií a zároveň je bezpečný, protože redukuje závažná krvácení při srovnatelném výskytu závažných krvácení do gastrointestinálního traktu.(10)
Lék patří mezi gatrany, přímé inhibitory trombinu. Inhibuje trombin vázaný na fibrin a trombinem indukovanou agregaci trombocytů. Na rozdíl od ostatních přímých antikoagulancií obsahuje tobolka dabigatranu proléčivo dabigatran etexilát, který je pak konvertován na dabigatran. Pro pacienty s renální funkcí při clearance kreatininu < 50 ml/min je nutno pamatovat na snížení dávky. Pokud klesne clearance kreatininu < 30 ml/min, je tento lék kontraindikován. K nesporným výhodám, které má tento lék, patří dostupnost antidota (idarucizumab, Praxbind). Idarucizumab je fragment humanizované monoklonální protilátky, který se s velmi vysokou afinitou váže na dabigatran a neutralizuje jeho antikoagulační účinek. Podle studie RE-VERSE AD umožňuje jeho podání trvalou reverzi antikoagulačního účinku v případě nutnosti akutní operace nebo u nezvladatelného krvácení.(11)
Souběžná léčba jinými antikoagulancii (hepariny, warfarin) je kontraindikována. Zvýšené riziko krvácení je nutno brát do úvahy i při převodu z jedné antikoagulační léčby na druhou.
Antiagregancia. Současné podávání kyseliny acetylsalicylové a 150 mg dabigatranu dvakrát denně může zvýšit riziko jakéhokoliv krvácení z 12 % na 18 %. Současné podání klopidogrelu zvyšuje AUC a Cmax dabigatranu o 38–40 %.
Měli bychom zvážit podání nižší dávky, pokud máme seniora mezi 75–80 lety, který má vyšší riziko krvácení a nižší riziko tromboembolických komplikací, zvlášť pokud se léčil s ezofagitidou, gastritidou nebo gastroezofageálním refluxem.
Častým problémem je chronické užívání nesteroidních antiflogistik. Riziko krvácení je zde zvýšené o 50 %, zejména je nutné sledovat příznaky krvácení u NSAID s eliminačním poločasem delším než 12 hodin.
Dabigatran není metabolizován v cytochromu P450, což znamená nízkou pravděpodobnost lékové interakce s léčivy metabolizovanými na tomto cytochromu. Naproti tomu jsou všechny DOAC substrátem glykoproteinu P (P-gp).(12)
Podávání inhibitorů P-gp (amiodaron, verapamil, chinidin, ketokonazol, dronedaron, klarithromycin a tikagrelor) snižuje účinky na DOAC a vede ke zvýšení koncentrací DOAC v plazmě. Léčba silnými inhibitory glykoproteinu P, jako je systémově podávaný ketokonazol, cyklosporin, itrakonazol nebo dronedaron, je kontraindikována.
Při současném podávaní antiarytmika amiodaronu, který patří mezi inhibitory P-gp a CYP3A4, je podle EMA (European Medicines Agency) vhodné redukovat dávku dabigatranu.(13) Problémem je i dlouhý poločas amiodaronu, proto potenciál pro lékovou interakci může přetrvávat týdny po vysazení amiodaronu. Zvláštní pozornost je třeba věnovat pacientům s mírnou nebo středně těžkou poruchou funkce ledvin.
Při podávání verapamilu je důležitý čas a forma podání. Pokud se podával verapamil s okamžitým uvolňováním, hodinu před dabigatranem bylo zvýšení Cmax o 180 % a AUC o 150 %. Pokud se podával verapamil s prodlouženým uvolňováním, bylo zvýšení Cmax zhruba o 90 % a AUC přibližně o 70 %. Dále je potřeba se zaměřit na renální parametry: pokud má pacient normální renální parametry a je po elektivní náhradě kyčelního nebo kolenního kloubu, musí být dabigatran snížen na 150 mg jednou denně. U středně těžké renální insuficience je třeba redukovat dávku na 75 mg denně.
Klarithromycin patří mezi inhibitory P-gp a CYP3A4. Při podávání 500 mg dvakrát denně u zdravých dobrovolníků spolu s dabigatranem bylo pozorováno zvýšení AUC přibližně o 19 % a Cmax o 15 %, nicméně opatrnosti je potřeba u pacientů s mírnou nebo středně těžkou poruchou funkce ledvin.
Induktory glykoproteinu P (rifampicin, třezalka tečkovaná, fenytoin) způsobují snížení koncentrace dabigatranu, a proto je nepodáváme.
Při současném podávaní selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) nebo selektivních inhibitorů zpětného vychytávání serotoninu a noradrenalinu (SNRI) došlo ve studii RE-LY ke zvýšení rizika krvácení.
Absorpce dabigatranu je redukována současným užíváním inhibitorů protonové pumpy (PPI), nicméně bez relevantního klinického efektu. To znamená, že můžeme tyto léky podávat společně.
Lékové interakce rivaroxabanu
Rivaroxaban (Xarelto) je selektivní přímý inhibitor faktoru Xa ze skupiny xabanů. Léčivo neblokuje existující trombinovou aktivitu a na rozdíl od inhibitorů trombinu umožňuje i nadále aktivaci endogenních antikoagulačních faktorů – proteinu C a proteinu S. Ukazuje se, že dávky vyšší než 15 mg jsou lépe vstřebávány, pokud jsou podávané současně s jídlem. Na rozdíl od dabigatranu je podíl renálního vylučování rivaroxabanu menší, riziko kumulace při snížení renálních funkcí je tedy podstatně nižší, a pokud klesne clearance kreatinu < 15 ml/min, je lék kontraindikován.(14,15)
Podávání rivaroxabanu s ostatními antikoagulačními přípravky (LMWH, jiné perorální antikoagulancium) není doporučováno vzhledem ke zvýšenému riziku krvácení. Pokud je pacient převáděn na tyto preparáty, je nezbytné postupovat opatrně.
Antiagregancia jsou rizikovějšími léky a je nutné je podávat s obezřetností. Klopidogrel vedl u části pacientů k nárůstu doby krvácení, která nekorelovala s agregací trombocytů ani hladinami P-selektinu nebo receptoru GPIIb/IIIa.
Mezi významné interakce patří léčiva, která působí na metabolizaci rivaroxabanu prostřednictvím CYP3A4 a na jejich transport prostřednictvím glykoproteinu P.
Rivaroxaban je substrátem P-glykoproteinu a současně i oxidázy CYP3A4, a proto se nedoporučuje podání rivaroxabanu současně se silnými inhibitory P-glykoproteinu a CYP3A4A (systémově podávaná azolová antimykotika jako ketokonazol, itrakonazol, vorikonazol a posakonazol či inhibitory proteáz HIV). Jejich současné podání by vedlo k významnému zvýšení Cmax a AUC rivaroxabanu.(16) Zajímavé je, že pokud se užívá flukonazol současně s rivaroxabanem, nedochází k významné interakci.
Klarithromycin je silný inhibitor CYP3A4 a středně silný inhibitor P-gp. Způsobuje sice 1,5násobný nárůst středních hodnot AUC rivaroxabanu a 1,4násobný nárůst Cmax, nicméně tento nárůst není významný. Při užívání erythromycinu je nutno zaměřit pozornost na pacienty s renální insuficiencí. V případě středně těžkého renálního poškození vedlo podávání erythromycinu k 2násobnému nárůstu střední hodnoty AUC rivaroxabanu a 1,6násobnému nárůstu v Cmax ve srovnání s pacienty s normální renální funkcí.
Dronedaron by neměl být podáván spolu s rivaroxabanem vzhledem k omezeným klinickým údajům, které jsou k dispozici.
U přípravků ze skupiny SSRI nebo SNRI dochází k vyššímu krvácení.
Při podání léčiv, která jsou induktory CYP3A4 a glykoproteinu P, dochází k velmi významným lékovým interakcím a snížení plazmatických koncentrací rivaroxabanu. To má za následek snížení antitrombotického účinku, proto je vhodné se současnému podání vyhnout. Do skupiny těchto léků řadíme rifampicin, fenytoin, karbamazepin, fenobarbital a třezalku tečkovanou.
Lékové interakce apixabanu
Apixaban (Eliquis) je další lék ze skupiny xabanů.(8,17) Jeho farmakodynamické vlastnosti jsou shodné s rivaroxabanem, nicméně se od něj liší některými farmakokinetickými vlastnostmi (tab. 4). Jeho biologická dostupnost je 50–80 % a na rozdíl od rivaroxabanu není zvýšena potravou. Nástup účinku po perorálním podání je 30–60 min, což je shodné s dabigatranem a rivaroxabanem. Přeměně na inaktivní metabolity podléhá asi 25 % podané dávky, přičemž hlavními biotransformačními enzymy jsou CYP3A4, CYP3A5. Dle Wanga příspěvek CYP2C8, 2C9 a 2C19 k metabolismu apixabanu byl méně signifikantní.(18) Preparát je také substrátem glykoproteinu P a BCRP. Co se týče renálního vylučování, na rozdíl od dabigatranu, který se ledvinami vylučuje až z 80 %, se apixaban ledvinami vylučuje pouze z 25 %. Převážná část metabolizace probíhá v játrech a vylučování probíhá převážně stolicí.(19) U pacientů s těžkou renální insuficiencí (clearance kreatinu pod 15 ml/min) dochází ke zvýšení hladiny apixabanu, a tím ke zvýšenému riziku krvácení – proto se jeho podání nedoporučuje.
Table 4. Přehled vlastností přímých perorálních antikoagulancií(8) 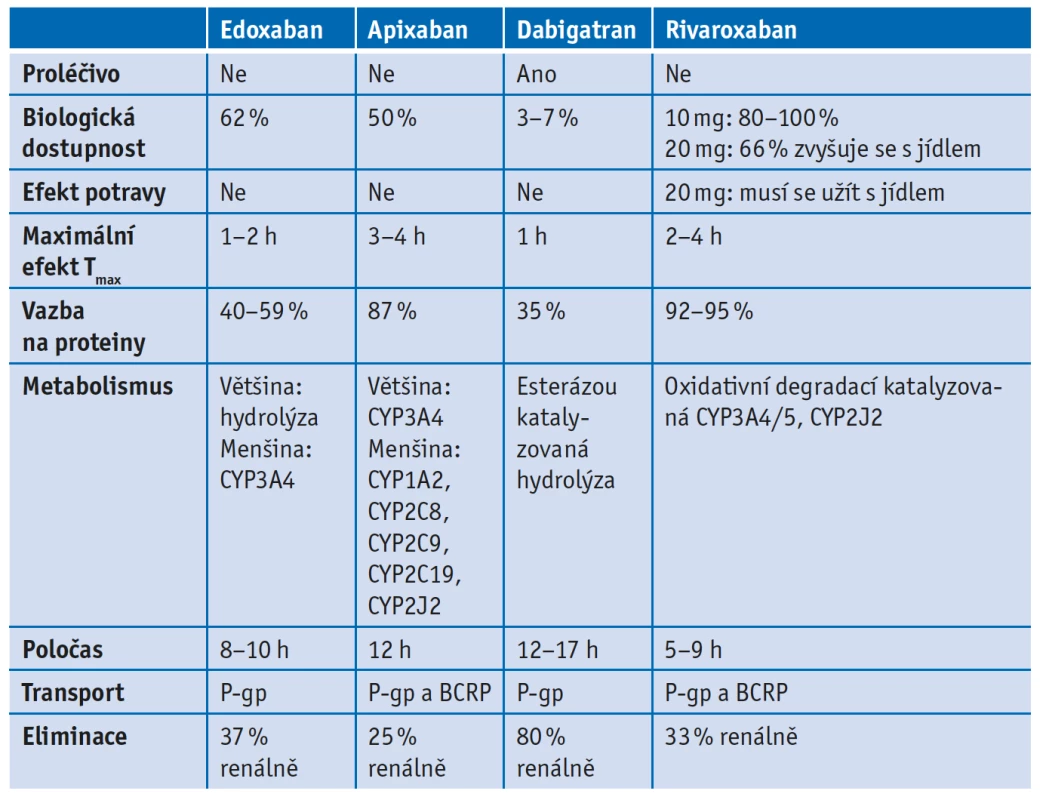
Jak bylo výše uvedeno, je třeba zohlednit, zda je léčivo silný inhibitor, nebo induktor CYP3A4 a glykoproteinu P. Podobně jako v případě rivaroxabanu se také u apixabanu nedoporučuje současné podávání silných inhibitorů CYP3A4 i glykoproteinu P, jako jsou ketokonazol, itrakonazol, vorikonazol, posakonazol a inhibitory HIV proteázy. Tyto léčivé přípravky mohou zvyšovat expozici apixabanu dvojnásobně nebo vícenásobně, zejména pokud je navíc přítomna těžká porucha funkce ledvin. Naopak současné použití se silnými induktory CYP3A4 a P-gp (rifampicin, fenytoin, karbamazepin, fenobarbital nebo třezalka tečkovaná) vede až k 50% snížení expozice apixabanu.
Klarithromycin, který patří mezi inhibitory P-gp a silné inhibitory CYP3A4, vedl k 1,6násobnému, resp. 1,3násobnému zvýšení průměrné AUC, resp. Cmax apixabanu. Současné podání jiných antikoagulancií je stejně jako u dabigatranu a rivaroxabanu kontraindikováno. Je nutno mít na paměti, že pokud se mění antikoagulační léčba, dochází k překryvu účinku a zvýšenému riziku krvácení.
Při současném podávání apixabanu s antiagregační léčbou, ke kterým často dochází z kardiologické indikace, počítejme se zvýšeným rizikem krvácení, zejména při trojkombinaci (LMWH, ASA a klopidogrel). Podání apixabanu s famotidinem nemělo žádný vliv na AUC nebo Cmax apixabanu.(19)
Lékové interakce edoxabanu
Jako zatím poslední ze skupiny xabanů byl registrován edoxaban (Lixiana).(20) Podle Samama edoxaban inhibuje tvorbu trombinu třikrát účinněji než fondaparinux.(21) Přibližně třetina edoxabanu je vylučována močí, a proto při clearance kreatininu pod 50 ml/min je nutné redukovat jeho dávkování. Dávka se redukuje i při tělesné hmotnosti ≤ 60 kg.
Studie ENGAGE AF-TIMI 48 (Edoxaban versus Warfarin in Patiens with Atrial Fibrillation) prokázala bezpečnost přípravku a potvrdila noninferioritu edoxabanu vůči warfarinu vzhledem k ischemické CMP a superioritu vzhledem k hemoragické CMP u nemocných s fibrilací síní. Celkem bylo randomizováno 21 105 pacientů s fibrilací síní a vysokým rizikem CMP. Roční výskyt krvácení při léčbě warfarinem byl 3,43 %, při podávání vysoké dávky edoxabanu 2,75 % (p < 0,001) a nízké dávky 1,61 % (p < 0,001).(22)
Další studie, která prokázala bezpečnost edoxabanu, byla studie ENSURE-AF. Zahrnovala celkem 2119 nemocných, z toho 1095 užívajících edoxaban a 1104 enoxaparin a warfarin. Jednalo se o studii antikoagulační léčby u elektrické kardioverze pro fibrilaci síní u nemocných s nevalvulární etiologií FS. Výskyt jak primárního, tak bezpečnostního cílového ukazatele prokazoval bezpečnost i účinnost edoxabanu při elektrické kardioverzi nevalvulární fibrilace síní (NVAF).
Jak bylo uvedeno u předchozích perorálních antikoagulancií, rovněž u edoxabanu platí, že společné podávání s jinými antikoagulancii je kontraindikováno.
Co se týče antiagregační léčby, podávání vysokých dávek ASA (325 mg) a edoxabanu není doporučeno pro zvýšené riziko krvácivosti. Povolené je podávání ASA ≤ 100 mg/den. Ve studii ENGAGE AF-TIMI 48 bylo povoleno souběžné použití thienopyridinů (např. klopidogrelu) v monoterapii, což vedlo ke zvýšení klinicky relevantního krvácení.
V klinických studiích vedlo také společné podávání s NSAID ke zvýšení klinicky relevantního krvácení, proto se jejich dlouhodobé užívání nedoporučuje.
Edoxaban je substrátem P-gp, proto je vhodná jeho redukce na 30 mg 1× denně při podávání s dronedaronem, erythromycinem, ketokonazolem, chinidinem a verapamilem, které řadíme mezi inhibitory glykoproteinu P. Souběžné podávání amiodaronu 400 mg 1× denně s edoxabanem 60 mg 1× denně zvýšilo AUC o 40 % a Cmax o 66 %. Toto zvýšení nebylo považováno za klinicky významné. Ve studii ENGAGE AF-TIMI 48, zabývající se NVAF, byly výsledky účinnosti a bezpečnosti podobné u subjektů se souběžným podáváním amiodaronu a bez souběžného podávání amiodaronu.
Souběžné podávání edoxabanu s induktorem P-gp rifampicinem vedlo k poklesu střední hodnoty AUC edoxabanu a zkrácenému poločasu s možným poklesem farmakodynamického účinku. Současné podání edoxabanu s jinými induktory P-gp (například fenytoinem, karbamazepinem, fenobarbitalem nebo třezalkou tečkovanou) může vést ke snížení plazmatických koncentrací edoxabanu.(23)
Závěr
Užívání přímých orálních antikoagulancií (DOAC) přineslo do klinické praxe řadu výhod v porovnání s tradičními antagonisty vitaminu K. Velkým pozitivem těchto léčiv, zejména u geriatrických pacientů, je to, že pacienti nejsou nuceni dodržovat striktní dietní omezení, odpadají pravidelné odběry a jejich terapeutický efekt je méně ovlivnitelný interakcemi s potravou a medikací v porovnání s kumarinovými deriváty.(24)
Mnohé lékové interakce jsou zapříčiněny nedodržením doporučení SPC jednotlivých přípravků, nicméně pokud je nemocný pečlivě sledován, můžeme předejít řadě komplikací. Warfarinu jistě zůstává jeho místo u některých indikací, kde přímá orální antikoagulancia nemůžeme podat. Příkladem je terminální renální selhání či umělé chlopenní náhrady. Nesmíme však zapomínat na jeho četné interakce vzhledem k tomu, že v oblasti perorální antikoagulační terapie se stále jedná o léčivo s vedoucím postavením na trhu.
I když jsou DOAC dražší variantou než klasický warfarin, jejich využití je stále častější a jejich výhody převyšují nad riziky.
Korespondenční adresa:
MUDr. Katarína Bielaková, Ph.D., MHA
Klinika interní, geriatrie a praktického lékařství
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail : bielakova.katarina@fnbrno.cz
MUDr. Katarína Bielaková, Ph.D., MHA
Promovala v roce 2003 na Fakultě všeobecného lékařství Univerzity v Bratislavě. Absolvovala atestaci z vnitřního lékařství a geriatrie. V roce 2015 ukončila postgraduální studium na Masarykově univerzitě v Brně. Tématem disertační práce bylo Clostridium difficile u geriatrických nemocných. Od roku 2016 je držitelkou funkční licence pro výkon F016 – umělá výživa a metabolická péče. V roce 2019 absolvovala vzdělávací program zaměřený na management ve zdravotnictví (MHA, Master of Healthcare Administration). Je místopředsedkyní České gerontologické a geriatrické společnosti ČLS JEP. V současnosti pracuje jako primářka Kliniky interní, geriatrie a praktického lékařství v Brně a odborná asistentka na Lékařské fakultě Masarykovy univerzity v Brně.
Sources
- Hochelová Z. Analýza spotreby antikoagulancií v Českej republike v rokoch 2007–2016. Hradec Králové, 2019. Rigorózní práce. Univerzita Karlova, Farmaceutická fakulta v Hradci Králové, Katedra sociální a klinické farmacie. Vedoucí práce Zimčíková E.
- Květina J, Grudmann M. Farmakologické interakce. Klin Farmakol Farm 2003; 17(1): 17–21.
- Michalcová J, Penka M, Buliková A, et al. Nová – přímá perorální antikoagulancia: aktuální přehled. Vnitř Lék 2016; 62(10): 805–813.
- Lefflerová K. Úskalí antikoagulační léčby warfarinem u nemocných s fibrilací síní – lékové a potravinové interakce. Interv Akut Kardiol 2008; 7(6): 220–224.
- Suchý D, Poklopová Z. Lékové interakce warfarinu s kardiovaskulárnimi léky. Klin Farmakol Farm 2005; 19 : 40–42.
- Schwarz UI, et al. Genetic determinants of response to warfarin therapy during initial anticoagulation. N Engl J Med 2008; 358(10): 999–1008.
- Suchopár J, Bultas J. Perorální antikoagulancia, jejich lékové interakce a dávkování u pacientů s fibrilací síní. Remedia 2015; 25 : 118–126.
- Karetová D, Bultas J. Antikoagulační terapie u seniorů. Vnitř Lék 2018; 64(11): 1011–1020.
- Witt D, Clark NP, Kaatz S, et al. Guidance for the practical management of warfarin therapy in the treatment of venous thromboembolism. J Thromb Thrombolysis 2016; 41 : 187–205.
- Kvasnička T. Dabigatran – klinické důkazy pro léčbu pacientů s TEN. Klin Farmakol Farm 2016; 30(3): 15–17.
- Urbánek K. Klinická farmakologie přímých perorálních antikoagulancií. Acta medicinae 2016 : 5(10): 29–34.
- Di Minno A, Frigerio B, Spadarella G, et al. Old and new oral anticoagulants: Food, herbal medicines and drug interactions. Blood Rev 2017; 31(4): 193–203.
- The European Medicines Agency. Souhrn o přípravku Pradaxa.
- Burdová K. Přímá perorální antikoagulancia. Klin Farmakol Farm 2015; 29(4): 138–143.
- Prokeš M, Suchopár J. Lékové interakce nových orálních antikoagulancií. Practicus 2015; 14(6): 14–21.
- The European Medicines Agency. Souhrn o přípravku Xarelto.
- Souček M. Apixaban má komplexní spektrum indikací. Farmakoterapie, Praha: Farmakon Press 2015; 1 : 104–108.
- Wang L, Zhang D, Raghavan N, et al. In vitro assessment of metabolic drug-drug interaction potential of apixaban through cytochrome P450 phenotyping, inhibition, and induction studies. Drug Metab Dispos 2010 : 38(3): 448–458.
- The European Medicines Agency. Souhrn o přípravku Eliquis.
- Kvasnička J. Edoxaban-nový inhibitor FXa. Remedia 2017; 27(2): 120–126.
- Samama MM, Mendell, J, Guinet, C et al. In vitro study of the anticoagulant effects of edoxaban and its effect on thrombin generation in comparison to fondaparinux. Thromb Res 2012; 129(4): e77–e82.
- Špinar J, Vítovec J. Edoxaban v klinických studiích a klinické praxi. Remedia 2016; 26 (4): 345–348.
- The European Medicines Agency. Souhrn o přípravku Lixiana.
- Bielaková K, Matějovská Kubešová H. Přehled lékových interakcí přímých perorálních antikoagulancií. Interní Med 2019; 21(1): 24–27.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2021 Issue 3-
All articles in this issue
- Editorial
- Vaccination of older people – not only SARS-CoV-2 vaccine
- Anticoagulant therapy – do we know its interactions?
- Effective chronic pain management can improve quality of life and compliance of elderly patients
- Current treatment options for Clostridioides difficile colitis and future pro-spects
- Nutrition and hydration in geriatric patients in palliative care
- Point of Care Ultrasound (POCUS) in geriatrics with focus on dehydration
- Social characteristic and dynamic of their changes during 25 years in the acute inpatient geriatric ward
- Analysis of the development of disability for mental illness and disability criteria
- Cooperation of a doctor and speech therapist in comprehensive patient care – our experience from the Centre of Postacute Care in Motol University Hospital
- Představení nového pracoviště – Geriatrické interní kliniky 2. LF UK a FN Motol
- Zpráva o činnosti konziliárního týmu paliativní péče v dospělé části FN Motol
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Current treatment options for Clostridioides difficile colitis and future pro-spects
- Nutrition and hydration in geriatric patients in palliative care
- Anticoagulant therapy – do we know its interactions?
- Cooperation of a doctor and speech therapist in comprehensive patient care – our experience from the Centre of Postacute Care in Motol University Hospital
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


