-
Medical journals
- Career
Obrovskobuněčná arteriitida – závažné onemocnění vyššího věku
Authors: Radim Bečvář
Authors‘ workplace: Revmatologická klinika 1. LF UK, Praha ; Revmatologický ústav, Praha
Published in: Geriatrie a Gerontologie 2021, 10, č. 1: 35-40
Category: Review Article
Overview
Bečvář R. Obrovskobuněčná arteriitida – závažné onemocnění vyššího věku
Obrovskobuněčná arteriitida je primární nekrotizující vaskulitida charakterizovaná granulomatózním zánětem velkých a středně velkých tepen odstupujících z aorty, kdy bývají často postiženy větve arteria carotis externa. Závažnost nemoci spočívá v riziku uzávěru tepen sítnice, vedoucího k rychlé nevratné ztrátě zraku. Velmi často tuto nemoc provází revmatická polymyalgie. Ke stanovení diagnózy slouží moderní zobrazovací metody – ultrasonografie, magnetická rezonance a CT angiografie. Při nejasných nálezech je indikována biopsie spánkové tepny. Při podezření na tuto nemoc je nutné okamžité zahájení terapie vysokými dávkami kortikosteroidů. Při kontraindikaci a neúčinnosti kortikosteroidů a ke snížení jejich dávky se podávají syntetické chorobu modifikující léky – obvykle methotrexát, méně často azathioprin, cyklosporin A a cyklofosfamid s rozporuplnými výsledky. U refrakterních a relabujících případů je ke zvážení biologická léčba. Nadějně se jeví aplikace monoklonálních protilátek proti receptoru pro interleukin 6 a inhibitorů interleukinu 12/23.
Klíčová slova:
obrovskobuněčná arteriitida – revmatická polymyalgie – ultrasonografie – kortikosteroidy – biologika
Definice a výskyt
Obrovskobuněčná (temporální, Hortonova) arteriitida (GCA, giant cell arteritis) je vaskulitida neznámého původu postihující větve zevní i vnitřní karotidy u osob středního a vyššího věku. GCA postihuje téměř výhradně jedince bílé rasy starší 50 let, obvykle po 70. roce života, s převahou žen.(1) Jsou značné rozdíly v incidenci podle geografických oblastí. Nejvyšší počty byly zjištěny na severu USA a v severní Evropě.(2) U poloviny neléčených dochází k oslepnutí bez rozdílu rasy.(3)
Etiologie a patogeneze
Příčina vzniku GCA je dosud nejasná. Výskyt omezený na osoby starší 50 let by ukazoval na souvislost s procesem stárnutí. Při senescenci imunitního systému v arteriích vznikají terciální lymfoidní orgány, které představují germinální centra, ve kterých může vzniknout autoimunitní zánět. Stále se uvažuje o genetické predispozici, u těchto nemocných byla zjištěna zvýšená incidence antigenu HLA-DR4 a zejména alel DRB1.(4,5) Uvažuje se také o roli infekce. U části nemocných byly nalezeny zvýšené protilátky proti viru parainfluenzy. Spouštěcím agens by mohla být infekce Mycoplasma pneumoniae, Chlamydia pneumoniae nebo parvovirem B19.(6,7)
Imunologické procesy se nepochybně účastní patogeneze GCA. Zásadní význam mají změny buněčné imunity, zejména cirkulující aktivované monocyty, které secernují prozánětlivé cytokiny. V biopsiích arteria temporalis byly nalezeny CD4+ T lymfocyty a aktivované makrofágy,(8) dále pak depozita imunoglobulinů a komplementu, která mohou představovat buď protilátky proti stěně tepny, nebo cirkulující imunitní komplexy.
Klinický obraz
Subjektivní příznaky a objektivní nálezy je možné rozdělit do čtyř skupin (tab. 1.), přičemž u nemocných GCA se může objevit libovolná kombinace těchto projevů.(9) Začátek onemocnění je většinou postupný s rozvojem celkových příznaků – slabost, horečka, hubnutí, může mít však i akutní charakter. Někdy jsou tyto příznaky přičítány depresi, stárnutí nebo malignitě. Je třeba zdůraznit, že příznaky v průběhu doby značně kolísají i bez léčby.
Table 1. Výskyt klinických projevů obrovskobuněčné arteriitidy 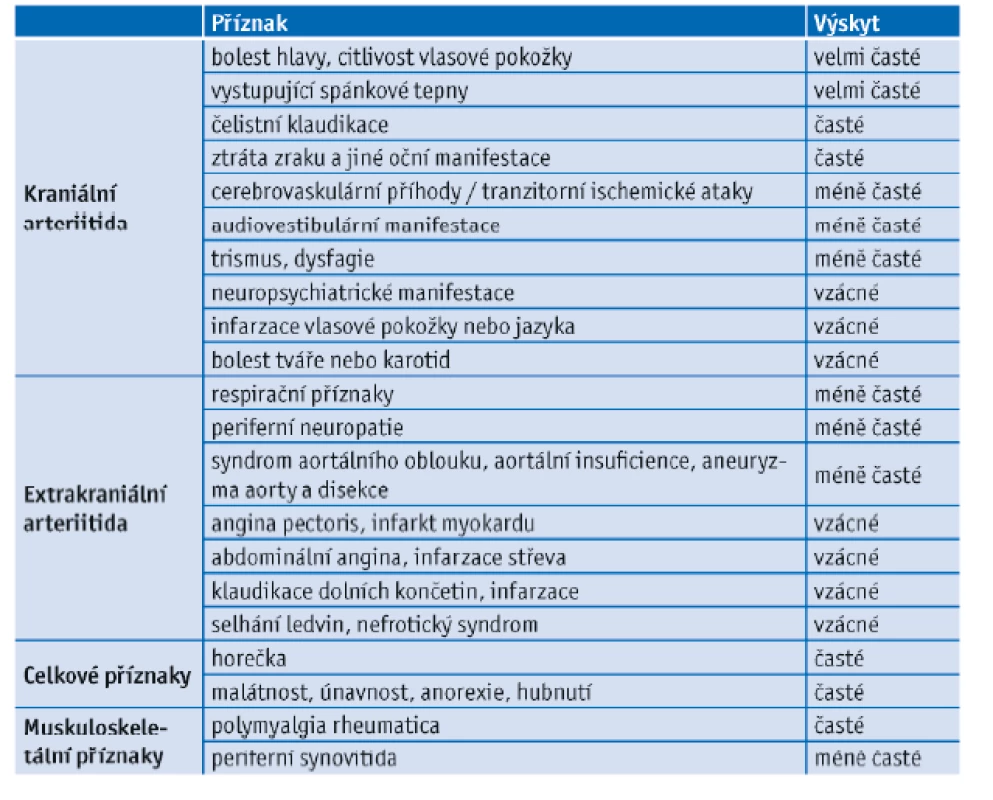
Kraniofaciální příznaky
Bolest hlavy je častým příznakem a lokalizuje se do jedné nebo obou spánkových oblastí. Může být také celková nebo v týlní krajině. Intenzita často kolísá, může být trvalá nebo záchvatovitá. Za příčinu se obvykle považují zduřelé, uzlovité nebo jen ztluštělé větve spánkové tepny (obr. 1.).(10) Citlivost vlasové pokožky je častá u nemocných s bolestí hlavy. Bolest jazyka nebo čelistí během žvýkání, která ustupuje v klidu (čelistní klaudikace), je poměrně častá. Může postihovat musculus masseter nebo temporální svaly a bývá oboustranná.
Image 1. Zduření větví arteria temporalis při obrovskobuněčné arteriitidě 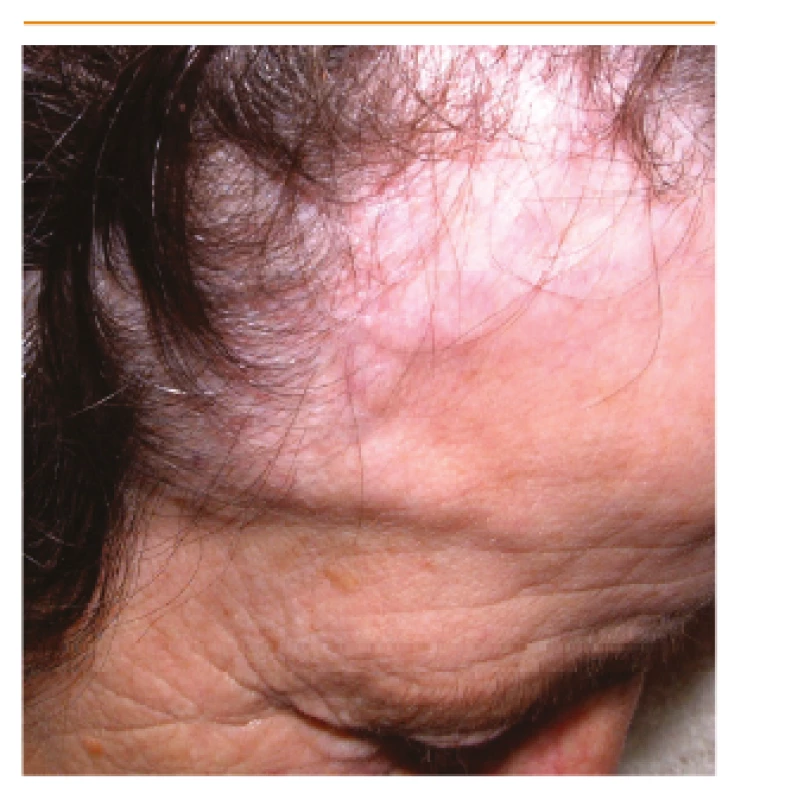
Neurologické a psychiatrické manifestace
GCA se může manifestovat různými neurologickými příznaky. Cerebrovaskulární příhody jsou málo časté. U starších jedinců je ale někdy obtížné rozlišit, zda se jedná o projev vaskulitidy, nebo aterosklerózy mozkových tepen.(11) Vzácné není mozkové krvácení v povodí arteria carotis interna nebo arteria basilaris. Periferní postižení nervů není časté a bývá pod obrazem mononeuropatie nebo symetrické polyneuropatie. Vzácné neuropsychiatrické manifestace zahrnují demenci, psychotické projevy, halucinace a deprese a jsou zřejmě následkem mnohočetných mozkových infarktů.
Oční manifestace
Oční manifestace GCA jsou časté a mohou být příčinou oslepnutí. Ztráta zraku u GCA bývá náhlá. Nicméně výsledky několika studií ukázaly, že více než 50 % nemocných s ireverzibilní ztrátou zraku mělo varovné příznaky jako mlhavé vidění, přechodná slepota, halucinace nebo diplopie. Arteritická přední ischemická oční neuropatie (AION) je hlavní příčinou slepoty u GCA.(12) Může být i prvním projevem nemoci. Arteritická AION je následkem vaskulitidy krátkých zadních ciliárních arterií, větví arteria ophthalmica, které zásobují optický nerv a cévnatku. Obecně lze říci, že jen 5 % pacientů s AION má GCA.(13) Vyšetření očního pozadí v akutní fázi nemusí rozlišit arteritickou od nearteritické AION, obvykle pomohou další příznaky a výsledky laboratorních vyšetření.
Polymyalgia rheumatica
Základním klinickým příznakem revmatické polymyalgie (PMR) je bolest a ztuhlost, kterou nemocní lokalizují do svalů. Zpravidla onemocnění začíná v oblasti ramenních kloubů a šíje, někdy s postižením celých pletenců ramenních a pánevních a proximálních svalových skupin. Symptomy jsou většinou symetrické. Někdy lze hovořit až o bolesti difuzní. Ztuhlost bývá výrazná po ránu, kdy nemocnému téměř zabraňuje vstát z postele.(14) Noční bolesti jsou také obvyklé. Pohyb zvýrazňuje bolest. Aktivní hybnost je v ramenních kloubech omezena, ale důvodem je bolest, nikoliv strukturální změny. Pasivní hybnost bývá normální. Svalová síla nebývá snížena, i když vzhledem k bolesti je interpretace složitá. Celý kloub a přilehlé oblasti měkkých tkání bývají značně palpačně citlivé.
Vyšetřovací metody
Laboratorní vyšetření
Změny základních laboratorních testů u GCA významně přispívají ke stanovení diagnózy a sledování průběhu a efektu léčby. Jejich přehled s frekvencí je uveden v tabulce 2.(15) Typické je zvýšení sedimentace erytrocytů (FW) a C-reaktivního proteinu (CRP) a dysproteinemie – nízké hodnoty sérového albuminu a zvýšení alfa2-globulinů. Většina nemocných GCA má hypochromní nebo normochromní anemii. Sérová hladina železa a saturace transferinu bývají snížené. Počet leukocytů je obvykle v normě, počet destiček vyšší. Některé práce ukazují, že rychlost FW a změny CRP nevystihují vždy dynamiku procesu a že spolehlivějším ukazatelem by se mohl stát interleukinu 6 (IL-6).(16) Malá část nemocných GCA (5–10 %) může mít typické klinické příznaky bez zrychlení FW, ale u těchto nemocných byl zvýšený CRP v 80–90 %.
Table 2. Změny základních laboratorních testů u obrovskobuněčné arteriitidy 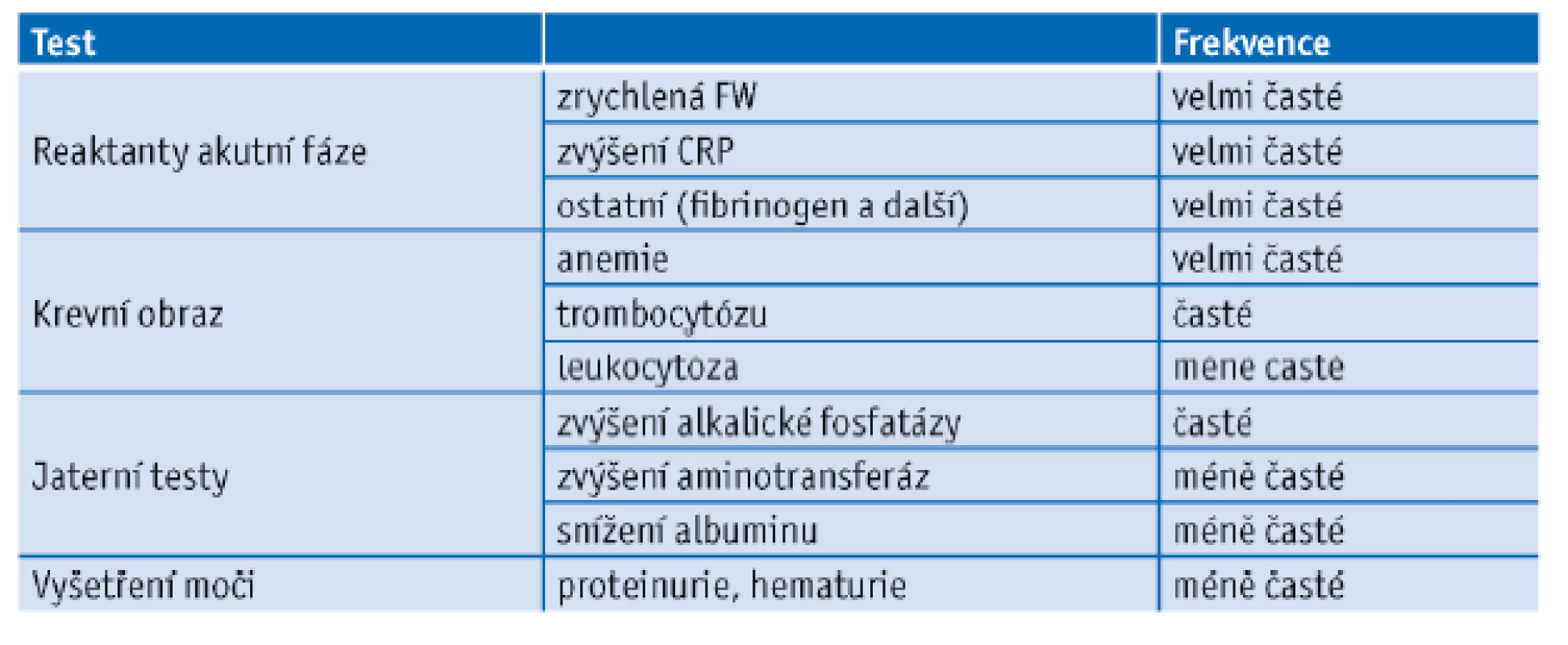
Pomocná vyšetření
Segmentální oslabení pulzu spánkové tepny svědčí pro vaskulitidu, kdežto celkové oslabení pulzu proximální části karotidy bývá důsledkem aterosklerotického zúžení. Využití zobrazovacích metod v klinické praxi podporují nová doporučení Evropské ligy proti revmatismu (EULAR).(17) Je třeba je využít při podezření na GCA a v nejčasnější fázi onemocnění. To však předpokládá jejich velmi dobrou dostupnost a zkušenost vyšetřujícího. Tato vyšetření nesmí v žádném případě vést k opožděnému zahájení léčby. U nemocných s vysokým klinickým podezřením a pozitivním nálezem ze zobrazovací metody je možno stanovit diagnózu bez doplňujícího vyšetření (biopsie nebo další zobrazovací metody). U jedinců s nízkým klinickým podezřením a negativním zobrazovacím nálezem je možno považovat diagnózu GCA za nepravděpodobnou. Jako první zobrazovací metoda se doporučuje provést ultrazvukové vyšetření temporálních a axilárních tepen u jedinců s podezřením na kraniální formu GCA.(18) Nález nestlačitelné „halo“ je typický pro GCA. Pokud je ultrazvukové vyšetření nedostupné nebo s nejasným nálezem, je metodou volby MR s vysokým rozlišením, která zobrazí zánětlivé změny stěny hlavových tepen. Dalšími používanými metodami jsou CT angiografie a MR angiografie, které se mohou kombinovat s pozitronovou emisní tomografií.
Při nejasném klinickém nálezu a ze zobrazovacích metod může diagnózu potvrdit biopsie větve arteria temporalis, přičemž je třeba vyšetřit postižený úsek. V některých případech je možné bioptovat postiženou okcipitální nebo lícní tepnu. Pokud není tepna jasně makroskopicky postižena, je vhodné odebrat delší úsek (4–6 cm). Falešná negativita histopatologického nálezu dosahuje 15 %.(19) Pokud se v prvním vzorku neprokážou patologické změny a trvá klinické podezření, je vhodné provést biopsii na druhé straně. V klasickém histopatologickém obraze dominuje infiltrace lymfocyty s fragmentací lamina elastica interna, dále granulomatózní zánět s histiocyty a mnohojadernými obrovskými buňkami. Nacházíme též T lymfocyty typu CD4+ a příměs B lymfocytů.
Diagnóza a diferenciální diagnóza
Pro stanovení diagnózy GCA byla Americkou revmatologickou asociací (ACR) v roce 1990 vypracována klasifikační kritéria (tab. 3.).(20) Ke stanovení definitivní diagnózy je nutná přítomnost alespoň tří kritérií.
Table 3. Klasifikační kritéria obrovskobuněčné arteriitidy (upraveno dle Hunter at al., 1990) 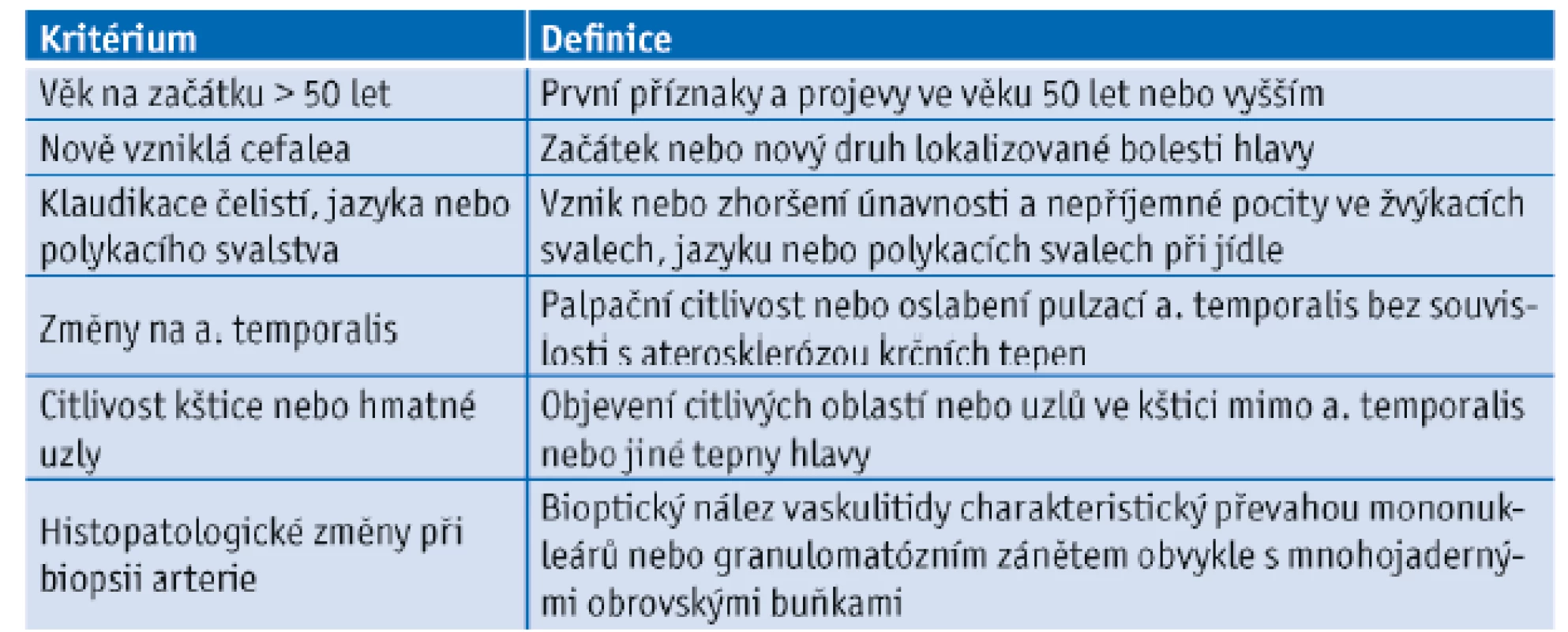
V diferenciální diagnostice není obvykle obtížné odlišit GCA od jiných typů vaskulitid díky charakteristickému klinickému obrazu, morfologickým změnám ze zobrazovacích metod, typickému histopatologickému nálezu a orgánovému postižení. Jiné nekrotizující vaskulitidy jen zřídka postihují větve arteria carotis externa. Podobný morfologický obraz je možné pozorovat u Takayasuovy arteriitidy, avšak ta mívá jinou distribuci změn a je v Evropě mnohem vzácnější.
Terapie
Léčba kortikosteroidy
Při podezření na GCA je rozhodující okamžité zahájení terapie vysokými dávkami kortikosteroidů (KS) (až 1 mg/kg/den),(21) obvykle do 60 mg/den.(22,23) Uvedená zahajovací dávka by měla být podávána 1 měsíc a poté postupně detrahována. V tabulce 4 je uvedeno srovnání doporučení EULAR a Britské revmatologické společnosti (BSR).(23) Detrakce by na rozdíl od PMR neměla probíhat formou alternativního denního podávání vzhledem k vyššímu riziku relapsu vaskulitidy. Celková doba podávání KS je variabilní, u některých pacientů může léčba trvat několik let, u jiných úplné vysazení KS nebude možné vůbec vzhledem k opakujícím se relapsům či vzniku sekundární adrenální insuficience. BSR ve svém doporučení rozděluje terapeutický přístup ke GCA na případy komplikované (s přítomnými zrakovými symptomy jako např. amaurosis fugax) a nekomplikované (nejsou přítomné vizuální symptomy ani čelistní klaudikace). U nekomplikované GCA doporučuje zahájit terapii 40–60 mg prednisonu / den, u komplikované pak podávání 500 mg až 1 g methylprednisolonu intravenózně po dobu 3 dnů před nasazením perorální léčby. V případě již vzniklé ztráty vizu jednoho oka se doporučuje podávat iniciálně dávku 60 mg prednisonu / den per os jako prevenci postižení druhého oka. Počáteční dávka prednisonu by měla být podávána do úpravy klinického stavu i laboratorních abnormalit (nejméně 3–4 týdny), poté je započata pomalá detrakce (tab. 4.).
Table 4. Srovnání doporučení British Society for Rheumatology (BSR) a Evropské ligy proti revmatismu (EULAR) pro iniciální dávku a režim detrakce kortikosteroidů u obrovskobuněčné arteriitidy (převzato z Dasgupta et al., 2010, Mukhtyar et al., 2009) 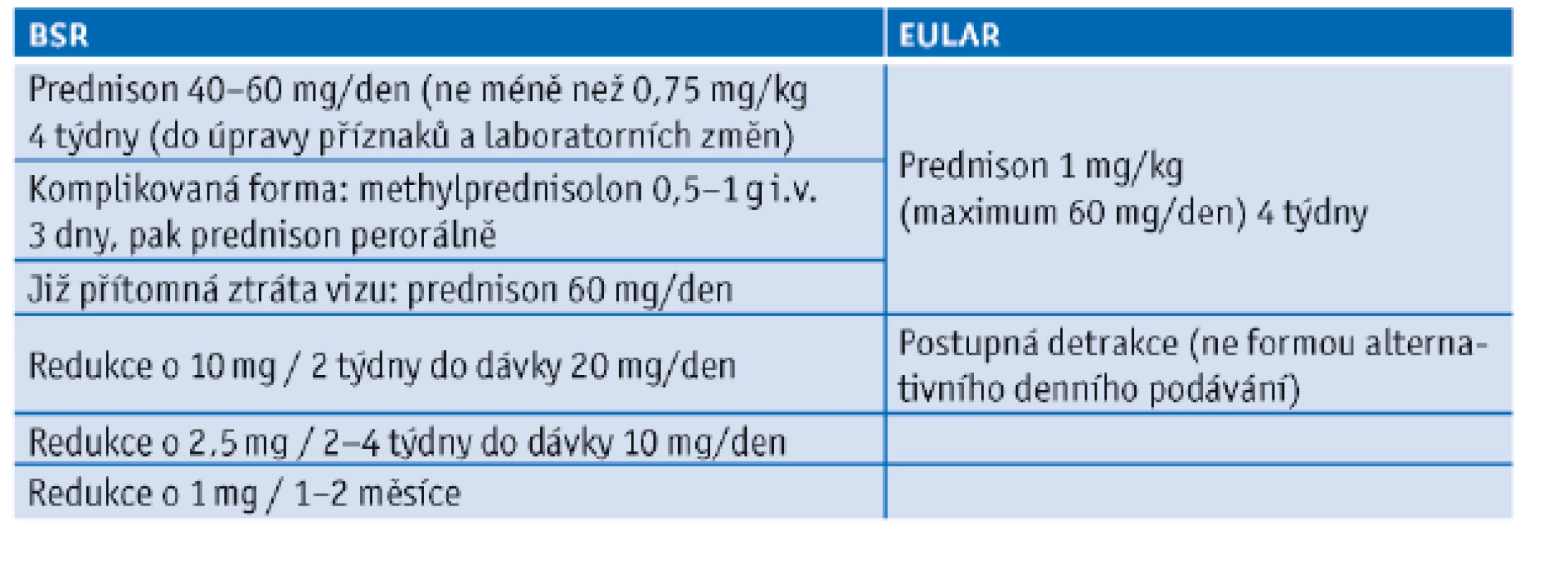
V případě relapsu se zrakovými symptomy nebo s čelistními klaudikacemi je doporučeno vrátit se k dávce 60 mg prednisonu nebo k intravenóznímu podání methylprednisolonu. Při návratu bolestí hlavy se doporučuje léčba předešlou vyšší účinnou dávkou KS. U všech pacientů bychom měli myslet na kontrolu glykemie, krevního tlaku a prevenci vzniku osteoporózy.
Konvenční syntetické chorobu modifikující léky
Z konvenčních syntetických chorobu modifikujících léků (DMARD) byl nejčastěji zkoušen methotrexát (MTX). Několik klinických hodnocení (KH) ukázalo jeho mírný efekt v dávkách 10–15 mg týdně ve snížení počtu relapsů a celkové kumulativní dávky KS.(26) Nasazení MTX u GCA je individuální a mělo by být zváženo u pacientů s vysokým rizikem nežádoucích účinků KS, u relabující choroby či prolongované terapie KS. Léčebný algoritmus s použitím KS a následně MTX je uveden v grafu na obrázku 2.(27)
Image 2. Algoritmus léčby obrovskobuněčné arteriitidy (převzato z Buttgereit et al., 2016) 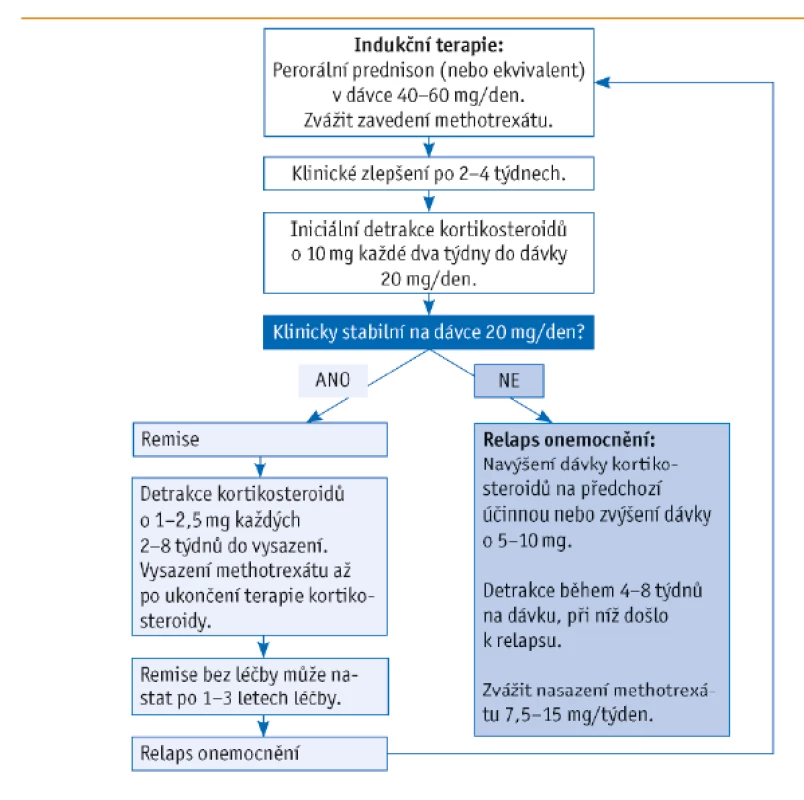
Systematický rozbor dat o účincích cyklofosfamidu v léčbě GCA potvrdil, že podání cyklofosfamidu ve formě infuzí u refrakterních forem dříve léčených DMARD a při výrazné toxicitě KS vedlo k navození remise. Cyklofosfamid je tak určitou léčebnou možností u vybraných jedinců.(28)
Biologická léčba
U infliximabu a adalimumabu nebyl prokázán efekt ve dvou multicentrických dvojitě slepých randomizovaných KH.(29,30) V jiném randomizovaném KH byla zjištěna nižší celková kumulativní dávka KS u pacientů léčených etanerceptem oproti skupině s placebem.(31) A tak se vzhledem k nedostatku validních důkazů o efektu blokátorů tumor necrosis faktoru alfa (TNF-alfa) jejich užití v léčbě GCA nedoporučuje. O pozitivních účincích abataceptu a rituximabu bylo dosud publikováno jen několik kazuistických sdělení.
Tocilizumab (TCZ) je monoklonální humanizovaná protilátka proti receptoru pro IL-6. Na základě průkazu zvýšených hladin cirkulujícího IL-6 u pacientů s aktivním onemocněním se usuzuje na jeho zásadní roli v patogenezi GCA a PMR. Velmi slibná jsou data z randomizovaného dvojitě slepého placebem kontrolovaného klinického hodnocení GiACTA, kde byl sledován účinek TCZ u pacientů s ověřenou aktivní GCA.(32,33) Výsledky tohoto KH ukázaly na velmi silný KS šetřící efekt TCZ v léčbě GCA. Je třeba vzít v úvahu, že k častým nežádoucím účinkům této léčby patří zvýšená vnímavost k různým infekcím.(34)
Dalším vhodným léčivem by se mohl stát ustekinumab, blokátor IL-12 a IL-23. Bylo prokázáno, že tyto cytokiny stimulují odpověď lymfocytů Th1 a Th7, a tím zřejmě hrají významnou roli v patogenezi GCA. Otevřené KH s ustekinumabem prokázalo, že je možné významně snížit dávku KS a u 24 % pacientů je úplně vysadit.(35) Při tom nebyl zaznamenán žádný relaps. Došlo k významnému poklesu CRP a u všech nemocných ke zlepšení nálezu na CT angiografii velkých tepen. Autoři dospěli k závěru, že ustekinumab by se mohl stát další volbou v léčbě GCA, ale je třeba tato data ověřit kontrolovaným KH.
Antiagregační léčba
Jedno z retrospektivních KH pacientů s GCA prokázalo menší výskyt ischemických příhod u těch pacientů, kteří současně užívali kyselinu acetylsalicylovou z jiné indikace. Proto má EULAR ve svém doporučení z roku 2008 dlouhodobé podávání nízkých dávek kyseliny acetylsalicylové (75–150 mg/den) u všech pacientů s GCA, u nichž neexistuje kontraindikace této léčby.(22) Současně se zahájením této terapie by měl být podáván inhibitor protonové pumpy.
Závěr
Ke stanovení diagnózy GCA nově mohou přispět některé moderní zobrazovací metody – ultrasonografie, MR a CT angiografie. Méně často je dnes nutná biopsie postižené tepny.
KS jsou stále lékem volby, a to u všech forem nemoci. Rozhodující je strategie jejich podávání – okamžité zahájení a individualizovaná pomalá detrakce. Z běžných DMARD má stále svou významnou roli MTX. Při neúčinnosti nebo kontraindikaci KS a DMARD je vhodná terapie biologickými léčivy, ale jejich indikace pro tuto diagnózu není zatím v ČR schválena. Léčbu blokátory TNF-alfa nelze na základě dostupných dat doporučit. Nadějně se jeví léčba monoklonálními protilátkami proti receptoru pro IL-6 a v budoucnu možná i inhibitory IL-12/23.
doc. MUDr. Radim Bečvář, CSc.
Zabývá se především systémovou sklerodermií a vaskulitidami, možnostmi jejich diagnostiky a léčby. V současné době pracuje v Revmatologickém ústavu a je pedagogem na Revmatologické klinice 1. LF UK v Praze. Je autorem a spoluautorem více než 250 domácích a zahraničních monografií i originálních publikací, spoluřešitelem několika výzkumných grantů. Řadu let je členem mezinárodní organizace EUSTAR/EULAR a členem redakční rady časopisu Česká revmatologie.
Korespondenční adresa:
doc. MUDr. Radim Bečvář, CSc.
Revmatologický ústav
Na Slupi 450/4
128 00 Praha 2
e-mail: becvar@revma.cz
Sources
1. Dejaco C, Duftner C, Buttgereit F, et al The spectrum of giant cell arteritis and polymyalgia rheumatica: revisiting the concept of the disease. Rheumatology (Oxford) 2017; 56 : 506–15.
2. Salvarani C, Crowson CS, O’Fallon WM, et al. Reappraisal of the epidemiology of giant cell arteritis in Olmsted County, Minnesota, over fifty-year period. Arthritis Rheum 2004; 51 : 264–8.
3. Yates M, Graham K, Watts RA, MacGregor AJ. The prevalence of giant cell arteritis and polymyalgia rheumatica in a UK primary care population. BMC Musculoskelet Disord 2016; 17 : 285.
4. Weyand CM, Hicok KC, Hunder GG, Goronzy JJ. The HLA-DRB1 locus as a genetic component in giant cell arteritis. J Clin Invest 1992; 90 : 23455–61.
5. Gonzales-Gay MA, Amoli MM, García-Porrua C, Ollier WE. Genetic markers of disease susceptibility and severity in giant cell arteritis and polymyalgia rheumatica. Sem Arthritis Rheum 2003; 33 : 38–48.
6. Elling P, Olsson AT, Elling H. Synchronous variations of the incidence of temporal arteritis and polymyalgia rheumatica in different regions of Denmark; association with epidemics of Mycoplasma infection. J Rheumatol 1996; 23 : 112–9.
7. Alvarez-Lafuente R, Fernandez-Gutierrez B, Jover JA, et al. Human parvovirus B1Q9, varicella zoster virus, and human herpes virus 6 in temporal artery biopsy specimens of patients with giant cell ateritis. Ann Rheum Dis 2005; 64 : 780–2.
8. Wagner AD, Goronzy JJ, Weyand CM. Functional profile of tissue infiltrating and circulating CB68+ cells in giant cell arteritis. J Clin Invest 1994; 94 : 1134–40.
9. Nesher G, Nesher R. Giant cell arteritis and polymyalgia rheumatica. In: Ball GB, Bridges SL Jr (eds.). Vasculitis. 2nd ed. Oxford: Oxford University Press 2008 : 307–22.
10. Brack A, Martinez-Taboada V, Stanson V, et al. Disease pattern in cranial and large-vessel giant-cell arteritis. Arthritis Rheum 1999; 42 : 311–7.
11. Save-Soderbergh J, Malmwall BE, Andersson R, Bengtsson BA. Giant cell arteritis as a cause of death. J Am Med Assoc 1986; 255 : 493–6.
12. Gonzales-Gay MA, García-Porrua C, Liorca J, et al. Visual manifestations of giant cell arteritis. Medicine 2000; 79 : 283–92.
13. Miller NR. Visual manifestations of temporal arteritis. Rheum Dis Clin North Am 2001; 27 : 781–97.
14. Salvarani C, Macchioni P, Boiardi L. Polymyalgia rheumatica. Lancet 1997; 350 : 43–7.
15. Hayareh SS, Podhajsky PA, Raman R, Zimmerman B. Giant cell arteritis: validity and reliability of various diagnostic criteria. J Ophthalmol 1997; 123 : 285–96.
16. Dasgupta B, Panayi GS. Interleukin-6 in serum of patients with polymyalgia rheumatica and giant cell arteritis. Br J Rheumatol 1990; 29 : 456 J Ophtalmol 8.
17. Dejaco C, Ramiro S, Duftner C, et al. EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice Ann Rheum Dis 2018; 77 : 636–43.
18. Romera-Villegas A, Villa-Coll R, Poca-Dias V, Cairols-Castellote MA. The role of color duplex sonography in the diagnosis of giant cell arteritis. J Ultrasound Med 2004; 23 : 1493–8.
19. Taylor-Gjevre R, Vo M, Shukla D, Resch L. Temporal artery biopsy for giant cell arteritis. J Rheumatol 2005; 32 : 1279–82.
20. Hunder GG, Bloch DA, Michel BA, et al. The American College of Rheumatology 1990 criteria for the classification of giant cell arteritis. Arthritis Rheum 1990; 33 : 1122–8.
21. Hernández-Rodríguez J, García-Martínez A, Casademont J, et al. A strong initial systemic inflammatory response is associated with higher corticosteroid requirements and longer duration of therapy in patients with giant-cell arteritis. Arthritis Rheum 2002; 47 : 29–35.
22. Mukhtyar C, Guillevin, Cid MC, et al. EULAR recommendations for the management of large vessel vasculitis. Ann Rheum Dis 2009; 68 : 318–23.
23. Bečvář R. Základní terapeutické přístupy. In: Bečvář R, Tesař V, Rychlík I. Vaskulitidy v klinické praxi – diagnostika a terapie. 1. vyd. Praha: Medprint 1994 : 42–7.
24. Dasgupta B, Borg A, Hasan H, et al. BSR and BHPR guidelines for the management of giant cell arteritis. Rheumatology (Oxford) 2010; 49 : 1594–7.
25. Langford CA. Management of systemic vasculitis. Best Pract Res Clin Rheum 2001; 15 : 281–297.
26. Settas L, Dimitriades G, Sfetsios T, et al. Methotrexate versus azathioprine in polymyalgia rheumatica – giant cell arteritis: a double-blind, crossover trial. Arthritis Rheum 1991; 34(Suppl): 72.
27. Buttgereit F, Dejaco C, Matteson EL, et al. Polymyalgia rheumatica and giant cell arteritis: A systematic review. JAMA 2016; 315 : 2442–58.
28. De Boysson H, Boutemy J, Creveuil C, et al. Is there a place for cyclophosphamide in the treatment of giant-cell arteritis? A case series and systematic review. Semin Arthritis Rheum 2013; 43 : 105–12.
29. Hoffman GS, Cid MC, Rendt-Zagar KE, Infliximab-GCA Study Group. Infliximab for maintenance of glucocorticosteroid-induced remission of giant cell arteritis: a randomized trial. Ann Intern Med 2007; 146 : 621–30.
30. Seror R, Baron G, Hachulla E, et al. Adalimumab for steroid sparing in patients with giant-cell arteritis: results of a multicentre randomised controlled trial. Ann Rheum Dis 2014; 73 : 2074–81.
31. Martínez-Taboada VM, Rodríguez-Valverde V, Carreño L, et al. A double-blind placebo controlled trial of etanercept in patients with giant cell arteritis and corticosteroid side effects. Ann Rheum Dis 2008; 67 : 625–30.
32. Stone JH, Tuckwell K, Dimonaco S, et al.: Trial of tocilizumab in giant cell arteritis. N Engl J Med 2017; 377 : 317–28.
33. Tuckwell K, Collinson N, Dimonaco S, et al.: Newly diagnosed vs. relapsing giant cell arteritis: baseline data from the GiACTA trial. Semin Arthritis Rheum 2017; 46 : 657–64.
34. Schmidt J, Smail A, Roche B, et al. Incidence of severe infections and infection-related mortality during the course of giant cell arteritis: a multicenter, prospective, double-cohort study. Arthritis Rheum 2016; 68 : 1477–82.
35. Conway R, O’Neill L, Gallagher P, et al. Ustekinumab for refractory giant cell arteritis: A prospective 52-week trial. Semin Athritis Rheum 2018; 48 : 523–8.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2021 Issue 1-
All articles in this issue
- Editorial
-
Hodnocení disability s využitím nástroje WHODAS 2.0 u geriatrických pacientů.
Pilotní studie WHODAS-GERI - Knihy
- WHODAS 2.0
- Mobilita jako klíčový faktor zdravého stárnutí
- Kniha
- Sarkopenická obezita: od vzniku k intervenci
- Jak určit kardiovaskulární riziko u geriatrických pacientů?
- Obrovskobuněčná arteriitida – závažné onemocnění vyššího věku
-
Standard nutriční péče v geriatrii
Nutriční screening a proces péče
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sarkopenická obezita: od vzniku k intervenci
-
Standard nutriční péče v geriatrii
Nutriční screening a proces péče - Mobilita jako klíčový faktor zdravého stárnutí
-
Hodnocení disability s využitím nástroje WHODAS 2.0 u geriatrických pacientů.
Pilotní studie WHODAS-GERI
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


